风干肉是我国北方少数民族(蒙古族、哈萨克族等)过冬时制作的肉制品,是传统自然发酵肉制品之一。自然发酵肉制品品质形成过程非常复杂,肉制品中的蛋白质、脂肪等营养物质的部分降解与肉制品特殊风味物质形成直接相关[1]。其中,肉制品中小分子的多肽和氨基酸是由蛋白质在酶的作用下降解产生,而这些小分子的多肽和氨基酸除了具有一定的呈味特性外,还是发酵肉制品特征风味的前体物质[2]。氨基酸可以在酶的作用下被进一步降解成小分子的含硫化合物和含氮化合物,这些小分子化合物通常具有较低的阈值,可以赋予发酵肉制品特殊的风味[3]。在此过程中,特定微生物代谢产生的酶和内源性酶共同为蛋白质降解提供了必要条件。其中,乳酸菌是一类兼具发酵性能和益生作用的微生物。研究发现,发酵肉制品中的乳酸菌与呈味氨基酸及挥发性风味物质的形成密切相关[4]。
乳酸菌是发酵肉制品中常见的优势菌,在提升发酵肉制品风味品质方面发挥着积极作用[3],尤其是参与蛋白质降解方面,这主要是因为乳酸菌不仅可以产生胞外蛋白酶,而且具有完善的氨基酸和多肽转运系统,在肉制品发酵过程中,乳酸菌将二肽、三肽等转运到乳酸菌细胞内,从而继续分解产生氨基酸,同时参与碳水化合物代谢方面,可以降低肉制品中的pH值,增加蛋白酶活性,从而直接或间接参与肉制品蛋白质降解[5]。为了提高发酵肉制品品质,研究者试图通过外源接种乳酸菌发酵剂的方式来提升产品风味品质[5]。其中,优良乳酸菌菌株主要来源于当地传统的发酵肉制品[6],这主要是因为微生物在长期的演化过程中,对当地环境和原料具有很好的适应性,发酵效率较高,可以很好地保证肉制品的传统风味[7],后期不需要再进行特殊的驯化和改良就具备较好的应用价值。新疆传统手工制作的风干肉中蕴藏着丰富的微生物资源,其中对肉制品风味品质形成比较重要的微生物有乳酸菌、葡萄球菌、微球菌和部分酵母菌[8]。肉制品发酵过程中,乳酸菌代谢产生的蛋白酶、脂肪酶以及有机酸都会直接或间接影响肉制品的风味[9-10]。HU等[11]通过在风干肠中接种(Lactobacillus sakei)HRB10和(Weissella hellenica)HRB6两株益生乳酸菌,发现风干肠的蛋白质降解程度增加,挥发性风味物质含量明显更多。L PEZ等[12]研究发现,(Lactobacillus curvatus)CRL705具有强烈的蛋白质降解能力,将其应用在风干肠中可以促进风味物质的形成,增加挥发性风味物质的含量。由此可知,肉制品中蛋白质的适度降解会促进其风味物质的产生,从而提升产品风味品质。
PEZ等[12]研究发现,(Lactobacillus curvatus)CRL705具有强烈的蛋白质降解能力,将其应用在风干肠中可以促进风味物质的形成,增加挥发性风味物质的含量。由此可知,肉制品中蛋白质的适度降解会促进其风味物质的产生,从而提升产品风味品质。
戊糖片球菌(Pediococcus pentosaceus)TMR-WJG、格氏乳球菌(Lactococcus garvieae)TC-6和乳酸乳球菌(Lactococcus lactis)TC-2三株菌是项目组前期从风干肉中分离得到的乳酸菌,具有较好的产蛋白酶性能。研究表明,3株乳酸菌作为发酵剂制作风干牛肉,其产生的酶可以将蛋白质降解成小分子肽和氨基酸,但对风干牛肉风味品质提升不够明显[13]。为了进一步提高风干牛肉的风味品质,该研究拟使用混合菌种发酵,分析牛肉发酵过程中蛋白质降解情况及呈味物质的变化规律,明确不同复配发酵剂对风干牛肉不同发酵阶段蛋白质的降解和风味物质的影响,为后续开发风干牛肉专用发酵剂提供帮助。
1 材料与方法
1.1 材料
新鲜牛后腿肉、食盐、白糖,新疆友好超市。戊糖片球菌TMR-WJG,分离自新疆巴里坤传统风干肉;格氏乳球菌TC-6和乳酸乳球菌TC-2分离自新疆塔城传统风干肉。
高氯酸,济南源飞伟业化工有限公司;丙酮,天津永晟精细化工有限公司;三氯乙酸(trichloroacetic acid, TCA)、异丙醇,天津政成化学制品有限公司;NaH2PO4,山东德彦有限公司。上述试剂均为分析纯。
1.2 仪器设备
JIDI-16R高速冷冻离心机、BHP电热恒温培养箱,上海丙林电子科技有限公司;SPX智能生化培养箱,广州吉迪仪器有限公司;J-V08双室深槽型真空包装机,苏州锦达包装设备有限公司;AH-408C恒温恒湿箱,广东星拓环境试验设备科技有限公司;Waters 1525高效液相色谱仪,安捷伦科技有限公司;L-8900全自动氨基酸分析仪,日立科学仪器(北京)有限公司;FlavourSpec®气相离子迁移谱(gas chromatography ion mobility spectrometer, GC-IMS)联用仪,山东海能科学仪器有限公司;Heracles NEO 50快速气相色谱电子鼻,阿默思仪器有限公司。
1.3 风干牛肉的加工工艺
1.3.1 乳酸菌活化及发酵剂制备
将冻藏在-80 ℃的戊糖片球菌TMR-WJG、格氏乳球菌TC-6和乳酸乳球菌TC-2取出,放置在室温(20 ℃)条件下,静置1~2 h,融化后分别接种于MRS增菌培养基,36 ℃培养24 h,收集菌体,制备成浓度为108 CFU/mL的发酵剂。按表1比例对乳酸菌进行复配,备用。
表1 乳酸菌菌种复配比例表
Table 1 Mixing ratio of lactic acid bacteria strains

分组菌种比例(mL∶mL)A组格氏乳球菌、戊糖片球菌1∶1B组格氏乳球菌、乳酸乳球菌1∶1C组戊糖片球菌、乳酸乳球菌1∶1D组乳酸乳球菌、戊糖片球菌、格氏乳球菌1∶1∶1E组不添加发酵剂,自然发酵
1.3.2 风干牛肉的制备及取样
新鲜牛后腿肉用无菌水清洗晾干后,无菌条件下切割为4 cm×4 cm× 10 cm左右的长条状,每块约200 g。前处理结束后进行腌制。配料:按照牛肉样品质量添加糖1%、盐2.5%(均为质量分数)、NaNO2 100 mg/kg;腌制条件:4 ℃,24 h。腌制结束后发酵。发酵样品分组及处理条件按照表1进行,分别按牛肉质量的0.2%接种浓度1.0×108 CFU/mL的复配乳酸菌发酵剂;发酵条件:温度15 ℃,相对湿度65%,发酵时间24 h。发酵结束后风干,风干条件为:温度10 ℃,相对湿度30%,时间7 d,空气流速1.8~2.0 m/s。贮藏期:温度4 ℃,相对湿度65%,贮藏时间7 d。每个采样点各取3份样品(200 g左右)。根据样品采样时间将所有样品分为25组A1~A5、B1~B5、C1~C5、D1~D5、E1~E5,具体分组见表2。每组样品采集完成后分别放置于无菌采样袋中,-80 ℃保存,备用。
表2 风干牛肉样品分组
Table 2 Grouping of dried beef in different processing stages
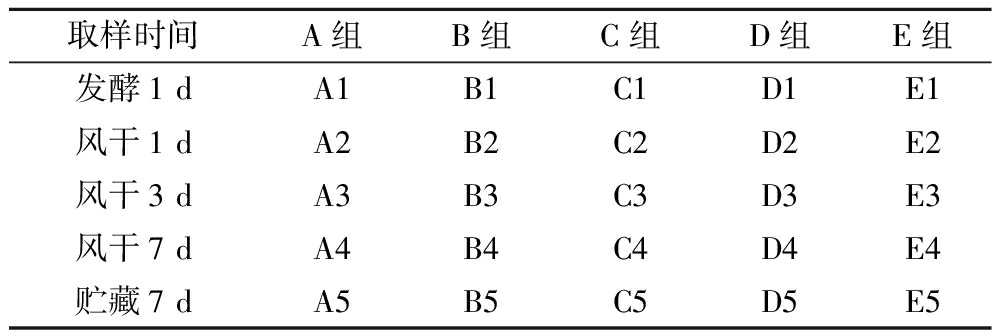
取样时间A组B组C组D组E组发酵1 dA1B1C1D1E1风干1 dA2B2C2D2E2风干3 dA3B3C3D3E3风干7 dA4B4C4D4E4贮藏7 dA5B5C5D5E5
1.4 蛋白质降解指标
1.4.1 非蛋白氮(non-protein nitrogen,NPN)含量的测定
参照王选飞等[14]方法并稍作修改。准确称取5.00 g牛肉,粉碎后加入25 mL蒸馏水混匀,摇床振摇15 min后,4 ℃条件下2 000×g离心15 min,吸取上清液10 mL,与20 mL的200 g/L TCA溶液混合,4 ℃条件下2 000×g离心15 min,采用凯氏定氮法测定NPN含量。
1.4.2 氨基酸肽氮(amino acid nitrogen, AAN)含量测定
将风干牛肉粉碎后称取5.00 g与25 mL H2O混匀,摇床振摇10 min,加入H2O定容至100 mL。取出溶液于4 ℃, 2 000×g条件下离心20 min,取上清液加入500 g/L TCA溶液,并将TCA质量浓度调整到50 g/L,过滤后在1 h内完成茚三酮比色测定。
1.4.3 游离氨基酸(free amino acid, FAA)测定
称取5.00 g风干牛肉,剪碎后加入H2O 20.0 mL,涡旋振荡2 min,2 000×g离心10 min,取上清液,样品中加入20 mL乙腈,涡旋振荡2 min,2 000×g离心5 min,合并上清液并定容至40 mL,静置待测。
标准曲线及样品衍生过程:标准溶液200 μL中加入正亮氨酸(1 mg/mL,溶剂0.1 mol/L盐酸)50 μL、三乙胺(1.0 mol/L,溶剂乙腈)溶液100 μL、异硫氰酸苯酯(0.2 mol/L,溶剂乙腈)溶液100 μL,摇匀室温静置衍生1 h,衍生结束加入正己烷400 μL,密封剧烈振荡5~10 s,静置分层,弃去上层溶液,取下层溶液200 μL和水800 μL混合,0.22 μm滤膜过滤,待上机。
1.5 风干肉风味指标检测
1.5.1 电子鼻检测
样品准备:准确称取2.00 g牛肉样品剪碎后置于电子鼻顶空瓶中,聚四氟乙烯(polytetrafluoroethylene, PTFE)隔垫密封后待测。
顶空产生:样品顶空瓶,65 ℃振荡20 min。进样:进样速度250 μL/s,时间40 s,进样口温度200 ℃;捕集阱:捕集阱初始温度20 ℃,分流速度10 mL/min,持续时间45 s,最终捕集阱温度240 ℃;柱温:初始温度50 ℃维持40 s,以1.0 ℃/s升温至80 ℃,随后以1.5 ℃/s升温至250 ℃维持17 s,采集时间200 s;氢火焰离子化检测器温度260 ℃。
1.5.2 GC-IMS检测
参考ZHAN等[15]方法略有改动。准确称取2 g样品,置于20 mL顶空瓶中,60 ℃孵育15 min 后进样,进样针温度65 ℃。每种样品送样3份,每份取3次。
1.5.3 风干牛肉综合感官评分
参考王俊钢等[16]的方法对风干牛肉进行感官评价。由10名肉类食品研究人员分别从气味、滋味、口感、肉色、组织状态等5个方面对风干牛肉进行感官评分,并记录结果。评价标准如表3所示。
表3 风干牛肉感官评分表
Table 3 Sensory score table of dried beef

评分项目感官评价标准得分/分气味脂肪香气,无霉味0^10口感口感顺滑,细腻0^10滋味味道醇厚,有回味0^10肉色红色均匀,有光泽0^10组织状态组织致密,不松散0^10
1.6 数据分析
所有样品均做3次平行试验,结果采用“平均值±标准差”表示。电子鼻检测结果采用AlphaSoft 2021进行数据分析;离子迁移质谱采用VOCal和Gallery Plot插件、Reporter插件和Dynamic PCA插件进行样品分析;利用Origin 2022软件作图,并使用SPSS 25中Duncan检验对试验数据进行多重比较。
2 结果与分析
2.1 复配乳酸菌对风干牛肉NPN含量的影响
NPN是指样品中除蛋白质以外的所有多肽、短肽及游离氨基酸的总称,NPN可以反映肉中蛋白质的降解程度[15]。接种不同复配乳酸菌发酵的风干牛肉NPN含量结果如图1所示。在风干过程中随着加工时间的延长,NPN含量逐渐增加。发酵1 d,5组样品中的NPN含量均在8 mg/g以下;风干期(风干1~7 d)NPN含量值增加明显(P<0.05),至风干期结束,A~E 5组样品中NPN的含量分别为10.21、11.14、10.78、10.61、10.27 mg/g,可能是因为发酵期微生物大量繁殖,蛋白质大量降解,从而NPN含量增加[17]。风干肉加工过程中,各组样品中的NPN含量显著增加(P<0.05),且B组、D组(风干3 d除外)NPN含量增加值始终高于自然发酵E组(P<0.05),说明试验组中产生了更多的短肽和游离氨基酸,这对赋予风干牛肉特殊风味有明显作用[17]。短肽的种类多样,其中部分呈味肽,对提升产品的鲜味和整体风味具有显著影响[18]。游离氨基酸本身也具有一定的香味,此外在肉制品贮藏过程中还可以被进一步降解,生产小分子风味化合物[19]。
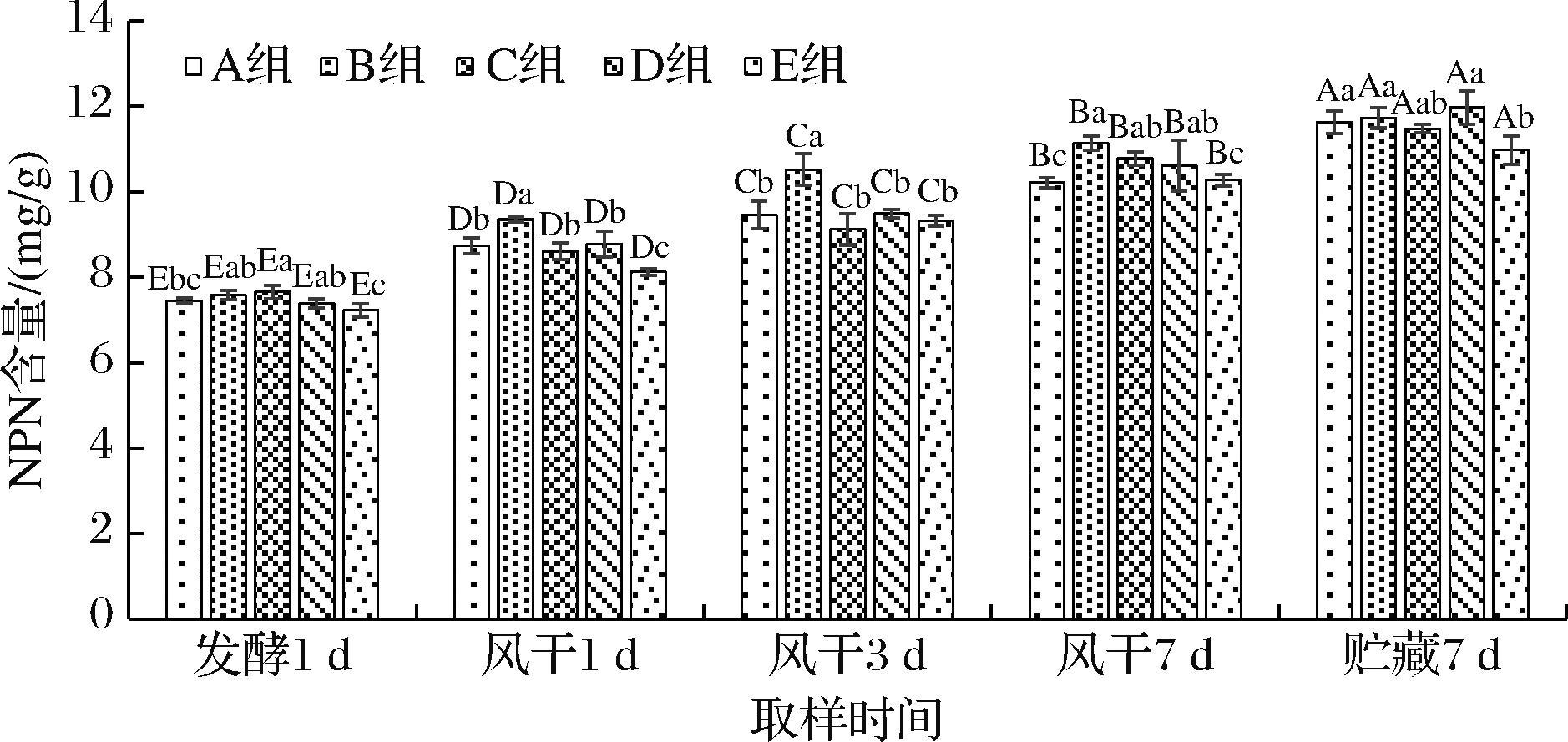
图1 复配乳酸菌对风干牛肉NPN含量的影响
Fig.1 Effects of different lactic acid bacteria on non-protein nitrogen content of dried beef
注:大写字母不同表示同一样品在不同采样阶段差异显著(P<0.05),小写字母不同表示同一采样阶段不同样品之间差异显著(P<0.05)(下同)。
2.2 复配乳酸菌对风干牛肉AAN的影响
AAN是以氨基酸形式存在的氮元素,包括水溶性蛋白、多肽和氨基酸等物质,在一定程度上可以反映发酵产品的发酵程度,对产品特征风味的形成具有一定的作用。如图2所示,所有样品中AAN含量均随加工时间延长而不断增加(P<0.05),其中B组和D组中AAN含量从风干期开始增加值始终高于对照E组(P<0.05)。贮藏7 d时B组和D组AAN含量达到最高,分别为5.87、6.16 mg/g,而E组AAN含量仅为5.11 mg/g。A组和C组从发酵期到风干3 d,AAN含量始终低于对照E组,而风干7 d和贮藏7 d样品中AAN含量超过对照E组,这可能是因为A组和C组中添加的戊糖片球菌TMR-WJG所产生的蛋白酶活力不够[13],从而限制了肌原纤维蛋白的降解,导致在风干前期AAN含量增速过慢;但随着加工时间的延长,A组和C组中乳酸菌不断繁殖,产生的蛋白酶量不断累积,使得AAN含量不断增加。E组中由于缺少外源添加的发酵剂,因此AAN含量增速较慢。范露等[20]在研究宣威火腿发酵过程中AAN变化规律时也发现,在发酵中前期AAN快速升高,末期AAN增速减缓,这与该研究结果基本一致。蛋白质的降解贯穿于风干牛肉加工的整个过程,尤其是在风干前期,这种水解程度更为明显,为风干牛肉特有风味的形成发挥重要作用。因此,B组和D组的AAN含量最高,对产品特征风味的形成具有一定的作用。
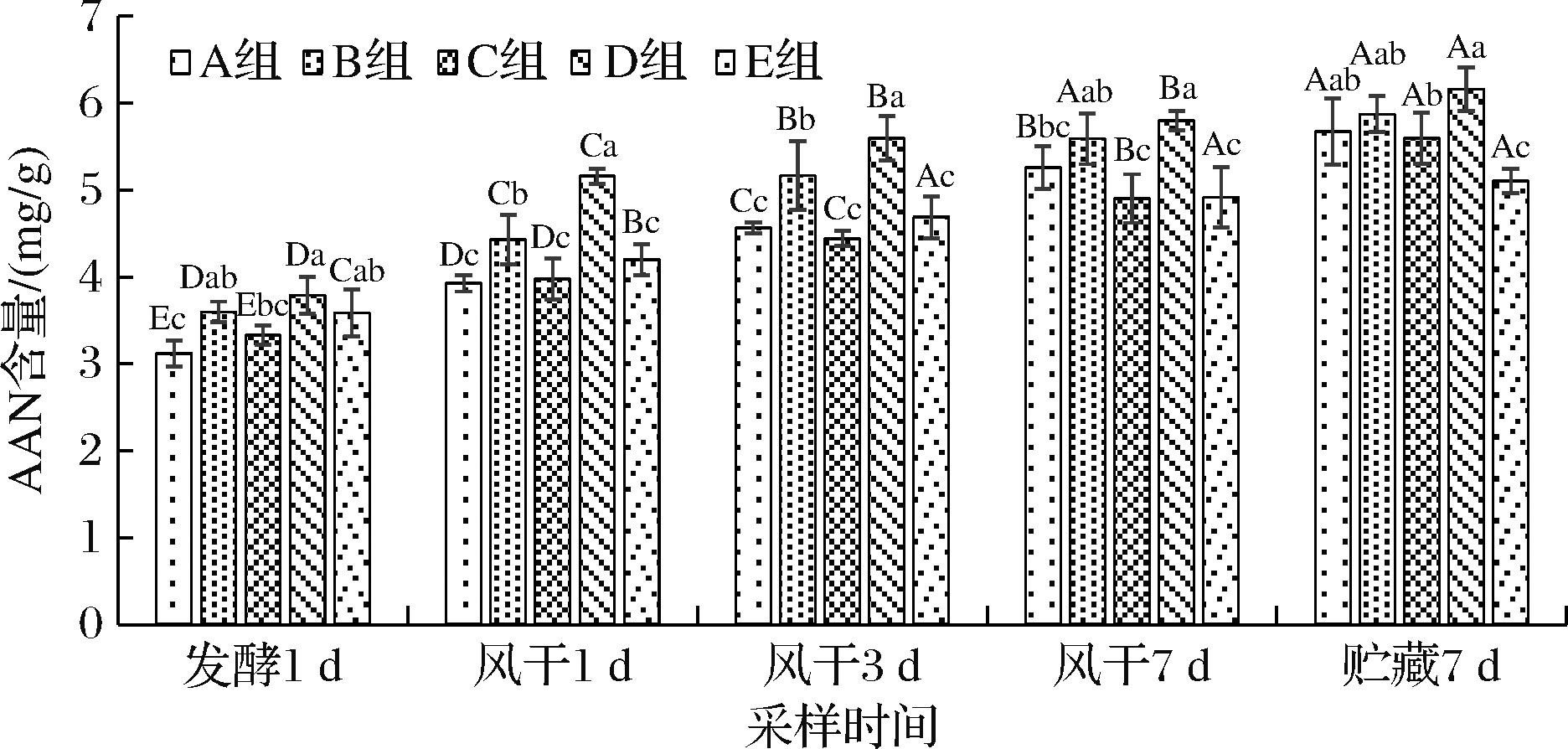
图2 复配乳酸菌对风干牛肉AAN含量的影响
Fig.2 Effects of different lactic acid bacteria on amino acid peptide nitrogen content of dried beef
2.3 复配乳酸菌对风干牛肉中游离氨基酸的影响
通常情况下,肉制品中游离氨基酸含量相对较低,但对肉类的滋味呈现及风味物质的形成较为重要[21],且呈味特性随氨基酸种类和含量的不同会有所差异。风干牛肉贮藏7 d游离氨基酸的含量及滋味特征见表4。5组风干牛肉均检测出17种游离氨基酸,其中精氨酸(Arg)与丙氨酸(Ala)含量最高,这与JU等[22]对发酵香肠中游离氨基酸含量的研究结果相似。所有风干牛肉样品均检测到人体所必需氨基酸(Try、Thr、Val、Met、Leu、Ile、Lys和Phe)。Asp与Glu具有鲜味,Ser、Gly、Thr、Ala与Pro具有甜味,Val、Met、Ile、Leu、Tyr、Phe、Lys、His、Arg具有苦味。在呈味特性方面,谷氨酸(Glu)和天冬氨酸(Asp)具有直接的呈鲜作用,从表4可以看出,A组中Asp含量显著高于其他组(P<0.05),B组中Glu显著高于其他组(P<0.05)。另外,甘氨酸(Gly)和丙氨酸(Ala)等甜味氨基酸具有增鲜作用,A组中Gly含量为0.624 μmol/mL,显著高于C、D、E组(P<0.05);B组中的Ala含量为2.571 μmol/mL,显著高于其他组(P<0.05)。另外,精氨酸(Arg)虽属于甜/苦味氨基酸,但有提鲜作用,A组中精氨酸含量最高,为2.063 μmol/mL,显著高于其他组(P<0.05)。因此可以推断,A组和B组样品可能会有较好的滋味。风干牛肉在贮藏过程中由于微生物的作用,蛋白质被肽酶降解形成多肽、非蛋白氮和游离氨基酸等物质,而这些物质对风干牛肉后期滋味的形成有很大的作用[23]。另外,游离氨基酸还可以参与美拉德反应对风味物质的形成起到重要作用[24]。
表4 不同乳酸菌发酵风干牛肉主要游离氨基酸含量测定结果 单位:μmol/mL
Table4 Determination results of main free amino acids in dried beef fermented with different lactic acid bacteria

氨基酸滋味特征[25]A组B组C组D组E组Asp(L-天冬氨酸)鲜0.144±0.012a0.054±0.003b0.010±0.000c0.049±0.012b0.064±0.005bGlu(L-谷氨酸)鲜0.826±0.002b1.421±0.035a0.638±0.021b0.847±0.148b0.630±0.030bSer(L-丝氨酸)甜0.087±0.008c0.308±0.003a0.157±0.005bc0.248±0.041a0.165±0.008bGly(甘氨酸)甜0.624±0.022a0.594±0.008a0.222±0.008c0.355±0.054b0.328±0.016bArg(L-精氨酸)甜/苦2.063±0.142a1.504±0.029b0.561±0.014d1.278±0.191c0.857±0.045dThr(L-苏氨酸)甜0.293±0.016a0.276±0.006ab0.172±0.005c0.209±0.034bc0.222±0.010bcAla(L-丙氨酸)甜2.123±0.112b2.571±0.039a0.991±0.038c1.209±0.191c1.104±0.056cPro(L-脯氨酸)甜0.823±0.024a0.816±0.030a0.271±0.009c0.224±0.036c0.441±0.023bTry(L-酪氨酸)苦0.036±0.002b0.031±0.002b0.039±0.000ab0.051±0.007a0.029±0.000bVal(L-缬氨酸)苦0.547±0.026a0.615±0.026a0.196±0.008c0.271±0.048bc0.306±0.016bMet(L-蛋氨酸)苦0.130±0.003b0.144±0.007a0.068±0.002c0.092±0.015c0.092±0.004cCys(L-胱氨酸)0.196±0.003a0.196±0.001a0.185±0.001b0.187±0.004b0.191±0.001abIle(L-异亮氨酸)苦0.223±0.007ab0.254±0.015a0.117±0.004c0.156±0.030c0.166±0.008bcLeu(L-亮氨酸)苦0.252±0.006b0.293±0.017a0.159±0.006b0.229±0.044ab0.240±0.011abPhe(L-苯丙氨酸)苦0.176±0.008ab0.219±0.036a0.087±0.002c0.166±0.029abc0.133±0.006bcTrp(色氨酸)0.185±0.002b0.229±0.001a0.076±0.001c0.108±0.018c0.184±0.009bLys(L-赖氨酸)甜/苦0.160±0.009bc0.182±0.003ab0.116±0.005c0.170±0.029bc0.237±0.011a氨基酸含量之和16.843±0.001b19.455±0.030a10.171±0.002c11.673±0.014c10.815±0.012c
注:同行数据字母不同表示差异显著(P<0.05)。
2.4 不同发酵剂对风干牛肉成熟后挥发性风味物质的影响
2.4.1 不同风干牛肉电子鼻挥发性风味物质差异分析
图3为经电子鼻检测后5组风干牛肉贮藏7 d样品中挥发性物质的主成分分析图。第一主成分PC1贡献率为94.797%,第二主成分PC2的贡献率为3.377%,这表明主成分分析能有效反映样品中挥发性风味物质的实际情况。主成分分析图的识别指数为96,表明可以在气味上能有效区分5个风干牛肉样品。由图3可知A、B组与C、D、E组相距较远,说明A、B 2组与其余3组气味相差较大。D组与对照组E组相距较近,表明D组与E组风干牛肉气味相差较小。
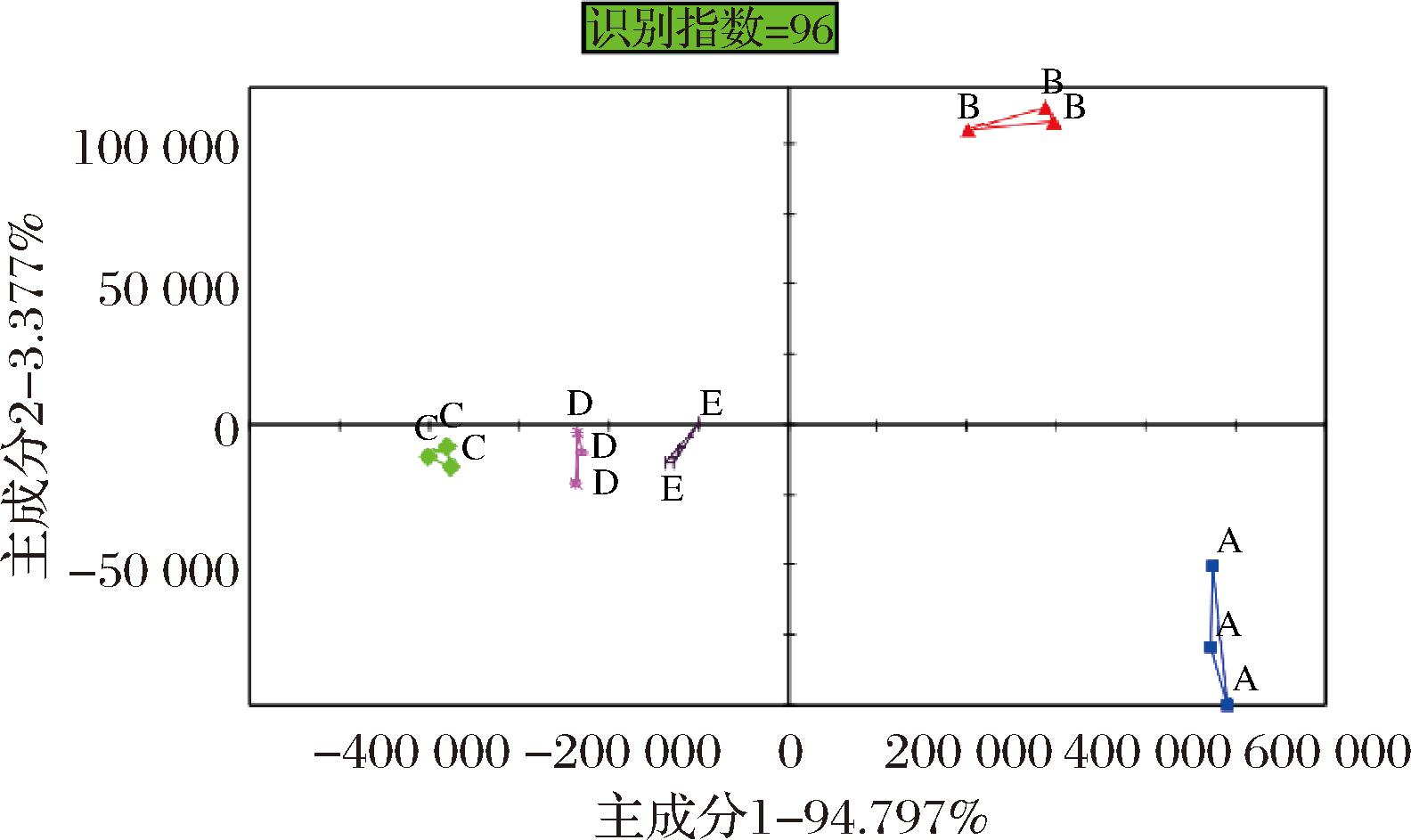
图3 复配乳酸菌发酵风干牛肉气味主成分分析图
Fig.3 Principal component analysis of the odor of dried beef fermented with compound lactic acid bacteria
采用电子鼻对不同风干牛肉样品中化合物含量进行测定,用AroChemBase数据库对筛选出的差异较大的色谱峰进行定性,并绘制差异含量柱状图(图4)。2-甲基丁醛、2-甲基-1-丁醇、丙酮、(E)-2-戊烯醛、2-丁酮、肉豆蔻烯等化合物在风干牛肉中含量较高。另外,接种不同复配发酵剂的试验组中,B组风味物质总体含量更高,特别是具有油脂香味的2-丁酮、果香味的2-甲基丁醛,焦香味辛烷和肉豆蔻烯等物质[19]含量相对更高。杨晓钢等[26]利用乳酸菌、葡萄球菌和酵母菌作为发酵剂在低酸条件下对牛肉进行发酵,发现与自然发酵相比,添加发酵剂的牛肉产生的特征风味物质更多,这与本研究的结果类似。另外,杨晓钢等[26]还发现发酵牛肉的特征风味物质为3-甲基丁醛,而本试验中检测到的特征风味物质为2-甲基丁醛,这可能是由于使用的发酵菌株不同所致。XIAO等[27]也发现,风味蛋白酶和植物乳杆菌联合使用可以促进草鱼发酵过程中蛋白质的降解,增加水溶性风味物质的含量。本试验中,选用的乳酸菌均具有产蛋白酶能力,因此其制作的风干牛肉的特征挥发性风味物质含量相对更高,但是由于3株乳酸菌的产蛋白酶性能及产生酶的活力均存在一定的差异,按照不同的方式进行复配后,产生的蛋白酶对蛋白质的降解能力仍存在差异,因此导致了其特征挥发性风味物质也存在差异。

图4 复配乳酸菌发酵风干牛肉气味差异性化合物含量柱状图
Fig.4 Histogram of the content of compounds with different odors in dried beef fermented with compound lactic acid bacteria
2.4.2 不同风干牛肉GC-IMS挥发性风味物质差异分析
GC-IMS不仅能对样品中挥发性风味物质进行检测,还能对不同样品间风味物质的差异性进行可视化比较。
图5为复配乳酸菌发酵牛肉样品GC-IMS差异图,图左侧样品E组横坐标1.0处的红色竖线为反应离子峰(reaction ion peak,RIP),位于RIP峰两侧的每个亮点都代表一种挥发性有机物。亮点颜色表示化合物量的多少,其中红色代表含量较高,而白色则表示该物质含量较低。以E组风干牛肉为参照,其余样品GC-IMS谱图中减去与E组中信号峰含量相同的成分,即得到与E组比对的复配乳酸菌发酵牛肉样品GC-IMS差异图(图5,右侧A、B、C、D)。图5中蓝色亮点便是在相同离子迁移时间条件下该物质在此样品中的含量低于对照E组,红色亮点则表示该物质在此样品中含量高于对照E组。图5蓝色方框内亮点代表的化合物是2-甲基丁酸乙酯。在A和C样品中,代表2-甲基丁酸乙酯的信号峰颜色为红色,说明其含量高于对照E组,而D组的信号峰颜色为蓝色,其含量低于对照E组。图5中,相对于其他试验组,B组样品中信号峰较多且颜色较深,说明B组样品中挥发性风味物质与E组差异较大,主要差异化合物集中在红色方框内。相对于实验组,对照组中没有外源添加发酵剂,但其与A组和C组中挥发性风味物质之间差异不大,这可能跟乳酸菌对牛肉肌原纤维蛋白的降解能力有关[12]。A组中添加的发酵剂为格氏乳球菌TC-6和戊糖片球菌TMR-WJG,C组样品添加的为戊糖片球菌TMR-WJG和乳酸乳球菌TC-2,而相对于乳酸乳球菌和格氏乳杆菌,戊糖片球菌TMR-WJG的产酶性能和酶活力都较弱[28],另外,在发酵过程中,戊糖片球菌TMR-WJG的生长繁殖可能会竞争其营养物质,从而影响其他乳酸菌的发酵性能,进一步影响其对蛋白质的降解能力。
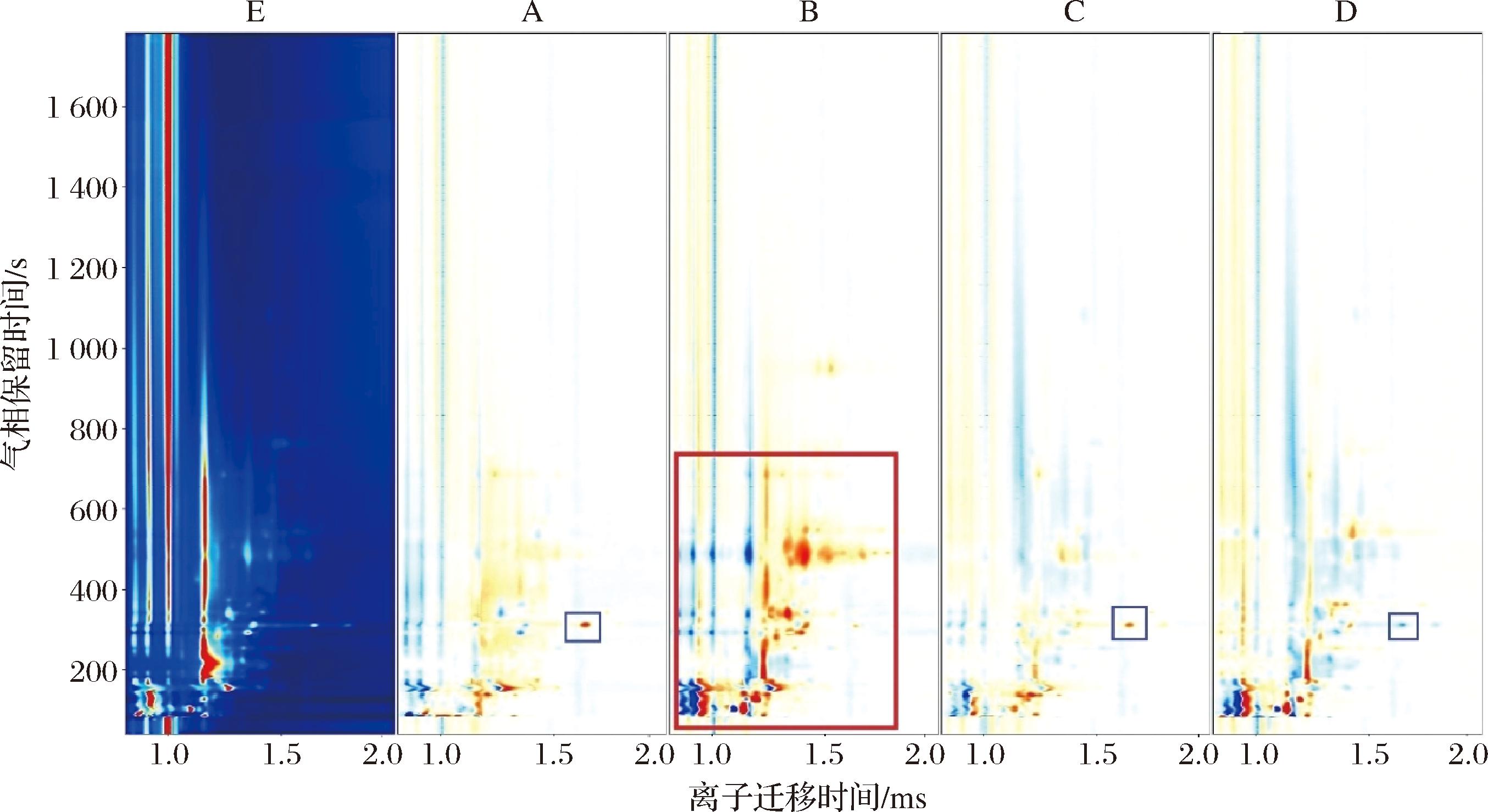
图5 复配乳酸菌发酵牛肉样品GC-IMS差异图
Fig.5 Differences in gas chromatographic ion mobility spectra of beef samples treated with compound lactic acid bacteria
2.4.3 不同风干牛肉GC-IMS挥发性风味物质定性分析
通过对检测到的挥发性化合物与GC-IMS Library Search内置数据库进行对比发现,5组样品中共有56种挥发性化合物被检测。由于数据库限制,只有35种化合物被确定名称,这些化合物包括烃类2种、醛类9种、醇类8种、酸类4种、酯类3种、萜烯类1种、酮类5种、其他类3种(图6)。
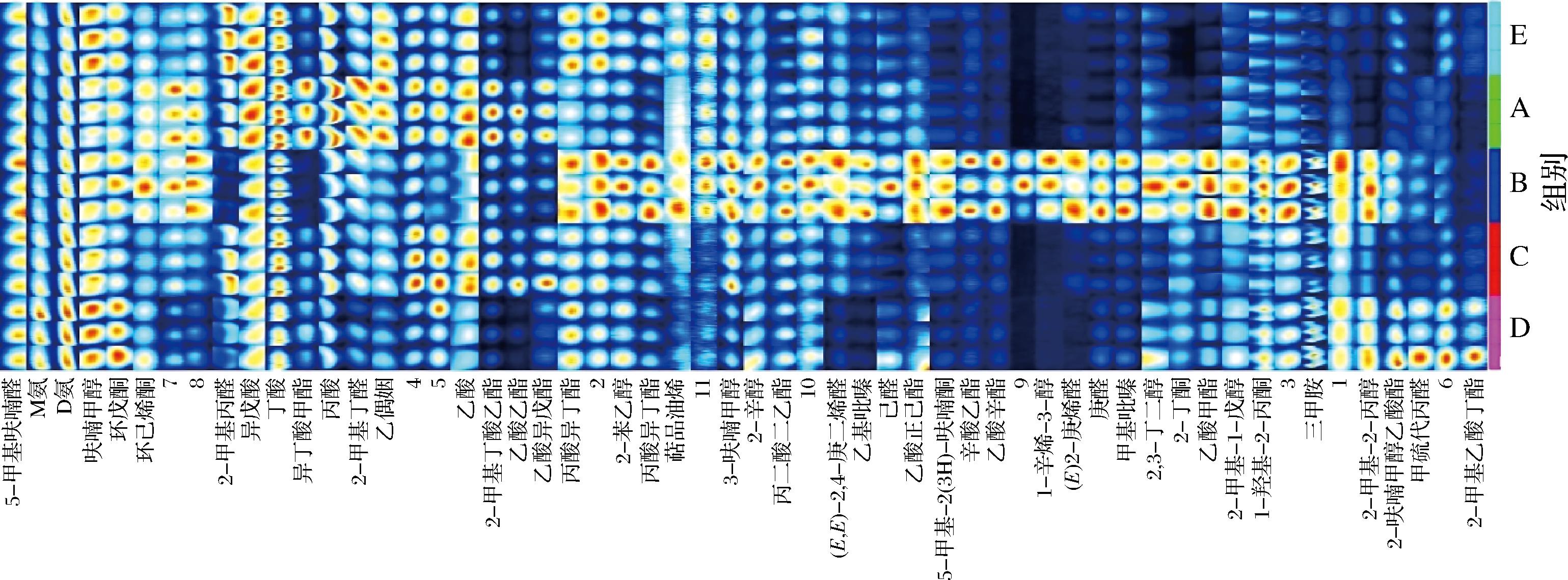
图6 复配乳酸菌发酵牛肉样品挥发性物质指纹图谱
Fig.6 The fingerprint of volatile substances in beef samples treated with compound lactic acid bacteria
为了更清晰地比较不同处理组样品中挥发性物质的异同,将样品中所有化合物信号峰构建风干牛肉挥发性物质指纹图谱,其中每一行代表一种样品,每组样品重复3次(右侧相同色块标注)。每一列则表示同一种化合物在不同样品中的信号峰,颜色越红,代表该物质在样品中的含量越高。风干牛肉指纹图谱结果表明,5组样品的特征图谱存在一定差异,且B组样品的挥发性风味物质的种类最多且含量也最高。图6中红色方框中的丁酸丙酯、丙二酸二乙酯、辛酸乙酯、丙酸异丁酯、乙酸甲酯、己酸正异戊酯、乙酸辛酯、2-辛醇、1-辛烯-3-醇、2,3-丁二醇、2-甲基-1-戊醇、2-甲基-2-丙醇、2-苯乙醇、3-呋喃甲醇、萜品油烯等物质在B组中含量很高,其中2,3-丁二醇、1-辛烯-3-醇、(E)2-庚烯醛、乙酸辛酯、辛酸乙酯仅存在于B组中;丁酸丙酯、丙酸异丁酯、2-苯乙醇、萜品油烯等物质在对照E组样品中含量仅次于B组,而乙酸甲酯、1-羟基-2-丙酮、2-甲基-1-戊醇、2-甲基-2-丙醇、三甲胺等物质在D组样品中含量也仅次于B组。黄框中的甲硫代丙醛和2-甲基乙酸丁酯等物质在D组样品中含量较高,其中2-甲基丁基乙酸酯仅存在于该样品中,这有可能是由D组中接种的3种乳酸菌共同作用的结果。绿框中的乙酸乙酯、2-甲基丁酸乙酯、乙酸异戊酯、乙酸在A组和B组样品中含量高于其他组。紫色框中的异戊酸、丁酸在对照E组中含量较高,在A组样品中含量也比较高,在其他处理组的牛肉样品中含量略低。丙酸、2-甲基丙酸甲酯、2-甲基丁醛在A组样品里含量高于其他样品。从以上结果可以看出,B组样品中醇和酯类的含量相比于其他组更高,说明格氏乳球菌TC-6和乳酸乳球菌TC-2按照1∶1复配作为发酵剂生产风干牛肉,可以增加风干牛肉中醇类和酯类风味物质的产生,从而赋予风干牛肉一定水果香气[29]。D组样品中挥发性风味物质指纹图谱与B组较为接近,可能是因为D组添加的发酵剂是3种乳酸菌的混合物,其中包括了格氏乳球菌TC-6和乳酸乳球菌TC-2,而戊糖片球菌TMR-WJG所产的蛋白酶活力稍弱,在本组试验中对蛋白质的降解不起主导作用,因此B组和D组风干牛肉样品的风味特征较为相似。A组和C组风干牛肉的挥发性风味物质种类和含量均与B组差异较大,这有可能是因为这2组样品中均添加的戊糖片球菌TMR-WJG影响了风干牛肉挥发性风味物质的产生,这可能跟戊糖片球菌TMR-WJG产生的蛋白酶活力不高有关[28]。
2.5 风干牛肉的感官评价
如图7所示,对接种不同发酵剂的风干牛肉肉色、滋味、口感、气味、组织形态5个方面进行感官评定。结果显示,接种发酵组评分均大于E组,发酵组和E组在气味、肉色方面的差别明显,E组略有霉味,发酵组具有特殊果香味。感官评分中B组明显高于其他组,这与风干牛肉的风味指标一致。说明添加格氏乳球菌TC-6和乳酸乳球菌TC-2在一定程度上可以提高风干牛肉的整体风味品质。
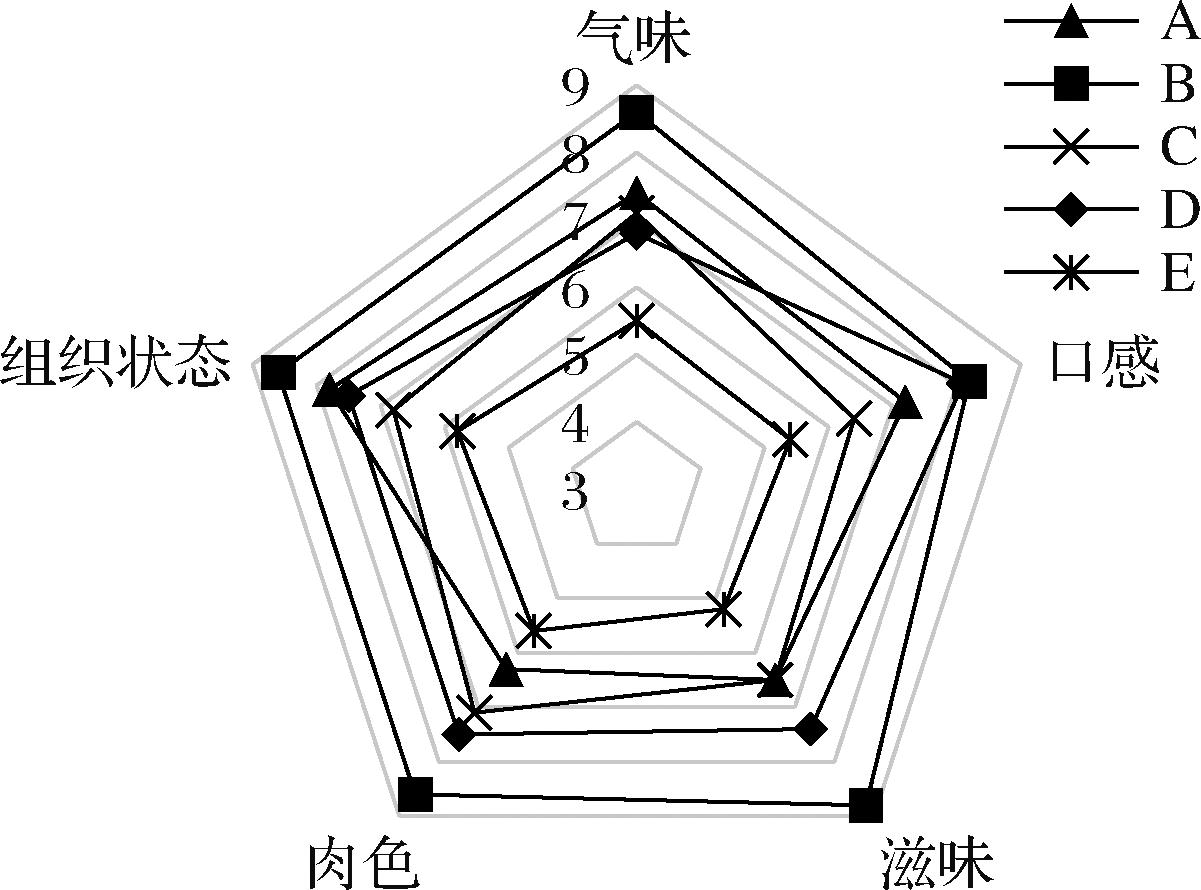
图7 风干牛肉感官评价雷达图
Fig.7 Radar diagram of sensory evaluation of dried beef
3 结论
乳酸菌发酵剂能够增加风干牛肉中蛋白质的降解程度,提高牛肉中NPN和AAN含量(P<0.05),显著提高A组和B组风干牛肉中总游离氨基酸含量 (P<0.05),其中,B组中鲜味氨基酸Glu(L-谷氨酸)含量为1.421 μmol/mL,甜味氨基酸Ala(L-丙氨酸)含量为2.571 μmol/mL,为各组最高;对C组和D组中总游离氨基酸含量的影响不明显(P>0.05)。
电子鼻技术对5组风干牛肉中挥发性风味物质差异含量检测结果表明,格氏乳球菌TC-6与乳酸乳球菌TC-2按1∶1混合作为发酵剂制作的风干牛肉中2-甲基丁醛、2-丁酮、辛烷和肉豆蔻烯等物质含量最高,风干牛肉特征香气较好。气相离子迁移谱结果表明,风干牛肉中主要的挥发性风味物质包括烃类2种、醛类9种、醇类8种、酸类4种、酯类3种、萜烯类1种、酮类5种、其他类3种。B组中挥发性风味物质最为丰富,且与对照E组差异最大,其风味物质中醇类和酯类含量较其他组更高。感官综合指标方面,B组肉色、滋味、口感、气味、组织状态评分都最佳。
综上所述,利用格氏乳球菌TC-6和乳酸乳球菌TC-2混合发酵的风干牛肉风味品质更好,产生的游离氨基酸含量更高,挥发性风味中含有油脂香味和果香味,使得风干牛肉风味更加丰富和细腻。
[1] 李泽坤, 肖宇, 焦阳, 等.脂质和蛋白质氧化对肉品质的影响[J].中国食品学报, 2024, 24(7):438-449.LI Z K, XIAO Y, JIAO Y, et al.Effects of lipid and protein oxidation on meat quality[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(7):438-449.
[2] ROCCHETTI G, REBECCHI A, MARIA LOPEZ C, et al.Impact of axenic and mixed starter cultures on metabolomic and sensory profiles of ripened Italian salami[J].Food Chemistry, 2023, 402:134182.
[3] ZHOU J Y, YING Y B, PENG J B, et al.Lactic acid bacteria and Staphylococcus carnosus fermentation as a means for eliminating 4-alkyl branched odour fatty acids of mutton jerky and its effect on other quality characteristics[J].International Journal of Food Science &Technology, 2022, 57(10):6843-6851.
[4] HU Y Y, TIAN Y, ZHU J M, et al.Technological characterization and flavor-producing potential of lactic acid bacteria isolated from traditional dry fermented sausages in Northeast China[J].Food Microbiology, 2022, 106:104059.
[5] LYU J, LIN X P, LIU M Y, et al.Effect of Saccharomyces cerevisiae LXPSC1 on microorganisms and metabolites of sour meat during the fermentation[J].Food Chemistry, 2023, 402:134213.
[6] 陈倩, 李永杰, 扈莹莹, 等.传统发酵食品中微生物多样性与风味形成之间关系及机制的研究进展[J].食品工业科技, 2021, 42(9):412-419.CHEN Q, LI Y J, HU Y Y, et al.Research progress on relationship and mechanism between microbial diversity and flavor development in traditional fermented foods[J].Science and Technology of Food Industry, 2021, 42(9):412-419.
[7] 周洁, 李洪英, 朱秋劲, 等.贵式肉品中乳酸菌的选育及其对发酵里脊火腿风味品质的影响[J].食品科学, 2022, 43(8):175-183.ZHOU J, LI H Y, ZHU Q J, et al.Isolation and characterization of lactic acid bacteria from Guizhou-style meat products and its effect on flavor and quality of fermented loin ham[J].Food Science, 2022, 43(8):175-183.
[8] 王俊钢, 李宇辉, 刘成江, 等.新疆哈萨克族传统风干肉中细菌多样性分析及安全评价[J].中国食品学报, 2021, 21(11):209-218.WANG J G, LI Y H, LIU C J, et al.Analysis and safety evaluation of bacterial diversity profiles in traditional air-dried meat of Xinjiang Kazakh[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):209-218.
[9] LYU J, YANG Z X, XU W H, et al.Relationships between bacterial community and metabolites of sour meat at different temperature during the fermentation[J].International Journal of Food Microbiology, 2019, 307:108286.
[10] GAO F, ZHANG K P, WANG D X, et al.Effect of Lactobacillus helveticus IMAUJBH1 on fat and volatile flavor substances in fermented mutton sausages[J].Food Chemistry:X, 2024, 21:101205.
[11] HU Y Y, LI Y J, LI X G, et al.Application of lactic acid bacteria for improving the quality of reduced-salt dry fermented sausage:Texture, color, and flavor profiles[J].LWT, 2022, 154:112723.
[12] L PEZ C M, SENTANDREU M A, VIGNOLO G M, et al.Low molecular weight peptides derived from sarcoplasmic proteins produced by an autochthonous starter culture in a beaker sausage model[J].EuPA Open Proteomics, 2015, 7:54-63.
PEZ C M, SENTANDREU M A, VIGNOLO G M, et al.Low molecular weight peptides derived from sarcoplasmic proteins produced by an autochthonous starter culture in a beaker sausage model[J].EuPA Open Proteomics, 2015, 7:54-63.
[13] 王俊钢, 李宇辉, 岳建平, 等.不同产蛋白酶乳酸菌对风干牛肉蛋白质降解的影响[J].食品工业科技, 2022, 43(8):117-123.WANG J G, LI Y H, YUE J P, et al.Effects of different protease-producing lactic acid bacteria on the degradation of dried beef protein[J].Science and Technology of Food Industry, 2022, 43(8):117-123.
[14] 王选飞, 刘俊荣, 衣鸿莉, 等.红鳍东方鲀肌肉组织及生化组成特性研究[J].食品科学技术学报, 2020, 38(6):93-102.WANG X F, LIU J R, YI H L, et al.Study on muscle texture and biochemical properties of farmed Takifugu rubripes[J].Journal of Food Science and Technology, 2020, 38(6):93-102.
[15] ZHAN F L, SUN L X, ZHAO G M, et al.Multiple technologies combined to analyze the changes of odor and taste in Daokou braised chicken during processing[J].Foods, 2022, 11(7):963.
[16] 王俊钢, 李宇辉, 岳建平.不同干燥条件对风干牛肉品质影响[J].食品研究与开发, 2023, 44(16):76-84.WANG J G, LI Y H, YUE J P.Effects of different drying conditions on beef quality[J].Food Research and Development, 2023, 44(16):76-84.
[17] 董玉影. 贮藏期间不同部位延边黄牛肉蛋白质降解及品质分析[D].延边:延边大学, 2015
DONG Y Y.Protein degradation and quality analysis of different parts of Yanbian yellow beef during storage[D].Yanbian:Yanbian University, 2015.
[18] 张宁龙, 王文利, 刘源.牛肉风味肽的研究进展[J].食品工业科技, 2019, 40(8):317-322.ZHANG N L, WANG W L, LIU Y.Research progress of beefy meaty peptide[J].Science and Technology of Food Industry, 2019, 40(8):317-322.
[19] 陈敬敬. 传统陇西腊肉加工过程中内源性蛋白酶和肉品质的相关性研究[D].兰州:甘肃农业大学, 2023.CHEN J J.Study on the correlation between endogenous proteases and meat quality of Traditional Longxi bacon during processing[D].Lanzhou:Gansu Agricultural University, 2023.
[20] 范露, 冯牛, 许嘉验, 等.宣恩火腿蛋白质降解规律[J].食品工业科技, 2019, 40(23):42-46;53.FAN L, FENG N, XU J Y, et al.Degradation law of protein of Xuanen ham[J].Science and Technology of Food Industry, 2019, 40(23):42-46;53.
[21] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5):642-646.
[22] JU M G, KIM J H, JANG H J, et al.Changes of physicochemical and sensory properties of fermented sausage from sulfur-fed pork[J].Korean Journal for Food Science of Animal Resources, 2016, 36(6):729-736.
[23] 陈援援, 马凯华, 牛文秀, 等.微生物发酵剂对风干肠风味形成及变化的影响[J].食品科学, 2022, 43(14):125-135.CHEN Y Y, MA K H, NIU W X, et al.Effect of starters on the formation and changes of flavor substances in air-dried sausages[J].Food Science, 2022, 43(14):125-135.
[24] SUN A, CHEN L N, WU W, et al.The potential meat flavoring generated from Maillard reaction products of wheat gluten protein hydrolysates-xylose:Impacts of different thermal treatment temperatures on flavor[J].Food Research International, 2023, 165:112512.
[25] DASHDORJ D, AMNA T, HWANG I.Influence of specific taste-active components on meat flavor as affected by intrinsic and extrinsic factors:An overview[J].European Food Research and Technology, 2015, 241(2):157-171.
[26] 杨晓钢, 赵鑫锐, 堵国成.低酸牛肉发酵剂的筛选、工艺优化及品质特性研究[J].食品与发酵工业, 2022, 48(19):185-195.YANG X G, ZHAO X R, DU G C.Screening, fermentation condition optimization and quality evaluation of commercial low acidity fermented beef starter[J].Food and Fermentation Industries, 2022, 48(19):185-195.
[27] XIAO N Y, ZHANG Q, XU H Y, et al.Effect of Lactobacillus plantarum and flavourzyme on protein degradation and flavor development in grass carp during fermentation[J].Food Chemistry:X, 2024, 22:101439.
[28] 李丹阳, 李宇辉, 高云云, 等.新疆哈萨克族风干肉中产蛋白酶乳酸菌的筛选及酶学特性研究[J].食品与发酵工业, 2020, 46(9):57-63.LI D Y, LI Y H, GAO Y Y, et al.Screening of protease-producing lactic acid bacteria from Xinjiang Kazakh air-dried meat and their enzymatic characteristics[J].Food and Fermentation Industries, 2020, 46(9):57-63.
[29] CARRAPISO A I, NOSEDA B, GARC A C, et al.SIFT-MS analysis of Iberian hams from pigs reared under different conditions[J].Meat Science, 2015, 104:8-13.
A C, et al.SIFT-MS analysis of Iberian hams from pigs reared under different conditions[J].Meat Science, 2015, 104:8-13.