蓝莓富含多种生物活性物质,其中花色苷是蓝莓中最重要的生物活性成分之一[1]。花色苷具有多种生物活性,包括抗氧化、抗炎和神经保护等。由于其鲜艳的色泽和功能特性,花色苷被广泛应用于商业食品和饮料产品,作为天然色素添加剂使用[2]。然而,花色苷对光、温度、氧气、pH值等环境因素敏感,这些不利影响因素会导致花色苷褪色[3]。研究表明,添加有机酸可以提高(巴西莓、草莓、李子、覆盆子、越橘、蔓越莓等)花色苷的稳定性[4-5],但是这些研究大都基于花色苷水溶液或含有花色苷的模拟液体溶液,而不是复杂的饮料基质,如果汁或葡萄酒。此外,ZHAO等[6]的研究结果表明,5种花色苷和常见酚类相互作用导致的增色作用和热力学值变化与辅色素的种类及结构有关,不同花色苷和酚类的作用结果都遵循槲皮素>表儿茶素>没食子酸的规律。李依娜等[7]在研究中发现,不同的有机酸在提高三华李清汁贮藏期间的色泽稳定性上表现出差异性。目前,大量研究已证实不同有机酸对花色苷稳定性的保护效果各不相同,但这些研究主要集中于辅色效果及其在食品、饮料等产品中的应用。相比之下,关于有机酸结构对辅色效果影响的深入探讨仍相对有限。
因此,本研究中,为研究蓝莓汁颜色变化及花色苷的热反应动力学,选择了常见的4种有机酸(阿魏酸、咖啡酸、没食子酸、苹果酸),比较不同结构对共色素沉着作用的影响,利用傅里叶变换红外吸收光谱(Fourier transform infrared spectrometer,FTIR)法和分子对接分析复合物的相互作用力,探究了花色苷与有机酸之间的相互作用机理。
1 材料与方法
1.1 材料与仪器
蓝莓,江苏省南京市溧水区提供;苹果酸、阿魏酸、咖啡酸、没食子酸,上海麦克林生化科技有限公司;果胶酶,HCl、乙醇、KCl,上海凌峰化学试剂有限公司;所有试剂均为分析纯。
UV-2803紫外可见分光光度计,上海谱元公司;Color Quest XE色差计,深圳三恩时科技有限公司;Spectrum GX型FTIR仪,常州国华电器有限公司;QFN-DGJ-10 N台式高速冷冻离心机,金坛市白塔新宝仪器厂。
1.2 实验方法
1.2.1 蓝莓汁及有机酸混合溶液的制备
参考文献[8]的方法并适当修改,将500 g蓝莓与0.5 L去离子水一同加入破碎机进行打浆,加入2 g果胶酶(30 000 U/g)后搅拌,酶解1 h,制备得到蓝莓粗提取液。将所得粗提取液以3 500 r/min离心20 min,取上清液;分别加入0.08 mol/L阿魏酸、咖啡酸、苹果酸以及没食子酸溶液3 mL(体积分数10%乙醇水溶液),混合后离心过滤,用1 mol/L HCl或NaOH溶液调节pH值至3.5,得到有机酸-蓝莓汁溶液。
1.2.2 吸收光谱测定
取4 mL有机酸-蓝莓汁溶液,用pH 3.5的磷酸缓冲液分别稀释至10 mL,并使溶液吸光度在合理区间0.2~0.8,振荡15 min后置于室温下避光静置2 h。用紫外-可见分光光度计在波长450~600 nm扫描样品可见吸收光谱并确定其最大吸收波长。计算辅色后的蓝莓汁最大吸收峰波长与对照组的差值Δλmax和最大吸光度差值ΔAλmax。
1.2.3 有机酸对蓝莓汁溶液色度值的影响
参考文献[9]的方法,在25 ℃下避光储存7 d,测定样品的L、a、b值,并计算储存后与储存前的ΔL、Δa、Δb值与蓝莓汁的色差值ΔE,如公式(1)所示:
(1)
1.2.4 花色苷保留率测定
参考文献[10]的方法,分别配制pH 1.0的KCl溶液和pH 4.5的CH3COONa溶液。将上述缓冲液分别与蓝莓汁混合,室温下孵育20 min后,读取吸光度。利用公式(2)和公式(3)计算保留率:
D=(D520 nm-D700 nm)pH1.0-(D520 nm-D700 nm)pH4.5
(2)
(3)
式中:D,总吸光值;D520 nm、D700 nm分别为波长520、700 nm处的吸光度值;Dt、D0分别为t、0时间的总吸光值;X,t时间的保留率,%。
1.2.5 热力学参数测定
将样品置于不同温度(40、60、80 ℃)的水浴中加热,每30 min测定吸光度。辅色花色苷的降解遵循一级动力学[11],降解速率常数(k)和半衰期(t1/2)使用公式(4)、公式(5)计算:
(4)
(5)
式中:C0、Ct,在时间0、t处的花色苷含量,mg/L;t,时间,h;k,速率常数,h-1;t1/2,降解的半衰期值,h。
使用阿伦尼乌斯方程[12]计算活化能(Ea),如公式(6)所示:
(6)
式中:K0,花色苷降解率,h-1;Ea,活化能,kJ/mol;R,理想气体常数,8.314 J/(mol·K);T,温度,K。
使用公式(7)~公式(9)计算每个温度下的活化焓(ΔH,kJ/mol)、活化熵(ΔS,kJ/mol)和失活吉布斯自由能(ΔG,kJ/mol):
ΔH=Ea-RT
(7)
(8)
(9)
式中:T,温度,K;h,普朗克常数,6.626 2×10-34 J/s;KB,玻尔兹曼常数,1.380 6×10-23 J/K。
1.2.6 加成产物分析
将样品放入冷冻干燥机中充分冷冻干燥,取粉末固体与烘干KBr一起研磨,混合均匀[13]。将磨好的样品压片后,放到FTIR仪上分析,光谱范围为4 000~700 cm-1,分辨率2 cm-1。
1.2.7 分子计算
蓝莓中花色苷主要为矢车菊色素、飞燕草色素、芍药色素、牵牛花色素、锦葵素的3-糖苷(糖苷分别为半乳糖、葡萄糖、阿拉伯糖)[14]。选取矢车菊素-3-O-葡萄糖苷和飞燕草素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷作为代表对象研究,分析他们与几种有机酸的辅色反应,以解释和验证实验结果的合理性。
从PubChem分子库下载花色苷及有机酸的分子结构,OpenBabel将所有分子格式转换为与对接所需的PDBQT格式。AutoDock设置对接盒子,Vina快速柔性对接花色苷和有机酸。根据操作结果中结合能最低、结合数最大的原则,得到最佳对接结果,所得结构参数导入到PyMol可视化复合物结构和相互作用力。
1.3 数据处理
所有测试均重复3次。使用SPSS 16.0进行统计分析。采用单因素方差分析和邓肯差异分析,显著性水平设置为P<0.05。
2 结果与分析
2.1 有机酸对蓝莓汁吸收光谱的影响
图1显示,4种辅色素均导致400~700 nm的吸光度增加与最大吸收波长右移。与对照组相比,有机酸辅色组λmax向右增加了2~8 nm,Aλmax增加了3.6%~38.6%。4种有机酸辅色作用从大到小顺序为:阿魏酸>咖啡酸>没食子酸>苹果酸。与没食子酸相比,阿魏酸和咖啡酸含有苯环并且辅色作用更强,这是因为它们的结构包含1个平面的富含电子的π环,允许其与黄酮离子的嘧环有较大的π-π重叠[15]。同时,阿魏酸和咖啡酸中碳双键的存在更容易提供电子,可能导致羟甲基肉桂酸的辅色作用优于羟甲基苯甲酸的辅色作用。此外,阿魏酸的取代基是甲氧基,咖啡酸的取代基是羟基,前者的辅色更强,取代基为甲氧基结构的酚酸比为羟基的辅色作用更强[16],可能是由于甲氧基具有更大的空间尺寸,因此促进了色素-共色素复合物中的π-π堆叠相互作用[6]。高敏[17]在对红肉苹果花色苷的辅色研究中,也观察到阿魏酸和咖啡酸处理后的花色苷最大吸收波长出现红移现象。辅色剂结构显著影响了蓝莓花色苷的共色素沉着效果。
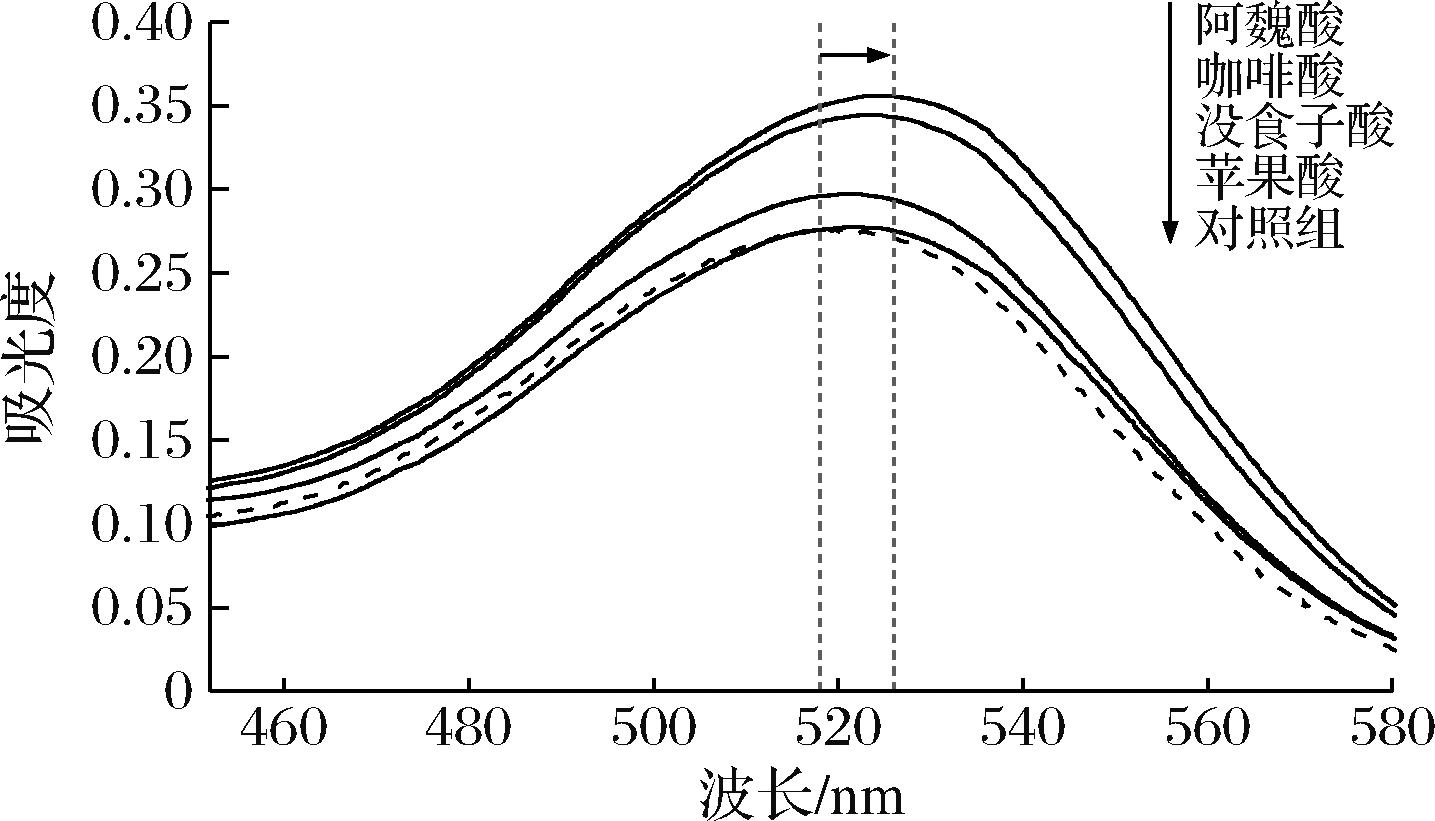
图1 不同有机酸处理下蓝莓汁在450~580 nm的吸收光谱
Fig.1 Absorption spectra of blueberry juice with different organic acids in 450-580 nm
2.2 有机酸对蓝莓汁泽稳定性的影响
ΔE值越大,样品的色差越大。若ΔE>3.0,表示产生了肉眼可辨的颜色变化[18]。如表1所示,随着贮藏时间的延长,蓝莓汁溶液的ΔE值逐渐增加,L值上升,而a和b值则下降,但在此贮藏条件下,花色苷仍保持相对稳定。经有机酸处理的样品组ΔE值显著低于对照组,有机酸能够提高蓝莓汁溶液的颜色稳定性,可作为蓝莓汁花色苷的优选辅色剂。所选有机酸对颜色的稳定效果由高到低依次为:阿魏酸、咖啡酸、没食子酸和苹果酸。YOU等[19]曾报道属于羟基肉桂酸组的咖啡酸、阿魏酸和对香豆酸表现出最强的护色特性,单宁酸表现出中等程度的颜色保护,属于羟基苯甲酸族的没食子酸、对羟基苯甲酸和丁香酸表现出最少的颜色保护特性。辅色剂不仅对花色苷具有辅色作用,同时它会使平衡向有色基团的生成转变,黄烊阳离子相比其他几种形式具有更高的稳定性,因此提高了蓝莓汁颜色的稳定性[20]。尽管4种共色素的行为具有保护趋势,共色素的不同结构导致效果存在差异。
表1 不同有机酸处理蓝莓汁在储存7 d后的色度变化
Table 1 Chromatic changes in blueberry juice with different organic acids after 7 days of storage
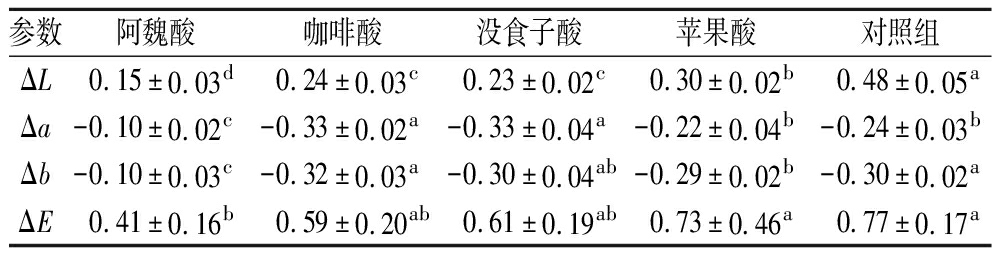
参数阿魏酸咖啡酸没食子酸苹果酸对照组ΔL0.15±0.03d0.24±0.03c0.23±0.02c0.30±0.02b 0.48±0.05aΔa-0.10±0.02c-0.33±0.02a-0.33±0.04a-0.22±0.04b-0.24±0.03bΔb-0.10±0.03c-0.32±0.03a-0.30±0.04ab-0.29±0.02b-0.30±0.02aΔE0.41±0.16b0.59±0.20ab0.61±0.19ab0.73±0.46a0.77±0.17a
注:不同字母代表显著性差异(P<0.05)(下同)。
2.3 有机酸对花色苷热稳定性的影响
所有组中花色苷保留率均随着温度的升高而降低(图2)。在高温下,辅色素阻止了花色苷的热降解,其中阿魏酸对花色苷保护效果最佳,其次是咖啡酸、没食子酸和苹果酸。在本研究中,花色苷分别与阿魏酸和苹果酸形成了最稳定和最不稳定的复合物,这与辅色剂的苯酚环以及羟基等化学结构有关。CHEN等[21]提出阿魏酸和咖啡酸中均由于含有苯环和碳双键,这2种有机酸的辅色效果较好。没食子酸有3个羟基能够连接到苯环上,其超色素效果优于原儿茶酸和对羟基苯甲酸,这表明辅色剂的游离羟基能够促进共色素沉着。
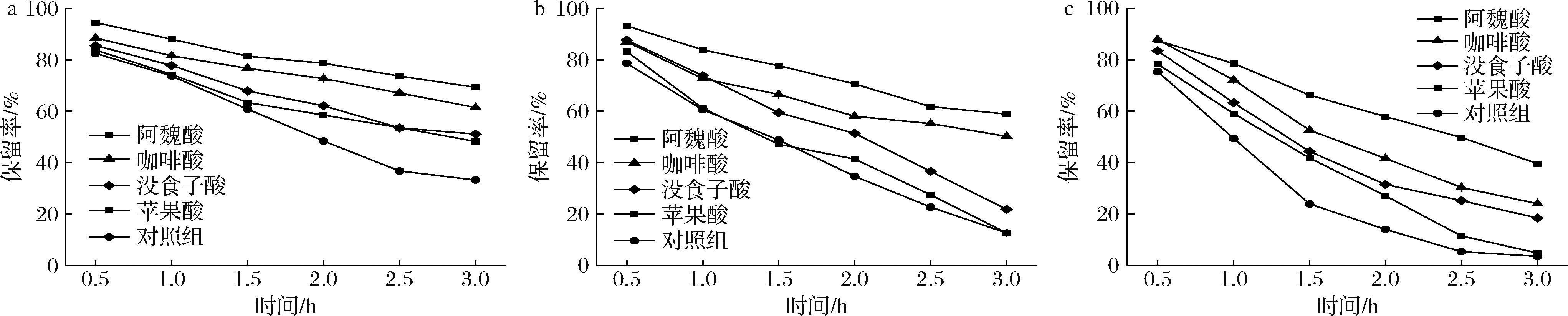
a-40 ℃;b-60 ℃;c-80 ℃
图2 不同温度下有机酸处理对蓝莓汁中花色苷保留率的影响
Fig.2 Effect of temperature on anthocyanin retention rate in blueberry juice with different organic acids
一级动力学模型通常用于测量花色苷的降解。所有花色苷样品的降解速率k值随温度的升高而增加,t1/2值降低(表2)。在低温下,有机酸样品的t1/2值显著高于对照组。在40、60、80 ℃高温处理后,辅色样品的半衰期大小顺序为:阿魏酸>咖啡酸>没食子酸>苹果酸>对照组。如表2所示,高活化能值表示降解反应需要较高的能量,能量越高,花色苷越稳定[13]。阿魏酸的辅色作用过程所需的能量大于咖啡酸、没食子酸和苹果酸,因此,阿魏酸辅色组的花色苷最稳定。
表2 有机酸处理花色苷在 40、60、80 ℃热处理条件下的降解动力学参数
Table 2 Thermal degradation kinetics of anthocyanin with organic acid at 40, 60, and 80 ℃
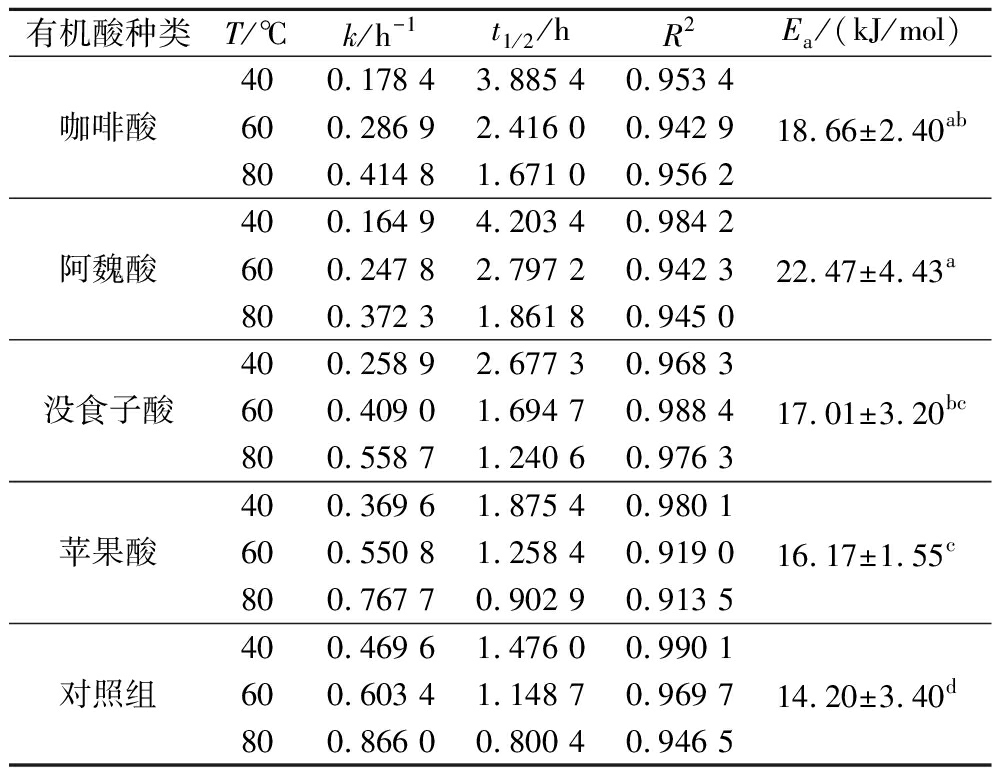
有机酸种类T/℃k/h-1t1/2/hR2Ea/(kJ/mol)咖啡酸400.178 43.885 40.953 4600.286 92.416 00.942 9800.414 81.671 00.956 218.66±2.40ab阿魏酸400.164 94.203 40.984 2600.247 82.797 20.942 3800.372 31.861 80.945 022.47±4.43a没食子酸400.258 92.677 30.968 3600.409 01.694 70.988 4800.558 71.240 60.976 317.01±3.20bc苹果酸400.369 61.875 40.980 1600.550 81.258 40.919 0800.767 70.902 90.913 516.17±1.55c对照组400.469 61.476 00.990 1600.603 41.148 70.969 7800.866 00.800 40.946 514.20±3.40d
2.4 有机酸对热降解动力学的影响
热力学参数的估计可以为解释花色苷在辅色作用处理下的热降解动力学提供有价值的信息。ΔG代表活化态和反应物之间的差异[22],如表3所示,其值范围为59.02~65.85 kJ/mol。ΔG为正值说明花色苷降解是一种非自发反应。ΔH为正值表示活化络合物和反应物之间为吸热状态。如果ΔH值较小,则活化配合物的形成是可行的,因为势能势垒较低[22]。蒋文鸿等[23]研究发现阿魏酸、香豆酸、对香豆酸与花色苷形成配合物的容易程度依次下降。在40~80 ℃加热处理下,有机酸样品的ΔH值显著高于对照组,表明形成其他状态的共色花色苷需要克服更大的势能势垒。ΔS表示系统中分子的无序变化,ΔS值较低时物质的状态接近其自身的热力学平衡[12]。添加有机酸的蓝莓汁溶液ΔS值均明显低于对照组,表明辅色效应导致这些花色苷的分子重序,接近其自身的热力学平衡,意味着辅色后花色苷具有较高的稳定性。
表3 不同有机酸处理蓝莓汁中花色苷的热力学参数
Table 3 Thermodynamic parameters of anthocyanin in blueberry juice with different organic acids
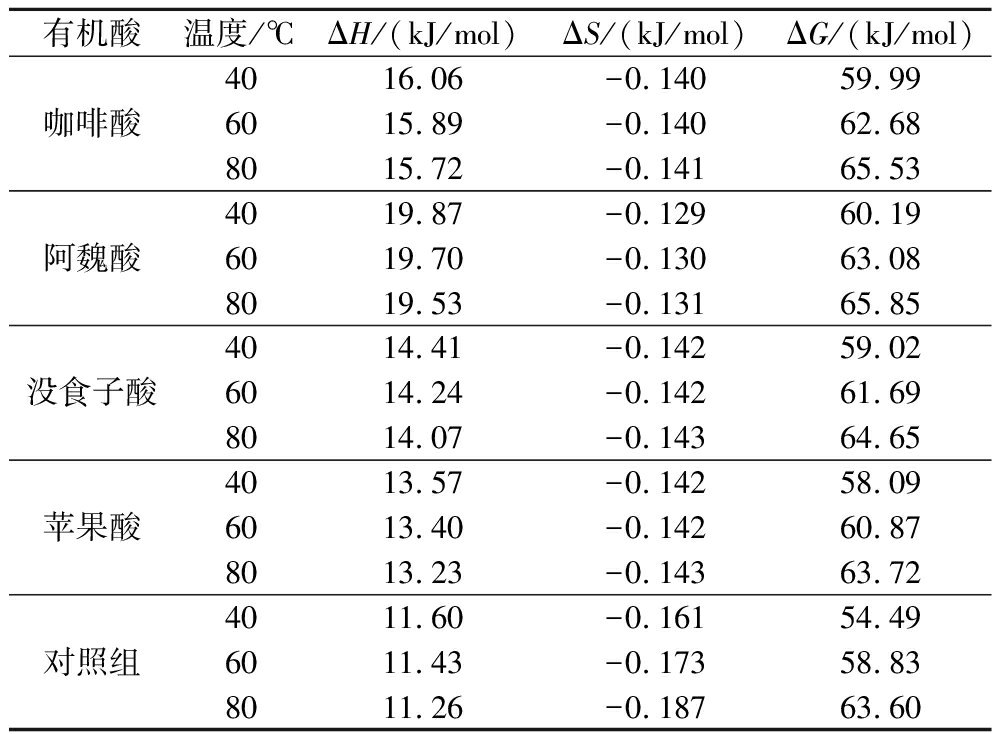
有机酸温度/℃ΔH/(kJ/mol)ΔS/(kJ/mol)ΔG/(kJ/mol)咖啡酸4016.06-0.14059.996015.89-0.14062.688015.72-0.14165.53阿魏酸4019.87-0.12960.196019.70-0.13063.088019.53-0.13165.85没食子酸4014.41-0.14259.026014.24-0.14261.698014.07-0.14364.65苹果酸4013.57-0.14258.096013.40-0.14260.878013.23-0.14363.72对照组4011.60-0.16154.496011.43-0.17358.838011.26-0.18763.60
2.5 有机酸和蓝莓花色苷加成产物的分析
FTIR法利用化合物不同基团的特征吸收分析化合物结构,是评价复合物结合方式的有效方法。如图3所示,复合物的红外光谱不同于对照组。3 336 cm-1处的强而宽的吸收带归因于—OH的拉伸振动,包括来自花色苷的酚羟基、有机酸和来自花色苷糖基的醇羟基以及水和氢键。没食子酸、咖啡酸和阿魏酸能够与花色苷形成更多的氢键。在2 972、2 881 cm-1的峰值对应于—CH3和—CH2的拉伸振动和。1 695 cm-1被认为是C![]() O拉伸振动的典型峰值,苹果酸处理组的峰值强度要明显强于其他组,这可能是因为苹果酸含有更多的羰基,1 089 cm-1处的吸收对应于弯曲振动的C—O—C基团,其吸收强度增大可能由于(蓝莓)花色苷与有机酸之间形成的氢键。1 498~965 cm-1的红外波段被称为“指纹”区域,主要对应于C—C、C—O、C—C、C—H的振动的区域。未出现新的吸收峰说明在辅色过程中,花色苷与有机酸之间没有发生化学反应。氢键和范德华力可能是花色苷辅色作用的主要驱动力[24]。
O拉伸振动的典型峰值,苹果酸处理组的峰值强度要明显强于其他组,这可能是因为苹果酸含有更多的羰基,1 089 cm-1处的吸收对应于弯曲振动的C—O—C基团,其吸收强度增大可能由于(蓝莓)花色苷与有机酸之间形成的氢键。1 498~965 cm-1的红外波段被称为“指纹”区域,主要对应于C—C、C—O、C—C、C—H的振动的区域。未出现新的吸收峰说明在辅色过程中,花色苷与有机酸之间没有发生化学反应。氢键和范德华力可能是花色苷辅色作用的主要驱动力[24]。
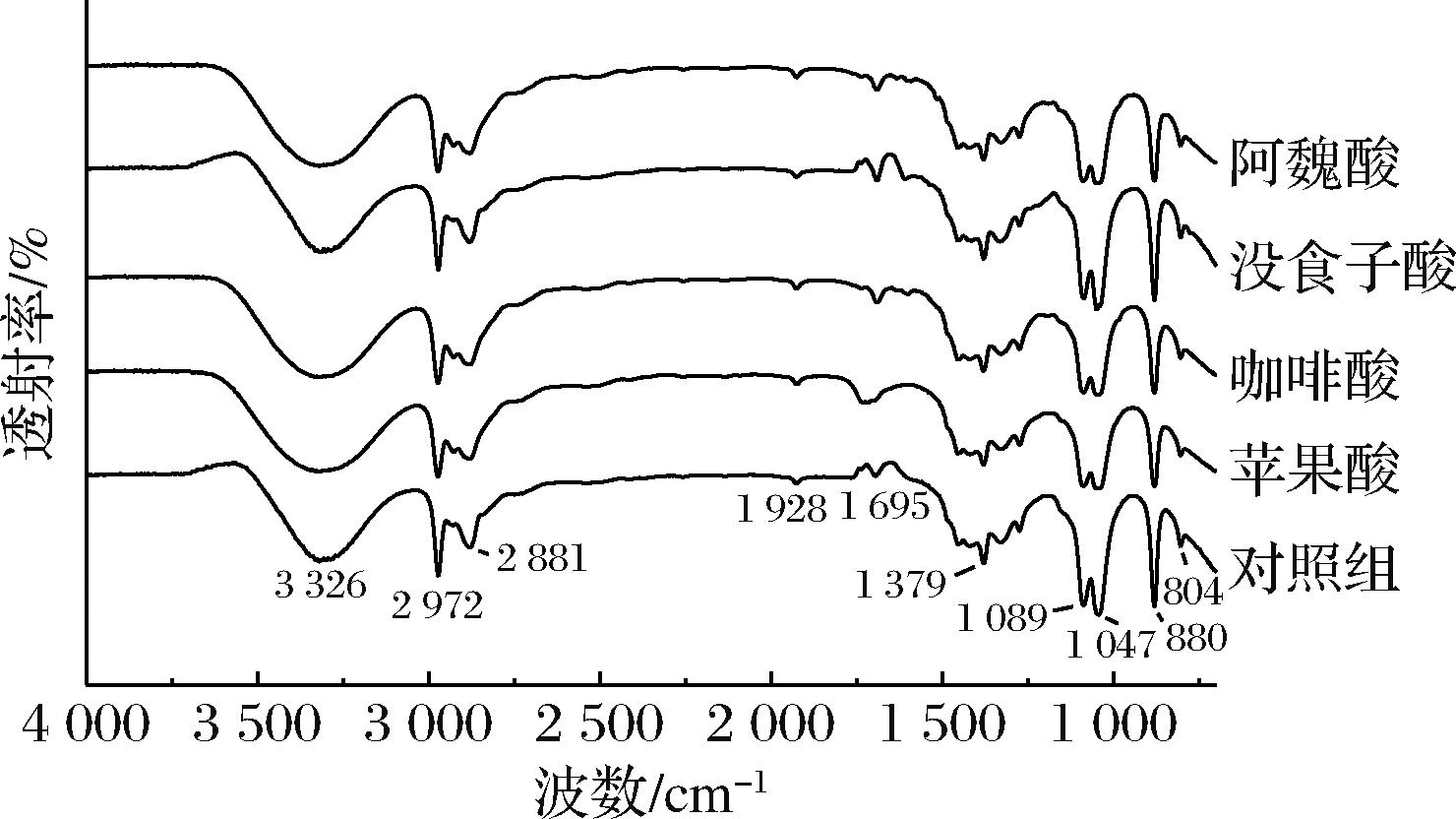
图3 不同有机酸处理样品的红外光谱图
Fig.3 Infrared spectra of samples treated with different organic acids
2.6 分子对接
通常,负亲和力能越高表明相互作用越紧密,花色苷的稳定性就越高。如表4所示,矢车菊素-3-O-葡萄糖苷与阿魏酸的复合物结构最稳定,而矢车菊素-3-O-葡萄糖苷与没食子酸的复合物结构最不稳定。分子对接构象图中,绿色代表π-π堆积相互作用力,黄色代表氢键。显然,π-π相互作用对于具有酚环的有机酸与花色苷具有重要意义,它更容易形成于阿魏酸、咖啡酸与花色苷之间。有机酸更倾向于靠近花色苷的C环上附着的葡萄糖部分,而不是A/B环平面,从而阻止了黄酮阳离子带正电荷的碳受到水分子的亲核攻击[6,25]。苹果酸分子结构中没有苯环结构,但有大量的羟基,进而能够与花色苷形成够多的氢键,提高花色苷的结构和颜色稳定性,具有较高的辅色能力。分子对接表明,辅色作用主要由氢键的形成和其他非共价相互作用驱动,阿魏酸对降低花色苷的热降解常数和延长其半衰期的效果最好,表明阿魏酸与蓝莓花色苷的组合更稳定,与实验结果一致。
表4 四种辅色剂与主要蓝莓花色苷之间的构象及结合能的分子对接
Table 4 Molecular docking simulations of conformation and binding energies between four copigments and major anthocyanins in blueberry
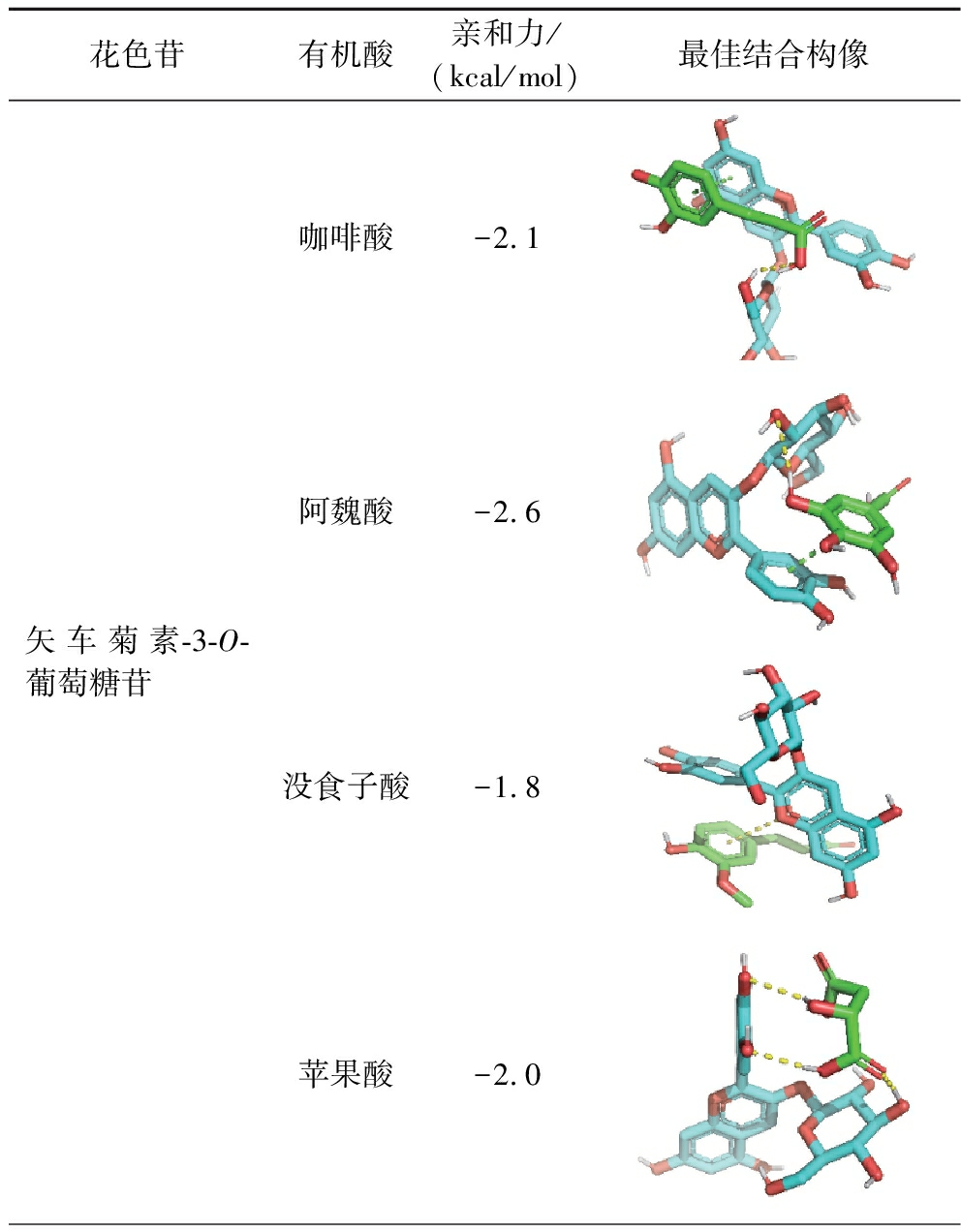
花色苷有机酸亲和力/(kcal/mol)最佳结合构像矢车菊素-3-O-葡萄糖苷咖啡酸-2.1阿魏酸-2.6没食子酸-1.8苹果酸-2.0
续表4

花色苷有机酸亲和力/(kcal/mol)最佳结合构像飞燕草素-3-O-葡萄糖苷咖啡酸-2.0阿魏酸-2.2没食子酸-1.9苹果酸-2.1矮牵牛素-3-O-葡萄糖苷咖啡酸-2.0阿魏酸-2.1没食子酸-1.9苹果酸-1.9
3 结论
本研究比较了4种有机酸对蓝莓汁花色苷的颜色及热稳定性的影响。结果表明,这些辅色剂可以增强花色苷的颜色和热稳定性,主要是通过花色苷形成复合物,提高花色苷的活化能、活化焓和失活自由能,降低花色苷的降解。其中阿魏酸在辅色作用中表现最佳,咖啡酸次之,甲氧基比羟基有更好的辅色效果。由于共轭双键的存在,羟甲基肉桂酸组比属于羟甲基苯甲酸的没食子酸的辅色效果要强。不含苯环结构的苹果酸在辅色方面表现最差。阿魏酸和咖啡酸与花色苷形成的复合物最为稳定,复合物形成的作用力主要是氢键和π-π堆积。研究结果可为多酚共色素在饮料行业用作天然功能性着色剂提供有益参考。
[1] 乌凤章, 张润梅, 尹泽宇, 等.基于主成分分析的高丛蓝莓品种果实品质综合评价[J].农业工程学报, 2022, 38(22):262-269.WU F Z, ZHANG R M, YIN Z Y, et al.Comprehensive quality evaluation of highbush blueberry cultivars based on principal component analysis[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(22):262-269.
[2] 黄金萍, 吴继红, 廖小军, 等.果蔬汁饮料中花色苷与VC相互作用研究进展[J].食品科学, 2022, 43(21):358-371.HUANG J P, WU J H, LIAO X J, et al.Recent progress in the study on the interaction between anthocyanins and vitamin C in fruit and vegetable beverages[J].Food Science, 2022, 43(21):358-371.
[3] 彭文婷, 李士鹏, 王勇, 等.黑米花色苷微胶囊的制备及其稳定性评价[J].粮油食品科技, 2024, 32(1):99-104.PENG W T, LI S P, WANG Y, et al.Preparation and stability evaluation of black rice anthocyanin microcapsules[J].Science and Technology of Cereals, Oils and Foods, 2024, 32(1):99-104.
[4] WEBER F, BOCH K, SCHIEBER A.Influence of copigmentation on the stability of spray dried anthocyanins from blackberry[J].LWT, 2017, 75:72-77.
[5] 刘霞, 邢佳雨, 冯敬雯, 等.红葡萄酒辅助呈色作用研究进展[J].中国酿造, 2023, 42(11):9-14.LIU X, XING J Y, FENG J W, et al.Research progress on copigmentation of red wine[J].China Brewing, 2023, 42(11):9-14.
[6] ZHAO X, DING B W, QIN J W, et al.Intermolecular copigmentation between five common 3-O-monoglucosidic anthocyanins and three phenolics in red wine model solutions:The influence of substituent pattern of anthocyanin B ring[J].Food Chemistry, 2020, 326:126960.
[7] 李依娜, 邹颖, 余元善, 等.不同酚酸对三华李清汁贮藏期间色泽稳定性的比较分析[J].现代食品科技, 2020, 36(7):165-172; 16.LI Y N, ZOU Y, YU Y S, et al.Comparative analysis of color stability of Sanhua plum juice during storage with different phenolic acids[J].Modern Food Science and Technology, 2020, 36(7):165-172; 16.
[8] 邵增琅, 裴少芬, 闫征, 等.茶多酚对蓝莓花色苷的辅色作用研究[J].饮料工业, 2014, 17(8):42-45.SHAO Z L, PEI S F, YAN Z, et al.Studies on copigmentation effect of tea polyphenols on blueberry anthocyanins[J].Beverage Industry, 2014, 17(8):42-45.
[9] 庞文倩, 于蕊, 李大婧, 等.紫玉米花色苷辅色配方优化及其对紫玉米品质的影响[J].食品与机械, 2024, 40(3):196-202; 216.PANG W Q, YU R, LI D J, et al.Optimization of anthocyanin copigmentation formula of purple corn and its effect on the quality of purple corn[J].Food &Machinery, 2024, 40(3):196-202; 216.
[10] TAGHAVI T, PATEL H, AKANDE O E, et al.Total anthocyanin content of strawberry and the profile changes by extraction methods and sample processing[J].Foods, 2022, 11(8):1072.
[11] LIU J N, ZHUANG Y H, HU Y H, et al.Improving the color stability and antioxidation activity of blueberry anthocyanins by enzymatic acylation with p-coumaric acid and caffeic acid[J].LWT, 2020, 130:109673.
[12] MERCALI G D, JAESCHKE D P, TESSARO I C, et al.Degradation kinetics of anthocyanins in acerola pulp:Comparison between ohmic and conventional heat treatment[J].Food Chemistry, 2013, 136(2):853-857.
[13] 谢凤英, 李凤凤, 张爽, 等.黑米花色苷酰化修饰红外光谱分析[J].光谱学与光谱分析, 2018, 38(8):2386-2389.XIE F Y, LI F F, ZHANG S, et al.Analysis of acylation modification of black rice anthocyanins using Fourier transform infrared spectroscopy(FTIR)[J].Spectroscopy and Spectral Analysis, 2018, 38(8):2386-2389.
[14] 曾丹, 邹波, 徐玉娟, 等.蓝莓成熟过程中花色苷组分的变化[J].食品工业科技, 2016, 37(23):86-90.ZENG D, ZOU B, XU Y J, et al.Changes in anthocyanin components of blueberry during ripening process[J].Science and Technology of Food Industry, 2016, 37(23):86-90.
[15] 唐柯, 倪高玉, 李记明, 等.辅色素对葡萄酒单体花色苷及颜色的影响[J].食品与发酵工业, 2019, 45(22):54-59.TANG K, NI G Y, LI J M, et al.Effect of co-pigment on monomeric anthocyanin and color of wine[J].Food and Fermentation Industries, 2019, 45(22):54-59.
[16] SUN J X, CAO X M, BAI W B, et al.Comparative analyses of copigmentation of cyanidin 3-glucoside and cyanidin 3-sophoroside from red raspberry fruits[J].Food Chemistry, 2010, 120(4):1131-1137.
[17] 高敏. 酚酸影响红肉苹果花色苷辅色效果及稳定性[J].中国果业信息, 2017, 34(3):70-71.GAO M.Phenolic acid affects the auxiliary color effect and stability of anthocyanins in red meat apples[J].China Fruits News, 2017, 34(3):70-71.
[18] 刘建国. 甲壳素纳米纤维-蓝莓花色苷纳米复合物的稳定性及抗氧化活性研究[D].沈阳:沈阳农业大学, 2020.LIU J G.Stability and antioxidant activity of chitin nanofiber-blueberry anthocyanin nanocomposites[D].Shenyang:Shenyang Agricultural University, 2020.
[19] YOU Y L, LI N, HAN X, et al.The effects of six phenolic acids and tannic acid on colour stability and the anthocyanin content of mulberry juice during refrigerated storage[J].International Journal of Food Science &Technology, 2019, 54(6):2141-2150.
[20] 梁璐, 隋勇, 黄师荣, 等.花色苷结构与呈色稳定性研究进展[J].现代食品科技, 2024, 40(6):336-346.LIANG L, SUI Y, HUANG S R, et al.Research progress on the structures and coloration stability of anthocyanins[J].Modern Food Science and Technology, 2024, 40(6):336-346.
[21] CHEN X Y, GAO Q Y, LIAO S T, et al.Co-pigmentation mechanism and thermal reaction kinetics of mulberry anthocyanins with different phenolic acids[J].Foods, 2022, 11(23):3806.
[22] AL-ZUBAIDY M M I, KHALIL R A.Kinetic and prediction studies of ascorbic acid degradation in normal and concentrate local lemon juice during storage[J].Food Chemistry, 2007, 101(1):254-259.
[23] 蒋文鸿, 张纯, 刘素稳, 等.酚酸及有机酸辅色对山楂酒贮藏期品质的影响[J].食品工业科技, 2024, 45(5):292-300.JIANG W H, ZHANG C, LIU S W, et al.Effect of phenolic acid and organic acid co-color on the quality of hawthorn wine during storage[J].Science and Technology of Food Industry, 2024, 45(5):292-300.
[24] HE Y, WEN L K, YU H S, et al.Effects of high hydrostatic pressure-assisted organic acids on the copigmentation of Vitis amurensis Rupr anthocyanins[J].Food Chemistry, 2018, 268:15-26.
[25] HUANG J Y, HU Z H, CHIN Y, et al.Improved thermal stability of Roselle anthocyanin by co-pigmented with oxalic acid:Preparation, characterization and enhancement mechanism[J].Food Chemistry, 2023, 410:135407.