新疆樱桃李(Prunus cerasifera Ehrh.)又称野酸梅,野生群落集中分布于新疆伊犁霍城的大、小西沟乡[1]。樱桃李果实营养丰富且应用广泛,现已实现规模化种植。近年来新疆果企在樱桃李深加工过程中产生了大量果皮副产物,有研究表明,其富含花色苷等生物活性成分[2]。花色苷作为水溶性类黄酮化合物,兼具抗癌、抗氧化、抗炎等药理活性[3]及天然色素特性,在功能食品开发中具有应用价值。
目前,关于樱桃李果皮花色苷的绿色提取与纯化研究尚不充分,开展相关研究,既能延伸果实加工产业链,又可推动果皮副产物的高值化利用。花色苷的提取已有多种成熟方法,如有机溶剂提取[4-5]、微波辅助提取法[6]、超声波辅助提取法[7]等,然而,现有方法多依赖酸化的甲醇/乙醇作为提取溶剂,易导致溶剂残留、环境污染及产品纯度低等问题。相比之下,酶辅助提取法因其高效性、环境友好性以及工业化潜力备受关注,近年来已在研究和应用中取得显著进展。KIM等[8]采用柠檬酸结合果胶酶的辅助提取法从桑树中提取花色苷,得率为1.24 mg/g。VIDANA等[9]系统比较了果胶酶、超声波和微波辅助热水提取对黑果枸杞花色苷提取的影响,其中果胶酶辅助提取(果胶酶1.5%、料液比1∶15、温度50 ℃、提取时间30 min)效果最佳。现有研究多聚焦于单一纯化技术(如大孔吸附树脂),很难从基质复杂的体系中获得较纯的花色苷。有研究发现,大孔吸附树脂-聚酰胺树脂联用可以使花色苷的纯度达到50%以上[10-11]。因此,本文通过构建“果胶酶辅助提取-双树脂联合纯化”体系对樱桃李果皮花色苷进行提取和纯化,借助超高效液相色谱-四级杆-飞行时间质谱(ultra-high-performance liquid chromatography with quadrupole time-of-flight mass spectrometry, UPLC-Q-TOF/MS)对纯化后的组分进行鉴定,以期为樱桃李果皮花色苷的开发利用、地区药用资源产业结构的优化提供必要的技术和物质基础。
1 材料与方法
1.1 材料与试剂
新疆樱桃李果实,采摘于新疆伊犁霍城县大西沟乡;HP2MGL大孔吸附树脂、聚酰胺树脂(60~100目)、矢车菊素-3-O-葡萄糖苷标准品(纯度≥98%,批号:25011507),北京英莱克科技发展有限公司;柠檬酸、柠檬酸钠(分析纯),山东科源生化有限公司;无水乙醇(分析纯),天津福晨化学试剂有限公司;浓盐酸、KCl、乙酸、结晶乙酸钠(分析纯),天津市北联精细化学品开发有限公司;甲醇(色谱级)、甲酸、乙腈(质谱级),赛默飞世尔科技(中国)有限公司;果胶酶(酶活力3万U/g),上海麦克林生化科技股份有限公司。
1.2 仪器
AB135-S电子天平,瑞士梅特勒公司;1000T多功能粉碎机,浙江永康市敏业工贸有限公司;HH-S6恒温水浴锅,江苏金坛市医疗仪器厂;UV-2700紫外可见分光光度计,日本岛津仪器有限公司;N-1001旋转蒸发仪,上海爱朗仪器有限公司;LGJ-10/25冷冻干燥机,北京四环福瑞科仪科技发展有限公司;ZWYR-D2402智城恒温培养振荡器,上海智城分析仪器制造有限公司;1290液相色谱-G6545四级杆-飞行时间质谱联用仪,美国Agilent公司。
1.3 实验方法
1.3.1 新疆樱桃李果皮冻干粉的制备
樱桃李果实清洗并剥皮,将果皮冷冻干燥24 h后粉碎,过60目筛网,封装后于-20 ℃冰箱中保存,备用。
1.3.2 新疆樱桃李果皮花色苷的提取
称取0.25 g的樱桃李果皮冻干粉于50 mL的具塞锥形瓶中,用柠檬酸-柠檬酸钠缓冲溶液调节pH,按照一定的料液比和果胶酶在恒温水浴锅中进行酶解反应,之后过滤,将过滤液于90 ℃水浴灭酶10 min后,冰浴冷却至室温,再转移至50 mL棕色容量瓶中,用蒸馏水定容,作为样品液。
1.3.3 总花色苷的含量测定
取1 mL样品液分别加入pH 1.0的KCl溶液和pH 4.5的醋酸钠溶液9 mL,混匀并避光静置60 min,使花色苷组分的结构在缓冲液体系中达到平衡,以蒸馏水作空白对照,分别测定样品在510 nm和700 nm处的吸光度[12]。总花色苷的含量以pH示差法按公式(1)和公式(2)计算
A=(A510-A700)pH 1.0-(A510-A700)pH 4.5
(1)
总花色苷含量![]()
(2)
式中:A,吸光度;449.2,矢车菊素-3-O-葡萄糖苷的摩尔分子质量,g/mol;10,稀释倍数;50,定容后的体积,mL;26 900,矢车菊素-3-O-葡萄糖苷的摩尔消光系数,L/(mol·cm);m,取样量,g。
1.3.4 单因素试验
按照1.3.2节的提取方法,设定单因素固定水平为果胶酶添加量0.2%、pH 3.0、提取温度40 ℃、料液比1∶40(g∶mL)、提取时间1 h。以不同的果胶酶添加量(0、0.1%、0.2%、0.3%、0.4%)、pH(2.0、3.0、4.0、5.0、6.0)、提取温度(30、40、50、60、70、80 ℃)、料液比(1∶20、1∶40、1∶60、1∶80、1∶100)及提取时间(0.5、1.0、1.5、2.0、2.5 h)为单因素的试验条件,系统探究这5个关键因素对花色苷提取量的影响规律。
1.3.5 正交试验
以单因素试验为基础,总花色苷含量为指标,设计L9正交试验,对pH、料液比、提取温度和提取时间4个因素在3个不同水平上进行考察,比较各个条件下提取的总花色苷含量大小,因素与水平见表1。
表1 正交试验因素水平表
Table 1 Orthogonal experimental factor level table

水平因素A pHB料液比(g∶mL)C温度/℃D提取时间/h12.01∶60500.523.01∶80601.034.01∶100701.5
1.3.6 大孔吸附树脂-聚酰胺树脂纯化
1.3.6.1 HP2MGL大孔吸附树脂和聚酰胺树脂的预处理
根据代文清等[10]的方法进行树脂预处理操作。
1.3.6.2 HP2MGL大孔吸附树脂纯化
参考王玮等[2]的纯化方式并加以修改,将质量浓度为3 mg/mL的花色苷粗提物以2个柱体积(bed volume, BV)/h的流速过柱,直至吸附体积为树脂体积的1/2,吸附6 h,用4 BV、pH 2.5的去离子水,以2 BV/h的流速过柱,洗去水溶性杂质,以2 mL/min的流速泵入2 BV、体积分数80%的乙醇溶液(pH 2.5)进行洗脱,根据510 nm处的吸光度变化收集洗脱液,将洗脱液在40 ℃旋转蒸发仪减压浓缩后,冷冻干燥24 h,得到花色苷冻干粉(a)。将冻干粉配制成0.5 mg/mL、pH 3.0的花色苷溶液。
1.3.6.3 上样液的pH值对聚酰胺树脂吸附的影响
在预实验的基础上,选择60~100目聚酰胺树脂用于联合HP2MGL大孔吸附树脂纯化花色苷,花色苷在聚酰胺树脂上的吸附和解吸时间根据吸附率和解吸率分别确定为3 h和4 h。取2 g聚酰胺树脂放入150 mL锥形瓶中,分别加入pH 2.0、2.5、3.0、3.5、4.0、4.5、5.0的花色苷溶液50 mL,置于摇床158 r/min吸附3 h后取1 mL上清液,树脂的吸附率按照公式(3)计算。
吸附率![]()
(3)
式中:c0,花色苷溶液的初始浓度,mol/L;c1,吸附后上清液的浓度,mol/L。
1.3.6.4 乙醇体积分数对聚酰胺树脂解吸附的影响
取2 g吸附饱和的聚酰胺树脂放入150 mL锥形瓶中,分别加入pH 2.5,体积分数10%、30%、50%、70%、90%的乙醇溶液,放置摇床中解吸附4 h后取上清液1 mL,树脂的解吸率按照公式(4)计算。
解吸率![]()
(4)
式中:c0,花色苷溶液的初始浓度,mol/L;c2,解吸后上清液的浓度,mol/L;c3,吸附饱和后上清液的浓度,mol/L。
1.3.6.5 泄露曲线和洗脱曲线的绘制
称取12 g聚酰胺树脂,湿法装入层析柱(20 mm×200 mm)中,加入0.5 mg/mL的花色苷溶液,以2.5 mL/min流过树脂,湿法上样。每1 BV收集一次流出液然后测定吸光度,绘制泄露曲线;同前湿法上样,当上样体积达到10 BV后,停止上样,使用pH 2.5体积分数50%的乙醇溶液洗脱(流速2.5 mL/min),每1 BV收集一次流出液测定吸光度,绘制洗脱曲线。将洗脱液在40 ℃旋转蒸发仪减压浓缩后,冷冻干燥24 h,得到花色苷冻干粉(b)。
1.3.7 超高效液相色谱-四级杆-飞行时间质谱(ultra-high-performance liquid chromatography with quadrupole time-of-flight mass spectrometry, UPLC-Q-TOF/MS)鉴定主要组分
准确称取适量花色苷冻干粉(b),用甲醇∶水=1∶1(体积比)配制成2 mg/mL溶液,涡旋离心取上清液后过0.22 μm有机滤膜,作为供试品溶液。同样对照品(矢车菊素-3-O-葡萄糖苷)溶液配制成200 μg/mL溶液。分别在正、负离子模式下对其化学成分进行定性分析。
色谱条件:Waters ACQUITY HSS T3 C18(2.1 mm×100 mm,1.8 μm),柱温30 ℃,流速0.4 mL/min,进样量1 μL。流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~10 min,5%~30%B;10~36 min,30%~95%B;36~38 min,95%B;38~38.1 min,95%~5%B;38.1~40 min,5%B,以上均为体积分数)。
质谱条件:Dual AJS ESI 离子源,正、负离子扫描,一级质谱扫描范围m/z 50~1 200,二级质谱扫描范围m/z 30~1 200,碎裂电压120 V,碰撞能量10、30 eV,雾化气(N2)压力35 psi,雾化气温度320 ℃,干燥气流速8 L/min,鞘气温度350 ℃,鞘气流速11 L/min,毛细管电压3 500 V。
1.4 数据处理
每组实验重复3次,结果表示为 “平均值±标准差”;绘图由Origin 2021完成;正交试验设计由正交设计助手软件II v3.1完成;通过Agilent MassHunter Qualitative Analysis 10.0软件对UPLC-Q-TOF/MS采集的原始数据进行处理与分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶的添加量对提取花色苷的影响
樱桃李果皮中含有大量果胶,使用一定量的果胶酶可以有效降解细胞壁中的果胶,促进细胞内物质的释放,提高花色苷的提取率[13]。如图1所示,提取液中总花色苷含量呈现先增加后降低的趋势,在0%~0.2%的范围内,高添加量的果胶酶会帮助花色苷的溶出,当果胶酶的添加量超过0.2%时,过量的果胶酶会破坏花色苷的结构,导致总花色苷含量下降,这与聂铭等[14]的结果相似。
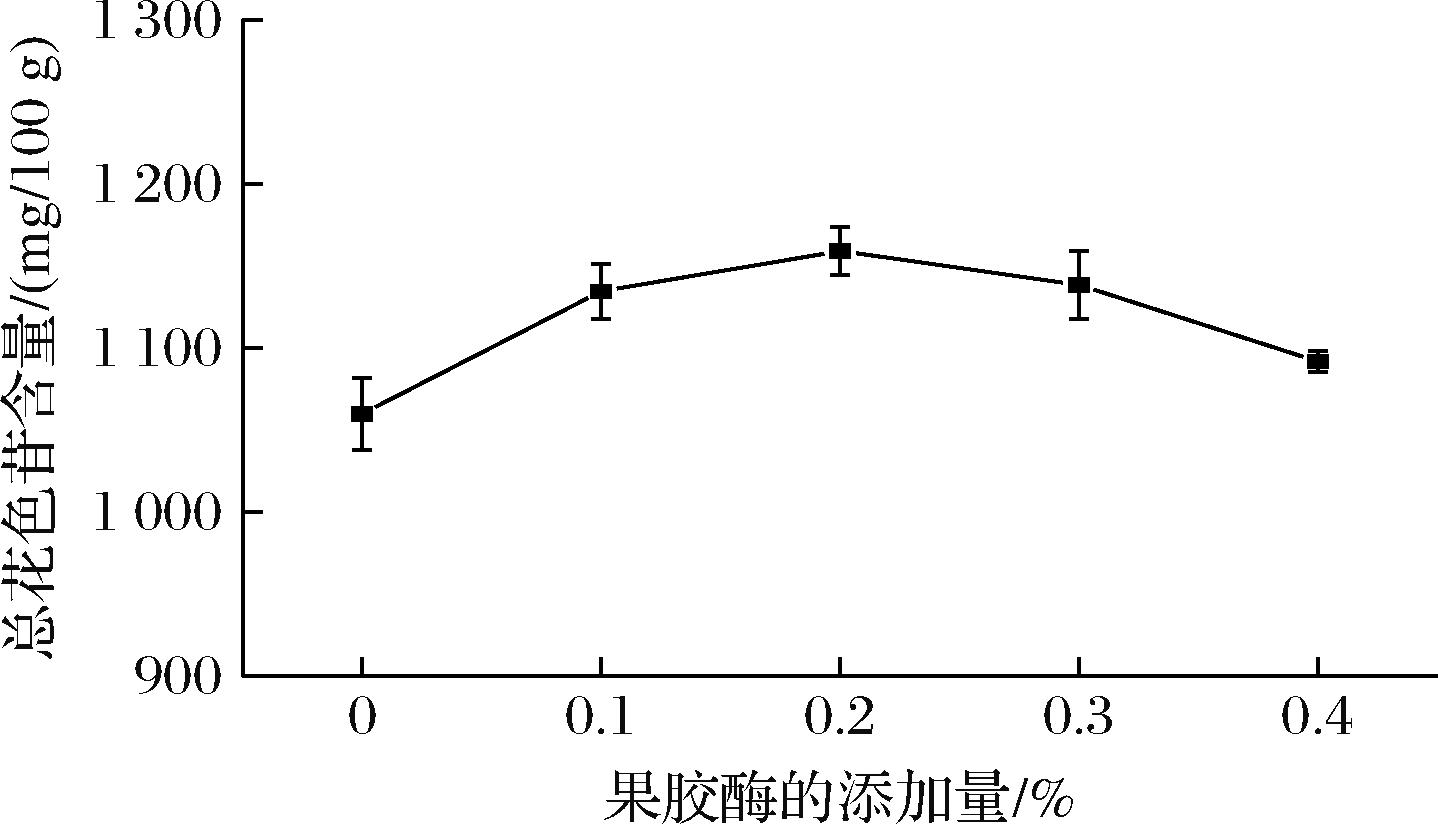
图1 果胶酶的添加量对提取花色苷的影响
Fig.1 Effect of pectinase addition on the extraction of anthocyanins
2.1.2 pH对提取花色苷的影响
在提取花色苷的过程中,适度酸化溶剂至关重要,一方面,酸化可以促进花色苷的结构向稳定的黄烊盐阳离子形式转化[15],另一方面,酸性溶剂可以破坏植物的细胞壁,增加花色苷的溶出。如图2所示,随着pH的减少,总花色苷含量在不断上升。尽管在酸性条件下有利于花色苷的溶出,但过强的酸度(pH<2.0)可能导致花色苷的糖基水解[16]。因此,为了保护花色苷结构的完整性,不再考虑降低酸度来提高花色苷的提取率。
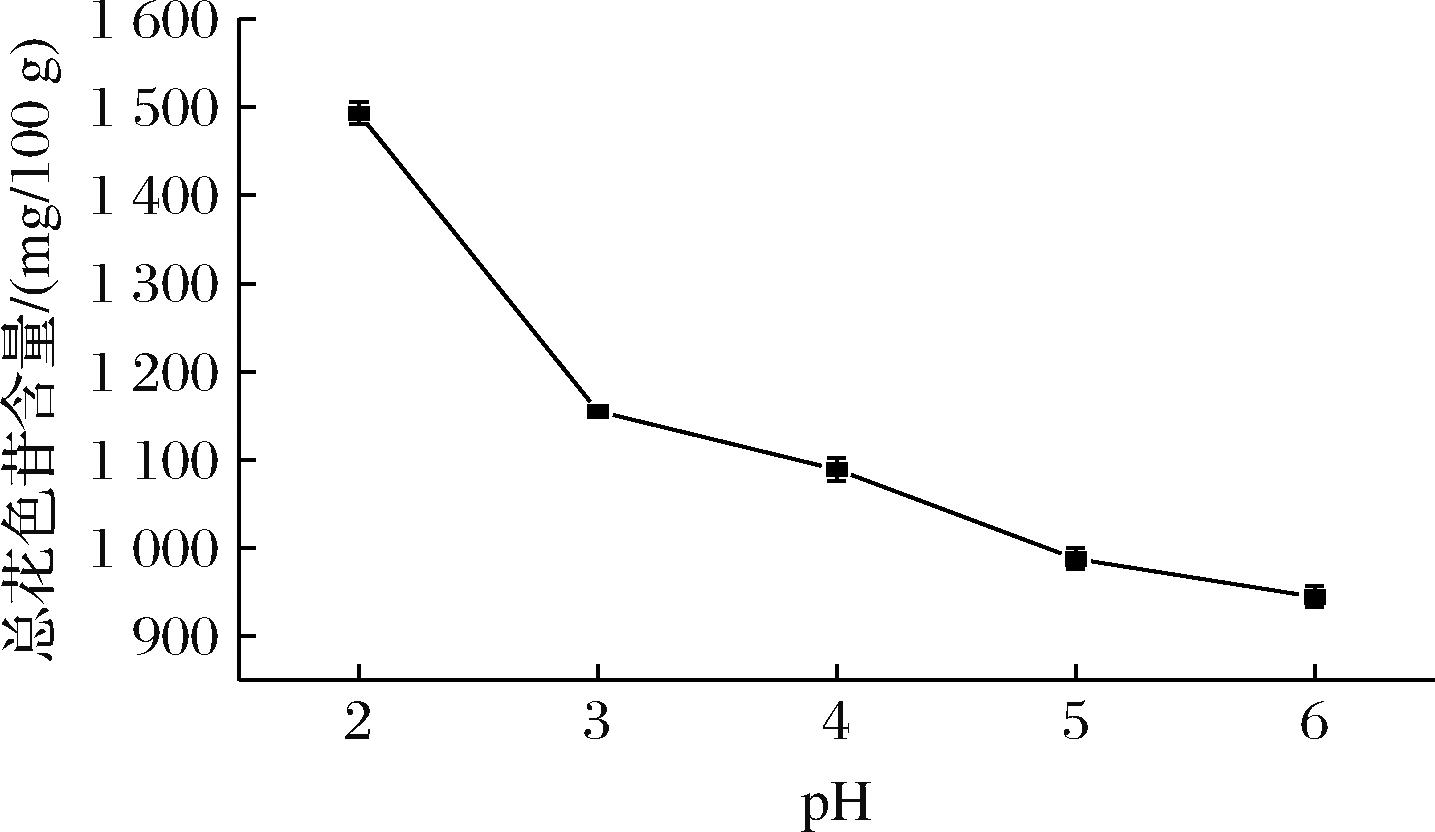
图2 pH对提取花色苷的影响
Fig.2 Effect of pH on the extraction of anthocyanins
2.1.3 料液比对提取花色苷的影响
如图3所示,随着料液比的增加,总花色苷含量在不断上升,考虑到料液比与温度和提取时间的交互关系,更大的料液比可能需要更高的温度和更多的提取时间,影响提取效率,故不再考虑提高料液比来提高花色苷的提取率。
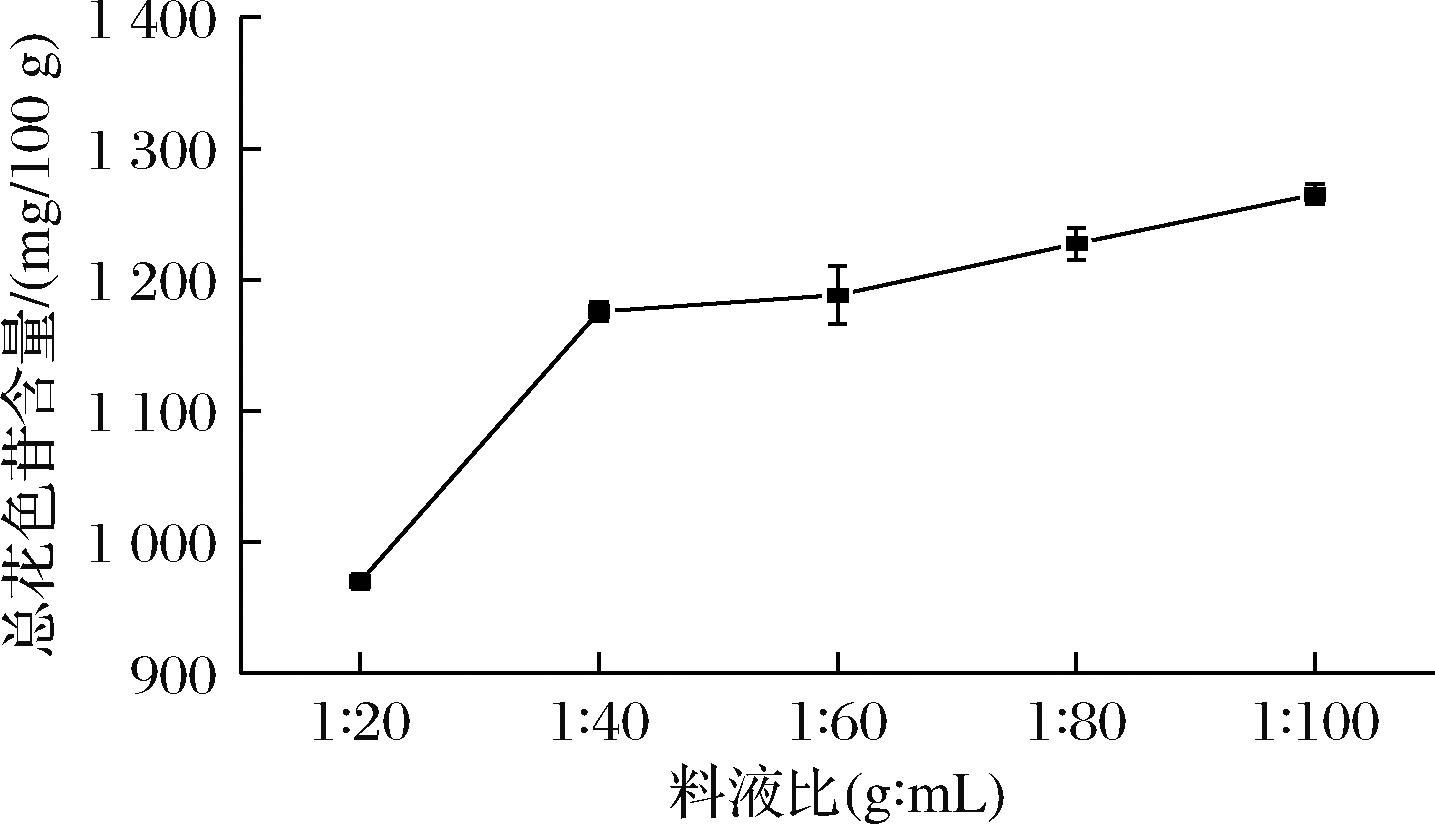
图3 料液比对提取花色苷的影响
Fig.3 Effect of solid-liquid ratio on the extraction of anthocyanins
2.1.4 温度对提取花色苷的影响
适当升高温度可以提高花色苷在溶剂中的溶解速率,同时提高果胶酶的活性,但温度过高也会导致花色苷的降解和酶的失活[9, 13]。选择合适的温度可以在实现高效酶法提取的同时避免花色苷和酶的降解。如图4所示,随着提取温度的升高,总花色苷含量呈现先增加后减少的趋势,当提取温度达到60 ℃时,总花色苷含量达到了峰值(1 388.061 mg/100 g)。
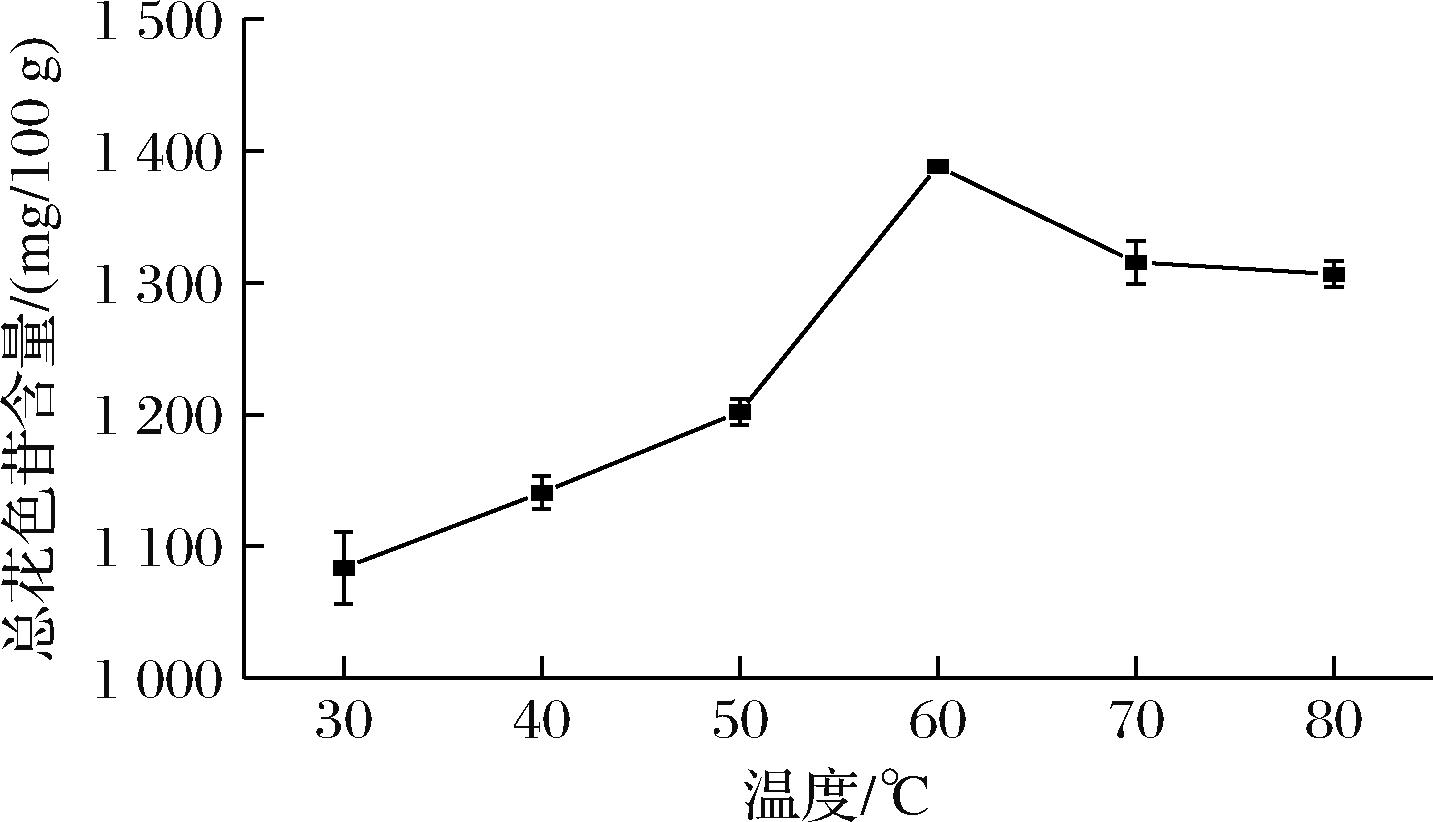
图4 温度对提取花色苷的影响
Fig.4 Effect of temperature on the extraction of anthocyanins
2.1.5 提取时间对提取花色苷的影响
如图5所示,随着提取时间的增加,在1 h时总花色苷含量达到最高(1 139.616 mg/100 g),之后开始减少。含量下降可能由于花色苷在长时间果胶酶催化或水浴加热过程中发生了降解[17]。
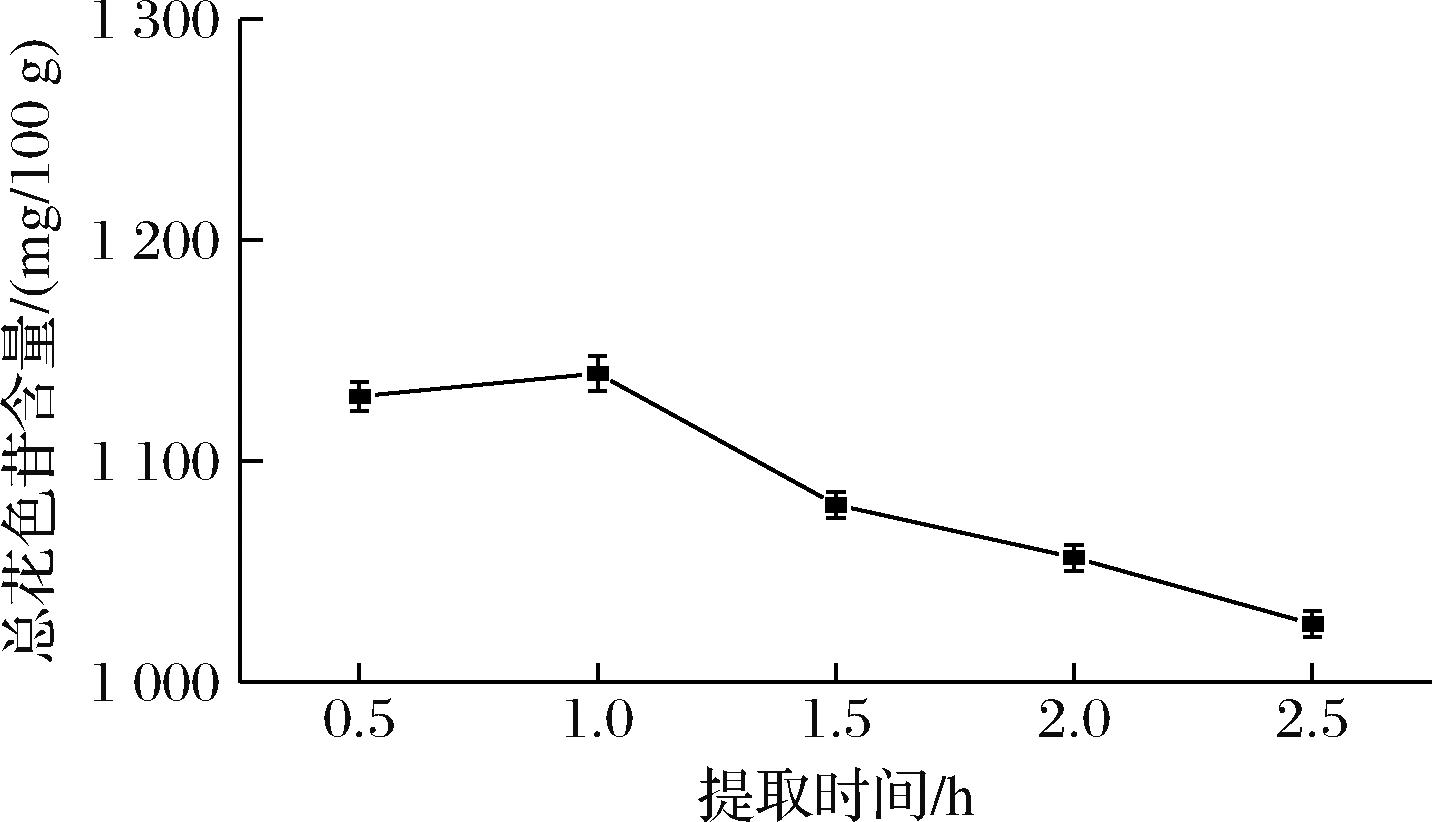
图5 提取时间对提取花色苷的影响
Fig.5 Effect of extraction time on the extraction of anthocyanins
2.2 正交试验结果及验证
正交试验结果如表2所示,由极差R的大小可知影响花色苷提取率的因素大小顺序依次为:pH>温度>提取时间>料液比,最佳工艺条件为A1B2C3D1。
表2 正交试验设计及结果
Table 2 Orthogonal experimental design and results
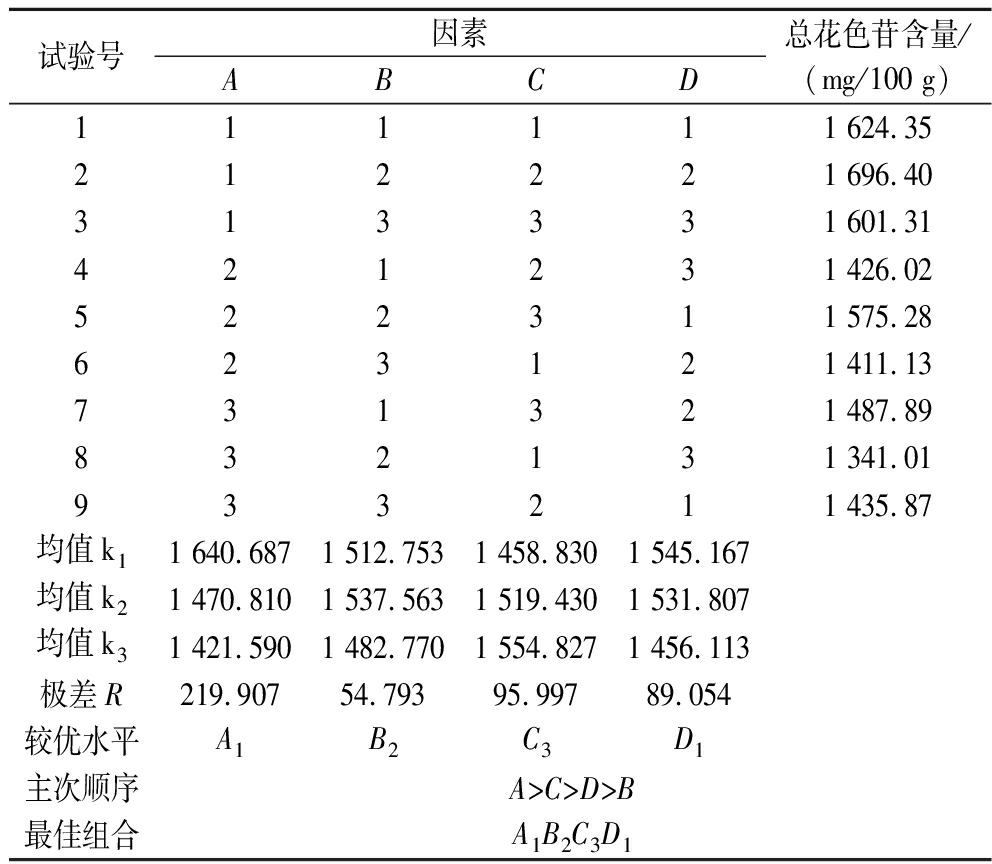
试验号因素ABCD总花色苷含量/(mg/100 g)111111 624.35212221 696.40313331 601.31421231 426.02522311 575.28623121 411.13731321 487.89832131 341.01933211 435.87均值k11 640.6871 512.7531 458.8301 545.167均值k21 470.8101 537.5631 519.4301 531.807均值k31 421.5901 482.7701 554.8271 456.113极差R219.90754.79395.99789.054较优水平A1B2C3D1主次顺序A>C>D>B最佳组合A1B2C3D1
对最佳提取工艺条件(果胶酶的添加量0.2%、pH 2.0、料液比1∶80、温度70 ℃、提取时间30 min)进行验证试验,樱桃李果皮中总花色苷的含量为(1 718.35±7.27) mg/100 g,显著高于正交试验中的结果。与之前采用有机溶剂提取法[4](体积分数1%HCl-甲醇、固液比1∶5、温度55 ℃、时间80 min、提取2次,总花色苷含量480.81 mg/100 g)相比,该工艺更加高效且环保。
2.3 大孔吸附树脂-聚酰胺树脂纯化
2.3.1 HP2MGL大孔吸附树脂纯化
按1.3.6.2节的步骤,得到花色苷冻干粉(a),总花色苷含量为27.79%,较之前文献报道的16.9%[2],有大幅提升,经修改后的方法可以有效提高花色苷的含量。
2.3.2 上样液的pH对聚酰胺树脂吸附的影响
pH可以通过改变花色苷和树脂的电荷状态及稳定性,显著影响树脂的吸附效果。如图6所示,当pH<3.0时,花色苷以黄烊盐阳离子为主,而聚酰胺树脂易发生氨基质子化(—NH2→—NH3-),形成带正电的基团,从而破坏与花色苷的氢键吸附作用,且聚酰胺在强酸的条件下不稳定,会进一步降低花色苷的吸附量;当pH>3.0时,花色苷逐渐转化为醌式碱或查耳酮等中性或负电性异构体,在溶液中呈现不同的结构[18],组分比例差异通过调控花色苷-聚酰胺树脂作用力来影响树脂的吸附率。
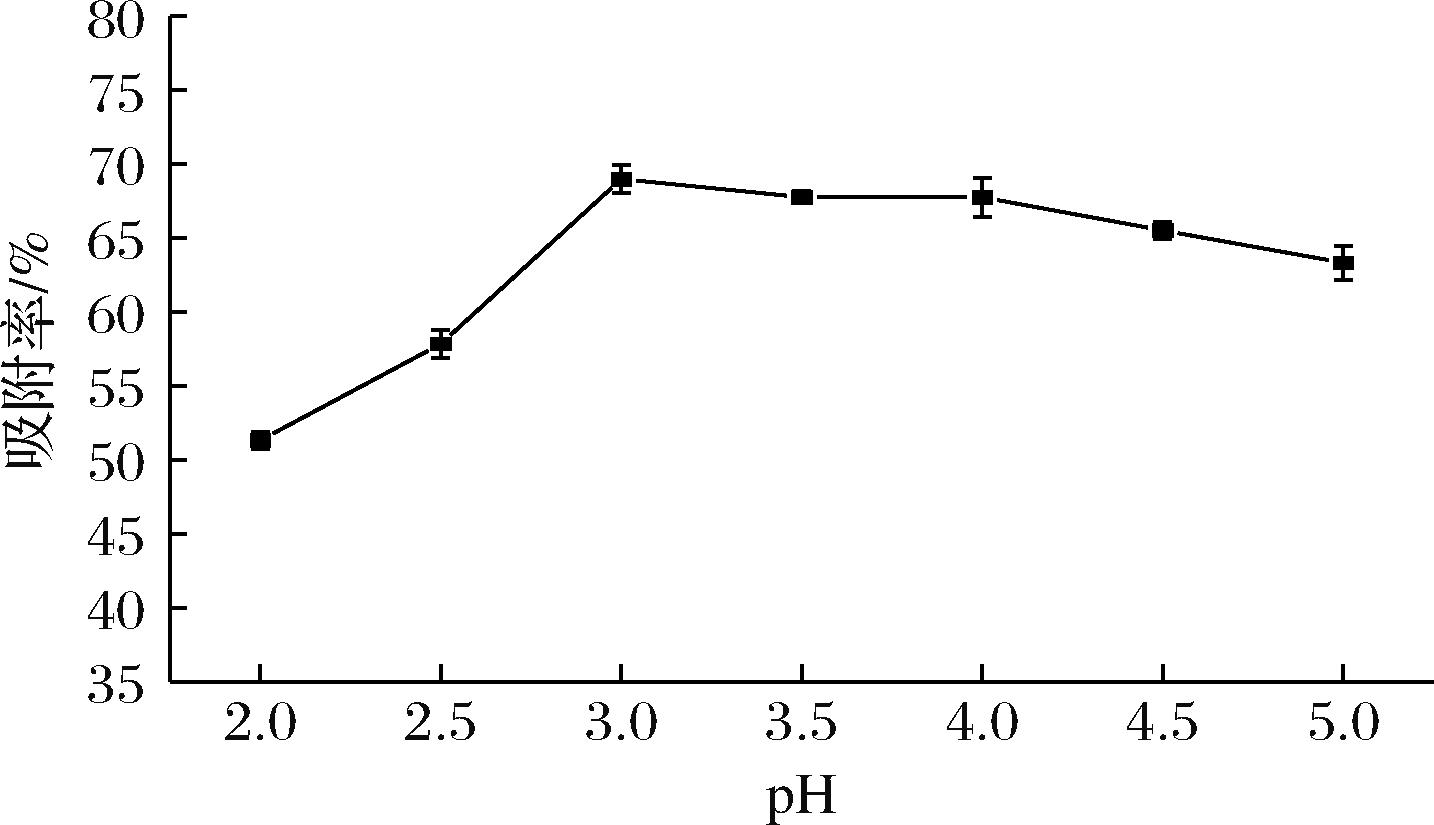
图6 上样液的pH对聚酰胺树脂吸附的影响
Fig.6 Effect of pH of the loading solution on the adsorption of polyamide resin
2.3.3 乙醇体积分数对聚酰胺树脂解吸附的影响
如图7所示,花色苷的解吸率随乙醇体积分数的增加而呈先升高后降低趋势。当乙醇体积分数从10%增加到70%时,溶液的极性降低,疏水作用增强,进而促进花色苷的解吸,当乙醇体积分数超过70%时,乙醇的极性可能不足以有效破坏聚酰胺与花色苷氢键缔合作用[19]。考虑到体积分数为50%和70%的乙醇溶液的解吸率没有显著性差异,且高浓度的乙醇洗脱液可能会洗脱下其他物质,故选择体积分数50%的乙醇溶液作为洗脱液。
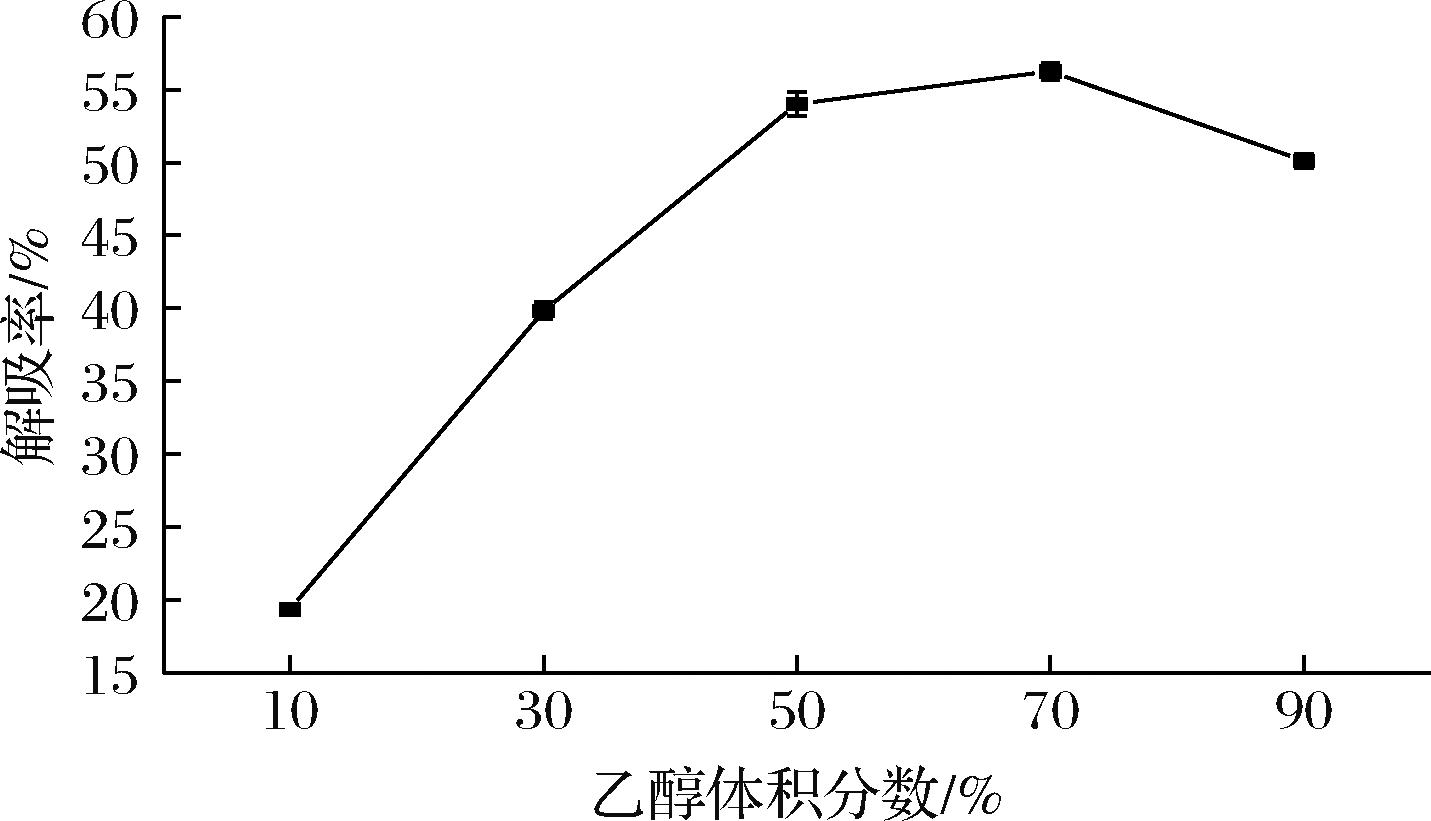
图7 乙醇体积分数对聚酰胺树脂解吸附的影响
Fig.7 Effect of alcohol by volume on the desorption of polyamide resin
2.3.4 泄露曲线与洗脱曲线
聚酰胺树脂因吸附容量有限,超载上样将导致花色苷流失(图8-a)。当上样体积增加到10 BV时,流出液吸光度达到原液的1/10,即为穿透点,表明树脂已接近吸附饱和,故建议控制上样量≤10 BV。洗脱过程显示(图8-b),2 BV时吸光度峰值出现,至3 BV时洗脱完全(吸光度趋近基线),确定最佳洗脱体积为3 BV。
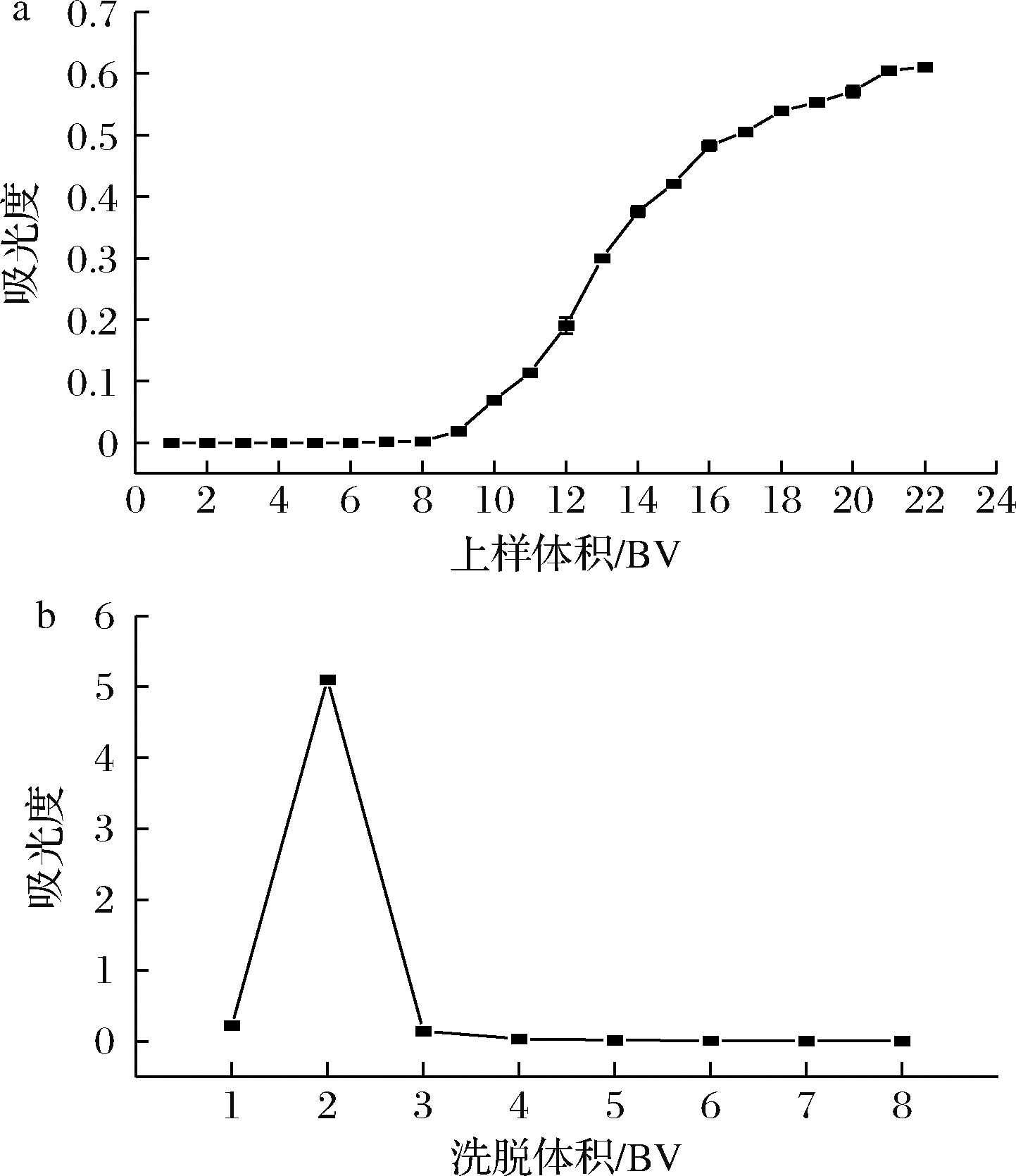
a-泄露曲线;b-洗脱曲线
图8 泄露曲线和洗脱曲线
Fig.8 Leak curves and elution curves
2.3.5 聚酰胺树脂纯化后总花色苷含量的测定
按1.3.6.5节的步骤,得到花色苷冻干粉(b),总花色苷含量为(50.72±0.91)%,表明该联合纯化策略具有一定的效果。
2.4 花色苷冻干粉主要化学成分的鉴定结果
通过检索中国知网和PubMed等数据库,收集与樱桃李相关的文献资料,并结合MassBank和PubChem等在线数据库提供的质谱信息,通过相对分子质量匹配、二级碎片离子比对,并参考花色苷类、黄酮类、酚酸类和苯丙素类化合物的特征裂解规律,共鉴定出30种化合物。样品的总离子流色谱图和化合物质谱信息表如电子版增强出版附图1和附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042853)。
2.5 各类化合物分析
2.5.1 花色苷类
花色苷由花色素苷元与糖基通过糖苷键连接构成,通常在酸性条件下以黄烊盐阳离子形式存在,因此在正离子模式下更容易被离子化,形成M+。同时在负离子模式下检测[M-2H]-或[M-2H+H2O]-离子的存在,进一步确定花色苷类成分[20]。樱桃李果皮花色苷主要以矢车菊素为主,矢车菊素在正离子模式的特征碎片离子m/z 287.05[21]在一级质谱中,准分子离子峰m/z 449.110 0[M]+,二级质谱得到m/z 287.055 7的离子是丢失1分子己糖(162 Da)的残基,化合物2经过和对照品的相对保留时间比对,确定为矢车菊素-3-O-葡糖糖苷。在反向色谱柱中,半乳糖苷的相对保留时间先于葡萄糖苷化合物[22],化合物1的质谱信息和化合物2一致,仅保留时间不同,推测为矢车菊素-3-O-半乳糖苷。同理,化合物4、5、6、8的二级质谱得到的m/z 287.05分别是丢失掉132、294、308、146、204 Da糖基的矢车菊素碎片离子[21, 23, 24]。化合物3的准分子离子峰为m/z 433.112 3[M]+,丢失162 Da糖基,产生m/z 271.060 2,是天竺葵素类花色苷的特征碎片离子[22]。化合物7的准分子离子峰为m/z 463.123 0[M]+,丢掉一分子葡萄糖后得到m/z 301.070 5,是芍药素类花色苷的特征碎片离子[25],鉴定其为芍药素-3-O-葡萄糖苷[26]。
2.5.2 黄酮类
黄酮类成分通常在负离子模式的响应信号较强,可观察到明显的准分子离子峰[M-H]-,共鉴定出10种化合物,其中化合物10、11、15、16、17、19主要都是以槲皮素或山奈酚为主要苷元与己糖、鼠李糖、芸香糖相连,在质谱分析中,这些化合物因糖苷键断裂分别丢失162、146、308 Da糖基,生成苷元碎片离子 m/z 301(槲皮素)、285(山奈酚)[27-29]。槲皮素易失去中性小分子(H2O、CO、CO2),生成m/z 283.02[M-H-H2O]-、m/z 257.04[M-H-CO2]-、m/z 273.04[M-H-CO]-,也可通过逆Diels-Alder反应生成m/z 178.99,并进一步丢失CO形成m/z 151.00,图9-a展示了金丝桃苷可能的裂解途径。化合物12、13和槲皮素的裂解方式相似,结合文献参考裂解规律[30-31],推测其为花旗松素-己糖苷和花旗松素。同理,参考裂解规律推测化合物14为野黄芩素,其可能的裂解途径如图9-b所示。
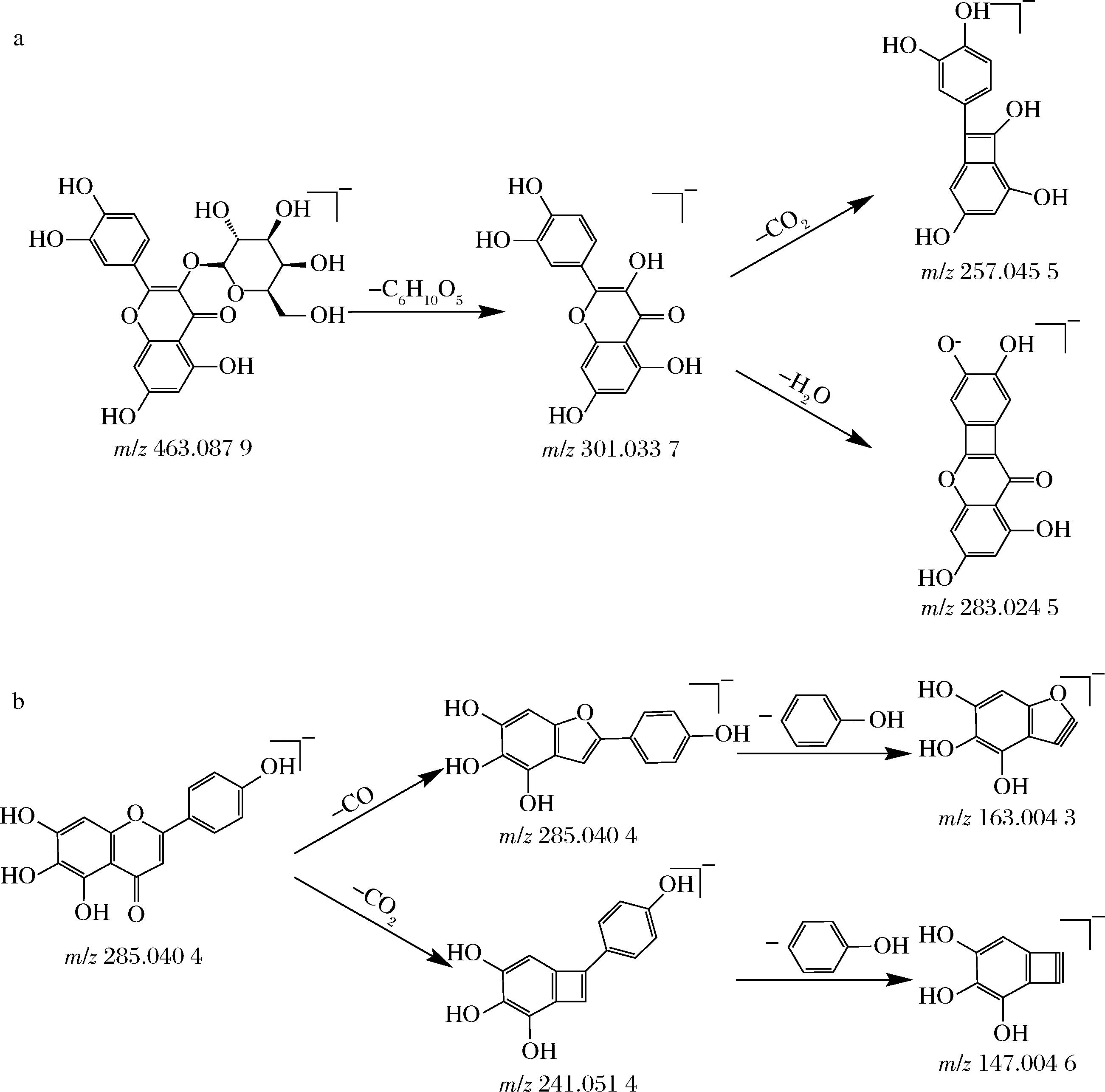
a-金丝桃苷;b-野黄芩素
图9 金丝桃苷和野黄芩素的裂解途径
Fig.9 Fragment pathways of hypericin and scutellarein
2.5.3 酚酸类
酚酸类化合物在负离子模式下易形成稳定的氧负离子,通常以[M-H]-的准分子离子峰出现,裂解方式主要为丢失CO2或H2O。共分析出4种酚酸类化合物,参考罗世博等[28]的研究推测化合物20、21、22分别是原儿茶酸葡萄糖苷、原儿茶酸和奎宁酸。图10展示了化合物23可能的裂解途径,结合公共数据库及裂解规律,推测其为2-(3,4-二羟基苯甲酰氧基)-4,6-二羟基苯乙酸。
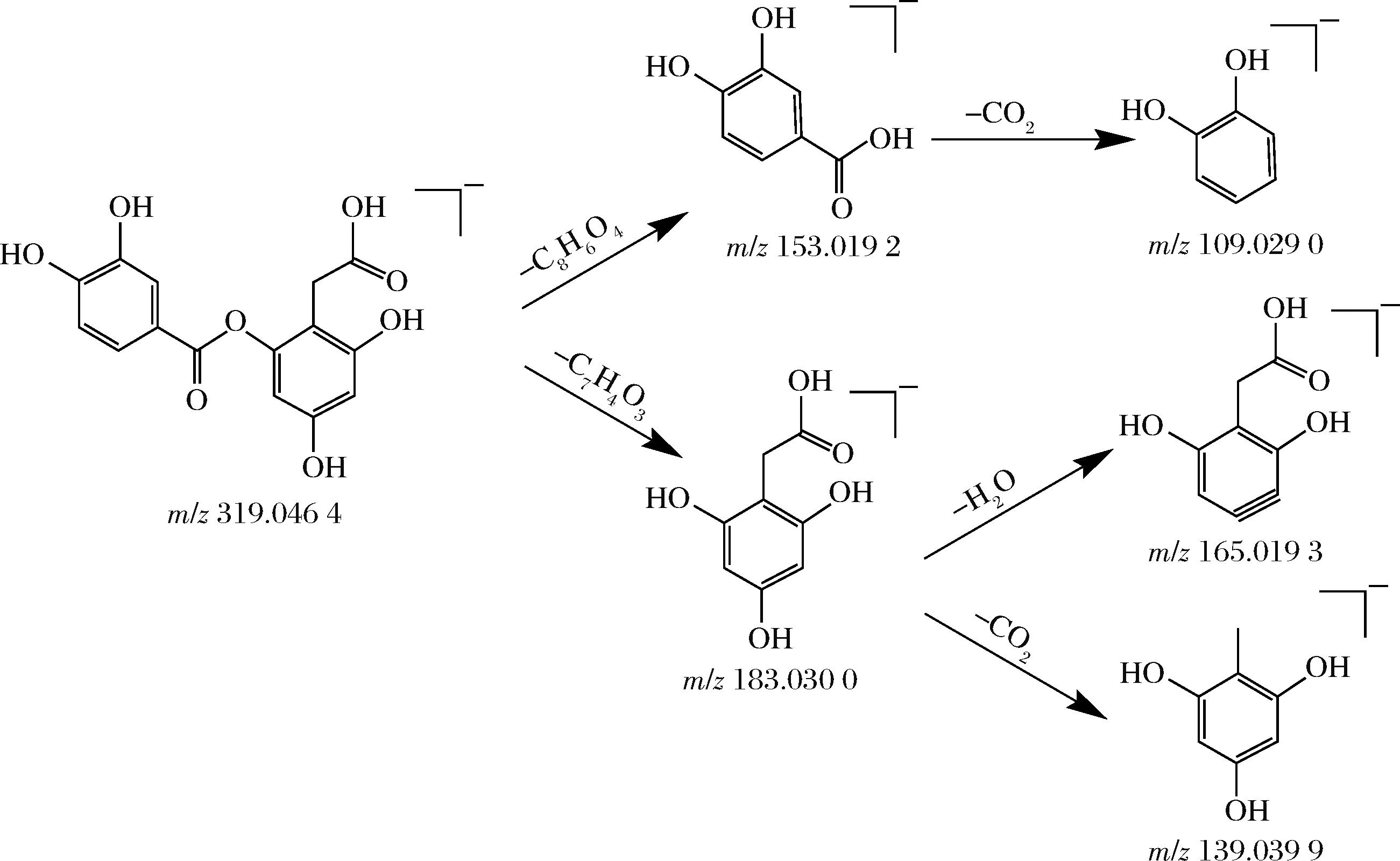
图10 2-(3,4-二羟基苯甲酰氧基)-4,6-二羟基苯乙酸的裂解途径
Fig.10 Fragment pathway of 2-(3,4-Dihydroxybenzoyloxy)-4,6-dihydroxyphenylacetic acid
2.5.4 苯丙素类
苯丙素类化合物的基本骨架由苯环和三碳侧链(C6-C3基团)组成,在负离子模式下,其质谱裂解途径主要通过脱羧、脱水、酯键断裂和苯环裂解等方式进行[32]。共鉴定出7种简单的苯丙素类化合物,主要是由咖啡酸或香豆素与奎宁酸或莽草酸通过酯键结合,由于结构中包含酯基,在负离子模式中很容易发生断裂,形成特定的离子碎片,如m/z 191.05、m/z 179.03。同时,羟基与羧基的存在也会中性丢失CO2和H2O,形成[M-H-CO2]-、[M-H-H2O]-的碎片离子。化合物24、26、27被鉴定为绿原酸体异构体[33],可通过m/z 191、173及179的相对丰度比,来区分这3种异构体[28]。化合物26由于咖啡酸连接在3位,奎宁酸部分的裂解较为明显,以m/z 191为基峰,推测为绿原酸,化合物24,m/z 179的峰占基峰的比例比化合物27高,推测化合物24和27分别是新绿原酸和隐绿原酸。基于类似裂解规律及罗世博等[28]的研究,推测化合物25、28、29、30分别为3-对香豆酰基奎宁酸、3-O-阿魏酰奎尼酸、5-O-咖啡酰莽草酸和绿原酸甲酯。图11展示了5-O-咖啡酰莽草酸和绿原酸甲酯可能的裂解途径。
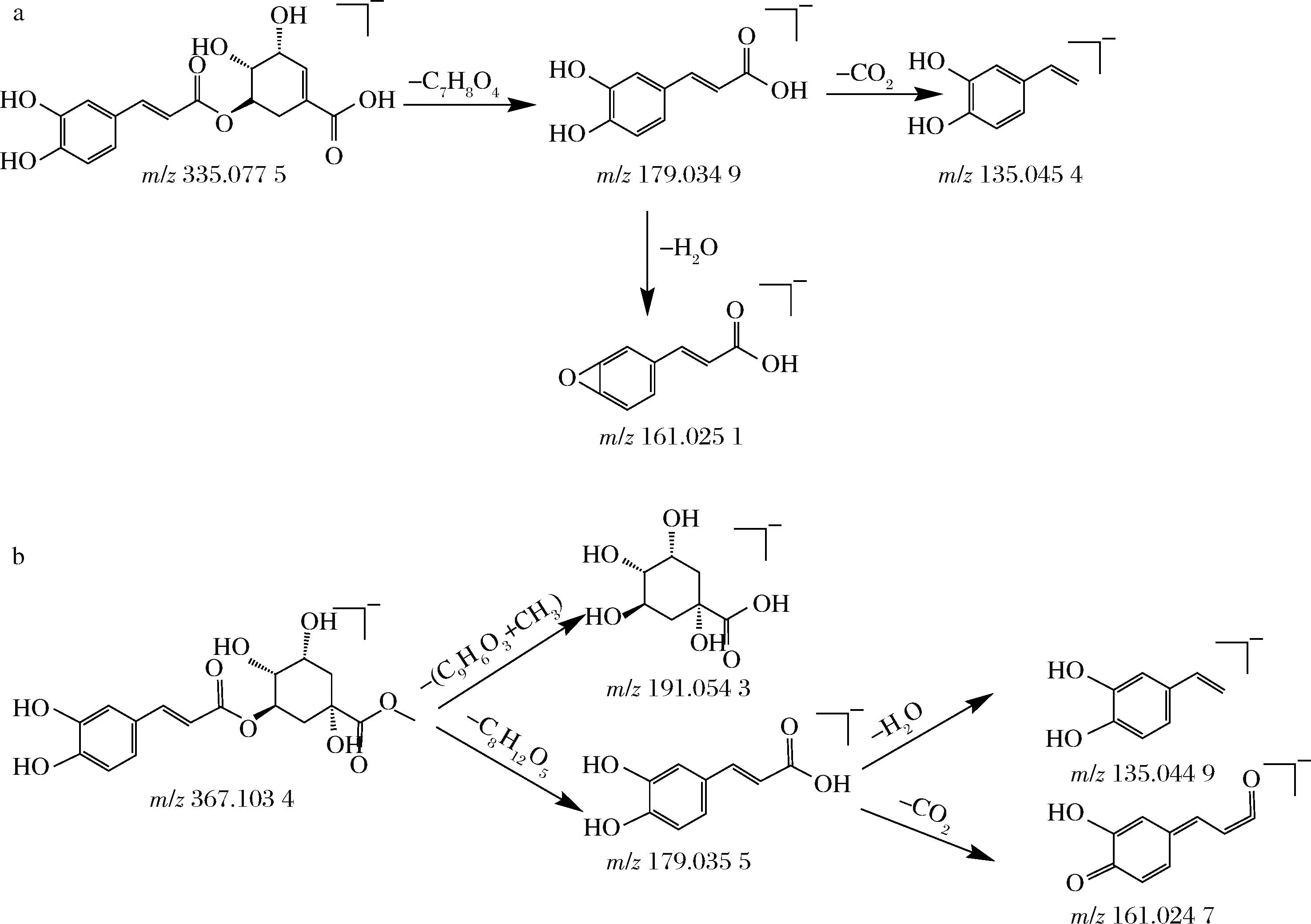
a-5-O-咖啡酰莽草酸;b-绿原酸甲酯
图11 5-O-咖啡酰莽草酸和绿原酸甲酯的裂解途径
Fig.11 Fragment pathway of 5-O-Caffeoylshikimic acid and methyl chlorogenate
3 结论
本文建立了以新疆樱桃李果皮为原料绿色制备高纯度花色苷的方法。花色苷的最佳提取工艺为:果胶酶的添加量0.2%、pH 2.0、料液比1∶80、温度70 ℃、提取时间30 min。在此条件下,总花色苷含量可达(1 718.35±7.27) mg/100 g。大孔吸附树脂-聚酰胺树脂联合纯化花色苷,其中聚酰胺树脂的纯化条件为:上样液pH 3.0、上样体积10 BV、乙醇体积分数50%、洗脱体积3 BV、流速2.5 mL/min。纯化后总花色苷含量可达(50.72±0.91)%。通过“果胶酶辅助提取-双树脂联合纯化”体系对新疆樱桃李果皮花色苷进行提取、纯化的可行性高,该体系具备大规模工业化生产的可能,可为相关产业提供有价值的实践。UPLC-Q-TOF-MS对花色苷冻干粉进行成分分析,共鉴定出30种物质,包括花色苷、黄酮、酚酸及苯丙素类物质。其中,花色苷类以矢车菊素衍生物为主;黄酮类主要是槲皮素或山奈酚苷元结合糖基化物质;酚酸类多为原儿茶酸衍生物;苯丙素类则以绿原酸为主。值得注意的是在质谱中还发现了未被文献报道过的新疆樱桃李果皮花色苷,分别是天竺葵素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷,明确樱桃李果皮花色苷的成分可以为后续药效学实验的靶向设计与机制研究提供物质基础依据。
[1] 张士康, 肖正春, 张卫明, 等.我国野生樱桃李的生态学研究[J].中国野生植物资源, 2004, (2):1-3.ZHANG S K, XIAO Z C, ZHANG W M, et al.Study on the ecology of Prunus divaricata in China[J].Chinese Wild Plant Resources, 2004, (2):1-3.
[2] 王玮, 沈静, 姚军.新疆野生樱桃李果皮中花色苷纯化工艺及体外抗氧化活性[J].食品科技, 2018, 43(2):247-252.WANG W, SHEN J, YAO J.Purification process and antioxidant activity of anthocyanins from Prunus cerasifera peel[J].Food Science and Technology, 2018, 43(2):247-252.
[3] DONG Y H, WU X, HAN L, et al.The potential roles of dietary anthocyanins in inhibiting vascular endothelial cell senescence and preventing cardiovascular diseases[J].Nutrients, 2022, 14(14):2836.
[4] 沈静, 徐楠, 姚军, 等 新疆野生樱桃李果皮中花色苷提取工艺优化及成分鉴定[J].食品安全质量检测学报, 2019, 10(19):6615-6621.SHEN J, XU N, YAO J, et al.Optimization of extraction technology and identification of anthocyanin in Prunus cerasifera from Xinjiang[J].Journal of Food Safety &Quality, 2019, 10(19):6615-6621.
[5] 连敏, 高艺玮, 年新, 等 黑果枸杞花色苷的提取、纯化及降解动力学研究[J].食品工业科技, 2024, 45(6):24-31.LIAN M, GAO Y W, NIAN X et al.Study on extraction, purification and degradation kinetics of anthocyanins from Lycium ruthenicum[J].Science and Technology of Food Industry, 2024, 45(6):24-31.
[6] LARASATI I D, CARRERA C, LIOE H N, et al.Anthocyanin extraction from roselle (Hibiscus sabdariffa L.) calyces:A microwave-assisted approach using Box-Behnken design[J].Journal of Agriculture and Food Research, 2024, 18:101480.
[7] DEVI L M, DAS A B, BADWAIK L S.Ultrasound-assisted extraction of anthocyanin from black rice bran and its encapsulation by complex coacervation[J].Food Hydrocolloids for Health, 2024, 5:100174.
[8] KIM M, NAM D G, CHOE J S, et al.Optimization of pectinase-assisted extraction condition of mulberry (Morus alba L.) fruit using response surface methodology and its effect on anthocyanin synthesis pathway-related metabolites[J].Journal of Food Science, 2021, 86(9):3926-3938.
[9] VIDANA GAMAGE G C, CHOO W S.Effect of hot water, ultrasound, microwave, and pectinase-assisted extraction of anthocyanins from black goji berry for food application[J].Heliyon, 2023, 9(3):e14426.
[10] 代文清, 张福娟, 纪秀凤, 等.大孔树脂-聚酰胺联用纯化桑葚花色苷[J].包装工程, 2021, 42(19):63-68.DAI W Q, ZHANG F J, JI X F, et al.Purification of mulberry anthocyanins by macroporous resin and polyamide[J].Packaging Engineering, 2021, 42(19):63-68.
[11] 李慧敏, 陈玲, 阳莹, 等.黑果小檗果实中锦葵素-3-O-葡萄糖苷的分离纯化及安全性研究[J].食品安全质量检测学报, 2024, 15(1):303-313.LI H M, CHEN L, YANG Y, et al.Isolation and purification of malvidin 3-O-glucoside from Berheris heteropoda Schrenk fruits and its safety studies[J].Journal of Food Safety &Quality, 2024, 15(1):303-313.
[12] 辛美丽, 梁琪, 田金龙, 等.加工及贮藏条件下蔗糖降解产物对蓝莓花色苷稳定性及抗氧化活性的影响[J].食品科学, 2024, 45(14):51-59.XIN M L, LIANG Q, TIAN J L, et al.Effects of sucrose degradation products on the stability and antioxidant activity of blueberry anthocyanins under processing and storage conditions[J].Food Science, 2024, 45(14):51-59.
[13] LIU Y X, DENG Y, YANG Y L, et al.Comparison of different drying pretreatment combined with ultrasonic-assisted enzymolysis extraction of anthocyanins from Lycium ruthenicum Murr[J].Ultrasonics Sonochemistry, 2024, 107:106933.
[14] 聂铭, 陆胜民, 王阳光, 等.响应面法优化果胶酶辅助提取杨梅花色苷工艺研究[J].食品科技, 2021, 46(7):194-200.NIE M, LU S M, WANG Y G, et al.Optimization of anthocyanins extraction assisted with pectinase from red bayberry by response surface methodology[J].Food Science and Technology, 2021, 46(7):194-200.
[15] TAO W, DE LUCA L, MATEUS N, et al.A reliable, green and fast two-step solid-phase extraction methodology for the obtention of anthocyanin-rich extracts from different sources[J].Journal of Food Composition and Analysis, 2025, 140:107232.
[16] 崔丽霞, 张志军, 李晓君, 等.紫苏花色苷纯化工艺研究[J].食品科技, 2017, 42(5):204-208.CUI L X, ZHANG Z J, LI X J, et al.Purification of anthocyanins from perilla[J].Food Science and Technology, 2017, 42(5):204-208.
[17] SWER T L, CHAUHAN K, PAUL P K, et al.Evaluation of enzyme treatment conditions on extraction of anthocyanins from Prunus nepalensis L[J].International Journal of Biological Macromolecules, 2016, 92:867-871.
[18] YANG P Q, BAS LIO N, LIAO X J, et al.Thermodynamics and kinetics of 3-deoxyanthocyanidins versus anthocyanins:What is common and different[J].Journal of Agricultural and Food Chemistry, 2025, 73(9):5605-5613.
LIO N, LIAO X J, et al.Thermodynamics and kinetics of 3-deoxyanthocyanidins versus anthocyanins:What is common and different[J].Journal of Agricultural and Food Chemistry, 2025, 73(9):5605-5613.
[19] 杨观兰, 钟朝玲, 卢连香, 等.南酸枣叶总黄酮的纯化及其抗氧化活性研究[J].食品科技, 2021, 46(8):178-183.YANG G L, ZHONG C L, LU L X, et al.Purification and antioxidant activity of flavonoids from Choerospondias axillaris leaves[J].Food Science and Technology, 2021, 46(8):178-183.
[20] SUN J H, LIN L Z, CHEN P.Study of the mass spectrometric behaviors of anthocyanins in negative ionization mode and its applications for characterization of anthocyanins and non-anthocyanin polyphenols[J].Rapid Communications in Mass Spectrometry, 2012, 26(9):1123-1133.
[21] WANG Y, CHEN X L, ZHANG Y M, et al.Antioxidant activities and major anthocyanins of Myrobalan plum (Prunus cerasifera Ehrh.)[J].Journal of Food Science, 2012, 77(4):C388-C393.
[22] 王雷, 董金旭, 王一凯, 等.基于UPLC-Orbitrap-MS/MS技术联合GNPS分子网络快速分析黑果腺肋花楸果实成分[J].质谱学报, 2024, 45(6):874-883.WANG L, DONG J X, WANG Y K, et al.Rapid identification of constituents of Aronia melanocarpa(Michx.) Elliott fruit by UPLC-Orbitrap-MS/MS and GNPS molecular network[J].Journal of Chinese Mass Spectrometry Society, 2024, 45(6):874-883.
[23] TIAN Q G, GIUSTI M M, STONER G D, et al.Screening for anthocyanins using high-performance liquid chromatography coupled to electrospray ionization tandem mass spectrometry with precursor-ion analysis, product-ion analysis, common-neutral-loss analysis, and selected reaction monitoring[J].Journal of Chromatography A, 2005, 1091(1-2):72-82.
[24] 杨杰, 王艳林, 杨迪, 等.基于UPLC-Q-TOF-MS和HPLC-DAD的三七黄酮类成分定性与定量研究[J].中国中药杂志, 2023, 48(13):3462-3471.YANG J.WANG Y L, YANG D, et al.Qualitative and quantitative study of flavonoids in Notoginseng Radix et Rhizoma based on UPLC-Q-TOF-MS and HPLC-DAD[J].China Journal of Chinese Materia Medica, 2023, 48(13):3462-3471.
[25] 贺叶风, 张春英, 刘群录.映山红花瓣花色苷成分组成分析[J].中国农业科技导报, 2021, 23(2):50-56.HE Y F, ZHANG C Y, LIU Q L.Characterization of flower coloration in petals of Rhododendron simsii[J].Journal of Agricultural Science and Technology, 2021, 23(2):50-56.
[26] YANG C, SUN N, QIN X, et al.Analysis of flavonoid metabolism of compounds in succulent fruits and leaves of three different colors of Rosaceae[J].Scientific Reports, 2024, 14:4933.
[27] 蓝艳, 王慧玉, 张晓芹, 等.基于HPLC-Q-TOF-MS/MS和HPLC-DAD的青钱柳叶化学成分的鉴定分析[J].中国药师, 2022, 25(6):966-971.LAN Y, WANG H Y, ZHANG X Q, et al.Analysis of main active components from the leaves of Cyclocarya paliurus by HPLC-Q-TOF-MS/MS and HPLC-DAD[J].China Pharmacist, 2022, 25(6):966-971.
[28] 罗世博, 刘伟, 谢星, 等.紫色野生樱桃李提取物抗氧化和降血糖活性研究及化学成分鉴定[J].食品与发酵工业, 2024, 50(19):191-200.LUO S B, LIU W, XIE X, et al.Antioxidant and hypoglycemic activities of purple Prunus cerasifera Ehrh extracts and.identification of chemical constituents[J].Food and Fermentation Industries, 2024, 50(19):191-200.
[29] TSUGAWA H, NAKABAYASHI R, MORI T, et al.A cheminformatics approach to characterize metabolomes in stable-isotope-labeled organisms[J].Nature Methods, 2019, 16(4):295-298.
[30] 李颖, 吴茵, 李倩, 等.水飞蓟素胶囊化学成分的UPLC-Q-TOF-MS快速鉴定与分析[J].中国医院药学杂志, 2017, 37(22):2259-2265.LI Y, WU Y, LI Q, et al.Quick identification and analysis of chemical constituents in silymarin capsules by UPLC-QTOF-MS[J].Chinese Journal of Hospital Pharmacy, 2017, 37(22):2259-2265.
[31] 张露, 王红红, 杨斯涵, 等.基于UPLC-QTOF-MS/MS技术分析荷叶乙酸乙酯相中主要化学成分[J].食品科学, 2019, 40(22):229-235.ZHANG L, WANG H H, YANG S H, et al.Characterization of chemical constituents in ethyl acetate fraction of lotus leaves by ultra-high performance liquid chromatography-quadrupole time-of-flight tandem mass spectrometry[J].Food Science, 2019, 40(22):229-235.
[32] MA T C, LIN J P, GAN A N, et al.Qualitative and quantitative analysis of the components in flowers of Hemerocallis citrina Baroni by UHPLC-Q-TOF-MS/MS and UHPLC-QQQ-MS/MS and evaluation of their antioxidant activities[J].Journal of Food Composition and Analysis, 2023, 120:105329.
[33] 邬旻珊, 肖观林, 谢灿辉, 等.UPLC-Q-TOF-MS/MS和UPLC-QQQ-MS/MS分析洋甘菊的化学成分[J].分析测试学报, 2024, 43(11):1803-1812.WU M S, XIAO G L, XIE C H, et al.Analysis of chemical components in chamomile using UPLC-Q-TOF-MS/MS and UPLC-QQQ-MS/MS[J].Journal of Instrumental Analysis, 2024, 43(11):1803-1812.