德庆贡柑(Deqing Gonggan Mandarin,简称GM)是广东省德庆县的传统名优农产品,被列入国家地理标志保护产品。它是一种天然杂交柑橘,集中橘类皮薄、橙类型美双重优势[1],具有肉脆化渣,清甜多汁等特点[2];贡柑果皮富含生物活性成分,包括酚酸和黄酮类化合物(以橙皮苷、川陈皮素和桔红素为主)[3-4],具有抗炎和抗氧化特性,对人类健康有益[5]。2023年德庆县贡柑产量约1.26亿斤。据报道,大约80%的柑橘被果汁行业使用,产生大量的农副产品被直接丢弃,如果皮、果籽等,占产品重量的55%,造成资源浪费和环境污染等问题[6]。因此,分析贡柑果实的酚类物质种类及含量,将德庆贡柑副产品开发成为具有高营养价值和经济吸引力的食品添加剂或补充剂具有重要意义。
酚类化合物是重要的次生代谢产物,影响水果风味和营养品质[7]。在结构上,酚类化合物可分为黄酮类和非黄酮类;反过来,黄酮类化合物的主要亚类是花青素、黄烷-3-醇、黄烷酮、黄酮、黄酮醇和异黄酮,而营养相关性的非黄酮类化合物是酚酸[8]。随着果实的成熟,茶枝柑[9]、玫瑰柑[10]果实不同部位的黄酮类化合物含量差异较大,果皮比其他部位表现出更高的抗氧化能力。酚酸是影响柑橘果实抗氧化能力的主要因素,归因于它较强的清除不同自由基的能力[11-12]。但目前,关于不同成熟期对德庆贡柑果实酚类物质及抗氧化活性的变化规律尚不清楚。
植物体内酚类化合物的合成会受到水分有效性、土壤施肥和土壤矿物质含量等环境条件的影响。特别是水果的酚类特征因栽培方式而异[13]。根据欧盟理事会的规定,有机农业遵守健康、生态、公平、关爱等基本原则,禁止使用转基因生物,禁止使用电离辐射,以及限制使用人工肥料、除草剂和杀虫剂[13]。然而,在传统种植中,农用化学品的使用量较高[14],而有机农业已被证明对环境的影响较小,有机产品中化学残留物的存在较少[15]。据报道,植物性食品的酚类成分会因农场管理制度(即有机与非有机)的不同而有所差异[16]。然而,有机与非有机贡柑果实酚类成分差异尚未见报道。
本研究采用高效液相色谱法测定不同成熟期有机与非有机贡柑果实各个部位的主要酚类成分,分析其总酚、总黄酮、抗氧化能力,探索酚类化合物与抗氧化活性的相关性,有助于了解不同成熟期有机和非有机贡柑果实各个部位的酚类成分以及抗氧化特性的动态变化规律和差异,旨在为贡柑果实的加工和应用提供科学依据。
1 材料与方法
1.1 材料与仪器
有机和非有机贡柑材料采摘于中国广东省肇庆市德庆县官圩镇五福村(北纬23.26°,东经111.80°附近)的相邻果园,所有气候参数、生产和种植系统、贡柑树龄、植物密度和土壤条件都相同。唯一区别是种植方式(常规施肥和有机施肥)。非有机的果园按照常见的农业种植进行管理,包括使用化学肥料(NPK复合肥料和唯释16-6-24),施用时间为3月和8月各1次。有机果园是获得批准的有机生产实践,未使用任何化学品。有机果园仅使用生物、机械和物理方法来控制害虫和杂草。具体实施:采用自主研发的高效有机肥(花生麸和鸭毛混合发酵液),施用时间为2月和8月各1次。防虫技术:不打农药,不喷除草剂,通过留草育草培养各类益虫,达到以虫防虫,同时通过叶面喷施有机肥,增强叶片的腊质层达到防虫的目的。在生产基地的东、南、西、北、中5个采样点各选取5株果树,从2023年9月到2024年1月每月18日选取果形均匀、大小适中、表面光滑无虫蛀的鲜果采样,共25 kg,平均每棵树1 kg。
甲醇(色谱纯),天津市彪仕奇科技发展有限公司;Al3NO3(分析纯),天津市科密欧化学试剂有限公司;NaNO2、NaOH、三氯乙酸、K2S2O8、Na2CO3、铁氰化钾、FeCl3,褔晨(天津)化学试剂有限公司;芸香柚皮苷、柚皮苷、橙皮苷、香蜂草苷、橙皮素、甜橙黄酮、川陈皮素、桔红素、芦丁、绿原酸、阿魏酸、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、DPPH、福林酚、没食子酸、ABTS,上海源叶生物科技公司。
D3024R台式高速冷冻型微量离心机,美国赛洛捷克SCILOGEX公司;UV1800紫外分光光度计、LC-20AT高效液相色谱仪,日本岛津公司;DL-800B超声波清洗器,上海之信仪器有限公司;101-A电热鼓风干燥箱,上海科恒实业发展有限公司。
1.2 实验方法
1.2.1 样品前处理
取不同成熟时期新鲜的有机(O)和非有机(N)贡柑(GM)果实分别剥皮(果皮)、去籽(果籽)、果肉榨汁(果汁)、过滤出渣(果渣)。果汁置于-20 ℃备用;将有机和非有机贡柑果皮、渣和籽分别在50 ℃下烘干至恒重,烘干后的果皮、渣和籽打成细粉,过100目筛网,重复3次,备用。
1.2.2 酚类物质含量的测定
酚类物质的提取参照左龙亚[17]的方法,称取0.1 g果皮(果渣、果籽和果汁)于10 mL离心管中。在试管中加入4 mL甲醇(体积分数为100%),涡漩振荡30 s,混合液在60 ℃下超声波提取30 min,将上清液转移到50 mL试管中,重复此步骤2次,合并上清液即为酚类物质提取液。总酚、总黄酮和单体酚含量参照朱晓婷等[11]的方法。单体酚含量的测定参数条件为:C18色谱柱(4.6 mm×250 mm,5 μm),柱温35 ℃;二极管阵列检测器(photo-diode array,PDA),检测波长280 nm,流速0.7 mL/min,进样量10 μL。流动相:体积分数为0.1%的甲酸(A),甲醇(B);梯度洗脱程序:00:01 min,A 95%,B 5%;10:00 min,A 80%,B 20%;15:00 min,A 70%,B 30%;20:00 min,A 60%,B 40%;35:00 min,A 50%,B 50%;40:00 min,A 40%,B 60%;55:00 min,A 30%,B 70%;60:00 min,A 20%,B 80%;65:00 min,A 95%,B 5%;70:00 min,A 95%,B 5%。
1.2.3 抗氧化能力的分析
使用DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力等3种方法评估抗氧化活性,以Trolox为标准品制作标准曲线,结果以Trolox当量(mg TE/g)表示。DPPH自由基清除能力的方法参照陈霖虹等[18]的方法,ABTS阳离子自由基清除能力和铁离子还原能力的方法参照朱晓婷等[11]的方法。
1.2.4 数据处理
所有试验处理进行3次重复测定,结果以“平均值±标准差”表示;数据运用Excel 2021软件汇总整理,GraphPad Prism version 10.0.0软件绘图;统计差异比较采用SPSS 26.0软件,样品间的差异显著性(P<0.05)检验采用Waller-Duncan法,用不同大小写字母表示。
2 结果分析
2.1 不同成熟期有机和非有机贡柑果实总酚和总黄酮含量的比较
如图1-a所示,有机和非有机贡柑果实各个部位的总酚含量趋势依次为果皮>果渣>果籽>果汁,说明果皮的酚类含量高于可食用部位,与GHASEMI等[19]的研究结果一致。贡柑果实在生长过程中存在显著性差异(P<0.05)。9月至次年1月,有机和非有机贡柑果皮、渣、籽和汁的总酚含量分别下降了28.93%和29.92%,40.34%和44.58%,50.08%和54.56%,31.18%和36.51%。与非有机贡柑各个部位相比,不同成熟期(9月至次年1月)有机贡柑果皮、渣、籽和汁的总酚含量分别显著提高了4.12%~8.53%,3.17%~15.55%,13.27%~44.97%和2.80%~11.80%(P<0.05)。
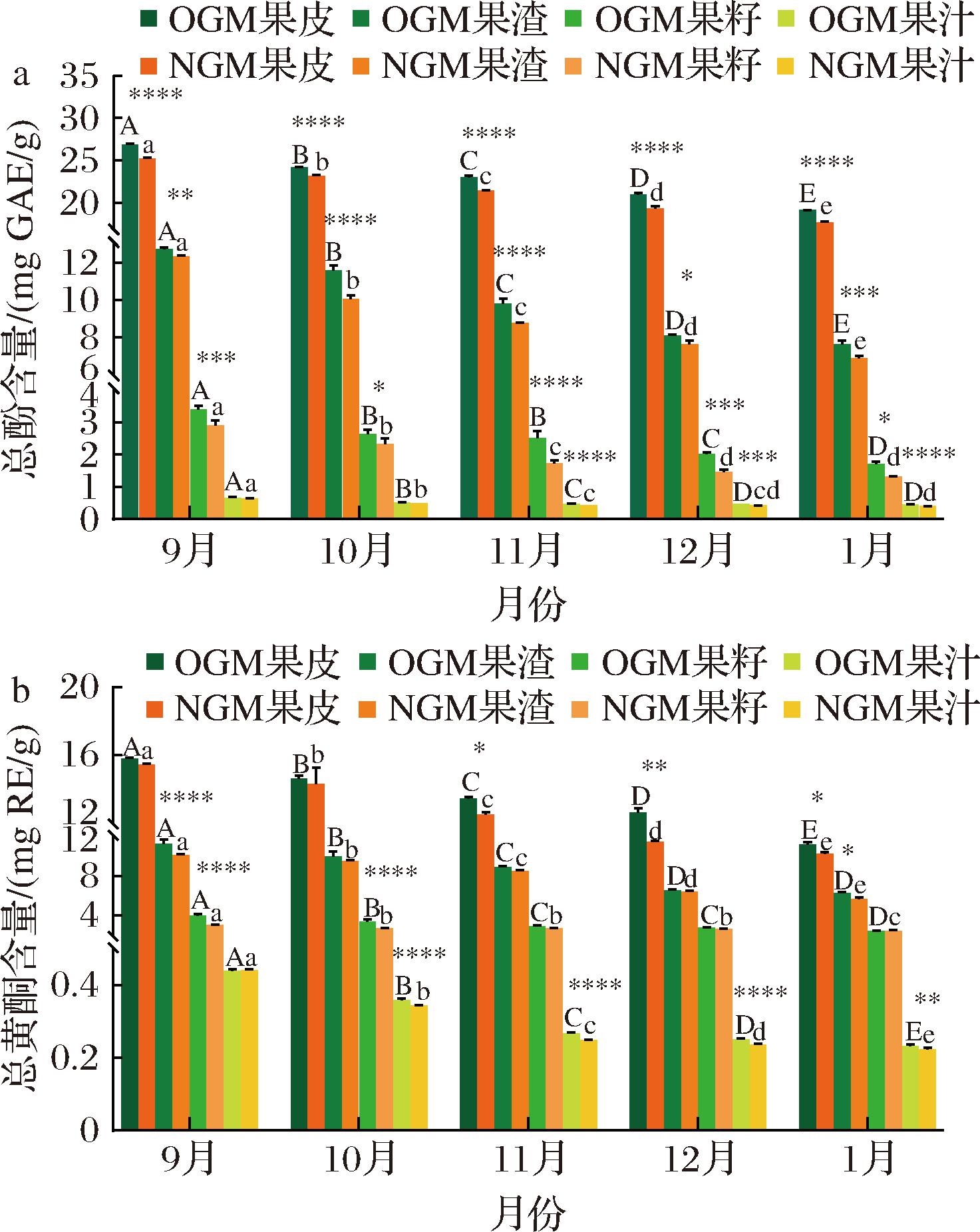
a-总酚含量;b-总黄酮含量
图1 不同成熟期有机(O)和非有机(N)贡柑果皮、果渣、果籽和果汁中总酚和总黄酮含量的比较
Fig.1 Comparison of total phenolic and total flavonoid contents in the peel, pomace, seed, and juice of OGM and NGM at different ripening stages
注:不同大写字母表示不同月份有机贡柑间存在显著性差异(P<0.05),不同小写字母表示不同月份非有机贡柑间存在显著性差异(P<0.05),*表示同一月份有机和非有机组间存在显著性差异(*P<0.05;**P<0.01;***P<0.001;****P<0.0001)(下同)。
不同成熟期有机和非有机贡柑果实各个部位的总黄酮趋势与总酚一致(图1-b),亦依次为果皮>果渣>果籽>果汁,但含量各不相同。9月至次年1月,有机和非有机贡柑果皮、渣、籽和汁的总黄酮含量分别下降了28.84%和33.25%,44.45%和44.33%,39.59%和20.33%,46.91%和49.30%。与非有机贡柑果皮和果渣相比,生长过程中(9月至次年1月)有机贡柑果皮和果渣的总黄酮含量分别提高了2.21%~9.58%和2.46%~11.19%;9~10月有机贡柑果籽的总黄酮含量显著高于非有机贡柑果籽24.22%~31.78%(P<0.05);10月至次年1月有机贡柑果汁的总黄酮含量显著高于非有机贡柑果汁4.36%~6.98%(P<0.05)。
造成不同成熟期贡柑果实酚类物质的差异,可归因于果实的不同成熟阶段[20],与金诺橙和默科特橙果皮的总酚含量随发育呈下降趋势的结果一致,可能与叶绿素的减少和花青素的积累有关[20],或将酚类物质的减少归因于多酚氧化酶的作用[21];而有机与非有机贡柑果实之间的差异主要来源于种植方式(有机施肥和常规施肥)[22]不同。有机贡柑果皮、渣、籽和汁中酚类化合物的含量均显著高于非有机贡柑,可能是由于使用的有机肥料为花生麸和鸭毛复合发酵液,营养更丰富,主要包括氮、磷、钾等大量关键元素以及有机物质和微量元素。与化学肥料相比,花生麸和鸭毛复合发酵液不仅能够提供植物生长所需的主要营养元素,还能提高土壤微生物多样性,增加土壤的肥力和改善土壤环境,从而提高肥料的肥效和作物的品质。据报道,使用有机肥料能够促进次生代谢物的生物合成,增加苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)的活性,与莽草酸途径有关[23]。莽草酸代谢途径提供了合成苯丙氨酸的前体——莽草酸。增加的莽草酸可以促进苯丙氨酸的合成,进而通过苯丙烷代谢途径增加酚酸的含量。此外,PAL是苯丙烷代谢途径的关键酶,苯丙氨酸可通过PAL的作用转化为肉桂酸,随后经过不同的酶代谢合成下游酚酸代谢产物。对香豆酰CoA作为底物时,可通过类黄酮生物合成途径经查尔酮合成酶(chalcone synthase, CHS)生物合成查尔酮,随后在查尔酮异构酶(chalcone isomerase, CHI)的催化下转化为柚皮素查尔酮,进而形成柚皮素,开启类黄酮的下游代谢产物合成,包括黄酮、黄酮醇、二氢黄酮类、异黄酮等不同的类黄酮代谢类别[24]。
2.2 不同成熟期有机和非有机贡柑果实主要单体酚含量的比较
2.2.1 不同成熟期有机和非有机贡柑果实主要酚酸成分含量的比较
对不同成熟期有机和非有机贡柑果实酚酸成分的组成和含量进行了评价。采用HPLC法共检测出3种酚酸成分,经标准品对照,分别为1种羟基苯甲酸(没食子酸)和2种羟基肉桂酸(绿原酸、阿魏酸)。如图2所示,贡柑果皮的主要酚酸为没食子酸、绿原酸和阿魏酸且含量高于其他部位,而果渣、籽和汁的主要酚酸为没食子酸和阿魏酸。绿原酸仅在果皮中检测到,且在不同成熟期有机和非有机贡柑果皮含量(349.64~868.96 μg/g和280.68~634.11 μg/g)显著高于另2种酚酸。9月至次年1月,3种酚酸含量均显著下降,在有机和非有机贡柑果皮中绿原酸含量分别下降了59.76%和55.74%(P<0.05),果皮、渣、籽和汁中没食子酸含量分别下降了60.20%和52.72%,55.44%和67.29%,79.17%和76.42%,34.12%和48.29%,阿魏酸分别下降了52.96%和47.36%、52.00%和43.04%、56.57%和73.68%、58.31%~56.24%。
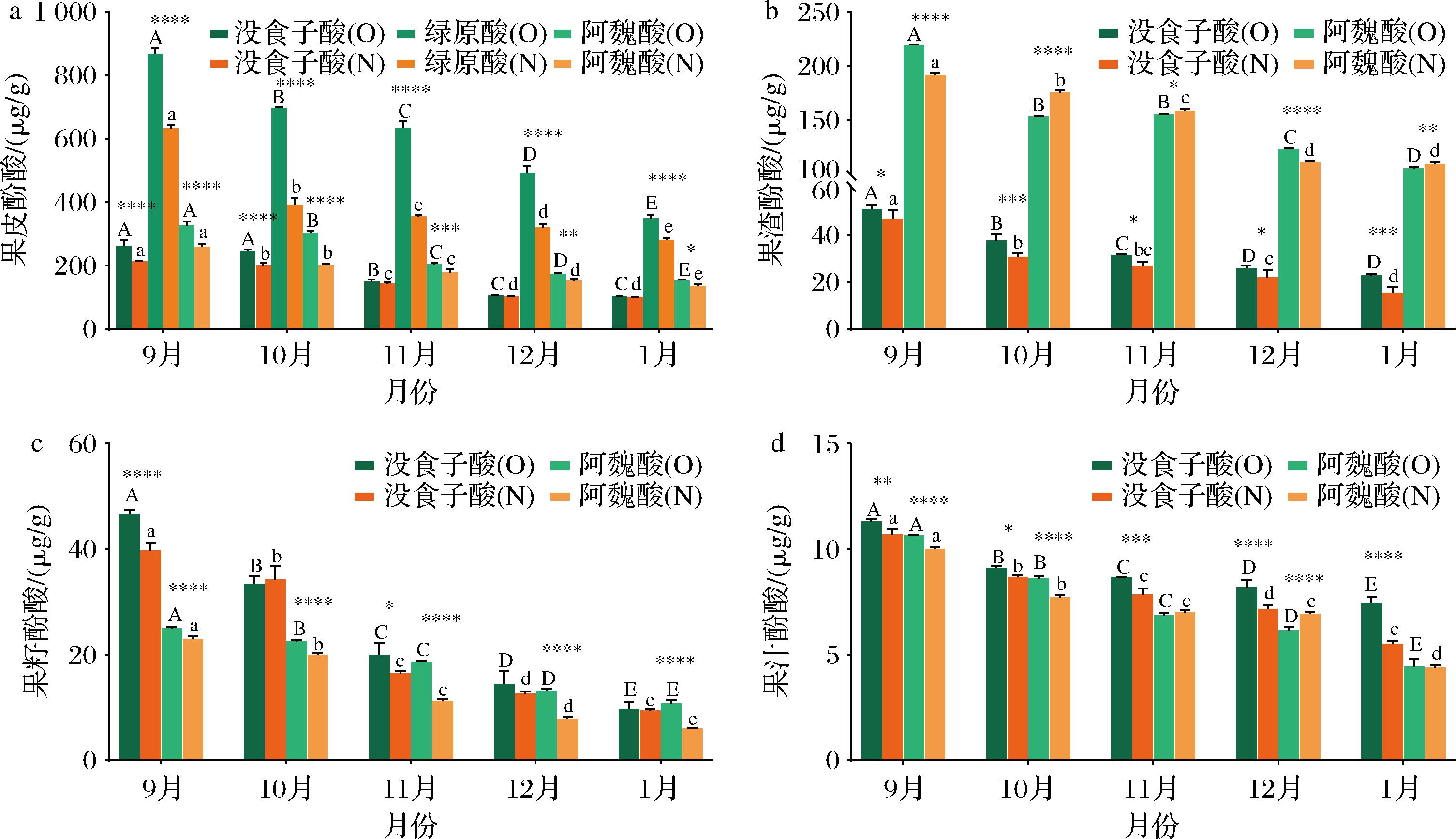
a-果皮;b-果渣;c-果籽;d-果汁
图2 不同成熟期有机(O)和非有机(N)贡柑果皮、果渣、果籽和果汁主要酚酸成分含量的比较
Fig.2 Comparison of the concentrations of major phenolic acids in the peel, pomace, seed, and juice of OGM and NGM fruits at different ripening stages
种植方式(有机施肥和常规施肥)影响了不同成熟期贡柑果实(果皮、渣、籽和汁)主要酚酸成分含量累积,导致同一月份有机和非有机贡柑果实酚酸成分间存在显著性差异(P<0.05)。与非有机贡柑果皮相比,9月至次年1月期间有机贡柑果皮中绿原酸和阿魏酸分别显著提高了24.57%~78.76%和12.60%~50.70%(P<0.05);9月至10月期间有机贡柑果皮中没食子酸显著高于非有机贡柑果皮22.27%~23.08%(P<0.05),而其他月份没食子酸在有机和非有机贡柑果皮之间无显著性差异(P>0.05)。9月至次年1月期间有机贡柑果渣中没食子酸显著高于非有机贡柑果渣8.74%~48.15%;9月和12月有机贡柑果渣中阿魏酸分别显著高于非有机贡柑果渣14.34%和10.89%(P<0.05),相反,其他月份(10月、11月和次年1月)非有机贡柑果渣中阿魏酸分别显著高于有机贡柑果渣14.18%、2.11%和3.79%(P<0.05)。9月至次年1月期间有机贡柑果籽中阿魏酸含量显著高于非有机贡柑果籽8.96%~79.79%(P<0.05);9月和11月有机贡柑果籽没食子酸显著高于非有机贡柑果籽17.50%和20.84%(P<0.05)。与非有机贡柑果汁相比,9月至次年1月期间有机贡柑果汁没食子酸含量显著提高了5.15%~35.08%(P<0.05);9月至10月期间有机贡柑果汁中阿魏酸显著高于非有机贡柑果汁6.43%~11.84%(P<0.05);反之,12月份非有机贡柑果汁中阿魏酸含量显著高于有机贡柑果汁12.70%(P<0.05)。
2.2.2 不同成熟期有机和非有机贡柑果实主要黄酮类化合物含量的比较
2.2.2.1 不同成熟期有机和非有机贡柑果皮主要黄酮类化合物含量的比较
对不同成熟期有机和非有机贡柑果皮黄酮类化合物的组成和含量进行了评价。采用HPLC法共检测出13种黄酮类化合物,经标准品对照并结合文献报道[25],鉴定为2种黄酮醇类(表儿茶素、芦丁),6种二氢黄酮类(芸香柚皮苷、柚皮苷、橙皮苷、甲基橙皮苷、香蜂草苷、橙皮素),1种异黄酮(染料木素),4种黄酮类(芹菜素、甜橙黄酮、桔红素、川陈皮素)。由图3可知,有机和非有贡柑果皮中含量最多的为橙皮苷(35.89~57.53 mg/g和33.19~53.66 mg/g),其次是川陈皮素(6.68~12.26 mg/g和5.76~10.95 mg/g)和桔红素(4.41~7.74 mg/g和3.64~6.85 mg/g)。9月至次年1月期间贡柑果皮主要黄酮化合物含量均显著下降(P<0.05),有机和非有机贡柑果皮中表儿茶素、芦丁、染料木素、橙皮苷、甲基橙皮苷、川陈皮素、桔红素、甜橙黄酮含量分别下降了59.52%和49.35%、50.17%和63.00%、4.24%和3.55%、37.62%和38.14%、8.18%和10.25%、45.56%和47.42%、42.99%和46.79%、52.49%和46.72%;而随着果实的成熟,果皮中芹菜素、芸香柚皮苷、柚皮苷、香蜂草苷、橙皮素含量稍有波动,整体呈下降趋势。
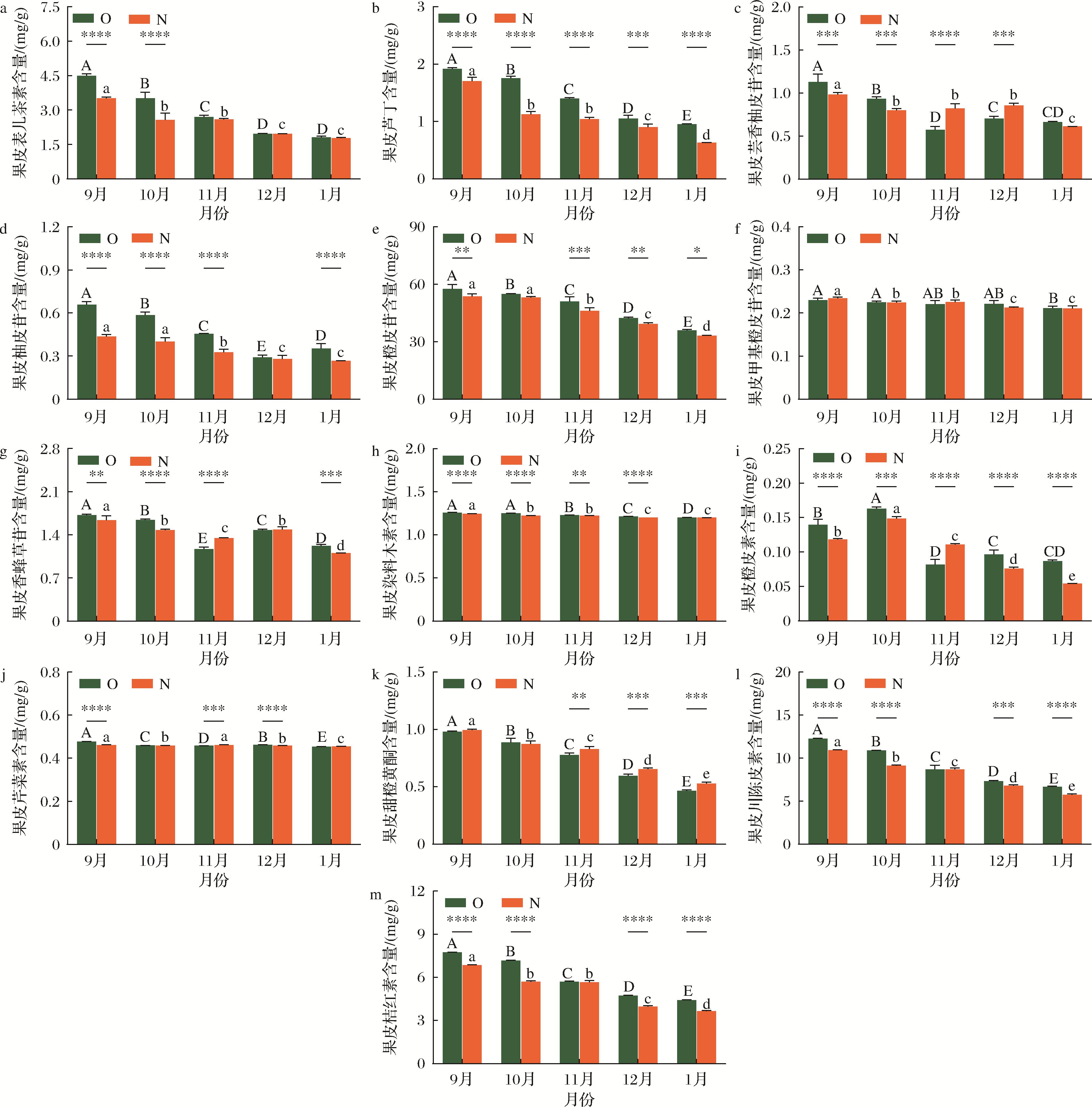
a-果皮表儿茶素;b-果皮芦丁;c-果皮芸香柚皮苷;d-果皮柚皮苷;e-果皮橙皮苷;f-果皮甲基橙皮苷;g-果皮香蜂草苷;h-果皮染料木素;i-果皮橙皮素;j-果皮芹菜素;k-果皮甜橙黄酮;l-果皮川陈皮素;m-果皮桔红素
图3 不同成熟期有机(O)和非有机(N)贡柑果皮主要黄酮类化合物含量的比较
Fig.3 Comparison of major flavonoid contents in OGM and NGM peels at different ripening stages
同一月份有机和非有机贡柑果皮中主要黄酮类化合物含量存在显著性差异(P<0.05)。与非有机贡柑果皮相比,9月至次年1月期间有机贡柑果皮表儿茶素、芦丁、染料木素、橙皮苷、柚皮苷和桔红素含量分别提高了0.56%~36.69%、12.44%~55.38%、0.24%~2.23%、3.46%~10.83%、3.89%~51.12%和0.52%~25.84%。9月份有机贡柑果皮中芸香柚皮苷、香蜂草苷、橙皮素、川陈皮素和芹菜素含量分别显著高于非有机贡柑果皮14.54%、4.79%、17.97%、12.01%和3.62%(P<0.05);10月份有机贡柑果皮中芸香柚皮苷、香蜂草苷、橙皮素和川陈皮素分别显著高于非有贡柑果皮16.52%、11.15%、9.64%和19.51%(P<0.05);而11月份有机贡柑果皮中芸香柚皮苷、香蜂草苷、橙皮素、芹菜素和甜橙黄酮分别显著低于非有机贡柑果皮30.12%、13.37%、26.08%、0.60%和6.08%(P<0.05);12月份有机贡柑果皮中橙皮素、川陈皮素和芹菜素分别显著高于非有机贡柑果皮27.05%、7.92%和0.86%,然而,芸香柚皮苷和甜橙黄酮含量分别显著低于非有机贡柑果皮17.65%和8.98%(P<0.05);次年1月份有机贡柑果皮中香蜂草苷、橙皮素和川陈皮素分别显著高于非有机贡柑果皮10.92%、60.39%和15.98%,而甜橙黄酮含量显著低于非有机贡柑果皮12.02%(P<0.05);同一生长期,仅甲基橙皮苷含量在有机和非有机贡柑果皮之间无显著性差异(P>0.05)。
2.2.2.2 不同成熟期有机和非有机贡柑果渣主要黄酮类化合物含量的比较
从不同成熟期有机和非有机贡柑果渣中共鉴定了10种黄酮类化合物(图4),分别为2种黄酮醇类(表儿茶素、芦丁),2种黄酮类(桔红素、川陈皮素),6种二氢黄酮类(芸香柚皮苷、柚皮苷、橙皮苷、甲基橙皮苷、香蜂草苷、橙皮素)。其中,橙皮苷(30.61~62.16 mg/g和29.26~52.62 mg/g)在有机和非有机贡柑果渣中含量最高,其次是香蜂草苷(2.19~4.70 mg/g和1.70~3.33 mg/g)和芸香柚皮苷(2.15~4.39 mg/g和1.54~3.18 mg/g)。9月至次年1月期间贡柑果渣主要黄酮化合物含量均显著下降(P<0.05),有机和非有机贡柑果渣中芦丁、柚皮苷、橙皮苷分别下降了7.75%和6.58%、59.49%和45.33%、50.75%和44.39%,而随着果实的成熟,果渣中表儿茶素、桔红素、川陈皮素、芸香柚皮苷、甲基橙皮苷、香蜂草苷、橙皮素含量稍有波动,整体呈下降趋势。
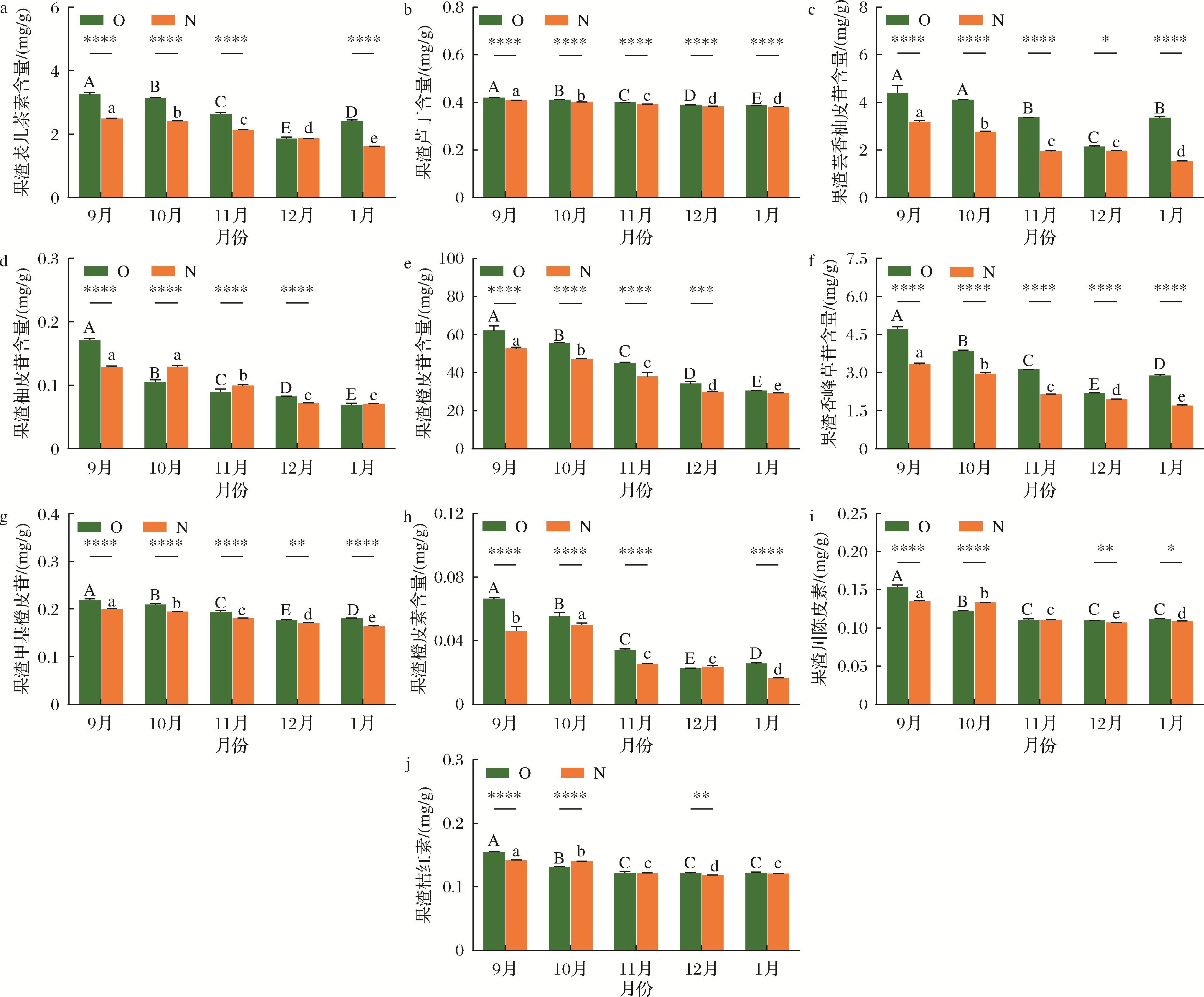
a-果渣表儿茶素;b-果渣芦丁;c-果渣芸香柚皮苷;d-果渣柚皮苷;e-果渣橙皮苷;f-果渣香蜂草苷;g-果渣甲基橙皮苷;h-果渣橙皮素;i-果渣川陈皮素;j-果渣桔红素
图4 不同成熟期有机(O)和非有机(N)贡柑果渣主要黄酮类化合物含量的比较
Fig.4 Comparison of major flavonoid contents of OGM and NGM pomace at different ripening stages

a-果籽表儿茶素;b-果籽芸香柚皮苷;c-果籽柚皮苷;d-果籽橙皮苷;e-果籽香蜂草苷;f-果籽川陈皮素;g-果籽桔红素
图5 不同成熟期有机(O)和非有机(N)贡柑果籽主要黄酮类化合物含量的比较
Fig.5 Comparison of major flavonoid contents of OGM and NGM seeds at different ripening stages
同一月份有机和非有机贡柑果渣中主要黄酮类化合物含量存在显著性差异(P<0.05)。与非有机贡柑果渣相比,9月至次年1月期间有机贡柑果渣中芦丁、芸香柚皮苷、橙皮苷、甲基橙皮苷和香蜂草苷分别提高了1.44%~2.73%、9.09%~118.08%、4.63%~18.65%、2.76%~10.17%和11.67%~69.65%。9月份有机贡柑果渣中表儿茶素、柚皮苷、橙皮素、川陈皮素和桔红素分别显著高于非有机贡柑果渣30.67%、33.15%、44.31%、14.00%和9.21%(P<0.05);10月有机贡柑果渣中表儿茶素和橙皮素分别显著高于非有机贡柑果渣30.10%和10.64%,相反的是柚皮苷、川陈皮素和桔红素分别显著低于非有机贡柑果渣18.12%、8.13%和6.44%(P<0.05);11月有机贡柑果渣中表儿茶素和橙皮素分别显著高于非有机贡柑果渣23.62%和34.61%,而柚皮苷显著低于非有机贡柑果渣9.97%(P<0.05)。12月份有机贡柑果渣中柚皮苷、川陈皮素和桔红素分别显著高于非有机贡柑果渣15.03%、2.57%和2.37%(P<0.05)。次年1月份有机贡柑果渣中表儿茶素、橙皮素和川陈皮素分别显著高于非有机贡柑果渣50.02%、56.35%和2.38%(P<0.05)。
2.2.2.3 不同成熟期有机和非有机贡柑果籽主要黄酮类化合物含量的比较
从不同成熟期有机和非有机贡柑果籽中共鉴定了7种黄酮类化合物(图5),分别为1种黄酮醇类(表儿茶素)、2种黄酮类(桔红素、川陈皮素)和4种二氢黄酮类(芸香柚皮苷、柚皮苷、橙皮苷、香蜂草苷)。其中,橙皮苷(0.54~1.74 mg/g和0.58~1.54 mg/g)在有机和非有机贡柑果籽中含量最高。9月至次年1月期间贡柑果籽主要黄酮化合物含量存在显著性差异(P<0.05),表儿茶素、芸香柚皮苷、橙皮苷、香蜂草苷含量稍有波动,整体呈下降趋势,有机和非有机贡柑果籽中川陈皮素(0.10~0.15 mg/g和0.10~0.13 mg/g)和桔红素(0.12~0.15 mg/g和0.12~0.13 mg/g)呈先升高后下降趋势。随着果实的成熟,有机和非有机贡柑果籽中柚皮苷(23.56~28.00 μg/g和22.09~28.50 μg/g)的含量变化较小。
同一月份有机和非有机贡柑果籽中主要黄酮类化合物含量存在显著性差异(P<0.05)。与非有机贡柑果籽相比,9月至次年1月期间有机贡柑果籽中表儿茶素提高了1.02%~21.96%;9月份有机贡柑果籽中芸香柚皮苷、橙皮苷和香蜂草苷含量显著高于非有机贡柑果籽24.14%、12.38%和24.04%(P<0.05),而柚皮苷、川陈皮素和桔红素显著低于非有机贡柑果籽14.93%、8.46%和7.92%(P<0.05);10月份有机贡柑果籽中芸香柚皮苷含量显著高于非有机贡柑果籽7.87%(P<0.05),而香蜂草苷、川陈皮素和桔红素含量分别显著低于非有机贡柑果籽10.10%、5.28%和3.47%(P<0.05);11月份有机贡柑果籽中柚皮苷、川陈皮素和桔红素含量分别显著高于非有机贡柑果籽12.45%、21.14%和14.58%(P<0.05),而芸香柚皮苷、橙皮苷、香蜂草苷分别显著低于非有机贡柑果籽16.80%、11.79%和16.53%(P<0.05);12月份有机贡柑果籽中芸香柚皮苷、橙皮苷、香蜂草苷、川陈皮素和桔红素含量分别显著高于非有机贡柑果籽95.48%、51.67%、69.60%、1.50%和0.88%(P<0.05)。次年1月份有机贡柑果籽中芸香柚皮苷、川陈皮素和桔红素分别显著高于非有机贡柑果籽15.15%、2.19%和2.35%(P<0.05),而有机贡柑果籽中橙皮苷和香蜂草苷分别显著低于非有机贡柑果籽6.50%和12.80%(P<0.05)。
2.2.2.4 不同成熟期有机和非有机贡柑果汁主要黄酮类化合物含量的比较
从不同成熟期有机和非有机贡柑果籽中共鉴定了4种黄酮类化合物(图6),分别为1种黄酮醇类(表儿茶素)和3种二氢黄酮类(芸香柚皮苷、橙皮苷、香蜂草苷)。其中,橙皮苷(1.22~2.20 mg/g和1.16~1.62 mg/g)在有机和非有机贡柑果籽中含量最高。9月至次年1月期间贡柑果汁主要黄酮化合物含量存在显著性差异(P<0.05),有机和非有机贡柑果汁中橙皮苷含量分别下降了44.74%和28.24%,表儿茶素(0.22~0.43 mg/g和0.21~0.35 mg/g)、芸香柚皮苷(0.08~0.17 mg/g和0.08~0.17 mg/g)以及有机贡柑果汁中香蜂草苷(0.08~0.14 mg/g)含量整体呈下降趋势。这些化合物在9至10月份含量相对较高,反之在11月至次年1月期间含量较低且相对稳定;而非有机贡柑果汁中香蜂草苷(0.06~0.09 mg/g)含量波动较小,在生长过程中呈先下降后上升的趋势。
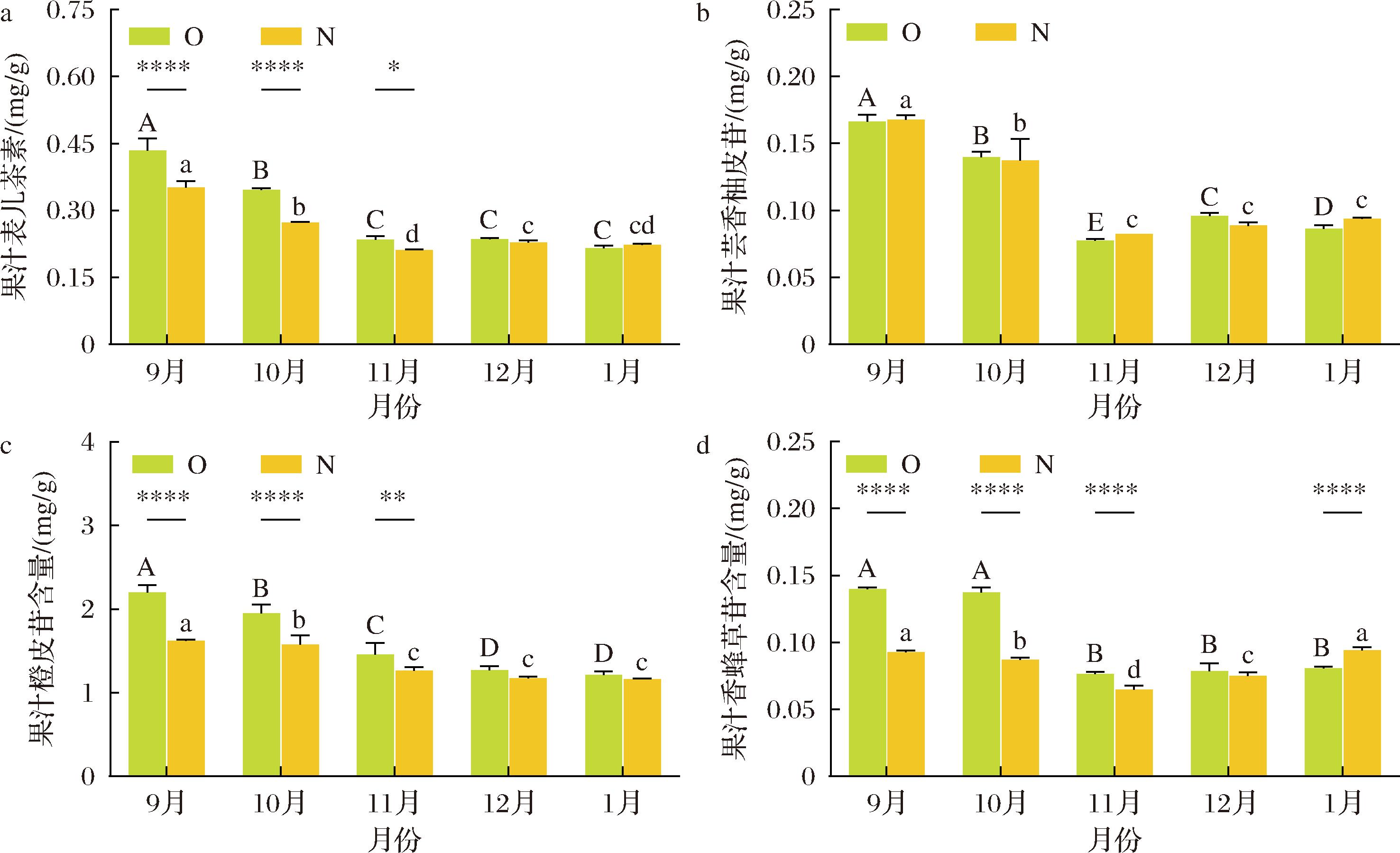
a-果汁表儿茶素;b-果汁芸香柚皮苷;c-果汁橙皮苷;d-果汁香蜂草苷
图6 不同成熟期有机(O)和非有机(N)贡柑果汁主要黄酮类化合物含量的比较
Fig.6 Comparison of the major flavonoid contents in OGM and NGM juices at different ripening stages
同一月份有机和非有机贡柑果汁中主要黄酮类化合物含量存在显著性差异(P<0.05)。与非有机贡柑果汁相比,9月至次年1月期间有机贡柑果汁橙皮苷降低了4.46%~35.65%。9至11月份期间有机贡柑果汁中表儿茶素和香蜂草苷分别显著高于非有机贡柑果汁10.47%~26.69%和17.90%~58.05%(P<0.05);次年1月份有机贡柑果汁中香蜂草苷显著低于非有机贡柑果汁14.25%(P<0.05)。
2.3 不同成熟期有机和非有机贡柑果实抗氧化能力分析
化学抗氧化活性测定法已被广泛用于评估柑橘样品的抗氧化活性,其机理主要基于评估反应过程中的氢原子转移和电子转移[26]。而柑橘果实的酚酸和黄酮参与提供质子或电子以稳定自由基[27],从而终止自由基链式反应,这有助于防止或延缓由氧化应激引起的生物分子损伤。因此,这些方法在评估柑橘样品的抗氧化活性方面具有重要作用。不同成熟期间,贡柑果实各个部位的DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力含量趋势均依次为果皮>果渣>果籽>果汁,说明果皮的抗氧化活性明显高于果实的可食用部位,与GORINSTEIN等[28]的研究结果一致。由图7所示,从9月份至次年1月份,贡柑果皮、渣、籽和汁的DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力值均呈下降趋势且存在显著性差异(P<0.05);有机和非有机贡柑果皮、渣、籽和汁中DPPH自由基清除能力的下降率分别为32.71%和22.04%、29.73和33.87%、22.76%和23.98%、20.57%和37.84%;有机和非有机贡柑果皮、渣、籽和汁中ABTS阳离子自由基清除能力的下降率分别为39.00%和42.99%、12.13%和17.21%、24.04%和27.24%、32.95%和35.59%;有机和非有机贡柑果皮、渣、籽和汁中铁离子还原能力的下降率分别为25.03%和25.35%、30.77%和24.39%、16.25%和15.13%、24.91%和29.05%。研究表明,随着果实成熟度的增加,柑橘果皮、渣和汁的抗氧化活性逐渐降低,与本文结果一致[9-10]。
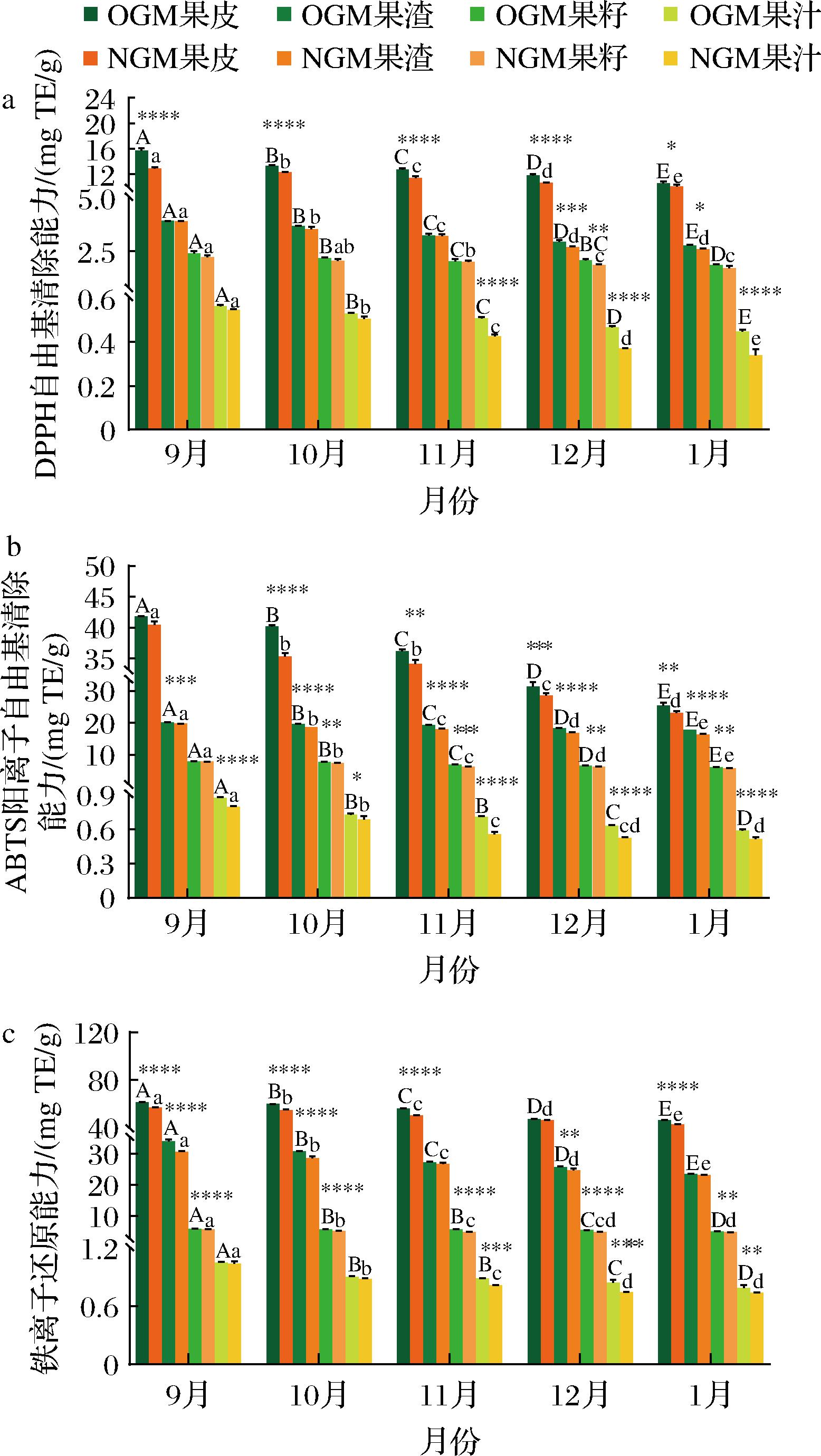
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-铁离子还原能力
图7 不同成熟期有机(O)和非有机(N)贡柑果实抗氧化能力的比较
Fig.7 Comparison of the antioxidant capacity between OGM and NGM fruits at different ripening stages
同一生长时期,有机和非有机贡柑果实各个部位的抗氧化活性(DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力)存在显著性差异(P<0.05)。9月至次年1月,与非有机贡柑果实各个部位相比,有机贡柑果皮、渣、籽和汁的DPPH自由基清除能力分别提高了5.03%~21.70%、0.62%~9.73%、0.33%~13.03%,2.96%~31.58%,ABTS阳离子自由基清除能力分别提高了3.25%~13.95%、2.17%~8.47%、1.41%~11.59%、6.29%~27.51%,铁离子还原能力分别提高了1.80%~11.56%、1.43%~10.93%、4.47%~17.29%、0.70%~13.26%;说明有机贡柑的抗氧化能力强于非有机贡柑果实。据报道,与非有机食品相比,有机食品酚类化合物含量较高,抗氧化活性更强,与本文结果一致[22, 29]。
2.4 酚类化合物与抗氧化活性相关性分析
众所周知,植物化学物质,包括黄酮、酚酸等,是水果中抗氧化活性的主要成分[30]。因此,相关性分析揭示了酚类化合物的重要作用。如图8所示,抗氧化活性与贡柑果实各个部位的总酚(r>0.84)和总黄酮(r>0.82)呈现极显著正相关(P<0.001)。值得注意的是贡柑果皮中16种主要酚类化合物(r>0.60)、果渣中12种主要酚类化合物(r>0.72)、果籽中6种主要酚类化合物(r>0.64)、果汁中6种主要酚类化合物(r>0.53)均与DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力呈显著正相关(P<0.05),而果籽中柚皮苷、川陈皮素和桔红素与DPPH自由基清除能力呈现无显著正相关(P>0.05)。贡柑果实中总酚、没食子酸、绿原酸和阿魏酸与抗氧化活性呈极显著正相关(P<0.001)。据报道,柑橘类中酚酸对抗氧化能力有显著贡献,其强抗氧化活性归因于苯环上的邻位取代和羟基的脱氢作用[12]。值得注意的是,贡柑果实中表儿茶素、芦丁、柚皮苷、橙皮苷、甲基橙皮苷、香蜂草苷、橙皮素、染料木素、芹菜素、甜橙黄酮、桔红素、川陈皮素与抗氧化活性具有高度相关性。黄酮类化合物(黄烷酮和黄酮苷或苷元)在清除自由基的过程中表现出特定选择性,更倾向于清除羟自由基[5]。此外,黄酮类化合物能抑制自由基的产生,抵消脂质氧化,并提高人体的抗氧化酶活性,从而减少体内过氧化物的形成[31]。

a-果皮;b-果渣;c-果籽;d-果汁
图8 不同成熟期有机(O)和非有机(N)贡柑果皮、果渣、果籽和果汁的抗氧化能力分析
Fig.8 Analysis of the antioxidant capacity of OGM and NGM peels, pulp, seeds, and juice at different ripening stages
3 结论
本研究以不同成熟期有机和非有机德庆贡柑的果皮、果渣、果籽和果汁为对象,对其活性成分和抗氧化特性进行了系统评价和分析。结果表明,生长过程中贡柑果皮、果渣、果籽和果汁中总酚、总黄酮和抗氧化活性均呈下降趋势,且果皮>果渣>果籽>果汁。在贡柑果实各个部位橙皮苷含量均最高。同一成熟时期,有机贡柑果实各个部位的总酚、总黄酮和抗氧化活性显著高于非有机贡柑。相关性分析揭示了总酚、总黄酮、酚酸和黄酮类化合物对抗氧化能力的贡献作用。本研究结果为有机和非有机贡柑果实生长过程中酚类物质和抗氧化活性的变化规律提供了参考价值,有助于对单个酚类化合物或其他生物活性化合物的生理功能进行研究,可用作食品和制药工业中有效的天然抗氧化剂来源。
[1] LIU J L, CHEN L, XU S L, et al.Effect of aloin on the soluble sugars metabolism and flavor quality keeping of Gonggan[J].Applied Mechanics and Materials, 2011, 140:309-313.
[2] LIU D J, SHEN Q M, LIN K W, et al.The aroma profiles of dried Gonggans:Characterization of volatile compounds in oven-dried and freeze-dried Gonggan[J].Food Research International, 2024, 191:114716.
[3] WU Y, JIANG H, CHEN G F, et al.Preventive effect of Gonggan (Citrus reticulata blanco var.Gonggan) peel extract on ethanol/HCl-induced gastric injury in mice via an anti-oxidative mechanism[J].Frontiers in Pharmacology, 2021, 12:715306.
[4] WANG F, LIN K W, SHEN Q M, et al.Metabolomic analysis reveals the effect of ultrasonic-microwave pretreatment on flavonoids in tribute Citrus powder[J].Food Chemistry, 2024, 448:139125.
[5] SINGH B, SINGH J P, KAUR A, et al.Phenolic composition, antioxidant potential and health benefits of citrus peel[J].Food Research International, 2020, 132:109114.
[6] MOULEHI I, BOURGOU S, OURGHEMMI I, et al.Variety and ripening impact on phenolic composition and antioxidant activity of mandarin (Citrus reticulate Blanco) and bitter orange (Citrus aurantium L.) seeds extracts[J].Industrial Crops &Products, 2012, 39:74-80.
[7] JIA D F, LIAO G L, YE B, et al.Changes in fruit quality, phenolic compounds, and antioxidant activity of kiwifruit (Actinidia eriantha) during on-vine ripening[J].LWT, 2024, 206:116564.
[8] DEL RIO D, RODRIGUEZ-MATEOS A, SPENCER J P E, et al.Dietary (poly)phenolics in human health:Structures, bioavailability, and evidence of protective effects against chronic diseases[J].Antioxidants &Redox Signaling, 2013, 18(14):1818-1892.
[9] 陈玉婷, 傅曼琴, 吴继军, 等.不同生长时期茶枝柑果实品质分析[J].食品与发酵工业, 2023, 49(10):251-258.CHEN Y T, FU M Q, WU J J, et al.Analysis of Citrus reticulata ‘Chachi’ quality during different growth periods[J].Food and Fermentation Industries, 2023, 49(10):251-258.
[10] 陈玉婷, 傅曼琴, 吴继军, 等.不同生长时期玫瑰柑果实品质分析[J].南方农业学报, 2022, 53(3):869-878.CHEN Y T, FU M Q, WU J J, et al.Analysis of rose orange fruit quality during different growth periods[J].Journal of Southern Agriculture, 2022, 53(3):869-878.
[11] 朱晓婷, 肖更生, 邢东旭, 等.产地及肥料对新会茶枝柑果实品质的影响[J].食品工业科技, 2025, 46(5):267-276.ZHU X T, XIAO G S, XING D X, et al.Influence of place of origin and fertilizer on fruit quality of Citrus reticulata ‘chachiensis’ in Xinhui district[J].Science and Technology of Food Industry, 2025, 46(5):267-276.
[12] GUO H, ZHENG Y J, WU D T, et al.Quality evaluation of citrus varieties based on phytochemical profiles and nutritional properties[J].Frontiers in Nutrition, 2023, 10:1165841.
[13] CRUZ-CARRI N
N  , RUIZ DE AZUA M J, MUGUERZA B, et al.Organic vs.non-organic plant-based foods—A comparative study on phenolic content and antioxidant capacity[J].Plants, 2023, 12(1):183.
, RUIZ DE AZUA M J, MUGUERZA B, et al.Organic vs.non-organic plant-based foods—A comparative study on phenolic content and antioxidant capacity[J].Plants, 2023, 12(1):183.
[14] PEDRO A C, S NCHEZ-MATA M-C, PÉREZ-RODR
NCHEZ-MATA M-C, PÉREZ-RODR GUEZ M L, et al.Qualitative and nutritional comparison of goji berry fruits produced in organic and conventional systems[J].Scientia Horticulturae, 2019, 257:108660.
GUEZ M L, et al.Qualitative and nutritional comparison of goji berry fruits produced in organic and conventional systems[J].Scientia Horticulturae, 2019, 257:108660.
[15] ROSATI A, CAFIERO C, PAOLETTI A, et al.Effect of agronomical practices on carpology, fruit and oil composition, and oil sensory properties, in olive (Olea europaea L.)[J].Food Chemistry, 2014, 159:236-243.
[16] HEIMLER D, ROMANI A, IERI F.Plant polyphenol content, soil fertilization and agricultural management:A review[J].European Food Research and Technology, 2017, 243(7):1107-1115.
[17] 左龙亚. 柑橘亚属植物果皮多酚类物质提取及其抗氧化、抑菌活性检测[D].重庆:西南大学, 2018.ZUO L Y.Polyphenols extraction and antioxidant, antifungal activities test of subgenus citrus[D].Chongqing:Southwest University, 2018.
[18] 陈霖虹, 肖更生, 徐玉娟, 等.不同贮藏方式陈皮精油成分及其抗氧化活性分析[J].食品与发酵工业, 2025, 51(3):215-224.CHEN L H, XIAO G S, XU Y J, et al.Analysis of essential oil composition and antioxidant activity of Pericarpium Citri Reticulatae in different storage methods[J].Food and Fermentation Industries, 2025, 51(3):215-224.
[19] GHASEMI K, GHASEMI Y,EBRAHIMZADEH M A.Antioxidant activity, phenol and flavonoid contents of 13 citrus species peels and tissues[J].Pakistan Journal of Pharmaceutical Sciences, 2009, 22(3):277-281.
[20] SINGH J, CHAHAL T S, GILL P S, et al.Changes in phenolics and antioxidant capacities in fruit tissues of mandarin cultivars Kinnow and W.Murcott with relation to fruit development[J].Journal of Food Processing and Preservation, 2021, 45(12):e16040.
[21] MULTARI S, LICCIARDELLO C, CARUSO M, et al.Monitoring the changes in phenolic compounds and carotenoids occurring during fruit development in the tissues of four citrus fruits[J].Food Research International, 2020, 134:109228.
[22] BARRETO N M B, PIMENTA N G, BRAZ B F, et al.Organic black beans (Phaseolus vulgaris L.) from Rio de Janeiro state, Brazil, present more phenolic compounds and better nutritional profile than nonorganic[J].Foods, 2021, 10(4):900.
[23] VILLAMARIN-RAAD D A, LOZANO-PUENTES H S, CHITIVA L C, et al.Changes in phenolic profile and total phenol and total flavonoid contents of Guadua angustifolia Kunth plants under organic and conventional fertilization[J].ACS Omega, 2023, 8(44):41223-41231.
[24] 廖健利. 有机栽培土壤细菌及其在不结球白菜抗氧化物积累中的作用[D].上海:上海交通大学, 2019.LIAO J L.Antioxidants accumulation of pakchoi regulated by rhizobacteria in organic farming systems[D].Shanghai:Shanghai Jiao Tong University, 2019.
[25] 张桐, 胡益波, 柳建良.贡柑果皮黄酮类化合物组成及抗氧化活性研究[J].浙江柑橘, 2023, 40(4):24-28.ZHANG T, HU Y B, LIU J L.Composition and antioxidant activity of flavonoids in the pericarp of Gongquan fruit[J].Zhejiang Citrus, 2023, 40(4):24-28.
[26] ZOU Z, XI W P, HU Y, et al.Antioxidant activity of citrus fruits[J].Food Chemistry, 2016, 196:885-896.
[27] CHEN X M, TAIT A R, KITTS D D.Flavonoid composition of orange peel and its association with antioxidant and anti-inflammatory activities[J].Food Chemistry, 2017, 218:15-21.
[28] GORINSTEIN S, MART N-BELLOSO O, PARK Y-S, et al.Comparison of some biochemical characteristics of different citrus fruits[J].Food Chemistry, 2001, 74(3):309-315.
N-BELLOSO O, PARK Y-S, et al.Comparison of some biochemical characteristics of different citrus fruits[J].Food Chemistry, 2001, 74(3):309-315.
[29] BARA SKI M, SREDNICKA-TOBER D, VOLAKAKIS N, et al.Higher antioxidant and lower cadmium concentrations and lower incidence of pesticide residues in organically grown crops:A systematic literature review and meta-analyses[J].British Journal of Nutrition, 2014, 112(5):794-811.
SKI M, SREDNICKA-TOBER D, VOLAKAKIS N, et al.Higher antioxidant and lower cadmium concentrations and lower incidence of pesticide residues in organically grown crops:A systematic literature review and meta-analyses[J].British Journal of Nutrition, 2014, 112(5):794-811.
[30] FANG H T, ZHANG H L, WEI X B, et al.Phytochemicals and antioxidant capacities of young citrus fruits cultivated in China[J].Molecules, 2022, 27(16):5185.
[31] HARAOUI N, ALLEM R, CHAOUCHE T M, et al.In-vitro antioxidant and antimicrobial activities of some varieties citrus grown in Algeria[J].Advances in Traditional Medicine, 2020, 20(1):23-34.