五氯酚酸钠(sodium pentachlorophenoxide,PCP-Na)是一种广谱杀菌剂、防腐剂以及除草剂,被广泛应用于多个领域,但同时也因其毒性和副作用而受到严格限制[1-4]。PCP-Na在环境中降解缓慢并易溶于水,极易造成水体和土壤污染,经环境蓄积进一步通过食物链进入动植物体内,PCP-Na在碱性条件下稳定存在,而在酸性条件下会分解生成五氯酚,五氯酚具有有机氯和酚的毒性,能抑制生物代谢过程中氧化磷酸化作用,可对人体的肝、肾及中枢神经系统造成损害,严重者甚至可能昏迷、死亡[5-8]。
由于PCP-Na的毒性及蓄积性,美国国家环境保护局已将PCP-Na列为可疑致癌物质,并限制其使用。我国农业部2002年发布的235号公告《动物性食品中兽药最高残留限量》中,将PCP-Na列为违禁药物,不得在动物性食品中检出。尽管PCP-Na已被限制或禁用,但由于其难降解和持久性以及在一些地区和行业中仍有人非法使用,其残留至今仍可被发现,例如:2023年4月13日,养殖户郑某某违规使用PCP-Na用于养殖彩虹明樱蛤。2022年8月,青岛市市场监督管理局公布的食品安全抽检通告显示,市北区泰和顺海鲜苑销售的标称龙大美食生产的生猪肉检测出PCP-Na。2020年12月,海南省定安定城林琼霞鸡肉销售点和文昌文城林海珠鸡肉摊的鸡肉被检出PCP-Na残留。因此,建立一种有效、快速检测食品中PCP-Na残留的方法对食品安全具有重要意义。
目前针对PCP-Na的残留检测方法主要包括GC、HPLC、全自动固相萃取—气相色谱质谱法(solid-phase extraction and gas chromatography-mass spectrometry,SPE-GC-MS)、免疫层析法等[9-15]。其中最常用的分析检测技术多为实验室仪器检测方法,这些方法在灵敏度和准确度方面具有显著优势,但也面临着昂贵的使用成本、复杂的操作流程以及对设备和环境的要求高等局限性,例如针对动物源性食品样品中PCP-Na残留分析的GC-MS法,其前处理操作较为复杂,需通过衍生化反应将PCP-Na转化为挥发性衍生物,利用色谱柱分离目标物进行定性和定量分析,且适用范围较小;而LC-MS法检测应用范围相较于GC法更为广泛,但大多数前处理通常需结合固相萃取净化、紫外或荧光检测器完成分析,前处理操作时更为复杂。在与传统的仪器分析技术相比,免疫分析法方便、快速、廉价,可用于高通量样品检测。其中胶体金免疫层析技术(colloidal gold immuno-chromatography assay,GICA)因其灵敏、易操作、高通量等优点而被广泛应用。目前针对PCP-Na的快速检测方法中检出限、前处理方法、检测步骤和时间各不相同,检测产品的质量良萎不齐,从而降低了检测结果的可靠性。龚蕾等[16]建立的免疫层析法方法检出限为1.0 μg/kg,但其在处理不同类型样本时,采用了不同的前处理方法,水产品和内脏、鸡蛋样本的前处理方法相较于猪肉、牛肉等肌肉样本增加更复杂的净化后再离心、吹干的步骤,导致前处理时间以及潜在误差风险的增加;罗晓琴等[17]建立的免疫层析法方法对猪肉、水产品等检出限为1 μg/kg, 对水质的检出限为2 μg/kg;余宇燕等[18]建立的免疫层析法方法检出限为10 ng/mL,检测灵敏度难以满足检测要求。对此,针对动物性食品中PCP-Na违禁使用的监管需求,本研究通过设计合成了PCP-Na新型半抗原,制备了特异性识别PCP-Na的单克隆抗体,并建立一种快速检测动物性食品中PCP-Na的GICA法。对所建立的方法进行了标记体系、包被浓度和样品前处理等关键参数的优化,为食品安全监管部门提供了一种灵敏、可靠的现场筛查技术,以期为PCP-Na违禁使用的监测提供强有力的技术支撑。
1 材料与方法
1.1 材料与试剂
鸡肉、猪肉、花甲、生蚝等样品,市售;样本垫、硝酸纤维(nitrocellulose filter,NC)膜、吸水垫、聚氯乙烯底板,上海金标生物技术有限公司;氯金酸、柠檬酸三钠、PCP-Na标准品(纯度99.9%),国药集团化学试剂有限公司;金子保护剂、金子稀释液,广东达元绿洲食品安全科技股份有限公司;羊抗鼠二抗,北京全式金生物有限公司;其他试剂均为分析纯,实验用水均为超纯水。
1.2 仪器与设备
HM330三维平面点膜喷金仪、ZQ2000微电脑自动斩切机,上海金标生物科技有限公司;RS-NSY-1 便携式样品浓缩仪,广州瑞森生物科技股份有限公司;MX-S涡旋混匀器,大龙兴创实验仪器(北京)有限公司;MIRO 220R低温高速离心机,德国Hettich科学仪器公司;MS漩涡振荡器,德国IKA公司;2695高效液相色谱仪,美国Waters公司。
1.3 实验方法
1.3.1 PCP-Na半抗原的合成
合成路线如图1所示,步骤如下:
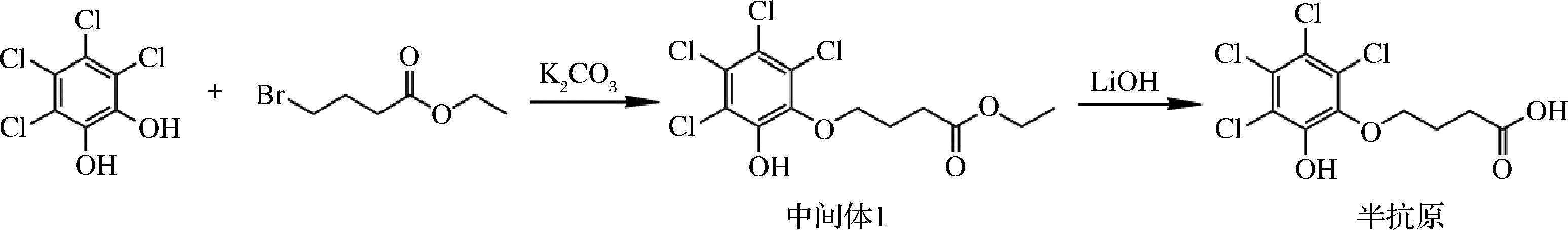
图1 PCP-Na半抗原合成路线
Fig.1 Synthetic routes of PCP-Na hapten
首先,称取1.00 g(4.00 mmol)四氯邻苯二酚溶于10 mL N,N-二甲基甲酰胺,0.55 g K2CO3(4.00 mmol)、0.16 g(0.80 mmol)4-溴丁酸乙酯和相转移催化剂四丁基溴化铵(50 mg),于25 ℃下反应16 h以上。反应完毕,加入90 mL 纯化水,用乙酸乙酯萃取2次,再减压去溶剂,柱层析纯化得0.26 g PCP-Na中间体1。
将0.26 g(0.72 mmol)的PCP-Na中间体1溶解到5 mL甲醇中,再加入5 mL 4 mol/L的LiOH水溶液中,反应混合物在室温反应8 h以上,加入30 mL NaCl水溶液,并用30 mL 二氯甲烷萃取2次,水相用4 mol/L的稀盐酸将pH值调至3~4,用乙酸乙酯萃取,再减压去溶剂,柱层析纯化得0.11 g PCP-Na半抗原。
1.3.2 抗PCP-Na单克隆抗体的制备及鉴定
将PCP-Na半抗原采用活泼酯法偶联血蓝蛋白和牛血清白蛋白(bovine serum albumin,BSA)得到PCP-Na人工抗原。以载体蛋白为血蓝蛋白的PCP-Na人工抗原为免疫原免疫BALB/c小鼠,每只鼠免疫剂量为100 μg,免疫间隔2周,免疫3次后,采小鼠尾部静脉血检测血清效价。如抗体效价不达要求,需加强免疫,待抗体效价不再升高后,以100 μg全抗原进行皮下加强免疫,5 d后取小鼠脾细胞与小鼠骨髓瘤细胞(SP2/0细胞)按比例融合,融合后的细胞进行HAT培养基选择性培养。用ic-ELISA对细胞上清液进行检测,将检测结果为强阳性的孔内细胞进行有限稀释法克隆培养,经3次克隆培养检测后,均呈阳性的孔内细胞即为分泌单克隆抗体的杂交瘤细胞。将杂交瘤细胞放大培养后,接种至小鼠腹腔,产生含抗体的腹水。用辛酸-硫酸铵沉淀法纯化腹水,经冷冻干燥后即可得到高纯度、高特异性的单克隆抗体。
将载体蛋白为BSA的PCP-Na人工抗原作为包被抗原,用0.05 mol/L、pH值为9.6的碳酸盐缓冲液(carbonate buffer,CB)稀释至0.08 μg/mL加入聚苯乙烯微孔板中包被,将PCP-Na标准储备液用0.01 mol/L、pH值为7.4的PBS稀释成质量浓度分别为0、0.2、0.6、1.8、5.4和16.2 μg/L的标准溶液,通过ic-ELISA法进行抗体性能鉴定,用酶标仪读取各孔OD450值,采用ELISA Calc软件进行四参数Logistic曲线拟合,以OD450值为纵坐标,药物质量浓度为横坐标绘制标准曲线,计算得到PCP-Na抗体的半抑制浓度(half inhibitory concentration, IC50)值与线性范围等表征数据。
1.3.3 GICA方法的建立
1.3.3.1 胶体金标记抗体条件优化
取2 mL透明离心管各加入1 mL 粒径为523 nm的胶体金溶液后分别加入0、2、3、5 μL质量分数1% K2CO3调节pH值,混匀后,加入5 μg PCP-Na单克隆抗体混匀,室温反应10 min后加入10 μL 10% BSA封闭剂混匀,室温反应10 min。将标记好的胶体金溶液于高速离心机中12 000 r/min离心12 min,去除上清液,先后加入100 μL金子保护剂和400 μL金子稀释液充分混匀,得到标记好的湿金溶液,置于4 ℃保存备用。
1.3.3.2 抗PCP-Na单克隆抗体的标记
取3个2 mL离心管加入1 mL胶体金溶液加入质量分数1%的K2CO3溶液的最佳添加量混匀,调节pH值,分别加入5、10、15 μL的抗PCP-Na单克隆抗体(7.0 mg/mL)混匀后室温反应10 min后加入质量分数10%的BSA水溶液混匀进行封闭,室温反应10 min。将标记好的胶体金溶液于高速离心机中12 000 r/min离心12 min,去除上清液,先后加入100 μL金子保护剂和400 μL金子稀释液充分混匀,得到标记好的湿金溶液,将湿金溶液以每孔20 μL分装到微孔中,金标微孔于45 ℃烘箱中烘干。通过对照胶体金比色卡判断阴性和阳性检测(test,T)线颜色的深浅与梯度,筛选出最佳的PCP-Na抗体标记量。
1.3.3.3 包被原浓度和羊抗鼠二抗浓度的优化
将PCP-Na抗原用PBS(0.1 mol/L,pH 7.4)稀释成0.1、0.2、0.3 mg/mL喷涂于NC膜T线上,将羊抗鼠IgG用PBS(0.1 mol/L,pH 7.4)稀释成0.4、0.6、0.8 mg/mL喷涂于NC膜质控(control,C)线上,对试纸条进行阴性、阳性对照实验,通过对照胶体金比色卡判断T线的颜色与梯度,筛选出最佳的PCP-Na抗原和羊抗鼠二抗包被浓度。
1.3.3.4 PCP-Na检测卡的组装
采用上述优化中最佳的质量分数1%的K2CO3添加量来调节胶体金溶液的pH值,加入抗PCP-Na单克隆抗体,最后将金标抗体以每孔20 μL分装到微孔中,45 ℃烘干备用。将NC膜贴于聚氯乙烯板上,将PCP-Na包被原和羊抗鼠IgG分别用划膜机划于NC膜的T线和C线位置上,置于45 ℃烘箱中烘干24 h后,取吸水纸和样品辅料垫粘贴于NC膜的两端,吸水纸贴于靠近C线的一端,样品辅料垫贴于靠近T线的一端,吸水纸和样品辅料垫重叠于NC膜上1~2 mm,裁切成宽度为3.00 mm的卡条,放入塑料卡槽,盖上卡盖即可使用。组装完毕的检测卡和微孔放入铝箔袋,加入干燥剂密封避光常温保存。
1.3.3.5 检测步骤及结果判定
用移液器准确量取100 μL待测液于金标微孔中,反复吹打3~5次后室温孵育3 min后,滴加液体至试纸条加样孔中,室温反应8 min后观察结果。对于不含有待测物的阴性样本,检测线T线上的PCP-Na包被原会捕获金标抗体,形成一条红色的T线,同时,C线上的羊抗鼠IgG会捕获剩余的金标抗体,形成另一条红色的C线,并且T线显色深于或相近于C线显色。含有待测物的阳性样本与金标抗体接触时会优先与PCP-Na结合,形成抗原-抗体复合物。由于金标抗体会优先与待测物结合,导致T线的显色强度随着待测物浓度的增加而逐渐变浅,T线不显色或颜色稍浅于C线。当试纸条的C线无色,无论试纸条的T线是否显色,结果无效。
1.3.4 样品前处理方法及测定步骤的优化
取阴性样本,PCP-Na含量为0.5 μg/kg的半检测限阴性样本,PCP-Na含量为1 μg/kg的阳性样本,分别对提取剂A乙酸乙酯的用量、提取剂B的种类、提取剂C的种类、加样量、孵育时间和层析反应时间进行优化。按照初步确认并改良后的前处理方法及测定步骤操作,吹干时每隔5 min查看并记录吹干所需时间。通过对比吹干所需时间和检测结果来判断样品提取剂对检测卡灵敏度的影响。
最终确认样品前处理的操作方案及测定步骤为:取待检样品100 g以上的肌肉组织样本,用均质机捣碎均质备用。准确称取(4.0±0.1) g样品于15 mL离心管中。分别加入2 mL PCP-Na提取剂A乙酸乙酯、2 mL PCP-Na提取剂正己烷和600 μL PCP-Na提取剂C对甲苯磺酸,涡旋混合1~2 min至组织均匀分散状态,4 000 r/min离心2 min。取全部上层清液于10 mL离心管,于样品浓缩仪上60~70 ℃加热吹干(约10 min)。加入300 μL PCP-Na复溶液PBS(0.01 mol/L,pH 7.4),涡旋1 min,液体待测。吸取100 μL样品待测液加入金标微孔中,吹打均匀后孵育反应3 min,将全部待测液加至试纸条加样孔中,层析反应8 min后进行结果判定。
1.3.5 试纸条性能测试
1.3.5.1 灵敏度
按照上述优化所得的最佳检测条件,分别配制一系列PCP-Na标准品溶液(0.1、0.2、0.4、0.8、1.6、3.2、6.4 μg/L),并在鸡肉、猪肉、鸭肉、桂花鱼、鲈鱼、罗非鱼、草鱼、花甲、蛏子、生蚝、白贝、鲍鱼等阴性样品中,分别添加PCP-Na标准品至质量浓度为0、0.5、1、1.5、2 μg/kg,按照优化的检测方法进行提取检测,各浓度重复3次,根据实验结果确定试纸条的样本和标准品检测限。
1.3.5.2 准确性
按照上述优化的前处理方法,对已经确认检测结果的20份水产品样本进行检测,通过对照确认结果进行检测结果验证,计算符合率,对优化后的前处理方法是否能满足实际检测要求进行评价。
1.3.5.3 特异性
将PCP-Na结构类似物2,4-二氯酚、2,4,6-三氯酚、苯酚添加于空白基质中,采用上述优化后的前处理方法提取后检测,通过比较试纸条的阴性及阳性对试纸条的特异性进行评价。
1.3.5.4 稳定性
将同一批次的试纸条及金标微孔置于37 ℃烘箱中进行加速老化实验,分别隔0、5、10、20、30、40、50、60 d进行阴性与阳性检测,通过比较试纸条显色及灵敏度的变化对试纸条的稳定性进行评价。
2 结果与讨论
2.1 PCP-Na半抗原及单克隆抗体性能鉴定
由于小分子物质本身不具有免疫原性,需要与大分子载体偶联制备完全抗原才能诱导机体产生抗体,因此人工抗原决定了抗体的质量,是免疫分析方法的关键步骤[19-20]。小分子半抗原的设计策略主要考虑保留待测物分子特征、活性基团的引入以及适宜长度的连接臂。基于以上半抗原设计原则,在半抗原设计策略上,设计的PCP-Na半抗原完整保留了待测目标物的苯酚类结构,增强了识别位点,并引入长度适中具有活性基团的连接臂,由于保留了多个识别位点,能检测到更加微量的PCP-Na。通过LC-MS对PCP-Na半抗原进行鉴定,如图2所示,PCP-Na半抗原分子式为C10H8Cl4O4,相对分子质量为333.97,其质荷比(m/z)=332.9。
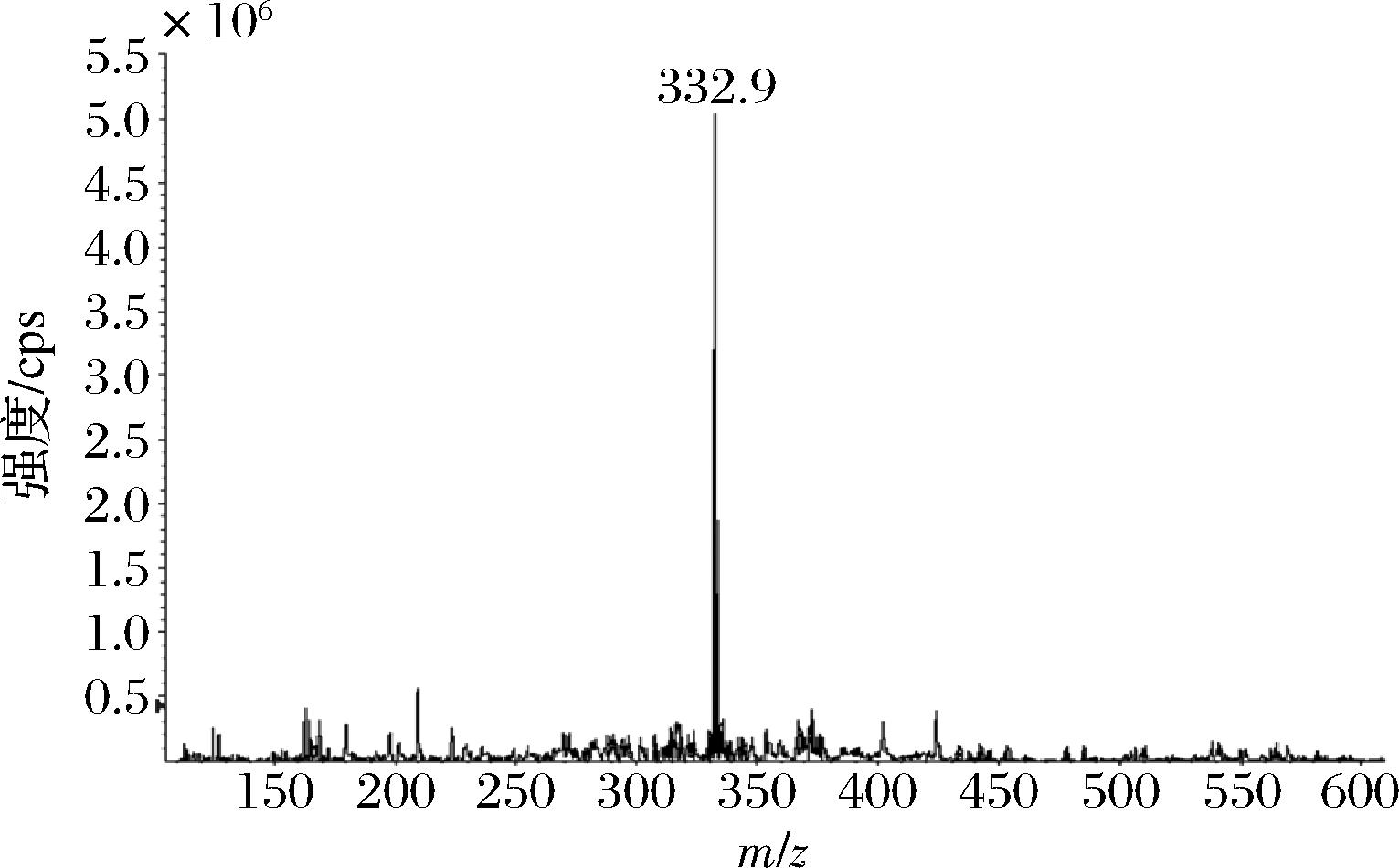
图2 PCP-Na半抗原负离子质谱图
Fig.2 Anion MS spectrum of PCP-Na hapten
将载体蛋白为BSA的PCP-Na人工抗原作为包被抗原进行聚苯乙烯微孔包被,加入不同质量浓度的PCP-Na标准溶液,再相应加入PCP-Na抗体溶液,得到ic-ELISA数据拟合绘制标准曲线,标准曲线如图3所示,PCP-Na的线性方程为y=(A-D)/[1+(X/C)B]+D,r2=0.998,A=2.336 58,B=0.788 60,C=0.865 61,D=0.001 71,x表示待测物质量浓度,y表示OD450值,通过计算得到IC50值为0.87 μg/L,在0.2~16.2 μg/L呈线性关系。
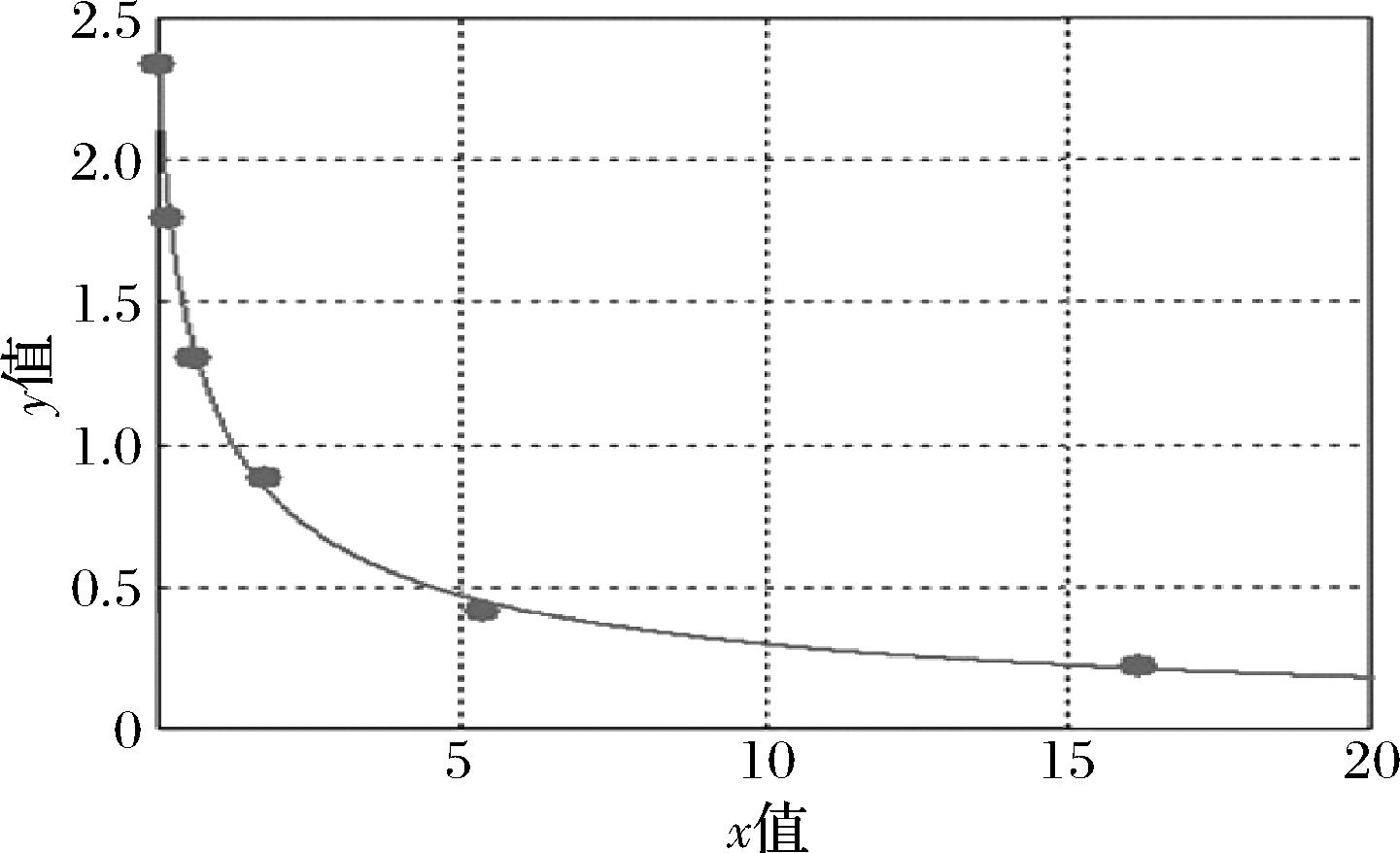
图3 PCP-Na ic-ELISA曲线
Fig.3 ic-ELISA curve of PCP-Na
2.2 试纸条检测条件优化
2.2.1 标记pH值的优化
胶体金标记抗体是通过静电吸附作用将抗体结合包裹在胶体金颗粒表面,标记体系的pH值的变化会直接影响胶体金颗粒和抗体分子表面的电荷分布和电荷密度,从而影响它们之间的静电吸附作用。通过添加不同体积质量分数1%的K2CO3溶液进行胶体金溶液pH值调节, 由图4可知,随着K2CO3溶液用量的增加,可以观察到的颜色变化为深紫色、紫红色、深红色、红色,当K2CO3溶液添加较少、pH值偏低时,胶体金溶液会发生明显的聚沉现象,导致溶液颜色加深,当K2CO3溶液添加量为5 μL时,整体溶液颜色最接近胶体金溶液本身的红色,没有聚沉现象的产生。因此1 mL胶体金溶液中质量分数1%的K2CO3溶液最适添加量为5 μL。
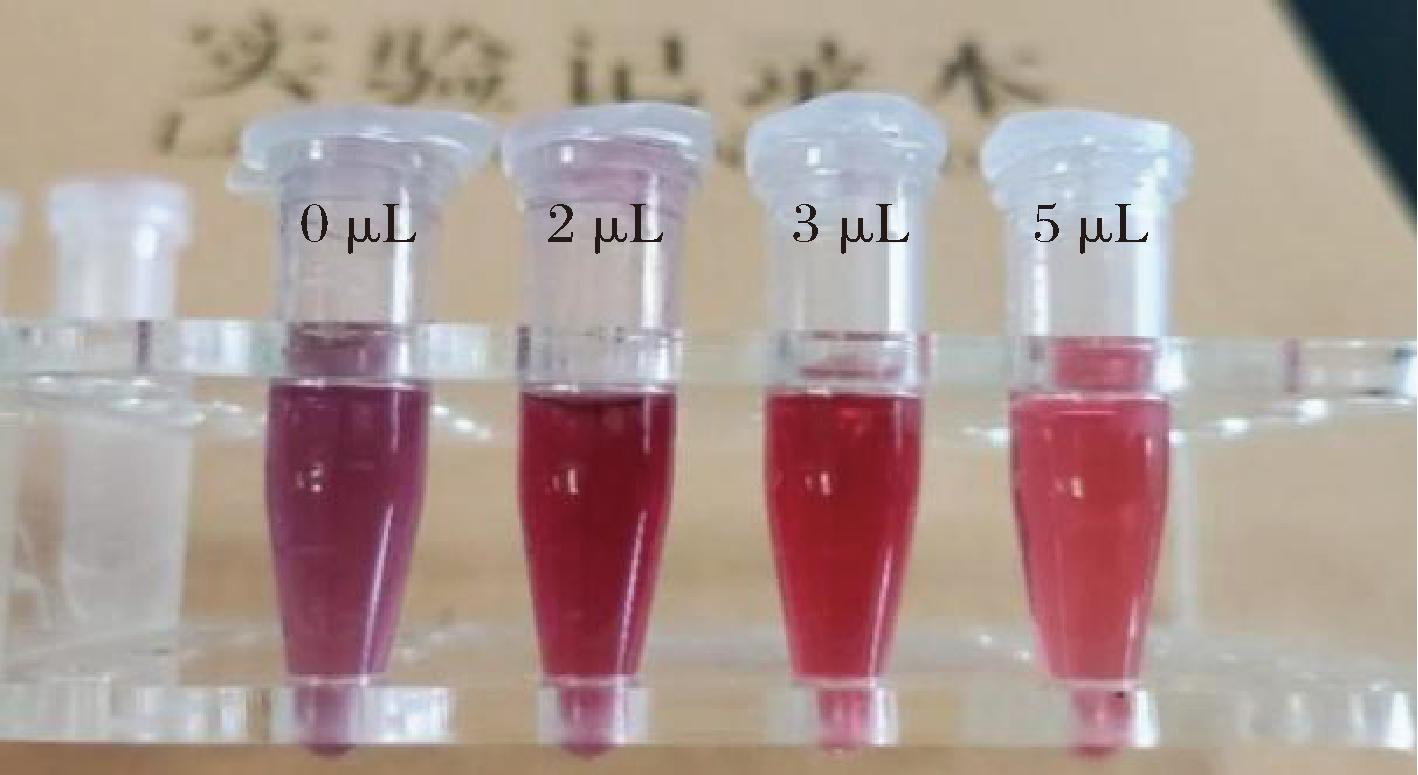
图4 不同1% K2CO3溶液添加量的胶体金探针颜色
Fig.4 Probe color with different 1% K2CO3solution addition volume
2.2.2 抗体标记浓度的优化
对于试纸条的显色效果及灵敏度,金标抗体的浓度是关键因素之一,因此在最适的pH值条件下,探究了不同金标抗体质量浓度(5、10、15 μg/mL)对试纸条检测性能的影响,由表1可知,随着PCP-Na抗体标记质量浓度的升高,阴性和阳性下的T线颜色都随之加深。随着PCP-Na抗体标记质量浓度的升高,阴性和阳性下的T线颜色都随之加深,阴性时T线颜色≥L7且显色梯度≥2.5,符合对胶体金的判读要求,但考虑到抗体活性可能在铺金烘干后有所下降故选择显色梯度更大的,标记量10、15 μg/mL的显色梯度都为3个,但过量添加抗体会导致试纸条灵敏度下降与容易造成聚沉现象,进一步考虑到制作成本,故选择10 μg/mL为PCP-Na抗体的最佳标记质量浓度。
表1 PCP-Na抗体标记质量浓度优化结果
Table 1 Optimization of PCP-Na antibody marker concertration

抗体标记质量浓度/(μg/mL)T线颜色空白对照(稀释液)PCP-Na标准溶液(2 μg/L)5L7L4+10L8L515L9L5+
2.2.3 抗原包被浓度、羊抗鼠二抗包被浓度的优化
对于试纸条的显色效果及灵敏度,检测T线上抗原包被浓度以及羊抗鼠二抗包被浓度也是2个重要的影响因素。由表2可知,T线颜色都随包被浓度升高而加深,但包被质量浓度为0.1 mg/mL时阴性T线颜色较浅,阳性T线颜色较深,梯度不明显,不利于结果的判定;包被质量浓度为0.3 mg/mL时浓度过高T线会出现单边现象;当包被质量浓度为0.2 mg/mL时,T线颜色>L7,没有出现单边且与阳性时T线的显色梯度为3,有利于阴阳性结果的判断,故选择0.2 mg/mL作为PCP-Na抗原(T线)的最佳包被质量浓度。
表2 T线抗原包被质量浓度优化结果
Table 2 Optimization of T-line antigen coating concentration
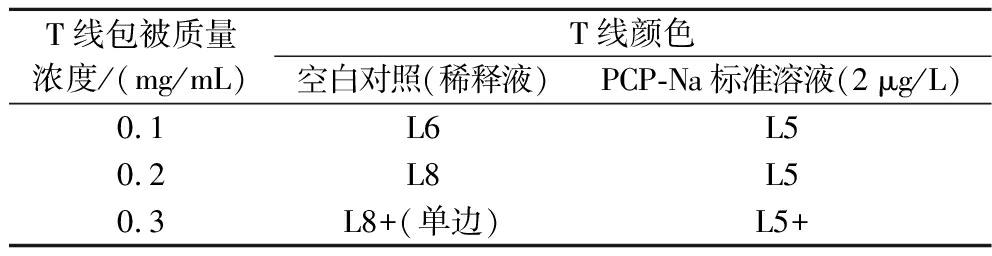
T线包被质量浓度/(mg/mL)T线颜色空白对照(稀释液)PCP-Na标准溶液(2 μg/L)0.1L6L50.2L8L50.3L8+(单边)L5+
用最佳T线质量浓度搭配3个不同质量浓度的C线来进行阴性和阳性对照实验,由表3可知当C线质量浓度为0.4 mg/mL和0.8 mg/mL时,C、T线在阴性和阳性下显色梯度只有1.0~1.5,结果较难判定,用读卡仪读出的T/C值阴性时<3.5,阳性时>0.4,也说明C、T线的梯度不明显,且C线质量浓度达0.8 mg/mL时,T线受到抑制,颜色变浅;当C线质量浓度为0.6 mg/mL时,阴性T线颜色能达到L7+,阴阳性C、T线显色梯度都为2.5,能很好的对结果进行判读,读出的T/C值也满足要求,故C线羊抗鼠二抗最佳包被质量浓度为0.6 mg/mL。
表3 C线包被质量浓度优化结果
Table 3 Optimization of C-line coating concentration
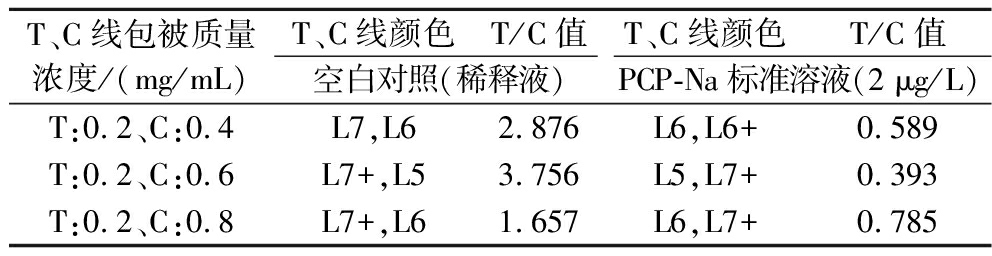
T、C线包被质量浓度/(mg/mL)T、C线颜色T/C值T、C线颜色T/C值空白对照(稀释液)PCP-Na标准溶液(2 μg/L)T:0.2、C:0.4L7,L62.876L6,L6+0.589T:0.2、C:0.6L7+,L53.756L5,L7+0.393T:0.2、C:0.8L7+,L61.657L6,L7+0.785
2.3 样品前处理优化
2.3.1 提取剂A用量的优化
在原有前处理方法的基础上,改变提取剂A乙酸乙酯的用量,通过对吹干所需时间的测定以及检测结果的测定。由表4可知,在温度均为65 ℃的情况下吹干,吹干时间随着乙酸乙酯的用量增加而增加,而在检测结果中,样本使用1 mL乙酸乙酯提取剂A检测卡阳性样本检测结果阳性较弱,乙酸乙酯使用量为2 mL和3 mL样本的检测结果无明显差异,考虑检测效率以及结果的准确性,因此提取剂A乙酸乙酯的最佳使用量为2 mL。
表4 不同量提取剂A吹干所需时间及检测结果
Table 4 Experimental results and time required for blow-drying of different amounts of extractant A

乙酸乙酯使用量/mL吹干所需时间/min提取剂PCP-Na检测结果乙酸乙酯阴性样本半检测限样本阳性样本19--+211--++315--++
注:“-”代表阴性,“+”代表阳性(下同)。
2.3.2 提取剂B种类的优化
由表5可知,在温度均为65 ℃的情况下吹干,正己烷吹干所需时间比乙腈短,且观察吹干情况发现乙腈吹干后底部剩余少量油,会导致复溶后溶液较混浊,而由于正己烷与油脂之间的极性差异,能够形成两相溶液,从而有效地将油脂从固体表面或混合物中溶解出来,吹干后复溶液较清澈。而在检测结果中,使用乙腈和正己烷作为提取剂B无明显差异。因此选择正己烷作为前处理优化中的提取剂B。
表5 不同提取剂B吹干所需时间及检测结果
Table 5 Experimental results and time required for blow-drying of different extractant B
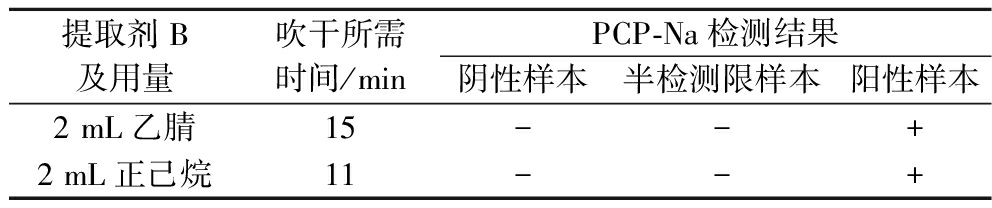
提取剂B及用量吹干所需时间/minPCP-Na检测结果阴性样本半检测限样本阳性样本2 mL乙腈15--+2 mL正己烷11--+
2.3.3 提取剂C种类的优化
根据PCP-Na的化学性质可知, 其在酸性条件下会失去其Na+,从而转化为五氯酚,因此选择酸性提取剂,能够使PCP-Na转化为五氯酚并且能有效地使动物性样品蛋白变性,从而减少样品基质对检测结果的干扰。由表6可知,在温度均为65 ℃的情况下吹干,对甲苯磺酸吹干所需时间更短,且对甲苯磺酸的酸性远远强于乙酸,能够更好地使蛋白变性。而在检测结果中,使用乙酸与对甲苯磺酸作为提取剂C无显著差异。因此选择对甲苯磺酸作为前处理优化中的提取剂C。
表6 不同提取剂C吹干所需时间及检测结果
Table 6 Experimental results and time required for blow-drying of different extractant C

提取剂C及用量吹干所需时间/minPCP-Na检测结果阴性样本半检测限样本阳性样本600 μL乙酸14--+600 μL对甲苯磺酸11--+
2.4 复溶液的选择
吹干复溶液可以缓冲样品提取液中的杂质和多余的溶剂,减少基质干扰,从而提高试纸条检测的灵敏度与准确性,例如在检测动物生鲜组织及动物性加工食品中的盐酸克伦特罗时,通过吹干复溶液可以去除样品提取液中的干扰物质,使检测结果更加准确[21]。因此,探究了不同复溶液对试纸条结果的影响,由表7可知,当采用PB复溶液复溶后,溶液呈现较混浊的状态,相比之下,PBS复溶后的效果更佳,溶液较为清澈。但在最终的检测结果中,使用PBS和使用PB作为复溶液的检测结果之间并未表现出明显的差异,因此选择复溶效果更佳的0.01 mol/L PBS作为前处理优化中的最佳复溶液。
表7 不同复溶液检测结果
Table 7 Experimental results of different reconstitution solution
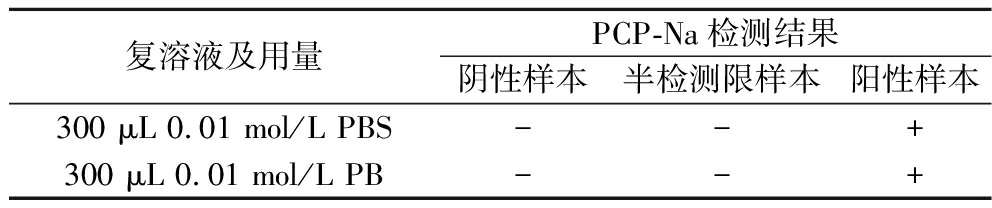
复溶液及用量PCP-Na检测结果阴性样本半检测限样本阳性样本300 μL 0.01 mol/L PBS--+300 μL 0.01 mol/L PB--+
2.5 加样量的优化
加样量的多少直接影响试纸条上的层析效果,它决定了目标分析物与胶体金颗粒在试纸条上的结合与移动情况。分别选择吸取50、80、100、150 μL样品待测液加入试纸条中,探究不同加样量对试纸条结果的影响。由图5可知,当加样量为50 μL时,加样孔中的待测液在层析尚未充分时已耗尽,导致层析不充分,影响结果的准确性和可靠性;当加样量增加到80 μL和100 μL时,试纸条均表现出充分的层析效果,T、C线显色强度明显利于判断,特别地,100 μL加样量时加样孔稍有湿润,但未出现明显的待测液残留;而当加样量增加到150 μL时虽然层析充分且结果准确,但加样孔中的待测液残留表明加样量稍微过量,因此,本研究选择加样量为100 μL。
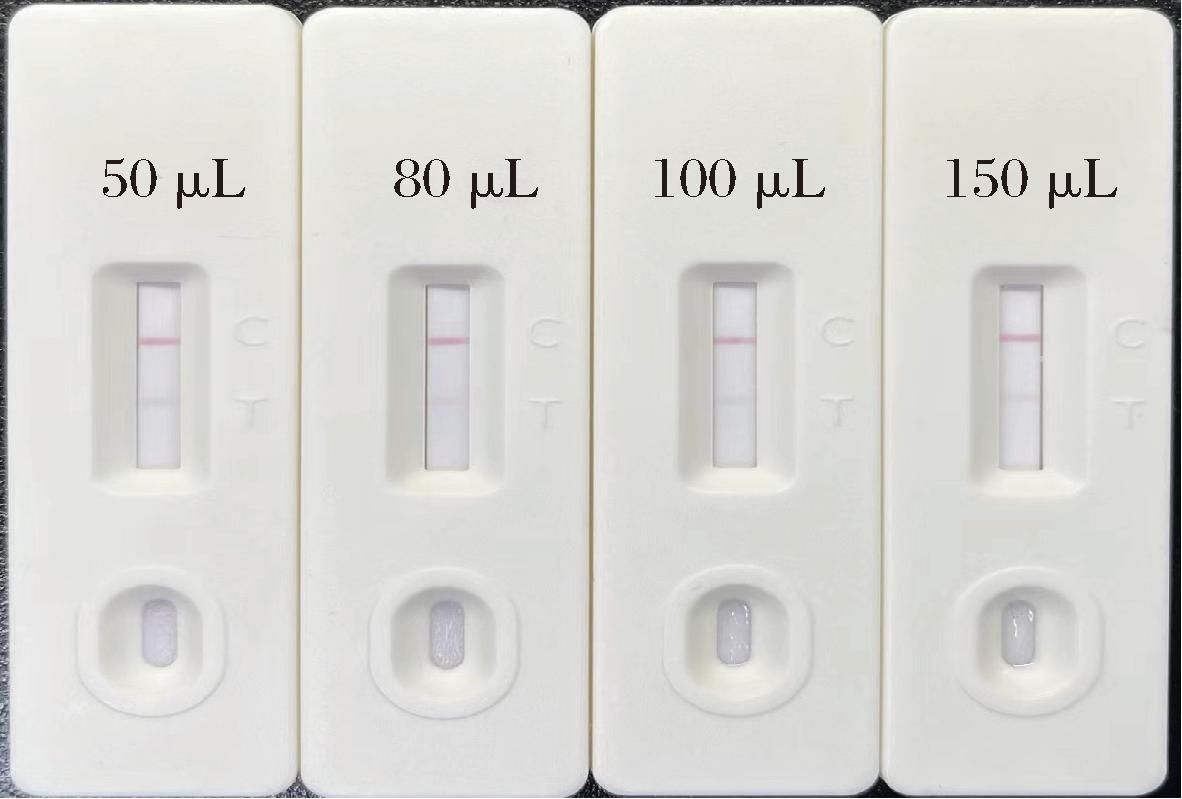
图5 不同加样量对试纸条效果的影响
Fig.5 Effect of different sampling volume on GICA performance
2.6 孵育时间的优化
孵育时间对胶体金比色结果影响显著,孵育时间的长短直接影响到胶体金颗粒与目标分析物之间的反应是否充分。时间过短,反应可能不完全,导致显色不明显或信号强度不足;时间过长,则可能引起非特异性结合或信号衰减,同样影响结果的准确性。吸取100 μL 样品待测液进行孵育时间的优化,由图6可知,孵育2 min时试纸条显色强度已达到要求,随着孵育时间的延长,对试纸条比色结果的影响并不显著。综合考虑到孵育时间延长至3 min可确保反应物之间更充分的相互作用和结合,从而提高检测的灵敏度和准确性,确保实验结果的可靠性和可重复性,因此本研究选择孵育3 min后进行层析反应。
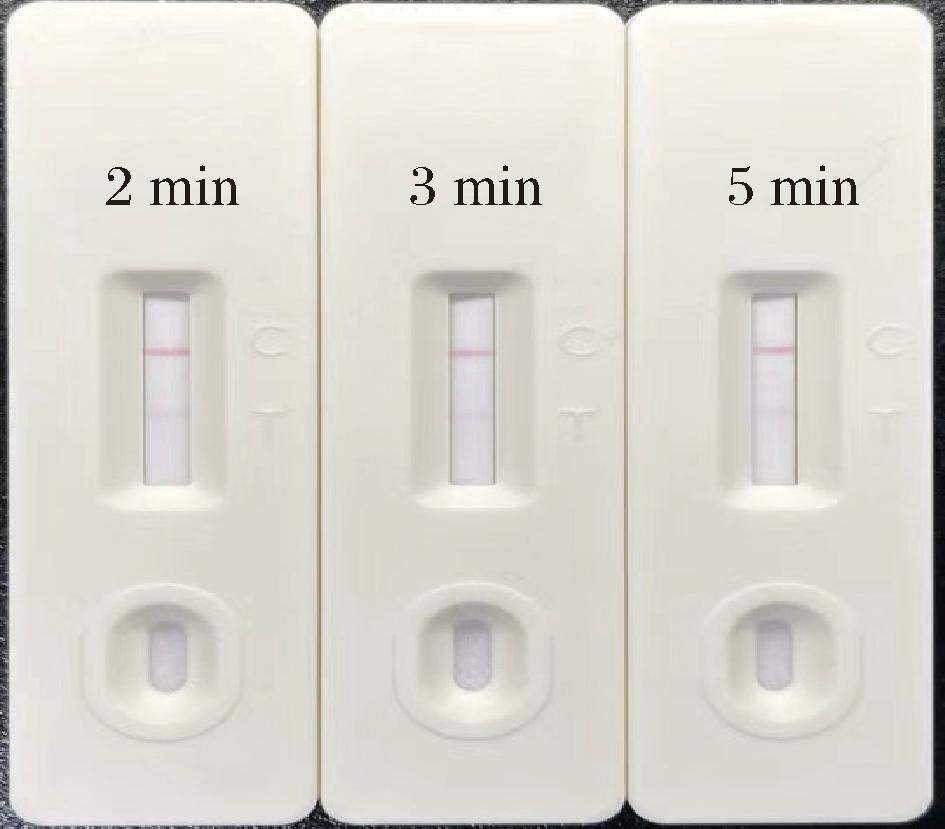
图6 不同孵育时间对试纸条效果的影响
Fig.6 Effect of different incubation times on GICA performance
2.7 层析反应时间的优化
层析反应时间是试纸条上化学反应进行的重要参数。如果层析时间过短,检测反应可能未充分进行,导致检测线和质控线上的显色强度不足,进而影响检测结果的准确性和可靠性。而如果层析时间过长,虽然可以确保检测反应的充分性,但会降低检测的效率。因此,为了获得最佳的检测结果,需要对层析时间进行优化。通过对比不同层析时间下的检测结果,可以确定最佳的层析时间范围,以确保检测反应的充分性和检测结果的准确性[22]。由图7可知,当层析反应时间为4 min,试纸条已经呈现出良好的显色强度,随着层析时间的延长,6 min后试纸条显色逐渐趋于稳定,层析时间8~10 min时,试纸条显色无明显区别,考虑到检测反应的充分性、检测效率和不同操作者或不同批次试纸条之间的误差对结果判定的影响,本研究选择层析反应8 min后进行结果判定。
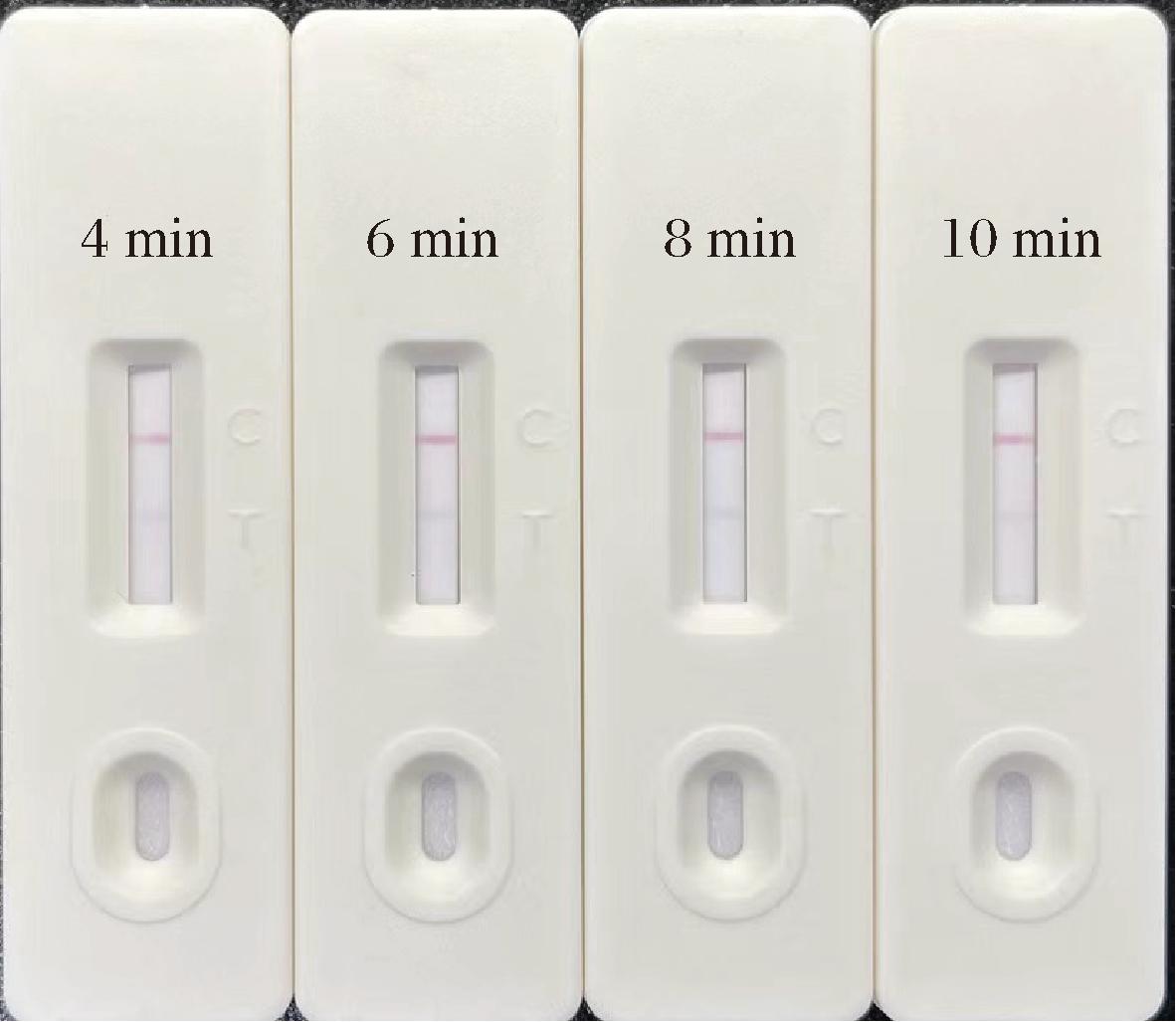
图7 不同层析反应时间对试纸条效果的影响
Fig.7 Effect of different chromatographic reaction time on GICA performance
2.8 试纸条性能评价
2.8.1 灵敏度
由表8灵敏度实验结果可知,在PCP-Na标准溶液质量浓度为0.8 μg/L时,试纸条结果为阳性。
表8 不同PCP-Na标准液质量浓度的试纸条检测结果
Table 8 Experimental results of different PCP-Na standard solution on GICA
标准液质量浓度/(μg/L)0.10.20.40.81.63.26.4检测结果---++++
由表9可知,在实际样品添加实验中,当PCP-Na添加质量浓度达到1 μg/kg时,不同样品的试纸条结果均为阳性,因此,本研究所建立的方法PCP-Na标准品检测限为0.8 μg/L,PCP-Na样品检测限为1 μg/kg。
表9 不同PCP-Na添加质量浓度的试纸条检测结果
Table 9 Experimental results of different PCP-Na spiked concentration on GICA
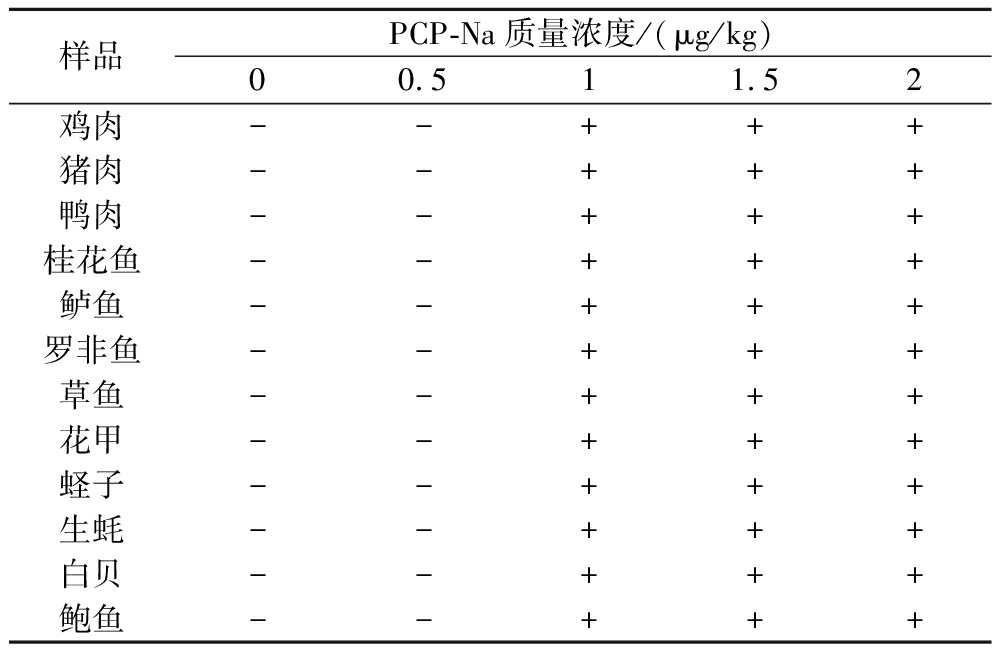
样品PCP-Na质量浓度/(μg/kg)00.5 1 1.5 2鸡肉--+++猪肉--+++鸭肉--+++桂花鱼--+++鲈鱼--+++罗非鱼--+++草鱼--+++花甲--+++蛏子--+++生蚝--+++白贝--+++鲍鱼--+++
2.8.2 准确性
对已经进行仪器验证确认结果的20份样品(阴性16份、阳性4份),使用上述最优前处理方案处理检测,对照确证结果进行准确性的验证,由表10可知,20份样品中共检出16份阴性、4份阳性,检测结果与确证结果一致,符合率为100%,表明所建立的方法准确性满足实际检测要求。
表10 准确性验证结果
Table 10 Accuracy verification results

样品基质PCP-Na检测结果鸡肉4份“-”鲈鱼3份“-”,1份“+”生蚝1份“-”,3份“+”猪肉4份“-”花甲4份“-”
2.8.3 特异性
通过比较检测结构类似物(2,4-二氯酚、2,4,6-三氯酚、苯酚)的试纸条结果评估方法的特异性,由表11可知,其与2,4-二氯酚、2,4,6-三氯酚、苯酚无明显的交叉,表明所建立的方法特异性良好。
表11 特异性检测结果
Table 11 Specificity results

结构类似物PCP-Na检测结果2,4-二氯酚-2,4,6-三氯酚-苯酚-
2.8.4 稳定性
为了验证试纸条的稳定性,在45 ℃干燥箱的条件下进行60 d的加速老化实验,由表12可知,在经过不同时间的加速老化实验,试纸条的显色及灵敏度无明显变化,稳定性良好。
表12 稳定性检测结果
Table 12 Stability results

时间/dPCP-Na质量浓度/(μg/L)00.40.81.60--++5--++10--++20--++30--++40--++50--++60--++
2.9 不同分析方法性能比较
目前关于食品中PCP-Na残留检测的不同方法如表13所示。李容[10]建立的SPE-GC-MS法对鸡肉样品中PCP-Na的检出限为0.3 μg/kg,但其前处理操作较为复杂,采用固相萃取前处理后需通过衍生化反应将PCP-Na转化为挥发性衍生物进行定性和定量分析;张美等[12]建立的高效液相色谱-串联质谱法对鸡蛋中PCP-Na检出限为0.3 μg/kg,相较于LC法减少了衍生化反应,但同样需要采用固相萃取柱进行前处理;而潘明迪[11]建立的液相色谱-三重四极杆串联质谱对牛百叶样品中PCP-Na的检出限为0.3 μg/kg,其结合QuEChERS方法可以有效降低前处理的成本与时间,但大型仪器分析方法昂贵的仪器和耗时长的检测时间限制了在现场快速检测中的应用。而在目前所报道的快速、便捷的免疫层析法方法中,龚蕾等[16]建立的免疫层析法方法检出限为1.0 μg/kg,但该方法检测时长因前处理步骤繁琐达到40 min,且前处理试剂的使用量为10 mL,这在一定程度上导致了整体成本的增加;HUANG等[15]建立的UiO-66-Eu荧光试纸条对猪肉、鸡肉和虾样品中PCP-Na检出限分别为0.84、0.98和0.37 μg/kg,提升了检测灵敏度以及简化了前处理步骤,只需采用乙腈萃取、吹干复溶后便可进行检测,但金属有机框架材料的使用也增加了整体的成本;本研究所构建的GICA法,针对不同类型的样本统一了前处理的方法,在肉制品和水产品实际样品中实现了PCP-Na的残留检测,检测限为1 μg/kg,并且控制了前处理试剂的使用量少于5 mL,降低了检测成本,使得该方法在实际应用中更具经济可行性,检测时间只需30 min,为动物性食品中PCP-Na残留的大批量快速筛选快速检测提供了一种高效、经济且实用的解决方案。
表13 PCP-Na不同检测分析方法的性能比较
Table 13 Comparation of different methods for PCP-Na detection
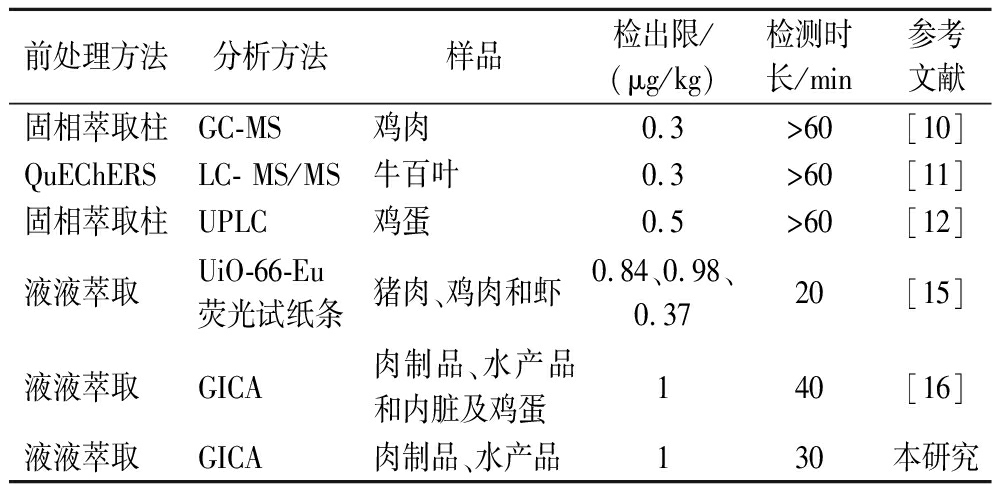
前处理方法分析方法样品检出限/(μg/kg)检测时长/min参考文献固相萃取柱GC-MS鸡肉0.3>60[10]QuEChERSLC- MS/MS牛百叶0.3>60[11]固相萃取柱UPLC鸡蛋0.5>60[12]液液萃取UiO-66-Eu荧光试纸条猪肉、鸡肉和虾0.84、0.98、0.3720[15]液液萃取GICA肉制品、水产品和内脏及鸡蛋140[16]液液萃取GICA肉制品、水产品130本研究
3 结论
本研究以PCP-Na的结构为基础,通过保留其苯环上的酚羟基设计合成了半抗原,制备了特异性识别PCP-Na的单克隆抗体,该单克隆抗体IC50值达到0.87 μg/L。基于所制备的单克隆抗体,建立了一种快速检测动物性食品中PCP-Na的GICA法。通过优化标记体系、抗原包被浓度和样品前处理等关键参数,所建立的GICA法对PCP-Na的标准品检出限、样品检出限分别为0.8 μg/L和1 μg/kg,可应用于鸡肉、猪肉、桂花鱼、花甲等动物性食品中PCP-Na的快速检测。该方法展现出优异的特异性,与结构类似物(2,4-二氯酚、2,4,6-三氯酚、苯酚)无显著交叉反应,且方法准确性检测结果与确证结果一致,充分满足实际检测要求。该方法具有灵敏、准确、前处理步骤简单等特点,可应用于动物性食品中PCP-Na残留的大批量快速筛选,为动物性食品中PCP-Na残留日常监督提供一定理论依据和有效的技术支持。未来将持续关注PCP-Na半抗原结构差异对免疫效果和检测灵敏度的影响,不断更新优化单克隆抗体制备,并探索使用多样化的免疫原及异源包被原,以期进一步提升GICA法的检测灵敏度与抗干扰能力,实现更快速、更精准的现场检测,有效应对食品安全领域日益复杂的挑战。
[1] 何正和, 陆井莲, 姜颖慧, 等.水产品中五氯苯酚及其钠盐检测技术研究进展[J].食品安全导刊, 2023(9):13-15.HE Z H, LU J L, JIANG Y H, et al.Research progress in detection technology of pentachlorophenol and its sodium salt in aquatic products[J].China Food Safety Magazine, 2023(9):13-15.
[2] ZHANG W X, TANG Y, HAN Y, et al.Immunotoxicity of pentachlorophenol to a marine bivalve species and potential toxification mechanisms underpinning[J].Journal of Hazardous Materials, 2022, 439:129681.
[3] YANG L H, ZHA J M, WANG Z J.Pentachlorophenol affected both reproductive and interrenal systems:In silico and in vivo evidence[J].Chemosphere, 2017, 166:174-183.
[4] 陈彦宏, 黄松, 陈穗, 等.五氯酚及其钠盐的样品前处理和分析检测技术研究进展[J].食品安全质量检测学报, 2019, 10(14):4465-4473.CHEN Y H, HUANG S, CHEN S, et al.Research progress of sample pretreatment and analytical techniques for determination of pentachlorophenol and sodium pentachlorophenate[J].Journal of Food Safety &Quality, 2019, 10(14):4465-4473.
[5] ZHANG X N, KANG H, PENG L Z, et al.Pentachlorophenol inhibits CatSper function to compromise progesterone’s action on human sperm[J].Chemosphere, 2020, 259:127493.
[6] 阮鑫, 陆春波, 屈健.畜禽产品中五氯酚酸钠残留危害与分析[J].中国畜禽种业, 2022, 18(1):54-56.RUAN X, LU C B, QU J.Harm and analysis of sodium pentachlorophenol residue in livestock and poultry products[J].The Chinese Livestock and Poultry Breeding, 2022, 18(1):54-56.
[7] 张秀芹, 王玉晶, 李胤楠, 等.动物源产品中五氯酚来源探讨及危害分析[J].食品安全质量检测学报, 2021, 12(19):7840-7845.ZHANG X Q, WANG Y J, LI Y N, et al.Discussion on source and hazard analysis of pentachlorophenol in animal-derived products[J].Journal of Food Safety &Quality, 2021, 12(19):7840-7845.
[8] MAHESHWARI N, KHAN A A, MAHMOOD R, et al.Pentachlorophenol-induced hemotoxicity diminishes antioxidant potential and oxidizes proteins, thiols, and lipids in rat blood:An in vivo study[J].Heliyon, 2023, 9(5):e16240.
[9] HUANG S R, CHANG J L, XU Z L, et al.Robust and bioaffinity-enhanced nanocarrier based immunochromatographic assay with simplified sample preparation for pentachlorophenol sodium in animal tissues[J].Talanta, 2024, 267:125190.
[10] 李容. 固相萃取-气相色谱质谱法测定鸡肉中五氯酚钠的研究[J].食品安全导刊, 2019(30):105.LI R.Determination of sodium pentachlorophenol in chicken by solid phase extraction-gas chromatography-mass spectrometry[J].China Food Safety Magazine, 2019(30):105.
[11] 潘明迪. 液相色谱-三重四极杆串联质谱结合QuEChERS测定牛百叶中五氯酚酸钠的含量[J].食品安全导刊, 2023(12):45-47;53.PAN M D.Determination of sodium pentachlorophenate in bovine louver by liquid chromatography-triple quadrupole tandem mass spectrometry combined with QuEChERS[J].China Food Safety Magazine, 2023(12):45-47;53.
[12] 张美, 朱莉莎, 徐飘飘, 等.高效液相色谱—串联质谱法检测鸡蛋中五氯酚钠药物残留研究[J].现代畜牧兽医, 2023(3):19-22.ZHANG M, ZHU L S, XU P P, et al.Determination of pentachlorophenol sodium residues in eggs by high performance liquid chromatography tandem mass spectrometry[J].Modern Journal of Animal Husbandry and Veterinary Medicine, 2023(3):19-22.
[13] DONG S, GUAN L J, ZHAO Y, et al.A dual-signal immunochromatographic assay using quantum dots and polydopamine coated gold nanoparticles for detection of sodium pentachlorophenate in animal-derived food[J].Microchemical Journal, 2022, 183:108070.
[14] DONG S, SHI Q Y, GUAN L J, et al.Preparation of monoclonal antibody and establishment of indirect competitive chemiluminescence enzyme immunoassay for sodium pentachlorophenolate[J].Microchemical Journal, 2024, 196:109674.
[15] HUANG S R, CHEN Z Y, WANG Y C, et al.Post-synthetic modification fluorescence UiO-66-Eu immunochromatography for high-performance detection of sodium pentachlorophenoate[J].Journal of Hazardous Materials, 2024, 480:135824.
[16] 龚蕾, 周陶鸿, 彭青枝, 等.免疫层析法快速检测动物源性食品中五氯酚酸钠含量[J].食品安全质量检测学报, 2022, 13(3):888-893.GONG L, ZHOU T H, PENG Q Z, et al.Rapid determination of sodium pentachlorophenolate in animal-derived foods by immunochromatography[J].Journal of Food Safety &Quality, 2022, 13(3):888-893.
[17] 罗晓琴, 韩深, 吕艳秋, 等.五氯酚钠胶体金快速检测试纸条的研制[J].安徽农业科学, 2016, 44(25):55-57.LUO X Q, HAN S, LU Y Q, et al.Study on gold immunochromatography assay for rapid detection of pentachlorophenol-Na[J].Journal of Anhui Agricultural Sciences, 2016, 44(25):55-57.
[18] 余宇燕, 张淑玲, 邹艳辉, 等.五氯酚免疫层析检测试纸条的研究[J].分析测试学报, 2014, 33(7):830-834.YU Y Y, ZHANG S L, ZOU Y H, et al.Preparation of colloidal gold immunochromatography strip for detection of pentachlorophenol[J].Journal of Instrumental Analysis, 2014, 33(7):830-834.
[19] ZHANG X Y, BAI Y C, TANG Q Q, et al.Development of epitopephore-based rational hapten design strategy:A combination of theoretical evidence and experimental validation[J].Journal of Hazardous Materials, 2023, 445:130615.
[20] ZHANG L W, WANG J C, WANG Y T, et al.Preparation of monoclonal antibodies recognizing pharmacologically active metabolites of metamizole based on rational hapten design and their application in the detection of animal-derived food[J].Talanta, 2024, 280:126753.
[21] LIANG J X, LIU Z W, FANG Y L, et al.Two kinds of lateral flow immunoassays based on multifunctional magnetic Prussian blue nanoenzyme and colloidal gold for the detection of 38 β-agonists in swine urine and pork[J].Food Chemistry, 2023, 417:135897.
[22] KAKKAR S, GUPTA P, SINGH YADAV S P, et al.Lateral flow assays:Progress and evolution of recent trends in point-of-care applications[J].Materials Today Bio, 2024, 28:101188.