沙棘(Hippophae rhamnoides Linn.)又名沙枣、酸柳,可以在干旱、盐碱以及低温等极端环境下生长[1]。沙棘作为一种药食同源植物,其根、茎、叶及果实等部位都具有丰富的营养成分及药用价值[2-4]。沙棘果口感酸甜,不仅蕴含蛋白质、维生素、氨基酸等多元营养成分,更含有黄酮类化合物、三萜酸和生物碱类、有机酸、脂肪酸等具有抗炎、抗氧化功能的活性物质,对人体有较高的营养价值[5-10]。沙棘果酒通过发酵工艺创新不仅有效保存了沙棘的活性成分与天然果香特质,同时能满足人们对营养食品的追求,显示出良好的商业前景。
目前,果酒酿造大多选用成熟的商业酿酒酵母,以保证酒品的稳定性。但因沙棘是典型的高酸低糖型水果,在发酵过程中,菌株暴露于各种环境压力之下,包括酸胁迫、高渗胁迫、氧化应激、乙醇胁迫以及发酵后期的冷胁迫。这些压力会导致细胞结构发生改变,降低细胞活力、适应性以及功能,并最终影响发酵致使果酒品质降低。
本研究利用耐酸酿酒酵母HJ-U17以及商业酵母Angel-RW及Excellence-Ds发酵沙棘果酒,并利用高效液相色谱(high performance liquid chromatography,HPLC)及顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)结合气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)技术测定沙棘果酒的有机酸及挥发性化合物,结合多元统计分析耐酸酿酒酵母发酵沙棘果酒品质特征及挥发性香气成分,为今后探寻形成沙棘果酒风味品质差异的原因提供依据。
1 材料与方法
1.1 材料与试剂
耐酸酿酒酵母HJ-U17由本实验室保存;Angel-RW果酒酵母,安琪酵母股份有限公司;Excellence-Ds果酒酵母,法国Lamothe-Abiet公司;沙棘原浆,甘肃艾康沙棘制品有限公司;有机酸、2-辛醇分析标准品,美国Sigma-Aldrich公司。其他化学品均购自国药集团。
1.2 仪器与设备
HZQ-F100全温振荡培养箱,苏州培英实验设备有限公司;FA2104N电子分析天平,上海菁海仪器有限公司;LRH-150 恒温培养箱,上海一恒科学仪器有限公司;SX-500 蒸汽灭菌仪,日本 TOMY公司;P0-1000单道移液器,梅特勒-托利多仪器有限公司;1260 Infinity Ⅱ高效液相色谱、8890-7000D气相色谱质谱联用仪,美国Agilent公司;SW-CJ-2FD双人单面垂直净化工作台,哈尔滨市东联公司。
1.3 试验方法
1.3.1 沙棘果酒的酿造
菌株在30 ℃下于酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基中活化后,在YPD培养基中180 r/min、30 ℃培养至对数生长期。用无菌水洗涤后,制成用于沙棘汁发酵的种子液。利用经单因素及响应面试验优化得到的结果对沙棘果酒进行发酵,其具体参数为:沙棘果汁中沙棘原浆含量为26.2%(体积分数),蔗糖添加量252.7 g/L,接种量7%,在23 ℃下进行11 d发酵。
1.3.2 理化指标分析
根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》对总酸度、含糖量和酒精含量进行测定。总酸度和总糖分别用NaOH溶液和斐林试剂滴定,酒精含量则将酒样蒸馏后利用酒精计测定。
1.3.3 有机酸测定
使用1260 Infinity Ⅱ系统配备ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相为0.01 mol/L (NH4)2HPO4(pH 2.7);流速0.5 mL/min;检测波长210 nm。样品经 0.22 μm 的滤膜孔过滤,进样量10 μL。
1.3.4 挥发性成分分析
利用HS-SPME-GC-MS技术测定沙棘果酒中的挥发性成分。使用2-辛醇(50 μg/L)作为内标物对沙棘果酒挥发性成分进行半定量分析。
HS-SPME 条件:采用50 μm/30 μm CAR/DVB/PDMS 的 SPME 纤维萃取头萃取风味物质;准确移取 8 mL 样品和 10 μL 内标以及1 g NaCl于 20 mL 萃取瓶中,于 50 ℃下萃取 40 min。
GC-MS 条件:采用 DB-Wax 色谱柱(60 m×0.25 mm×0.25 μm),以He作为载气,流速1.0 mL/min。进样口温度和检测器温度 250 ℃,离子源温度 200 ℃。MS 条件:EI 为电离源,电子能量70 eV,扫描范围 32.0~350.0 m/z。升温程序:初始温度 40 ℃,保持 4 min,以 5 ℃/min升温至 250 ℃,保持7 min。所有挥发性成分的质谱与美国国家标准与技术研究所(National Institute of Standards and Technology,NIST)20数据库进行比较,并且按公式(1)计算其相对气味活性值(relative odor activity value, ROAV)。
(1)
式中:ρi,成分i的相对质量浓度,μg/L;ρmax,OAV最高成分的相对质量浓度,μg/L;OTmax/OTi,阈值比值。
1.3.5 统计分析
实验进行了3次重复,数据表示为“平均值±标准差”。采用SPSS 27进行统计分析,采用单因素方差分析(ANOVA)和Duncan的多重范围测试以及t检验来确定P<0.05时的显著差异。使用MetaboAnalyst 6.0通过偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)进一步分析挥发性轮廓。使用TBtools-II版本2.012软件生成热力图。图表由Origin 2021软件绘制。
2 结果与分析
2.1 沙棘果酒理化指标及有机酸分析
如表1所示,经HJ-U17发酵得到的沙棘果酒总糖含量8.34 g/L,总酸11.23 g/L,可溶性固形物含量4.77°Brix,显著低于Angel-RW及Excellence-Ds发酵酒样(P<0.05);酒精度达到11.17%vol,显著高于Angel-RW及Excellence-Ds发酵酒样(P<0.05)。这可能是由于沙棘果汁的pH较低,具有更强耐酸性的酿酒酵母HJ-U17在此环境中具有更好的发酵性能。沙棘果酒中有机酸主要来源于果实本身,少部分来源于发酵过程。苹果酸作为沙棘果酒中的主要有机酸,对沙棘果酒的酸味贡献最大。在经过不同酿酒酵母发酵后,HJ-U17发酵酒样中苹果酸含量显著低于其余2种商业酿酒酵母发酵酒样(P<0.05),这可更有效缓解沙棘本身的尖酸口感。柠檬酸含量同样显著低于其他2组酒样(P<0.05)。在不同菌株发酵酒样间酒石酸含量没有显著差异。HJ-U17发酵酒样中琥珀酸含量显著低于Angel-RW发酵酒样,琥珀酸主要由酵母在发酵过程中代谢产生,其不仅提供酸度,还有助于果酒风味的形成,并在发酵阶段促进更丰富的酯类物质生成[11];乙酸是评估果酒发酵过程中是否被污染以及储存是否变质的重要指标,3株菌发酵的酒样乙酸含量均低于1.2 g/L,符合国家轻工行业标准QB/T 5476—2020《果酒通用技术要求》。
表1 沙棘果酒理化指标及有机酸含量
Table 1 Physicochemical indicators and organic acid content of sea buckthorn wine
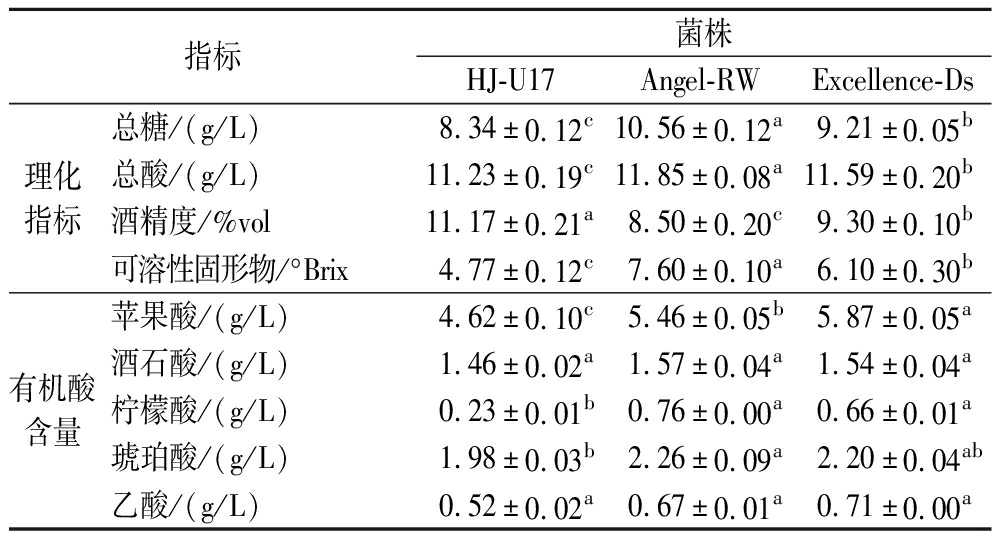
指标菌株HJ-U17Angel-RWExcellence-Ds理化指标总糖/(g/L)8.34±0.12c10.56±0.12a9.21±0.05b总酸/(g/L)11.23±0.19c11.85±0.08a11.59±0.20b酒精度/%vol11.17±0.21a8.50±0.20c9.30±0.10b可溶性固形物/°Brix4.77±0.12c7.60±0.10a6.10±0.30b有机酸含量苹果酸/(g/L)4.62±0.10c5.46±0.05b5.87±0.05a酒石酸/(g/L)1.46±0.02a1.57±0.04a1.54±0.04a柠檬酸/(g/L)0.23±0.01b0.76±0.00a0.66±0.01a琥珀酸/(g/L)1.98±0.03b2.26±0.09a2.20±0.04ab乙酸/(g/L)0.52±0.02a0.67±0.01a0.71±0.00a
2.2 沙棘果酒挥发性香气成分分析
2.2.1 不同酿酒酵母发酵沙棘果酒挥发性成分组分及含量
挥发性成分的组成及含量对沙棘果酒的品质尤为重要[12]。如图1所示,在3组酒样中共鉴定主要挥发性成分69种,HJ-U17发酵酒样挥发性成分种类最为丰富(图1-c),这些物质主要涉及醇、醛、酸、酯、酮、呋喃、萜烯以及一些其他类物质,其中醇类物质11种、醛类物质5种、酸类物质5种、酯类物质29种、酮类物质2种、呋喃类物质3种、萜烯类物质12种(图1-a)。不同酿酒酵母发酵的沙棘果酒样品中挥发性成分主要在于酯类物质的含量及萜烯类物质的组成有所区别。

a-不同酿酒酵母发酵沙棘果酒挥发性成分聚类热图;b-挥发性成分种类及含量;c-挥发性成分韦恩图
图1 沙棘果酒挥发性化合物含量及组成
Fig.1 Volatile compound content and composition of sea buckthorn wine
注:不同小写字母表示差异显著(P<0.05)(下同)。
如图1-b所示,在3组样品中酯类化合物含量最高,占挥发性成分总量的60.01%~67.96%。值得注意的是乙酸乙酯、己酸乙酯,辛酸乙酯及癸酸乙酯是沙棘果酒中主要的乙酯挥发性香气成分,在HJ-U17发酵酒样中辛酸乙酯含量较高,占总酯含量的35.51%;而在Angel-RW及Excellence-Ds发酵酒样中癸酸乙酯含量较高分别占其总酯含量的42.59%及48.59%。果酒中酯类物质主要由微生物酯酶催化生成,包括酰基辅酶A与乙醇反应生成乙酯,乙酰辅酶A与高级醇反应生成乙酸酯等[13]。在酸胁迫条件下,酵母细胞趋向于延长脂肪酸链以及增加不饱和度来抵抗酸性压力。由于Angel-RW及Excellence-Ds的耐酸能力低于HJ-U17,因此在发酵沙棘果酒过程中Angel-RW及Excellence-Ds代谢产生的脂肪酸与醇类发生酯化反应,生成了大量的中长链脂肪酸酯,这类物质的过量存在会给果酒带来不良的脂肪气味。
醇类化合物占沙棘果酒挥发性成分总量的21.67%~31.94%,醇类物质中含量较高的主要有苯乙醇、异戊醇、辛醇和异丁醇,不同酿酒酵母发酵沙棘果酒酒样的醇类物质含量及组成有较大差异,HJ-U17发酵酒样醇类物质含量高达11 183.86 μg/L是Angel-RW和Excellence-Ds发酵酒样的3.03倍及1.05倍(P<0.05)。这些高级醇主要通过氨基酸分解代谢的Ehrlich途径产生,并且它们的形成很大程度上取决于所用的酵母菌株。
沙棘果酒中酸类物质可以通过微生物的各种生化反应合成。在3组酒样中辛酸含量较高,它不仅有助于在果酒中积累特征风味化合物,并可作为酯合成的前体,增强酒样品的香味,强调其他芳香化合物的存在,有助于总体风味平衡。
萜烯类化合物主要来源于酿酒过程中酵母产生的β-葡萄糖苷酶,促进了游离萜类、苯基丙烯类和特定脂肪酸酯的释放[14]。由于高酸环境能够破坏细胞内的酸碱平衡,干扰细胞壁与质膜的正常功能,抑制细胞内多种酶活性。因此在3组酒样中,具有较强耐酸性的HJ-U17发酵酒样中萜烯类化合物种类显著高于其他2组酒样,例如芳樟醇、橙花叔醇、金合欢醇、香叶基丙酮、α-紫罗兰酮等。这些物质对沙棘果酒的独特风味起着至关重要的作用。
2.2.2 不同酿酒酵母发酵沙棘果酒挥发性成分多元统计分析
采用PLS-DA研究了不同酿酒酵母对沙棘果酒挥发性成分的影响。如图2-a所示,组分1和组分2的方差贡献率分别为54.3%和41.4%,累积方差贡献率为95.7%,样本点在组间分散分布,而组内样本独立聚类。并且通过置换检验构建并验证每个模型,以确保其稳定性和预测性能。排列检验结果产生的P值<0.05,表明模型具有统计学显著性(图2-c)。PLS-DA中变量投影重要性(variable importance in the projection,VIP),用于衡量各代谢物积累差异对各组样本分类判别的影响强度和解释能力,VIP值>1为常见的差异代谢物筛选标准。如图2-b所示,共得到VIP值>1的挥发性香气成分20种。在3组酒样中主要差异挥发性成分集中在醇类、酯类及酸类。其中苯甲酸异丁酯、肉豆蔻酸乙酯、安息香醛、癸酸、乙酸乙酯、癸酸异戊酯、乙酸、辛酸、大马士酮、2-丙酰呋喃、2-羟乙基苯甲酸酯及2-戊酰呋喃与Excellence-Ds发酵酒样有强相关性,甲基庚烯酮、琥珀酸二乙酯与HJ-U17发酵酒样有强相关性,丙三醇、辛酸异丁酯、辛醇、呋喃甲酸丁酯、异丁醇及琥珀酸单乙酯与Angel-RW发酵酒样有强相关性。上述结果表明,不同酿酒酵母菌株通过差异调控醇类、酯类及酸类等20种关键挥发性成分的合成(VIP>1),形成了沙棘果酒独特的挥发性成分代谢谱。
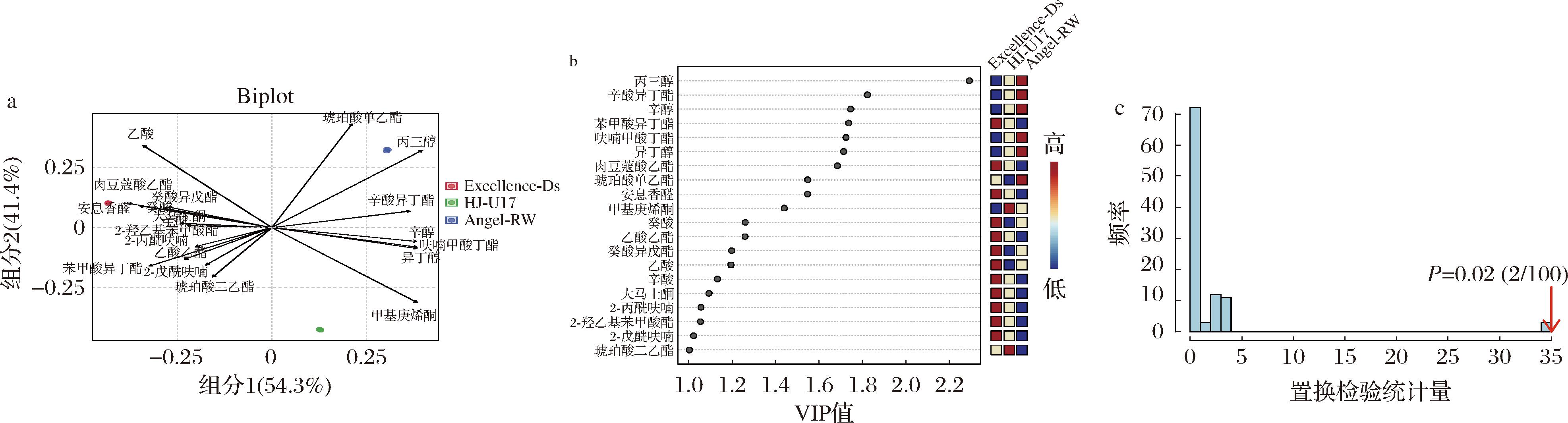
a-不同酿酒酵母发酵沙棘果酒挥发性成分PLS-DA两点图;b-VIP值图;c-置换检验结果图
图2 沙棘果酒挥发性化合物PLS-DA结果
Fig.2 PLS-DA results of volatile compounds in sea buckthorn wine
2.3 ROAV分析
2.3.1 沙棘果酒挥发性成分组分及含量ROAV分析
通常认为气味活度值(odor acitivity value,OAV)>1 的物质才对果酒的香气有实质性贡献,OAV 越大的挥发性风味化合物对酒体的整体香气贡献越大[15-17]。但有研究表明,某些挥发性成分即使在浓度和阈值相对较低的情况下也会显著影响香气特征,因此ROAV可用于鉴定样品中关键芳香化合物[18-19]。当挥发性香气成分的ROAV≥1时,被认为是关键芳香化合物,而0.1≤ROAV<1的挥发性成分被认为在调节样品的芳香方面起着重要作用[20]。由表2可知,在3组样品中共得到ROAV≥0.1的挥发性香气成分22种,其中HJ-U17发酵酒样20种,Excellence-Ds发酵酒样15种,Angel-RW发酵酒样14种,共有关键挥发性香气成分(ROAV≥1)包括异戊醇、乙酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯以及乙酸异戊酯,这些物质赋予沙棘果酒样品丰富的果香。此外,在HJ-U17发酵酒样中还存在芳樟醇、α-松油醇及大马士酮等萜烯类化合物赋予了酒样甜美的花香,Angel-RW发酵酒样中的3-苯丙酸乙酯赋予了样品玫瑰香气。
表2 沙棘果酒挥发性化合物ROAV
Table2 ROAV of volatile compounds in sea buckthorn wine

序号呈香物质气味描述阈值/(μg/L)[21]ROAVHJ-U17Angel-RWExcellence-Ds1庚醇柑橘 5.40 0.22 ND ND2壬醇玫瑰、甜橙45.50 0.25 NDND3异戊醇麦芽4.00 31.86 23.82 20.55 4苯乙醇蜂蜜、玫瑰564.23 0.30 0.71 0.44 5壬醛甜橙1.10 0.74 NDND6癸醛花香3.00 0.15 NDND7苯乙醛风信子6.30 0.24 0.46 0.48 8乙酸乙酯果香、甜味5.00 7.32 3.24 5.17 9丁酸乙酯苹果、菠萝0.90 1.48 ND0.40 10己酸乙酯苹果1.00 67.83 20.27 20.31 11庚酸乙酯菠萝1.90 2.21 1.42 1.01 12辛酸乙酯菠萝19.30 11.26 21.04 13.70 13癸酸乙酯椰子5.00 37.58 100.00 100.00 14苯甲酸乙酯依兰花55.56 ND0.14 0.09 15乙酸苯乙酯玫瑰、茉莉19.00 0.62 0.93 0.45 163-苯丙酸乙酯风信子、玫瑰1.60 0.48 1.03 0.38 17乙酸异戊酯香蕉0.15 100.00 44.53 22.61 18芳樟醇薰衣草0.80 3.26 NDND19α-松油醇茴香、花香4.60 1.42 0.91 0.31 20大马士酮蜂蜜、花香0.90 1.06 ND1.34 21紫罗兰酮紫罗兰5.70 0.10 NDND22苯乙烯花香65.00 ND0.22 0.14
注:“ND”表示未检测到或ROAV<0.1。
2.3.2 关键挥发性香气成分多元统计分析
通过PLS-DA鉴别3组沙棘果酒样品中ROAV≥0.1挥发性香气成分,结果如图3所示。由图3-a可知,组分1和组分2的方差贡献率分别为55%和40.9%,累积方差贡献率为95.9%,样本点在组间分散分布,而组内样本独立聚类。置换检验的P值<0.05,表明模型具有统计学显著性(图3-c)。共得到VIP值>1的挥发性香气成分10种(图3-b),3组酒样中关键呈香物质主要区别于酯类,苯甲酸乙酯、苯乙烯、苯乙醇、癸酸乙酯、乙酸乙酯及辛酸乙酯与Excellence-Ds发酵酒样有强相关性,丁酸乙酯、己酸乙酯及乙酸异戊酯与HJ-U17发酵酒样有强相关性,3-苯丙酸乙酯与Angel-RW发酵酒样有强相关性。结果表明,不同酿酒酵母由于对酯类物质合成与积累的代谢差异,塑造了3组独特的沙棘果酒香气特征轮廓,其菌株特异性与关键呈香物质的强关联性,揭示了酵母代谢功能对果酒风味轮廓的决定性作用。
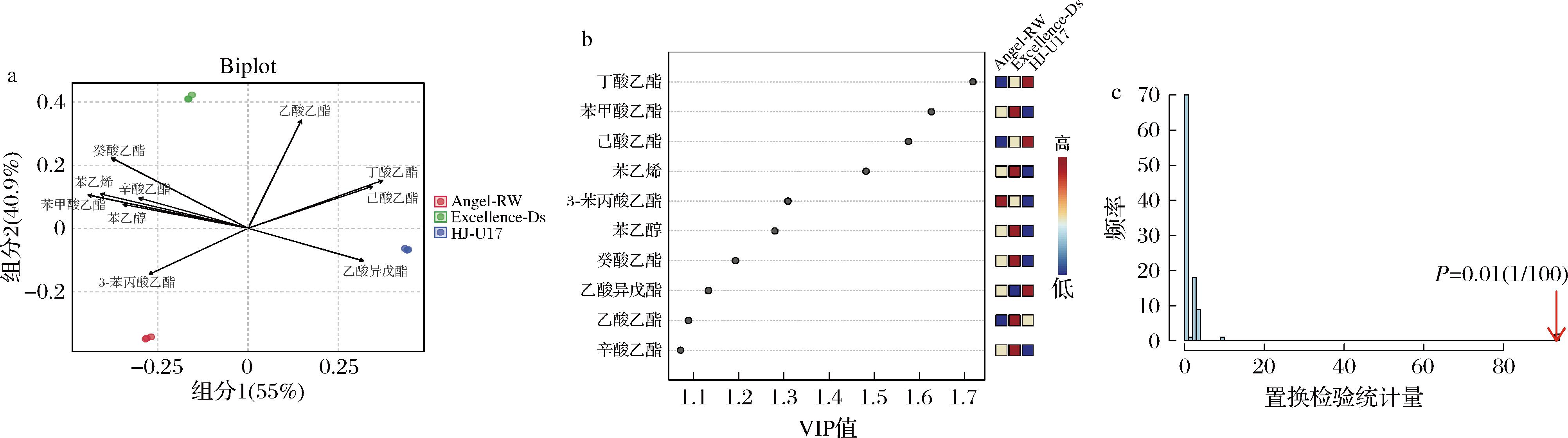
a-ROAV≥0.1挥发性香气成分PLS-DA两点图;b-VIP值图;c-置换检验结果图
图3 沙棘果酒关键挥发性化合物PLS-DA结果
Fig.3 PLS-DA results of key volatile compounds in sea buckthorn wine
3 结论
本研究对耐酸酿酒酵母HJ-U17以及商业酿酒酵母Angel-RW和Excellence-Ds发酵沙棘果酒的品质进行分析。研究发现,HJ-U17发酵酒样的残糖、总酸及可溶性固形物含量低,酒精度高;苹果酸、酒石酸及柠檬酸含量下降更多,琥珀酸、乙酸生成量更少,具有较好的风味品质。不同酿酒酵母发酵的沙棘果酒样品中挥发性香气成分主要区别于酯类物质含量及萜烯类物质组成。HJ-U17发酵沙棘果酒可产生更多种类的挥发性成分,其中醇类、酮类、呋喃类及萜烯类物质含量较高。对全部挥发性成分进行PLS-DA发现,3组酒样中的20种差异挥发性化合物构成了沙棘果酒独特的挥发性成分代谢谱。结合ROAV分析发现3组酒样中10种关键香气化合物对沙棘果酒的特征香气有显著的影响,塑造了3组独特的沙棘果酒香气特征轮廓,其菌株特异性与关键呈香物质的强关联性,揭示了酵母代谢功能对果酒风味轮廓的决定性作用。本研究为今后探寻形成沙棘果酒风味品质差异的原因提供依据。
[1] ERCISLI S, ORHAN E, OZDEMIR O, et al.The genotypic effects on the chemical composition and antioxidant activity of sea buckthorn (Hippophae rhamnoides L.) berries grown in Turkey[J].Scientia Horticulturae, 2007, 115(1):27-33.
[2] WANI T A, WANI S M, AHMAD M, et al.Bioactive profile, health benefits and safety evaluation of sea buckthorn (Hippophae rhamnoides L.):A review[J].Cogent Food and Agriculture, 2016, 2(1).
[3] 盛艳, 吴泽柱.沙棘的营养保健功能及其开发利用研究进展[J].农产品加工, 2017(17):58-60;63.SHENG Y, WU Z Z.Research progress in nutrition and health care functions of sea buckthorn and its development and utilization[J].Farm Products Processing, 2017(17):58-60;63.
[4] 王宏昊, 孙欣, 花圣卓, 等.我国沙棘药用历史记载及药品开发现状[J].国际沙棘研究与开发, 2012(4):25-28.WANG H H, SUN X, HUA S Z, et al.Historical record and current situation of pharmaceutical R &D about seabuckthorn in China[J].The Global Seabuckthorn Research and Development, 2012(4):25-28.
[5] MA Q G, HE N X, HUANG H L, et al.Hippophae rhamnoides L.A comprehensive review on the botany, traditional uses, phytonutrients, health benefits, quality markers, and applications[J].Journal of Agricultural and Food Chemistry, 2023, 71(12):4769-4788.
[6] SYTA OV
OV I, ORSAVOV
I, ORSAVOV J, SNOPEK L, et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of sea buckthorn (Hippopha⊇ rhamnoides L.) berries and leaves of diverse ripening times[J].Food Chemistry, 2020, 310:125784.
J, SNOPEK L, et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of sea buckthorn (Hippopha⊇ rhamnoides L.) berries and leaves of diverse ripening times[J].Food Chemistry, 2020, 310:125784.
[7] ZHANG G K, LIU Y F, LIU P.Active components from sea buckthorn (Hippophae rhamnoides L.) regulate hepatic stellate cell activation and liver fibrogenesis[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12257-12264.
[8] 张二豪, 何萍, 刘盼盼, 等.西藏沙棘酵母菌的分离鉴定及其产香特性分析[J].食品科学, 2022, 43(20):207-215.ZHANG E H, HE P, LIU P P, et al.Identification and aroma-producing characteristics of yeast strains isolated from Tibet-grown Hippophaer hamnoides[J].Food Science, 2022, 43(20):207-215.
[9] 魏晨业, 包晓玮, 王娟, 等.沙棘多糖分离纯化及抗氧化活性[J].食品科学, 2021, 42(4):227-232.WEI C Y, BAO X W, WANG J, et al.Isolation, purification and antioxidant activity of polysaccharides from the fruit of Hippophae rhamnoides[J].Food Science, 2021, 42(4):227-232.
[10] MA Q G, WEI R R, SHANG D L, et al.Structurally diverse flavonolignans with immunosuppressive and neuroprotective activities from the fruits of Hippophae rhamnoides L.[J].Journal of Agricultural and Food Chemistry, 2020, 68(24):6564-6575.
[11] HE Y, WANG X Y, LI P H, et al.Research progress of wine aroma components:A critical review[J].Food Chemistry, 2023, 402:134491.
[12] CARPENA M, FRAGA-CORRAL M, OTERO P, et al.Secondary aroma:Influence of wine microorganisms in their aroma profile[J].Foods, 2020, 10(1):51.
[13] CHEN L H, LIU B, LI D N, et al.Effects of fermentation on flavor and antioxidant activity in ginkgo rice wine[J].Food Bioscience, 2023, 53:102652.
[14] ZHANG P Z, ZHANG R G, SIRISENA S, et al.Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics:A mini-review[J].Food Microbiology, 2021, 100:103859.
[15] ZHU J C, CHEN F, WANG L Y, et al.Characterization of the key aroma volatile compounds in cranberry (Vaccinium macrocarpon ait.) using gas chromatography-olfactometry (GC-O) and odor activity value (OAV)[J].Journal of Agricultural and Food Chemistry, 2016, 64(24):4990-4999.
[16] CHEN Y, ZHANG W, YI H, et al.Microbial community composition and its role in volatile compound formation during the spontaneous fermentation of ice wine made from Vidal grapes[J].Process Biochemistry, 2020, 92:365-377.
[17] NICOLLI K P, BIASOTO A C T, SOUZA-SILVA É A, et al.Sensory, olfactometry and comprehensive two-dimensional gas chromatography analyses as appropriate tools to characterize the effects of vine management on wine aroma[J].Food Chemistry, 2018, 243:103-117.
[18] LIU J J, WAN Y, CHEN Y R, et al.Evaluation of the effect of Torulaspora delbrueckii on important volatile compounds in navel orange original brandy using E-nose combined with HS-SPME-GC-MS[J].Food Chemistry, 2024, 453:139625.
[19] LI S Q, BI P F, SUN N, et al.Characterization of different non-Saccharomyces yeasts via mono-fermentation to produce polyphenol-enriched and fragrant kiwi wine[J].Food Microbiology, 2022, 103:103867.
[20] QIN Y N, XU H T, SUN J S, et al.Succession of microbiota and its influence on the dynamics of volatile compounds in the semi-artificial inoculation fermentation of mulberry wine[J].Food Chemistry:X, 2024, 21:101223.
[21] 里奥·范海默特.化合物嗅觉阈值汇编[M].北京:科学出版社, 2018.VAN GEMERT L J.Compilation of Compound Olfactory Thresholds[M].Beijing:Science Press, 2018.