低温保存领域中低温冷链技术缓解了食品、微生物等在低温贮藏期间冰晶不规律生长以及重结晶现象,并且一系列新技术迭代提升了冷链物流效率[1]。但低温下依旧存在波动不稳定的现象,而导致贮存食品、生物体等受到重结晶的影响,细胞膜受到机械损伤而影响其品质。目前,科研学者和专业研发人员正尝试应用不同类型的思路去保护食品、生物体等的品质,降低损伤品质的不利因素[2]。
研究发现,抗冻保护剂是一种高效且能缓解食品品质下降的方法之一。目前在商业领域中广泛应用的抗冻剂一般为糖类、醇类及其复配物。除此之外,高浓度的糖醇类及多聚磷酸盐类抗冻剂虽能在低温环境下减小冰晶颗粒的形成,但冷链的温度波动会使小冰晶发生重结晶现象,冰晶颗粒变大,破坏食品原本的组织结构,造成营养成分流失,进而导致冷冻食品的品质下降[3]。
不同科学团队的研究发现,由一部分生存于极寒和高海拔地区的生物体在其生存环境中应激产生的抗冻蛋白(antifreeze protein, AFP),可抵抗恶劣的生存环境,提高物种的存活率[4]。AFP的特点是吸附在冰晶表面,并减缓冰晶的重结晶现象,冰晶的形态在AFP的存在下被改变[5]。目前,虽然对天然来源抗冻蛋白进行了广泛实验分析,但其后续研究与商业推广仍面临新的问题。首先,天然生物来源的AFP虽然对于缓解冰晶生长有较好的效果,但其难于大规模纯化限制了其工业化应用;其次,转基因技术在现代工业中的成熟让科研工作者看到了AFP广泛应用的可能性,然而出于对食品安全法律法规的要求,由转基因技术改造后的AFP相关基因在使用限制等方面存在安全问题,规模化应用的愿景难以实现[6-7]。因此,具有高活性的抗冻肽在学术界成为了新的研究对象。本文根据国内外抗冻肽领域的研究,综述了抗冻肽在食品以及其他领域的研究进展,为抗冻肽作为在食品领域的应用的新型抗冻剂提供了理论依据。
1 抗冻肽的简介
抗冻肽,主要来源于鱼类、昆虫、细菌和植物等生物体内,这些生物体主要生长在极寒高海拔地区[8]。抗冻肽根据来源可以分为鱼类抗冻肽、昆虫抗冻肽、细菌抗冻肽和植物抗冻肽4类;按照活性可分为:AFP I~IV以及抗冻糖肽(antifreeze glycoprotein,AFGP)[9]。天然生物体的抗冻肽虽然具有降低被保护生物体冰晶损伤等特质,但其纯化难度高,在工业应用领域受到了一定的限制[10]。
目前在工业领域中应用较为广泛的抗冻肽是食源性抗冻肽,可通过动物皮和食用明胶等原料进行提取和制备。然而其复杂的提取过程和高生产成本,导致产量不稳定,难以满足大范围的生产需求[11]。尽管如此,抗冻肽分子结构的三肽的重复序列,和特定的氨基酸序列长度,对于深入了解抗冻肽如何在低温条件下发挥抗冻效果有着重要意义。这不仅有助于开拓探索其作用机制,而且有助于增加其在食品工业推广应用的前景[12]。
2 抗冻肽的抗冻机理
2.1 抗冻肽的性质
2.1.1 热滞活性
热滞活性是指存在于低温环境中的抗冻蛋白显著降低了溶液的冰点,与熔点之间产生的温度差值[13]。现有的研究发现抗冻蛋白可以与冰晶表面相互结合,冰晶的曲率受到较大的影响,冰晶曲面的蒸汽压力大于平面,从而降低了冰点,其中产生的效应为开尔文(Kelvin)效应[14]。
有研究人员通过分子动力学的模拟实验,发现AFP存在2种不同的结合面[15]。如图1所示,冰结合面可结合在冰核表面上,而非冰结合面则会对冰晶产生相反的效果。当AFP和冰核相互结合后,生成的冰层使得冰核表面的曲率等数值增大,从而影响整个体系中冰点的变化。
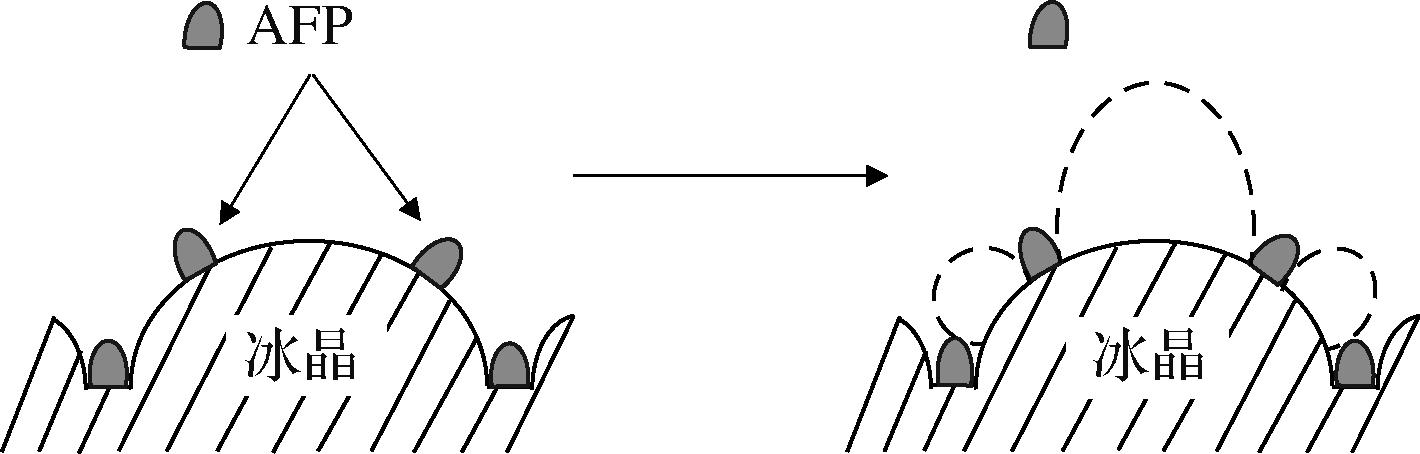
图1 AFPs和冰晶表面结合流程
Fig.1 Illustration of AFPs binding to ice crystal surfaces
另有研究表明,通过堆叠算法等计算机模拟技术准确识别出了AFP中的特定结构域,并从中发现AFP的局部结构域所产生的抗冻活性可独立发挥抗冻作用[16]。KIM等[17]发现抗冻肽的α螺旋构象能够提升其结合冰面的能力,在低温条件下使冰晶结构出现裂缝等现象,成功抑制冰晶的进一步生长,避免被保护对象的功能损失,以上这些现象与开尔文效应中表面曲率调控原理一致。
2.1.2 重结晶抑制活性
重结晶现象的定义是当环境温度和冰点之间产生了差值,冰晶会发生聚集并且会形成更大形态的冰晶,冰晶的形态变化会影响生物体在低温条件下的生存。抗冻肽的存在则大幅度缓解冰晶形态变化所带来的机械损伤,通过疏水相互作用等化学键的作用,冰晶的形态发展得到了抑制[18]。有研究认为,相比热滞活性,重结晶抑制活性对生物体低温生存起到了更重要的作用,抗冻肽的存在能够减缓冰晶形态变化所带来的副作用[19]。
2.1.3 细胞膜保护作用
细胞膜是生物体细胞最外层的屏障,当生物体在低温环境下,细胞会受到影响而形成冰晶,冰晶的产生会对细胞产生机械损伤,细胞膜也受到影响,从而使生物体的活性降低[20]。SHI等[21]证实鱼类AFP通过两亲性结构形成屏障,保护细胞膜免受低温损伤。另外,抗冻肽在多次冻融循环期间减少了冰晶聚集,使得细胞膜免受较大机械应力的影响而破损。MIMI等[22]也报道了抗冻肽在结构上有与天然抗冻AFP相似的亲水性和疏水性结构,这样的结构有助于抗冻肽在细胞膜表面生成保护膜,进一步降低低温环境对于细胞膜的损伤。CHEN等[23]研究发现,细胞膜内部的磷脂双分子层可以和抗冻肽相互结合,从而使细胞得到保护,免受机械损伤(见图2)。
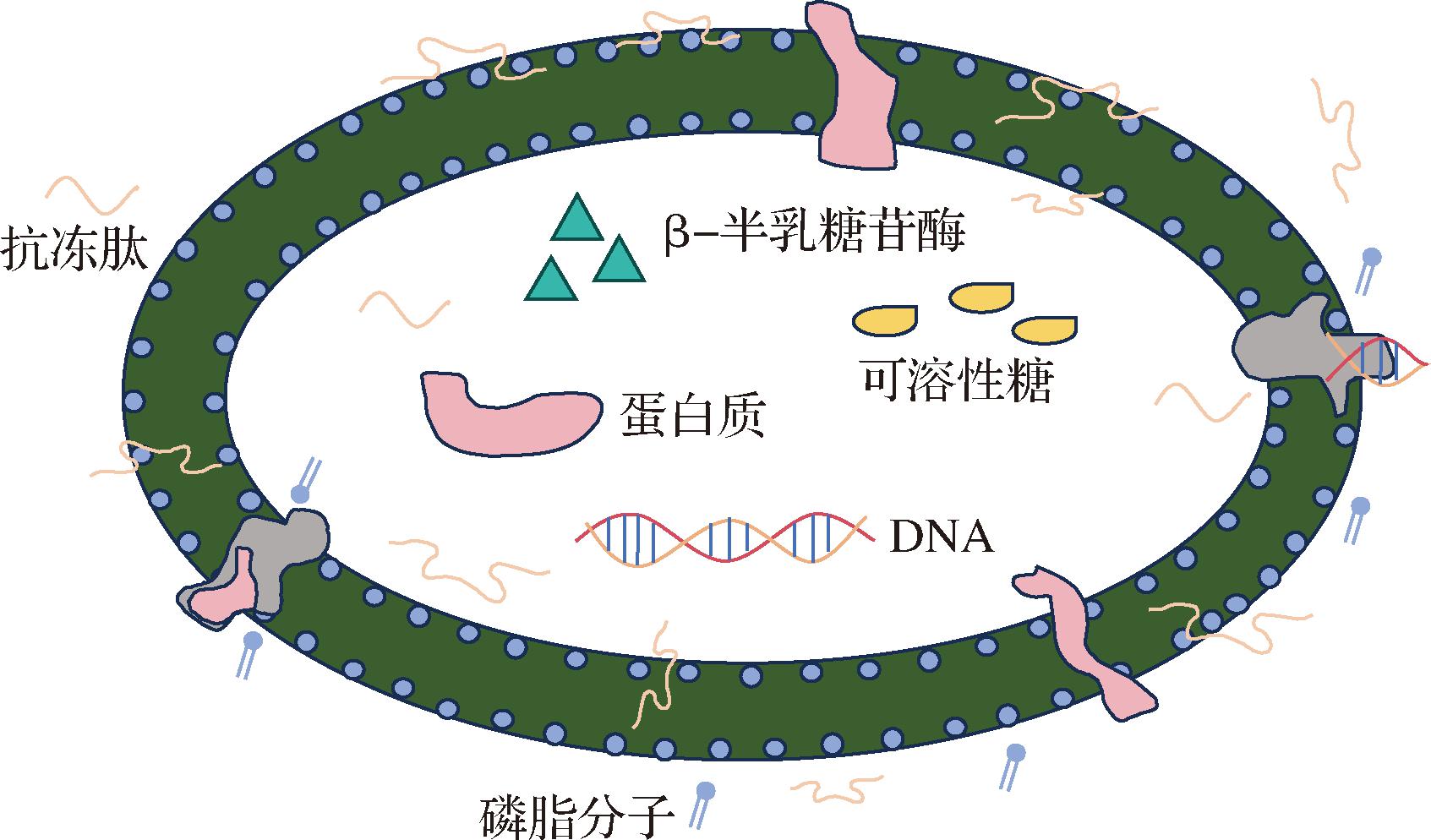
图2 抗冻肽与生物的细胞膜相互作用
Fig.2 Interaction of antifreeze peptides with cell membranes in organisms
2.2 抗冻肽的作用机制
2.2.1 “吸附-抑制”学说
有研究表明,早在1977年RAYMOND等[24]在学术界提出了著名的“吸附-抑制学说”。该学说的核心观点是围绕AFP能吸附在冰晶表面从而抑制其生长。从微观角度上分析冰晶的形态,冰晶是沿着a轴在其表面垂直生长。当冰晶表面有其他分子等物质吸附时,冰晶本身的生长速度和方向发生变化,冰晶曲率明显变大,从而导致冰晶发生形变现象。而“吸附-抑制”学说也同样适用于抗冻肽分子,MADDAH等[25]通过分子动力学模拟研究发现,对抗冻肽的氨基酸残基进行突变,替换亲水、极性和中性氨基酸组分,使得抗冻肽能够和水合物表面相互作用更容易,从而抑制冰晶生长。
2.2.2 亲水互补模型
MARKUS等[26]提出抗冻肽中亲水互补的相关模型,从不同性质的氨基酸分布以及肽链序列编码角度解析亲水和疏水作用的相互结合。在肽链中的亲水性残基主要面向水相,疏水性残基与之不同的是介于肽链之间的界面。从整体肽链结构来看,疏水性残基和亲水性残基之间的分布使得肽链之间结合更加紧密有序。另外,肽链中DNA密码子相互互补,产生了亲水互补性,增加了肽链之间的稳定性,避免疏水表面暴露。
此外,ZHANG等[27]通过分子动力学模型模拟一种具有高生物活性的昆虫AFP,发现其亲水和疏水性基团在抑制水合物方面具有协同效应,通过模型互补性作用可以实现冰晶面的结合,从而阻止了冰晶的进一步生长。
2.2.3 两种学说的对比分析
“吸附-抑制”学说从宏观角度解释了抗冻肽的抗冻机制:通过冰晶形态与生长受抑制的现象,直观阐明抗冻肽在低温下的作用原理。同时,这一理论框架可扩展至抗冻蛋白等具备抗冻性质的物质,具有较广的适用范围。值得注意的是,“吸附-抑制”学说在解析抗冻肽与冰晶之间具体的作用方式存在缺陷,学说内容不够完善和详细。此外,抗冻肽在不同条件下冰晶形态的调控现象无法通过该学说进行全面解析。
相比之下,亲水互补模型在分子层面具有更为详细和微观角度的机制解析。亲水互补模型可详细描述抗冻肽与冰晶之间化学键相关的机制,解析了抗冻肽的特定结构和其抗冻效果之间的联系,为优化抗冻肽在低温条件对不同食品的保护提供了理论依据。然而该模型对于构建提出了较高的要求,需要消耗大量时间在构建以及验证其作用上,该模型对于解析一些结构特征不明显的抗冻肽的抗冻机制存在一定限制。因此,对于不同种类的抗冻肽,应考虑其抗冻机制,综合以上2种学说以达到最佳的应用效果。
2.3 抗冻肽在食品低温保存领域中的应用
现阶段食品工业正处于健康化和本土化的发展阶段,其中跨境电商和食品冷链之间的协同发展,进一步加快了生鲜冷冻食品在全球食品市场中的占比,以满足更多消费者多元化的需求。在整条食品冷链中,低温保存尤为重要,从工厂到消费者手中,要保障食品的风味、质地和营养价值等[28]。然而在冷链中,低温下的冷冻食品会生成冰晶,冰晶的形态会发生变化,甚至还有重结晶现象,使得食品的品质受到损伤。研究表明,抗冻肽可作为新型低温保护剂应用于食品冷冻保存环节,通过抑制冰晶生长与重结晶现象,减少冷冻食品的物理损伤,从而保障食品品质,推动低温冷链上下游的发展[29-30]。
2.3.1 益生菌
在当今食品领域的大健康赛道中,益生菌是一个研究热点。益生菌的研究为人体营养健康、微生物学等学科提供了新视角。然而,其较长的培养周期和较低的稳定性限制了部分研究的进展。在此背景下,冷冻干燥技术作为近年来重点发展的方向之一,已成为实现益生菌高效低温保活的关键手段[31]。益生菌在低温保活过程中,冷冻干燥所带来的细胞代谢活力以及存活率的降低是不可避免的。有研究表明低温保存生物体需要额外添加低温保护剂来维持生物活性和存活率,并且保护剂的添加能够减缓细胞膜的损伤以及抑制冰晶的进一步生长[32]。
多数低温保护剂为羟基化合物,其中甘油因成本效益比高且保护效果显著,成为一种常用的保护剂。研究证实,随着甘油浓度升高,其对细菌冷冻损伤的防护作用逐渐增强[33]。虽然甘油的有效保护作用已被证实,但细胞结构的不可逆损伤以及较低存活率依旧是难以解决的问题。另外客观存在的细胞毒性问题也影响着其低温保护效果[34]。从细胞膜的结构来看,其表面含有大量水分,通过氢键的作用,在磷脂双分子层周围形成了一层水化层,水化层的存在可维持细胞膜的完整性和稳定性。当环境温度远低于冰点时,部分水分转化为不同形态的冰晶,即使是添加高浓度的保护剂,一部分冰晶仍旧会影响细胞活性,降低细胞膜结构的稳定性[35]。SONG等[36]通过利用AFP和多糖混合物作为包埋材料在低温条件下保护益生菌,发现该材料中抗冻肽的参与可以显著提高益生菌的存活率,维持细胞在低温条件下的活性。从微观机理来看,抗冻肽以氢键的形式与细胞膜结合,抑制低温下冰晶对于细胞膜的损伤,减少胞内物质的泄露。BAZZAZ等[37]发现使用益生菌和抗冻肽这样的生物活性物质相互封装,可以让益生菌成分更高效地输送到特定的结肠区域,提高益生菌的生存能力和生物活性,为满足日益增长的功能性食品需求提供了新的思路和研究方向。
虽然抗冻肽为益生菌低温保存领域提供了新的思路,但仍存在一些问题。首先是成本角度,大规模提取和生产抗冻肽的成本较高,给益生菌制造商等上游企业带来了不可避免的问题。其次,抗冻肽的选择需基于益生菌的特异性进行适配性评估,以确保保护高效。由于部分抗冻肽对特定菌株保护效能低下甚至无效,未来研究应通过理性设计或定向进化开发耐寒性增强的新型抗冻肽,并借助结构生物学手段优化现有抗冻肽的构效关系,从而突破益生菌低温保活的技术瓶颈,推动该领域产业化进程。
2.3.2 海鲜
在整个生鲜供应链中,为保障呈现到消费者餐桌上的生鲜品质达到最优,其贮藏的各项条件十分重要。冷冻是海产品贮存常用的方法之一,能在一段时间内保障海产品的质量,但是在冷冻贮藏期间所发生的一系列物理化学变化,如蛋白质变性等影响了产品质量。此外,在海鲜的长时间冷链运输中,温度波动会引发反复冻融循环,冰晶的形态和数量会发生改变,甚至出现重结晶。因此海鲜在供应链中的贮存问题始终是食品行业中面临的巨大挑战。抗冻肽作为低温保存海产品的新型商业抗冻剂,目前已在食品行业,如海产品中得到了应用[38-39]。
鱼糜制品在现代食品加工领域是关注度较高的一类产品,得到了专业人士和普通消费者的高度关注。以往这些产品大都以冷冻保存技术实现长期贮藏,而研究发现抗冻肽的存在使得鱼糜产品中的蛋白质等关键指标有了一定的提升。CHEN等[40]研究了来源于银鲤鱼的抗冻肽(silver carp AFPs,ScAFPs)在鱼糜制品冷冻过程中控制冰晶生长的形态和速率。鱼糜中含有的蛋白质在冻融循环中极易发生变性和氧化,从而降低其品质。而ScAFPs处理过的鱼糜在巯基含量、盐溶性蛋白质浓度和持水能力上得到了显著提升,表面疏水性、羰基含量以及二硫键总含量显著减少,说明抗冻肽可以有效保持鱼糜中蛋白质和活性结构。ScAFPs在冷冻期间动态调节了冰晶大小,经过处理后鱼糜的凝胶性能显著优于未处理的鱼糜,说明抗冻肽在冻融循环中加强了鱼糜的水合作用,从而有效提高了鱼糜的品质和稳定性。YANG等[41]在研究暗纹东方鲀鱼皮抗冻肽(Takifugu obscurus skin AFPs, TsAFPs)的特性时发现,添加量为4%的TsAFPs能维持冷冻鱼糜中蛋白质溶解度,同时抑制内部的肌原纤维蛋白的微观结构变化和变性。TsAFPs和肌球蛋白结合,维持了肌球蛋白的保水能力,从而保障了鱼糜的质地。TsAFPs的特性为鱼糜抗冻保护提供了创新解决方案,深化了其在鱼糜制品中的应用理论基础。
抗冻肽的出现让海鲜产品的低温保存有了新的研究方向,发现其在低温保存中存在稳定性的问题。抗冻肽在海鲜冷冻中发挥抗冻作用时,有概率会因极低的贮藏温度而导致其发生变性或者降解现象,降低其抗冻效果的发挥。另外针对海产品的保护还需考虑到其营养物质的保存、风味等多维需求,而现有的抗冻肽针对于以上需求有一定限制。未来可进一步开发多功能抗冻肽,从而降低冻藏损耗,推动海鲜市场的商业化拓展。
2.3.3 冷冻面团
目前在全球市场中冷冻面团技术广泛应用于面包、蛋糕等烘焙产品,满足全球消费者和专业客户多元化和精细化的需求。冷冻技术对于面团低温保藏是最常见和易用的,但对全球的冷链来说,运输长是弊端,期间冰晶的大小改变以及不同颗粒冰晶的重结晶现象使得面团中的面筋结构发生破坏,导致面团的产气和持气性能削弱,酵母细胞活性大幅度降低甚至死亡,最终导致面团出现干裂、发硬等品质上的劣变,降低相关产品的生产效率[42-43]。为应对冷冻面团在冻藏过程中由冰晶生长和酵母失活导致的品质劣变,如比容下降、质地硬化,近年来研究聚焦于开发新型抗冻剂,以期通过抑制蛋白变性及维持面团网络结构稳定性,提升其长期贮藏品质。
DING等[44]在研究大麦抗冻肽(barley antifreeze protein, BaAFP-1)对于冷冻的面包面团是否能起到保护作用,分析了影响冷冻面团的相关因素,如流变学性质、发酵性能以及微观结构。最终发现有了BaAFP-1的加持,面包面团在冷冻和解冻循环中的储存模量和损耗模量得到缓解,冰晶的形成和重结晶现象得到抑制。大麦抗冻肽的存在让面团中的产气能力得到保持,使得面筋结构和酵母细胞的活性免受冰晶的损伤。此外,BaAFP-1能够降低面包变硬的速度,减少面包空隙面积的扩张,抗冻肽确实改善了冷冻面团的结构稳定性和发酵性能,维持了其活性,并提高了产品的生产效率。WANG等[45]研究了在寒冷地区生长的冬小麦中的冰结构蛋白(winter wheat ice structuring proteins, WISPs),WISPs的存在起到了保护冻融面团内部结构的作用,面筋网络得到保留,质构特性也得到改善。此外添加量为0.7%(质量分数)WISPs的面团的玻璃化转变温度提高了1.8 ℃,这说明冬小麦来源的冰结构蛋白有效提升了面团的冻融稳定性。
对于冷冻面团来讲,抗冻肽的添加确实有效降低了冷冻过程中冰晶生长的现象,然而在实际应用中,抗冻肽可能会影响冷冻面团的机械性能,从而最终对其发酵后的产品品质产生一定的负面影响。通过基因工程技术的加持来合成新型抗冻肽,可作为改进其抗冻效果的新研究方向,解决冷冻面团性能下降等问题,提升烘焙产品的质量并促进行业的创新发展。
3 结语
低温保存技术在生物资源管理与食品工业中具有关键作用。抗冻肽通过抑制冰晶生长与重结晶提升了产品品质,其在益生菌、海鲜及冷冻面团低温贮存领域的保护效果已获得广泛验证,并较传统糖醇类抗冻剂具有独特优势。当前研究为抗冻肽的食品商业化奠定了理论基础。然而,分子稳定性不足、应用成本高及保护效果的特异性差异,如来源依赖性,仍是产业化的核心瓶颈。未来需着力提升肽结构稳定性与功能多样性,依托基因工程技术优化生产效益,并拓展至生物医药等新兴应用场景。本文综述了近年来抗冻肽的研究进展及其在食品领域的应用,为开发新型抗冻肽及未来进一步研究提供了参考。
[1] 黄虹, 谢如鹤, 杨雅斌, 等. 基于CiteSpace的国内外冷链物流热点及趋势探析[J]. 包装工程, 2024, 45(19):233-246.HUANG H, XIE R H, YANG Y B, et al. Hot spots and trends in cold chain logistics at home and abroad explored based on CiteSpace[J]. Packaging Engineering, 2024, 45(19):233-246.
[2] LISBOA H M, PASQUALI M B, DOS ANJOS A I, et al. Innovative and sustainable food preservation techniques: Enhancing food quality, safety, and environmental sustainability[J]. Sustainability, 2024, 16(18):8223.
[3] 王静静, 廖爱美, 刘莹莹, 等. 抗冻蛋白的制备及其在食品工业的应用研究进展[J]. 食品研究与开发, 2023, 44(24):186-192.WANG J J, LIAO A M, LIU Y Y, et al. Antifreeze proteins: Preparation and application in food industry[J]. Food Research and Development, 2023, 44(24):186-192.
[4] PURWAR S, SRIVASTAVA S. Adaptations of psychrophilic microorganism to low-temperature environments[J]. Applied Microbiology: Theory & Technology, 2024,5(2):76-79.
[5] XIA B, WANG J T, CHEN H H, et al. Recent advances in antifreeze peptide preparation: A review[J]. Molecules, 2024, 29(20):4913.
[6] ZHANG M L, GUO X N, SUN X H, et al. Frozen dough steamed products: Deterioration mechanism, processing technology, and improvement strategies[J]. Comprehensive Reviews in Food Science and Food Safety, 2024, 23(6): e70028.
[7] 章寅, 贾军伟, 白蓝, 等. 转基因检测标准的方法验证工作研究[J]. 生物技术进展, 2024, 14(1):120-124.ZHANG Y, JIA J W, BAI L, et al. Analysis of method validation of transgenic testing standards[J]. Current Biotechnology, 2024, 14(1):120-124.
[8] XIAO S J, HU S Y, ZHU K X, et al. Recent advances, challenges and functional applications of antifreeze protein in food industry[J]. International Journal of Food Science &Technology, 2024, 59(3):1169-1186.
[9] KNIGHT C A, CHENG C C, DEVRIES A L. Adsorption of alpha-helical antifreeze peptides on specific ice crystal surface planes[J]. Biophysical Journal, 1991, 59(2):409-418.
[10] BIA OSK
OSK RSKA M, RUCI
RSKA M, RUCI SKA A, BOCZKOWSKA M. Molecular mechanisms underlying freezing tolerance in plants: Implications for cryopreservation[J]. International Journal of Molecular Sciences, 2024, 25(18):10110.
SKA A, BOCZKOWSKA M. Molecular mechanisms underlying freezing tolerance in plants: Implications for cryopreservation[J]. International Journal of Molecular Sciences, 2024, 25(18):10110.
[11] YANG F J, JIANG W T, CHEN X, et al. Identification of novel antifreeze peptides from Takifugu obscurus skin and molecular mechanism in inhibiting ice crystal growth[J]. Journal of Agricultural and Food Chemistry, 2022, 70(44):14148-14156.
[12] ZHOU J X, FENG Q H, FU H X, et al. Current trends and perspectives on aquatic-derived protein: A focus on structure-technofunctional properties relationship and application for food preservation[J]. Trends in Food Science &Technology, 2024, 151:104651.
[13] DELERAY A C, SAINI S S, WALLBERG A C, et al. Synthetic antifreeze glycoproteins with potent ice-binding activity[J]. Chemistry of Materials, 2024, 36(7):3424-3434.
[14] ESKANDARI A, LEOW T C, RAHMAN M B A, et al. Molecular dynamics-guided insight into the adsorption-inhibition mechanism for controlling ice growth/melt of antifreeze protein type IV mutant from longhorn sculpin fish[J]. Chemical Papers, 2024, 78(7):4437-4454.
[15] MIMI A, AMIN M R, HAQUE M A, et al. Characterization, structure-function relationship, and mechanism of antifreeze proteins[J]. Bangladesh Journal of Environmental Science, 2024, 46: 61-72.
[16] MIN J W, RONG X, ZHANG J X, et al. Computational design of peptide assemblies[J]. Journal of Chemical Theory and Computation, 2024, 20(2): 532-550.
[17] KIM Y D, JUNG W H, AHN D J, et al. Self-assembled nanostructures of homo-oligopeptide as a potent ice growth inhibitor[J]. Nano Letters, 2023, 23(20):9500-9507.
[18] MOCHIZUKI K, MOLINERO V. Antifreeze glycoproteins bind reversibly to ice via hydrophobic groups[J]. Journal of the American Chemical Society, 2018, 140(14):4803-4811.
[19] GHARIB G, SAEIDIHARZAND S, SADAGHIANI A K, et al. Antifreeze proteins: A tale of evolution from origin to energy applications[J]. Frontiers in Bioengineering and Biotechnology, 2022, 9:770588.
[20] ZHENG O Y, ZHANG L, SUN Q X, et al. Basic theory of ice crystallization based on water molecular structure and ice structure[J]. Foods, 2024, 13(17):2773.
[21] SHI L Y, ZANG C B, LIU Z C, et al. Molecular mechanisms of natural antifreeze phenomena and their application in cryopreservation[J]. Biotechnology and Bioengineering, 2024, 121(12):3655-3671.
[22] MIMI A, AMIN M R, AHMED S M, et al. Potential uses of antifreeze proteins: A review[J]. Bangladesh Journal of Environmental Science, 2024, 46: 77-82.
[23] CHEN X, LI L, YANG F J, et al. Effects of gelatin-based antifreeze peptides on cell viability and oxidant stress of Streptococcus thermophilus during cold stage[J]. Food and Chemical Toxicology, 2020, 136:111056.
[24] RAYMOND J A, DEVRIES A L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1977, 74(6):2589-2593.
[25] MADDAH M, MADDAH M, PEYVANDI K. The influence of a type Ⅲ antifreeze protein and its mutants on methane hydrate adsorption-inhibition: A molecular dynamics simulation study[J]. Physical Chemistry Chemical Physics, 2019, 21(39):21836-21846.
[26] MARKUS G, TRITSCH G L, PARTHASARATHY R. A model for hydropathy-based peptide interactions[J]. Archives of Biochemistry and Biophysics, 1989, 272(2):433-439.
[27] ZHANG N, DU Y T, YAO P Q, et al. Synergistic effect of hyperactive antifreeze protein on inhibition of gas-hydrate growth by hydrophobic and hydrophilic groups[J]. The Journal of Physical Chemistry. B, 2023, 127(49):10469-10477.
[28] 赵瑞祥. 跨境电商生鲜食品冷链物流优化策略探究[J]. 中国食品工业, 2024(7):77-79.ZHAO R X. Research on optimization strategy of cold chain logistics of fresh food for cross-border E-commerce[J]. China Food Industry, 2024(7):77-79.
[29] CHEN L, LIN S Y, SUN N. Recent advances in natural peptide-based cryoprotectants in food industry: From source to application[J]. Critical Reviews in Food Science and Nutrition, 2024,68: 106673.
[30] FAN X R, GENG W H, LI M, et al. Cryoprotective effects and quality maintenance of antifreeze proteins and peptides on aquatic products: A review[J]. Foods, 2024, 13(6):917.
[31] TIAN J, WU J Y, HUANG L Y, et al. Respirative metabolism improves the growth performance and stress response properties of Lactiplantibacillus plantarum SXC48[J]. LWT, 2024, 198:116012.
[32] LI B, ZHONG M M, SUN Y F, et al. Recent advancements in the utilization of ultrasonic technology for the curing of processed meat products: A comprehensive review[J]. Ultrasonics Sonochemistry, 2024, 103:106796.
[33] DE MORAES REGO A V P L, DOS SANTOS SILVA M, CONCEIÇ O R S, et al. Four different cryoprotectors in preservation of Staphylococcus aureus[J]. Journal of Bioengineering, Technologies and Health, 2023, 6(2):121-123.
O R S, et al. Four different cryoprotectors in preservation of Staphylococcus aureus[J]. Journal of Bioengineering, Technologies and Health, 2023, 6(2):121-123.
[34] URB N-DUARTE D, TOMITA S, SAKAI H, et al. Permeability and toxicity of cryoprotective agents in silkworm embryos: Impact on cryopreservation[J]. International Journal of Molecular Sciences, 2024, 25(21):11396.
N-DUARTE D, TOMITA S, SAKAI H, et al. Permeability and toxicity of cryoprotective agents in silkworm embryos: Impact on cryopreservation[J]. International Journal of Molecular Sciences, 2024, 25(21):11396.
[35] LIU S D, LI Y F, SHI L Q, et al. Maintaining sidedness and fluidity in cell membrane coatings supported on nano-particulate and planar surfaces[J]. Bioactive Materials, 2024, 32:344-355.
[36] SONG H, LI R, YANG L N, et al. Encapsulation of probiotic Lacticaseibacillus casei with whey protein isolate/soybean hull polysaccharide enhances cell viability in harsh conditions[J]. Food Hydrocolloids, 2024, 154:110126.
[37] BAZZAZ S, ABBASI A, GHOTBABAD A G, et al. Novel encapsulation approaches in the functional food industry: With a focus on probiotic cells and bioactive compounds[J]. Probiotics and Antimicrobial Proteins, 2025, 17(3):1132-1170.
[38] CAO S Q, CAI J X, WANG X Z, et al. Cryoprotective effect of collagen hydrolysates from squid skin on frozen shrimp and characterizations of its antifreeze peptides[J]. LWT, 2023, 174:114443.
[39] DANG M Z, WANG R F, JIA Y Y, et al. The antifreeze and cryoprotective activities of a novel antifreeze peptide from Ctenopharyngodon idella scales[J]. Foods, 2022, 11(13):1830.
[40] CHEN X, LI X Z, YANG F J, et al. Effects and mechanism of antifreeze peptides from silver carp scales on the freeze-thaw stability of frozen surimi[J]. Food Chemistry, 2022, 396:133717.
[41] YANG F J, JIANG W T, CHEN X, et al. Investigation on the quality regulating mechanism of antifreeze peptides on frozen surimi: From macro to micro[J]. Food Research International, 2023, 163:112299.
[42] YANG Z X, XU D, ZHOU H L, et al. New insight into the contribution of wheat starch and gluten to frozen dough bread quality[J]. Food Bioscience, 2022, 48:101777.
[43] ARIAS A C, BOBADILLA C A F, DOM NGUEZ C M Z. Cryoprotectants for frozen dough: A review[J]. Food Biophysics, 2024, 19(1):18-28.
NGUEZ C M Z. Cryoprotectants for frozen dough: A review[J]. Food Biophysics, 2024, 19(1):18-28.
[44] DING X L, LI T T, ZHANG H, et al. Effect of barley antifreeze protein on dough and bread during freezing and freeze-thaw cycles[J]. Foods, 2020, 9(11):1698.
[45] WANG X, GENG H Y, WU D D, et al. Isolation of ice structuring proteins from winter wheat in frigid region (Dongnongdongmai1) and the effect on freeze-thaw stability of dough[J]. Food Research International, 2024, 197:115295.