近年来国际贸易壁垒加剧,我国大宗油料面临的自给率低、供给失衡等风险日益突出[1]。据统计,2020年我国大宗油料,包括大豆、油菜籽、花生和棉籽的进口量总和已超过10 000万t,占油料作物总进口量的98%以上[2]。而特色油料在我国有着良好的种植和产量优势,种植面积约1 350万hm2,年产量约1 500万t,占国产油料的31%,主要包括亚麻籽、葵花籽、芝麻等草本油料及核桃、油茶等木本油料[3],对其深度开发利用不仅能够有效缓解日益加剧的粮食安全风险,也有助于我国粮油加工及上下游产业的健康、持续发展。相较于大宗油料作物,特色油料副产物中营养组分和活性物质的加工程度低、高值化产品开发不足,资源优势未得到充分发挥。随着生物加工技术及分离纯化工艺的发展,特色油料副产物中特征组分的转化规律和解离机制被逐渐明晰,为高值化产品开发提供了理论基础和技术支撑[4-8]。
蛋白质是特色油料中的重要成分,其干重占提油后饼粕质量的30%~40%(油橄榄约5%~10%),在全球蛋白质消费激增的大背景下特色油料蛋白(special oil proteins,SOP)成为一种极具潜力的新型蛋白质资源[9]。包括SOP在内的植物蛋白有着产量丰富的经济优势,但其功能特性及营养品质与动物蛋白间的差距制约了其在消费市场上的应用[10]。多酚是植物产生的一种次生代谢产物,以酚酸类、单宁类和黄酮类化合物等形式广泛存在于特色油料作物中,具有抑制氧化、缓解炎症等生物活性,对癌症、肥胖、心脑血管疾病有良好的调节作用[11]。其中内源性多酚(endogenous polyphenols,EP)指的是天然存在于生物体(特别是植物)本身,而非从其他生物体中获得或通过合成得到的多酚[12-13]。植物蛋白与多酚之间能够通过共价/非共价作用结合,促进蛋白质展开,使疏水残基暴露在亲水环境中,在植物蛋白的功能特性得以改善的同时形成了具有生物活性的植物蛋白-多酚复合物[14]。但目前研究大多集中于大宗油料蛋白如大豆蛋白、花生蛋白与茶多酚、儿茶素等外源性多酚间的相互作用,复合物特性的测定及互作机制的探讨[15-16]。特色油料作物中蛋白质与内源性多酚间相互作用的机制探究最近才成为研究热点。
本文主要从特色油料中EP的结构基础和赋存形态切入,系统论述SOP与EP间相互作用方式和影响因素,复合物的功能特性和生物活性,总结完善SOP-EP复合物形成的理论基础和产品应用的研究现状与进展,为油脂加工及其下游产业发展提供直接的应用依据。
1 特色油料蛋白与内源性多酚的相互作用
1.1 特色油料中内源性多酚的组成
多酚类化合物在自然界中广泛存在,从物质结构可将其分为黄酮类、酚酸类、儿茶素类以及木脂素类几种,其结构式如图1所示[17]。其中黄酮类物质富集于种子和种皮中,主要包括由苯环、苯丙酮骨架和邻二氢苯并呋喃酮环结构组成的槲皮素和芦丁以及苯环、呋喃环及苯丙酮结构组成的山奈酚;酚酸类物质主要存在于特色油料作物的果仁、外层种皮和胚乳中(油橄榄存在于果仁和果皮中),主要包括含有酯键、苯环和碳碳双键的绿原酸、阿魏酸和咖啡酸等;儿茶素类物质在特色油料作物中赋存形态差异较大,在种子和果实的内外部均有不同形态的儿茶素类化合物,主要包括由2个多羟基苯环和三碳的三羟基丙烷桥连接而成的儿茶素和表儿茶素;木脂素类化合物结构特点是含有1个苯环和1个β-双键,这使得它们具有一定的共轭体系和芳香性,大多存在于特色油料的果实和种子外皮,主要包含有木酚素、松脂酚和芝麻素等[18]。
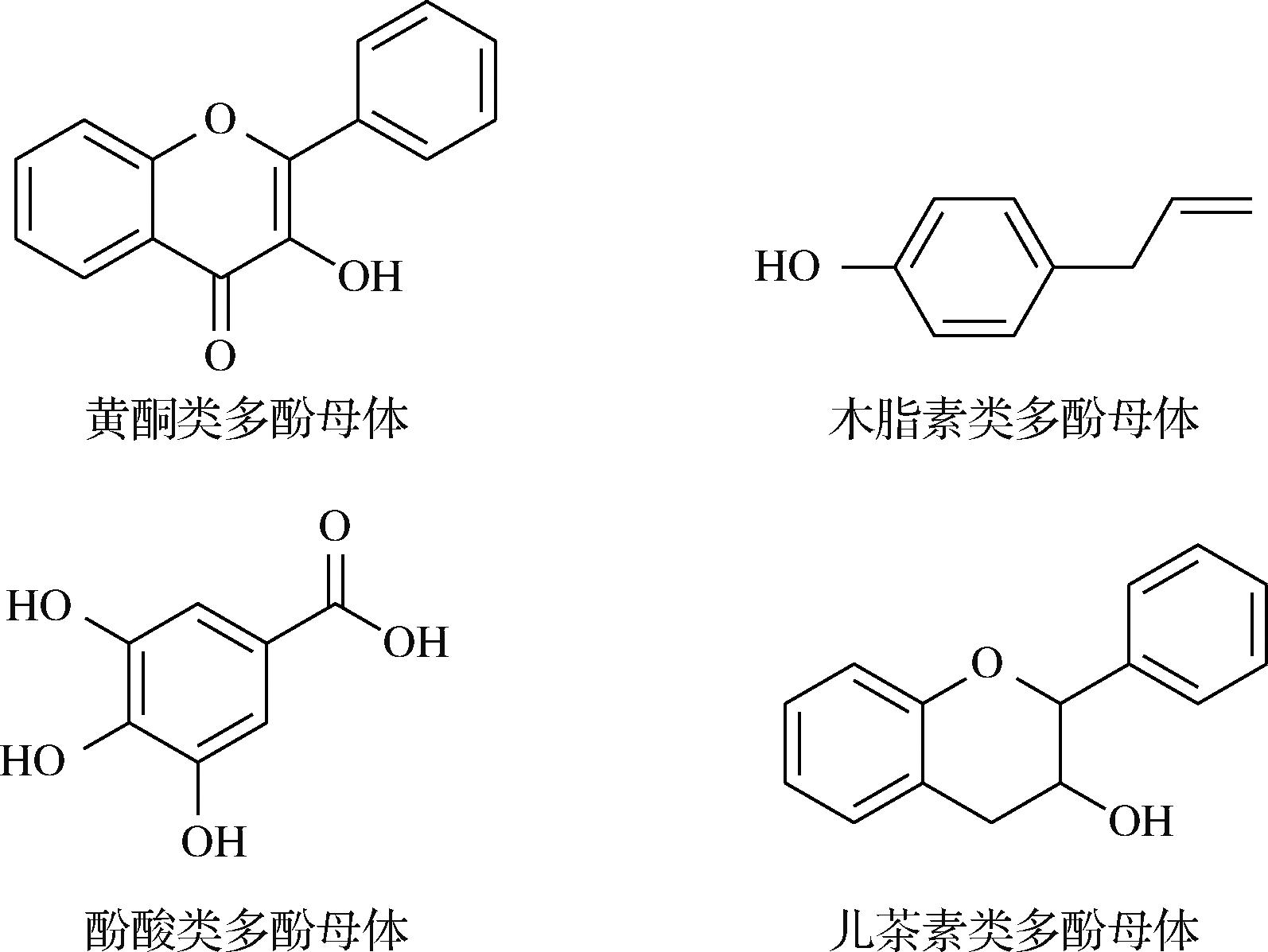
图1 多酚化合物类型及母体结构
Fig.1 Types and maternal structures of polyphenols
芝麻、亚麻、核桃、葵花、油茶等特色油料作物中的多酚种类及含量如表1所示。植物中多酚的种类和含量受到遗传因素、生长环境、收获时间和后期加工方式等诸多因素影响。其中特色油料作物加工后油脂和饼粕中多酚含量受到加工条件影响较大,油脂中多酚的含量、结构、功能分析已有广泛报道,而副产物中多酚的赋存形态、提取工艺以及构效关系仍需要更深入的研究。
表1 部分特色油料中内源性多酚组成
Table 1 The composition of endogenous polyphenols in partial specialty oils crops
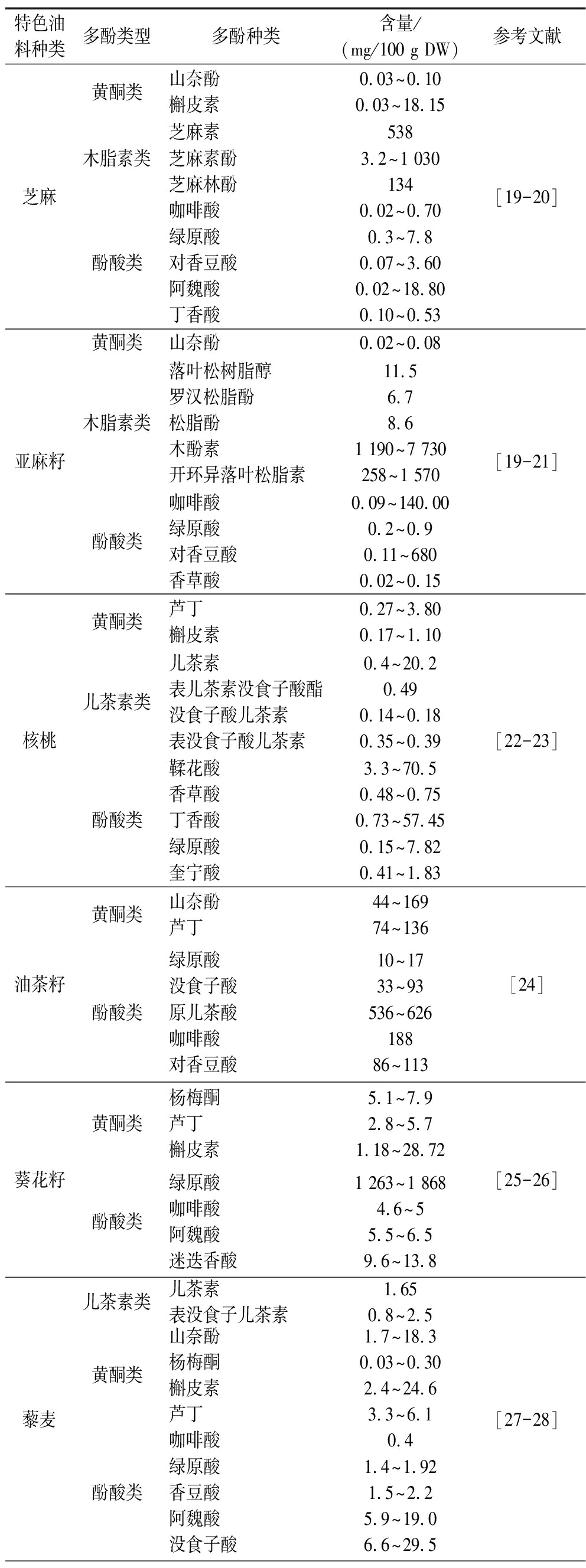
特色油料种类多酚类型多酚种类含量/(mg/100 g DW)参考文献芝麻黄酮类山奈酚槲皮素0.03^0.100.03^18.15木脂素类芝麻素芝麻素酚芝麻林酚5383.2^1 030134酚酸类咖啡酸绿原酸对香豆酸阿魏酸丁香酸0.02^0.700.3^7.80.07^3.600.02^18.800.10^0.53[19-20]亚麻籽黄酮类山奈酚0.02^0.08木脂素类落叶松树脂醇罗汉松脂酚松脂酚木酚素开环异落叶松脂素11.56.78.61 190^7 730258^1 570酚酸类咖啡酸绿原酸对香豆酸香草酸0.09^140.000.2^0.90.11^6800.02^0.15[19-21]核桃黄酮类芦丁槲皮素0.27^3.800.17^1.10儿茶素类儿茶素表儿茶素没食子酸酯没食子酸儿茶素表没食子酸儿茶素0.4^20.20.490.14^0.180.35^0.39酚酸类鞣花酸香草酸丁香酸绿原酸奎宁酸3.3^70.50.48^0.750.73^57.450.15^7.820.41^1.83[22-23]油茶籽黄酮类山奈酚芦丁44^16974^136酚酸类绿原酸没食子酸原儿茶酸咖啡酸对香豆酸10^1733^93536^62618886^113[24]葵花籽黄酮类杨梅酮芦丁槲皮素5.1^7.92.8^5.71.18^28.72酚酸类绿原酸咖啡酸阿魏酸迷迭香酸1 263^1 8684.6^55.5^6.59.6^13.8[25-26]藜麦儿茶素类儿茶素表没食子儿茶素1.650.8^2.5黄酮类山奈酚杨梅酮槲皮素芦丁1.7^18.30.03^0.302.4^24.63.3^6.1酚酸类咖啡酸绿原酸香豆酸阿魏酸没食子酸0.41.4^1.921.5^2.25.9^19.06.6^29.5[27-28]
续表1
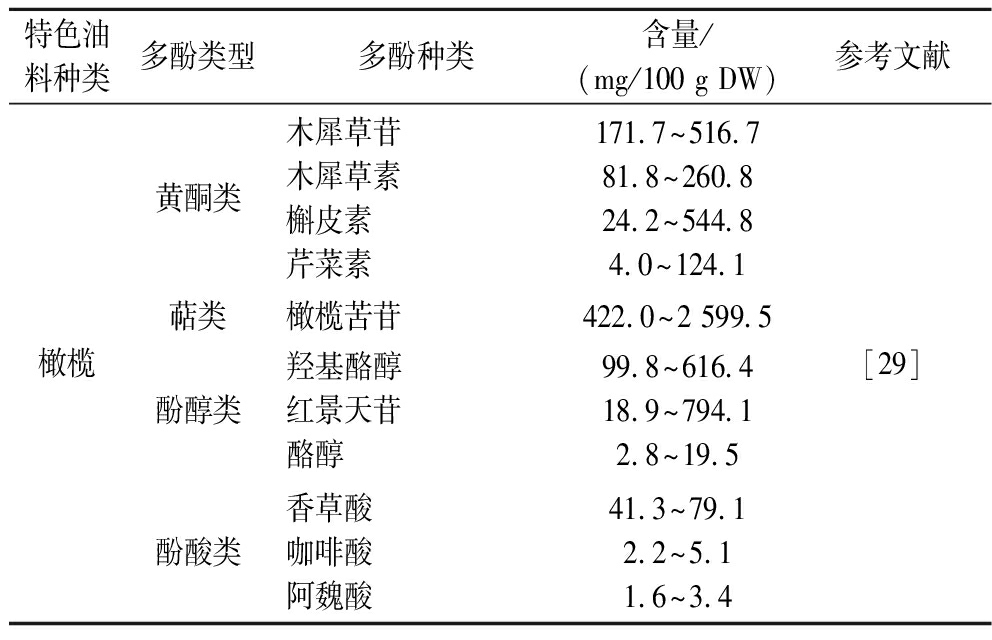
特色油料种类多酚类型多酚种类含量/(mg/100 g DW)参考文献橄榄黄酮类木犀草苷木犀草素槲皮素芹菜素171.7^516.781.8^260.824.2^544.84.0^124.1萜类橄榄苦苷422.0^2 599.5酚醇类羟基酪醇红景天苷酪醇99.8^616.418.9^794.12.8^19.5酚酸类香草酸咖啡酸阿魏酸41.3^79.12.2^5.11.6^3.4[29]
1.2 特色油料蛋白与内源性多酚的相互作用方式
特色油料蛋白与内源性多酚间相互作用形式与植物蛋白-多酚复合物形成途径相似,主要通过共价和非共价相互作用使其形成生物聚合物。
1.2.1 油料蛋白与内源性多酚间非共价相互作用
蛋白质和多酚的非共价相互作用包括疏水相互作用、氢键、静电相互作用及范德华力,这些分子间弱相互作用不包括化学键的形成,主要存在于蛋白质氨基与多酚羟基之间(图2)。已有研究表明植物蛋白与多酚间的非共价相互作用是可逆的,且受环境因素影响在不同研究体系中存在动态平衡,通常疏水键>氢键>静电相互作用[11, 30]。
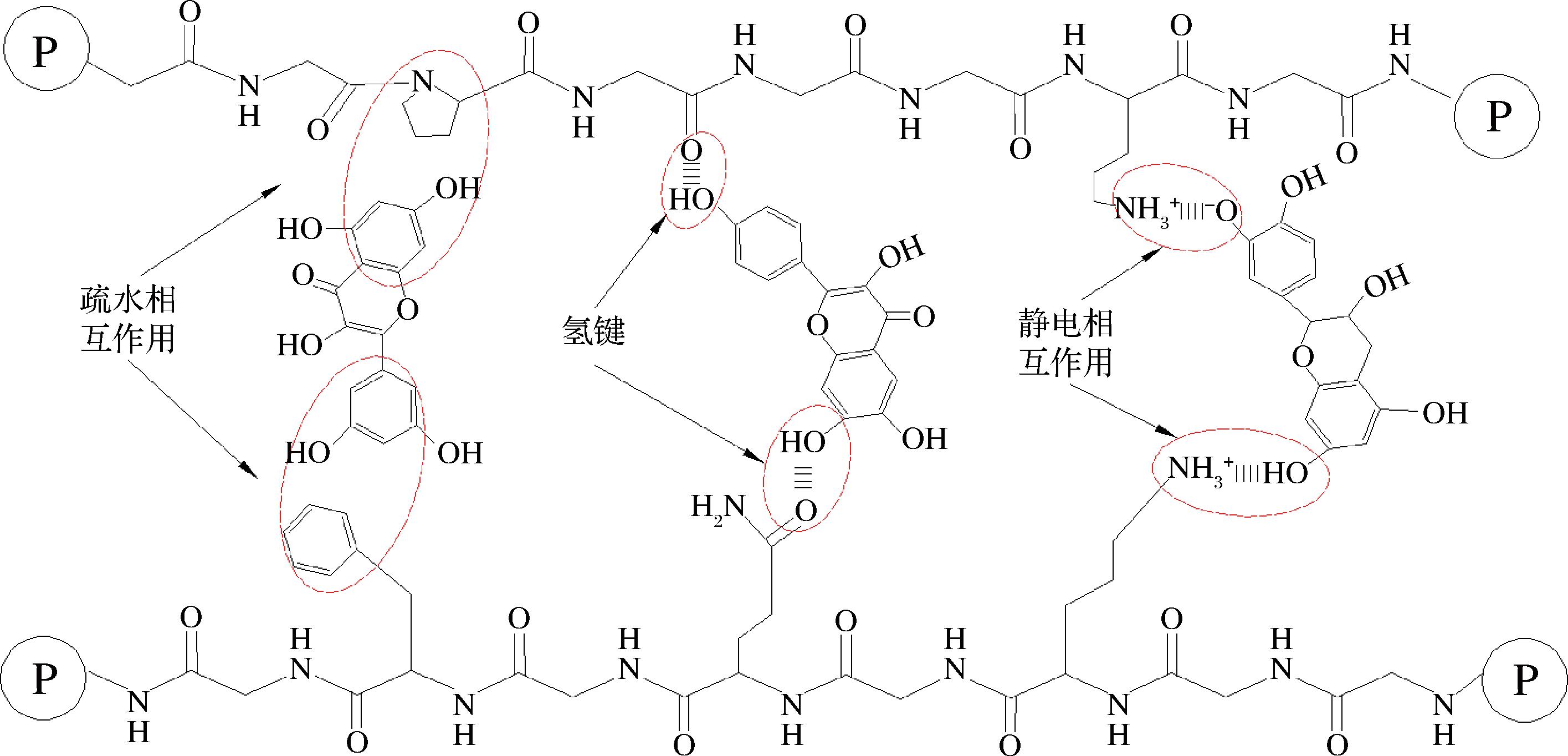
图2 蛋白质与多酚间非共价相互作用类型
Fig.2 Types of non-covalent interactions between proteins and polyphenols
疏水相互作用是SOP与EP间最主要分子间作用力之一,存在于氨基酸的疏水性残基和非极性侧链与多酚的芳香环之间[31]。菜籽中的索马榆脂二酸与菜籽蛋白中的球蛋白组分(12 S)在中性(pH 7.0)和弱碱性(pH 8.5)环境中通过疏水相互作用形成复合物,其结合强度显著高于相同条件下菜籽蛋白与辛酸间的静电相互作用,对复合物凝胶的弹性模量提升显著[32]。SALGADO等[33]研究表明,在碱性环境下(pH 9.0)葵花籽浓缩蛋白与EP间的疏水相互作用导致葵花籽蛋白变性程度增加,溶解度降低,热稳定性增强。
氢键是维持蛋白质-多酚复合物稳定性的重要分子间作用力,存在于蛋白质羰基(C![]() O)与酚羟基中氢原子之间[34]。KAREFYLLAKIS等[35]在绿原酸对葵花籽蛋白界面特性影响的研究中也发现葵花籽蛋白中11S组分与绿原酸中酚羟基间的氢键是最主要的分子间作用力,绿原酸分子中的2个酚羟基均能够与蛋白质分子通过氢键交联,所形成的复合物更易在油水界面吸附,降低界面张力,提升乳液稳定性。XU等[36]通过傅里叶红外光谱和圆二色谱结果证明氢键和范德华力为火麻蛋白与大麻素形成的蛋白-多酚复合物的主要作用力,且大麻素A的结合亲和力大于大麻素B。
O)与酚羟基中氢原子之间[34]。KAREFYLLAKIS等[35]在绿原酸对葵花籽蛋白界面特性影响的研究中也发现葵花籽蛋白中11S组分与绿原酸中酚羟基间的氢键是最主要的分子间作用力,绿原酸分子中的2个酚羟基均能够与蛋白质分子通过氢键交联,所形成的复合物更易在油水界面吸附,降低界面张力,提升乳液稳定性。XU等[36]通过傅里叶红外光谱和圆二色谱结果证明氢键和范德华力为火麻蛋白与大麻素形成的蛋白-多酚复合物的主要作用力,且大麻素A的结合亲和力大于大麻素B。
静电相互作用发生在蛋白质表面的阳离子基团(如赖氨酸的ε-氨基)和多酚中的阴离子基团(酚羟基)之间,极易受到溶液中pH环境变化的影响,在中性条件下(大多数食品体系的应用环境)其作用强度弱于疏水相互作用和氢键,在蛋白-多酚复合物中居次要地位[37]。这是由于中性环境下蛋白质电离出带负电的羧基和带正电的氨基浓度相近,蛋白质整体呈中性电荷,正负电荷之间的吸引力相对较弱。RUBINO等[32]研究表明当pH值小于菜籽蛋白等电点时(pH≈4.5),菜籽蛋白与EP之间的静电相互作用变得更为重要,这是由于更多阳离子基团暴露在蛋白质表面,增加了与酚羟基的结合位点。另有研究发现豌豆蛋白与菜籽蛋白等电点相似(pH≈4.7),但在中性环境下却与绿原酸形成了以静电相互作用主导的非共价复合物,有关蛋白质与多酚间静电相互作用机制仍需进一步讨论[38]。
SOP-EP复合物的形成、结构、功能及应用与组分间非共价相互作用的类型和强度密切相关,探明不同类型非共价相互作用对复合物构象的影响机制是明晰其构效关系的理论基础。
1.2.2 油料蛋白与内源性多酚间共价相互作用
蛋白质和多酚之间的共价相互作用通常是不可逆的,比非共价相互作用更稳定,主要包括碱法、自由基接枝法和酶法处理3种途径(图3)[19,34,39]。多酚经过氧化和酶促反应形成邻醌或半醌,能够与蛋白质中的氨基和巯基侧链键合形成蛋白质-多酚复合物。
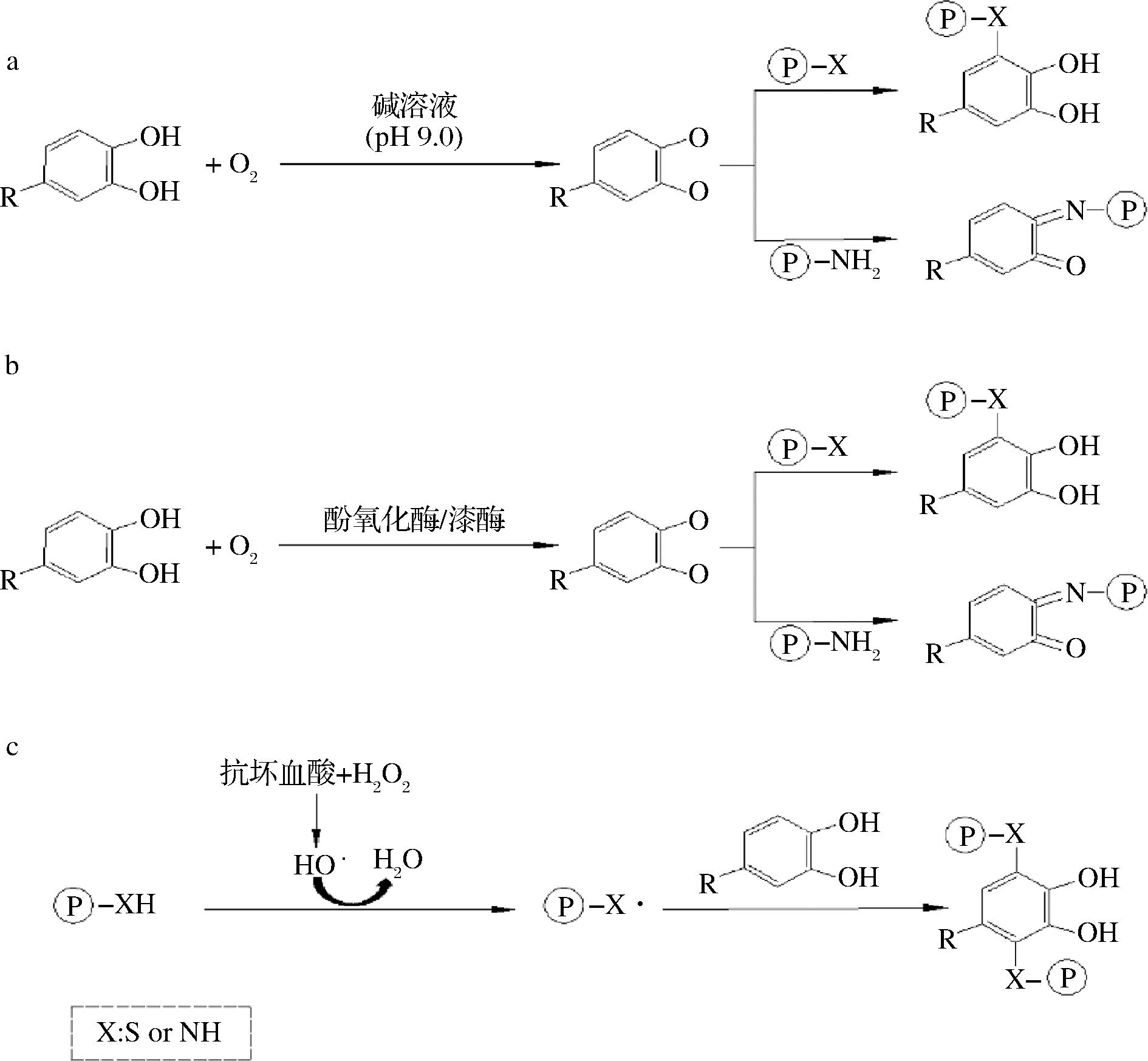
a-碱处理法;b-酶法诱导;c-自由基接枝法
图3 蛋白质与多酚共价相互作用机制
Fig.3 Covalent interaction mechanism between proteins and polyphenols
碱法反应是产生多酚-蛋白复合物最常用方法,具有操作简单、反应温和、经济性强的特点[40]。在碱性环境和氧气的协同作用下,多酚易被氧化成醌,后与蛋白质侧链上的亲核残基(如色氨酸、半胱氨酸、蛋氨酸、组氨酸、酪氨酸和脯氨酸)产生共价交联,蛋白质和多酚间形成C—N或C—S键[41]。黄子林[42]将脱衣核桃蛋白和核桃衣游离多酚溶于pH 9.0的溶液制备蛋白-多酚共价复合物,结果表明核桃蛋白中主要是赖氨酸与EP发生共价交联,并推测其键合机制为碱性条件下,EP中的酚羟基被氧化为邻醌,核桃蛋白质侧链上的赖氨酸残基具有一定还原性,与邻醌类物质在溶液中充分接触并被还原,然后通过C—N键结合。WILDERMUTH等[43]在综述葵花籽蛋白与绿原酸互作生成呈色复合物的报道中指出,绿原酸在碱性环境下被氧化为绿原酸醌后具有亲电性,与蛋白质中的亲核硫醇或氨基共价键合,所形成氨基化合物能够进一步通过加成反应形成二聚体,同时指出这些交联大多发生在绿原酸醌与C3位置的氨基和巯基间。碱法形成的共价复合物的一个特点是蛋白质表面的游离氨基和巯基减少,这也是大多数蛋白-多酚复合物溶解度改善的潜在原因之一。
酶法诱导蛋白-多酚共价复合物的形成机制与碱法类似,区别在于诱导邻醌形成的途径不同。首先多酚在单酚氧化酶的催化下形成邻二酚,后被邻二酚酶或儿茶酚酶转化为邻醌[44]。酶法诱导反应在中性条件下即可发生,从环境和效率角度,酶法处理是一种极具潜力的蛋白-多酚复合物绿色制备方法。酶制剂昂贵价格和使用程序复杂是限制该种方法在传统食品工业中推广应用的主要原因[45]。
自由基接枝法是由抗坏血酸和过氧化氢反应产生游离的羟自由基完成对蛋白质侧链上的活性氨基和巯基的氧化,进而由氧化后的基团与多酚分子间产生共价交联,形成蛋白-多酚复合物[46]。该反应可以在室温下进行,不会产生有毒产物或分解抗氧化剂[47]。自由基诱导的动物源蛋白-多酚复合物比碱法形成的复合物具有更高的抗氧化活性[45],SOP与EP通过自由基接枝形成的共价复合物也有相似的结果,CHEN等[40]对藜麦分离蛋白与二氢咖啡酸和二氢杨梅素所形成的共价复合物自由基清除能力测定结果表明由自由基接枝法形成的复合物具有更高的抗氧化能力。
2 特色油料蛋白-内源性多酚复合物的特性
2.1 功能特性
SOP与EP间的相互作用会对复合物的性质产生影响,通常是指复合物中蛋白质构象变化对蛋白功能特性的影响,主要包括蛋白质的溶解性、乳化性、起泡性、凝胶性、持水持油性及热稳定性等。
蛋白质-多酚复合物的溶解度是其在许多食品加工领域应用的先决条件,同时也会对乳化性和起泡性等功能特性产生影响。研究表明核桃蛋白与鞣花酸间形成共价结合,使蛋白质在中性溶液(pH 7.0)中的溶解度提升了90%[48],XU等[49]的研究也发现火麻蛋白与内源性多酚间形成了共价交联,一方面亲水性酚羟基能够部分阻断疏水蛋白簇,另一方面带负电的酚羟基引入能够增加复合物表面的电荷,导致阻碍聚集的斥力增强,两者的协同作用增加了复合物的溶解性(pH 6.0~9.0)。非极性多酚与蛋白质的相互作用则会增加多酚-蛋白复合物的表面疏水性,降低其在水中的溶解度[32]。总而言之蛋白质与多酚间相互作用对溶解度的影响取决于系统的酸碱性,多酚的极性以及蛋白质-多酚间相互作用类型等因素。
蛋白质-多酚复合物的乳化性在食品工业中的应用十分常见。有报道表明葵花籽蛋白与极性绿原酸结合形成的复合物粒径越小稳定性越好,且随着复合物中绿原酸比例增加而增加(1∶1、1∶5、1∶10),通过非共价相互作用形成的复合物油水界面张力降低,界面吸附性能增加,葵花籽蛋白的乳化性能提升[35]。对SOP而言,与EP相互作用使乳化性得到提升的过程通常伴随着α-螺旋结构向无规则卷曲结构的转变[50]。EP与SOP的互作类型以及蛋白质二级结构的变化都会影响复合物的起泡特性,有研究表明起泡性的优劣取决于其蛋白与多酚疏水基团间的相互作用和酚羟基与蛋白羰基间的氢键,更多的非共价键有利于多层蛋白吸附膜的形成,使蛋白-多酚复合物起泡性增加。但包括氢键和疏水相互作用在内的非共价相互作用对起泡性是否始终是正向影响仍有待深入研究,有研究指出葵花籽蛋白中EP的减少,增加了蛋白质表面疏水性,但其起泡能力却显著下降[51-52]。
多酚对蛋白凝胶特性的改善作用在动物源蛋白质中已被广泛证明,由于动物蛋白易于氧化的特点,更多羰基化合物与醌类形成共价交联,凝胶网络的黏弹性和结合水分子的能力均得到提升,使凝胶特性得以改善[53]。EP对SOP凝胶特性的研究仍处于起步阶段,ALU’DATT等[54]的研究发现葵花籽蛋白中EP会导致凝胶强度的降低,最小成胶浓度变大,但黏性模量和对水分的结合能力提升。在对比大宗油料和特色油料中EP对蛋白凝胶特性的研究中发现,亚麻籽中的EP能够有效地提升亚麻籽蛋白凝胶的黏弹性、持水性,但大豆蛋白中的EP则对大豆蛋白凝胶特性起到不利影响。
蛋白质与多酚的相互作用可能导致复合物热稳定性的变化。热加工是许多食品生产中的一个重要步骤,包括SOP在内的大多数植物蛋白分子为球状结构,热诱导导致蛋白质变性并增加食品质量问题的风险[46]。大量研究详细阐述蛋白与多酚相互作用过程中焓值的变化,明确了多酚对植物蛋白热稳定性的改善效果[55-57]。JIA等[58]的研究表明,葵花籽蛋白和绿原酸间的非共价相互作用能够略微降低复合物的热稳定性,相比之下利用碱法诱导的蛋白-多酚共价复合物的热稳定性有显著提升。CAO等[59]研究表明,亚麻籽蛋白与绿原酸间的共价相互作用会降低复合物的热稳定性。CHEN等[40]在研究内源性酚酸(二氢咖啡酸、二氢杨梅素)与藜麦蛋白共价结合对热稳定性的影响时发现,藜麦蛋白-多酚共价复合物的形成会显著提升其热稳定性,同时指出其热稳定性与形成共价键的基团和键合程度密切相关。
2.2 生物活性
植物蛋白与多酚形成的复合物在生物活性方面具有一些独特的性质和潜在的健康益处,主要包含抗氧化性、消化特性、致敏性、生物相容性和抗菌性等几方面。从营养和健康角度来看,蛋白质-多酚复合物能够减少氧化应激,缓解炎症反应、抑制炎症介质的释放,增强蛋白质等营养成分的生物利用率,还能够改善肠道益生菌群,调节血糖,改善心脑血管健康等积极作用。这些生物活性取决于蛋白和多酚的具体类型、浓度以及它们的结合方式。近年来有关SOP与EP复合物生物活性挖掘、内在机制阐述与应用前景探索的研究逐渐成为了研究热点,表2中列举部分相关研究的最新进展。
表2 部分特色油料蛋白-内源性多酚相互作用对其生物活性的影响
Table 2 Effects of partial specialty oilseed proteins-endogenous polyphenols interaction on their biological activities

蛋白类型多酚类型互作方式生物活性结果文献葵花籽浓缩蛋白总酚共价相互作用抗氧化性(ABTS、FRA、ORAC)抗氧化性(+)[31]大麻籽球蛋白大麻素A大麻素B氢键、范德华力抗氧化性(ABTS、DPPH)体外消化性(胃蛋白酶、胰蛋白酶)抗氧化性(+)体外消化性(+)[36]藜麦分离蛋白二氢咖啡酸二氢杨梅素共价及非共价相互作用抗氧化性(ABTS、DPPH)生物相容性(细胞毒性、溶血率、体内ROS清除、细胞抗氧化活性)抗氧化性(+)生物相容性(+)[40]大麻籽球蛋白大麻籽多酚共价相互作用抗氧化性(ABTS、DPPH)体外消化性(胃蛋白酶、胰蛋白酶)抗氧化性(+)体外消化性(+)[49]核桃分离蛋白绿原酸共价相互作用抗氧化性(DPPH、ABTS)抗氧化性(+)[50]亚麻籽蛋白绿原酸共价相互作用抗氧化性(DPPH、ABTS、FRA)抗氧化性(+)[59]葵花籽分离蛋白总酚二硫键/氢键抗氧化性(ABTS)抗氧化性(+)[60]
续表2
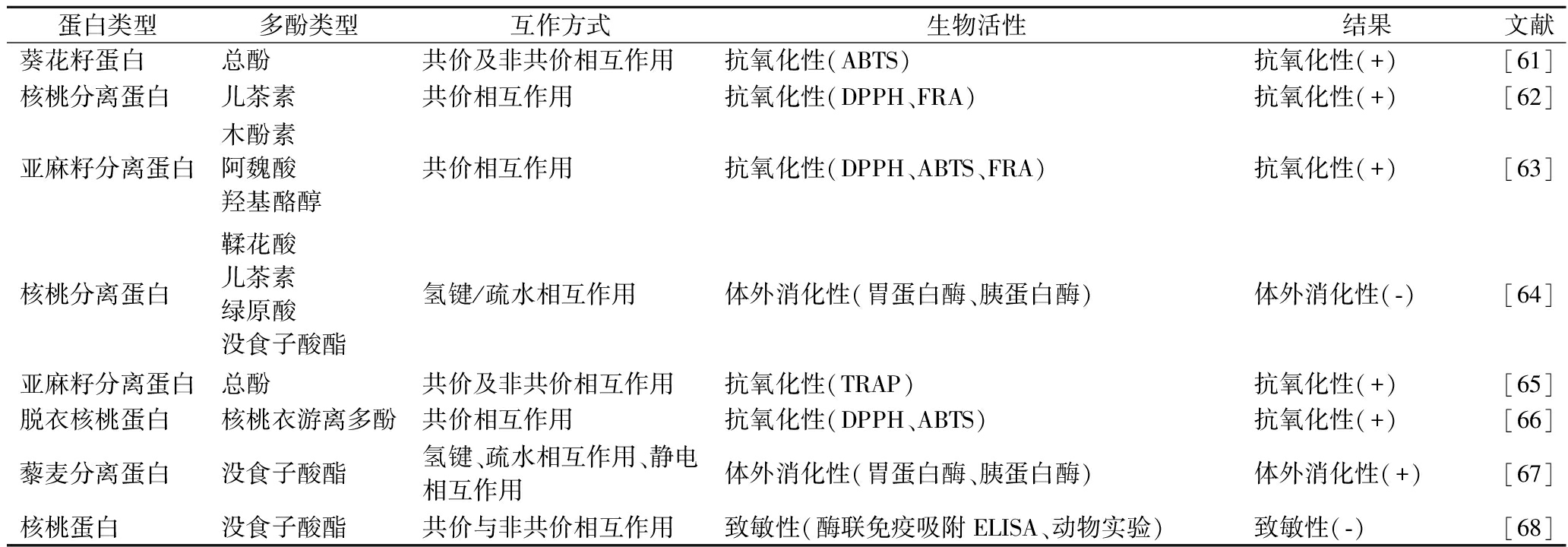
蛋白类型多酚类型互作方式生物活性结果文献葵花籽蛋白总酚共价及非共价相互作用抗氧化性(ABTS)抗氧化性(+)[61]核桃分离蛋白儿茶素共价相互作用抗氧化性(DPPH、FRA)抗氧化性(+)[62]亚麻籽分离蛋白木酚素阿魏酸羟基酪醇共价相互作用抗氧化性(DPPH、ABTS、FRA)抗氧化性(+)[63]核桃分离蛋白鞣花酸儿茶素绿原酸没食子酸酯氢键/疏水相互作用体外消化性(胃蛋白酶、胰蛋白酶)体外消化性(-)[64]亚麻籽分离蛋白总酚共价及非共价相互作用抗氧化性(TRAP)抗氧化性(+)[65]脱衣核桃蛋白核桃衣游离多酚共价相互作用抗氧化性(DPPH、ABTS)抗氧化性(+)[66]藜麦分离蛋白没食子酸酯氢键、疏水相互作用、静电相互作用体外消化性(胃蛋白酶、胰蛋白酶)体外消化性(+)[67]核桃蛋白没食子酸酯共价与非共价相互作用致敏性(酶联免疫吸附ELISA、动物实验)致敏性(-)[68]
注:+表示显著上升;-表示显著下降。
3 特色油料蛋白-内源性多酚复合物的应用前景
3.1 乳液
乳液是植物蛋白-多酚体系最常见的应用之一,多酚的引入改变了蛋白质结构,有利于油/水界面的稳定并具有抑制氧化作用[69]。含有SOP-EP复合物的乳液性质及应用近年来得到广泛研究。PHAM等[63]发现亚麻籽分离蛋白与EP相互作用降低了蛋白本身的乳化性和乳化稳定性,这与其亚麻分离蛋白具有较高的表面电荷密度相关,液滴表面较高的电荷密度比液滴粒径对乳液稳定性的贡献更大。这一研究结果与KAREFYLLAKIS等[35]的有关葵花籽蛋白-绿原酸复合物对水包油乳液稳定的影响一致。HE等[67]利用超声辅助法制备藜麦蛋白-没食子酸酯复合物并发现其在Pickering乳液中主要通过疏水相互作用、氢键和静电相互作用结合,没食子酸酯量的增加会减小杂化颗粒粒径,显著提升乳液的稳定性。TANG等[50]通过自由基接枝法制备了核桃分离蛋白-绿原酸复合物,复合物中分子间的共价结合改善了蛋白的乳化性和抗氧化活性,并指出该共价复合物在核桃乳制品如冰淇淋、酸奶和牛奶等产品开发中具有良好的应用潜力。
3.2 薄膜
天然的SOP中多含有脂蛋白、结合态多酚,由其制成的生物可降解薄膜具有可食性、柔韧性及抗氧化活性,能够有效阻隔氧气、CO2、油脂和挥发性化合物的转移,从而防止食品质量下降,延长产品保质期[70-71]。起初研究集中于含有残余多酚的油料蛋白直接制备可降解生物薄膜,并对其机械强度、抗氧性等性质进行测定,结果表明EP与蛋白间具有良好的生物相容性,所制备的复合物薄膜具有良好的机械性能和抗氧化性,同时多酚通常能够赋予薄膜一定的不透明性和防光性能,可以有效地抑制食品中光敏性物质的分解[72]。在此基础上,SALGADO等[33]系统研究了葵花籽分离蛋白与绿原酸相互作用机制对生物膜性质的影响,研究表明多酚的添加对膜的机械性能和阻隔性能没有显著影响,但随着绿原酸添加量的增加,其颜色、不透明度以及抗氧化性有所增加,生物膜的抗氧化活性与多酚的含量及其与蛋白质结合方式密切相关,对葵花分离蛋白-绿原酸复合膜结构稳定性的贡献大小为:氢键/二硫键>疏水相互作用/离子键,这些薄膜同样是维生素、抗菌剂、多肽等功能性组分的低成本载体,能够拓宽其在食品和非食品加工领域的应用范围[73]。
3.3 递送系统
蛋白质-多酚复合物通常具有双亲性,对疏水分子和亲水分子都具有亲和力。利用蛋白质-多酚复合物作为不稳定生物活性物质的载体是一个热门的研究课题。生物活性物质发挥对人体健康的促进作用要面临包括口腔、胃、肠道在内的整个消化系统的复杂生物环境,为有效提高活性物质的生物利用率,递送载体与生物活性物质之间的生物相容性、负载率、靶向释放等性质是研究的重点[46]。以SOP和EP为原料构建的递送系统因其在生物相容性方面的优势,逐渐受到更多的关注。WANG等[62]指出核桃分离蛋白与表没食子儿茶素没食子酸酯的纳米颗粒载体能够负载番茄红素,负载效率达到20.21%,纳米颗粒载体有效地提高了活性物质的热稳定性、光敏性和储藏稳定性,体外模拟消化实验表明核桃分离蛋白-表没食子儿茶素没食子酸酯纳米颗粒/番茄红素存在协同作用,提高了对细胞氧化应激的抑制作用。
3.4 凝胶
许多SOP与多酚的相互作用会对其凝胶特性有所改善,如2.1节部分论述。多酚与蛋白相互作用除了能够改善其黏弹性、保水能力,为传统蛋白凝胶类食品品质提升和新型凝胶食品开发提供助力外,基于淀粉样纤维蛋白和多酚组装所形成的与生物组织结构高度类似的水凝胶已成为新的研究热点[74-76]。多酚对蛋白质纤维结构的影响在动物源蛋白中已有诸多报道,研究表明多酚对动物蛋白纤维结构的影响有利于改善其抗氧化能力、凝胶特性和感官特性,对肉质品的品质提升有明显的促进作用[77-78]。最新的研究表明纤维化后的β-乳球蛋白与表没食子儿茶素没食子酸酯能够形成网络结构致密的蛋白凝胶,其质构特性、流变学特性得到改善,对金黄色葡萄球菌和大肠杆菌具有明显的抑制作用[79]。但包括SOP在内的植物蛋白纤维与多酚间相互作用及应用的研究较少,这可能是由于植物蛋白的纤维化诱导技术尚不成熟,大多需要酸性条件下加热,使蛋白质展开和水解,以特定的结构进行组装[80],这种环境不利于植物蛋白与多酚之间通过碱法和酶法结合。蛋白和多酚间的相互作用较弱,对植物蛋白纤维化诱导和与多酚间结合工艺的优化是深入挖掘SOP应用价值需要解决的关键问题。
4 总结
综上所述,对SOP与EP在不同基质中的赋存形态和分子间相互作用的探究,有助于明确其构象变化对复合物功能特性和生物活性的影响,促进组分绿色高效提取和新产品的创制,具有重要的理论意义和产业价值。已有研究表明特色油料蛋白与内源性多酚基于疏水相互作用、氢键、静电相互作用及范德华力的非共价相互作用是SOP-EP复合物中的主要相互作用形式;与非共价作用相比,由碱处理、自由基及酶制剂等环境因素诱导的酚羟基与蛋白质分子侧链上的活性氨基、巯基间的共价交联能够形成更加稳定且具有良好功能特性、生物活性的SOP-EP复合物。尽管在阐明SOP与EP之间的互作机制方面取得了很大进展,但基于相互作用引起的复合物构效关系的变化仍然不够清晰。为了进一步拓宽特色油料及其副产物的应用范围、提升其商业价值,广泛研究SOP-EP复合物的高效制备技术和新的复合物开发是其关键所在。并在此基础上阐明它们在乳液、薄膜、递送载体、凝胶等食品和生物医药领域的应用潜力。
[1] 李孝忠, 马春蕊, 肖雪, 等.中国特色油料产业贸易特征及发展趋势分析[J].中国油料作物学报, 2024, 46(6):1213-1221.LI X Z, MA C R, XIAO X, et al.Analysis on trade characteristics and development trend of China’s specific oilseed crops industry[J].Chinese Journal of Oil Crop Sciences, 2024, 46(6):1213-1221.
[2] 施文华, 严茂林, 刘昌勇, 等.我国油料进口贸易的结构特征及对策分析[J].中国油脂, 2023, 48(8):1-8.SHI W H, YAN M L, LIU C Y, et al.Structural characteristics and countermeasures analysis of Chinese oilseeds import trade[J].China Oils and Fats, 2023, 48(8):1-8.
[3] 赵艳飞, 王继永.我国主要植物油料油脂供需现状、问题及发展对策[J].作物杂志, 2024(3):8-12.ZHAO Y F, WANG J Y.Current situation, problems and development countermeasures of supply and demand of main plant oil in China[J].Crops, 2024(3):8-12.
[4] WEI P P, ZHAO F L, WANG Z, et al.Sesame (Sesamum indicum L.):A comprehensive review of nutritional value, phytochemical composition, health benefits, development of food, and industrial applications[J].Nutrients, 2022, 14(19):4079.
[5] PETRARU A, URSACHI F, AMARIEI S.Nutritional characteristics assessment of sunflower seeds, oil and cake.perspective of using sunflower oilcakes as a functional ingredient[J].Plants, 2021, 10(11):2487.
[6] GOKSEN G, DEMIR D, DHAMA K, et al.Mucilage polysaccharide as a plant secretion:Potential trends in food and biomedical applications[J].International Journal of Biological Macromolecules, 2023, 230:123146.
[7] XUE W W, SHEN X L, WU L K.Microwave pretreatment of hemp seeds changes the flavor and quality of hemp seed oil[J].Industrial Crops and Products, 2024, 213:118396.
[8] YANG J, DUAN Y Q, ZHANG H H, et al.Ultrasound coupled with weak alkali cycling-induced exchange of free sulfhydryl-disulfide bond for remodeling interfacial flexibility of flaxseed protein isolates[J].Food Hydrocolloids, 2023, 140:108597.
[9] HALPERN B S, FRAZIER M, VERSTAEN J, et al.The environmental footprint of global food production[J].Nature Sustainability, 2022, 5(12):1027-1039.
[10] RIAZI F, TEHRANI M M, LAMMERS V, et al.Unexpected morphological modifications in high moisture extruded pea-flaxseed proteins:Part I, topological and conformational characteristics, textural attributes, and viscoelastic phenomena[J].Food Hydrocolloids, 2023, 136:108304.
[11] 王远利, 康心蕊, 陶亮, 等.蛋白质与多酚的互作机制及其应用[J].中国食品学报, 2024, 24(2):357-372.WANG Y L, KANG X R, TAO L, et al.The interaction mechanism between protein and polyphenol and its application[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(2):357-372.
[12] XI Y, CHENG D, ZENG X Q, et al.Evidences for chlorogenic acid:A major endogenous polyphenol involved in regulation of ripening and senescence of apple fruit[J].PLoS One, 2016, 11(1):e0146940.
[13] 杜伊晗, 王书语, 向燕, 等.核桃内源性多酚的体外抗氧化能力及对核桃油氧化稳定性的影响[J].中国油脂, 2024, 49(5):88-94;143.DU Y H, WANG S Y, XIANG Y, et al.In vitro antioxidant capacity of endogenous walnut polyphenols and their effects on the oxidation stability of walnut oil[J].China Oils and Fats, 2024, 49(5):88-94;143.
[14] YAN X H, ZENG Z L, MCCLEMENTS D J, et al.A review of the structure, function, and application of plant-based protein-phenolic conjugates and complexes[J].Comprehensive Reviews in Food Science and Food Safety, 2023, 22(2):1312-1336.
[15] HE W Y, HE K, LIU X Y, et al.Modulating the allergenicity and functional properties of peanut protein by covalent conjugation with polyphenols[J].Food Chemistry, 2023, 415:135733.
[16] ZHANG C H, LI C Z, ZHU Y L, et al.Stability of a novel glycosylated peanut protein isolate delivery system loaded with Gallic acid[J].Food Chemistry, 2024, 437:137790.
[17] 张子微, 段子渊, 程卯生.多酚类化合物对脂代谢的影响[J].中国食品工业, 2024(14):87-89.ZHANG Z W, DUAN Z Y, CHENG M S.Effects of polyphenols on lipid metabolism[J].China Food Industry, 2024(14):87-89.
[18] CUTRIM C S, CORTEZ M A S.A review on polyphenols:Classification, beneficial effects and their application in dairy products[J].International Journal of Dairy Technology, 2018, 71(3):564-578.
[19] ALASALVAR C, CHANG S K, BOLLING B, et al.Specialty seeds:Nutrients, bioactives, bioavailability, and health benefits:A comprehensive review[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(3):2382-2427.
[20] LUCINI MAS A, BRIGANTE F I, SALVUCCI E, et al.Defatted chia flour as functional ingredient in sweet cookies.How do Processing, simulated gastrointestinal digestion and colonic fermentation affect its antioxidant properties?[J].Food Chemistry, 2020, 316:126279.
[21] CHEN R, OH H B, PARAMESWARAN R, et al.Practice patterns in parathyroid surgery:A survey of Asia-Pacific parathyroid surgeons[J].World Journal of Surgery, 2019, 43(8):1964-1971.
[22] SLATNAR A, MIKULIC-PETKOVSEK M, STAMPAR F, et al.Identification and quantification of phenolic compounds in kernels, oil and bagasse pellets of common walnut (Juglans regia L.)[J].Food Research International, 2015, 67:255-263.
[23] VU D C, VO P H, COGGESHALL M V, et al.Identification and characterization of phenolic compounds in black walnut kernels[J].Journal of Agricultural and Food Chemistry, 2018, 66(17):4503-4511.
[24] 陈佩云, 湛晔, 周安宁, 等.比较6种油茶花、叶和籽的多酚含量及其抗氧化活性[J].现代食品, 2019, 25(24):149-153.CHEN P Y, ZHAN Y, ZHOU A N, et al.Comparison of polyphenol content and antioxidant activity of six kinds of Camellia oleifera flowers, leaves and seeds[J].Modern Food, 2019, 25(24):149-153.
[25] ÖZCAN M M, YLMAZ F G, USLU N, et al.Determination of bioactive compounds, phenolic contents, fatty acid and biogenic element profiles of the seeds of sunflower (Helianthus annuus L.) genotypes[J].Food and Humanity, 2024, 2:100222.
[26] WEISZ G M, KAMMERER D R, CARLE R.Identification and quantification of phenolic compounds from sunflower (Helianthus annuus L.) kernels and shells by HPLC-DAD/ESI-MSn[J].Food Chemistry, 2009, 115(2):758-765.
[27] HAN Y M, CHI J W, ZHANG M W, et al.Changes in saponins, phenolics and antioxidant activity of quinoa (Chenopodium quinoa Willd) during milling process[J].LWT, 2019, 114:108381.
[28] HEMALATHA P, BOMZAN D P, SATHYENDRA RAO B V, et al.Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects on α-amylase and α-glucosidase activities[J].Food Chemistry, 2016, 199:330-338.
[29] PELLEGRINI M, LUCAS-GONZALEZ R, SAYAS-BARBER E, et al.Bioaccessibility of phenolic compounds and antioxidant capacity of chia (Salvia hispanica L.) seeds[J].Plant Foods for Human Nutrition, 2018, 73(1):47-53.
E, et al.Bioaccessibility of phenolic compounds and antioxidant capacity of chia (Salvia hispanica L.) seeds[J].Plant Foods for Human Nutrition, 2018, 73(1):47-53.
[30] 熊雅婷, 张亚丽, 李真顺.多酚/植物蛋白质复合物的界面特性及其在乳液中的应用研究进展[J].食品科技, 2021, 46(12):258-262.XIONG Y T, ZHANG Y L, LI Z S.Development of the interfacial properties of polyphenol/plant protein complexes and their applications in emulsions[J].Food Science and Technology, 2021, 46(12):258-262.
[31] 齐奇, 李艳霞, 杨凯, 等.内源多酚对松仁各组分蛋白理化性质、功能特性和结构的影响[J].食品科学, 2022, 43(16):81-89.QI Q, LI Y X, YANG K, et al.Effects of endogenous polyphenols on the physicochemical and functional properties and structure of pine kernel proteins[J].Food Science, 2022, 43(16):81-89.
[32] RUBINO M I, ARNTFIELD S D, NADON C A, et al.Phenolic protein interactions in relation to the gelation properties of canola protein[J].Food Research International, 1996, 29(7):653-659.
[33] SALGADO P R, L PEZ-CABALLERO M E, G
PEZ-CABALLERO M E, G MEZ-GUILLÉN M C, et al.Exploration of the antioxidant and antimicrobial capacity of two sunflower protein concentrate films with naturally present phenolic compounds[J].Food Hydrocolloids, 2012, 29(2):374-381.
MEZ-GUILLÉN M C, et al.Exploration of the antioxidant and antimicrobial capacity of two sunflower protein concentrate films with naturally present phenolic compounds[J].Food Hydrocolloids, 2012, 29(2):374-381.
[34] QUAN T H, BENJAKUL S, SAE-LEAW T, et al.Protein-polyphenol conjugates:Antioxidant property, functionalities and their applications[J].Trends in Food Science &Technology, 2019, 91:507-517.
[35] KAREFYLLAKIS D, ALTUNKAYA S, BERTON-CARABIN C C, et al.Physical bonding between sunflower proteins and phenols:Impact on interfacial properties[J].Food Hydrocolloids, 2017, 73:326-334.
[36] XU P W, YUE X J, YUAN X F, et al.Non-covalent interaction between hemp seed globulin and two hemp seed phenolic compounds:Mechanism and effects on protein structure, bioactivity, and in vitro simulated digestion[J].International Journal of Biological Macromolecules, 2024, 255:128077.
[37] ZHANG Q Z, CHENG Z Z, WANG Y B, et al.Dietary protein-phenolic interactions:Characterization, biochemical-physiological consequences, and potential food applications[J].Critical Reviews in Food Science and Nutrition, 2021, 61(21):3589-3615.
[38] HAO L L, SUN J W, PEI M Q, et al.Impact of non-covalent bound polyphenols on conformational, functional properties and in vitro digestibility of pea protein[J].Food Chemistry, 2022, 383:132623.
[39] LE BOURVELLEC C, RENARD C M G C.Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition, 2012, 52(3):213-248.
[40] CHEN Y Y, LI X Y, LI Q M, et al.Dual decoration of quinoa protein isolate by different dietary polyphenols with covalent and noncovalent approaches:Structure characterization, conformational changes and functional properties[J].Food Hydrocolloids, 2024, 156:110376.
[41] PAN X, FANG Y, WANG L L, et al.Covalent interaction between rice protein hydrolysates and chlorogenic acid:Improving the stability of oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry, 2019, 67(14):4023-4030.
[42] 黄子林.核桃多酚对核桃蛋白结构和性质的影响[D].无锡:江南大学,2022.HUANG Z L.Study on the effect of walnut pehnolic compounds on structure and properties of walnut protein[D].Wuxi:Jiangnan University,2022.
[43] WILDERMUTH S R, YOUNG E E, WERE L M.Chlorogenic acid oxidation and its reaction with sunflower proteins to form green-colored complexes[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(5):829-843.
[44] WANG H, YOU S P, WANG W H, et al.Laccase-catalyzed soy protein and Gallic acid complexation:Effects on conformational structures and antioxidant activity[J].Food Chemistry, 2022, 375:131865.
[45] GU L P, PENG N, CHANG C H, et al.Fabrication of surface-active antioxidant food biopolymers:Conjugation of catechin polymers to egg white proteins[J].Food Biophysics, 2017, 12(2):198-210.
[46] LIU F G, MA C C, GAO Y X, et al.Food-grade covalent complexes and their application as nutraceutical delivery systems:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(1):76-95.
[47] FENG J, CAI H, WANG H, et al.Improved oxidative stability of fish oil emulsion by grafted ovalbumin-catechin conjugates[J].Food Chemistry, 2018, 241:60-69.
[48] KONG X Z, HUANG Z L, ZHANG C M, et al.Phenolic compounds in walnut pellicle improve walnut (Juglans regia L.) protein solubility under pH-shifting condition[J].Food Research International, 2023, 163:112156.
[49] XU P W, YUE X J, YUAN X F, et al.Covalent modification using hemp seed polyphenols improves the structural and functional properties of the hemp seed globulin[J].Food Bioscience, 2023, 56:103293.
[50] TANG M G, YANG M, XU L K, et al.Covalent interactions between walnut protein isolate and chlorogenic acid impact the formation, structure, functionality and emulsions stability of the isolates[J].LWT, 2024, 199:115991.
[51] AHMAD MALIK M, SAINI C S.Polyphenol removal from sunflower seed and kernel:Effect on functional and rheological properties of protein isolates[J].Food Hydrocolloids, 2017, 63:705-715.
[52] SUBA
 B G, CASANOVA F, CAPANOGLU E, et al.Protein extracts from de-oiled sunflower cake:Structural, physico-chemical and functional properties after removal of phenolics[J].Food Bioscience, 2020, 38:100749.
B G, CASANOVA F, CAPANOGLU E, et al.Protein extracts from de-oiled sunflower cake:Structural, physico-chemical and functional properties after removal of phenolics[J].Food Bioscience, 2020, 38:100749.
[53] TANG C B, ZHANG W G, ZOU Y F, et al.Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J].Food Hydrocolloids, 2017, 67:197-205.
[54] ALU’DATT M H, RABABAH T, ALLI I.Effect of phenolic compound removal on rheological, thermal and physico-chemical properties of soybean and flaxseed proteins[J].Food Chemistry, 2014, 146:608-613.
[55] HASLAM E.Plant Polyphenols:Vegetable Tannins Revisited[M].Cambridge:Cambridge University Press, 1989.
[56] ZHANG K Y, HUANG J B, WANG D X, et al.Covalent polyphenols-proteins interactions in food processing:Formation mechanisms, quantification methods, bioactive effects, and applications[J].Frontiers in Nutrition, 2024, 11:1371401.
[57] LIN D Q, LU W, KELLY A L, et al.Interactions of vegetable proteins with other polymers:Structure-function relationships and applications in the food industry[J].Trends in Food Science &Technology, 2017, 68:130-144.
[58] JIA W Q, SETHI D S, VAN DER GOOT A J, et al.Covalent and non-covalent modification of sunflower protein with chlorogenic acid:Identifying the critical ratios that affect techno-functionality[J].Food Hydrocolloids, 2022, 131:107800.
[59] CAO W W, CHEN J L, MA S H, et al.Structure characterization and functional properties of flaxseed protein-chlorogenic acid complex[J].Foods, 2023, 12(24):4449.
[60] SALGADO P R, MOLINA ORTIZ S E, PETRUCCELLI S, et al.Biodegradable sunflower protein films naturally activated with antioxidant compounds[J].Food Hydrocolloids, 2010, 24(5):525-533.
[61] SARICAOGLU B, YLMAZ H, SUBA B G, et al.Effect of de-phenolization on protein-phenolic interactions of sunflower protein isolate[J].Food Research International, 2023, 164:112345.
B G, et al.Effect of de-phenolization on protein-phenolic interactions of sunflower protein isolate[J].Food Research International, 2023, 164:112345.
[62] WANG Y Z, LV J, LI C, et al.Walnut protein isolate-epigallocatechin gallate nanoparticles:A functional carrier enhanced stability and antioxidant activity of lycopene[J].Food Research International, 2024, 189:114536.
[63] PHAM L B, WANG B, ZISU B, et al.Covalent modification of flaxseed protein isolate by phenolic compounds and the structure and functional properties of the adducts[J].Food Chemistry, 2019, 293:463-471.
[64] WANG Y Z, CAO S N, MENG Y Y, et al.Mechanisms underlying the effect of walnut pellicle extracts and its four representative polyphenols on in vitro digestion of walnut protein isolate[J].Food and Bioproducts Processing, 2024, 144:166-177.
[65] ALU’DATT M H, RABABAH T, EREIFEJ K, et al.Phenolic-protein interactions in oilseed protein isolates[J].Food Research International, 2013, 52(1):178-184.
[66] 黄子林, 陈思蕊, 孔祥珍, 等.核桃衣多酚改性对植物蛋白溶解性和抗氧化活性的影响[J].中国油脂, 2023, 48(4):112-118.HUANG Z L, CHEN S R, KONG X Z, et al.Effect of walnut pellicle polyphenols modification on solubility and antioxidant activity of vegetable protein[J].China Oils and Fats, 2023, 48(4):112-118.
[67] HE X, YANG W S, ZHAO Q H, et al.Controlled oxidation and digestion of Pickering emulsions stabilized by quinoa protein and (-)-epigallocatechin-3-gallate (EGCG) hybrid particles[J].International Journal of Biological Macromolecules, 2023, 253(2):126755.
[68] MA J, TONG P Y, CHEN Q W, et al.Covalent conjugation with polyphenol reduced the sensitization of walnut and ameliorated allergy by enhancing intestinal epithelial barrier in mice[J].Food Chemistry, 2024, 439:138191.
[69] CAO H, SAROGLU O, KARADAG A, et al.Available technologies on improving the stability of polyphenols in food processing[J].Food Frontiers, 2021, 2(2):109-139.
[70] LI P, ZHANG Y J, CAO C W, et al.Screening and characterization of antioxidant film applicable to walnut kernels from Juglans sigillata[J].Foods, 2024, 13(9):1313.
[71] PETRARU A, AMARIEI S.A novel approach about edible packaging materials based on oilcakes:A review[J].Polymers, 2023, 15(16):3431.
[72] GONZ LEZ-PÉREZ S, VEREIJKEN J M.Sunflower proteins:Overview of their physicochemical, structural and functional properties[J].Journal of the Science of Food and Agriculture, 2007, 87(12):2173-2191.
LEZ-PÉREZ S, VEREIJKEN J M.Sunflower proteins:Overview of their physicochemical, structural and functional properties[J].Journal of the Science of Food and Agriculture, 2007, 87(12):2173-2191.
[73] SALGADO P R, FERN NDEZ G B, DRAGO S R, et al.Addition of bovine plasma hydrolysates improves the antioxidant properties of soybean and sunflower protein-based films[J].Food Hydrocolloids, 2011, 25(6):1433-1440.
NDEZ G B, DRAGO S R, et al.Addition of bovine plasma hydrolysates improves the antioxidant properties of soybean and sunflower protein-based films[J].Food Hydrocolloids, 2011, 25(6):1433-1440.
[74] CAO M M, LIAO L, ZHANG X C, et al.Electric field-driven fabrication of anisotropic hydrogels from plant proteins:Microstructure, gel performance and formation mechanism[J].Food Hydrocolloids, 2023, 136:108297.
[75] FABER I, POUVREAU L, JAN VAN DER GOOT A, et al.Modulating commercial pea protein gel properties through the addition of phenolic compounds[J].Food Hydrocolloids, 2024, 154:110123.
[76] HU B, SHEN Y, ADAMCIK J, et al.Polyphenol-binding amyloid fibrils self-assemble into reversible hydrogels with antibacterial activity[J].ACS Nano, 2018, 12(4):3385-3396.
[77] XIE W L, HUANG Y, XIANG Y Z, et al.Insights into the binding mechanism of polyphenols and fish myofibrillar proteins explored using multi-spectroscopic methods[J].Food and Bioprocess Technology, 2020, 13(5):797-806.
[78] LIN D Q, SUN L C, HUO W S, et al.Improved functionality and safety of peptides by the formation of peptide-polyphenol complexes[J].Trends in Food Science &Technology, 2023, 141:104193.
[79] MA J Q, ZHANG X Y, DU Z X, et al.Construction of protein hydrogels with antibacterial activity by interaction of β-lactoglobulin amyloid fibrils with epigallocatechin-3-gallate[J].Food Bioscience, 2024, 58:103632.
[80] NIKBAKHT NASRABADI M, SEDAGHAT DOOST A, MEZZENGA R.Modification approaches of plant-based proteins to improve their techno-functionality and use in food products[J].Food Hydrocolloids, 2021, 118:106789.