γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种由L-谷氨酸钠在谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)作用下产生的四碳氨基酸,广泛存在于微生物与动植物体内[1]。GABA是一种抑制性神经递质,与受体特异性结合后发挥降血压、抗焦虑、改善睡眠等多种生理功能[2-3]。随着社会压力的增大与年龄的增长,身体产生GABA的能力下降,补充适量的GABA能够改善焦虑和睡眠[4]。
GABA的生产方法有化学合成法、植物富集法和微生物发酵法[5]。化学合成法的反应温度高,常使用腐蚀性试剂,生产成本高且安全性低。植物富集法通过改变外界环境,使植物产生应激反应进而提高GABA产量[6]。植物富集法存在基质复杂,提取困难,成本高等问题,不适合工业化生产。微生物发酵法具有安全性高、成本低、周期短、不受资源和环境的限制等优点,成为了规模化生产GABA的理想途径,近年来成为研究热点。微生物发酵法生产GABA常用的菌种有酵母菌、霉菌、乳酸菌、大肠杆菌[7-8]。霉菌生长缓慢、发酵周期长,且有时会代谢毒素,因此实用性和安全性不高。酵母菌普遍GAD活力不足,因此GABA产量较低。乳酸菌是公认的食品安全级微生物,具有调节肠道菌群、抗氧化、提高机体免疫力等多种生理功能[9-10]。乳酸菌GAD活性普遍高于其他菌株,利用乳酸菌生产GABA在食品及医药领域更具优势。
本研究从酸菜中筛选出高产GABA的乳酸菌,对菌株发酵液中的GABA进行定性定量,对菌株的生长特性、产酸能力、耐酸耐胆盐能力、耐胃肠液能力、自凝聚能力和表面疏水性等益生特性进行分析,为今后利用乳酸菌生产GABA提供菌种资源,为后续GABA功能性食品的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源
本实验所用的菌株分离自农家自制酸菜。
1.1.2 药品及试剂
MRS培养基,青岛海博生物技术有限公司;L-谷氨酸钠、胃蛋白酶、胰蛋白酶,北京索莱宝科技有限公司;正丁醇、无水乙酸、茚三酮、硼酸、NaOH、苯酚、次氯酸钠、二甲苯,胆盐,上海沪试有限公司;GABA标品,坛墨质检标准物质中心;盐酸,安徽金奥冠新材料科技有限公司。
1.1.3 仪器与设备
BKQ-B50Ⅱ立式高压蒸汽灭菌锅,济南爱来宝医疗科技有限公司;ZWYR-D2401恒温振荡器,上海智城分析仪器制造有限公司;SW-CJ-1F超净工作台,成都市苏净科学器材有限公司;DNP-9022电热恒温培养箱,上海精宏有限公司;HH-S4A电热恒温水浴锅,北京能克方圆科技有限公司;PB-10 pH计,赛多利斯有限公司;CPJ3102电子天平,奥豪斯有限公司;Multiskan FC酶标仪、Multifuge X1R高速离心机、Evolution200紫外分光光度计,赛默飞世尔科技公司。
1.2 实验方法
1.2.1 菌种的分离与纯化
将酸菜汁接种到50 mL MRS肉汤培养基中,37 ℃,160 r/min培养24 h,取0.5 mL菌液梯度稀释,取20 μL稀释后菌液接种到MRS固体培养基涂布,37 ℃培养24 h。挑取单菌落在MRS固体培养基进行平板划线,37 ℃培养24 h,重复平板划线3次。
1.2.2 薄层层析法定性测定
将菌液以体积分数4%的接种量,接种至50 mL MRS发酵培养基(MRS液体培养基+10 g/L L-谷氨酸钠)中37 ℃,160 r/min培养48 h,发酵液于4 ℃,12 000 r/min离心5 min,取上清液进行薄层层析。
参考李欢等[11]的方法进行薄层层析法定性测定,展开剂为V(水)∶V(无水乙醇)∶V(正丁醇)=3∶1∶4,加入质量分数为0.4%茚三酮溶液作为显色剂。参比选择1 g/L GABA标准品和1 g/L L-谷氨酸钠,取1.5 μL发酵上清液点样,层析后放置90 ℃烘箱10 min。
1.2.3 Berthelot比色法定量测定
参考王冰聪[12]的方法进行Berthelot比色法定量测定,配制0、0.10、0.40、0.60、1.00、2.00、4.00 g/L 的GABA标准溶液,稀释4倍后取各浓度标准液0.5 mL,加入0.2 mL硼酸盐缓冲液(0.2 mol/L,pH=9.0),1 mL体积分数为6%苯酚溶液和0.4 mL体积分数为9% NaClO溶液。振荡2 min后放入沸水水浴10 min,再冰浴20 min,振荡2 min后加入2 mL体积分数为60%乙醇溶液,于645 nm波长下检测吸光度。建立标准曲线后,发酵上清液处理同1.2.3节。
1.2.4 乳酸菌的形态学鉴定
将纯化好的菌种在MRS固体培养基上进行平板划线,37 ℃培养24 h,观察菌落形态、颜色、边缘隆起,挑取单菌落进行革兰氏染色,观察菌体形态特征。
1.2.5 乳酸菌的分子生物学鉴定
16S rDNA序列委托华大基因科技有限公司测定。测定引物分别为AGAGTTTGATCCTGGCTCAG、TACGGCTACCTTGTTACGACTT。PCR反应体系(总体积25 μL):PCR Mix 21 μL,Primer F和Primer R各1 μL,DNA模板2 μL。PCR扩增条件:96 ℃预变性5 min,96 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃再延伸5 min,4 ℃保存。将测序结果与GenBank数据库中已知序列进行BLAST比对,采用MEGA 11.0构建系统发育树。
1.2.6 生长曲线、产酸曲线和GABA产量积累曲线的测定
菌株以体积分数1%的接种量,接种MRS肉汤培养基中37 ℃,160 r/min培养24 h,每间隔2 h检测菌株发酵液在600 nm的吸光度和pH值。以1%的接种量,将菌株接种到MRS肉汤培养基中,37 ℃,160 r/min培养48 h,每间隔4 h检测发酵液GABA含量。
1.2.7 耐酸与耐胆盐能力的测定
菌株以体积分数1%的接种量,分别接种到pH=4、pH=3、胆盐质量浓度1 g/L的MRS肉汤培养基中,37 ℃,160 r/min培养,在0、2、4 h取菌株发酵液进行梯度稀释,取10 μL稀释后的菌株发酵液于MRS固体培养基上涂布,37 ℃培养24 h,进行平板活菌计数和存活率计算,如公式(1)所示:
菌株存活率![]()
(1)
式中:A0,0 h活菌数,CFU/mL;A1,处理后活菌数,CFU/mL。
1.2.8 耐胃肠液能力的测定
将菌液4 ℃,12 000 r/min离心5 min,生理盐水洗涤沉淀后再离心,3 mL人工胃液(pH=3,3 g/L胃蛋白酶)与沉淀混匀,37 ℃培养3 h,取1 mL处理后的菌液与9 mL人工肠液混合,37 ℃培养2 h。计算菌株在人工胃肠液的活菌数和存活率。
1.2.9 自凝聚与表面疏水性的测定
将菌液4 ℃,12 000 r/min离心5 min,生理盐水洗涤沉淀后再离心,用生理盐水重悬至OD600=0.5±0.02,37 ℃静置培养,0、2、4、6、8 h取上清液测定波长600 nm处的吸光度,自凝集性计算如公式(2)所示:
自凝集性![]()
(2)
式中:A0,0 h吸光度;A1,菌液静置后的吸光度。
将菌液4 ℃,12 000 r/min离心5 min,生理盐水洗涤沉淀后再离心,用生理盐水重悬至OD600=0.4±0.05,取2 mL菌液与同体积二甲苯混合,振荡后静置,取1、2、3 h混合物的下层水相,测定600 nm处的吸光度,疏水作用力计算如公式(3)所示:
疏水作用力![]()
(3)
式中:A0,菌液与二甲苯混合前的吸光度;A,菌液与二甲苯混合后的吸光度。
1.3 数据处理
实验数据使用Origin、Excel进行作图和数据统计分析,实验均重复3次,数据以“平均值±标准差”表示。
2 结果与分析
2.1 产GABA菌株的筛选
通过薄层层析法对GABA进行定性。由图1-a可知,各菌株发酵液有和GABA标准品Rf值相同的部分,其中菌株C1和G6-2的颜色较深,产GABA的能力较强。
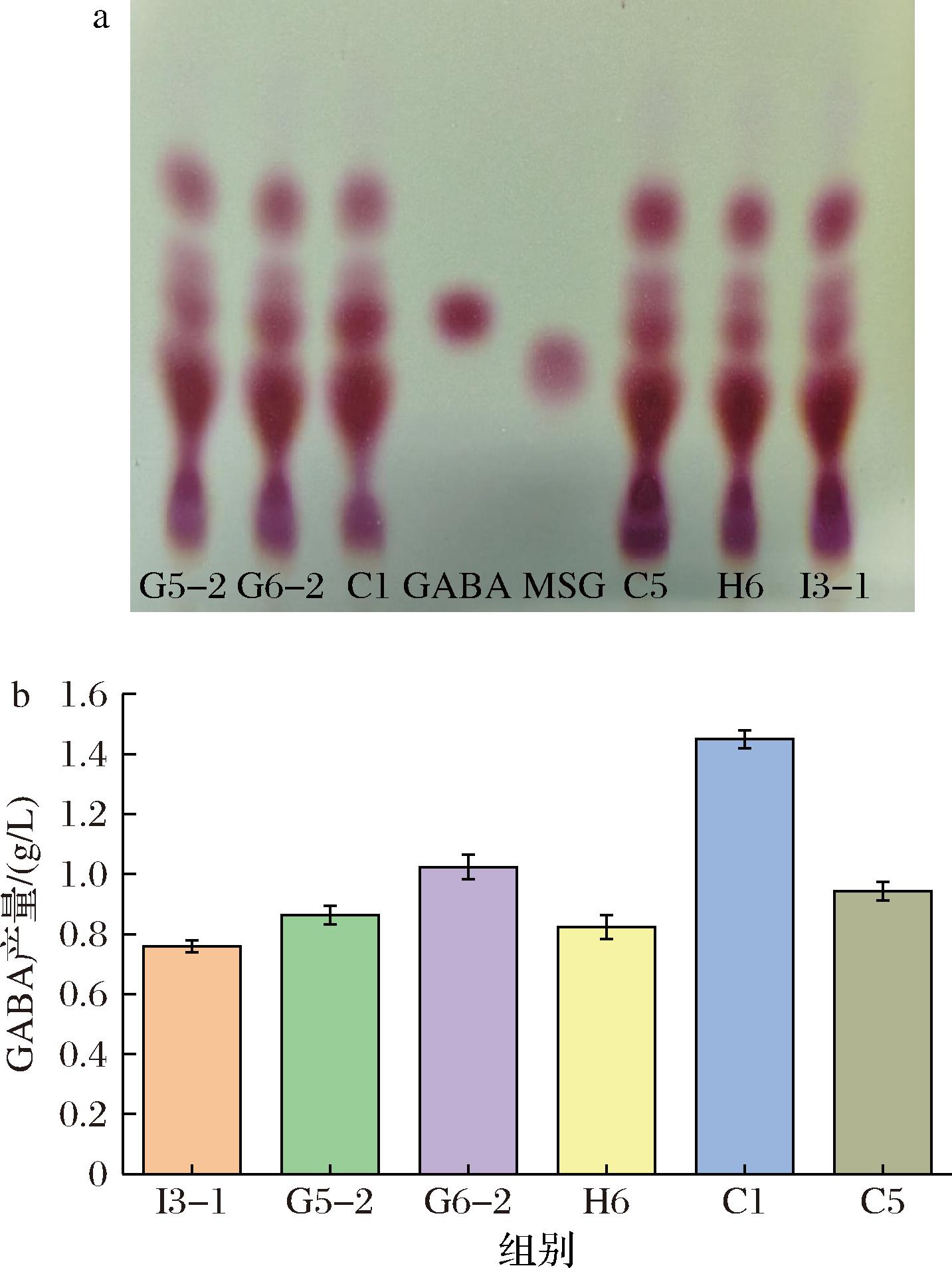
a-菌株发酵液薄层层析;b-菌株发酵液GABA含量
图1 菌株发酵液的薄层层析图和GABA含量图
Fig.1 Thin layer chromatography and GABA content of the fermentation broth of the strain
通过Berthelot比色法对GABA进行定量。GABA含量的线性回归方程为y=0.181 7x-0.005 5,R2=0.999 3。参照薄层层析的结果,选取6株高产GABA的菌株发酵液进行定量。由图1-b可知,C1菌株发酵液GABA含量最高,为1.45 g/L。
2.2 菌株的形态学特性
结果如图2所示,6株菌的菌落为乳白色,表面光滑湿润,中央突起,对各菌株进行革兰氏染色,菌株均为革兰氏阳性菌,其中C5为球形,其他菌株均为短杆状。

a-菌落形态图;b-菌体形态图
图2 菌株的菌落形态图和菌体形态图
Fig.2 The colony morphology and cell morphology of the strain
2.3 乳酸菌的分子生物学鉴定
对6株高产GABA乳酸菌进行16S rDNA测序。如表1所示,C1为布氏乳杆菌(Lactobacillus buchneri),C5为戊糖片球菌(Pediococcus pentosaceus),G5-2、G6-2、H6、I3-1均为植物乳植杆菌(Lactiplantibacillus plantarum)。
表1 乳酸菌鉴定结果
Table 1 Identification results of lactic acid bacteria

菌株编号菌株种类拉丁文I3-1植物乳植杆菌L.plantarumG5-2植物乳植杆菌L.plantarumG6-2植物乳植杆菌L.plantarumH6植物乳植杆菌L.plantarumC1布氏乳杆菌L.buchneriC5戊糖片球菌P.pentosaceus
2.4 生长和产酸曲线
由图3-a可知,6株乳酸菌生长曲线呈“S”型,C1与C5从2 h开始率先进入对数生长期,2~16 h为对数生长期,最终C1的OD600值最高为2.39。由图3-b可知,C1与C5从2 h发酵液pH迅速下降,与生长曲线趋势一致,从12 h开始C1的菌浓度和产酸能力反超C5。最终G5-2产酸效果最好,pH值为3.76,C1发酵液pH值为3.83。
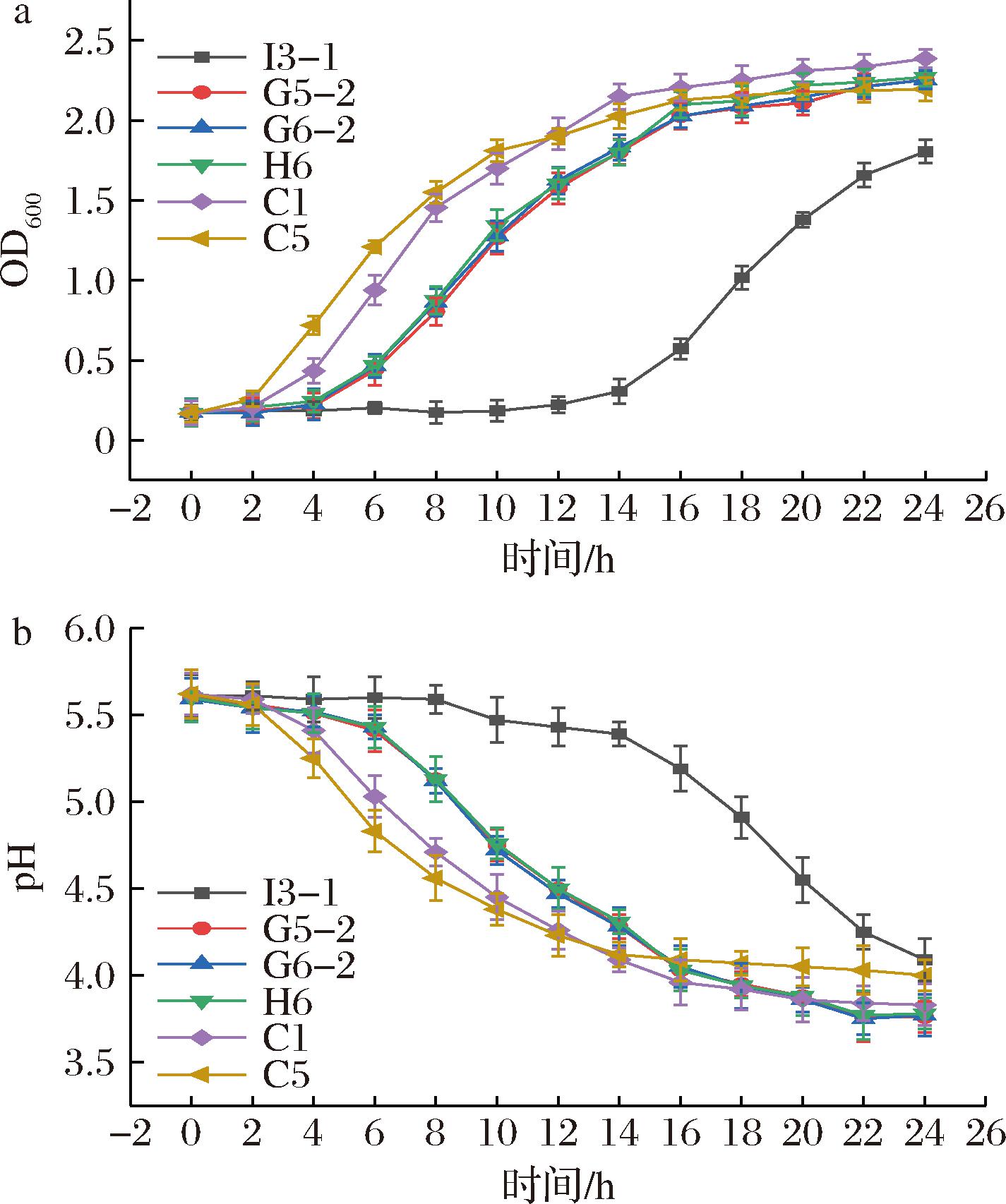
a-生长曲线;b-产酸曲线
图3 菌株的生长曲线和产酸曲线
Fig.3 The growth curve and acid production curve of the strain
2.5 GABA产量积累曲线
GABA的产量积累受到GAD活性影响。L-谷氨酸钠在GAD作用下脱羧消耗质子产生GABA,是乳酸菌抵抗酸胁迫、维持细胞内酸碱平衡的重要方式[13]。不同菌株的GAD活性和GAD最适pH不同,环境pH值在GAD最适pH范围时GAD活性最强[14]。GABA的发酵过程分为菌体生长阶段和GABA合成阶段[15]。由图4可知,0~16 h布氏乳杆菌C1处于菌体生长阶段,GABA产量积累缓慢,16 h时培养基pH值达到3.96,菌株GAD活性良好,GABA产量积累迅速,48 h时GABA产量达到1.45 g/L。
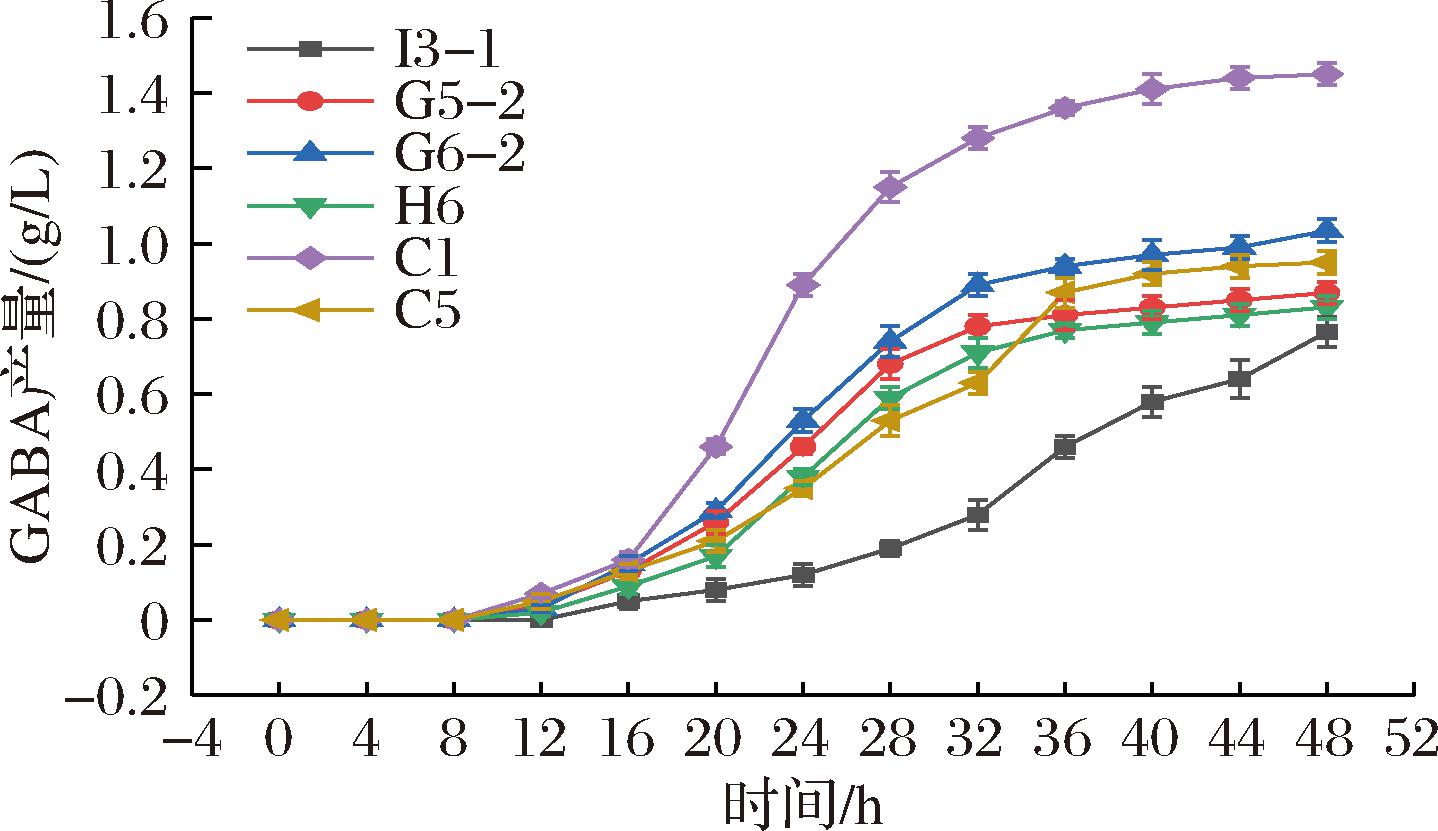
图4 GABA产量积累曲线图
Fig.4 GABA yield accumulation curve
2.6 乳酸菌耐酸能力
在胃液低pH下存活是乳酸菌发挥益生功能的前提。由表2可知,6株乳酸菌在pH=4时存活率菌超过100%,可以正常生长繁殖。在pH=3时G6-2存活率最高为95.50%,C5存活率最低为17.38%,H6和C1存活率也较为良好,分别为87.10%和83.18%。
表2 不同菌株的耐酸能力
Table 2 Acid resistance of different strains
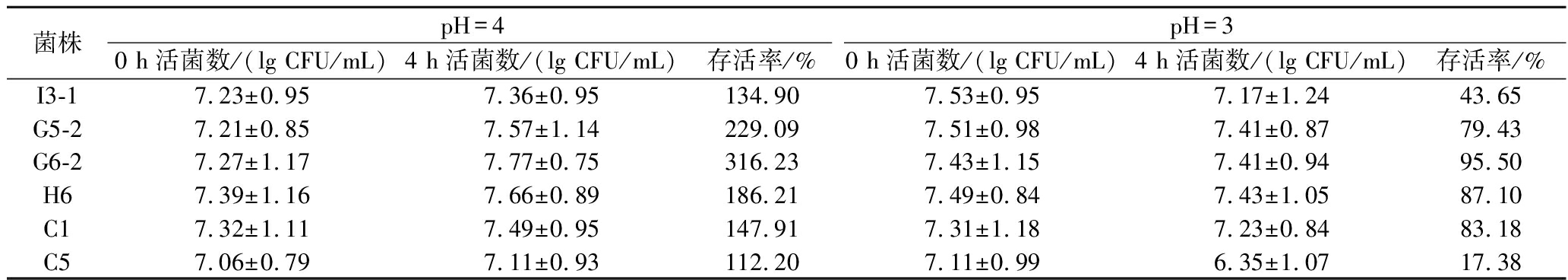
菌株pH=4 pH=30 h活菌数/(lg CFU/mL)4 h活菌数/(lg CFU/mL)存活率/%0 h活菌数/(lg CFU/mL)4 h活菌数/(lg CFU/mL)存活率/%I3-17.23±0.957.36±0.95134.907.53±0.957.17±1.2443.65G5-27.21±0.857.57±1.14229.097.51±0.987.41±0.8779.43G6-27.27±1.177.77±0.75316.237.43±1.157.41±0.9495.50H67.39±1.167.66±0.89186.217.49±0.847.43±1.0587.10C17.32±1.117.49±0.95147.917.31±1.187.23±0.8483.18C57.06±0.797.11±0.93112.207.11±0.996.35±1.0717.38
2.7 乳酸菌耐胆盐能力
胆盐由肝细胞分泌,参与脂肪的消化和吸收。小肠中存在一定浓度的胆盐,乳酸菌在肠道定殖需要一定的耐胆盐能力。由表3可知,I3-1、G5-2、G6-2、H6四株乳酸菌不耐受胆盐,C1的存活率最高,2 h和4 h存活率分别为95.50%和85.11%。
表3 不同菌株的耐胆盐能力
Table 3 Bile salt tolerance of different strains

菌株0 h活菌数/(lg CFU/mL)2 h活菌数/(lg CFU/mL)4 h活菌数/(lg CFU/mL)2 h存活率/%4 h存活率/%I3-17.51±1.170000G5-27.50±0.870000G6-27.58±0.940000H67.68±1.030000C17.68±0.987.66±1.087.61±0.8895.5085.11C57.39±0.896.98±0.956.94±1.0238.9035.48
2.8 耐胃肠液能力
耐胃肠液能力可反映菌株在消化道环境中的耐受能力。由表4可知,在人工胃液中培养3 h后C1存活率最高,达到69.18%,转入人工肠液再培养2 h后为12.30%。其他菌株在人工胃肠液的存活率均较低。
表4 不同菌株的耐胃肠液能力
Table 4 Gastrointestinal fluid resistance of different strains
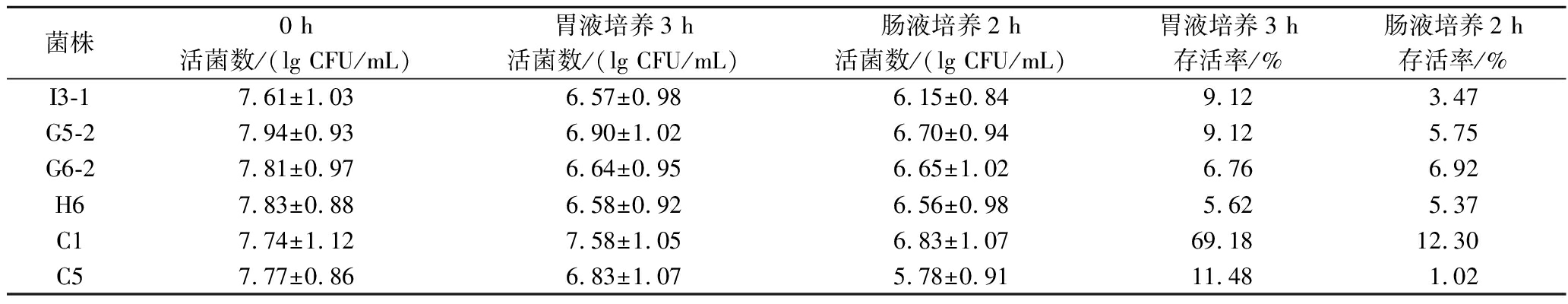
菌株0 h胃液培养3 h肠液培养2 h胃液培养3 h肠液培养2 h活菌数/(lg CFU/mL)活菌数/(lg CFU/mL)活菌数/(lg CFU/mL)存活率/%存活率/%I3-17.61±1.036.57±0.986.15±0.849.123.47G5-27.94±0.936.90±1.026.70±0.949.125.75G6-27.81±0.976.64±0.956.65±1.026.766.92H67.83±0.886.58±0.926.56±0.985.625.37C17.74±1.127.58±1.056.83±1.0769.1812.30C57.77±0.866.83±1.075.78±0.9111.481.02
2.9 自凝聚性和表面疏水性
研究表明,自凝聚性和表面疏水性与Caco-2细胞黏附率呈正相关,在益生菌肠道定殖中发挥重要作用[16]。由图5-a可知,2 h时C1自凝聚性最强达到14.19%,4、6、8 h时H6凝集性最强分别为33.57%、39.54%和42.36%。C1在4、6、8 h时凝集性为18.84%、26.65%和29.20%。由图5-b可知,H6的表面疏水性最强,在3 h达到73.81%。C1的表面疏水性较弱,在3 h达到55.56%。
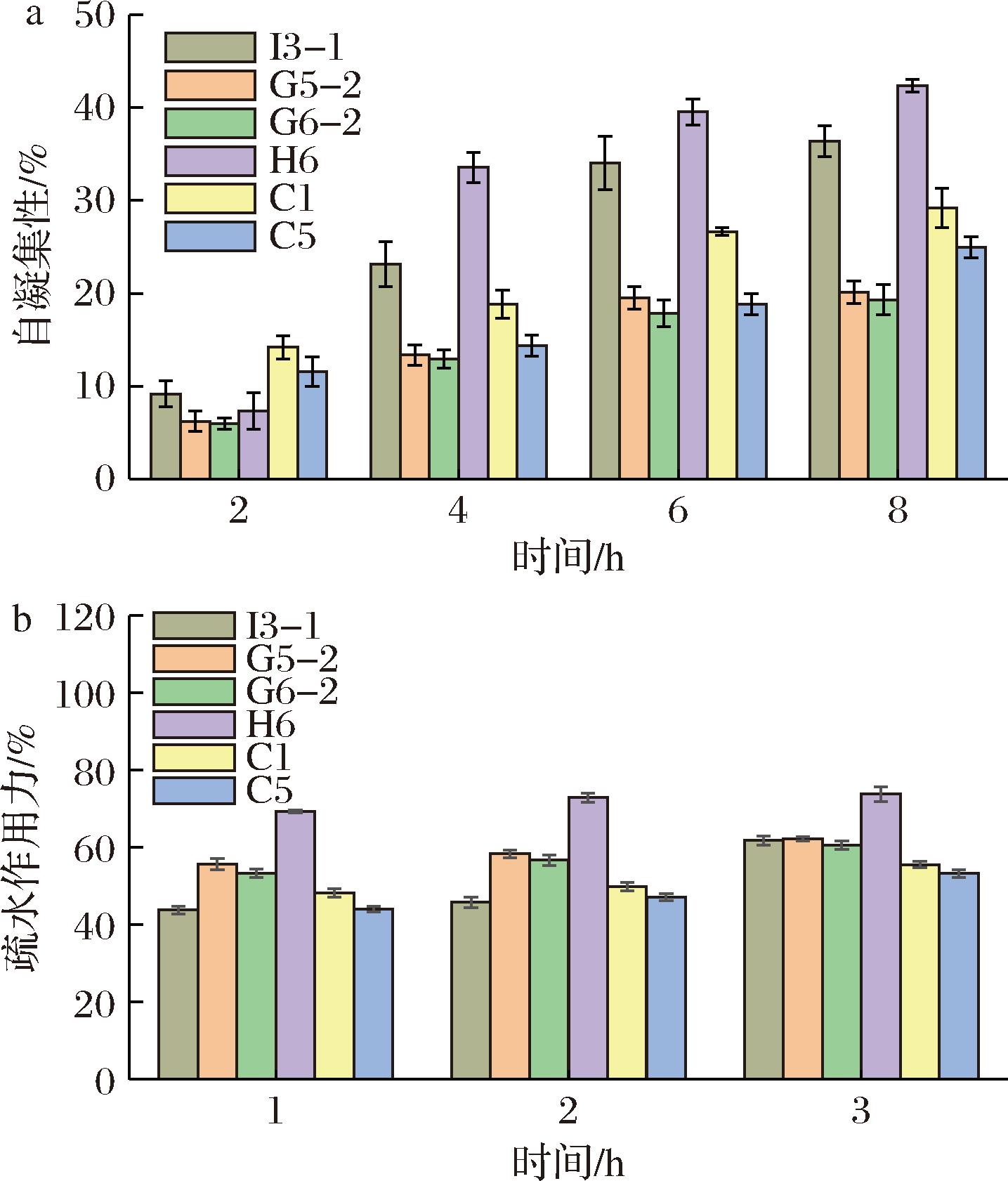
a-自凝聚性;b-表面疏水性
图5 菌株的自凝聚性和表面疏水性
Fig.5 Self-agglomeration ability and surface hydrophobicity of the strain
3 讨论与结论
随着生活节奏的加快和生活方式的改变,人们常常出现失眠、焦虑、血压升高等症状。GABA作为一种抑制性的神经递质,具有帮助睡眠、缓解焦虑、降血压等功效[17]。乳酸菌是是公认的食品安全级微生物,同时也是益生菌,具有调节肠道菌群、抗氧化、提高机体免疫力等多种生理功能。选择乳酸菌生产GABA具有安全、高效、成本低廉等多种优势,所以筛选高产GABA且具有良好益生特性的乳酸菌是市场的迫切需求。本研究选用农家自制酸菜为原料,对高产GABA且益生特性良好的乳酸菌进行筛选鉴定和分析。
本研究从酸菜中筛选得到6株高产GABA的乳酸菌,布氏乳杆菌(L.buchneri)C1菌株发酵液GABA含量最高,为1.45 g/L。吕欣然等[18]从东北传统腌渍蔬菜中筛选出植物乳植杆菌,GABA产量为0.48 g/L。王清清等[19]对乳酸菌进行航天诱变,得到植物乳植杆菌L1-51和乳酸片球菌L21-48,GABA产量分别为0.77 g/L和0.48 g/L,两菌株共培养响应面优化后GABA产量为1.68 g/L。马莉等[20]从浆水中分离出植物乳植杆菌,对GABA产量进行响应面优化,最终产量为0.78 g/L。李朔[21]从发酵食品中发现一株GABA产量2.114 g/L的植物乳植杆菌,进行发酵条件和培养基优化后GABA产量达到6.152 g/L。施生玲等[22]从牦牛乳酸奶中筛选出GABA产量1.8 g/L的乳酸菌,进行发酵条件优化后GABA产量达到4.11 g/L。金忆文[23]从传统泡菜中筛选出GABA产量5.64 g/L的短乳杆菌,后对该菌株进行气液相等离子体诱变促使菌株GABA产量提高4.37%。林杨[24]从传统发酵乳制品中筛选出高产GABA的戊糖乳杆菌,利用常压室温等离子体诱变和发酵培养条件优化后GABA产量达到3.69 g/L。研究者以L-谷氨酸代替L-谷氨酸钠作为发酵底物,对发酵培养基进行优化后进行分批发酵,最终GABA产量高达205 g/L[25]。面团发酵剂中分离出的高产GABA乳酸菌,采用响应面法优化发酵条件,GABA产量达到49.42 g/L[26]。传统发酵饮料中分离出的希氏乳杆菌,通过发酵条件优化和补料分批发酵,GABA产量达到239 g/L[27]。
乳酸菌在胃肠环境存活并发挥益生功能,需要具备良好的生长速度、耐酸耐胆盐能力、耐胃肠液能力、自凝聚性和表面疏水性。C1的生长繁殖速度最快,24 h时OD600值为2.39。G5-2、G6-2、H6和C1的产酸效果较好,24 h时发酵液pH值分别为3.76、3.77、3.78和3.83。G6-2、H6和C1的耐酸能力较强,存活率分别为95.50%、87.10%、83.18%。C1的耐胆盐能力最强,存活率为85.11%,I3-1、G5-2、G6-2和H6四株乳酸菌不耐胆盐,存活率都为0。C1的耐胃肠液能力最强,存活率为12.30%。2 h时C1自凝聚性在6株菌中最强达到14.19%,4、6、8 h时C1自凝集性为18.84%、26.65%和29.20%。C1的表面疏水性,在3 h达到55.56%。孙世鑫等[28]筛选出高产GABA乳酸菌,24 h时OD600值为0.8,发酵液pH值为5.5,耐酸实验中存活率为65%,不耐胆盐,4 h时自凝聚性和表面疏水性不足10%。吕欣然等[18]筛选出高产GABA乳酸菌,24 h时OD600值为1.9,发酵液pH值为3.7,耐酸实验中存活率为28.33%,耐胆盐实验存活率为55.56%。马莉[29]的植物乳植杆菌不仅生长繁殖能力强,而且在0.3%的高胆盐和pH值2.5的酸性环境下培养3 h后存活率仍在85%以上。徐毓琴等[30]从泡菜中筛选出的植物乳植杆菌,pH值2.0条件下培养4 h后存活率接近100%,0.3%胆盐条件下培养4 h后存活率为9.26%~2.78%。可见对比其他菌株,布氏乳杆菌C1具有良好的生长速度、产酸能力、耐酸耐胆盐能力、自凝聚性和表面疏水性。
综上所述,本研究从农家酸菜中中分离得到高产GABA且益生特性良好的布氏乳杆菌C1,GABA产量为1.45 g/L。该菌株生长繁殖速度快,产酸效果好,具有良好的耐酸耐胆盐能力和耐胃肠液能力,具有一定的自凝集性和表面疏水性。本研究为今后利用乳酸菌生产GABA提供菌种资源,为后续GABA功能性食品的开发奠定基础。
[1] WU Q L, SHAH N P.High γ-aminobutyric acid production from lactic acid bacteria:Emphasis on Lactobacillus brevis as a functional dairy starter[J].Critical Reviews in Food Science and Nutrition, 2017, 57(17):3661-3672.
[2] 谢芳,杨承剑,唐艳,等.含γ-氨基丁酸水牛酸奶对SHR大鼠血压、血脂及小鼠醉酒的影响[J].中国酿造,2015,34(9):97-100.XIE F, YANG C J, TANG Y, et al.Effects of γ-aminobutyric acid buffalo milk yogurt on blood pressure, blood lipids levels of SHR and drunkness of mice[J].China Brewing, 2015,34(9):97-100.
[3] KIM S, JO K, HONG K B, et al.GABA and L-theanine mixture decreases sleep latency and improves NREM sleep[J].Pharmaceutical Biology, 2019, 57(1):64-72.
[4] BOONSTRA E, DE KLEIJN R, COLZATO L S, et al.Neurotransmitters as food supplements:The effects of GABA on brain and behavior[J].Frontiers in Psychology, 2015, 6:1520.
[5] 张瑞姣, 杨鹏, 宫安东, 等.微生物发酵生产γ-氨基丁酸的研究进展[J].信阳师范学院学报(自然科学版), 2023, 36(1):162-172.ZHANG R J, YANG P, GONG A D, et al.Research progress on the production of gamma-aminobutyric acid by microbial fermentation[J].Journal of Xinyang Normal University (Natural Science Edition), 2023, 36(1):162-172.
[6] 王凯凯,孙朦,宋佳敏,等.γ-氨基丁酸(GABA)形成机理及富集方法的研究进展[J].食品工业科技,2018,39(14):323-329.WANG K K, SUN M, SONG J M, et al.Research progress in the formation mechanism and accumulation methods of γ-aminobutyric acid (GABA)[J].Science and Technology of Food Industry, 2018,39(14):323-329.
[7] DURANTI S, LUGLI G A, MANCABELLI L, et al.Prevalence of antibiotic resistance genes among human gut-derived bifidobacteria[J].Applied and Environmental Microbiology, 2017, 83(3):e02894-16.
[8] LI X L, SONG Y, MA X Y, et al.Lactobacillus plantarum and Lactobacillus fermentum alone or in combination regulate intestinal flora composition and systemic immunity to alleviate obesity syndrome in high-fat diet rat[J].International Journal of Food Science &Technology, 2018, 53(1):137-146.
[9] LIU Z J, XU C, TIAN R, et al.Screening beneficial bacteriostatic lactic acid bacteria in the intestine and studies of bacteriostatic substances[J].Journal of Zhejiang University:Science B, 2021, 22(7):533-547.
[10] ZHANG Q Q, ZHAO Q, LI T, et al.Lactobacillus plantarum-derived indole-3-lactic acid ameliorates colorectal tumorigenesis via epigenetic regulation of CD8+ T cell immunity[J].Cell Metabolism, 2023, 35(6):943-960.
[11] 李欢,潘道东,吴振,等.产GABA乳酸菌的筛选鉴定及其发酵条件研究[J].食品工业科技,2020,41(23):78-84.LI H, PAN D D, WU Z, et al.Screening and identification of Lactobacillus producing GABA and study on the fermentation conditions[J].Science and Technology of Food Industry, 2020,41(23):78-84.
[12] 王冰聪.产γ-氨基丁酸乳酸菌的筛选及发酵条件的优化[D].长春:长春大学,2019.WANG B C.Screening of γ-aminobutyric acid-producing lactic acid bacteria and optimization of the fermentation conditions[D].Changchun:Changchun University, 2019.
[13] FEEHILY C, KARATZAS K A G.Role of glutamate metabolism in bacterial responses towards acid and other stresses[J].Journal of Applied Microbiology, 2013, 114(1):11-24.
[14] 刘璐.乳酸杆菌γ-氨基丁酸合成能力的强化研究[D].杭州:浙江大学,2018.LIU L.Improvement of γ-aminobutyric acid biosynthesis capability of Lactobacillus[D].Hangzhou:Zhejiang University, 2018.
[15] 黄俊, 梅乐和, 胡升, 等.pH值控制下γ-氨基丁酸分批发酵动力学模型[J].化学工程, 2008, 36(9):51-54.HUANG J, MEI L H, HU S, et al.γ-Aminobutyric acid batch fermentation dynamics models under pH control[J].Chemical Engineering (China), 2008, 36(9):51-54.
[16] 杨振泉,靳彩娟,张咪,等.高粘附性戊糖片球菌的筛选、标记及其表面疏水与自凝聚性特征[J].食品与生物技术学报,2015,34(9):926-934.YANG Z Q, JIN C J, ZHANG M, et al.Screening and molecular marking of highly adhesive Pediococcus pentosaceus and the characteristics of their surface hydrophobicities and autoaggregation abilities[J].Journal of Food Science and Biotechnology, 2015,34(9):926-934.
[17] 李海峰, 李冰冰, 石硕硕, 等.γ-氨基丁酸在食品中的应用研究进展[J].河南工业大学学报(自然科学版), 2023, 44(1):117-125.LI H F, LI B B, SHI S S, et al.Research progress on the application of γ-aminobutyric acid in food[J].Journal of Henan University of Technology (Natural Science Edition), 2023, 44(1):117-125.
[18] 吕欣然, 李叙波, 佟鑫瑶, 等.东北传统腌渍蔬菜中产γ-氨基丁酸乳酸菌的筛选及其生物特性研究[J].中国食品学报, 2023, 23(12):61-69.LÜ X R, LI X B, TONG X Y, et al.Screening of lactic acid bacteria with production of γ-aminobutyric acid from traditional pickled vegetables in Northeast China and their biological properties[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(12):61-69.
[19] 王清清,张孟雨,江雨静,等.产γ-氨基丁酸航天育种乳酸菌的筛选与发酵剂的制备[J].食品与发酵工业,2024,50(16):93-100.WANG Q Q, ZHANG M Y, JIANG Y J, et al.Screening of space-breeding lactic acid bacteria for γ-aminobutyric acid production and preparation of fermentation starter[J].Food and Fermentation Industries, 2024,50(16):93-100.
[20] 马莉, 刘慧燕, 方海田, 等.产γ-氨基丁酸乳酸菌的分离鉴定及其发酵条件优化[J].中国酿造, 2022, 41(7):94-100.MA L, LIU H Y, FANG H T, et al.Isolation and identification of lactic acid bacteria with γ-aminobutyric yield and optimization of fermentation conditions[J].China Brewing, 2022, 41(7):94-100.
[21] 李朔.高产γ-氨基丁酸乳酸菌的筛选及其在酸菜中的应用研究[D].沈阳:沈阳农业大学,2023.LI S.Screening of high yielding γ-aminobutyric acid lactic acid bacteriaand its application in sauerkraut[D].Shenyang:Shenyang Agricultural University, 2023.
[22] 施生玲,郭星晨,马金璞,等.产GABA乳酸菌工艺优化及其产物抗氧化活性研究[J].食品工业,2023,44(5):86-91.SHI S L, GUO X C, MA J P, et al.Optimization of GABA-producing lactic acid bacteria process and study on its antioxidant activity[J].The Food Industry, 2023,44(5):86-91.
[23] 金忆文.产GABA乳酸菌的筛选、发酵条件优化及应用研究[D].合肥:中国科学技术大学,2023.JIN Y W.Screening, optimization of fermentation conditions and application of GABA-producing lactic acid bacteria[D].Hefei:University of Science and Technology of China, 2023.
[24] 林杨.高产γ-氨基丁酸乳酸菌的选育及其发酵工艺优化[D].乌鲁木齐:新疆农业大学,2021.LIN Y.Screening of high yield γ-aminobutyric acid (GABA) lacticacid bacteria and optimization of fermentation conditions[D].Urumqi:Xinjiang Agricultural University, 2021.
[25] WANG Q, LIU X H, FU J H, et al.Substrate sustained release-based high efficacy biosynthesis of GABA by Lactobacillus brevis NCL912[J].Microbial Cell Factories, 2018, 17(1):80.
[26] LI H F, LI B B, GAO L S, et al.Gamma-aminobutyric acid (GABA) promotes characteristics of Levilactobacillus sp.LB-2[J].LWT, 2023, 184:115014.
[27] ZOU X Z, GONG L C, LI T T, et al.Optimization of fermentation conditions for the production of γ-aminobutyric acid by Lactobacillus hilgardii GZ2 from traditional Chinese fermented beverage system[J].Bioprocess and Biosystems Engineering, 2024, 47(6):957-969.
[28] 孙世鑫, 李科, 骆鹏飞, 等.制备富含γ-氨基丁酸酸奶的乳酸菌筛选及相关特性分析[J].现代食品科技, 2021, 37(3):106-114;285.SUN S X, LI K, LUO P F, et al.Screening and characteristics of lactic acid bacteria for preparing γ-aminobutyric acid-rich yogurt[J].Modern Food Science and Technology, 2021, 37(3):106-114;285.
[29] 马莉.产γ-氨基丁酸乳酸菌的筛选及其在发酵枸杞汁中的应用研究[D].银川:宁夏大学,2022.MA L.Screening of lactic acid bacteria producing γ-aminobutyric acid and its application in fermentation of Lycium barbarum juice[D].Yinchuan:Ningxia University, 2022.
[30] 徐毓琴, 戴茜茜, 唐慧琴, 等.产γ-氨基丁酸益生菌的筛选及其生物活性研究[J].浙江农业学报, 2016, 28(3):502-508.XU Y Q, DAI X X, TANG H Q, et al.Screening of γ-aminobutyric acid-producing probiotics and characterization of its biological activity[J].Acta Agriculturae Zhejiangensis, 2016, 28(3):502-508.