荞麦包括甜荞(Fagopyrum esculentum Moench)和苦荞[Fagopyrum tartaricum (L.) Gaerth],属蓼科荞麦属,一年生草本古双叶植物[1-2]。荞麦主要种植于北半球的亚洲、东欧及中欧[1,3]。我国苦荞主要分布于陕西、宁夏、西藏、四川、云南及贵州等省份[2]。苦荞不仅是干旱和寒冷地区居民的主食,还是一种常见的中药[2,4],具有降血糖、抗氧化、调节脂代谢及肠道菌群等多种功能活性[5-6]。研究表明,苦荞的这些功能活性与其蛋白质与多肽[5]、膳食纤维[7]、多酚[8]、维生素及生物碱[9]等成分紧密相关。其中,苦荞多酚倍受关注,其种类超过60余种,主要为芦丁、槲皮素、没食子酸、对羟基苯甲酸、对香豆酸及花青素类等,并主要以游离态形式存在[1, 10-11],特别是芦丁含量较为丰富[1, 10]。再者,苦荞多酚单体含量与其种粒部位有关,如芦丁在苦荞皮层和胚层含量明显高于胚乳层和壳层,而槲皮素在苦荞皮层含量远高于胚乳层[10, 12]。此外,人们对苦荞膳食纤维、蛋白、淀粉及其与调控血糖功能之间关系的认识也逐渐深入。
目前,2型糖尿病已成为威胁世界各国公共健康的主要慢性代谢性疾病,其发病率和流行率均逐渐增加,而饮食干预将是预防2型糖尿病的有效途径[13-14]。在我国一些地区,苦荞常用于干预或预防慢性代谢性疾病[5]。研究表明,苦荞对机体糖脂代谢及胰岛素敏感性均有较好的改善作用[15],其中苦荞多酚和膳食纤维可通过改善氧化应激水平、脂质代谢及肠道菌群等方式改善胰岛素抵抗[16-18]。然而,关于苦荞功能成分与其调控血糖活性的研究缺乏系统性。因此,梳理已有研究结果及进展,聚焦苦荞营养成分与其调控血糖机制的相关性,可为进一步深入理解和研究苦荞营养功能提供新思路。
1 苦荞主要营养成分
苦荞的主要营养成分包括淀粉、蛋白、膳食纤维及多酚等(图1),它们与苦荞调控血糖功能紧密相关[1, 19-20],而这些成分理化性质又受苦荞品种、生长环境及颗粒部位等因素的影响。

图1 苦荞主要营养成分[24, 27]
Fig.1 Predominant nutrient components of Tartary buckwheat[24, 27]
注:GAE-没食子酸当量;RE-视黄醇当量(下同)。
1.1 淀粉
苦荞总淀粉含量在55%~70%(干重),其颗粒多呈不光滑的近球形(图1),粒径多在5~15 μm(占比68%~74%),明显小于小麦淀粉,具有较多的完整晶体结构(A型晶体),糊化温度(74~77 ℃)较高,热焓值在7~10 J/g,易老化[21-22]。苦荞直链淀粉约占总淀粉的12%,抗性淀粉含量约占总淀粉的21%,其淀粉颗粒形状、粒径、结晶度、微晶区域、链长分布、糊化温度与甜荞淀粉并无显著差异,但糊化峰值黏度和热焓值(ΔH)更高[23-24]。苦荞抗性淀粉含量在9.1%~22.5%(约占总淀粉21%)[25],直链淀粉含量(20%~28%)比小麦淀粉低3%~4%,快速消化淀粉含量占50%~60%,与小麦淀粉并无显著差异[22]。总之,苦荞淀粉粒径较小,直链淀粉含量较低,总淀粉和抗性淀粉含量、淀粉颗粒形态与甜荞并无明显差异,主要区别在于糊化特性,这可能与苦荞淀粉的精细结构紧密相关。
1.2 蛋白
苦荞中有超过3 300种功能性蛋白质,包括酶催化蛋白、调节蛋白、结构蛋白及转运蛋白[4]。苦荞粗蛋白含量与小麦接近,无面筋,总含量在9.1%~14.0%,包括清蛋白(5.6%~7.5%)、谷蛋白(1.32%~1.67%)、球蛋白(0.31%~0.45%)、醇溶谷蛋白(0.45%~0.81%)及其他蛋白(2.95%~4.17%),其他蛋白在不同苦荞中的差异不明显[6, 12, 26]。其中清蛋白分子质量在24~67 kDa,球蛋白分子质量在56~69 kDa[4],β-折叠、无规卷曲、α-螺旋及β-转角占比分别为25.9%、24.9%、32.1%及17.0%[27]。但有研究发现苦荞球蛋白的分子质量在23~32 kDa,清蛋白分子质量在50~75 kDa,且二级结构多为β-折叠(31.7%)和β-转角(20.8%),反平行β-折叠、α-螺旋及无规卷曲含量均约为14.5%,zeta-电位为-34.8~-51.2 mV,这可能与苦荞品种、生长环境及分析方法相关,也说明苦荞水溶蛋白在水溶液中较为稳定[28-29]。BHINDER等[30]发现23种苦荞蛋白总含量在9.06%~14.88%,氨基酸组成主要为谷氨酸(1 417.1~2 381.7 mg/100 g)、精氨酸(756.1~1 517.3 mg/100 g)及天冬氨酸(557.6~1 318.3 mg/100 g)等18种氨基酸,其中疏水性氨基酸含量最高(3 297.1~4 497.0 mg/100 g),其次为中性氨基酸(2 624.2~3 623.7 mg/100 g),而半胱氨酸、异亮氨酸、胱氨酸及天冬酰胺为限制性氨基酸。苦荞蛋白氨基酸具有较高的生物价(氨基酸评分为100分),与大米蛋白比较接近[31]。此外,苦荞蛋白的消化率约80%,低于动物蛋白、燕麦及黑麦蛋白,但明显高于高粱和玉米蛋白,其消化性会因单宁、植酸及皂苷等抗营养因子的存在而降低[4, 31]。因此,苦荞蛋白种类繁多,其含量、消化性和结构特征(分子质量、氨基酸组成、分子结构)会受品种、生长环境、处理方法(如脱脂、水热处理、微波、机械加工、超声)及分析技术的影响。
1.3 多酚
酚类是指由一个或多个芳香环及一个或多个羟基组成的一类化合物,通常包括黄酮类、酚酸、多酚酰胺及单宁类等[32]。苦荞多酚含量及种类(包括酚酸、黄酮、单宁及其衍生物)如表1所示,总酚含量在8.9~14.7 mg GAE/g DW,总黄酮含量23.74~28.67 mg RE/g DW[6, 26, 33]。苦荞多酚含量、抗氧化活性及药用价值均高于甜荞[1, 34],也常高于大麦、燕麦等杂粮[32, 35]。
表1 荞麦多酚含量与多酚单体组成
Table 1 Content of total polyphenol and composition of polyphenol monomer from buckwheat

产地种类多酚黄酮酚酸多酚组成文献陕西榆林苦荞总单宁:7.8±0.1(粉), 6.7±0.3(皮), 9.2±0.4(壳);缩合单宁:3.4±0.5(粉), 5.1±0.3(皮), 2.8±0.1(壳),单位:mg CAE/g DW总酚:11.1±0.50(粉), 14.2±0.4(皮),13.2±0.4(壳),单位:mg GAE/g DW单体种类543种,1,4-邻二没食子酰葡萄糖、6-氧烷基葡萄糖、3-氧烷基葡萄糖、黑儿茶鞣质B3、花青素B1/B4/C1/C2;没食子酸(5.58±1.76), 花青素C1(6.18±2.54), 单位:mg/kg;花青素B1(17.41±4.28), 氰胺3-O-葡萄糖苷(4.51±2.71), 氰胺3-O-芦丁苷(15.77±3.05), 单位:μg/kg。甜荞总单宁:3.5±0.3(粉), 4.4±0.2(皮), 7.5±0.3(壳),单位:mg CAE/g DW;缩合单宁:2.3±0.2(粉), 2.9±0.3(皮), 4.8±0.2(壳),单位:mg CAE/g总酚:4.30±0.3(粉), 6.4±0.3(皮),7.6±0.4(壳),单位:mg GAE/g单体种类533种,1,4-邻二没食子酰葡萄糖、6-氧烷基葡萄糖、3-氧烷基葡萄糖、黑儿茶鞣质B3、花青素B1/B4/C1/C2;没食子酸(16.26±7.54), 花青素C1(3.17±1.36), 单位:mg/kg;花青素B1(27.69±15.40), 氰胺3-O-葡萄糖苷(16.38±4.0), 氰胺3-O-芦丁苷(222.94±79.88), 单位:μg/kg。[35]塞尔维亚苦荞—总酚:12.99 g GAE/kg DW没食子酸、棓酰己糖异构体、二羟基苯甲酰己糖苷异构体、原儿茶酸、5-O-咖啡因酰基喹酸、山奈甲黄素、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、山奈酚、表儿茶素、杨梅酮、山奈酚-7-O-己糖苷、表儿茶酸没食子酸酯、槲皮素、四羟黄酮等59种。[50]中国苦荞总黄酮:(3.71±0.39) mg CAE/g总酚:(6.67±0.57) mg GAE/g没食子酸(6.52 ±0.59)、原儿茶酸(10.04± 1.06)、2,3,4-三羟基苯甲酸(6.85 ±0.05)、3,4-二羟苯甲醛(1.96±0.16)、龙胆酸(1.95±0.12)、香草酸+咖啡酸(18.68±1.38)、阿魏酸(ND), 水杨酸(554.57±19.57), 芦丁(7 623.26±110.19), 槲皮素(128.56±23.23), 槲皮苷(23.63±1.87),单位:mg/kg。甜荞总黄酮:(1.22±0.23) mg CAE/g总酚:(5.32± 0.37) mg GAE/g没食子酸(2.84 ±0.20), 原儿茶酸(4.04± 0.37), 2,3,4-三羟基苯甲酸(5.36 ±0.21), 3,4-二羟苯甲醛(25.44±0.40), 龙胆酸(11.51±0.35), 香草酸+咖啡酸(31.44±0.72), 阿魏酸(8.94±0.12), 水杨酸(ND), 芦丁(62.19±1.33), 槲皮素(26.95±1.14), 槲皮苷(8.41±0.29),单位:mg/kg。[1]韩国甜荞总黄酮:(0.5±0.1) mg CAE/g总酚:(7.2±1.8) mg GAE/g芦丁(0.147 ±0.003), 儿茶酚(0.130±0.003), 异牡荆素(0.009±0.001), 儿茶素甘油酸酯(0.018±0.000),单位:mg/g。苦荞总黄酮:(11.67±2.1) mg CAE/g总酚:(21.3±2.2) mg GAE/g芦丁(10.7 ±1.1), 儿茶酚(ND), 槲皮素(1.27±0.23), 异牡荆素(0.183±0.019), 儿茶素甘油酸酯(ND), 异荭草素(0.32±0.002),单位:mg/g。[20]意大利荞麦总黄酮:1 422.5(皮),1 056.9(中层粉), 157.84(轻粉),614.5(去壳粉), mg/kg DW总酚酸:509.8(皮),548.6(中层粉), 96.3(轻粉), 295.8(去壳粉),单位:mg/kg DW无壳粉:总酚酸(149.5), 总黄酮(371.3),2-羟基-3-O-β-D-葡萄糖基吡喃基苯甲酸(32.7), 原儿茶酸-4-邻葡萄糖苷酸(65.6), 咖啡酸己糖(30.9), 儿茶素葡萄糖苷(13.5), 儿茶酸(7.3), 咖啡酸(0.96), 荭草素(1.6), 芦丁(87.3), 牡荆素(2.0)等25种(游离态);总酚酸(146.3), 总黄酮(243.2),2-羟基-3-O-β-D-葡萄糖基吡喃基苯甲酸(7.9), 咖啡酸己糖异构体(0.43), 儿茶酚(95.5), 紫丁香酸(35.6),原花青素A(4.9), 芦丁(33.7), 表儿茶酸(41.6), 咖啡酸(ND), 荭草素(0.22), 槲皮素(18.8), 獐牙菜大苷(30.4)等24种(结合态),单位:mg/kg。[36]波兰苦荞—总酚酸, 2个品种(6 948.9, 7 014.8 mg/kg DW)2个品种:芦丁(2 064.1, 3 257.0);阿魏酸(3.49, 2.37);香豆酸(15.5, 18.8);紫丁香酸(38.6,44.3);香草酸(155.8, 186.6), 单位:mg/kg。甜荞—总酚酸, 4个品种(2 222.2, 2 856.4, 3 891.1,2 322.7 mg/kg DW)4个品种:芦丁(91.9, 114.6, 318.9, 143.4);阿魏酸(4.0, 3.3, 2.7, 2.3);香豆酸(28.2, 39.5, 20.5, 26.7);紫丁香酸(72.0, 74.1, 85.6, 79.9);香草酸(240.0, 254.4, 378.0, 370.0), 单位:mg/kg。[33]
续表1
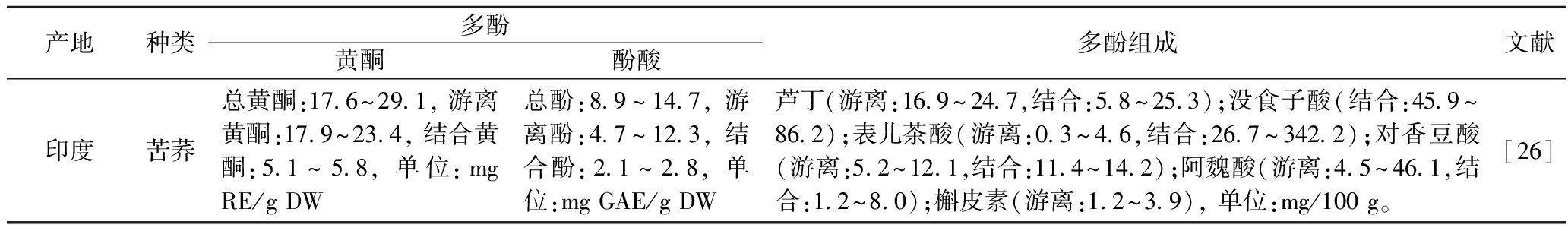
产地种类多酚黄酮酚酸多酚组成文献印度苦荞总黄酮:17.6^29.1, 游离黄酮:17.9^23.4, 结合黄酮:5.1^5.8, 单位:mg RE/g DW总酚:8.9^14.7, 游离酚:4.7^12.3, 结合酚:2.1^2.8, 单位:mg GAE/g DW芦丁(游离:16.9^24.7,结合:5.8^25.3);没食子酸(结合:45.9^86.2);表儿茶酸(游离:0.3^4.6,结合:26.7^342.2);对香豆酸(游离:5.2^12.1,结合:11.4^14.2);阿魏酸(游离:4.5^46.1,结合:1.2^8.0);槲皮素(游离:1.2^3.9), 单位:mg/100 g。[26]
注:CAE-槲皮素当量;—表示未检出。
1.3.1 酚酸
苦荞酚酸包括没食子酸、绿原酸、阿魏酸、咖啡酸、对香豆酸等,并多以游离态存在[1, 36]。苦荞游离酚酸以没食子酸、阿魏酸及绿原酸等为主,结合态以儿茶酸、对香豆酸及表儿茶酸为主[26, 36]。BHINDER等[26]发现8种苦荞游离酚含量普遍高于结合酚,但少量游离酚却低于结合态,如游离表儿茶酸和对香豆酸。相比甜荞,苦荞酚酸含量更高,但部分酚酸单体含量反而更低,如苦荞没食子酸含量显著低于甜荞(表1)[35]。另外,苦荞酚酸的含量及种类在壳、皮及粉之间也存在明显差异,其中壳层和皮层含量较高[35-36],胚乳层较低,如皮层表儿茶酸含量较高,而胚轴与子叶相连部分富含儿茶酚[37]。
1.3.2 黄酮与单宁类
苦荞总黄酮含量可达甜荞的14.9倍,特别是芦丁和槲皮素含量分别可达93.3倍和108倍[10, 12],但其他黄酮如牡荆素、异牡荆素、红草素及异荭草素相对较低[32]。苦荞黄酮以游离态为主,主要包括芦丁、槲皮素、荭草素、牡荆素及表儿茶素等[1, 26, 36],其中芦丁和槲皮素占比可超过总黄酮的80%[20, 38]。与酚酸相似,苦荞粒子叶部分芦丁含量(283.37 mg/kg)显著高于其他部位[37]。苦荞单宁主要包括原花青素B1/B2/B4/C1/C2,3-氧烷基葡萄糖和6-氧烷基葡萄糖等[35, 37],总单宁及缩合单宁含量均显著高于甜荞[35]。
综上,苦荞多酚含量常高于甜荞及其他杂粮谷物,游离多酚明显高于结合多酚,具有较高的潜在生物可及性。苦荞多酚主要包括芦丁、槲皮素、牡荆素、没食子酸、阿魏酸、对香豆酸及单宁等60余种,其种类、含量及存在型态受品种、产地、生长环境、采收时间、种粒部位及溶剂等因素的影响。
1.4 膳食纤维
苦荞总膳食纤维含量在8.4%~26%,其中可溶性膳食纤维占比不到1%[6, 25]。有研究发现苦荞膳食纤维含量(19.8±0.2)%明显高于甜荞(12.1±0.1)%[12]。但也有研究指出苦荞壳中膳食纤维含量明显高于苦荞皮和苦荞粒,无壳苦荞总膳食纤维含量仅有5.3%[22]。苦荞可溶性膳食纤维主要为果胶、阿拉伯半乳聚糖、木葡聚糖,其中果胶主要分布在海绵组织、胚乳及种皮内外层的细胞壁[25]。也有研究报道苦荞膳食纤维由果胶(1.8%)、半纤维素(39%,主要为木葡聚糖)、木质素(20%)及纤维素(39%)组成,与谷物类(如青稞)膳食纤维组成差异较大,理化性质也存在明显不同[39-40]。苦荞膳食纤维主要由酸性多糖和中性多糖组成,单糖组成更接近果蔬类膳食纤维[25],由葡萄糖、半乳糖、鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖醛酸及葡萄糖醛酸组成,其中葡萄糖为主(占比可超90%),半乳糖次之,分子质量在13~45 000 kDa,主要受苦荞品种和提取方法的影响[41],其分子骨架主要由α-1→4吡喃(型)葡萄糖糖苷连接,不具有三螺旋结构,主链与支链间由1,6和1,3半乳糖-鼠李糖葡萄糖连接,支链由α-D-1→6吡喃甘露糖、α-D-1→3-吡喃葡萄糖及α-D-1→2,4吡喃鼠李糖组成[25, 39]。因此,苦荞膳食纤维含量、单糖组成及分子质量受品种、种粒部位及分析技术等因素的影响。
1.5 矿物质及其他
PODOLSKA等[33]比较了3种甜荞与3种苦荞矿物质含量,发现苦荞K含量最高(甜荞与苦荞间差异不明显),其次为P和Mg,在部分种间有差异,这与BHINDER等[30]的研究结果存在一定差异,主要体现在K、Mg及Ca含量。苦荞Ca、K、Mg、Fe、Zn含量高于甜荞[10, 12]。总体而言,苦荞Ca和Mg与灰分含量(0.7%~1.5%)呈正相关,Ca、K含量常高于甜荞,其他矿物质差异不明显[42]。苦荞脂肪含量在1%~5%,脂肪酸种类近20种,饱和与不饱和脂肪酸种类相当,γ-氨基丁酸平均含量为315.1~566.2 mg/100 g[30, 32]。此外,苦荞还含有环多醇、三萜、类固醇、维生素(如β-胡萝卜素、维生素B1、维生素C等)等多种次级代谢产物[32],但这些成分的含量较低,未引起足够重视。
2 苦荞调控血糖机制
2.1 抗氧化
细胞内高浓度葡萄糖会产生过多的电子供体,当这些电子供体超出线粒体处理能力时,会产生过多的超氧自由基[43],这些自由基会导致葡萄糖转运蛋白4在靠近葡萄糖转运通道的过度氧化和羰基化,进而刺激一些应激活性激酶并产生系统性的氧化应激反应,引发葡萄糖摄取的胰岛素刺激缺陷进而导致胰岛素抵抗[44]。
多酚是苦荞抗氧化功能的主要成分,其抗氧化活性与浓度呈正相关。CHOI等[45]利用苦荞有机提取物及芦丁干预炎症巨噬细胞后,NO含量及活性氧簇(reactive oxygen species, ROS)水平显著降低,核因子kB(nuclear factor kappa-B, NF-κB)蛋白、环氧合酶-2(cyclooxygenase-2, COX-2)及一氧化氮合酶(nitric oxide synthase, iNOS)基因表达水平明显下调,提取物和芦丁的抑制作用具有浓度依赖性(表2)。此外,苦荞可通过抑制COX-2和脂肪氧合酶活性实现抗氧化作用[46]。动物试验表明,苦荞芦丁、槲皮素、山奈酚、牡荆素等23种次级代谢产物具有抗糖尿病效果,其中部分还具有抗动脉粥样硬化,降压及预防心血管疾病作用[34],富含苦荞(30%)饮食可通过调节去乙酰化酶1(sirtuin 1,SIRT1)及抗氧化水平改善大鼠氧化应激水平[47]。苦荞乙醇提取物对肥胖炎症大鼠体重及摄食量无明显影响,但能降低脂肪含量、血脂水平、降低脂肪组织3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GPDH)活性、iNOS及NO水平,下调过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors γ, PPAR-γ)、脂肪酸结合蛋白2(adipocyte fatty acid binding protein2, aP2)、CCAAT/增强结合蛋白α(CCAAT/enhancer binding protein-alpha, C/EBP-α)、TNF-α、IL-6、精氨酸酶1(arginase1, Arg 1)、单磷酸腺苷激活蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)的基因表达水平和肌肉线粒体PPAR-γ共激活剂-1α(PPAR-γ coactivator-1α, PGC-1α)、SIRT1基因表达水平,且这些调节作用具有剂量依赖性[48]。
表2 苦荞改善血糖作用及其相关机制
Table 2 Hypoglycemic effect of Tartary buckwheat and its related mechanisms
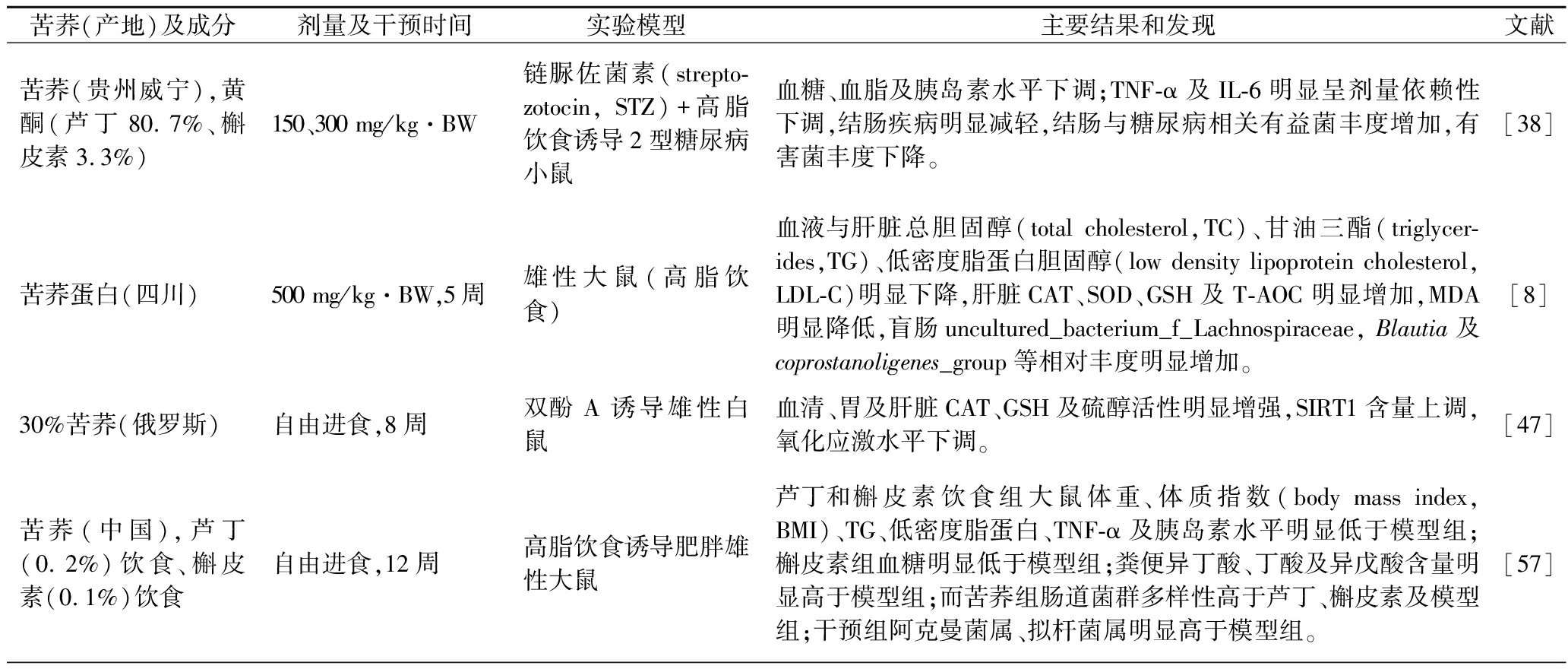
苦荞(产地)及成分剂量及干预时间实验模型主要结果和发现文献苦荞(贵州威宁),黄酮(芦丁80.7%、槲皮素3.3%)150、300 mg/kg·BW链脲佐菌素(strepto-zotocin, STZ)+高脂饮食诱导2型糖尿病小鼠血糖、血脂及胰岛素水平下调;TNF-α及IL-6明显呈剂量依赖性下调,结肠疾病明显减轻,结肠与糖尿病相关有益菌丰度增加,有害菌丰度下降。[38]苦荞蛋白(四川)500 mg/kg·BW,5周雄性大鼠(高脂饮食)血液与肝脏总胆固醇(total cholesterol,TC)、甘油三酯(triglycer-ides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)明显下降,肝脏CAT、SOD、GSH及T-AOC明显增加,MDA明显降低,盲肠uncultured_bacterium_f_Lachnospiraceae, Blautia及coprostanoligenes_group等相对丰度明显增加。[8]30%苦荞(俄罗斯)自由进食,8周双酚A诱导雄性白鼠血清、胃及肝脏CAT、GSH及硫醇活性明显增强,SIRT1含量上调,氧化应激水平下调。[47]苦荞(中国),芦丁(0.2%)饮食、槲皮素(0.1%)饮食自由进食,12周高脂饮食诱导肥胖雄性大鼠芦丁和槲皮素饮食组大鼠体重、体质指数(body mass index, BMI)、TG、低密度脂蛋白、TNF-α及胰岛素水平明显低于模型组;槲皮素组血糖明显低于模型组;粪便异丁酸、丁酸及异戊酸含量明显高于模型组;而苦荞组肠道菌群多样性高于芦丁、槲皮素及模型组;干预组阿克曼菌属、拟杆菌属明显高于模型组。[57]
续表2

苦荞(产地)及成分剂量及干预时间实验模型主要结果和发现文献苦荞(四川),饲料(22%)自由进食,12周高脂饮食诱导肥胖雄性大鼠血清TG、TC、LDL-C、游离脂肪酸、TNF-α、IL-6、MDA及空腹血糖明显低于模型组,与燕麦效果相当;血清SOD、脂肪细胞因子和T-AOC显著高于模型组;肝脏甾醇调节元件结合蛋白2(sterol regu-latory element-binding protein 2, SREBP-2)和PPAR-γ蛋白表达水平明显低于模型组;肠道菌群多样性及结肠乙酸、丁酸、戊酸含量高于模型组。[58]黑苦荞(中国)0.83 g/kg,8周高脂膳食诱导肥胖大鼠血清胆固醇、TG、LDL-C降低;法尼醇X受体(farnesoid X receptor, FXR)、SREBP1及PPARα蛋白表达水平改变;Lactobacillus、 Fae-calibaculum及Allobaculum相对丰度增加,Romboutsia相对丰度降低;结肠内容物乙酸、丁酸无明显变化;Allobaculum相对丰度与多酚、黄酮、槲皮素及山奈酚呈正相关,与芦丁呈负相关。[59]苦荞(中国台湾,3%、10%添加量),芦丁(0.1%)饲料自由进食,4周高脂膳食+胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)受体基因敲除+STZ诱导雄性2型糖尿病小鼠血清葡萄糖浓度,糖化血红蛋白下降,糖耐受力增强,GLP-1、Ghre-lin、Leptin及Adiponectin水平明显增加,10%苦荞及0.1%芦丁饲料效果优于0.3%苦荞饲料。[15]苦荞(陕西)蛋白(24%),芦丁、槲皮素芦丁、槲皮素(8.2 mmol/kg);苦荞蛋白膳食自由进食,8周雄性仓鼠 苦荞蛋白可降低仓鼠血清TC(45%),显著高于消胆胺(37%)、大米蛋白及小麦蛋白(10%^13%),增加粪便中性甾醇、酸性甾醇的分泌,下调肠道NPC1L1、ACAT2及ABCG5/8蛋白表达水平,上调肝脏CYP7A1基因表达。而芦丁对血清TC没有显著影响。[60]苦荞(四川)膳食纤维及多糖(0.5%,1%,2%)500, 1 500 mg/kg·BW,多糖实验自由进食,8周 C57BL/KSJ-db/db小鼠;STZ+高脂饮食诱导空腹血糖及糖化血红蛋白降低,糖耐受力及胰岛素抵抗、结肠与胰腺损伤改善;磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)、GPR43、AMPK蛋白表达水平上调;FoxO1、PEPCK及G-6-Pase蛋白表达水平下调,粪便短链脂肪酸(short chain fatty acids, SCFAs)、结肠GPR43及血清GLP-1增加;Parabacteroides, norank_f_Muribaculaceae等相对丰度增加。[61]苦荞(日本)5 000 mg/kg·BW,12周42名男性,107名女性,年龄30^69岁,动脉粥样硬化指数:2.25±0.653周后动脉粥样硬化指数、氧化低密度脂蛋白无明显改变,但8周后硫代巴比妥酸反应物水平、体重及BMI明显低于对照组,4周后BFP显著低于对照组。[62]苦荞多肽(陕西)200 μg/mL,20 hH2O2诱导人源肝癌HepG2细胞T-AOC、SOD、CAT、GSH活性增加;PPAR-α/HO-1蛋白表达水平上调,氧化应激水平下调。[49]苦荞(韩国)提取物及芦丁25、50、100 μg/mL, 芦丁(2.5、5、10 μg/mL),24 h脂多糖及干扰素-γ诱导的炎症RAW264.7细胞NO含量及ROS水平相比模型组显著降低, NF-κB、COX-2及iNOS基因表达水平明显下调。中低浓度苦荞提取物及芦丁对IL-6具有抑制作用,高浓度具有促进作用。[45]苦荞(韩国)乙醇提取物5、10 g/kg膳食,13周高脂饮食诱导肥胖大鼠体重无明显变化,脂肪组织减少,血脂水平下降;脂肪GPDH活性、iNOS、CD11c及NO水平降低,Arg1、AMPK基因表达水平显著增加,脂肪PPAR-γ、aP2、C/EBP-α、TNF-α、IL-6及MCP-1基因表达水平显著降低;肌肉线粒体PGC-1α、SIRT1基因表达水平及SIRT酶活性显著增加。[48]苦荞(四川)荞麦糖醇B1(Fago B1), Fa-go A1DCI:30 mg/kg·BW;Fago A1或 Fago B1:58 mg/kg·BW;体外:0.1^0.5 mmol/L;6周KK-Ay小鼠;HepG2细胞荞麦糖醇和D-手性肌醇(D-chiro-inositol, DCI)抑制血糖浓度持续增加,改善葡萄糖耐受力,增加胰岛素敏感性;荞麦糖醇增加肝脏和肌肉胰岛素受体及PI3K蛋白表达水平,细胞实验中,还能上调PI3K及AKT的表达,且Fago B1效果优于Fago A1和DCI。[56]苦荞(山西)蛋白、抗性淀粉及全粉自由进食,6周饮食诱导肥胖小鼠相比模型组,苦荞蛋白与全粉均能缓解肥胖小鼠脂肪肝、结肠和盲肠炎症水平,苦荞全粉显著降低了血清TC、TG、LDL-C,增加HDL-C,但苦荞抗性淀粉无明显影响。苦荞抗性淀粉和苦荞全粉对肥胖小鼠肠道细菌多样性具有积极作用能降低厚壁菌门/拟杆菌门比例,其中抗性淀粉能增加粪菌属、蛋白增加黏液真杆菌属和瘤胃球菌科菌属,苦荞粉对拟杆菌属、罗姆布茨菌属和产粪甾醇真杆菌属生长具有促进作用,苦荞粉和抗性淀粉对埃氏菌属-志贺氏菌属及丹毒丝梭菌属均有抑制作用。[63]苦荞(贵州)110 g/d,4周临床试验(165名2型糖尿病患者,试验组80人,对照组85人)体重、BMI、血糖水平、糖化血红蛋白、TG及HDL-C无显著变化,胰岛素水平、LDL-C显著降低。[17]
体外试验表明,苦荞蛋白碱性蛋白酶水解多肽抗氧化活性强于维生素C[31],苦荞球蛋白水解多肽干预经H2O2诱导的HepG2细胞(20 h)后,细胞活性、总抗氧化力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase, SOD)及谷胱甘肽(glutathione, GSH)活性明显增强,丙二醛(malondialdehyde, MDA) 含量显著降低,PPAR-α及血红素氧化酶1(heme oxygenase 1)蛋白表达水平显著上调,具有良好的抗炎与抗氧化效果[49],这可能与这些多肽苯丙氨酸残基芳香环对自由基的捕获和疏水氨基酸残基紧密相关[4]。苦荞可溶性多糖(10 μg/mL)也能刺激巨噬细胞生长并增强其活性,调节自然杀伤细胞的细胞毒性,抑制其NO的产生[38]。体内试验显示,苦荞蛋白能够降低肝脏氧化应激水平,增加过氧化氢酶(catalase,CAT)、SOD、GSH活性及T-AOC能力,并降低MDA水平,最终改善脂质代谢[8]。因此,苦荞多酚、蛋白及膳食纤维可通过多种途径改善机体氧化应激水平(图2-a),而苦荞蛋白的抗氧化活性可能来源于其水解活性多肽。

a-调节肝脏及脂肪组织脂代谢与氧化应激水平;b-蛋白和脂类延缓淀粉水解途径;c-多酚抑制淀粉水解途径;d-膳食纤维及蛋白调控脂类代谢途径;e-调节肠道脂代谢及菌群组成途径
图2 苦荞调控血糖机制
Fig.2 Mechanism of Tartary buckwheat regulating blood glucose level
2.2 调控淀粉消化与代谢
苦荞多酚和膳食纤维可通过抑制淀粉消化、调节葡萄糖转运与代谢多种途径影响糖代谢,且苦荞淀粉理化性质也与苦荞降血糖功效紧密相关。
2.2.1 限制淀粉消化
苦荞淀粉颗粒粒径(5~15 μm)比小麦淀粉小,但具有更完整的晶体结构(A型),支链淀粉的聚合度通常大于100,糊化温度高,冷却过程中分子间更易聚集从而更易老化和难以微粒化,因而消化速率和消化率较低[6, 21]。再者,苦荞淀粉颗粒结构致密,其与淀粉酶接触的表面积相对较低,苦荞淀粉的持水力和凝聚力更高,更能抑制基质中水分的迁移从而降低了消化酶的可及性[23]。
苦荞颗粒的结构特征也会影响其淀粉的消化速率,如脂肪和蛋白可通过脂肪/蛋白-淀粉复合物封装淀粉颗粒的形式抑制淀粉水解[51]。植物多酚常以共价键和/或非共价键(疏水相互作用、氢键、离子键)吸附或定植于植物细胞壁多糖中,因而多酚与细胞壁多糖、淀粉及蛋白经热处理后常以复合物形式共存[52],从而阻碍淀粉酶与淀粉分子接触,降低淀粉的消化速率(图2-b、图2-c)。苦荞槲皮素与淀粉可形成复合物,同时由于其直链淀粉含量通常高于谷物类,抗性淀粉含量较高,因而血糖指数较低[53]。如苦荞槲皮素和芦丁与淀粉结合可改变淀粉的结构,并能同时以游离形式抑制淀粉酶活性进而抑制淀粉的消化(图2-c),槲皮素对淀粉消化的抑制作用比芦丁更强,这种差异主要源于芦丁分子结构上的糖苷配基会弱化芦丁与淀粉酶之间的相互作用[54]。甚者,苦荞槲皮素和芦丁可通过弱疏水力和氢键与苦荞淀粉结合并阻碍淀粉的水解,并能同时与α-淀粉酶和α-淀粉糖苷酶形成复合物进而抑制其活性[半抑制浓度分别为(270±3.3) μg/mL和(544±9.0) μg/mL][55],苦荞蛋白水解多肽也有类似作用[31]。类似地,苦荞非淀粉膳食纤维在苦荞基食品中形成凝胶层,这种结构可包裹淀粉、蛋白及脂类分子,进而阻碍这些宏量营养成分与消化酶的接触,降低了淀粉的水解速率。与此同时,这些非淀粉多糖还能直接与消化酶相互作用,降低其活性及与底物的相互作用。WANG等[39]发现苦荞多糖(平均分子质量26 kDa)对葡萄糖糖苷酶活性具有浓度依赖性抑制作用,其作用效果优于阿卡波糖,也能降低葡萄糖吸收率。苦荞果胶和纤维素能够吸附葡萄糖分子[22],膳食纤维的高吸水性降低了消化酶及其底物在食物基质中的移动能力[40]。因此,苦荞淀粉的结构特征与性质,多酚、膳食纤维与淀粉及淀粉酶之间的相互作用是调节苦荞淀粉消化速率的关键因素。
2.2.2 调控葡萄糖转运与代谢
苦荞可通过调节GLP-1受体改善2型糖尿病小鼠血糖水平,且10%苦荞与0.1%芦丁调节效果差异不是特别明显[15]。苦荞中fagopyritols A1/B1及 DCI能够抑制胰岛素抵抗小鼠血糖浓度持续增加,增加肝脏和肌肉胰岛素受体及PI3K蛋白表达水平,改善其葡萄糖耐受力,增加胰岛素敏感性,且与细胞实验结果相似[56]。此外,苦荞蛋白水解多肽能抑制与胰岛素分泌及血糖水平相关的二肽酶Ⅳ活性[31],然而,苦荞多肽的这种构效机理尚未清楚。综上,苦荞蛋白和多酚可改善机体血糖转运及代谢进而降低血糖水平。
2.3 调节脂代谢
脂质代谢障碍与高血糖症主要存在2个方面的关联,其一,外周饱和脂肪酸与来自肝脏的胎球蛋白A(Fetuin A)结合后通过刺激Toll样受体4(Toll-like receptor 4, TLR4)激活JNK(c-Jun N-terminal kinase)和IKK(inhibitor of kappa B kinase),再通过激活下游应激信号通路(如JNK/AP-1)促进IRS-1丝氨酸残基的磷酸化抑制胰岛素信号通路[64]。且TLR4的活化还可激活NF-κB,进而通过炎症反应影响胰岛素相关基因的表达,加重胰岛素抵抗[65];其二,过量脂肪积累也会超过细胞线粒体β氧化能力,导致部分氧化酰基肉碱中间体的积累,饱和脂肪酸产物神经酰胺可抑制AKT(protein kinase B)的活性而降低胰岛素敏感性,同时,炎症反应可增强神经酰胺的产量,进而强化了炎症反应与胰岛素作用之间的联系[65]。
苦荞对脂代谢的调控主要通过调节脂质消化、吸收、转运及细胞代谢实现。苦荞可溶性多糖(如果胶)形成的大分子网络结构可捕获胆汁酸(图2-d),进而阻碍其重吸收,降低肠道中脂肪及胆固醇的消化和转运速率,减少肝脏胆固醇水平,但不同组分对胆汁酸的吸附能力不同,如无果胶膳食纤维对牛磺胆酸相比于全膳食纤维的吸附力较弱[25]。细胞、动物及临床试表明,苦荞作为主食被摄入机体后,肝脏及血清TC、TG、LDL-C显著降低,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)显著增加[3]。苦荞低消化性蛋白能够与结肠胆汁酸结合并形成不溶性复合物,进而增加粪便中固醇(包括酸性固醇和中性固醇)的排放和促进肝脏胆固醇转化为胆汁酸,同时还能抑制胆结石的形成[4, 60],且苦荞蛋白对血清TC的改善作用优于大米蛋白及小麦蛋白,这主要得益于苦荞蛋白能够下调肠道尼曼-匹克C1样蛋白1(Niemann-Pick C1-like protein, NPC1L1)、乙酰辅酶A胆固醇脂肪酰转移酶2(acyl CoA cholesterol acyltransferase, ACAT2)及ATP结合盒式转运体5和8(ATP binding cassette transporters 5 and 8, ABCG5/8)基因和上调肝脏胆固醇7-α羟化酶(hepatic cholesterol-7α-hydroxylase, CYP7A1)基因的表达。此外,苦荞可显著降低脂肪PPAR-γ基因表达水平,下调血清及脂肪组织iNOS、CD11c、TNF-α、IL-6、MCP-1基因表达,上调骨骼肌PGC-1α和SIRT1基因表达水平[48]。临床试验(剂量,110 g/d,4周)表明,全苦荞可显著降低空腹胰岛素、TC、LDL-C水平[17],这进一步说明苦荞对人体脂质代谢具有积极的调节作用。概括之,苦荞调节脂代谢的机理主要包括几个方面:1)通过膳食纤维和不溶性蛋白吸附胆汁酸,增加粪便脂质体及胆汁酸的排泄(图2-d);2)调节肠道胆固醇及胆汁吸收的基因表达与酶活性,如NPC1L1、ACAT2及ABCG5/8等(图2-a);3)调节肝脏及脂肪组织脂质代谢相关基因,如降低肝脏葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G-6-PD)和脂肪酸合成酶(fatty acid synthase, FAS)活性,下调PPAR-γ、CCAAT/强化结合蛋白α(CCAAT/enhancer-binding protein-α, C/EBPα)、甾醇调节元结合蛋白1c(sterol regulatory element-binding protein 1c, SREBP1c)、碳水化合物反应元结合蛋白(carbohydrate responsive element-binding protein, ChREBP)、3-羟基3-甲基戊二酰辅酶A(3-hydroxy3-methylglutaryl-coenzyme A, HMG-CoA)、iNOS、TNF-α、IL-6等基因的表达水平(图2-a);4)下调机体炎症水平[3, 48, 60]。参与调节脂质代谢的主要成分为苦荞膳食纤维、蛋白及多酚。
2.4 调节肠道微生态
肠道微生态可通过多种分子机制影响机体血糖水平:1)改善炎症;2)改变肠道渗透性;3)调节葡萄糖代谢;4)调节脂肪酸氧化与合成;5)调节微生物组成及代谢[66-67]。比如,乳杆菌属和阿克曼菌属的一些种类能分泌α-葡萄糖糖苷酶抑制剂抑制淀粉的分解,肠道微生物产物丁酸作为肠道G蛋白偶联受体43(G protein-coupled receptor 41/43, GPR41/43)配体,促进肠内分泌L细胞释放GLP-1等肠激素改善胰岛素抵抗和葡萄糖耐受[66]。
全苦荞可通过增加乳杆菌、乳酸菌、粪球菌和异杆菌属相对丰度,增强其产SCFAs水平,下调肝脏SREBP-2和PPAR-γ的表达水平,并能影响SREBP1和PPARα蛋白表达水平,降低氧化应激和炎症水平,改善大鼠脂质代谢[58-59]。而苦荞黄酮(芦丁占80.7%)可增加糖尿病小鼠肠道中与糖尿病相关的有益微生物(阿克曼菌属和普雷沃氏菌属),降低有害微生物(如埃希氏菌属和嗜胆菌属)的相对丰度,促进产SCFAs微生物(如罗氏菌属)生长,下调TNF-α、IL-6及空腹胰岛素水平,改善血糖水平[38]。上述结果说明苦荞对肠道菌群的调节作用与其多酚、膳食纤维及蛋白等成分相关,如苦荞芦丁、槲皮素、山奈酚等6种黄酮在体外对Agrobacterium tumefaciens, Pseudomonas lachrymans, Xanthomonas vesicatoria等微生物具有抑制作用,且芦丁表现出最强的抑菌活性[19]。苦荞多酚能调节肥胖大鼠肠道菌群组成,抑制与脂质合成相关的Lachnoclostridium、肠杆菌属及脱硫弧菌属等细菌的生长,也能促进阿克曼菌属(可改善2型糖尿病症状)的繁殖[9],苦荞槲皮素能显著降低大鼠血清脂肪、TNF-α及胰岛素含量,增强葡萄糖耐受力[57]。HE等[61]发现苦荞膳食纤维可促进小鼠肠道副拟杆菌属、灰色拟普雷沃菌属及norank_f_Muribaculaceae等产SCFAs,上调结肠GPR43(G protein-coupled receptor 43)和血清GLP-1表达,以及胰岛素信号通路GPR41、磷酸化AMPK表达水平,下调肝脏叉头框转录因子O1(fork-head transcription factor O1, FoxO1)、磷酸烯醇式丙酮酸羧基激酶(phosphoenolpyruvate carboxy kinase, PEPCK)及葡萄糖-6-磷酸酶(glucose-6-phosphase, G-6-Pase)表达水平,进而改善血清和肝脏脂肪代谢,降低空腹血糖水平。此外,苦荞蛋白可通过促进肠道菌群产SCFA,促进肠道毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)、乳杆菌、肠球菌及双歧杆菌的生长,抑制大肠杆菌生长,并能改善血清及肝脏脂质水平[8, 31]。ZHOU等[63]发现苦荞全粉可促进饮食诱导型肥胖大鼠肠道拟杆菌属、罗姆布茨菌属和产粪甾醇真杆菌属生长,并能改善肠道炎症,其效果优于苦荞蛋白和苦荞抗性淀粉,不同的是,苦荞抗性淀粉能明显增加粪菌属相对丰度,苦荞蛋白显著增加布劳特氏菌属和瘤胃球菌属相对丰度,而苦荞全粉和抗性淀粉对埃氏菌属-志贺氏菌属均有抑制作用。
综上,苦荞多酚、膳食纤维、蛋白及抗性淀粉对肠道菌群均有调节作用,且存在差异。苦荞多酚可通过“肠道微生物-TNF-α/IL-6-胰岛素信号轴”改善高血糖症,而苦荞膳食纤维可通过肠道微生物-SCFAs-GPR43/GLP-1信号轴及PI3K/AKT/FoxO1与GPR43/AMPK信号通路等途径改善机体血糖水平(图2-a、图2-e)。
总之,糖转运与代谢和氧化应激的异常,脂代谢障碍和肠道微生态紊乱是造成机体血糖异常的重要因素。苦荞抗性淀粉、蛋白与多肽、多酚及膳食纤维可通过多种机制限制淀粉消化与糖吸收、抗氧化、改善脂质代谢及肠道微生态等途径改善血糖水平。
3 不足与对策
目前,苦荞调控血糖的机理正逐渐被揭晓,但依然存在诸多不足:1)高血糖症的形成机制较为复杂,常以发病周期长、胰岛素抵抗、胰岛素分泌不足及胰岛β-细胞功能损伤导致的胰岛素脱敏为主要特征,涉及脂质代谢异常、炎症反应、氧化应激、内质网应激、肠道微生态、神经中枢系统调控功能失衡等多种机制,且这些机制之间存在一定的关联性[13-14],而已有研究多集中于上述的某一方面,难以系统阐释其调控血糖机制;2)苦荞膳食纤维、抗性淀粉、多酚及蛋白等成分对上述机制均有一定程度的影响,若采用苦荞某单一提取物(且剂量及比例往往与其在苦荞原料中的存在明显差异)或全苦荞均不能较好地揭示苦荞降血糖的相关机制;3)动物试验干预时间较短,多不超过8周(表2),而慢性病形成时间往往很久,且缺乏足够的临床试验数据;4)苦荞多酚及膳食纤维对肠道菌群均有不同程度的调节作用,但两者的调节差异尚不清晰;5)多种分子机制之间的关联性不清晰,难以系统地理解苦荞的降血糖机理。此外,苦荞因富含芦丁等而呈苦涩味,并使苦荞产品呈褐色或深褐色[68],苦荞膳食纤维多以非水溶性形式存在,难以被人体肠道菌群发酵利用,这些特性降低了消费者对苦荞产品的可接受度及苦荞生理功能。因此,今后可从几个方面深入研究:1)充分利用对照试验,系统地探究苦荞生物活性成分对动物及人体的长期干预效果及机制;2)利用精细分离技术及代谢组学等多种方法,探究苦荞膳食纤维与多酚对肠道菌群的调节作用及其差异与机制;3)采用绿色加工技术降低苦荞芦丁含量,同时增加可溶性膳食纤维比例。
4 结论
苦荞淀粉、蛋白、脂质总含量与小麦等谷物并无明显差异,但其组成、结构及功能存在诸多不同。苦荞多酚含量与种类与品种、生长环境及分析技术紧密相关,并多以游离态存在,主要为芦丁(占比超过80%)、槲皮素及阿魏酸等,且在苦荞谷粒不同部位中的分布存在较大差异。苦荞膳食纤维以水不溶性多糖为主,含量与品种相关。苦荞主要通过参与调节机体氧化应激水平、淀粉消化、血糖转运与代谢、脂质代谢及肠道菌群等多种机制改善血糖水平,这与苦荞多酚、蛋白、多肽及膳食纤维的作用紧密相关。然而,苦荞功能成分的理化性质及其调控血糖多种机制之间的相关性仍需进一步深入研究。
[1] LIU Y X, CAI C Z, YAO Y L, et al.Alteration of phenolic profiles and antioxidant capacities of common buckwheat and Tartary buckwheat produced in China upon thermal processing[J].Journal of the Science of Food and Agriculture, 2019, 99(12):5565-5576.
[2] ZHOU M L, TANG Y, DENG X Y, et al.Overview of Buckwheat Resources in the World[M].Buckwheat Germplasm in the World.Amsterdam:Elsevier, 2018:1-7.
[3] GIMÉNEZ-BASTIDA J A, ZIELI SKI H.Buckwheat as a functional food and its effects on health[J].Journal of Agricultural and Food Chemistry, 2015, 63(36):7896-7913.
SKI H.Buckwheat as a functional food and its effects on health[J].Journal of Agricultural and Food Chemistry, 2015, 63(36):7896-7913.
[4] JIN J, OHANENYE I C, UDENIGWE C C.Buckwheat proteins:Functionality, safety, bioactivity, and prospects as alternative plant-based proteins in the food industry[J].Critical Reviews in Food Science and Nutrition, 2022, 62(7):1752-1764.
[5] ZOU L, WU D T, REN G X, et al.Bioactive compounds, health benefits, and industrial applications of Tartary buckwheat (Fagopyrum tataricum)[J].Critical Reviews in Food Science and Nutrition, 2023, 63(5):657-673.
[6] ZHU F.Chemical composition and health effects of Tartary buckwheat[J].Food Chemistry, 2016, 203:231-245.
[7] WU W J, LI Z G, QIN F, et al.Anti-diabetic effects of the soluble dietary fiber from Tartary buckwheat bran in diabetic mice and their potential mechanisms[J].Food &Nutrition Research, 2021, 65:4998.
[8] LIU J, SONG Y, ZHAO Q, et al.Effects of Tartary buckwheat protein on gut microbiome and plasma metabolite in rats with high-fat diet[J].Foods, 2021, 10(10):2457.
[9] ZHANG Z L, ZHOU M L, TANG Y, et al.Bioactive compounds in functional buckwheat food[J].Food Research International, 2012, 49(1):389-395.
[10] SINKOVI L, DEŽELAK M, KOPIN
L, DEŽELAK M, KOPIN R, et al.Macro/microelements, nutrients and bioactive components in common and Tartary buckwheat (Fagopyrum spp.) grain and stone-milling fractions[J].LWT, 2022, 161:113422.
R, et al.Macro/microelements, nutrients and bioactive components in common and Tartary buckwheat (Fagopyrum spp.) grain and stone-milling fractions[J].LWT, 2022, 161:113422.
[11] KE J, RAN B, SUN P Y, et al.An evaluation of the absolute content of flavonoids and the identification of their relationship with the flavonoid biosynthesis genes in Tartary buckwheat seeds[J].Agronomy, 2023, 13(12):3006.
[12] SINKOVI L, KOKALJ SINKOVI
L, KOKALJ SINKOVI D, MEGLI
D, MEGLI V.Milling fractions composition of common (Fagopyrum esculentum Moench) and Tartary (Fagopyrum tataricum) Gaertn.) buckwheat[J].Food Chemistry, 2021, 365:130459.
V.Milling fractions composition of common (Fagopyrum esculentum Moench) and Tartary (Fagopyrum tataricum) Gaertn.) buckwheat[J].Food Chemistry, 2021, 365:130459.
[13] SPRACKLEN C N, HORIKOSHI M, KIM Y J, et al.Identification of type 2 diabetes loci in 433, 540 East Asian individuals[J].Nature, 2020, 582(7811):240-245.
[14] GBD 2017 Diet Collaborators.Health effects of dietary risks in 195 countries, 1990—2017:A systematic analysis for the Global Burden of Disease Study 2017[J].Lancet, 2019, 393(10184):1958-1972.
[15] LEE L C, HOU Y C, HSIEH Y Y, et al.Dietary supplementation of rutin and rutin-rich buckwheat elevates endogenous glucagon-like peptide 1 levels to facilitate glycemic control in type 2 diabetic mice[J].Journal of Functional Foods, 2021, 85:104653.
[16] SHEN L, LI C, WANG W X, et al.Buckwheat extracts rich in flavonoid aglycones and flavonoid glycosides significantly reduced blood glucose in diabetes mice[J].Journal of Functional Foods, 2024, 113:106029.
[17] QIU J, LIU Y P, YUE Y F, et al.Dietary Tartary buckwheat intake attenuates insulin resistance and improves lipid profiles in patients with type 2 diabetes:A randomized controlled trial[J].Nutrition Research, 2016, 36(12):1392-1401.
[18] YAN J, XUE Q Y, CHEN W Y, et al.Probiotic-fermented rice buckwheat alleviates high-fat diet-induced hyperlipidemia in mice by suppressing lipid accumulation and modulating gut microbiota[J].Food Research International, 2022, 155:111125.
[19] ZHONG L Y, LIN Y J, WANG C, et al.Chemical profile, antimicrobial and antioxidant activity assessment of the crude extract and its main flavonoids from Tartary buckwheat sprouts[J].Molecules, 2022, 27(2):374.
[20] LEE L S, CHOI E J, KIM C H, et al.Contribution of flavonoids to the antioxidant properties of common and Tartary buckwheat[J].Journal of Cereal Science, 2016, 68:181-186.
[21] DU J, LI H T, HUANG J Y, et al.Insights into the reasons for lower digestibility of buckwheat-based foods:The structure-physical properties of starch aggregates[J].Journal of Cereal Science, 2022, 107:103506.
[22] WANG J L, WU Y X, HAN M R, et al.Effect of environment and variety on the physicochemical properties of Tartary buckwheat starch[J].Journal of the Science of Food and Agriculture, 2023, 103(5):2413-2424.
[23] ZHU F.Buckwheat starch:Structures, properties, and applications[J].Trends in Food Science &Technology, 2016, 49:121-135.
[24] SINDHU R, KHATKAR B S.Influence of oxidation, acetylation and hydrothermal treatment on structure and functionality of common buckwheat starch[J].International Journal of Biological Macromolecules, 2023, 253:127211.
[25] ZHU F.Dietary fiber polysaccharides of amaranth, buckwheat and quinoa grains:A review of chemical structure, biological functions and food uses[J].Carbohydrate Polymers, 2020, 248:116819.
[26] BHINDER S, SINGH B, KAUR A, et al.Effect of infrared roasting on antioxidant activity, phenolic composition and Maillard reaction products of Tartary buckwheat varieties[J].Food Chemistry, 2019, 285:240-251.
[27] ZHUO Z, YU B, QIAO J W, et al.Effect of high moisture extrusion on the structure and physicochemical properties of Tartary buckwheat protein and its in vitro digestion[J].Food Research International, 2024, 180:114065.
[28] JIN J, OKAGU O D, UDENIGWE C C.Differential influence of microwave and conventional thermal treatments on digestibility and molecular structure of buckwheat protein isolates[J].Food Biophysics, 2022, 17(2):198-208.
[29] LI D Z, ZHU L, WU Q M, et al.Different interactions between Tartary buckwheat protein and Tartary buckwheat phenols during extraction:Alterations in the conformation and antioxidant activity of protein[J].Food Chemistry, 2023, 418:135711.
[30] BHINDER S, KAUR A, SINGH B, et al.Proximate composition, amino acid profile, pasting and process characteristics of flour from different Tartary buckwheat varieties[J].Food Research International, 2020, 130:108946.
[31] ZHU F.Buckwheat proteins and peptides:Biological functions and food applications[J].Trends in Food Science &Technology, 2021, 110:155-167.
[32] RAGUINDIN P F, ADAM ITODO O, STOYANOV J, et al.A systematic review of phytochemicals in oat and buckwheat[J].Food Chemistry, 2021, 338:127982.
[33] PODOLSKA G, GUJSKA E, KLEPACKA J, et al.Bioactive compounds in different buckwheat species[J].Plants, 2021, 10(5):961.
[34] LI H Y, LYU Q Y, LIU A K, et al.Comparative metabolomics study of Tartary (Fagopyrum tataricum (L.) Gaertn) and common (Fagopyrum esculentum (L.)) buckwheat seeds[J].Food Chemistry, 2022, 371:131125.
[35] XIAO Y, LI K L, ZHANG H Y, et al.The profile of buckwheat tannins based on widely targeted metabolome analysis and pharmacokinetic study of ellagitannin metabolite urolithin A[J].LWT, 2022, 156:113069.
[36] MART N-GARC
N-GARC A B, PASINI F, VERARDO V, et al.Distribution of free and bound phenolic compounds in buckwheat milling fractions[J].Foods, 2019, 8(12):670.
A B, PASINI F, VERARDO V, et al.Distribution of free and bound phenolic compounds in buckwheat milling fractions[J].Foods, 2019, 8(12):670.
[37] KALINOV J P, VRCHOTOV
J P, VRCHOTOV N, T
N, T
 SKA J.Phenolics levels in different parts of common buckwheat (Fagopyrum esculentum) achenes[J].Journal of Cereal Science, 2019, 85:243-248.
SKA J.Phenolics levels in different parts of common buckwheat (Fagopyrum esculentum) achenes[J].Journal of Cereal Science, 2019, 85:243-248.
[38] CHENG W W, CAI C F, KREFT I, et al.Tartary buckwheat flavonoids improve colon lesions and modulate gut microbiota composition in diabetic mice[J].Evidence-Based Complementary and Alternative Medicine, 2022, 2022(1):4524444.
[39] WANG X T, ZHU Z Y, ZHAO L, et al.Structural characterization and inhibition on α-d-glucosidase activity of non-starch polysaccharides from Fagopyrum tartaricum[J].Carbohydrate Polymers, 2016, 153:679-685.
[40] ZHANG D Q, WANG L P, TAN B, et al.Dietary fibre extracted from different types of whole grains and beans:A comparative study[J].International Journal of Food Science &Technology, 2020, 55(5):2188-2196.
[41] OH M J, CHOI H D, HA S K, et al.Immunomodulatory effects of polysaccharide fraction isolated from Fagopyrum esculentum on innate immune system[J].Biochemical and Biophysical Research Communications, 2018, 496(4):1210-1216.
[42] ALT KARDE
KARDE E, GÜZEL N.Impact of germination pre-treatments on buckwheat and quinoa:Mitigation of anti-nutrient content and enhancement of antioxidant properties[J].Food Chemistry:X, 2024, 21:101182.
E, GÜZEL N.Impact of germination pre-treatments on buckwheat and quinoa:Mitigation of anti-nutrient content and enhancement of antioxidant properties[J].Food Chemistry:X, 2024, 21:101182.
[43] CAMPOS C.Chronic hyperglycemia and glucose toxicity:Pathology and clinical sequelae[J].Postgraduate Medicine, 2012, 124(6):90-97.
[44] BODEN G, HOMKO C, BARRERO C A, et al.Excessive caloric intake acutely causes oxidative stress, GLUT4 carbonylation, and insulin resistance in healthy men[J].Science Translational Medicine, 2015, 7(304):304re7.
[45] CHOI S Y, CHOI J Y, LEE J M, et al.Tartary buckwheat on nitric oxide-induced inflammation in RAW264.7 macrophage cells[J].Food &Function, 2015, 6(8):2664-2670.
[46] ALMUHAYAWI M S, HASSAN A H A, ABDEL-MAWGOUD M, et al.Laser light as a promising approach to improve the nutritional value, antioxidant capacity and anti-inflammatory activity of flavonoid-rich buckwheat sprouts[J].Food Chemistry, 2021, 345:128788.
[47] PANDE S, RANJAN R, RYAZANOVA M, et al.Buckwheat-enriched diet alleviates bisphenol A mediated oxidative stress via modulation of sirtuin 1 and antioxidant status in experimental rats[J].Food Chemistry, 2022, 373:131507.
[48] KIM S Y, LEE M S, CHANG E, et al.Tartary buckwheat extract attenuated the obesity-induced inflammation and increased muscle PGC-1a/SIRT1 expression in high fat diet-induced obese rats[J].Nutrients, 2019, 11(3):654.
[49] ZHOU Y M, JIANG Y, SHI R H, et al.Structural and antioxidant analysis of Tartary buckwheat (Fagopyrum tartaricum Gaertn.) 13S globulin[J].Journal of the Science of Food and Agriculture, 2020, 100(3):1220-1229.
[50] NE OVI
OVI M, GA
M, GA I
I U, TOSTI T, et al.Distribution of polyphenolic and sugar compounds in different buckwheat plant parts[J].RSC Advances, 2021, 11(42):25816-25829.
U, TOSTI T, et al.Distribution of polyphenolic and sugar compounds in different buckwheat plant parts[J].RSC Advances, 2021, 11(42):25816-25829.
[51] YANG J, GU Z B, ZHU L, et al.Buckwheat digestibility affected by the chemical and structural features of its main components[J].Food Hydrocolloids, 2019, 96:596-603.
[52] LIU X W, LE BOURVELLEC C, RENARD C M G C.Interactions between cell wall polysaccharides and polyphenols:Effect of molecular internal structure[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3574-3617.
[53] LUTHAR Z, GOLOB A, GERM M, et al.Tartary buckwheat in human nutrition[J].Plants, 2021, 10(4):700.
[54] WANG L B, WANG L J, WANG T T, et al.Comparison of quercetin and rutin inhibitory influence on Tartary buckwheat starch digestion in vitro and their differences in binding sites with the digestive enzyme[J].Food Chemistry, 2022, 367:130762.
[55] ZHOU Y M, JIANG Q Y, MA S J, et al.Effect of quercetin on the in vitro Tartary buckwheat starch digestibility[J].International Journal of Biological Macromolecules, 2021, 183:818-830.
[56] WU W J, WANG L J, QIU J, et al.The analysis of fagopyritols from Tartary buckwheat and their anti-diabetic effects in KK-Ay type 2 diabetic mice and HepG2 cells[J].Journal of Functional Foods, 2018, 50:137-146.
[57] PENG L X, ZHANG Q, ZHANG Y H, et al.Effect of Tartary buckwheat, rutin, and quercetin on lipid metabolism in rats during high dietary fat intake[J].Food Science &Nutrition, 2020, 8(1):199-213.
[58] WANG Y, QI W T, GUO X X, et al.Effects of oats, Tartary buckwheat, and foxtail millet supplementation on lipid metabolism, oxido-inflammatory responses, gut microbiota, and colonic SCFA composition in high-fat diet fed rats[J].Nutrients, 2022, 14(13):2760.
[59] REN Y H, WU S S, XIA Y, et al.Probiotic-fermented black Tartary buckwheat alleviates hyperlipidemia and gut microbiota dysbiosis in rats fed with a high-fat diet[J].Food &Function, 2021, 12(13):6045-6057.
[60] ZHANG C N, ZHANG R, LI Y M, et al.Cholesterol-lowering activity of Tartary buckwheat protein[J].Journal of Agricultural and Food Chemistry, 2017, 65(9):1900-1906.
[61] HE X Q, LI W Z, CHEN Y Y, et al.Dietary fiber of Tartary buckwheat bran modified by steam explosion alleviates hyperglycemia and modulates gut microbiota in db/db mice[J].Food Research International, 2022, 157:111386.
[62] NISHIMURA M, OHKAWARA T, SATO Y, et al.Effectiveness of rutin-rich Tartary buckwheat (Fagopyrum tataricum Gaertn.) ‘Manten-Kirari’ in body weight reduction related to its antioxidant properties:A randomised, double-blind, placebo-controlled study[J].Journal of Functional Foods, 2016, 26:460-469.
[63] ZHOU Y M, LU H Y, ZHAO S, et al.The beneficial effects of Tartary buckwheat (Fagopyrum tataricum Gaertn.) on diet-induced obesity in mice are related to the modulation of gut microbiota composition[J].Food Science and Human Wellness, 2023, 12(4):1323-1330.
[64] DODD G T, KIM S J, MÉQUINION M, et al.Insulin signaling in AgRP neurons regulates meal size to limit glucose excursions and insulin resistance[J].Science Advances, 2021, 7(9):eabf4100.
[65] JOHNSON A M F, OLEFSKY J M.The origins and drivers of insulin resistance[J].Cell, 2013, 152(4):673-684.
[66] GURUNG M, LI Z P, YOU H, et al.Role of gut microbiota in type 2 diabetes pathophysiology[J].EBioMedicine, 2020, 51:102590.
[67] LOUIS-JEAN S, MARTIROSYAN D.Nutritionally attenuating the human gut microbiome to prevent and manage metabolic syndrome[J].Journal of Agricultural and Food Chemistry, 2019, 67(46):12675-12684.
[68] BRITES L T G F, REBELLATO A P, MEINHART A D, et al.Technological, sensory, nutritional and bioactive potential of pan breads produced with refined and whole grain buckwheat flours[J].Food Chemistry:X, 2022, 13:100243.