据世界卫生组织(World Health Organization,WHO)统计发现,全球范围内由食源性致病菌感染引起的病例已经高达60亿,导致40万人感染死亡[1-2]。食源性致病菌是一类可以引起食物中毒或以食品为媒介的致病性细菌,主要由金黄色葡萄球菌(Staphylococcus aureus)、大肠埃希氏菌(Escherichia coli)、单增李斯特菌(Listeria monocytogenes)、沙门氏菌(Salmonella)等[3]。其中S.aureus属于葡萄球菌属,是革兰氏阳性菌,严重威胁食品工业和食品安全。同时S.aureus在一定条件下能够产生肠毒素,该毒素会引起食物中毒,受感染的患者会出现恶心、呕吐、腹泻等现象[4],严重者出现多脏器功能衰竭等症状[5]。临床上一般选择用抗生素治疗S.aureus,但随着抗生素的不断使用,S.aureus对抗生素的耐药性逐渐增加[6]。目前单一的抗生素很难有效遏制S.aureus的生长,该现象加大了对新型抑菌方案的需求。
药物联用是一种新型的抑菌方案,通过使用2种或多种抗菌化合物提高抑菌效果。相较于单一药物使用,药物联用可以有效减少药物使用浓度、缓解细菌耐药性并降低药物毒副作用[7]。LIN等[8]发现曲酸和天然化合物茶多酚联用通过改变铁的摄取途径来抑制E. coli。天然化合物茴香醛与抗生素的联用对S.aureus的抑制效果明显好于药物单独处理组[9]。将抗菌药物和天然化合物联用,天然化合物可以改变细胞膜的通透性,能够促进抗菌药物的渗透,从而达到更好的抑菌效果[10-11]。部分天然化合物可直接作用于毒力因子,抑制毒力因子活性并降低细菌致病性[12]。
山梨酸钾(potassium sorbate,PS),学名为2,4-己二烯酸钾,具有低毒性,基本不会对人体有危害。山梨酸钾通过人体正常的新陈代谢被分解为CO2和H2O,且对食品品质无不良影响,联合国粮农组织将山梨酸钾推荐为安全、高效的食品防腐剂[13-14],证实山梨酸钾能有效延长食品的保质期。LIU等[15]发现壳聚糖和山梨酸钾复配能有效降低真菌,从而实现大枣的保鲜。山梨酸钾和肉桂醛联用可以有效抑制鼠伤寒沙门氏菌(Salmonella Typhimurium),延长苹果酱的保质期[16],将山梨酸钾和辐射联合使用可以明显延长草莓的保质期[17]。
茶多酚(tea polyphenols,TP)是一种从茶叶中提取的多羟基酚类化合物的总称[18],对多种细菌有抑制作用,因其抑菌作用被广泛用于食品保鲜。茶多酚的抑菌机制表现在破坏微生物细胞膜的通透性、微生物酶活等方面。小檗碱(berberine,BB)起初是指从中药黄连中分离的一种季铵生物碱,后因小檗碱在研究中表现出多种药用效果,使其在临床医学的应用更为普遍。同时,小檗碱具有高浓度杀菌、低浓度抑菌的特点,可以影响S.aureus的生物膜形成,来发挥其抗菌作用[19]。
本文选取了山梨酸钾、茶多酚和小檗碱3种药物进行药物联合抑菌活性研究。测定了S.aureus的生长曲线,分析比较3种药物单独使用或联用对S.aureus生长趋势的影响;通过药敏性实验,测定S.aureus对不同浓度药物单独使用或组合使用的敏感性,探究药物浓度以及单独或联用的抑菌效果。
1 材料和方法
1.1 材料和试剂
金黄色葡萄球菌(S.aureus)ATCC 6538,本实验室菌种保藏。
Mueller Hinton肉汤(MH肉汤)培养基,青岛高科技工业园海博生物技术有限公司;胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基,北京奥博星生物技术有限责任公司;琼脂,北京索莱宝科技有限公司;茶多酚、小檗碱、山梨酸钾,上海源叶生物科技有限公司。
1.2 仪器和设备
Scientz-WSQ全自动微生物曲线仪,宁波新芝生物科技股份有限公司;GI54DWS高压蒸汽灭菌锅,致微(厦门)仪器有限公司。
1.3 实验方法
1.3.1 菌株活化
用划线法将S.aureus活化在胰蛋白胨大豆琼脂板上,在37 ℃培养箱中过夜培养。挑取单菌落至TSB中,在培养箱中以37 ℃,200 r/min的速度过夜培养。
1.3.2 最小抑菌浓度(minimal inhibitory concentration,MIC)测定
采用微量肉汤稀释法[20]测定山梨酸钾、茶多酚和小檗碱分别对S.aureus的MIC。配制山梨酸钾、茶多酚和小檗碱的母液质量浓度分别为4、4.8、8 mg/mL,过0.22 μm滤膜,用TSB进行二倍稀释,按1%(体积分数)的比例加入菌液。以仅含液体培养基的试管作为阴性对照,以不含药品的试管作为空白对照。调整最终菌液浓度为1×106 CFU/mL,取200 μL菌液加入96孔板中,在培养箱中以37 ℃静置培养24 h,肉眼观察没有细菌生长的最低浓度,即MIC值。
1.3.3 部分抑菌浓度指数(fractional inhibitory concentration index,FICI)测定
利用肉汤稀释棋盘测定法[21]测量3种药物在梯度浓度下两两联用的抑菌效果。先将菌液在MH肉汤中稀释至OD600=0.4,再稀释100倍,作为工作液待用。在96孔板的每个孔中加入2种不同浓度药物稀释液各50 μL,以及100 μL的工作液,将96孔板置于37 ℃培养箱中培养24 h。依据临床与实验室标准协会指南(Clinical &Laboratory Standards Institute,CLSI)指南来确保微生物测定的准确。为了评价每种组合的抗菌作用,FICI被计算为药物A和B组合的MIC与药物A(或B)单独的MIC的比值。FICI值≤0.5代表协同作用,0.5
(1)
式中:MICA和MICB,单独作用的抗菌剂A和B的![]() 和
和![]() 联合使用时最小抑菌组合中药剂A和B的作用浓度。
联合使用时最小抑菌组合中药剂A和B的作用浓度。
1.3.4 生长曲线
为探究山梨酸钾、茶多酚和小檗碱对S.aureus的生长影响情况。测定菌液在不加药物、单独加药物以及药物联用的情况下OD600值随时间的变化曲线,设置3个平行。使用全自动微生物生长曲线仪测定,设置仪器参数(37 ℃,220 r/min,24 h),记录仪器自动调零后的OD值,每30 min记录1次数值。
1.3.5 纸片扩散实验
采用纸片扩散法[23]对S.aureus进行药物敏感性实验。将过夜培养的菌液稀释100倍涂布在琼脂平板上,再将浸有1 MIC、1/2 MIC、1/4 MIC山梨酸钾与茶多酚或小檗碱单独或组合的纸片施加在平板上,37 ℃过夜培养后,测量抑菌圈直径大小。
1.3.6 分子对接
利用Swiss-Model同源构建毒力因子蛋白,肠毒素A、肠毒素B、酪蛋白裂解酶P(Clp protease proteolytic subunit,ClpP)和表面聚合因子A(clumping factor A,ClfA)为受体蛋白,小檗碱为配体蛋白。利用Autodock Vina将蛋白的活性点和小檗碱进行对接,以分子结合能为评价指标,最大负值即为最稳定构象。
1.4 数据处理
所有样本数据采用SPSS 26.0进行单因素分析,图基检验法确定P<0.05水平的显著性,用Graphpad Prism 10进行绘图,实验重复3次。
2 结果与分析
2.1 MIC值
山梨酸钾对S.aureus的MIC值为2 mg/mL,茶多酚对S.aureus的MIC值为0.125 mg/mL,小檗碱对S.aureus的MIC值为2 mg/mL。
2.2 FICI值
山梨酸钾和茶多酚联用对S.aureus的FICI值0.375<0.5,表现为协同作用;山梨酸钾和小檗碱联用对S.aureus 的FICI值为0.562 5,通过比较0.5<0.562 5<1,山梨酸钾和小檗碱联用对S.aureus的抑制表现为累加作用;小檗碱和茶多酚联用对S.aureus的FICI值为2.062,通过比较1<2.062<4,得出结论,小檗碱和茶多酚联用对S.aureus的抑制无相关作用,因此选择山梨酸钾和茶多酚以及山梨酸钾和小檗碱2个组合继续实验。
2.3 山梨酸钾和茶多酚或小檗碱联用对S.aureus生长趋势的影响
2.3.1 山梨酸钾和茶多酚单独使用或联用对S.aureus生长趋势的影响
1/2 MIC浓度的山梨酸钾和茶多酚单独使用或联用处理S.aureus的生长曲线如图1-a所示。在对数生长期,实验组的OD值始终低于空白对照组,表明添加药物对S.aureus均有很好的抑制作用(P<0.05)。进入稳定期后,山梨酸钾的OD值逐渐下降,此时茶多酚组的OD值依然缓慢上升。山梨酸钾和茶多酚单独使用时,S.aureus的细菌数量和空白对照组相比无显著差异。山梨酸钾和茶多酚联用时,S.aureus的增殖能力显著低于空白对照组和2种药物单独作用。
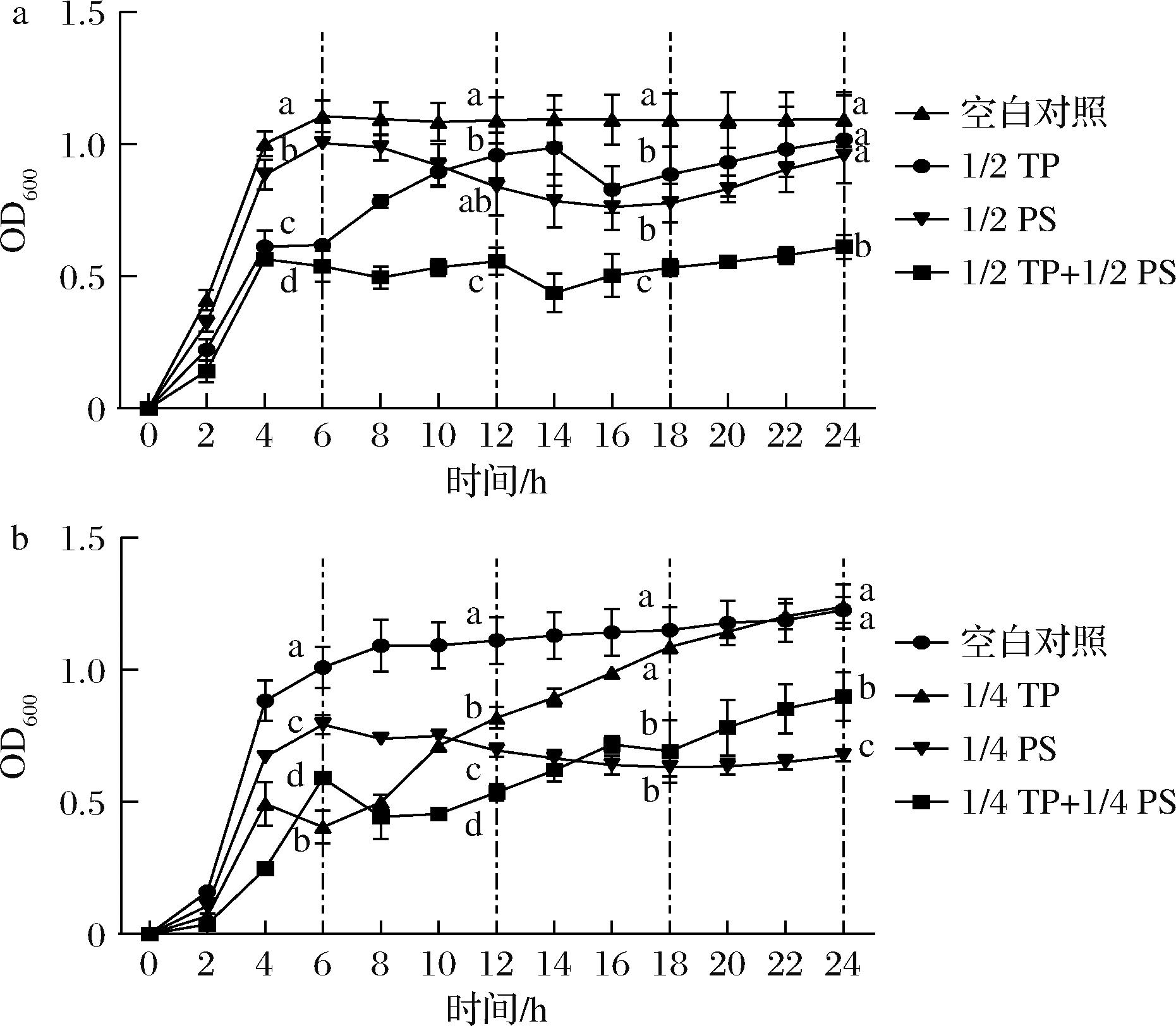
a-1/2 MIC药物浓度;b-1/4MIC药物浓度
图1 PS和TP单独使用或联用对S.aureus生长的影响
Fig.1 The growth of S.aureus treated with PS and TP alone or together
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
1/4 MIC浓度的山梨酸钾和茶多酚单独使用或联用处理S.aureus的生长曲线如图1-b所示。结果显示,药物浓度为1/4 MIC浓度,2种药物单独使用S.aureus的生长曲线和1/2 MIC浓度表现出相同的趋势。实验组对S.aureus均表现出显著的抑制效果,细菌数量始终低于空白对照组。山梨酸钾和茶多酚联用,相较茶多酚组,对S.aureus表现出更好的抑制效果,但山梨酸钾和茶多酚联用对S.aureus的抑制效果与单独使用山梨酸钾对S.aureus的抑制效果无显著差异。对比1/2 MIC和1/4 MIC浓度山梨酸钾和茶多酚联用S.aureus的生长曲线,发现1/2 MIC的药物浓度对S.aureus的抑制作用更显著并且更加稳定。
2.3.2 山梨酸钾和小檗碱单独使用或联用对S.aureus生长趋势的影响
S.aureus在不同浓度的山梨酸钾和小檗碱单独使用或联用时的生长曲线结果如图2所示。1/2 MIC和1/4 MIC药物浓度处理,S.aureus表现出相同的生长趋势。在对数生长期,Control组和山梨酸钾组的S.aureus的OD值均迅速上升。S.aureus进入稳定生长期后,山梨酸钾组S.aureus生长缓慢,且细菌数量明显少于对照组。小檗碱组和药物联用组S.aureus生长曲线基本重合,OD值始终接近于0。鉴于小檗碱存在时,S.aureus生长被完全抑制,推测出小檗碱在其中发挥了重要作用。此外,通过对比发现小檗碱和山梨酸钾联用的抑菌效果明显优于山梨酸钾和茶多酚联用。因此,进一步探究了小檗碱的干预时间对S.aureus生长趋势的影响以及小檗碱与S.aureus毒力因子的相互作用。
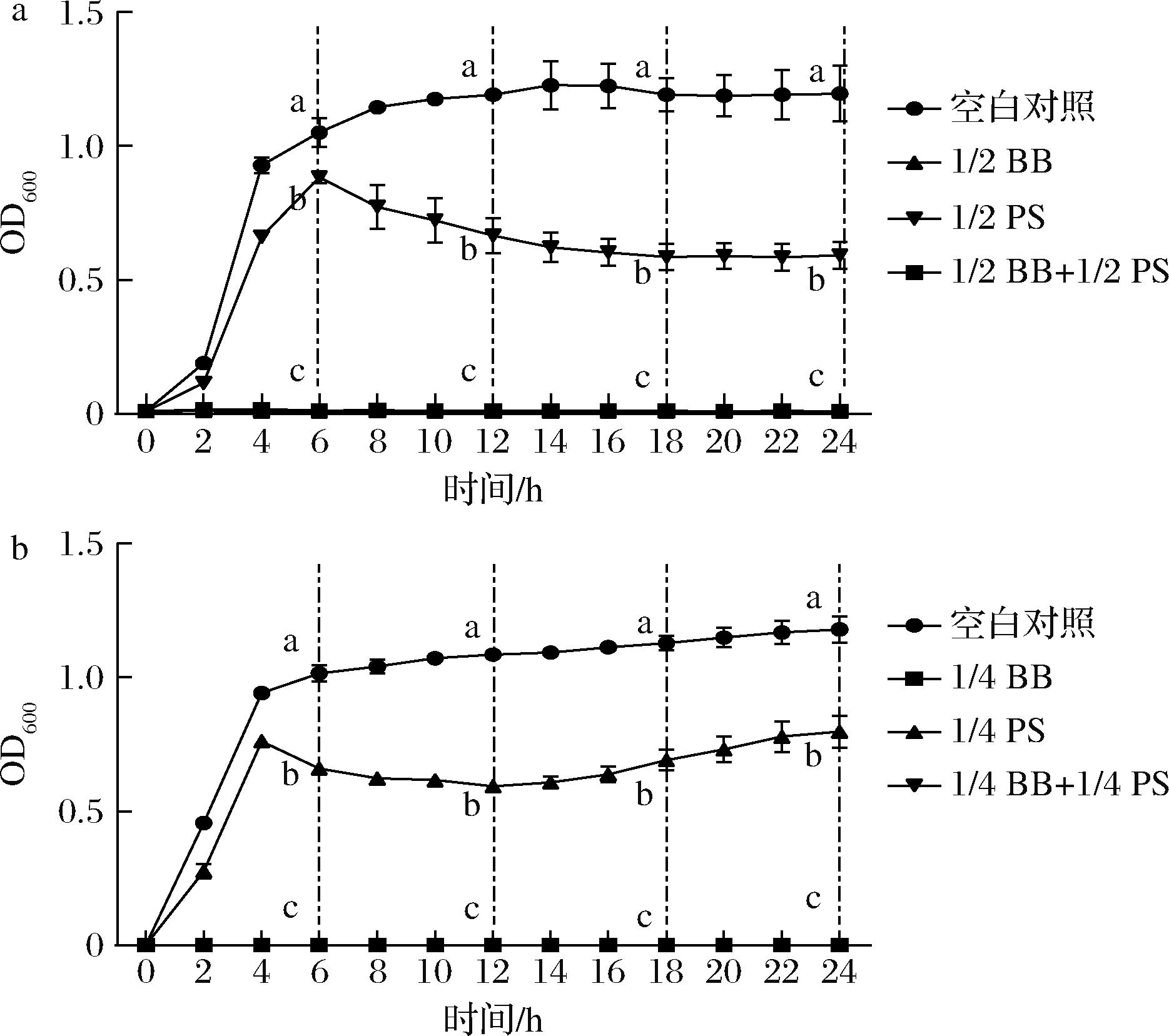
a-1/2 MIC药物浓度;b-1/4MIC药物浓度
图2 PS和BB单独使用或联用对S.aureus生长的影响
Fig.2 Growth of S.aureus treated with BB and PS alone or together
2.3.3 小檗碱的干预时间对S.aureus生长趋势的影响
为了探究小檗碱加入S.aureus的OD值趋近于0的原因,在不同的时间点加入小檗碱,测定S.aureus生长趋势的变化。
在0、3、6、9和12 h加入小檗碱,监测24 h内S.aureus的生长趋势变化,结果如图3所示。从曲线图可以看出,0 h加入小檗碱S.aureus的生长曲线与图2一致。在不同的时间点加入小檗碱,S.aureus的OD值都会出现下降的趋势。在6 h加入小檗碱,S.aureus的OD值下降速度最快,而在9 h或者12 h加入小檗碱,OD值并没有表现出很大变化。说明在对数生长期的S.aureus对小檗碱较为敏感。
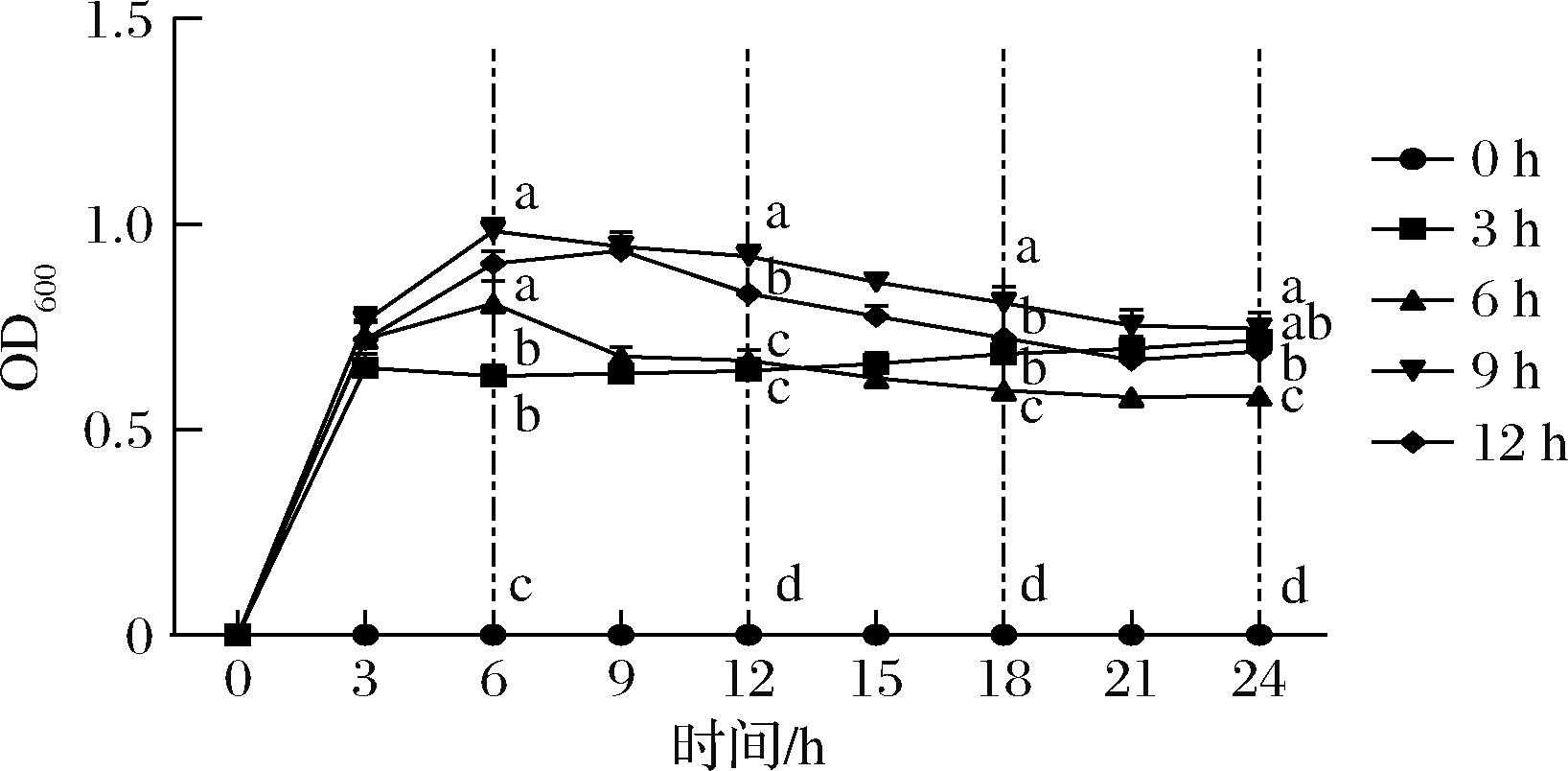
图3 不同时间段加入小檗碱S.aureus的生长趋势变化
Fig.3 Growth of S.aureus interrupted by berberine at different time point
综上所述,小檗碱在第6小时加入对S.aureus的生长干预效果最佳。0 h加入小檗碱S.aureus的OD值接近于0,细菌无法繁殖的原因,可能是小檗碱损害细菌细胞膜导致细菌死亡,具体机制的阐明有待进一步研究。
2.4 小檗碱与S.aureus毒力因子的相互作用
天然化合物能直接作用于S.aureus的毒力蛋白,减缓其毒副作用[12]。为了检验小檗碱是否会影响S.aureus毒力因子,选取了肠毒素A、肠毒素B、ClpP和ClfA为受体蛋白。利用分子对接的方法,探究小檗碱和S.aureus毒力因子之间的作用力。结果如图4所示。
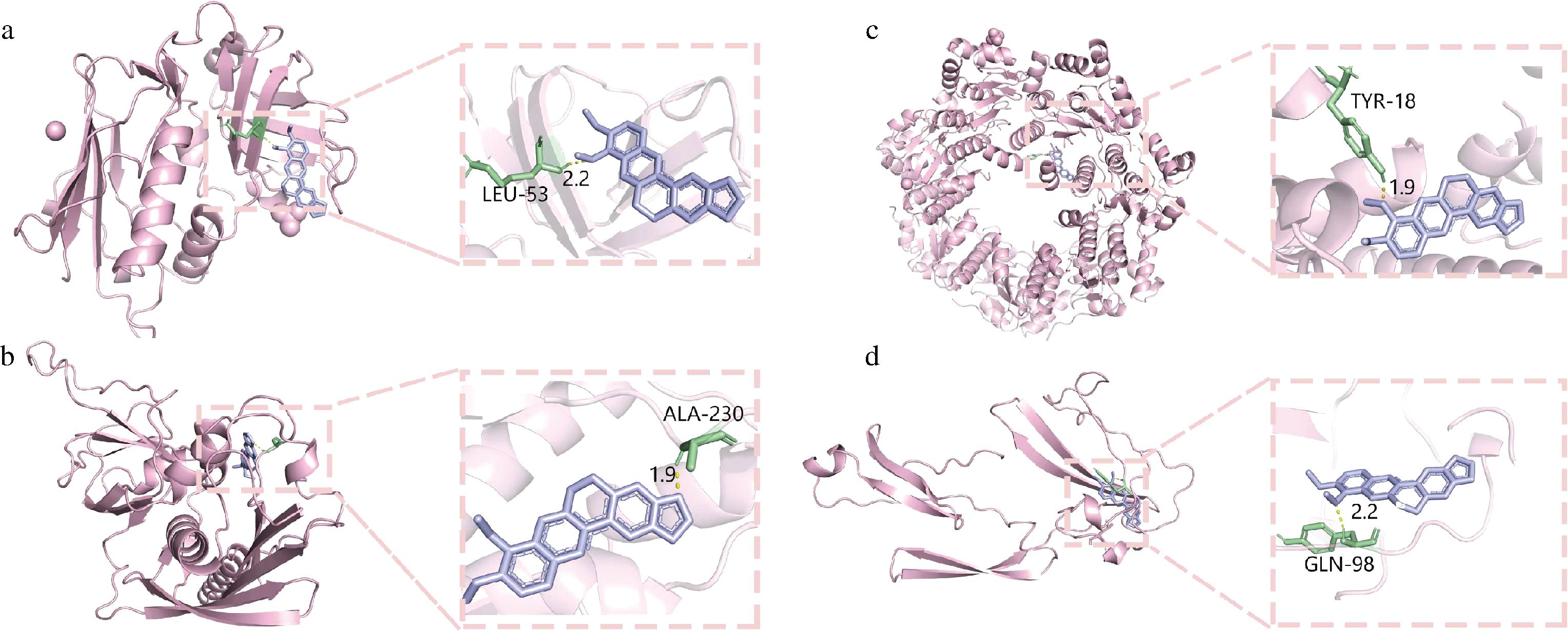
a-肠毒素A;b-肠毒素B;c-ClpP;d-ClfA
图4 小檗碱和毒力蛋白的分子对接图
Fig.4 Diagram of molecular docking between berberine and virulence factors
小檗碱均能对接于4种毒力蛋白的活性区域内,同时小檗碱和肠毒素A、肠毒素B、ClpP和ClfA的对接结合能分别为-5.02、-6.67、-5.21、-9.00 kcal/mol,其中ClfA和小檗碱的对接效果最佳,有最稳定构象。ClfA在S.aureus致病过程中起重要作用,帮助细菌的定植和扩散。ClfA和小檗碱特异性结合,抑制S.aureus的定植和扩散,抑制生物膜的形成。
2.5 S.aureus对山梨酸钾和茶多酚或者小檗碱联用的敏感性
2.5.1 S.aureus对山梨酸钾和茶多酚单独或联用的敏感性
利用琼脂扩散法[24]检测山梨酸钾和小檗碱或茶多酚单独或联用于S.aureus的抑制效果,反映了S.aureus对3种药物的敏感程度,山梨酸钾与茶多酚联用药敏试验结果如图5所示。在1 MIC浓度,单独使用山梨酸钾和茶多酚处理S.aureus,抑菌圈直径分别为0.75 cm和0.57 cm,S.aureus对山梨酸钾更加敏感。山梨酸钾和茶多酚联用处理S.aureus,抑菌圈直径达到了0.79 cm以上,且随山梨酸钾浓度增加,抑菌圈直径增加。1/2 MIC浓度,2种药物单独作用无显著差异(P<0.05),2种药物联用,低浓度的山梨酸钾与茶多酚对S.aureus的抑制效果不显著。在1/4 MIC浓度,药物单独作用以及低浓度的山梨酸钾和茶多酚联用没有显著差异,高浓度的药物联用表现出较强于其他处理组的抑菌活性。
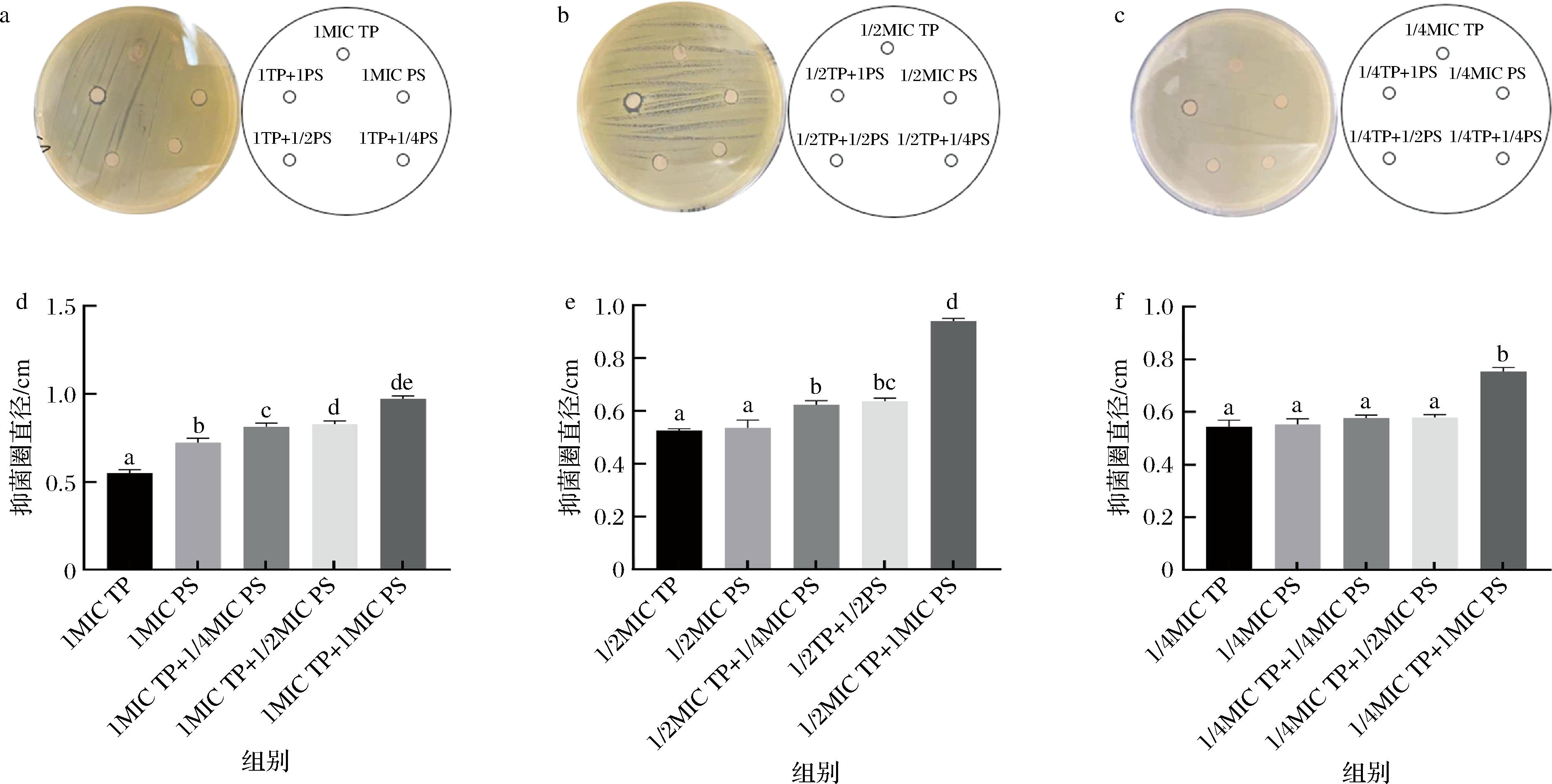
a-1 MIC琼脂平板图像;b-1/2 MIC琼脂平板图像;c-1/4 MIC琼脂平板图像;d-1 MIC抑菌直径;e-1/2 MIC抑菌直径;f-1/4 MIC抑菌直径
图5 S.aureus对PS和TP单独或联合使用时的敏感性
Fig.5 Sensitivity of S.aureus towards PS and TP alone or together
实验结果表明,2个药物单独处理时,山梨酸钾对S.aureus有更加显著的抑制效果。2个药物联用,不同浓度的药物组合均表现出高于药物单独作用时的抑菌活性。
2.5.2 S.aureus对山梨酸钾和小檗碱单独或联用的敏感性
山梨酸钾和小檗碱联用的药敏实验结果如图6所示,添加药物均对S.aureus有抑制作用。在1 MIC和1/2 MIC山梨酸钾浓度,使用单一药物处理S.aureus,山梨酸钾组和小檗碱组没有显著差异,抑菌圈直径随药物浓度增加而增加。2种药物联用,低浓度的小檗碱和山梨酸钾联用和药物单独使用无显著差异,抑菌圈直径随小檗碱浓度增加而增加。在1/4 MIC浓度,单独使用小檗碱对S.aureus的抑制作用优于山梨酸钾单独使用。药物联用实验结果和1 MIC和1/2 MIC浓度相似,低浓度的山梨酸钾和小檗碱联用与2种药物单独使用并没有表现出显著的差异,当小檗碱浓度增加时,抑菌圈直径也随之增加。
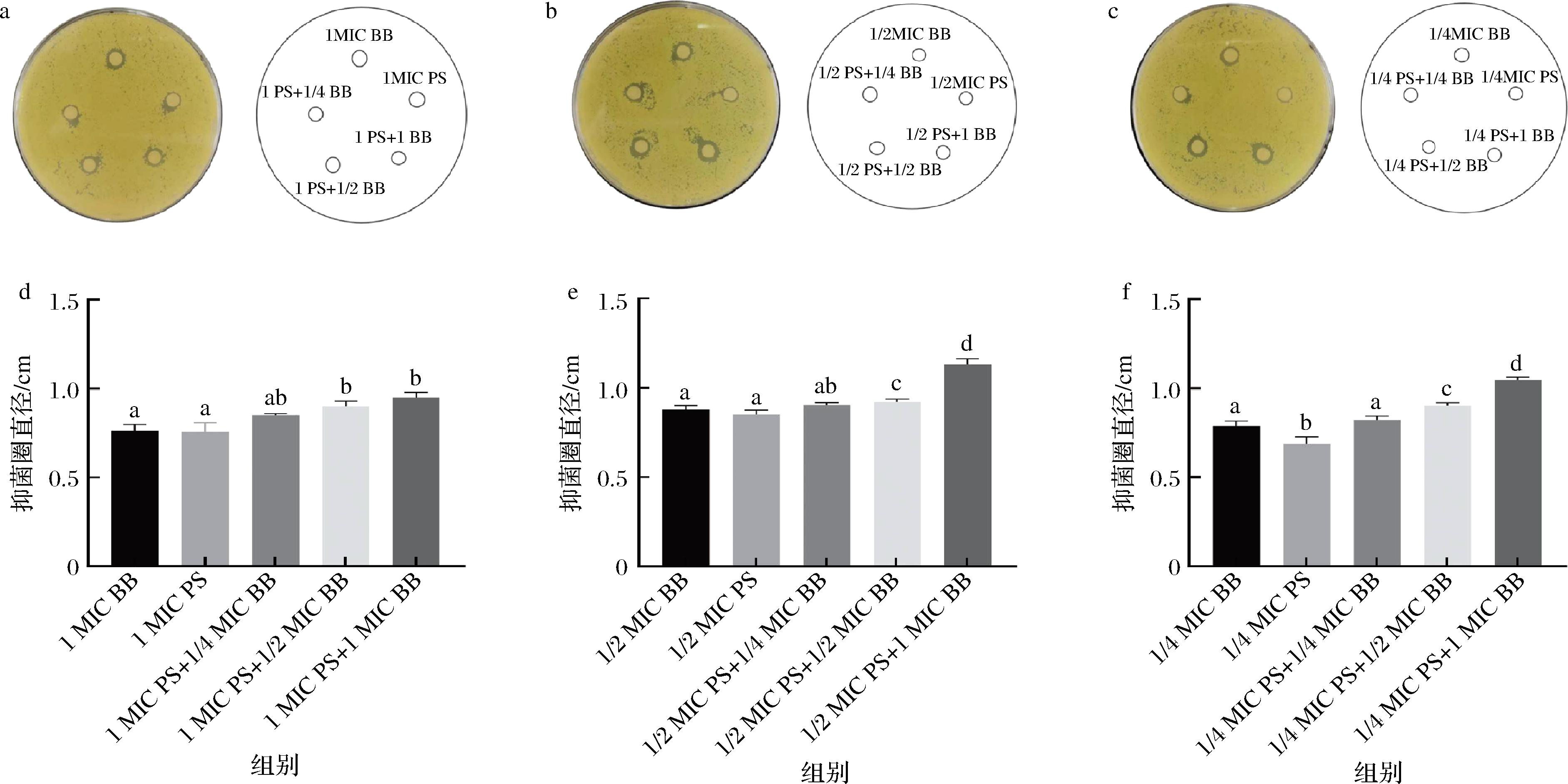
a-1 MIC琼脂平板图像;b-1/2 MIC琼脂平板图像;c-1/4 MIC琼脂平板图像;d-1 MIC抑菌直径;e-1/2 MIC抑菌直径;f-1/4 MIC抑菌直径
图6 S.aureus对PS和BB的敏感性
Fig.6 Sensitivity of S.aureus against PS and BB
实验结果表明,2个药物单独处理时,小檗碱对S.aureus有更加显著的抑制效果。2个药物联用时,不同浓度的药物组合均表现出高于药物单独作用时的抑菌活性,且对S.aureus的抑菌圈直径随小檗碱浓度增加而增加。
综上所述,3种浓度下,添加药物对S.aureus都产生了一定的抑制作用。在同浓度,3种药物在单独使用时,对S.aureus的抑制并没有表现出较大的差异。相较于药物单独使用,山梨酸钾和小檗碱或茶多酚联合作用,都对S.aureus表现出更高的抑制活性,并且有明显的浓度依赖性。对比山梨酸钾和小檗碱联用与山梨酸钾和茶多酚联用效果发现,在同浓度下,山梨酸钾和小檗碱联用对S.aureus抑制效果明显优于山梨酸钾和茶多酚联用,与棋盘微量法和生长曲线结果一致。结合山梨酸钾与小檗碱或茶多酚的生长曲线图以及药敏实验,说明小檗碱所担任的角色强于山梨酸钾。
3 讨论
S.aureus是常见的食源性致病菌,严重威胁到食品安全和人体健康。传统的杀菌方法是利用抗生素,但是 S.aureus已经显示出对多种抗生素具有耐药性,致使单一的抗生素无法达到预期的效果。天然化合物可促进药物的渗透,增强抑菌效果,减缓S.aureus对药物的耐药性[10]。因此,将抗菌药物和天然化合物联用可以有效减少药物使用浓度。在抑制S.aureus的研究中,天然化合物和诺氟沙星的联用有效降低了抗生素的使用浓度[25],且山梨酸钾和天然化合物的联用显著提高了其对S.aureus的抑制效果[26]。本研究将山梨酸钾与天然化合物茶多酚或小檗碱联用,通过比较药物联用前后S.aureus生长趋势以药物敏感性变化,发现药物联用后显著增强对S.aureus抑制作用,且与药物浓度成正比例关系。对比山梨酸钾和小檗碱联用以及山梨酸钾和茶多酚联用,发现山梨酸钾和小檗碱联用对S.aureus的抑制效果更好且更加稳定,说明小檗碱发挥了更大的作用。而在ZHOU等[27]的综述中也提到了小檗碱能够增强传统抗生素的有效性,是一种良好的抗生素佐剂,能够增强抗生素的抑菌活性以及防止细菌黏附。在棋盘实验中,本研究发现山梨酸钾和小檗碱联用为累加作用(FICI=0.563)。小檗碱和不同类型的抗生素之间的作用方式可能会导致其联用时表现出协同作用[28]或累加作用[29]。小檗碱可通过改变抗生素外排[30]、破坏生物膜形成[31]以及调节宿主免疫反应等机制抑制细菌活性。本研究通过分子对接发现小檗碱和ClfA结合有最优构象,结合能为-9.00 kcal/mol。ClfA可促进S.aureus的定植和扩散[32],小檗碱通过直接结合ClfA蛋白的活性位点,抑制毒力因子ClfA的活性,影响S.aureus在生物或非生物表面的定植能力。山梨酸钾联合天然化合物抑菌的具体分子机制,以及小檗碱抑制S.aureus活性及其生物膜形成的分子机制有待进一步研究。
4 结论
本研究旨在探究山梨酸钾与天然化合物联用对S.aureus的抑制效果。首先,测得山梨酸钾、茶多酚以及小檗碱对S.aureus的MIC值分别为2、0.125和2 mg/mL。其次,通过计算分析得知,山梨酸钾和茶多酚联合作用于S.aureus时表现为协同作用,与小檗碱联用时表现为累加作用。在1/4 MIC浓度,山梨酸钾与2种天然化合物联用时对S.aureus生长的抑制效果均高于药物单独作用的抑制效果,且山梨酸钾与茶多酚联用时的抑菌作用低于与小檗碱的联用。在1/2 MIC浓度,山梨酸钾与茶多酚或小檗碱联合作用的抑菌活性高于1/4 MIC浓度的药物处理,呈现剂量依赖性。S.aureus对山梨酸钾与茶多酚或小檗碱联用的敏感性高于药物单独处理组。小檗碱对S.aureus生长的完全抑制,与毒力因子ClfA的表达相关。鉴于本研究中小檗碱的重要作用,本课题组拟深入研究小檗碱与山梨酸钾联合抑菌的分子机制。本研究为食品工业中S.aureus污染防控提供了新策略,在一定程度上缓解了S.aureus耐药性难题。
[1] 王明珠, 田子豪, 谭中美, 等.细菌素协同物理技术对食源性致病菌和腐败微生物防控的研究进展[J].食品工业科技, 2025,46(3):425-435.WANG M Z, TIAN Z H, TAN Z M, et al.Research progress of bacteriocin combined with physical technology in the prevention and control of foodborne pathogens and spoilage microorganisms[J].Science and Technology of Food Industry, 2025,46(3):425-435.
[2] SALLAM K I, RASLAN M T, SABALA R F, et al.Antimicrobial effect of garlic against foodborne pathogens in ground mutton[J].Food Microbiology, 2024, 120:104462.
[3] 王冰, 李阳, 黄安琪, 等.噬菌体防治食品中食源性致病菌的研究进展[J].食品研究与开发, 2024, 45(15):204-209.WANG B, LI Y, HUANG A Q, et al.Research progress on the use of bacteriophages in controlling foodborne pathogens in foods[J].Food Research and Development, 2024, 45(15):204-209.
[4] 纪帅奇, 乌日娜, 张淘崴, 等.芽孢杆菌脂肽对金黄色葡萄球菌的抑制机理[J].中国食品学报, 2024, 24(8):197-205.JI S Q, WU R N, ZHANG T W, et al.The antimicrobial mechanism of Bacillus lipopeptide against Staphylococcus aureus[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(8):197-205.
[5] GAJEWSKA J, ZAKRZEWSKI A J, CHAJ![]() CKA-WIERZCHOWSKA W, et al.Impact of the food-related stress conditions on the expression of enterotoxin genes among Staphylococcus aureus[J].Pathogens, 2023, 12(7):954.
CKA-WIERZCHOWSKA W, et al.Impact of the food-related stress conditions on the expression of enterotoxin genes among Staphylococcus aureus[J].Pathogens, 2023, 12(7):954.
[6] MARSHALL B M, LEVY S B.Food animals and antimicrobials:Impacts on human health[J].Clinical Microbiology Reviews, 2011, 24(4):718-733.
[7] JUSTINO DE ARA JO A C, FREITAS P R, RODRIGUES DOS SANTOS BARBOSA C, et al.GC-MS-FID characterization and antibacterial activity of the Mikania cordifolia essential oil and limonene against MDR strains[J].Food and Chemical Toxicology, 2020, 136:111023.
JO A C, FREITAS P R, RODRIGUES DOS SANTOS BARBOSA C, et al.GC-MS-FID characterization and antibacterial activity of the Mikania cordifolia essential oil and limonene against MDR strains[J].Food and Chemical Toxicology, 2020, 136:111023.
[8] LIN Y L, WANG R F, LI X Q, et al.Antibacterial mechanism of kojic acid and tea polyphenols against Escherichia coli O157:H7 through transcriptomic analysis[J].Food Science and Human Wellness, 2024, 13(2):736-747.
[9] SHI C, ZHANG X W, ZHAO X C, et al.Synergistic interactions of nisin in combination with cinnamaldehyde against Staphylococcus aureus in pasteurized milk[J].Food Control, 2017, 71:10-16.
[10] HUANG Y L, HUANG C H, HUANG Y C, et al.Anti-biofilm activities and antibiotic synergy of naturally occurring compounds against drug-resistant rapidly growing mycobacteria[J].Microbiology Spectrum, 2024, 12(8):e0019924.
[11] LORCA G, BALLESTERO D, LANGA E, et al.Enhancing antibiotic efficacy with natural compounds:Synergistic activity of tannic acid and nerol with commercial antibiotics against pathogenic bacteria[J].Plants, 2024, 13(19):2717.
[12]  LVAREZ-MART
LVAREZ-MART NEZ F J, BARRAJ
NEZ F J, BARRAJ N-CATAL
N-CATAL N E, MICOL V.Tackling antibiotic resistance with compounds of natural origin:A comprehensive review[J].Biomedicines, 2020, 8(10):405.
N E, MICOL V.Tackling antibiotic resistance with compounds of natural origin:A comprehensive review[J].Biomedicines, 2020, 8(10):405.
[13] 侯辉. 浅谈山梨酸钾在食品中的应用[J].品牌与标准化, 2018(3):58-60.HOU H.Discussion on the application of potassium sorbate in food[J].Brand &Standardization, 2018(3):58-60.
[14] TANGO C N, KHAN I, PARK Y S, et al.Growth of Staphylococcus aureus in cooked ready-to-eat ground fish as affected by inoculum size and potassium sorbate as food preservative[J].LWT- Food Science and Technology, 2016, 71:400-408.
[15] LIU Y L, LIU Q Y, LI X Y, et al.Effects of postharvest chitosan and potassium sorbate coating on the storage quality and fungal community of fresh jujube[J].Postharvest Biology and Technology, 2023, 205:112503.
[16] PEREIRA BATISTA A F, COELHO TREVISAN D A, RODRIGUES DOS SANTOS A, et al.Synergistic inhibition of Salmonella Typhimurium and Staphylococcus aureus in apple jam by cinnamaldehyde and potassium sorbate[J].Food Science and Technology International, 2024, 30(4):384-394.
[17] AL-KURAIEEF A N, ALSHAWI A H, ALSUHAIBANI A M A.Effect of the combined action of potassium sorbate and irradiation on the quality-maintenance of strawberries[J].Journal of Food Science and Technology, 2019, 56(7):3374-3379.
[18] 李冰心, 张驰, 侯琳琳.茶多酚的保鲜机理及其在食品中的应用研究进展[J].现代食品, 2024, 30(13):60-63.LI B X, ZHANG C, HOU L L.Research progress on the preservation mechanism of tea polyphenols and their application in food[J].Modern Food, 2024, 30(13):60-63.
[19] 钟慈平, 骞宇, 舒畅, 等.小檗碱及其衍生物抑菌作用研究进展[J].食品科学, 2013, 34(7):321-325.ZHONG C P, QIAN Y, SHU C, et al.Research progress in antimicrobial effects of berberine and its derivatives[J].Food Science, 2013, 34(7):321-325.
[20] FOUAD A, SIMNER P J, NICOLAU D P, et al.Comparison of BD Phoenix and disk diffusion to broth microdilution for determining cefepime susceptibility among carbapenem-resistant Enterobacterales[J].Journal of Clinical Microbiology, 2024, 62(6):e0152023.
[21] PIRIM F, ATIK A C, YÜKSEL M B, et al.Multichannel multimodal piezoelectric middle ear implant concept based on MEMS technology for next-generation fully implantable cochlear implant applications[J].Biosensors and Bioelectronics:X, 2024, 18:100471.
[22] AKSOY C S, AVCI F G, UGUREL O M, et al.Potentiating the activity of berberine for Staphylococcus aureus in a combinatorial treatment with thymol[J].Microbial Pathogenesis, 2020, 149:104542.
[23] PÉRICHON B, COURVALIN P.Synergism between beta-lactams and glycopeptides against VanA-type methicillin-resistant Staphylococcus aureus and heterologous expression of the vanA operon[J].Antimicrobial Agents and Chemotherapy, 2006, 50(11):3622-3630.
[24] PALLADINI G, GARBARINO C, LUPPI A, et al.Comparison between broth microdilution and agar disk diffusion methods for antimicrobial susceptibility testing of bovine mastitis pathogens[J].Journal of Microbiological Methods, 2023, 212:106796.
[25] GUPTA P, PATEL D K, GUPTA V K, et al.Citral, a monoterpenoid aldehyde interacts synergistically with norfloxacin against methicillin resistant Staphylococcus aureus[J].Phytomedicine, 2017, 34:85-96.
[26] TREVISAN D A C, BATISTA A F P, CAMPANERUT-S P A Z, et al.Synergistic activity of Stryphnodendron adstringens and potassium sorbate against foodborne bacteria[J].Archives of Microbiology, 2022, 204(6):292.
P A Z, et al.Synergistic activity of Stryphnodendron adstringens and potassium sorbate against foodborne bacteria[J].Archives of Microbiology, 2022, 204(6):292.
[27] ZHOU H J, WANG W L, CAI L, et al.Potentiation and mechanism of berberine as an antibiotic adjuvant against multidrug-resistant bacteria[J].Infection and Drug Resistance, 2023, 16:7313-7326.
[28] 宋晨. 中药单体联合抗菌药物对犊牛源大肠杆菌生物被膜形成的影响及其机制探究[D].呼和浩特:内蒙古农业大学, 2023.SONG C.Effects of traditional chinese medicine monomer combined with antibacterial drugs on the biofilm formation of calf-derived escherichia coli and its mechanism[D].Hohhot:Inner Mongolia Agricultural University, 2023.
[29] 陈惠. 小檗碱和甘草查尔酮A对A型产气荚膜梭菌的侧枝敏感和交叉耐药性评价[D].武汉:华中农业大学, 2022.CHEN H.Evaluation of collateral susceptibility andi cross-resistance of berberine and licochalcone A against clostridium perfringens type A[D].Wuhan:Huazhong Agricultural University, 2022.
[30] SEO Y, KIM M, KIM T J.Enhanced efficacy of ciprofloxacin and tobramycin against Staphylococcus aureus when combined with Corydalis tuber and berberine through efflux pump inhibition[J].Antibiotics, 2024, 13(5):469.
[31] WANG X Q, LIU S W, ZHAO C, et al.Inhibition of berberine on methicillin-resistant Staphylococcus aureus biofilm formation[J].Revista Brasileira de Farmacognosia, 2022, 32(3):455-459.
[32] BRAHMA U, SINGOTHU S, SURESH A, et al.MMV 1804559 is a potential antistaphylococcal and antibiofilm agent targeting the clfA gene of Staphylococcus aureus[J].Journal of Applied Microbiology, 2024, 135(11):276.