牛奶蛋白过敏(cow’s milk protein allergy,CMPA)是最常见的食物过敏之一,通常发生在婴儿和少数成人身上。这种免疫反应可能引起特应性皮炎、湿疹、哮喘、呕吐和反复腹泻等症状[1]。牛乳中含有多种可以引发过敏反应的蛋白质,其中,β-乳球蛋白(β-lactoglobulin,β-LG)是牛乳中最主要的过敏原之一[2]。流行病学调查显示,约82%的牛奶过敏人群对β-LG过敏,这极大地限制了牛乳的适宜人群和应用范围[3]。
β-LG过敏是一种涉及免疫球蛋白E(immunoglobulin E,IgE)依赖性抗体反应的I型超敏反应[4]。β-LG进入机体时,促进天然T淋巴细胞分化成辅助T细胞2(T helper 2 cell,Th2),并产生Th2型细胞因子,进而诱导B淋巴细胞产生过敏原特异性IgE。特异性IgE与血液中的嗜碱性粒细胞或组织中的肥大细胞表面的高亲和力IgE受体(high affinity IgE receptor,FcεRI)交联,激活细胞脱颗粒,导致胞内的β-氨基己糖激酶(β-hexosaminidase, β-HEX)、组胺、白细胞介素和抗肿瘤坏死因子等内源性颗粒大量释放[5]。这些生物活性介质及炎症因子作用于机体的各个效应组织和器官,从而诱发皮肤、消化道以及呼吸道等部位的过敏症状。因此,嗜碱性粒细胞和肥大细胞释放生物活性介质和炎症因子是人体对抗原耐受性被打破的关键信号,其脱颗粒程度能够反映过敏反应的严重程度[6]。
近年来,均质、超高压、热处理和酶水解等方法被广泛用于处理牛乳过敏蛋白以降低其致敏性,但这些处理方式存在一定的缺陷,如产生新的过敏表位、影响营养价值和风味等[7]。微生物发酵是一种降低牛乳蛋白抗原性的新方法,可以突破其他方法的局限性。乳酸菌(lactic acid bacteria,LAB)是发酵食品中最常用的益生菌,具有由细胞包膜蛋白酶、肽转运系统和细胞内肽酶组成的蛋白水解系统[8]。在发酵过程中,LAB产生的蛋白酶可将牛乳蛋白水解成多肽,破坏原有的过敏表位,提高牛乳蛋白的消化率[9]。目前,一些研究证实从世界各地分离的LAB具有降低牛乳蛋白特别是β-LG致敏性的功能。KAZEMI等[10]研究发现,从伊朗传统乳制品中分离出的乳酸乳球菌(Lactococcus lactis)BMC12C和BMC19H具有很高的蛋白水解活性,显著降低了β-LG的致敏性。HUANG等[11]证实了鼠李糖乳杆菌(Lactobacillus rhamnosus)(CICC No.22175)能够有效水解酪蛋白和β-LG,其水解产物的抗原性和潜在致敏性明显降低。乳酸菌蛋白水解系统的存在还有助于提高牛乳的营养价值,塑造感官特性。ZHANG等[12]研究发现,保加利亚乳杆菌(Lactobacillus delbrueckii subsp. bulgaricus)DLPU F-36水解β-LG后,产生了13种具有健康益处的氨基酸,营养价值得到提高。
之前的研究已经证明从云南特色发酵蔬菜中分离得到的戊糖片球菌(Pediococcus pentosaceus)C1001、副干酪乳杆菌(Lacticaseibacillus paracasei)E1601-2能够较好地水解β-LG且具有益生菌潜力[13],但其水解产物对人体的致敏作用机制尚未得到研究。人外周血嗜碱性白血病细胞(human peripheral blood basophilic leukemia cells,KU812)是唯一的人嗜碱性粒细胞系,其表面的FcεRI与IgE结合具有高度特异性,为研究IgE/FcεRI相互作用提供了独特的模型[14]。因此,本研究建立KU812细胞致敏模型,通过测定释放的生物活性介质和炎症因子量等指标对2株菌株进行评价,用于评估LAB发酵对β-LG致敏性的影响,旨在为乳酸菌的利用和抗过敏活性的研究提供依据。
1 材料与方法
1.1 材料与试剂
菌株P.pentosaceus C1001、L.paracasei E1601-2由云南省高原特色食品预制化重点实验室提供;人外周血嗜碱性白血病细胞(KU812细胞),赛百慷(上海)生物技术股份有限公司。
1640完全培养基,大连美仑生物技术有限公司;胎牛血清,上海逍鹏生物科技有限公司;青-链霉素(双抗),北京兰杰柯科技有限公司;CCK-8试剂,亚科因生物技术有限公司;β-HEX、组胺、IL-4、TNF-α、TNF-γ、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,江苏酶免实业有限公司;IL-6、人商业化ELISA试剂盒,杭州联科生物技术有限公司。其余试剂均为国产分析纯。牛奶过敏患者血清,美国Plasma Lab International公司。过敏患者血清使用前于-80 ℃保存。牛乳过敏患者信息如表1所示。
表1 牛乳过敏患者信息
Table 1 The information of milk allergic patients
血清编号年龄性别临床症状PL 2771367女过敏性鼻炎、食物过敏
1.2 仪器与设备
ME203/02电子天平,德国梅特勒-托利多有限公司;Scientz-10N真空冷冻干燥机,宁波新芝生物科技股份有限公司;Multifuge Xl R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;CCL-170B-8 CO2培养箱、AC2-6S1 Alrstream A2生物安全柜,新加坡ESCO公司;EPOCG2酶标仪,美国BioTek公司;Guava easyCyte 6-2L流式细胞仪,美国Millipore公司;Bio-Rad凝胶成像仪,美国Bio-Rad有限公司。
1.3 实验方法
1.3.1 菌株培养
菌株P.pentosaceus C1001、L.paracasei E1601-2,以2%的接种量接种于MRS液体培养基中,37 ℃恒温培养12 h,活化3次备用。
1.3.2 样品制备
1.3.2.1 β-LG水解产物的制备
根据JIANG等[15]的方法配制不同浓度的β-LG水解产物。将P.pentosaceus C1001、L.paracasei E1601-2分别活化后,用无菌水洗涤2次后重悬,于柠檬酸钠-乳粉-琼脂平板上涂布。在指数生长期时,将菌株悬浮于含5 mmol/L CaCl2的100 mmol/L Na2HPO4缓冲液(pH=7)中,调节OD600nm=10.0,于37 ℃静置30 min形成氨基酸饥饿状态,然后将2株乳酸菌按1∶1(体积比)的比例混合,用于联合发酵。按2∶1(体积比)的比例分别将单菌和联合菌株接种于3 mg/mL的β-LG中,于37 ℃恒温摇床中培养24 h。培养结束后,样品在4 ℃下以8 000×g离心10 min,收集上清液并进行冻干处理。称量冻干样品,溶于无菌生理盐水(0.9%,体积分数)配制成10、50、100 μg/mL的β-LG水解产物。
1.3.2.2 β-LG消化产物的制备
根据BRODKORB等[16]的方法配制不同浓度的β-LG消化产物。将联合发酵的β-LG(1 mg/mL)用1 mol/L的HCl溶液调节pH值至3.0,然后加入胃蛋白酶(800 U/mg,3 mg/mL)消化2 h。反应结束后,用1 mol/L的NaOH溶液调节pH值至7.0,终止胃蛋白酶反应。取1 mL胃消化产物,加入等量的模拟肠液(胰蛋白酶100 U/mL),充分混合均匀后,于37 ℃恒温培养2 h。以上消化阶段所取样品均在4 ℃下以8 000×g离心10 min,收集上清液并进行冻干处理。称量冻干样品,溶于无菌生理盐水(0.9%,体积分数)配制成10、50、100 μg/mL的β-LG消化产物。不同β-LG分组如表2所示。
表2 不同β-LG分组处理方式
Table 2 Different β-LG grouping treatments

组别菌株水解时间/h胃消化时间/h肠消化时间/hβ-LG—β-LGh(C1001)P.pentosaceus C1001β-LGh(E1601-2)L.paracasei E1601-2β-LGh(E+C)P.pentosaceus C1001+L.paracasei E1601-2β-LGh(E+C)胃消化P.pentosaceus C1001+L.paracasei E1601-2β-LGh(E+C)胃-肠消化P.pentosaceus C1001+L.paracasei E1601-224————————2—22
注:—表示相关组别未进行该操作。
1.3.3 SDS-PAGE
样品在室温下溶解,稀释2倍,每条凝胶泳道上样20 μL后,加入5 μL的5×缓冲液使蛋白质变性。凝胶在垂直平板电泳槽上运行。将制备好的样品加入到120 g/L聚丙烯酰胺凝胶上,通过SDS-PAGE迁移分析蛋白质水解情况。分别在堆积凝胶上以80 V和分离凝胶上以100 V运行后,通过用考马斯亮蓝R-250[1 g/L R-250,25%(体积分数)甲醇,10%(体积分数)冰醋酸]对凝胶染色,然后在由甲醇(20%,体积分数)、乙酸(10%,体积分数)和蒸馏水制成的溶液中进行脱色。使用凝胶成像仪扫描凝胶,通过Image Lab 5.0软件进行图像采集和分析,并通过ImageJ.JS(https://cnij.im joy.io)软件分析条带强度。
1.3.4 KU812细胞实验
1.3.4.1 KU812细胞的培养
从液氮中解冻KU812细胞,转移到培养瓶中,并加入含10%(体积分数)胎牛血清、1%(体积分数)双抗的1640完全培养基,置于37 ℃、5%(体积分数)的CO2的饱和湿度环境下培养。每2~3 d更换1次培养基,3次传代后进行后续实验。
1.3.4.2 β-LG水解及消化产物对KU812细胞增殖的影响
收集处于对数生长中期的KU812细胞,制成单细胞悬液,以1×104个/mL的细胞密度接种于96孔细胞培养板中,分别设置空白组、对照组及实验组。实验组和对照组每孔加入100 μL的细胞悬液,空白组则加入100 μL 1640培养基。然后向实验组每孔加入100 μL不同浓度的待测样品,空白组加入100 μL PBS,于37 ℃、5%(体积分数)CO2的细胞培养箱中培养24 h。参照CCK-8检测试剂盒说明书,每孔加10 μL CCK-8溶液,在培养箱中将平板孵育2 h,使用酶标仪测量450 nm处的吸光度值。β-LG水解及消化产物对KU812细胞毒性的评价用细胞存活率(%)表示,细胞存活率按照公式(1)计算。
细胞存活率![]()
(1)
式中:A0为空白孔的吸光度;A1为实验孔的吸光度;A2为对照孔的吸光度。
1.3.4.3 KU812细胞脱颗粒模型的建立
根据MENG等[17]的方法建立KU812细胞脱颗粒模型。将KU812细胞以2×106个/mL的密度接种于12孔细胞培养板中,实验组每孔加入50 μL过敏患者血清,刺激细胞24 h,然后加入50 μL 1 mg/mL的样品激发细胞4 h。用PBS代替样品处理的细胞为阳性对照,用PBS代替血清和样品处理的细胞为阴性对照。向阳性对照组中加入0.5%(体积分数)TritonX-100裂解30 min后,收集各组溶液至离心管中,1 000 r/min离心5 min,收集上清液进行后续分析。
1.3.4.4 β-HEX含量的测定
利用商业化人ELISA试剂盒测定β-HEX,β-HEX释放率按照公式(2)计算:
β-HEX释放率![]()
(2)
式中:A0为空白组的吸光度;A1为实验组的吸光度;A2为对照组的吸光度。
1.3.4.5 组胺含量的测定
采用商业化人组胺ELISA试剂盒检测细胞激发后释放的组胺含量。从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃。设置标准品孔和样品孔,标准品孔各加不同浓度的标准品50 μL;样品孔先加待测样品10 μL,再加样品稀释液40 μL;空白孔不加。除空白孔外,标准品孔和样品孔中每孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃恒温箱温育60 min。弃去液体后,向每孔加满洗涤液,静置1 min,甩去洗涤液并拍干,如此重复洗板5次。每孔加入过氧化物酶和3,3′,5,5′-四甲基联苯胺各50 μL,37 ℃避光孵育15 min。最后,每孔加入终止液50 μL,在450 nm波长处测定各孔的OD值,以标准品的浓度为横坐标,对应的OD值为纵坐标绘制标准曲线,计算组胺的含量。
1.3.4.6 IL-4、TNF-α和TNF-γ含量的测定
采用商业化人IL-4、TNF-α和TNF-γ ELISA试剂盒检测细胞激发后释放的IL-4、TNF-α和TNF-γ含量。方法同1.3.4.5节。
1.3.4.7 IL-6含量的测定
采用人IL-6的ELISA检测试剂盒检测细胞激发后释放的IL-6含量。加入300 μL的1×洗液静置浸泡30 s。倒掉洗液之后,在吸水纸上将微孔板拍干。标准品孔加入100 μL,2倍倍比稀释的标准品,样本孔加入100 μL细胞培养上清液,并向每孔加入50 μL稀释的检测抗体。使用封板膜封板,室温孵育2 h。弃掉液体,每孔加入300 μL洗液洗板,洗涤6次并拍干。每孔加入100 μL稀释的辣根过氧化物酶标记的链霉亲和素后,使用新的封板膜封板,室温孵育45 min。弃掉液体,每孔加入300 μL洗液洗板,洗涤6次并拍干。每孔加入100 μL显色底物,室温避光孵育5~30 min。最后,每孔加入100 μL终止液,使用酶标仪测定其在450 nm下的OD值,以标准品的浓度为横坐标,对应的OD值为纵坐标绘制标准曲线,计算IL-6含量。
1.4 数据统计
使用SPSS 20软件进行方差分析,如有显著差异(P<0.05),进行最小显著差异多重比较。实验结果以“平均值±标准差”表示。利用Origin 2021软件绘制图表。
2 结果与分析
2.1 SDS-PAGE分析
通过对乳酸菌发酵β-LG的上清液进行SDS-PAGE分析判定蛋白水解程度,结果如图1所示。结果显示,经过乳酸菌水解后的β-LG的条带均明显变浅。经过乳酸菌水解后的β-LG中条带颜色最深的为P.pentosaceus C1001(泳道1),而经L.paracasei E1601-2水解后的β-LG条带颜色较浅(泳道2),这可能与E1601-2具有更完善的蛋白水解系统,并含有CEP编码基因prtP有关[13]。对比2株LAB协同发酵与单菌发酵后的蛋白条带,可以观察到协同发酵后的蛋白条带颜色稍浅于单菌发酵,说明P.pentosaceus C1001与L.paracasei E1601-2协同发酵可以更有效地水解β-LG。

M-Marker;C-β-LG对照;1-P.pentosaceus C1001;2-L.paracasei E1601-2;3-P.pentosaceusC1001+L.paracasei E1601-2。
图1 SDS-PAGE分析乳酸菌对β-LG的水解效果
Fig.1 SDS-PAGE analysis of the hydrolysis of β-LG by lactic acid bacteria
2.2 β-LG及其水解和消化产物对KU812细胞的增殖毒性
如图2所示,β-LG及其水解和消化产物的质量浓度分别为10、50、100 μg/mL,不同质量浓度的β-LG及其水解产物对KU812细胞产生的增殖毒性用细胞存活率(%)表示。当质量浓度分别为10、50、100 μg/mL时,每个实验组的KU812细胞都能够正常生长,细胞存活率均保持在95%以上,且各组之间没有显著性差异(P>0.05),说明各浓度范围的β-LG及其水解和消化产物对KU812细胞无毒性[18]。在质量浓度50 μg/mL下,各实验组的细胞存活率较稳定,为99.11%~106.07%,因此,选取50 μg/mL进行后续实验。
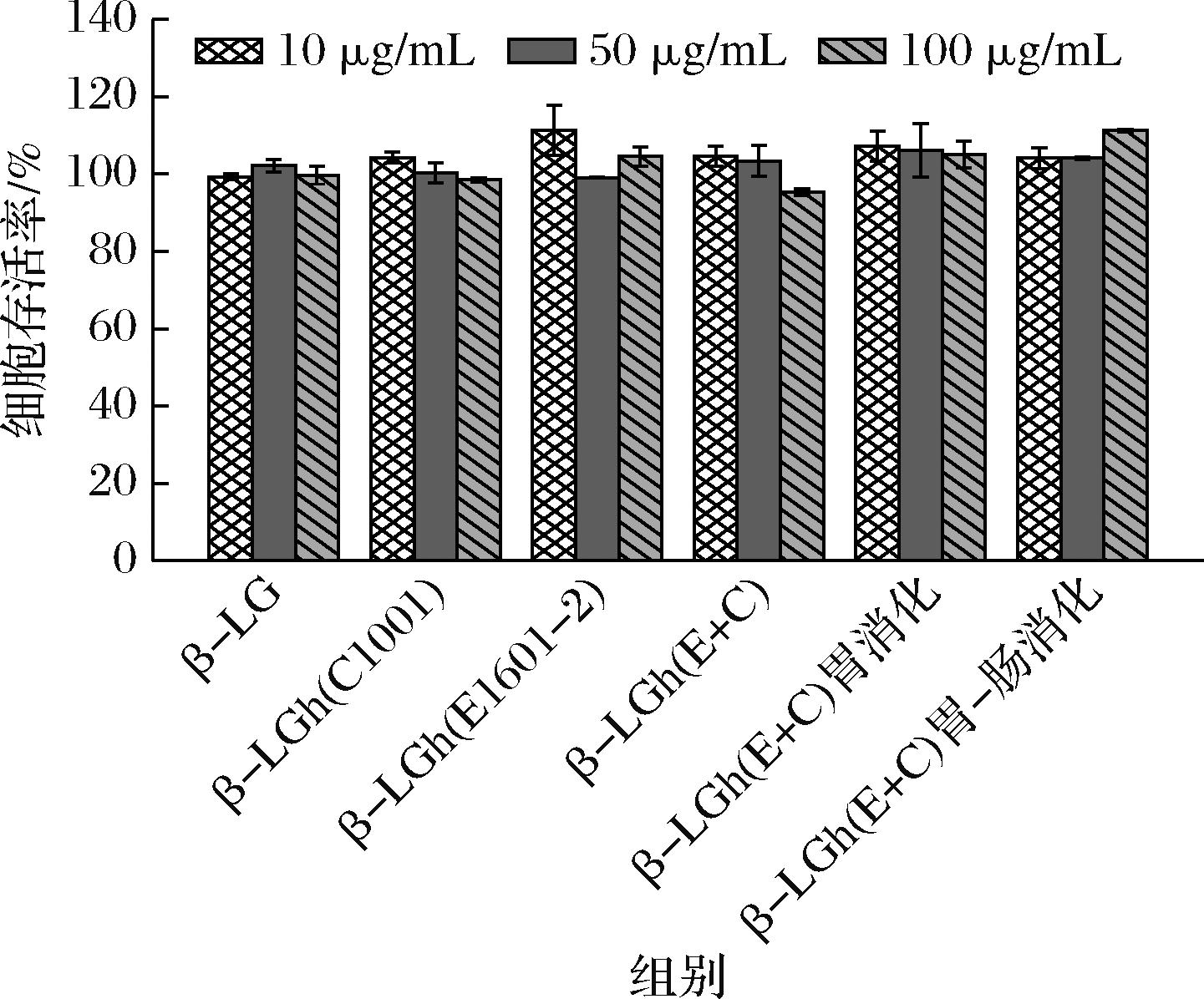
图2 β-LG及其水解产物对KU812细胞增殖的影响
Fig.2 Effect of β-LG and its hydrolyzed products on the proliferation of KU812 cells
2.3 β-LG及其水解和消化产物对KU812细胞脱颗粒释放β-HEX的影响
β-LG及其水解和消化产物诱导KU812细胞脱颗粒释放β-HEX的结果如图3所示。
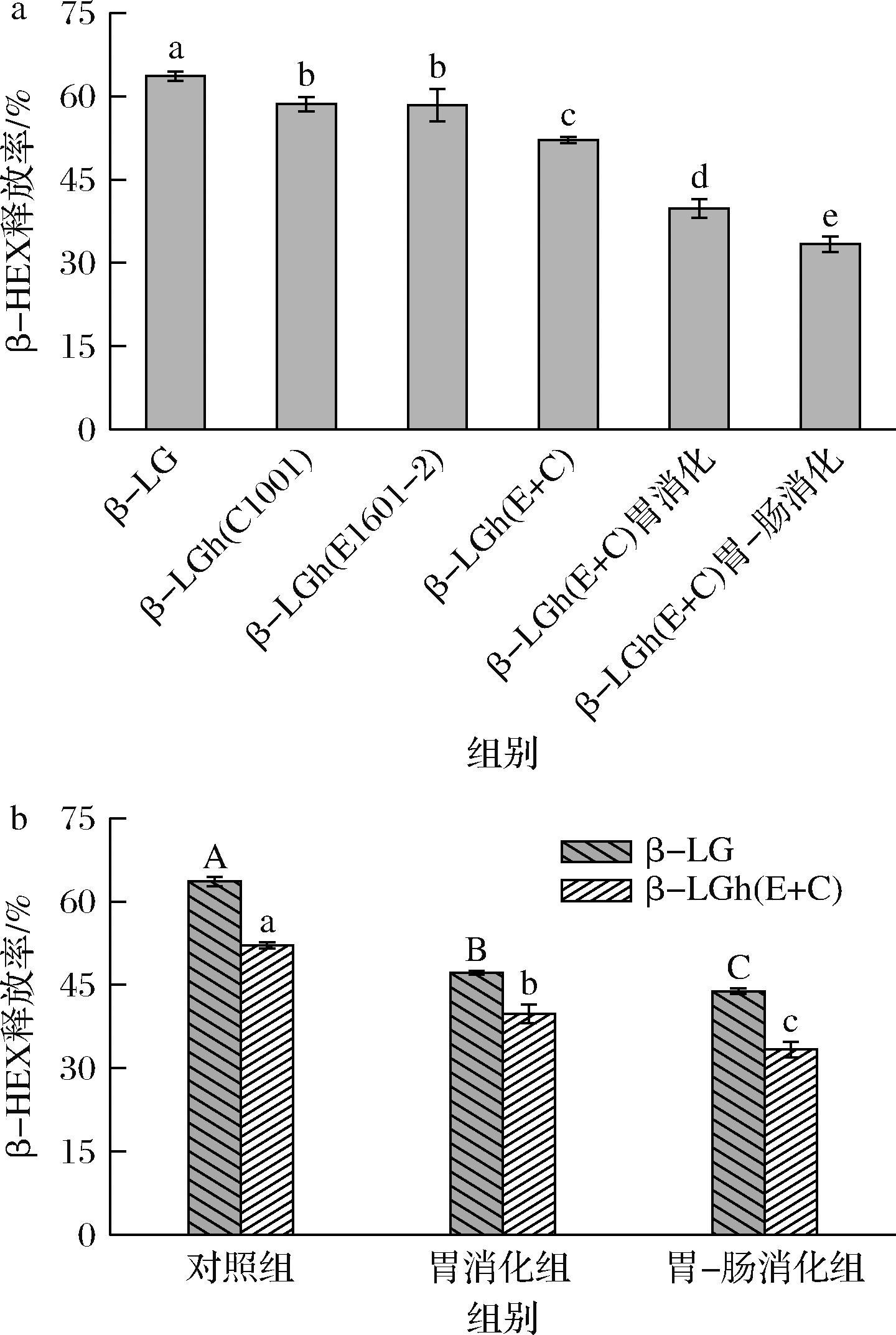
a-β-LG及其水解和消化产物的β-HEX释放率;b-β-LG和β-LGh(E+C)消化产物的β-HEX释放率
图3 β-LG及其水解产物和消化产物对KU812细胞脱颗粒释放β-HEX的影响
Fig.3 Effect of β-LG and its hydrolysis and digestion products on β-HEX release from degranulation of KU812 cells
注:大小写字母不同表示差异显著(P<0.05)(下同)。
当嗜碱性粒细胞被刺激脱颗粒时,它们会释放预先储存的β-HEX和其他新合成的生物活性介质,这些生物活性介质被用作嗜碱性粒细胞脱颗粒的标志性检测物[19]。如图3-a所示,β-LG水解和消化产物诱导KU812细胞产生的β-HEX较β-LG显著降低(P<0.05)。β-LGh(E+C)组的β-HEX释放率为52.12%,显著低于β-LGh(C1001)组和β-LGh(E1601-2)组的β-HEX释放率(P<0.05),说明L.paracasei E1601-2联合P.pentosaceus C1001水解产物的致敏性更低。研究表明,多种乳酸菌的共发酵在降低β-LG的抗原性或致敏性方面显示出协同作用[20],与本研究的结果相似。在先前的研究中,P.pentosaceus C1001可以部分水解致敏性片段V41-K60和L149-I162的过敏表位,产生9个肽;L.paracasei E1601-2 可以部分水解位于致敏性序列V41-K60、Y102-R124和L149-I162的过敏表位,共产生18个肽段[13]。由此推断,上述结果可能是由于2株乳酸菌的蛋白水解酶差异,经联合发酵后,产生更丰富的蛋白水解酶,导致更多的过敏性表位被水解,从而使得β-LG的致敏性降低。如图3-b所示,β-LG及其水解产物在消化过程中对KU812细胞释放β-HEX的刺激性均显著降低(P<0.05)。胃肠道消化结束后,β-LGh(E+C)的β-HEX释放率比β-LG降低了10%左右。相关研究表明,有效改变/破坏牛奶蛋白表位决定簇在降低牛奶蛋白引起的过敏性免疫反应中至关重要[21]。β-LG的致敏表位部分与抗原决定簇重叠,经过胃肠道消化后,重叠的IgE表位因二硫键还原被破坏,降低了β-LG的致敏性[22]。在消化过程中,KU812细胞β-HEX释放量的减少,可能是由于胃肠道消化改变的过敏位点与乳酸菌水解的表位不完全相同,乳酸菌水解后仍暴露的部分IgE表位经消化后被破坏导致的。这些结果表明,LAB水解可以破坏β-LG的部分致敏性表位,并能够降低β-LG在消化过程中的致敏性。
2.4 β-LG及其水解和消化产物对KU812细胞脱颗粒释放组胺的影响
嗜碱性粒细胞的细胞质内含嗜碱性颗粒,这些颗粒内含有组胺等致敏性物质,当细胞脱颗粒后胞膜随即破裂,致敏性物质向外周血和周围组织释放,持续加重IgE介导的I型超敏反应[23]。与β-LG组相比,β-LGh(C1001)组和β-LGh(E1601-2)组KU812细胞的组胺释放量显著降低(P<0.05)(图4-a)。β-LGh(E+C)组的组胺质量浓度降至8.75 ng/mL,但其与β-LGh(C1001)组和β-LGh(E1601-2)组间不存在显著差异(P>0.05)。β-LG水解产物对KU812细胞释放预合成的组胺刺激性减小,可能是β-LG的构象表位和线性表位被破坏所致[24]。过去的研究已确定了与IgE抗体结合的β-LG表位,乳酸菌在发酵过程中通过自身的蛋白水解系统破坏了β-LG的线性表位并产生大量乳酸,乳酸诱导的pH值降低有助于破坏β-LG的构象表位[8]。研究表明,组胺含量与过敏反应的严重程度呈正相关[25]。这表明LAB水解β-LG能够通过调节组胺的释放而降低致敏性,但LAB联合发酵对比单菌发酵的降敏效果还需要进一步验证。如图4-b所示,经过胃消化和胃肠道消化后,β-LG和β-LGh(E+C)均对KU812细胞释放组胺的刺激性显著降低(P<0.05),且胃肠道消化结束后,β-LGh(E+C)诱导产生的组胺质量浓度比β-LG降低了4 ng/mL左右,其致敏性在消化过程中得到极大改善。
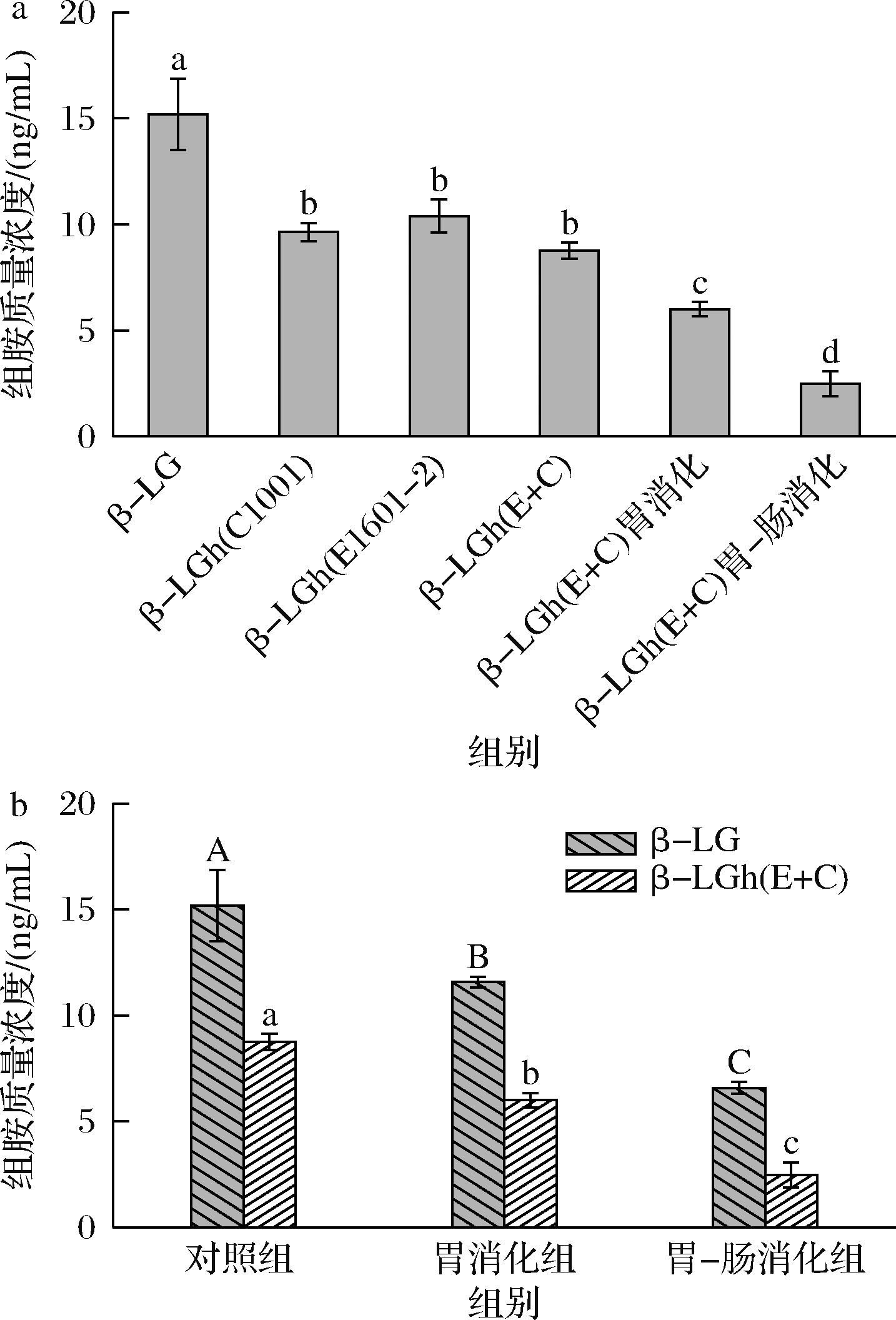
a-β-LG及其水解和消化产物的组胺质量浓度;b-β-LG和β-LGh(E1601-2+C1001)消化产物的组胺质量浓度
图4 β-LG及其水解和消化产物对KU812细胞脱颗粒释放组胺的影响
Fig.4 Effect of β-LG and its hydrolysis and digestion products on histamine release from degranulation of KU812 cells
2.5 β-LG及其水解和消化产物对KU812细胞脱颗粒释放IL-4的影响
IL-4是一种由Th2细胞、肥大细胞和嗜碱性粒细胞产生的免疫调节细胞因子,能够促进B细胞免疫球蛋白类型的转化为IgE[26]。摄入过敏原后,机体IgE/FcεRI交联会刺激嗜碱性粒细胞大量分泌IL-4,从而促进食物过敏的发生[27]。如图5-a所示,经过P.pentosaceus C1001、L.paracasei E1601-2及L.paracasei E1601-2联合P.pentosaceus C1001水解后的β-LG诱导KU812细胞脱颗粒释放IL-4的量显著降低(P<0.05)。如图5-b所示,在胃肠道消化过程中,β-LGh(E+C)的IL-4的释放量始终低于β-LG,且经过胃肠道消化后,β-LGh(E+C)组的IL-4质量浓度比β-LG的降低了17 ng/mL左右。这些结果说明,LAB水解能够通过调节KU812细胞促炎因子的产生来降低β-LG的致敏性。
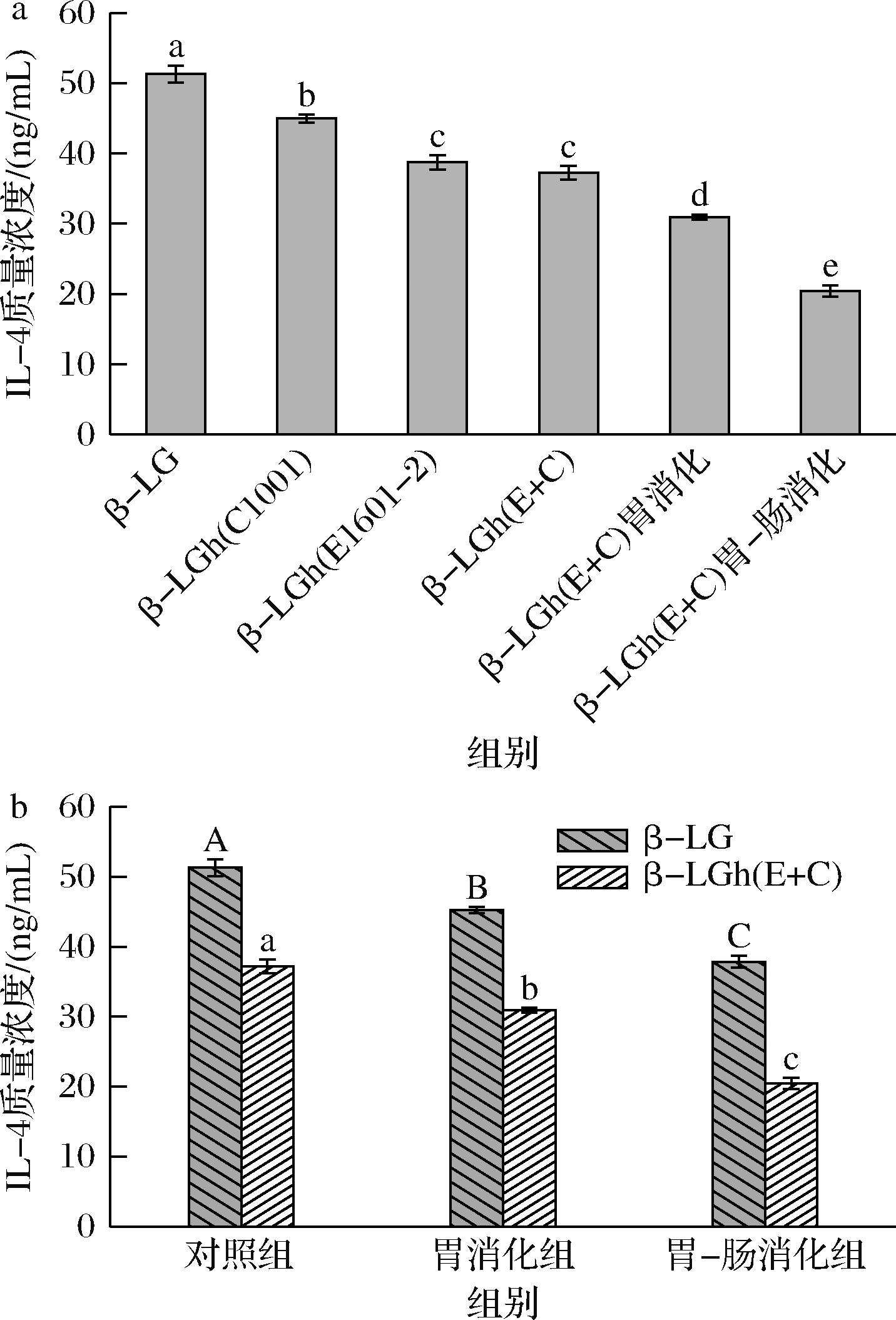
a-β-LG及其水解和消化产物的IL-4质量浓度;b-β-LG和β-LGh(E+C)消化产物的IL-4质量浓度
图5 β-LG及其水解产物和消化产物对KU812细胞脱颗粒释放IL-4的影响
Fig.5 Effect of β-LG and its hydrolysis and digestion products on IL-4 release from degranulation of KU812 cells
2.6 β-LG及其水解和消化产物对KU812细胞脱颗粒释放IL-6的影响
IL-6是一种多效促炎细胞因子,可以在免疫攻击和组织损伤时释放,并刺激多种先天性和适应性免疫反应[28]。此外,IL-6还可以诱导B细胞的增殖和分化,从而分泌更多的特异性IgE,引起嗜碱性粒细胞脱颗粒并诱导过敏反应的发生[29]。如图6-a所示,β-LGh(C1001)组的IL-6质量浓度为4.60 ng/mL,与β-LG组间没有显著性差异(P>0.05),而β-LGh(E1601-2)组和β-LGh(E+C)组的IL-6质量浓度显著低于β-LG组(P<0.05)。相关研究表明,一些乳酸菌仅通过选择性水解某些致敏性表位来降低蛋白质的致敏性[30]。PESCUMA等[31]发现德氏乳杆菌保加利亚亚种(L.delbrueckii subsp.bulgaricus)CRL656通过选择性水解β-LG的V41-K60、Y102-R124和L149-I162三个主要表位降低其致敏性。因此,上述研究结果可能是由于P.pentosaceus C1001不能选择性水解刺激IL-6释放的过敏表位,而L.paracasei E1601-2能够较好的水解相关表位,从而减少对KU812细胞释放IL-6的刺激,降低了β-LG的致敏性。如图6-b所示,IL-6的质量浓度均显著降低(P<0.05),经过胃消化和胃肠道消化后,β-LGh(E+C)诱导KU812细胞释放IL-6的量分别为3.17 ng/mL和2.34 ng/mL,均低于β-LG诱导产生的IL-6,与KU812细胞脱颗粒释放IL-4的结果一致。这些结果表明,LAB水解β-LG的降敏潜力在消化过程中得到充分发挥。
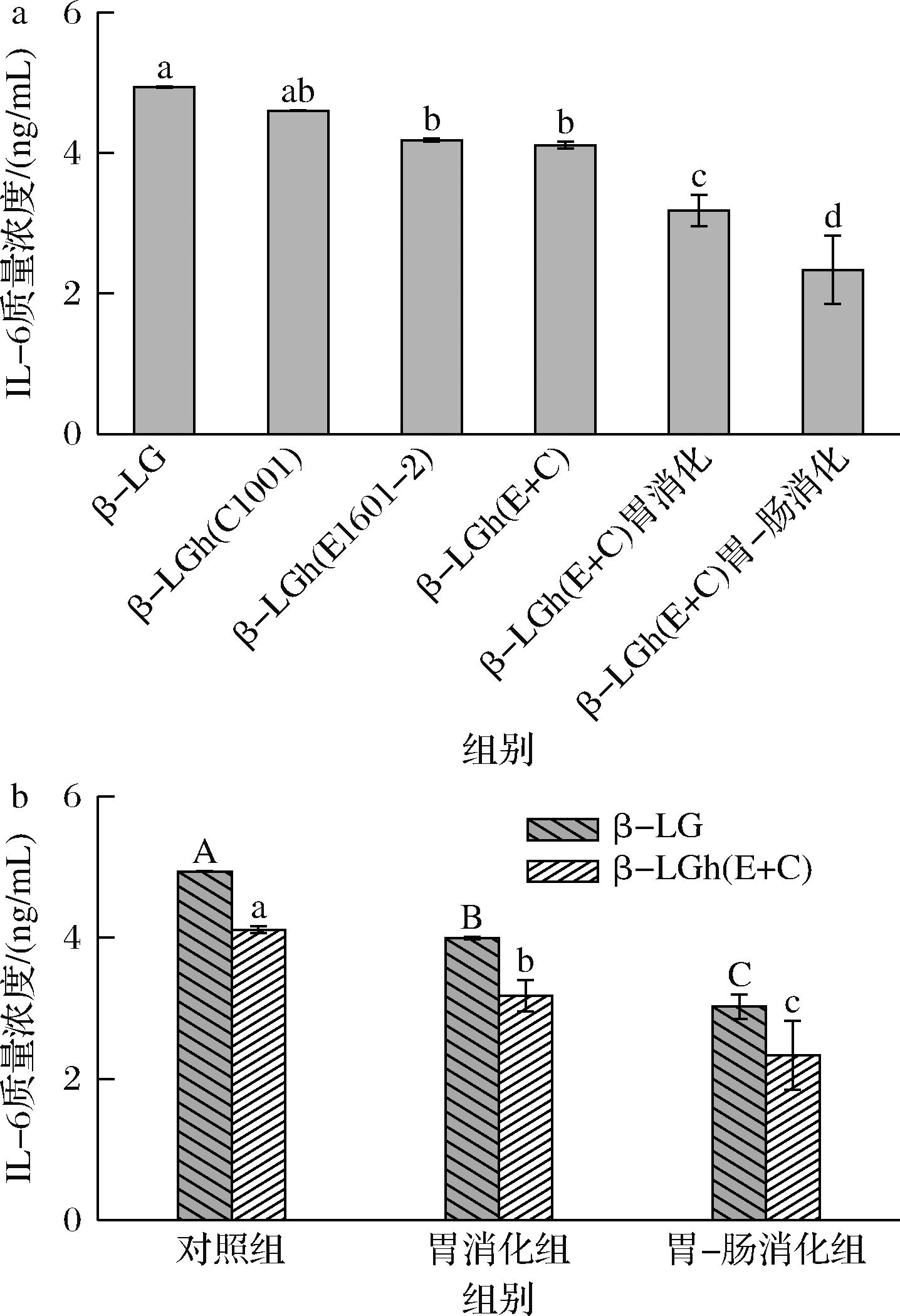
a-β-LG及其水解和消化产物的IL-6质量浓度;b-β-LG和β-LGh(E+C)消化产物的IL-6质量浓度
图6 β-LG及其水解产物和消化产物对KU812细胞脱颗粒释放IL-6的影响
Fig.6 Effect of β-LG and its hydrolysis and digestion products on IL-6 release from degranulation of KU812 cells
2.7 β-LG及其水解和消化产物对KU812细胞脱颗粒释放TNF-α的影响
与IL-6类似,TNF-α是嗜碱性粒细胞储存和释放的一种多功能细胞因子。TNF-α介导多种免疫和炎症反应,能够促使发热并引起细胞凋亡,其释放量与致敏性呈正相关[32]。如图7-a所示,LAB水解及胃肠道消化均显著降低了β-LG诱导KU812细胞脱颗粒释放TNF-α(P<0.05)。其中,β-LGh(E+C)胃消化组和β-LGh(E+C)胃-肠消化组的TNF-α释放量大幅降低,比β-LG组分别降低了70 ng/mL和85 ng/mL左右。这可能是由于乳酸菌水解破坏了β-LG的线性表位,并且在消化后β-LG进一步降解,导致消化产物的IgE结合能力降低[33]。如图7-b所示,胃肠道消化结束后,β-LG的TNF-α质量浓度从104.74 ng/mL降至49.10 ng/mL,β-LGh(E+C)的TNF-α质量浓度从84.61 ng/mL降至19.34 ng/mL,这可能是由于消化过程提高了蛋白质的利用率,说明消化是抑制KU812细胞释放TNF-α的有效途径。有文献报道,蛋白质的消化率会极大地影响其过敏性[34]。因此,本研究通过LAB发酵将β-LG水解为小分子的多肽和氨基酸,提高了β-LG的消化率进而大幅降低了其过敏性。
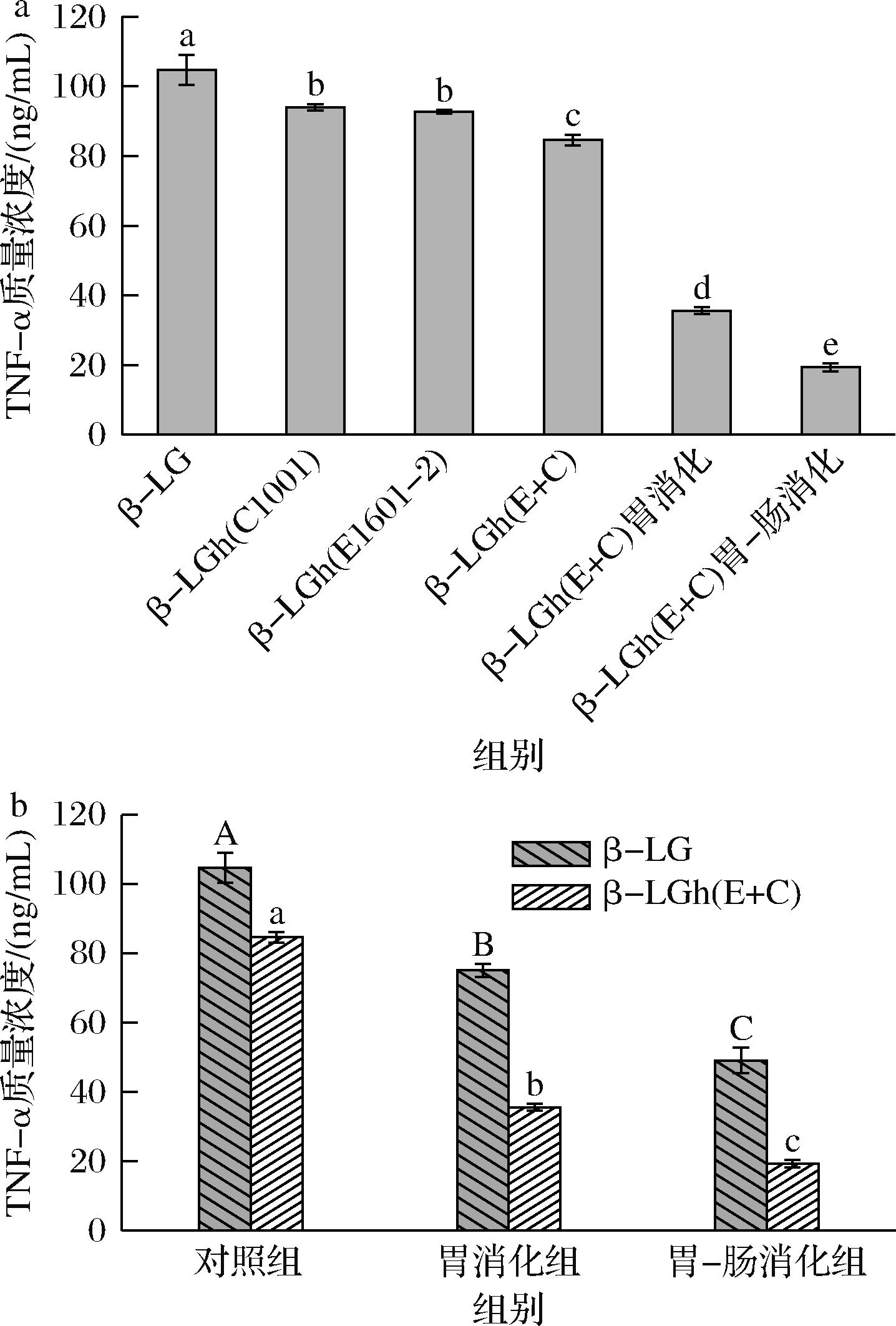
a-β-LG及其水解和消化产物的TNF-α质量浓度;b-β-LG和β-LGh(E+C)消化产物的TNF-α质量浓度
图7 β-LG及其水解和消化产物对KU812细胞脱颗粒释放TNF-α的影响
Fig.7 Effect of β-LG and its hydrolysis and digestion products on TNF-α release from degranulation of KU812 cells
2.8 β-LG及其水解和消化产物对KU812细胞脱颗粒释放TNF-γ含量的影响
TNF-γ由活化T细胞产生,有抗病毒、免疫调节及抗肿瘤特性[35]。如图8-a所示,TNF-γ的质量浓度呈上升的趋势,且各组相互之间存在显著性差异(P<0.05)。TNF-γ的含量越高,表示细胞受过敏原的刺激越小[36]。这表明β-LG水解和消化产物对KU812细胞脱颗粒的刺激性逐渐减弱。由图8-b可知,在消化过程中,β-LGh(E+C)的TNF-γ质量浓度始终高于β-LG,且在胃肠消化结束后,β-LGh(E+C)的TNF-γ质量浓度比β-LG增加了17 pg/mL左右。这些结果表明,LAB水解降低了β-LG的对细胞的致敏刺激,并降低了其在消化过程中的过敏原性。
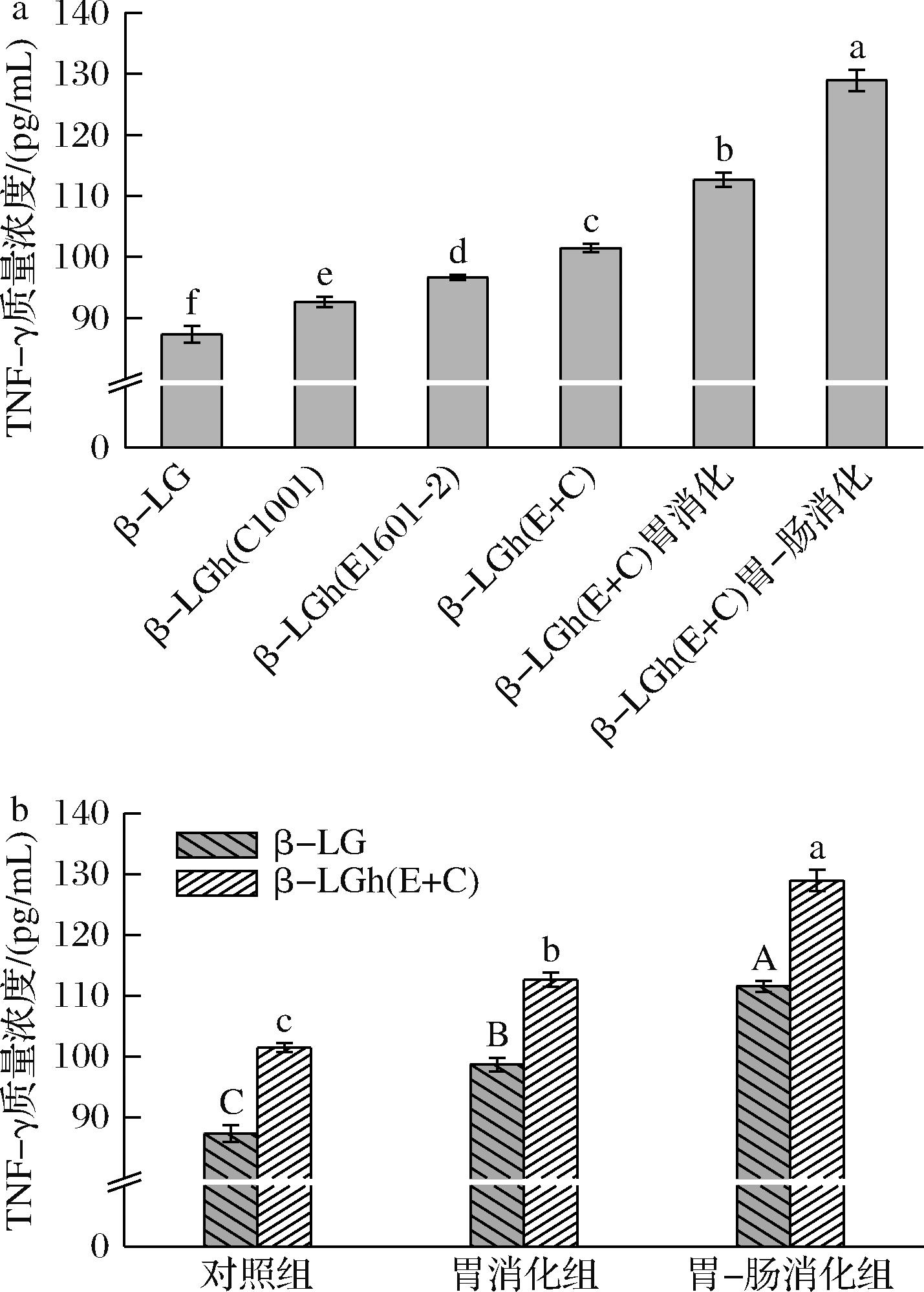
a-β-LG及其水解和消化产物的TNF-γ质量浓度;b-β-LG和β-LGh(E+C)消化产物的TNF-γ质量浓度
图8 β-LG及其水解产物和消化产物对KU812细胞脱颗粒释放TNF-γ的影响
Fig.8 Effect of β-LG and its hydrolysis and digestion products on TNF-γ release from degranulation of KU812 cells
3 结论
本研究通过KU812细胞脱颗粒实验,评估了从发酵蔬菜中分离出的2株乳酸菌的抗过敏潜力。结果表明,L.paracasei E1601-2和P.pentosaceus C1001水解均能通过减少β-LG对KU812细胞释放生物活性介质的刺激及调节KU812细胞炎症因子的释放等方式,降低β-LG在消化过程中的致敏性,并经过L.paracasei E1601-2联合P.pentosaceus C1001水解进一步降低了其过敏原性。本研究从细胞学的角度研究了LAB发酵与β-LG致敏性之间的相关性,显示出2株LAB在调节IgE介导的嗜碱性粒细胞过敏反应中的潜在功效,为菌株的综合利用奠定了基础,但致敏性的评价并不全面,后续还需通过构建动物过敏模型,分析其表征及组织变化和炎症细胞因子的释放等,进一步验证乳酸菌协同发酵的降敏效果。
[1] ZHAO L N, XIE Q G, SHI F Y, et al.Proteolytic activities of combined fermentation with Lactobacillus helveticus KLDS 1.8701 and Lactobacillus plantarum KLDS 1.0386 reduce antigenic response to cow milk proteins[J].Journal of Dairy Science, 2021, 104(11):11499-11508.
[2] LIANG X N, QIAN G L, YANG H, et al.Evaluation of IgG/IgE-binding capacity and functional properties of enzymatic hydrolysis in skimmed cow milk system[J].Journal of Food Science, 2023, 88(7):2780-2795.
[3] TIAN L H, ZHANG Q Q, CONG Y J, et al.Preparation, identification and application of β-lactoglobulin hydrolysates with oral immune tolerance[J].Foods, 2023, 12(2):307.
[4] JIA W, ZHU J Y, WANG X, et al.Covalent or non-covalent binding of polyphenols, polysaccharides, metal ions and nanoparticles to beta-lactoglobulin and advanced processing techniques:Reduce allergenicity and regulate digestion of β-lactoglobulin[J].Trends in Food Science &Technology, 2022, 129:634-645.
[5] KHAN M U, LIN H, AHMED I, et al.Whey allergens:Influence of nonthermal processing treatments and their detection methods[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(5):4480-4510.
[6] WANG X M, TU Z C, YE Y H, et al.Mechanism on the allergenicity changes of α-lactalbumin treated by sonication-assisted glycation during in vitro gastroduodenal digestion[J].Journal of Agricultural and Food Chemistry, 2021, 69(24):6850-6859.
[7] 邹琳, 陈琼珍, 熊子豪, 等.碱性氨基酸对β-乳球蛋白结构和致敏性的影响[J].食品与发酵工业, 2023, 49(11):7-12.ZOU L, CHEN Q Z, XIONG Z H, et al.Effect of basic amino acids on structure and allergenicity of β-lactoglobulin[J].Food and Fermentation Industries, 2023, 49(11):7-12.
[8] ZOU H, WANG H, ZHANG Z Y, et al.Immune regulation by fermented milk products:The role of the proteolytic system of lactic acid bacteria in the release of immunomodulatory peptides[J].Critical Reviews in Food Science and Nutrition, 2024, 64(28):10498-10516.
[9] 王宏鑫, 马鸣阳, 刘衍辰, 等.乳酸菌发酵降低牛乳蛋白致敏性的研究进展[J].中国食品学报, 2021, 21(4):364-374.WANG H X, MA M Y, LIU Y C, et al.Review on reducing bovine milk allergens by fermentation with lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(4):364-374.
[10] KAZEMI R, TAHERI-KAFRANI A, MOTAHARI A, et al.Allergenicity reduction of bovine milk β-lactoglobulin by proteolytic activity of Lactococcus lactis BMC12C and BMC19H isolated from Iranian dairy products[J].International Journal of Biological Macromolecules, 2018, 112:876-881.
[11] HUANG M J, LI X, WU Y, et al.Potential allergenicity and hydrolysis assessment of bovine casein and β-casein by treatment with lactic acid bacteria[J].Journal of Food Biochemistry, 2022, 46(12):e14424.
[12] ZHANG Z, XU Y P, LI X L, et al.Modulating whey proteins antigenicity with Lactobacillus delbrueckii subsp.bulgaricus DLPU F-36 metabolites:Insights from spectroscopic and molecular docking studies[J].Journal of Agricultural and Food Chemistry, 2024, 72(27):15198-15212.
[13] DU X, YIN S L, WANG T, et al.Identification of proteolytic bacteria from Yunnan fermented foods and their use to reduce the allergenicity of β-lactoglobulin[J].Journal of Dairy Science, 2024, 107(11):8990-9004.
[14] 刘庆梅, 杨永仕, 刘艳, 等.肥大细胞和嗜碱性粒细胞系在过敏性疾病中的研究进展[J].中国免疫学杂志, 2023, 39(12):2631-2637.LIU Q M, YANG Y S, LIU Y, et al.Research progress on mast cells and basophils lines in allergic diseases[J].Chinese Journal of Immunology, 2023, 39(12):2631-2637.
[15] JIANG S J, JIANG Y T, MENG L Y, et al.β-lactoglobulin hydrolysates by L.plantarum AHQ-14 and L.bulgaricus BD0390 alleviate allergic responses to β-lactoglobulin in sensitized mice[J].Food Bioscience, 2024, 58:103770.
[16] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[17] MENG X Y, ZENG Z L, GAO J Y, et al.Conformational changes in bovine α-lactalbumin and β-lactoglobulin evoked by interaction with C18 unsaturated fatty acids provide insights into increased allergic potential[J].Food &Function, 2020, 11(10):9240-9251.
[18] 钟菁华, 王中亮, 武涌, 等.高盐刺激嗜碱性粒细胞产生促炎因子及其分子机制[J].食品科学, 2023, 44(3):120-126.ZHONG J H, WANG Z L, WU Y, et al.Molecular mechanism by which sodium chloride stimulates basophils to produce pro-inflammatory factors[J].Food Science, 2023, 44(3):120-126.
[19] FUC E, Z OTKOWSKA D, WR
OTKOWSKA D, WR BLEWSKA B.Milk and meat allergens from Bos taurus β-lactoglobulin, α-casein, and bovine serum albumin:An in-vivo study of the immune response in mice[J].Nutrients, 2019, 11(9):2095.
BLEWSKA B.Milk and meat allergens from Bos taurus β-lactoglobulin, α-casein, and bovine serum albumin:An in-vivo study of the immune response in mice[J].Nutrients, 2019, 11(9):2095.
[20] XU Y P, ZHANG F F, MU G Q, et al.Effect of lactic acid bacteria fermentation on cow milk allergenicity and antigenicity:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2024, 23(1):e13257.
[21] ADEL-PATIENT K, NAHORI M A, PROUST B, et al.Elicitation of the allergic reaction in β-lactoglobulin-sensitized Balb/c mice:Biochemical and clinical manifestations differ according to the structure of the allergen used for challenge[J].Clinical &Experimental Allergy, 2003, 33(3):376-385.
[22] BERNASCONI E, FRITSCHÉ R, CORTHÉSY B.Specific effects of denaturation, hydrolysis and exposure to Lactococcus lactis on bovine β-lactoglobulin transepithelial transport, antigenicity and allergenicity[J].Clinical &Experimental Allergy, 2006, 36(6):803-814.
[23] 廖兵, 杨春平, 易韵, 等.RNAi沉默CCR3对变应性鼻炎嗜碱性粒细胞迁移、活化及脱颗粒的影响[J].中国老年学杂志, 2024, 44(6):1446-1450.LIAO B, YANG C P, YI Y, et al.Effect of RNAi silencing CCR3 on migration, activation and degranulation of basophils in allergic rhinitis[J].Chinese Journal of Gerontology, 2024, 44(6):1446-1450.
[24] CHIZOBA EKEZIE F G, CHENG J H, SUN D W.Effects of nonthermal food processing technologies on food allergens:A review of recent research advances[J].Trends in Food Science &Technology, 2018, 74:12-25.
[25] OHTSU H.Pathophysiologic role of histamine:Evidence clarified by histidine decarboxylase gene knockout mice[J].International Archives of Allergy and Immunology, 2012, 158(Suppl 1):2-6.
[26] SATHE S K, LIU C Q, ZAFFRAN V D.Food allergy[J].Annual Review of Food Science and Technology, 2016, 7:191-220.
[27] SCHROEDER J T.Basophils:Emerging roles in the pathogenesis of allergic disease[J].Immunological Reviews, 2011, 242(1):144-160.
[28] JEON J H, AHN K B, KIM S K, et al.Bacterial flagellin induces IL-6 expression in human basophils[J].Molecular Immunology, 2015, 65(1):168-176.
[29] KARA M, BESER O F, KONUKOGLU D, et al.The utility of TNF-α, IL-6 and IL-10 in the diagnosis and/or follow-up food allergy[J].Allergologia et Immunopathologia, 2020, 48(1):48-55.
[30] MENG L Y, ZHU X M, TUO Y F, et al.Reducing antigenicity of β-lactoglobulin, probiotic properties and safety evaluation of Lactobacillus plantarum AHQ-14 and Lactobacillus bulgaricus BD0390[J].Food Bioscience, 2021, 42:101137.
[31] PESCUMA M, HÉBERT E M, RABESONA H, et al.Proteolytic action of Lactobacillus delbrueckii subsp.bulgaricus CRL 656 reduces antigenic response to bovine β-lactoglobulin[J].Food Chemistry, 2011, 127(2):487-492.
[32] YANG H, QU Y Z, GAO Y R, et al.Role of the dietary components in food allergy:A comprehensive review[J].Food Chemistry, 2022, 386:132762.
[33] LU Q L, ZUO L L, WU Z H, et al.Characterization of the protein structure of soymilk fermented by Lactobacillus and evaluation of its potential allergenicity based on the sensitized-cell model[J].Food Chemistry, 2022, 366:130569.
[34] SAMADI N, HEIDEN D, KLEMS M, et al.Gastric enzyme supplementation inhibits food allergy in a BALB/c mouse model[J].Nutrients, 2021, 13(3):738.
[35] 马秋平. 超声波辅助糖基化对β-Lg在体外模拟消化过程中致敏性的影响[D].南昌:南昌大学, 2021.MA L P.Effects of ultrasound-assisted glycation on β-Lg allergenicity during simulated digestion in vitro[D].Nanchang:Nanchang University, 2021.
[36] PIPKIN M E, SACKS J A, CRUZ-GUILLOTY F, et al.Interleukin-2 and inflammation induce distinct transcriptional programs that promote the differentiation of effector cytolytic T cells[J].Immunity, 2010, 32(1):79-90.