近年来,随着人口持续增长,全球对水产品的需求日益增加,环境如何可持续和高质量地满足这一需求是重大挑战,依赖传统的水产养殖和捕捞方法难以解决这一问题[1-2]。因此,使用新兴技术生产水产品显得尤为迫切。细胞培养鱼肉技术是细胞培养肉领域的一个重要分支,指使用先进的细胞工程技术分离和培养来自鱼类的肌细胞、脂肪细胞或成纤维细胞,以定向生产大量肌肉、脂肪或结缔组织,然后将这些组织收集并通过食品化加工烹饪成鱼糜等食品,或利用生物支架进行细胞的三维培养,制成更接近真实鱼片风味和口感的细胞培养鱼片[3]。与传统水产养殖相比,细胞培养鱼肉的生产周期更短、生产过程更可控、转化率更高,同时极大程度地避免了由于水资源污染导致的水产品安全隐患[3]。因此,细胞培养鱼肉技术是应对自然资源枯竭、气候变化挑战,并为人类提供安全、优质水产品的重要手段。
目前,细胞培养鱼肉技术尚处于发展初期,已有的报道主要围绕大黄鱼、鲫鱼等肌肉干细胞分离、培养以及肌肉组织的制备。XU等[4]将大黄鱼肌肉干细胞接种于3D打印的凝胶支架上并进行增殖和成肌分化,最后将培养的鱼脂肪细胞填充到肌肉支架中,制备了尺寸为20 mm×12 mm×4 mm的仿真鱼片;YIN等[5]首次利用可食用多孔微载体作为细胞支架进行鲫鱼肌肉干细胞的三维扩增和分化,制备了厘米级细胞培养鲫鱼片;GAO等[6]应用Pickering乳化模板法结合双交联技术,成功构建了豌豆蛋白基可食用三维多孔支架,其能支持大黄鱼肌肉干细胞在支架上有效增殖和成肌分化。
在肉类制品中,除肌肉组织外,还有脂肪组织、结缔组织等。其中,脂肪是影响肉风味和质地的关键因素,赋予肉类最佳的口感、营养、多汁性和其他食品或健康相关品质[7]。鱼类的脂肪组织主要由成熟脂肪细胞及其包含的油脂构成,与哺乳动物脂肪相比,鱼类饱和脂肪酸更少,富含ω-3脂肪酸,如二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA),对人类的健康具有重要作用[8]。因此,在细胞培养肉的生产中引入脂肪组织的成分,对于模拟真实鱼肉的质地、风味和营养都至关重要,还能赋予肉制品特异性风味,提高肉制品质量,进一步提升消费者对替代肉制品的接受度。但是,目前尚缺乏高效、完善的细胞培养鱼类脂肪技术体系。
乌鳢(Channa argus)又称黑鱼,是一种低脂肪、高蛋白质、富含ω-3多不饱和脂肪酸的水产品[9],深受全球消费者的喜爱。在中国,乌鳢广泛分布于长江流域、嘉陵江流域以及近海淡水区域,主要养殖基地集中在广东、江苏等沿海省份。2022年数据显示,我国乌鳢市场规模已达到126.17亿元[10]。然而,随着集约化养殖的快速发展,水质恶化和鱼体兽药残留等问题日益凸显。因此,发展细胞培养鱼肉技术成为了解决这些问题的潜在途径。本研究以乌鳢前脂肪细胞作为生产培养脂肪的种子细胞,建立了一种高效的乌鳢前脂肪细胞分离和培养技术,旨在为高品质细胞培养乌鳢片的研发提供性能优良的种子细胞,为细胞培养鱼肉的工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
实验所用的乌鳢购自江苏省无锡市滨湖区水产市场,体重约1 200~1 500 g。选择强壮健康的乌鳢作为实验原料。
主要试剂:L15培养基,上海泰坦科技股份有限公司;胎牛血清(fetal bovine serum,FBS)、I型胶原酶,美国赛默飞世尔科技公司;I型胶原蛋白,中国索莱宝科技有限公司;猪明胶、鱼明胶,美国Sigma-Aldrich公司;Calcein AM染料、细胞衰老β-半乳糖苷酶染色试剂盒,上海碧云天生物技术有限公司;胶原蛋白一抗、波形蛋白一抗,武汉三鹰生物技术有限公司。
主要试剂的配制:1)完全培养基:L15培养基+体积分数为10% FBS+体积分数为2%双抗;2)2.5 g/L胶原酶消化液:称125 mg I型胶原酶粉末,加入1 g牛血清白蛋白(bovine serum albumin,BSA)溶入50 mL的L15培养基中,并通过0.22 μm膜除菌,现配现用;3)成脂诱导液:48.5 mL L15培养基+0.5 mL双抗+1 mL FBS+10 μL 50 mg/mL的胰岛素母液+1.5 μL油酸,胰岛素终质量浓度为10 μg/mL,油酸体积分数为0.003%。
1.2 仪器与设备
PU-150A恒温培养箱,上海知楚仪器有限公司;MF53-N倒置荧光显微镜,广州市明美光电技术有限公司;AX激光共聚焦显微镜,日本Nikon公司。
1.3 实验方法
1.3.1 前脂肪细胞的分离和培养
将乌鳢用体积分数为75%乙醇浸泡消毒10 min,解剖后剥离出肠系膜脂肪,除去多余的血管剁碎成糜状,称取5 g于50 mL离心管,并加入胶原酶消化液于28 ℃摇床60 r/min振荡消化45 min。消化结束后以1 800 r/min离心10 min后弃上清液,用含体积分数为2%双抗的磷酸缓冲盐溶液(phosphate buffered saline,PBS)重悬管底细胞并过70 μm细胞筛,离心弃上清液,加1 mL红细胞裂解液于冰上避光裂解7 min,裂解结束后用PBS定容至15 mL,离心弃上清液,用完全培养基重悬后计数,接种到培养皿于28 ℃无CO2培养箱中培养,每3~5 d更换培养基。
待乌鳢前脂肪细胞密度达到70%~80%时,用PBS清洗3次,加入胰酶室温消化2 min,镜下观察到大部分细胞收缩呈圆形时,终止消化,1 200 r/min离心5 min,弃上清液,用完全培养基重悬并传代培养。
1.3.2 消化时间和胶原酶用量对前脂肪细胞分离效率的影响
1)消化时间优化:设置30、45、60、75 min共4个梯度,按每组5 g组织装入50 mL离心管,加10 mL的2.5 g/L胶原酶消化液,设置3个重复,进行消化。铺板前重悬管底细胞并用血球计数板计数,计算初始细胞释放量;按0.1 g组织/孔接种到96孔板,设置3个重复,于第11天将细胞消化并用血球计数板计数。
2)胶原酶用量优化:按每组5 g组织装入50 mL离心管,分别加5、10、15 mL的2.5 g/L胶原酶消化液,设置3个重复,消化45 min。在铺板前重悬管底细胞并计数,计算初始细胞释放量;按0.1 g组织/孔接种到96孔板,设置3个重复,于第13天将细胞消化计数。
1.3.3 不同细胞外基质对前脂肪细胞增殖的影响
用10 g/L猪明胶、10 g/L鱼明胶和5 μg/cm2的胶原蛋白对培养板预包被,对照组为不铺胶的培养皿。选第3代细胞按每孔3×103个接种到96孔板,设置3个重复。于第10天消化计数。
1.3.4 活细胞绿色荧光探针Calcein AM染色
用无酚红的L15培养基按1 000倍稀释倍数配制Calcein AM工作液。吸去培养基,用PBS洗涤3次以完全清除酚红和血清,加工作液于28 ℃避光孵育10 min,用倒置荧光显微镜拍摄。
1.3.5 增殖曲线绘制
1)原代细胞培养:将胶原酶消化后的原代乌鳢前脂肪细胞按0.1 g组织/孔接种到10 g/L猪明胶包被的96孔板,添加完全培养基,设置3个重复,于1、3、6、9 d将细胞消化并计数,以细胞培养时间为横坐标、细胞数量为纵坐标绘制曲线。
2)连续传代增殖曲线绘制:取P1代细胞,按照每孔5×103个接种到10 g/L猪明胶包被的96孔板,设置3个重复。待密度达到70%~80%时,将细胞消化并计数,并接种到48孔板进行继代培养,计为P2代。按以上方式进行细胞连续传代和逐级扩大培养(24孔板—12孔板—6孔板—T25细胞培养瓶)。最后,以细胞培养天数或代数为横坐标、细胞数量为纵坐标绘制连续传代增殖曲线。按照公式(1)计算细胞倍增时间(T):
(1)
式中:Δt,培养时间,h;Nt,培养后细胞量;N0,接种细胞量。
1.3.6 免疫荧光
将细胞用40 g/L多聚甲醛固定15 min,并用PBS洗涤3次。用体积分数为0.2% Triton X-100于常温通透15 min,PBS洗涤3次。用含10 g/L BSA的PBS封闭30 min,PBS洗涤3次。加入一定比例配制的一抗:波形蛋白抗体(vimentin,1∶600)、胶原蛋白抗体(collagen,1∶400),于4 ℃孵育过夜。孵育后用PBS洗涤3次,加入二抗室温避光孵育1 h;DAPI染色5 min,PBS洗涤3次,用倒置荧光显微镜进行拍摄,在激发波长493 nm处检测绿色荧光,在340 nm处检测蓝色荧光。
1.3.7 成脂诱导分化与Bodipy染色
将细胞按4×104/cm2的密度接种于10 g/L猪明胶预包被的孔板,待生长至90%汇合度,加入成脂诱导液,每2 d换液1次,9 d后检测成脂情况:细胞用PBS洗涤3次,加40 g/L多聚甲醛固定15 min,PBS洗涤3次;加入Bodipy染液室温避光孵育30 min,DAPI染色5 min,PBS洗涤3次,用倒置荧光显微镜拍摄,在激发波长493 nm处检测绿色荧光,在340 nm处检测蓝色荧光,并计算成脂分化率。
1.3.8 细胞衰老β-半乳糖苷酶染色
使用细胞衰老β-半乳糖苷酶染色试剂盒对P2和P6代细胞进行染色,鉴定衰老情况。分别将P2和P6代细胞按4×104/cm2的密度接种于10 g/L猪明胶预包被的孔板,待生长至70%~80%汇合度,按照说明书步骤将细胞用40 g/L多聚甲醛固定15 min,并用PBS洗涤3次。将染色液加入细胞,于28 ℃孵育12 h,使用倒置显微镜拍摄染色情况。
1.3.9 统计学分析
本研究中实验均进行3次重复,数据以“平均值±标准差”表示。对于多组间的差异分析,使用GraphPad Prism软件进行ANOVA检验分析,显著性水平以差异字母表示,相同字母表示无显著性差异(P>0.05),不同字母表示存在显著性差异(P<0.05)。
2 结果与分析
2.1 胶原酶消化时间对前脂肪细胞分离效率的影响
消化离心后可清晰观察到组织消化程度的差异:30、45、60 min组有大量细胞聚积在离心管底,而75 min组细胞量显著减少,这可能是因为消化时间过长导致细胞损伤和破碎,无法沉积(图1-a)。随后重悬细胞并计数,消化45 min组每克组织可收获(5.24±0.11)×106个细胞,显著高于其他3组(图1-b);当时间由30 min延长到45 min,细胞数增加了1.34倍,但进一步延长时间反而降低了存活率。贴壁培养后由明场和活细胞染色可见45 min组细胞最多(图1-c和图1-d),45 min组每克组织可收获(1.40±0.04)×105个贴壁细胞,显著高于其他3组。综上,45 min是最佳消化时间。
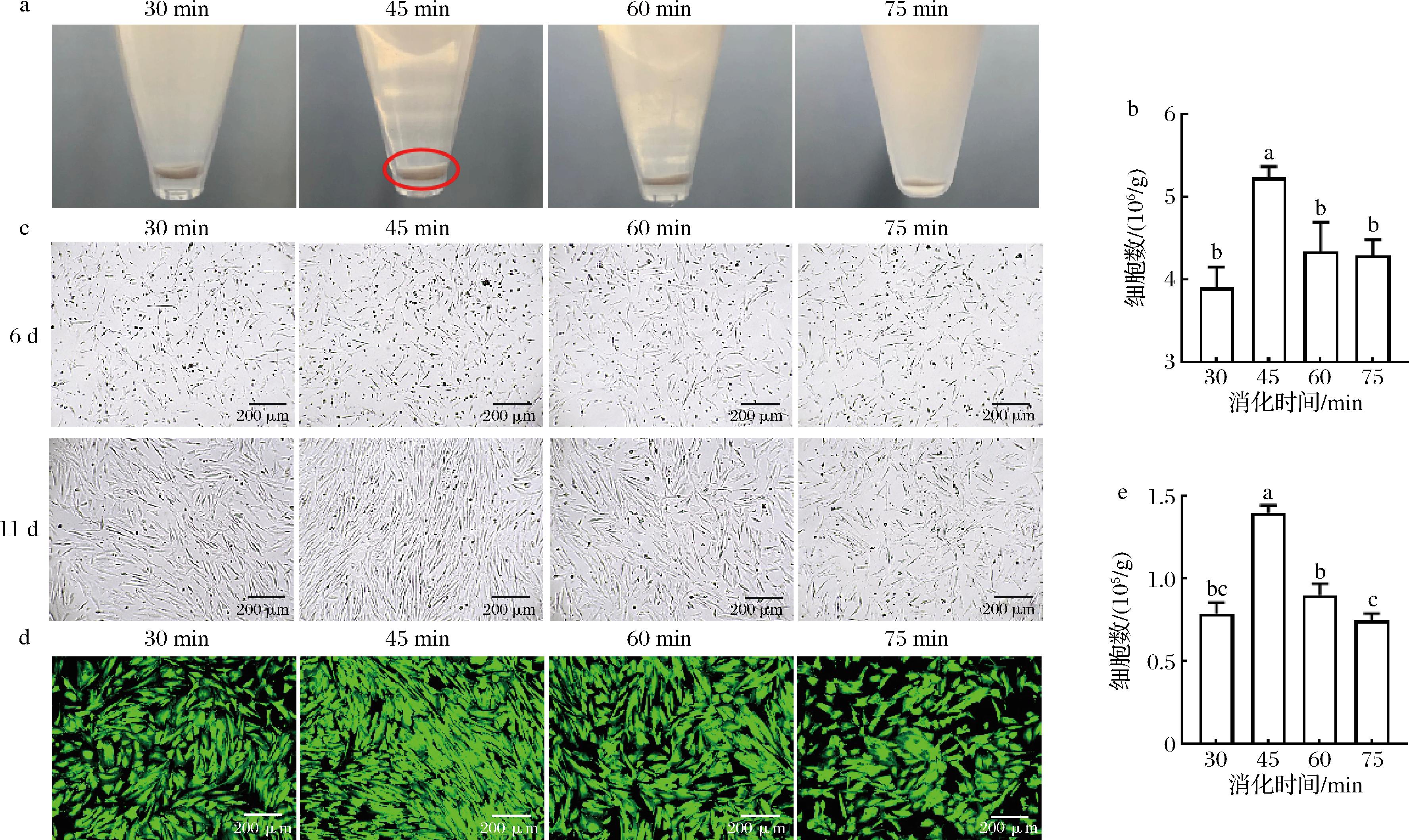
a-细胞沉淀照片;b -细胞的初始数量;c-细胞的显微形态;d-细胞培养11 d后的活细胞染色;e-细胞培养11 d后的活细胞数
图1 不同消化时间对前脂肪细胞分离效率的影响
Fig.1 Effect of different digestion times on the isolation efficiency of preadipocytes
注:不同字母表示存在显著性差异(P <0.05)(下同)。

a-细胞沉淀图片;b-细胞的初始数量;c-细胞的显微形态;d-细胞培养13 d后的活细胞染色;e-细胞培养13 d后的细胞数
图2 不同胶原酶用量对前脂肪细胞分离效率的影响
Fig.2 Effect of different collagenase dosages on the isolation efficiency of preadipocytes
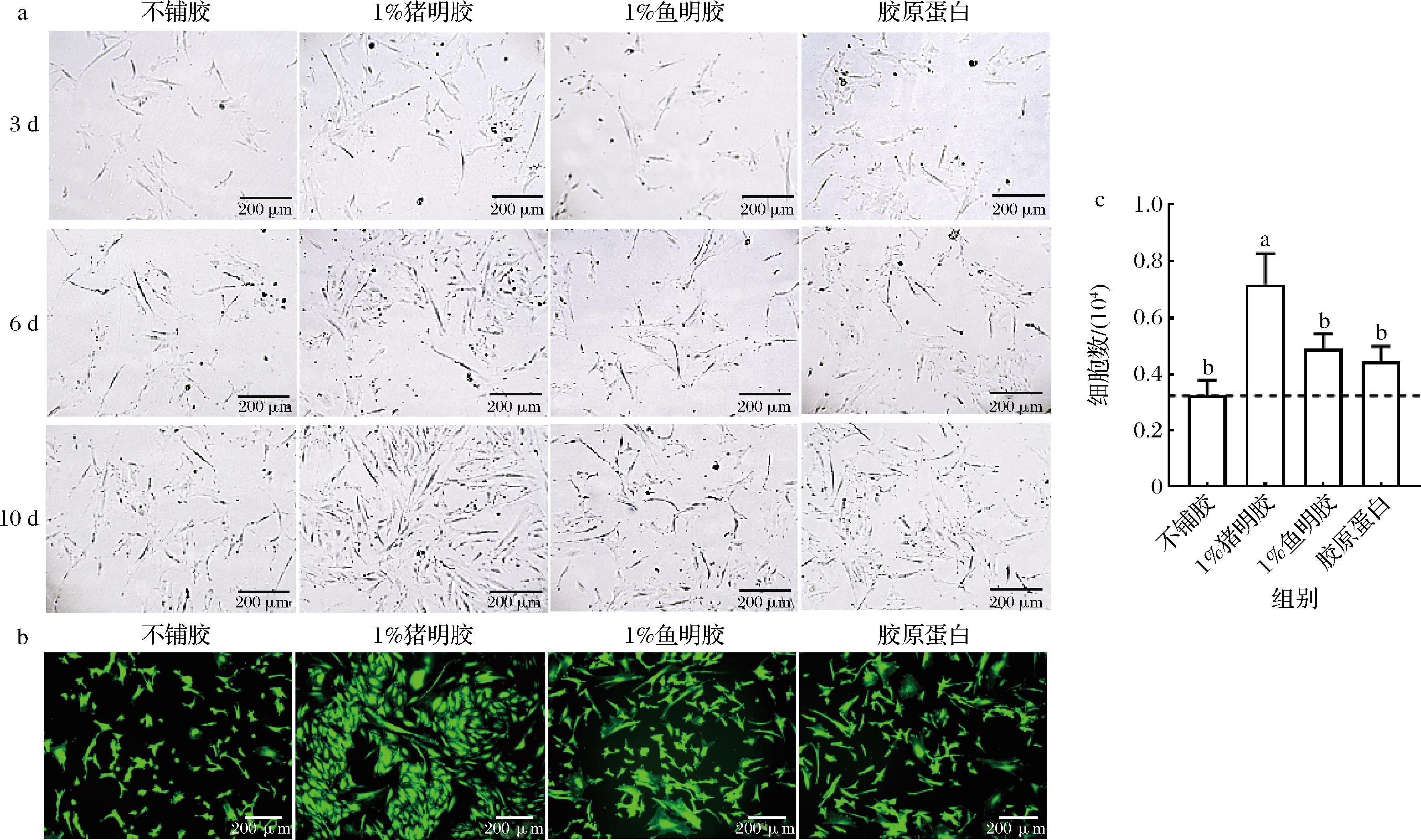
a-增殖情况的细胞显微形态;b-培养10 d后的活细胞染色;c-培养10 d后的细胞数
图3 不同细胞外基质对前脂肪细胞增殖的影响
Fig.3 Effect of different extracellular matrices on proliferation of preadipocytes
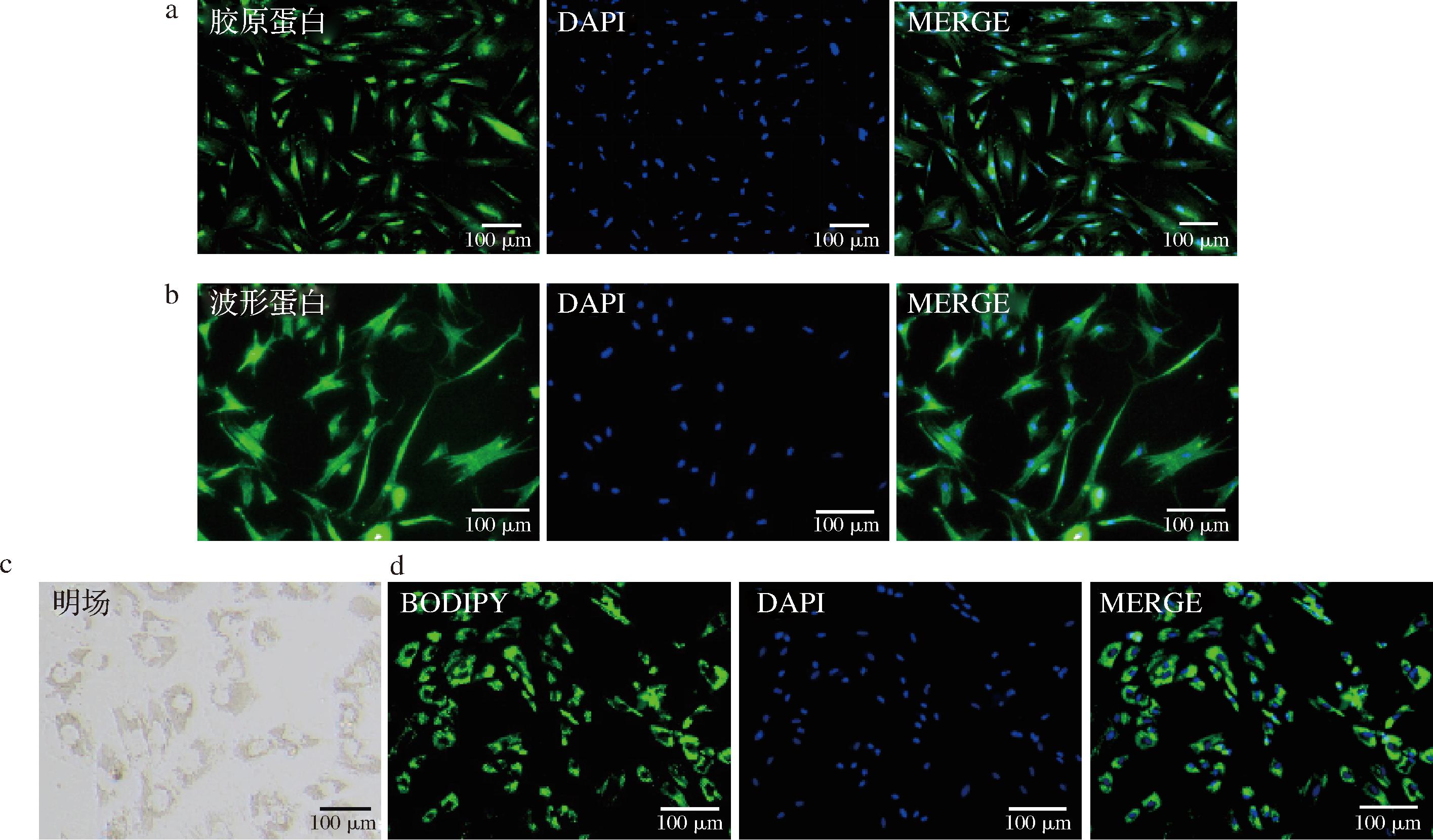
a-胶原蛋白免疫荧光染色图像;b-波形蛋白免疫荧光染色图像;c-成脂诱导9 d的前脂肪细胞显微形态;d-成脂诱导9 d的前脂肪细胞的脂滴染色荧光图像
图4 前脂肪细胞的生物学特性鉴定
Fig.4 Identification of biological characterization of preadipocytes
2.2 胶原酶用量对前脂肪细胞分离效率的影响
在最佳酶消化时间(45 min)下评估了酶用量的影响,结果表明,消化离心后各组均有明显细胞层沉积在管底(图2-a),计数发现2 mL胶原酶/g组织的酶量分离效率最高,可从每克组织收获(5.71±0.17)×106个细胞,当增加到3 mL胶原酶/g组织的酶量,细胞数反而减少(图2-b)。培养13 d后可见2 mL胶原酶/g组织的组别细胞最多(图2-c和图2-d),每克脂肪中获得(0.88±0.04)×105个细胞,是1 mL胶原酶/g组织的1.15倍,3 mL胶原酶/g组织的1.55倍(图2-e)。综上,2 mL胶原酶/g组织是最佳酶量。
2.3 不同细胞外基质对前脂肪细胞增殖影响
培养第3天,各组细胞均为梭形或纺锤形的正常形态(图3-a),贴壁率无显著差异,说明乌鳢前脂肪细胞的贴壁能力较强,不依赖于细胞外基质。随着培养时间增加,1%猪明胶组的细胞数显著增加(图3-a和图3-b)。计数结果显示,1%猪明胶组细胞数最多,分别是未包被、鱼明胶、胶原蛋白组的2.22、1.46、1.61倍(图3-c)。
2.4 乌鳢前脂肪细胞的鉴定
前脂肪细胞为中胚层起源的细胞[11],与间充质干细胞类似,能够表达波形蛋白[12]和胶原蛋白[13]。波形蛋白是一种Ⅲ型中间丝蛋白,是细胞骨架的主要组成部分[12],胶原蛋白是构成细胞间质纤维和细胞基底膜最丰富的蛋白[13]。因此,本研究选取这2种蛋白作为分子标志物并结合细胞成脂分化能力作为鉴定标准,对前脂肪细胞进行鉴别并确定细胞纯度。结果表明,分离获得的乌鳢前脂肪细胞中胶原蛋白、波形蛋白表达均呈阳性,利用特异性抗体检测到的绿色荧光分布于整个胞质,阳性率为100%(图4-a和图4-b)。进一步,对前脂肪细胞进行9 d成脂诱导后,可观察到细胞内脂滴大量聚集,呈花环状包裹在细胞核周围,说明前脂肪细胞已分化为成熟脂肪细胞,成脂分化率达到100%(图4-c和图4-d)。上述结果表明,本实验分离获得的乌鳢前脂肪细胞纯度较高且具有较强脂肪生成潜力。
2.5 乌鳢前脂肪细胞的原代培养观察及增殖曲线
将分离获得的乌鳢前脂肪细胞接种于10 g/L猪明胶包被的96孔板中,观察细胞体外生长情况并绘制细胞增殖曲线。结果显示,在细胞接种1 d内即可观察到细胞贴壁和铺展,3 d后贴壁细胞明显增多,并逐渐伸展为梭形或纺锤形,呈成纤维细胞样态分布于孔板中。6~9 d时细胞基本长满孔板底部并呈漩涡状分布,胞体呈长梭状,形态变得更为扁平(图5-a)。细胞计数结果显示,此时每孔细胞数达到(1.45±0.05)×104个(图5-b)。随后,收集细胞并以0.5×104个/孔的密度接种到96孔板中(计为P1代,d 0),对细胞进行连续传代和逐级扩大培养,以进一步评估乌鳢前脂肪细胞的体外增殖能力。共在体外连续培养细胞54 d,传代6次,细胞总数达到(3.50±0.24)×105个,细胞总数扩增约70倍(图5-c和图5-d)。在培养过程中,发现乌鳢前脂肪细胞的群体倍增时间随体外培养时间延长而显著增加,P2代时细胞的群体倍增时间是(1.05±0.16)×102 h,P6代时是(3.87±0.39)×102 h,增加了270.9%(图5-e)。因此,使用β-半乳糖苷酶检测试剂盒对细胞进行了衰老检测。结果显示,P2代细胞的β-半乳糖苷酶染色为阴性,提示此时细胞未发生衰老,而P6代细胞的β-半乳糖苷酶染色阳性率为60.47%,说明在体外传代过程中乌鳢前脂肪细胞发生衰老(图5-f)。
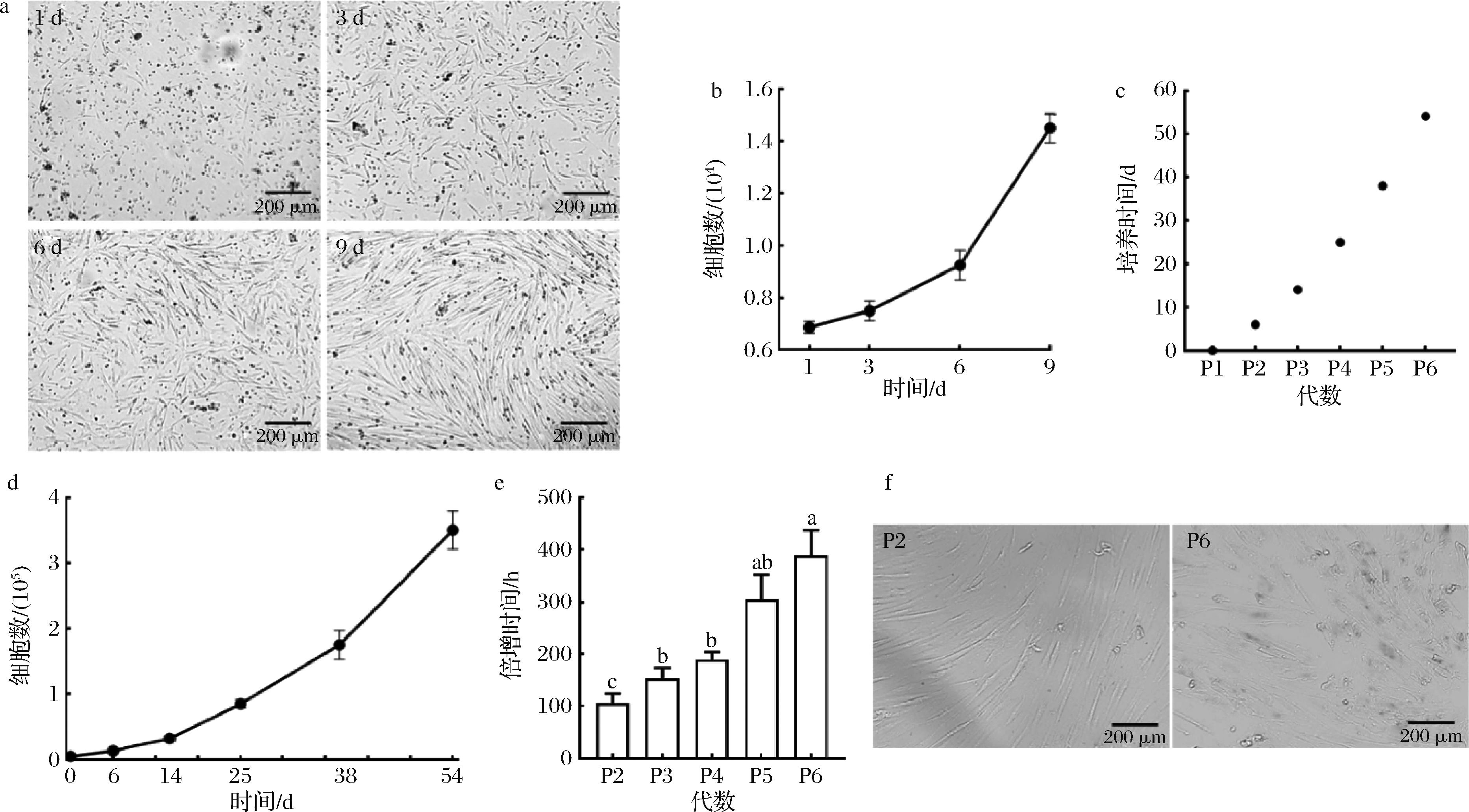
a-初始分离的前脂肪细胞培养1~9 d的细胞显微形态;b-初始分离的前脂肪细胞的生长曲线;c-前脂肪细胞体外培养时间与细胞代数的对应关系;d-前脂肪细胞连续传代的增殖曲线;e-前脂肪细胞连续传代的倍增时间;f-前脂肪细胞P2和P6的β-半乳糖苷酶衰老染色情况
图5 前脂肪细胞的增殖曲线和体外生长情况
Fig.5 Proliferation curves and in vitro growth of preadipocytes
3 结论与讨论
无论是开展细胞培养肉技术研发和还是构建规模化生产工艺,其先决条件是高效、经济地获取种子细胞[14]。胶原酶解是分离脂肪细胞的有效方法,且消化时间是影响消化效率的主导因素之一[15]。根据现有报道,分离不同鱼种前脂肪细胞所采用的消化时间各不相同。例如,分离罗非鱼前脂肪细胞的消化时间为1.5 h[16],分离草鱼前脂肪细胞的消化时间为50 min[17],分离大西洋鲑和大黄鱼前脂肪细胞的消化时间为1 h[18-19]。但是,上述大部分研究并没有针对消化时间进行研究和优化。本研究针对分离乌鳢前脂肪细胞的消化时间进行了系统研究。结果表明,细胞初始释放量和贴壁收获量都随胶原酶消化时间的延长呈现先增加后减少的趋势,45 min是分离乌鳢前脂肪细胞的最佳消化时间。由于不同物种、不同组织部位的硬度和纤维含量不同,因此所需的消化时间也不同。适当延长消化时间有利于组织的充分解离和细胞的完全释放,但是,长时间的消化可能会对细胞结构特别是细胞膜造成损害,降低消化效率和细胞活力。同时,胶原酶用量过多引起的消化过度也会导致释放的细胞数量减少。此外,在本研究中,贴壁细胞收获量约为初始细胞释放量的2.7%,原因可能包括以下几点:1)乌鳢腹腔脂肪组织的量虽然可观,但其中具有增殖能力的细胞有限,EMONT等[20]对人和小鼠的内脏脂肪中所有的细胞群进行单细胞测序,发现脂肪祖细胞和干细胞占比仅约20%,其余为成熟脂肪细胞、血细胞等杂细胞。2)鱼类脂肪细胞的贴壁和增殖能力不及猪、牛等哺乳动物[21],因此在分离后存活率并不能达到100%。3)研究表明,肥胖会导致脂肪组织中的脂肪祖细胞和干细胞增殖能力降低[22-23]。本研究所用的养殖乌鳢,其肠系膜脂肪重量为50~60 g,约占腹腔体积的40%~50%,可能由于肥胖导致其前脂肪细胞的活力下降。
水生动物的细胞培养仍处起步阶段[24],且物种不同有时培养体系难以相互借鉴。乌鳢前脂肪细胞的培养方案目前文献较为匮乏,为探究适合乌鳢前脂肪细胞的细胞外基质,本文对细胞外基质进行了优化,发现相比于鱼明胶,猪明胶更利于乌鳢前脂肪细胞的生长,这与一项关于草鱼前脂肪细胞的结果一致[17],这可能是由于不同物种来源明胶的营养成分和理化性质具有差异[25]。本研究中的猪明胶来源于猪皮,鱼明胶来源于冷水鱼皮肤,一般而言,猪明胶比冷水鱼明胶具有更高的刚度、熔点和亲水性,但黏度更低[26]。本实验中也观察到在同样置于4 ℃时,1%的猪明胶呈不流动的胶冻状,1%的鱼明胶仍为流动能力较强的液体。据报道,相较于较软的基质,较硬基质可促进细胞快速形成应力纤维以及黏着斑成熟,进而促进细胞增殖[27]。此外,更高的基质亲水性有利于细胞黏附,但过高的黏度会导致细胞承受的黏附力过大而无法继续迁移[28]。综上,猪明胶因其具有合适的刚度、亲水性和黏度,在乌鳢前脂肪细胞培养中表现出更好的促细胞黏附和增殖作用效果。
前脂肪细胞的一个典型特征是能够分化成为成熟的脂肪细胞[29],本研究中,成脂能力是评估其是否具有生产培养脂肪的潜力的最关键指标。结果显示,诱导9 d后的细胞大量充脂,花环状脂滴包裹于细胞核周围,已达成脂分化的成熟阶段,分化率达100%,成脂能力较强,同时观察到胞内脂滴呈细小而密集,不同于哺乳动物细胞分化后脂滴易融合成为大脂滴,这可能是由于鱼类和哺乳动物生成的脂质成分不同导致的[17],后续将进一步对乌鳢前脂肪细胞分化后的脂肪酸组成进行研究。
此外,本研究对乌鳢前脂肪进行了体外长期培养,观察发现乌鳢前脂肪细胞的增殖速度随体外培养时间延长而减缓,群体倍增时间在培养第6代时增加到第1代时的约2倍,衰老率从第2代细胞的0%增加到第6代的60.47%,这提示乌鳢前脂肪细胞在体外长期培养过程中发生了衰老,导致增殖能力减缓。通常原代种子细胞体外寿命有限,需要定期进行细胞分离[25],文献中已经报道了多种家畜的前脂肪细胞或脂肪间充质细胞,对于猪[30]、牛[31]、水牛[32]、鸡[33]细胞,体外培养的寿命通常在15~37代;对于鱼类前脂肪细胞,目前只有大黄鱼和花鲈有体外长期培养的报道,大黄鱼前脂肪在体外连续培养超过了10代[34],花鲈前脂肪细胞通过连续传代建立了自发永生化细胞系[35],而温加静[36]对罗非鱼前脂肪细胞进行为期5代的传代培养,发现在第3代以后,细胞增殖缓慢,有时需要近1个月才长至汇合期,其他鱼类的前脂肪细胞则未见长期培养相关报道。不同鱼类前脂肪细胞长期培养的差异表明,鱼类前脂肪细胞体外长期增殖能力可能与培养条件、不同品种鱼类细胞的代谢偏好都有关系,因此,为避免细胞的反复分离,本研究后续将通过进一步优化培养体系、靶向筛选促进乌鳢前脂肪细胞增殖的细胞因子和小分子化合物或自发永生化等技术来构建具有长寿命、高增殖活力和分化能力的乌鳢前脂肪细胞种子细胞系。
综上,本研究通过对乌鳢前脂肪细胞的分离方法进行研究,确定了乌鳢脂肪组织的最佳消化条件:I型胶原酶浓度0.25%,消化温度28 ℃,酶量2 mL/g脂肪组织,消化时间45 min,此时可以达到最佳的乌鳢前脂肪细胞分离效率,每克脂肪组织收获约1×105个具有良好贴壁性能和增殖活力的细胞。同时,发现且预包被1%猪明胶可提升乌鳢前脂肪细胞的增殖能力,经表面标志物鉴定和成脂能力鉴定确定所获前脂肪细胞纯度高且成脂能力强,最终为细胞培养乌鳢片的工业化生产提供种子细胞高效获取和培养方案,为后续生产脂肪酸谱可控的健康的细胞培养鱼肉奠定了基础。
[1] RUBIO N, DATAR I, STACHURA D, et al.Cell-based fish:A novel approach to seafood production and an opportunity for cellular agriculture[J].Frontiers in Sustainable Food Systems, 2019, 3:43.
[2] GOSWAMI M, BELATHUR SHAMBHUGOWDA Y, SATHIYANARAYANAN A, et al.Cellular aquaculture:Prospects and challenges[J].Micromachines, 2022, 13(6):828.
[3] GOSWAMI M, YASHWANTH B S, TRUDEAU V, et al.Role and relevance of fish cell lines in advanced in vitro research[J].Molecular Biology Reports, 2022, 49(3):2393-2411.
[4] XU E B, NIU R H, LAO J H, et al.Tissue-like cultured fish fillets through a synthetic food pipeline[J].NPJ Science of Food, 2023, 7:17.
[5] YIN H W, WANG L, HUR S J, et al.Cell-cultured fish meat via scale-up expansion of Carassius auratus skeletal muscle cells using edible porous microcarriers and quality evaluation[J].Journal of Agricultural and Food Chemistry, 2024, 72(29):16475-16483.
[6] GAO Y X, KONG Q, ZHENG H W, et al.Tailored edible 3D porous scaffolds constructed by Pickering emulgel templating for cell-cultured fish meat[J].Food Hydrocolloids, 2024, 157:110453.
[7] JIMÉNEZ COLMENERO F.Relevant factors in strategies for fat reduction in meat products[J].Trends in Food Science &Technology, 2000, 11(2):56-66.
[8] TOCHER D R.Metabolism and functions of lipids and fatty acids in teleost fish[J].Reviews in Fisheries Science, 2003, 11(2):107-184.
[9] 聂国兴, 傅艳茹, 张浩, 等.乌鳢肌肉营养成分分析[J].淡水渔业, 2002, 32(2):46-47.NIE G X, FU Y R, ZHANG H, et al.Analysis of nutritional ingredient in Ophiocephalus argus’s muscle[J].Freshwater Fisheries, 2002, 32(2):46-47.
[10] 谭璐. 一文读懂2023年中国乌鳢产业全景分析:预制菜等新需求带动乌鳢需求和价格增长[EB/OL].(2023-07-05)[2024-09-29].https://www.sohu.com/a/694643688_120961824.TAN L.A panoramic analysis of China’s snakehead industry in 2023:New demand such as prepared dishes drives the growth of the demand and price of snakehead[EB/OL].(2023-07-05)[2024-09-29].https://www.sohu.com/a/694643688_120961824.
[11] ANDREASSEN R C, RØNNING S B, SOLBERG N T, et al.Production of food-grade microcarriers based on by-products from the food industry to facilitate the expansion of bovine skeletal muscle satellite cells for cultured meat production[J].Biomaterials, 2022, 286:121602.
[12] 田志华, 杨公社, 赵兴波, 等.大鼠前体脂肪细胞分化过程中波形纤维形态结构的变化和波形纤维蛋白基因表达的研究[J].遗传学报, 2003, 30(12):1113-1117.TIAN Z H, YANG G S, ZHAO X B, et al.Studies of the gene expression and structure alteration of vimentin during differentiation of rat preadipocytes[J].Acta Genetica Sinica, 2003, 30(12):1113-1117.
[13] RITTER A, FRIEMEL A, ROTH S, et al.Subcutaneous and visceral adipose-derived mesenchymal stem cells:Commonality and diversity[J].Cells, 2019, 8(10):1288.
[14] YUEN J S K Jr, STOUT A J, KAWECKI N S, et al.Perspectives on scaling production of adipose tissue for food applications[J].Biomaterials, 2022, 280:121273.
[15] 陶凯, 刘晓燕, 梁久龙, 等.人脂肪组织来源干细胞体外培养条件的优化[J].中国美容整形外科杂志, 2007, 18(3):223-226.TAO K, LIU X Y, LIANG J L, et al.The optimization of culture conditions for human adipose tissue-derived stem cells cultured in vitro[J].Chinese Journal of Aesthetic and Plastic Surgery, 2007, 18(3):223-226.
[16] 王雅文, 乔芳, 张美玲, 等.外源性脂肪酸对罗非鱼脂肪细胞增殖与分化的影响[J].水生生物学报, 2018, 42(3):517-524.WANG Y W, QIAO F, ZHANG M L, et al.Effects of exogenous fatty acid on the proliferation and differentiation of Nile tilapia preadipocytes[J].Acta Hydrobiologica Sinica, 2018, 42(3):517-524.
[17] 吉红, 曹艳姿, 林亚秋, 等.草鱼前体脂肪细胞的原代培养[J].水生生物学报, 2009, 33(6):1226-1230.JI H, CAO Y Z, LIN Y Q, et al.Primary culture of grass carp preadipocyte in vitro[J].Acta Hydrobiologica Sinica, 2009, 33(6):1226-1230.
[18] VEGUSDAL A, SUNDVOLD H, GJØEN T, et al.An in vitro method for studying the proliferation and differentiation of Atlantic salmon preadipocytes[J].Lipids, 2003, 38(3):289-296.
[19] WANG X X, HUANG M, WANG Y Z.The effect of insulin, TNFα and DHA on the proliferation, differentiation and lipolysis of preadipocytes isolated from large yellow croaker (Pseudosciaena crocea R.)[J].PLoS One, 2012, 7(10):e48069.
[20] EMONT M P, JACOBS C, ESSENE A L, et al.A single-cell atlas of human and mouse white adipose tissue[J].Nature, 2022, 603(7903):926-933.
[21] 刘茜. 草鱼LPL基因克隆及草鱼脂肪细胞提取与培养的研究[D].杨凌:西北农林科技大学, 2007.LIU Q.The research on cloning of LPL and the extraction and culture of adipocytes in grass carp[D].Yangling:Northwest A&F University, 2007.
[22] HARRIS L J, ZHANG P, ABDOLLAHI H, et al.Availability of adipose-derived stem cells in patients undergoing vascular surgical procedures[J].Journal of Surgical Research, 2010, 163(2):e105-12.
[23] VAN HARMELEN V, SKURK T, RÖHRIG K, et al.Effect of BMI and age on adipose tissue cellularity and differentiation capacity in women[J].International Journal of Obesity, 2003, 27(8):889-895.
[24] GOSWAMI M, OVISSIPOUR R, BOMKAMP C, et al.Cell-cultivated aquatic food products:Emerging production systems for seafood[J].Journal of Biological Engineering, 2024, 18(1):43.
[25] LIN L, REGENSTEIN J M, LV S, et al.An overview of gelatin derived from aquatic animals:Properties and modification[J].Trends in Food Science &Technology, 2017, 68:102-112.
[26] WU J T, XIAO J, ZHU M Y, et al.Study of physicochemical and gelation properties of fish gelatin from different sources[J].Applied Sciences, 2023, 13(9):5337.
[27] PELHAM R J, CHANG F.Role of actin polymerization and actin cables in actin-patch movement in Schizosaccharomyces pombe[J].Nature Cell Biology, 2001, 3(3):235-244.
[28] 樊廷俊, 田梦, 赵君.细胞外基质对细胞行为调控作用的研究进展[J].生命科学, 2021, 33(7):844-852.FAN T J, TIAN M, ZHAO J.Progress in the regulation of extracellular matrix on cell behavior[J].Chinese Bulletin of Life Sciences, 2021, 33(7):844-852.
[29] 杨红文. 猪前脂肪细胞的分离培养与鉴定及猪SMAF1,ATGL基因的组织表达规律[D].武汉:华中农业大学, 2006.YANG H W.Primary culture and identification of porcine preadipocyte and tissue expression distribution of porcine SMAF1, ATGL gene[D].Wuhan:Huazhong Agricultural University, 2006.
[30] BHARTI D, SHIVAKUMAR S B, SUBBARAO R B, et al.Research advancements in porcine derived mesenchymal stem cells[J].Current Stem Cell Research &Therapy, 2016, 11(1):78-93.
[31] HILL A B T, BRESSAN F F, MURPHY B D, et al.Applications of mesenchymal stem cell technology in bovine species[J].Stem Cell Research &Therapy, 2019, 10(1):44.
[32] JUREK S, SANDHU M A, TRAPPE S, et al.Optimizing adipogenic transdifferentiation of bovine mesenchymal stem cells:A prominent role of ascorbic acid in FABP4 induction[J].Adipocyte, 2020, 9(1):35-50.
[33] LU T F, PEI W H, WANG K F, et al.In vitro culture and biological properties of broiler adipose-derived stem cells[J].Experimental and Therapeutic Medicine, 2018, 16(3):2399-2407.
[34] 王新霞, 汪以真.大黄鱼脂肪细胞体外培养方法:中国,CN102140439B[P].2013-05-01.WANG X X, WANG Y Z.Methods for in vitro culture of large yellow croaker adipocytes:China, CN102140439B[P].2013-05-01.
[35] 柯轶雄, 毛孝江, 任惠娟, 等.花鲈前脂肪细胞系的建立及油酸诱导分化[J].水生生物学报, 2024, 48(7):1102-1110.KE Y X, MAO X J, REN H J, et al.Establishment of a preadipocyte cell line of spotted sea bass(Lateolabrax maculatus) and oleic acid-induced differentiation[J].Acta Hydrobiologica Sinica, 2024, 48(7):1102-1110.
[36] 温加静. 罗非鱼前脂肪细胞传代培养模型的建立及诱导分化[D].上海:华东师范大学, 2019.WEN J J.Establishment of tilapia preadipocyte subculture model and induction of differentiation[D].Shanghai:East China Normal University, 2019.