皮肤衰老是人体衰老的一部分,主要表现为肌肤弹性下降、皱纹产生、色斑形成等现象[1]。多种内源性和外源性的因素会引起皮肤衰老,人体内过剩活性氧自由基(reactive oxygen species,ROS)的累积在皮肤衰老过程中起着关键性作用,可对皮肤细胞造成氧化损伤[2]。现有研究报道了具有抗氧化活性的功能成分如抗衰老多肽[1-2]、多糖[3]、多酚[4]、黄酮[5]等物质,能够有效清除皮肤细胞内过剩自由基,缓解细胞内氧化应激,对于延缓皮肤衰老具有重要意义。
阿胶(Colla Corii Asini,CCA)是由驴(Equus asinus L.)的干燥皮或鲜皮经加工制成的固体胶[6]。研究报道阿胶中富含的小分子肽对体外自由基和细胞胞内ROS均有一定的清除功能[7]。分子质量集中在400~1 000 Da 的小分子阿胶具有高占比的疏水性氨基酸、β-转角和无规卷曲结构,这可能与高抗氧化性密切相关[7]。阿胶糕以阿胶、桃仁、黑芝麻为主要原料,通过熬制加工而成,其原料芝麻和核桃仁含有众多抗氧化的功能性成分[8],如芝麻中木脂素类物质,代表性的有芝麻酚和芝麻素[9]。黑芝麻中的特征活性成分黑色素据报道表现出抗氧化、清除自由基、抗肿瘤、保肝、预防神经性疾病等多种药理保健活性[10]。现代研究证明阿胶具有抗衰老功效,阿胶可能通过增强抗氧化活性、清除自由基和调节衰老相关基因的表达等机制抑制衰老过程[11]。阿胶可以改善D-半乳糖诱导的模型小鼠的超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,降低丙二醛含量,并调节衰老相关基因表达[12]。
目前关于阿胶和阿胶糕抗皮肤衰老的功效研究部分集中在抗氧化方面,且抗氧化的测定主要基于体外生化方法[8,12]。从细胞水平上评价阿胶和阿胶糕抗皮肤衰老的功能,并且探索其抗衰老的机制已经成为新的研究热点。由于不同活性成分之间存在协同或拮抗作用,且不同活性成分在不同溶剂中的溶解性不同,不同极性溶剂提取对阿胶及阿胶糕中的活性物质含量、抗氧化活性和体内活性功能可能影响较大[13-14]。目前对于阿胶和阿胶糕不同极性溶剂提取物的活性功能成分、抗氧化活性和抗细胞衰老的相关性研究还未见报道。研究4种不同极性溶剂(水、乙醇、乙酸乙酯、正己烷)的阿胶和阿胶糕提取物,探究其改善人永生化表皮细胞(HaCaT)的生长状态、保护氧化应激损伤的HaCaT细胞以及清除自由基的作用。
1 材料与方法
1.1 材料及试剂
阿胶、桃花姬阿胶糕,东阿阿胶股份有限公司;人永生化表皮细胞HaCaT,上海誉弛生物科技有限公司;PBS、DEME培养基、胎牛血清、0.25%胰蛋白酶(质量分数),Gibco公司;CCK 8检测试剂盒、活性氧检测试剂盒,上海碧云天生物技术公司;细胞色素C(Mw 12 400 Da)、抑肽酶(Mw 6 511 Da)、杆菌肽(Mw 1 423 Da)、甘氨酸-甘氨酸-酪氨酸-精氨酸(GGYR,Mw 451 Da)、甘氨酸-甘氨酸-甘氨酸(GGG,Mw 189 Da)、抗坏血酸、DPPH、ABTS,上海源叶试剂试剂有限公司;乙腈、甲醇、正己烷、乙酸乙酯(色谱纯),国药集团化学试剂有限公司。
1.2 仪器与设备
SHJ-6A型数显磁力搅拌水浴锅,常州市亿能实验仪器厂;冷冻干燥机,美国 Labconco 公司;IKA RV8V旋转蒸发仪,上海莱睿科学仪器有限公司;L8 型紫外可见分光光度计,上海仪电分析仪器有限公司;Waters e2695 型高效液相色谱仪,美国Waters公司;Waters Atlantis C18 柱(4.6 mm×250 mm,5 μm)、氨基酸分析用色谱柱TSKgel G2000 SWXL(7.8 mm×300 mm),上海甄准生物科技有限公司;CO2培养箱,美国Thermo Scientific公司;1300系列Ⅱ级A2型生物安全柜,赛默飞世尔(苏州)仪器有限公司;M5 型多功能酶标仪,美国 Molecular Devices 公司;M205C 体视显微镜,德国Leica 公司。
1.3 实验方法
1.3.1 阿胶、阿胶糕提取物的制备
1.3.1.1 水提物制备
以料液比1∶20(g∶mL,下同)将称量好的阿胶和阿胶糕粉末加入到90 ℃蒸馏水中,提取3 h。提取结束后,4 000 r/min离心15 min后去除上清液,以料液比1∶10(g∶mL,下同)将沉淀物加入到90 ℃蒸馏水中,再重复提取1次。将2次离心后的上清液合并、减压浓缩,并收集浓缩液冷冻干燥。
1.3.1.2 醇提物制备
以料液比1∶20(g∶mL)将称量好的阿胶和阿胶糕粉末加入到体积分数为70%乙醇中,常温提取3 h。提取结束后,4 000 r/min离心15 min后去除上清液,以料液比1∶10(g∶mL)将沉淀物加入到体积分数为70%乙醇中,再重复提取1次。将2次离心后的上清液合并、减压浓缩,并收集浓缩液冷冻干燥。
1.3.1.3 乙酸乙酯提取物制备
以料液比1∶20将称量好的阿胶和阿胶糕粉末加入到乙酸乙酯中,常温提取3 h。提取结束后,4 000 r/min离心15 min后去上清液、旋转蒸发,于生物安全柜吹干烧瓶中残余液体的有机溶剂,备用。
1.3.1.4 正己烷提取物制备
以料液比1∶20将称量好的阿胶和阿胶糕粉末加入到正己烷中,常温提取3 h。提取结束后,4 000 r/min离心15 min后去上清液、旋转蒸发,于生物安全柜吹干烧瓶中残余液体的有机溶剂,备用。
1.3.2 阿胶糕提取物活性物质测定方法
1.3.2.1 阿胶糕中芝麻素、芝麻酚和黑色素含量测定
多酚和黄酮类物质是阿胶糕原料中的主要抗氧化功能性成分,芝麻素、芝麻酚和芝麻黑色素是黑芝麻的特征功能成分[8]。称取0.1 g冷冻干燥后的阿胶糕提取物粉末,以甲醇溶解并定容至10 mL,经0.22 μm有机滤膜过滤后高效液相色谱分析芝麻酚和芝麻素含量,参考罗自舒[9]的方法。芝麻酚色谱条件:柱温25 ℃;流动相A,含体积分数0.1%磷酸的超纯水;流动相B,乙腈;梯度洗脱程序:0~25 min,40%~95% B;流速1 mL/min;进样量10 μL;检测波长285 nm。芝麻素色谱条件:柱温30 ℃;流动相A,含体积分数0.1%磷酸的超纯水;流动相B,乙腈;梯度洗脱程序,0~25 min,20%~95% B;流速1 mL/min;进样量10 μL;检测波长292 nm。黑色素测定参考李杰等[10]的方法,测定不同浓度芝麻黑色素标准品溶液在470 nm下的吸光值,绘制标准曲线。取阿胶糕提取物溶液,于470 nm下测定其吸光度值,代入标准曲线计算。
1.3.2.2 阿胶糕总多酚和总黄酮含量测定
不同阿胶糕中总多酚和总黄酮含量测定方法参考于群[15]。称取0.1 g不同阿胶糕提取物,溶解并定容至10 mL,吸取没食子酸标准溶液或阿胶糕提取物溶液1 mL至比色管内,依次加入0.5 mL的1 mol/L福林酚反应5 min,2.0 mL的7.5% Na2CO3溶液(质量分数)于70 ℃下避光反应30 min。冷却后于750 nm下测定吸光值。绘制标准曲线,并计算阿胶糕样品中总酚含量,结果以每克阿胶糕中所含没食子酸当量(mg/g干重)表示。吸取芦丁标准溶液或阿胶糕提取物溶液1 mL至比色管内,依次加入0.5 mL的5% NaNO2溶液(质量分数)反应5 min,0.3 mL的10% Al(NO3)3溶液(质量分数)反应6 min,最后加入4 mL 1 mol/L NaOH溶液,以蒸馏水定容至10 mL。避光反应12 min后,测定510 nm下吸光度。绘制标准曲线,计算阿胶糕样品中总黄酮含量,结果以每克阿胶糕中所含芦丁当量(mg/g干重)表示。
1.3.3 阿胶、阿胶糕提取物氨基酸含量测定
氨基酸是阿胶的主要成分之一[6]。游离氨基酸的测定采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。通过高效液相色谱仪分析氨基酸组成。水解氨基酸测定参考王培宇[2],通过高效液相色谱仪分析氨基酸组成。
1.3.4 阿胶、阿胶糕提取物相对分子质量测定
适当的低分子质量肽有利于阿胶的抗氧化活性产生[7]。通过高效液相色谱法来测定样品的分子质量,测定方法参考樊雨梅等[6]。以细胞色素C(Mw12 400 Da)、抑肽酶(Mw 6 511 Da)、杆菌肽(Mw 1 423 Da)、甘氨酸-甘氨酸-酪氨酸-精氨酸(GGYR,Mw 451 Da)、甘氨酸-甘氨酸-甘氨酸(GGG,Mw 189 Da)为标准品。流动相条件设置为:柱温25 ℃,V(乙腈)∶V(三氟乙酸,trifluoroacetic acid,TFA)∶V(水)=40∶0.1∶59.9,检测波长220 nm,流速0.5 mL/min。通过标准曲线计算得到不同阿胶/阿胶糕样品的分子质量分布。
1.3.5 阿胶、阿胶糕提取物体外抗氧化能力测定
1.3.5.1 ABTS阳离子自由基清除能力
测定方法参考于群[15]。取0.5 mL不同提取液,加入2 mL ABTS工作液,摇匀后在避光条件下反应10 min,在波长734 nm下测定提取液的吸光度,记为Ax;无水乙醇代替Ax管中ABTS工作液,记为Ax0管;无水乙醇代替Ax管中提取液,记为A01管,按公式(1)计算ABTS阳离子自由基清除率。同时,绘制芦丁浓度对ABTS阳离子自由基清除率的标准曲线,最终结果表示为(μg Trolox/mL)。
ABTS阳离子自由基清除率![]()
(1)
式中:Ax,提取液的吸光值;Ax0,提取液和乙醇的吸光值;A01,ABTS和乙醇的吸光值。
1.3.5.2 DPPH自由基清除能力
测定方法参考王培宇[2]。在517 nm处测定吸光度,无水乙醇调零。吸光度A1:1 mL样品+3 mL DPPH;吸光度A2:1 mL无水乙醇+3 mL DPPH;吸光度A0:1 mL样品+3 mL无水乙醇,混匀后均需室温避光反应0.5 h。清除率按公式(2)计算。配制10、20、30、40、50 μg/mL Trolox,以浓度为横坐标,DPPH自由基清除率(%)为纵坐标绘制标准曲线,最终结果表示为(μg Trolox/mL)。
DPPH自由基清除率![]()
(2)
式中:A1,提取液的吸光值;A0,提取液和乙醇的吸光值;A2,DPPH和乙醇的吸光值。
1.3.5.3 羟自由基(·OH)清除能力
测定方法参考王培宇[2]。取0.1 mL提取液,依次加入0.3 mL 8 mmol/L的FeSO4溶液,0.25 mL 20 mmol/L H2O2,混合均匀后置于37 ℃水浴锅中反应30 min。取1 mL水杨酸与上述溶液反应5 min,随后在3 500 r/min下离心5 min,取上清液在510 nm下测定其吸光值,按公式(3)计算羟自由基清除率。同时,以抗坏血酸浓度为横坐标,羟自由基清除率(%)为纵坐标绘制标准曲线,最终结果表示为(μg 抗坏血酸/mL)
羟自由基清除率![]()
(3)
式中:Ax,样品的吸光值;Ax0,样品和乙醇的吸光值;A02,对照组的吸光值。
1.3.5.4 超氧阴离子自由基清除能力
测定方法参考王培宇[2]。取0.05 mol/L pH 8.2的Tris-HCl缓冲溶液4.5 mL,置于25 ℃水浴中预热20 min,分别加入1 mL不同浓度的样品溶液和0.5 mL 25 mmol/L邻苯三酚溶液,混匀后测定325 nm处的吸光值,每隔30 s记录依次,并以吸光度-时间作图,求直线斜率即为提取物抑制邻苯三酚自氧化的速率(Vs),以蒸馏水为对照得到速率V0,清除率计算如公式(4)所示:
超氧阴离子自由基清除率![]()
(4)
式中:VS,提取物抑制邻苯三酚自氧化的速率;V0,以蒸馏水为对照得到速率。
1.3.6 HaCaT细胞衰老模型建立
1.3.6.1 细胞复苏与培养
HaCaT细胞复苏后,转移至25 cm2无菌细胞培养瓶中,并加入含有10%胎牛血清(质量分数)和1%双抗(质量分数)的DMEM完全培养基,置于37 ℃、5.0% CO2条件下的恒温细胞培养箱培养,待细胞培养融合至80%左右进行传代,细胞传代3~4代后使用。
1.3.6.2 H2O2浓度筛选
衰老模型建立参考苏小明等[16]的方法。将HaCaT细胞接种于6孔板,于37 ℃、5% CO2培养箱中培养12 h使其贴壁。吸出废旧液体,对照组给予2 mL DMEM培养基,H2O2模型组加入2 mL含不同浓度H2O2的培养基(0.3、0.5、0.7、0.9、1.1 mmol/L),细胞培养箱中(5% CO2、37 ℃)处理4 h,吸出废旧液体,加入PBS进行二次清洗,加入DMEM培养基。观察细胞形态,并采用CCK-8试剂盒测定细胞存活率,确定合适的H2O2浓度。
1.3.7 提取物对HaCaT细胞的影响
1.3.7.1 细胞活力的测定
不同阿胶和阿胶糕提取物对细胞活力的测定方法参考孙睿[1]。将HaCaT细胞接种于96孔板,于37 ℃、5% CO2培养箱中培养12 h使其贴壁。吸出废旧液体,对照组给予100 μL DMEM培养基,处理组每孔加入100 μL以DMEM为溶剂配制的阿胶和阿胶糕提取物,质量浓度设置为25、50、100、200、400 μg/L,置于5% CO2、37 ℃的培养箱中继续孵育24 h,采用CCK-8法,以公式(5)计算不同浓度的阿胶和阿胶糕提取物对HaCaT细胞活力的作用。
细胞存活率![]()
(5)
式中:As,样品组(含有细胞的培养基、CCK-8、样品)的吸光值;Ac,对照孔(含有细胞的培养基、CCK-8、不含样品)的吸光值;Ab,空白孔(不含细胞和样品的培养基、CCK-8)的吸光值。
1.3.7.2 损伤细胞保护能力的测定
不同提取物对损伤细胞的保护能力参考苏小明等[16]的方法。将HaCaT细胞接种于96孔板,于37 ℃、5% CO2培养箱中培养12 h使其贴壁。吸出废旧液体,设置H2O2诱导组、H2O2诱导加样品组(处理组)、H2O2诱导加抗坏血酸组(阳性对照),以及仅含细胞的空白对照组。H2O2诱导组和空白对照组给予100 μL DMEM培养基,处理组和阳性对照组每孔加入100 μL以DMEM为溶剂配制的提取物或抗坏血酸,置于5% CO2、37 ℃的培养箱中继续孵育24 h。不换液,H2O2诱导组、处理组和阳性对照组每孔加入100 μL浓度为700 μmol/L H2O2,空白对照组每孔给予100 μL DMEM培养基。H2O2诱导处理4 h后,去除旧液,PBS清洗1次后,采用CCK-8法分析不同浓度的阿胶和阿胶糕提取物对HaCaT细胞损伤的保护作用,计算如公式(5)所示。
1.3.7.3 ROS测定
ROS测定方法参考孙睿[1]。HaCaT细胞诱导组和处理组以1.3.7.2节中步骤处理。采用ROS检测试剂盒,配制含 2′,7′-二氯荧光黄二乙酸盐(2′,7′-dichlorofluorescin dilacerate,DCFH-DA)荧光探针的培养基,37 ℃避光孵育20 min,用PBS冲洗细胞3次,在激发波长488 nm、发射波长525 nm的条件下,用荧光酶标仪定量检测细胞内ROS的荧光强度。测定不同质量浓度的阿胶和阿胶糕提取物对HaCaT细胞内自由基的清除能力,如公式(6)所示。
ROS清除率![]()
(6)
式中:As1,样品组(含有处理组细胞的培养基、荧光探针、样品)的荧光强度;Ab,空白对照组(含有未经H2O2诱导细胞的培养基、荧光探针、不含样品)的荧光强度;Ac,诱导组(含有H2O2诱导细胞的培养基、荧光探针、不含样品)的荧光强度。
1.3.7.4 细胞形态观察
将HaCaT细胞以细胞密度为1×105个/孔接种于24孔板中,培养至贴壁后分别加入含不同质量浓度提取物(25、50、100、200、400 μg/mL),继续培养24 h,以H2O2诱导处理4 h后,去除旧液,加入100 μL DMEM培养基,置于光学显微镜下观察细胞形态。
1.3.8 数据处理
实验重复测定3次,结果用“平均值±标准偏差”表示。采用Origin 2022软件绘图,SPSS 20.0,进行显著性分析。
2 结果与分析
2.1 阿胶提取物和阿胶糕提取物的功能活性成分
2.1.1 阿胶糕功能活性成分
阿胶糕的主要原料芝麻中含有众多抗氧化的功能性成分,对阿胶糕不同极性溶剂提取物中功能成分含量进行测定,如表1所示。相比其他极性溶剂的提取物,体积分数为70%乙醇溶液最有利于阿胶糕中多酚类物质的溶出,阿胶糕醇提物中总酚、总黄酮和芝麻黑色素含量最高,且芝麻中天然有机酚类化合物芝麻酚仅在阿胶糕醇提物中检测得到。芝麻中典型的功能活性成分芝麻素仅在阿胶糕的水提和醇提物中检测得到,且阿胶糕醇提物中芝麻素含量显著高于阿胶糕水提物(P<0.05)。这可能是由于相似相溶的原理以及不同提取溶剂的结构、性质等不同,乙醇的羟基官能团能够与芝麻中酚类物质形成氢键,加强了其在乙醇中的溶解能力[17]。相比之下,其他溶剂可能因为极性差异较大或者与多酚类物质的相互作用较弱,溶解度低。
表1 阿胶糕不同溶剂提取物中活性成分含量测定
Table 1 Determination of the content of active ingredients in different polar solvent extracts of Ejiao cake
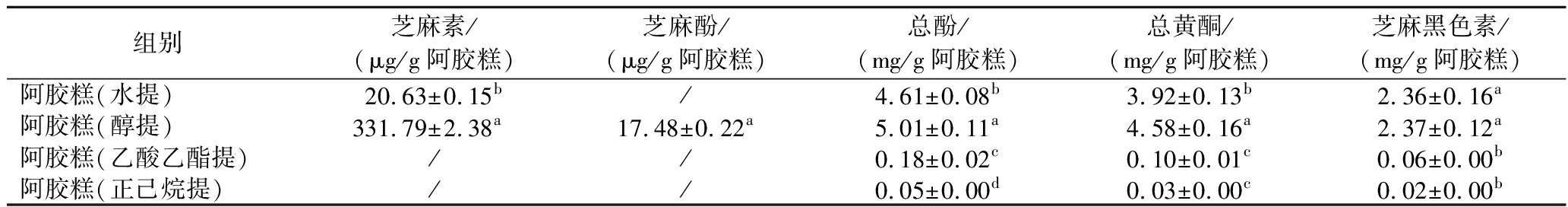
组别芝麻素/(μg/g阿胶糕)芝麻酚/(μg/g阿胶糕)总酚/(mg/g阿胶糕)总黄酮/(mg/g阿胶糕)芝麻黑色素/(mg/g阿胶糕)阿胶糕(水提)20.63±0.15b/4.61±0.08b3.92±0.13b2.36±0.16a阿胶糕(醇提)331.79±2.38a17.48±0.22a5.01±0.11a4.58±0.16a2.37±0.12a阿胶糕(乙酸乙酯提)//0.18±0.02c0.10±0.01c0.06±0.00b阿胶糕(正己烷提)//0.05±0.00d0.03±0.00c0.02±0.00b
注:同一列中不同字母表示具有显著性差异(P<0.05)。
2.1.2 阿胶提取物和阿胶糕提取物氨基酸组成分析
2.1.2.1 水解氨基酸
阿胶和阿胶糕中富含多种具有抗氧化功能活性的氨基酸,对阿胶和阿胶糕的醇提物进行水解氨基酸组成的分析,结果如图1-a所示。在阿胶和阿胶糕的醇提物中,氨基酸组成中含量最高的均为甘氨酸(Gly),其次是谷氨酸(Glu)、脯氨酸(Pro)、丙氨酸(Ala)和精氨酸(Arg),这与曹菲薇[8]报道一致。阿胶和阿胶糕的醇提物中Ala、Pro、Glu 3种氨基酸的含量分别占总氨基酸含量的36.67%和40.85%。相关研究表明疏水性氨基酸Ala、Pro可以使肽段更好地溶解于脂相中,便于与自由基互作,从而使肽段抑制脂质过氧化的能力增强[18]。酸性氨基酸Glu则通过含有电荷的侧基与金属离子形成络合物,达到螯合金属离子,提高抗氧化的效果[19]。疏水性氨基酸Ala、Pro、Glu含量越高,抗氧化性越强[19]。这表明阿胶糕的醇提物相比阿胶具有更高的抗氧化活性氨基酸占比。
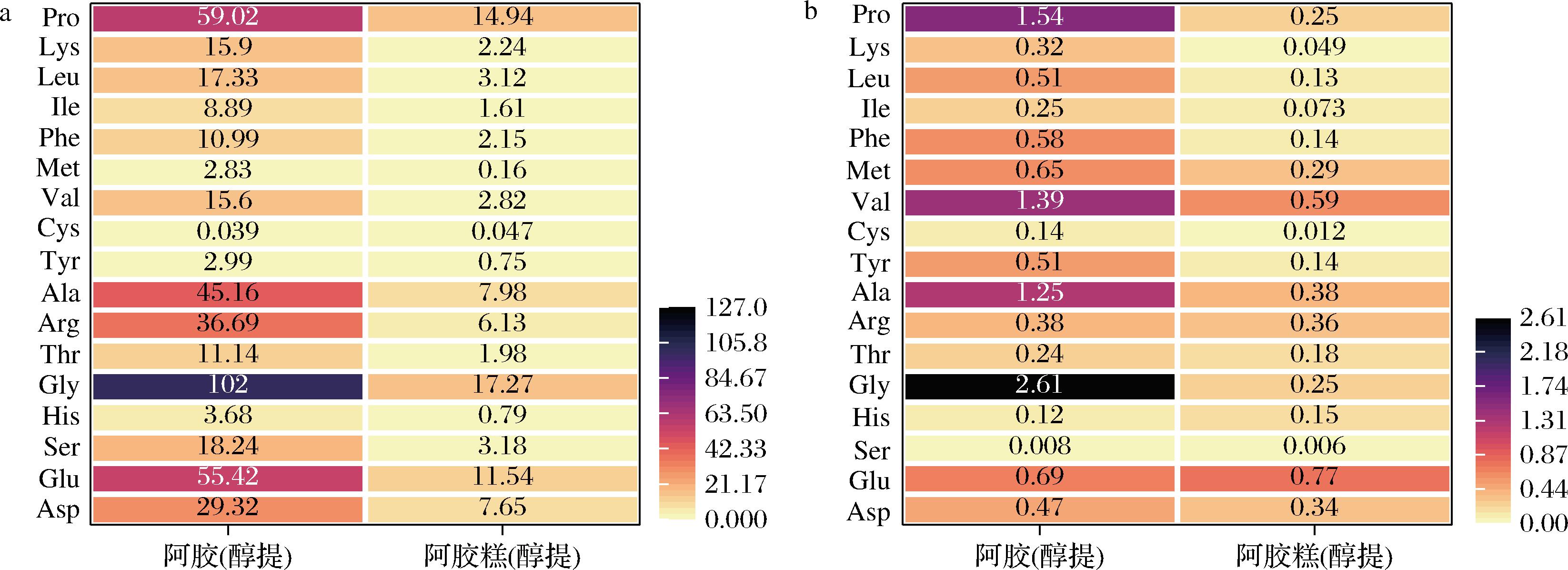
a-水解氨基酸含量;b-游离氨基酸含量
图1 阿胶和阿胶糕醇提取物的水解和游离氨基酸含量
Fig.1 Hydrolyzed amino acid and free amino acid content of different solvent extracts of Colla Corii Asini and Ejiao cake
注:上述氨基酸含量单位均为:mg/g提取物。
2.1.2.2 游离氨基酸
对阿胶和阿胶糕醇提物中的游离氨基酸组成进行分析,结果如图1-b所示。氨基酸组成中含量较高的氨基酸有甘氨酸、脯氨酸、丙氨酸和缬氨酸。His、Tyr、Cys和Met等氨基酸具有抗氧化活性[6],阿胶和阿胶糕醇提物中,His、Tyr、Cys和Met四种氨基酸的总含量分别占总氨基酸含量的12.19%和14.41%。因此,阿胶糕醇提物中具有抗氧化活性的氨基酸含量占比高于对应的阿胶提取物。
2.1.3 阿胶提取物和阿胶糕提取物相对分子质量分布
适当分子质量的肽与阿胶抗氧化性的产生有关。不同极性溶剂提取的阿胶和阿胶糕表现出不同的相对分子质量分布,结果如表2所示。阿胶和阿胶糕醇提物中相对分子质量小于500 Da的肽分别占总量的15.39%和36.43%。因此,阿胶糕的醇提物相比阿胶醇提物具有更多的小分子肽。文献报道分子质量集中在400~1 000 Da 的小分子阿胶具有高占比的疏水性氨基酸、β-转角和无规卷曲结构,这可能与其高抗氧化性密切相关[7]。
表2 阿胶和阿胶糕醇提物的相对分子质量分布
Table 2 Relative molecular mass distribution of different solvent extracts of Colla Corii Asini and Ejiao cake

分子质量范围/Da≥5 0003 000^<5 0002 000^<3 0001 000^<2 000500^<1 000180^<500<180阿胶(醇提)/%33.7916.5710.9613.579.717.77.69阿胶糕(醇提)/%2811.757.69.366.879.427.03
2.2 阿胶提取物和阿胶糕提取物的体外抗氧化效果
阿胶和阿胶糕提取物的体外抗氧化效果如图2所示。图2-a表明阿胶水提物对羟自由基的清除能力最强,其次为阿胶醇提物和阿胶乙酸乙酯提取物。图2-b表明阿胶水提物和醇提物以及阿胶糕水提物和醇提物清除ABTS阳离子自由基的能力最强。图2-c表明阿胶糕的醇提物清除DPPH自由基的能力最强,其次为阿胶醇提物和阿胶糕水提物。图2-d表明阿胶糕的醇提物对超氧阴离子自由基的清除能力最强,其次是阿胶醇提物和阿胶糕水提物。阿胶糕的醇提物相比其他极性溶剂提取物具有更强的ABTS阳离子自由基、DPPH自由基以及超氧阴离子自由基清除作用,这可能是由于体积分数为70%乙醇溶液相比其他溶剂(水、正己烷、乙酸乙酯)最有利于阿胶糕中多酚类物质的溶出,增强了功能活性成分芝麻素、芝麻素和芝麻黑色素的溶解度,而且体积分数为70%乙醇溶液相比热水可能更有利于提高提取物中的高抗氧化活性氨基酸占比和小分子肽的含量。宋亚静等[13]报道总多酚与DPPH自由基、羟自由基清除能力呈极显著相关。张成栋等[14]报道紫花亚菊70%乙醇提取物对肿瘤细胞活性具有显著抑制作用,而水提物的抑制作用较弱。
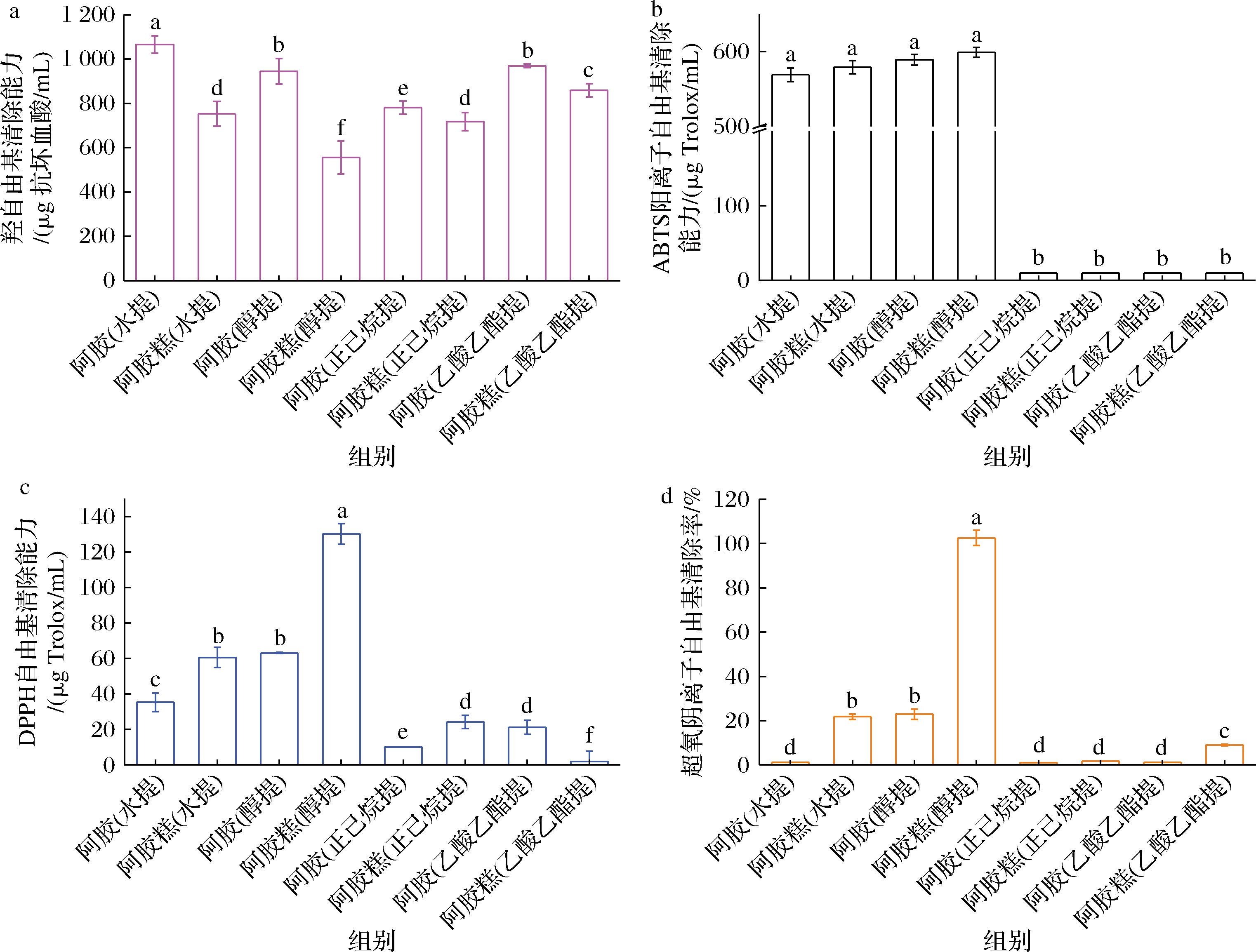
a-羟自由基;b-ABTS阳离子自由基;c-DPPH自由基;d-超氧阴离子自由基
图2 阿胶与阿胶糕不同溶剂提取物的抗氧效果
Fig.2 Antioxidant capacity of different solvent extracts of Colla Corii Asini and Ejiao cake
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 阿胶提取物和阿胶糕提取物对HaCaT细胞活力的影响
细胞活力实验能够筛选出对待测样品无细胞毒性的合适浓度,利用CCK-8检测阿胶提取物和阿胶糕提取物对HaCaT细胞活力的影响,结果如图3所示。阿胶水提物(图3-a)、醇提物(图3-c)和乙酸乙酯提取物(图3-g),以及阿胶糕的醇提物(图3-d)和正己烷提取物(图3-f)在25~400 μg/mL对HaCaT细胞作用24 h后,细胞存活率接近100%。阿胶正己烷提取物(图3-e),阿胶糕的水提物(图3-b)和乙酸乙酯提取物(图3-h)在质量浓度100 μg/mL时细胞存活率最大达到120%,具有促进HaCaT细胞增殖的能力,在其他质量浓度下细胞存活率接近100%。因此,所选择浓度范围内的阿胶或阿胶糕的提取物对细胞活力没有毒害作用,可用于后续实验。樊雨梅等[6]报道10 g/L的阿胶水提物对成纤维细胞无毒性作用,且可显著促进成纤维细胞增殖。

a-阿胶水提物;b-阿胶糕水提物;c-阿胶醇提物;d-阿胶糕醇提物;e-阿胶正己烷提取物;f-阿胶糕正己烷提取物;g-阿胶乙酸乙酯提取物;h-阿胶糕乙酸乙酯提取物
图3 阿胶与阿胶糕不同溶剂提取物对HaCaT细胞活力的影响
Fig.3 Effects of different solvent extracts of Colla Corii Asini and Ejiao cake on the viability of HaCaT cells
2.4 阿胶提取物和阿胶糕提取物对HaCaT细胞损伤的保护作用
2.4.1 衰老模型的构建
利用H2O2作用于细胞诱导其发生氧化应激,构建细胞衰老模型。以700 μmol/L H2O2作用HaCaT细胞4 h建立氧化应激模型,拍照并测定细胞活力,结果如图4所示。由图4-a可知,不同浓度(200、300、400、500、600、700、900、1 100 μmol/L)的H2O2导致HaCaT细胞活力下降,且呈浓度依赖性的趋势(P<0.05),在700 μmol/L H2O2处理后,细胞存活率降低了58%,这与苏小明等[16]的报道一致。由图4-b可知,H2O2模型组视野可明显看到死细胞漂浮和细胞碎片增多等现象,细胞形态出现异常的形态变化,如细胞皱缩,细胞形状不规则且连接不紧密,培养液中细胞碎片增多。因此,700 μmol/L H2O2处理能够诱导细胞氧化应激,表现为细胞活力下降,细胞形态发生改变,选用此浓度下的H2O2建立衰老模型。
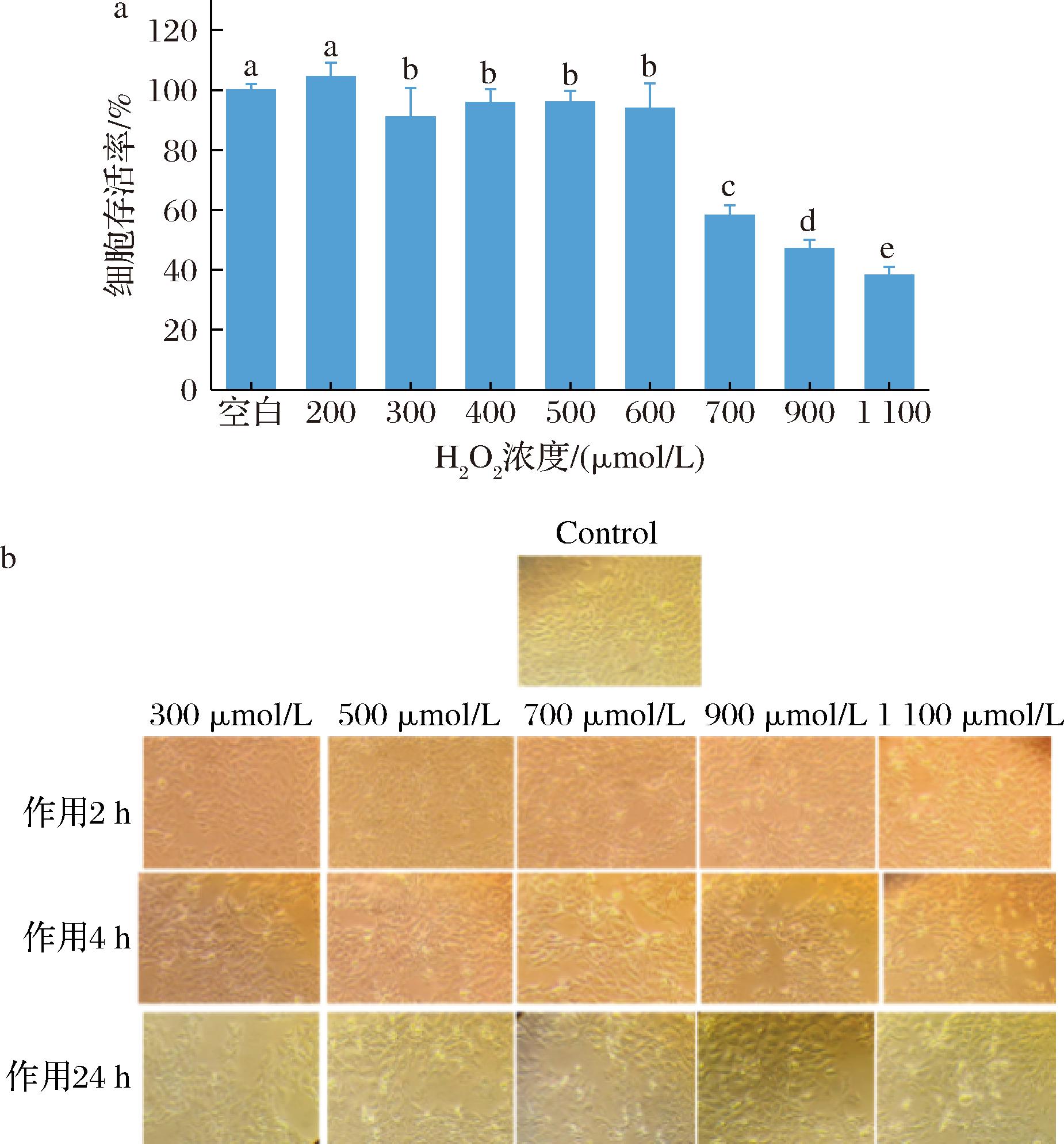
a-HaCaT细胞活力;b-细胞形态
图4 H2O2浓度对HaCaT细胞活力和细胞形态的影响
Fig.4 Effect of H2O2concentration on the viability and morphology of HaCaT cells
2.4.2 损伤保护作用
阿胶和阿胶糕提取物作用HaCaT细胞24 h后,以H2O2诱导细胞损伤,细胞存活率反映了不同提取物对H2O2诱导的损伤细胞的保护作用,以常用抗氧化剂抗坏血酸为阳性对照,结果如图5所示。不同浓度的阿胶和阿胶糕提取物作用于损伤细胞,细胞活力呈现出先上升再降低的趋势。由图5-d可知,在25~400 μg/mL阿胶糕醇提物作用下,细胞活力相比诱导组显著升高(P<0.05),且200 μg/mL阿胶和阿胶醇提物作用下的细胞分别达到最高存活率(84.16±3.21)%和(90.99±3.14)%,略高于阳性对照组的细胞存活率[(89.02±4.68%)],阿胶糕的醇提物对H2O2诱导损伤的HaCaT细胞的保护作用强于阿胶醇提物。此外,对于阿胶糕的水提物、正己烷提取物、乙酸乙酯提取物,损伤细胞的存活率最高达到(83.85±2.43)%、(82.55±3.09)%和(83.15±4.11)%;在阿胶的水提物、正己烷提取物和乙酸乙酯提取物的作用下,细胞存活率最高达到(75.08±2.73)%、(83.09±1.60)%和(83.15±3.11)%。因此,相比其他极性溶剂提取物,阿胶糕醇提物对损伤的HaCaT细胞具有更强的保护作用。王培宇[2]研究表明,在0.6 mg/mL酶解制备的南瓜籽多肽作用于细胞24 h,H2O2诱导损伤的HSF细胞存活率最高达到84.66%。陈舜让等[3]研究表明,50 μg/mL铁皮石斛多糖作用下损伤HaCaT细胞的相对存活率恢复至90.14%。

a-阿胶水提物;b-阿胶糕水提物;c-阿胶醇提物;d-阿胶糕醇提物;e-阿胶正己烷提取物;f-阿胶糕正己烷提取物;g-阿胶乙酸乙酯提取物;h-阿胶糕乙酸乙酯提取物
图5 阿胶与阿胶糕不同溶剂提取物对H2O2诱导损伤的HaCaT细胞的保护作用
Fig.5 Protective effects of different solvent extracts of Colla Corii Asini and Ejiao cake on H2O2-induced injury of HaCaT cells
2.5 阿胶和阿胶糕提取物对HaCaT细胞内ROS水平的影响
ROS是一种具有强生物活性的自由基,其过量会加速皮肤衰老的进程。利用2,7-二氯二氢荧光素二乙酸酯荧光素检测细胞内ROS水平,以抗坏血酸为阳性对照,结果如图6所示。由图6-d可知,与诱导组相比,200 μg/mL阿胶糕醇提物处理后细胞内ROS水平降低了(41.83±2.81)%,阳性对照降低了(38.25±2.5)%。与阿胶糕醇提物相比,200 μg/mL阿胶醇提物作用下,细胞内ROS相比诱导组最高降低(28.41±2.06)%。图6-b、图6-f和图6-h表明阿胶糕的水提物作用的细胞内ROS相比诱导组降低(27.44±2.94)%,其降幅高于正己烷提取物和乙酸乙酯提取物组[(25.69±2.56)%和(20.71±2.87)%]。图6-a、图6-e和图6-g也表明阿胶水提物相较正己烷提取物和乙酸乙酯提取物组具有更低的细胞内ROS水平,相比诱导组,3组ROS水平分别最大降低(28.54±2.62)%、(23.62±3.34)%和(22.82±3.00)%。因此,在200 μg/mL阿胶糕的醇提物作用下,损伤细胞内的自由基水平最低。这说明阿胶糕醇提物通过清除细胞内过量的ROS,从而减轻其对细胞的损伤,实现对H2O2诱导损伤细胞的保护作用[1]。王培宇[2]研究表明,0.3 mg/mL酶解南瓜籽多肽作用于氧化应激细胞24 h后,荧光强度相较于模型组降低0.71倍。陈慧等[4]研究表明,月见草素B可显著降低HaCaT细胞内ROS水平,表明多酚对UVB诱导的氧化应激的抑制作用。
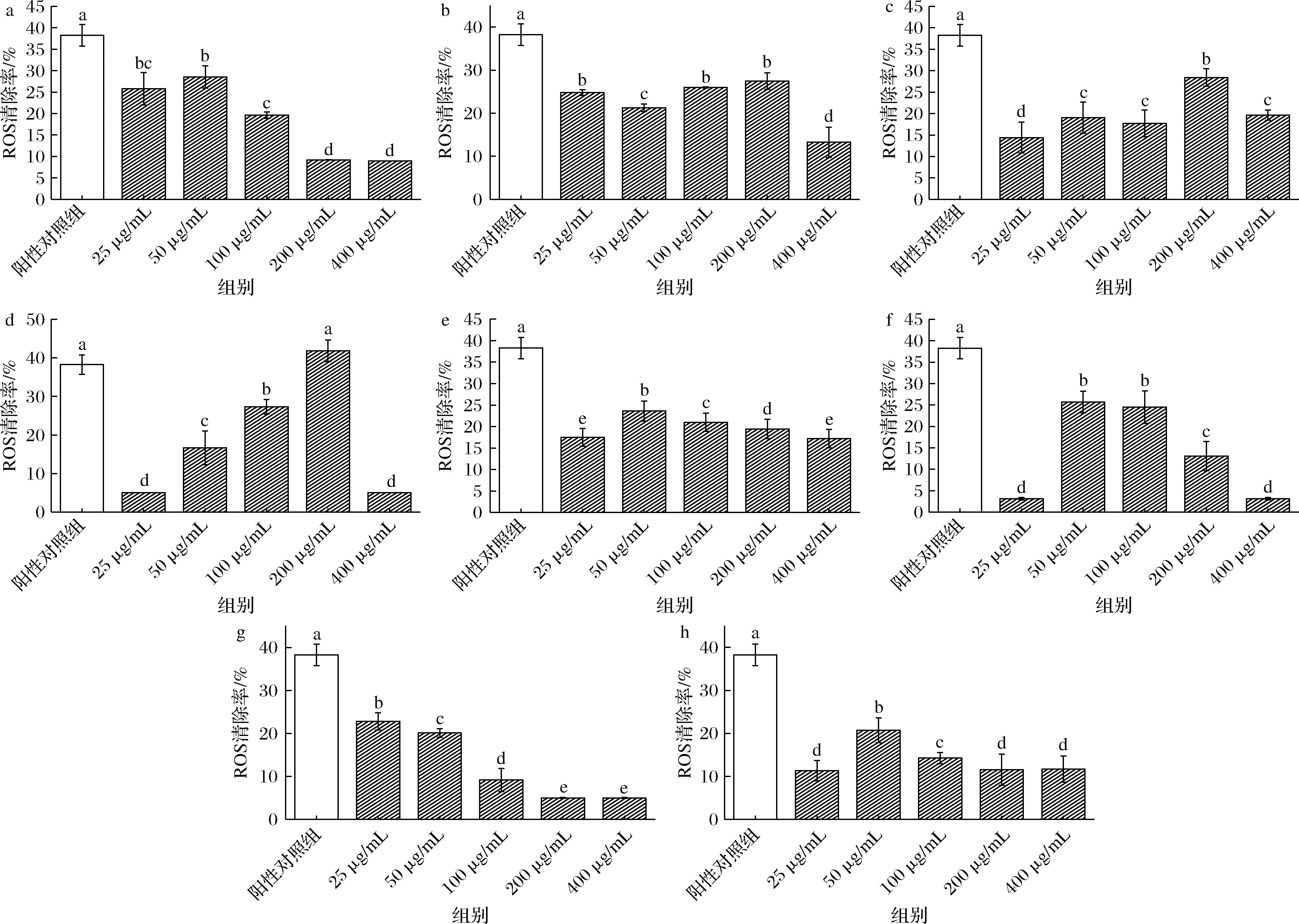
a-阿胶水提物;b-阿胶糕水提物;c-阿胶醇提物;d-阿胶糕醇提物;e-阿胶正己烷提取物;f-阿胶糕正己烷提取物;g-阿胶乙酸乙酯提取物;h-阿胶糕乙酸乙酯提取物
图6 阿胶与阿胶糕不同溶剂提取物对H2O2诱导损伤的HaCaT细胞内ROS的清除效果
Fig.6 Scavenging effect of extracts of Colla Corii Asini and Ejiao cake on ROS in H2O2-induced damaged HaCaT cells
2.6 阿胶和阿胶糕提取物对HaCaT形态的影响
阿胶和阿胶糕醇提物对诱导损伤的HaCaT形态影响如图7所示。诱导组细胞经700 μmol/L H2O2处理4 h后,视野内看到细胞分散亮点增多,细胞扁平宽大且排列无序,表明大部分细胞失去HaCaT细胞的典型特征。200 μg/mL阿胶和阿胶糕醇提物处理后,视野内细胞分散亮点减少,漂浮死细胞较少,细胞排列规则且有序,正常形态的细胞数目较多,说明200 μg/mL阿胶糕醇提物处理有利于减少H2O2导致的氧化应激损伤,维持细胞的正常形态,这一结果也与阿胶糕醇提物对损伤细胞的保护作用一致。王培宇[2]研究表明0.6 mg/mL酶解南瓜籽多肽有利于维持氧化应激损伤HSF细胞的正常形态,且细胞活力相比模型组提高。

a-对照;b-诱导组细胞;c-阳性对照组细胞;d1-50 μg/mL阿胶醇提物;e1-100 μg/mL阿胶醇提物;f1-200 μg/mL阿胶醇提物;d2-50 μg/mL阿胶糕醇提物;e2-100 μg/mL阿胶糕醇提物;f2-200 μg/mL阿胶糕醇提物;
图7 阿胶与阿胶糕醇提物对H2O2诱导损伤的HaCaT细胞形态的影响
Fig.7 Effects of Colla Corii Asini and Ejiao cake alcohol extracts on H2O2-induced injury of HaCaT cell morphology
3 结论与讨论
比较阿胶和阿胶糕不同极性溶剂提取物的体外抗氧化活性和对损伤HaCaT细胞的保护能力差异。相比水、正己烷和乙酸乙酯,70%乙醇提取更有利于阿胶糕中多酚类活性物质的溶出。相比阿胶醇提物,阿胶糕醇提物表现出更小的肽段分子质量分布和更高的抗氧化活性氨基酸占比,说明阿胶糕醇提物具有良好的抗氧化基础,这可能与其清除ABTS阳离子自由基、DPPH自由基、羟自由基和超氧阴离子自由基的能力有关。与诱导组相比,200 μg/mL阿胶和阿胶糕醇提物处理后,损伤HaCaT细胞存活率分别提高了34.98%和45.94%,表现出保护作用。阿胶糕醇提物的损伤保护作用可能与清除细胞内ROS能力有关。相比诱导组,200 μg/mL阿胶和阿胶糕醇提物处理后细胞内ROS水平分别降低了(28.41±2.06)%和(41.83±2.81)%。因此,阿胶糕醇提物相比其他提取物表现出最强的抗氧化作用、损伤细胞保护作用以及清除胞内自由基作用。实验结果不仅为下一阶段阿胶和阿胶糕抗氧化分子机制研究奠定了良好的基础,也为阿胶相关抗氧化保健食品和方便食品的开发利用提供了一定的理论支持。
[1] 孙睿. 寡肽类化合物抗皮肤衰老的机制研究[D].济南:齐鲁工业大学,2023.SUN R.Study on the mechanism of oligopeptide compounds against skin aging[D].Jinan:Qilu University of Technology, 2023.
[2] 王培宇.南瓜籽多肽制备及其抗衰老作用研究[D].无锡:江南大学,2020.WANG P Y.Study on preparation of pumpkin seed peptides and their anti-aging effect[D].Wuxi:Jiangnan University, 2020.
[3] 陈舜让, 付云芸, 陈泳斯, 等.铁皮石斛多糖对H2O2损伤HaCaT细胞的保护作用[J].今日药学, 2021, 31(6):429-432.CHEN S R, FU Y Y, CHEN Y S, et al.The protection effect of Dendrobium officinale polysaccharides on H2O2-induced oxidative stress in HaCaT cells[J].Pharmacy Today, 2021, 31(6):429-432.
[4] 陈慧, 彭雨欣, 徐莹皓, 等.SIRT3多酚激活剂的抗细胞氧化应激作用及机制[J].中国食品学报, 2022, 22(1):12-20.CHEN H, PENG Y X, XU Y H, et al.Inhibitive effects of SIRT3-augmenting polyphenols on cellular oxidative stress[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(1):12-20.
[5] 石浩, 王仁才, 吴小燕, 等.软枣猕猴桃黄酮对过氧化氢诱导HaCaT细胞损伤的保护作用[J].食品科学, 2018, 39(13):229-234.SHI H, WANG R C, WU X Y, et al.Protective effect of Actinidia arguta flavonoid on hydrogen peroxide-induced injury in HaCaT cells[J].Food Science, 2018, 39(13):229-234.
[6] 樊雨梅, 汝文文, 史传超, 等.阿胶低聚肽的成分分析及其抗氧化活性[J].食品工业科技, 2020, 41(18):314-318; 323.FAN Y M, RU W W, SHI C C, et al.Composition and its antioxidant activity of Colla corii asini oligopeptides[J].Science and Technology of Food Industry, 2020, 41(18):314-318; 323.
[7] 杜博玮, 徐晓冰, 郭尚伟, 等.高抗氧化性小分子阿胶的研究[J].北京化工大学学报(自然科学版), 2019, 46(6):15-20.DU B W, XU X B, GUO S W, et al.Preparation of a high-antioxidant hydrolysate from Colla corii asini[J].Journal of Beijing University of Chemical Technology (Natural Science Edition), 2019, 46(6):15-20.
[8] 曹菲薇. 阿胶糕及其主要原料阿胶的抗氧化作用及机理研究[D].杭州:浙江大学,2019.CAO F W.Antioxidant effects and its mechanism of Ejiao cake and its main raw material Colla Corii Asini[D].Hangzhou:Zhejiang University, 2019.
[9] 罗自舒. 黑芝麻特征营养成分分析及VE含量候选基因鉴定[D].北京:中国农业科学院,2023.LUO Z S.Analysis of characteristic nutrients of black sesame and identification of candidate genes for VE content[D].Beijing:Chinese academy of agricultural sciences, 2023.
[10] 李杰, 贾栩超, 张瑞芬, 等.黑芝麻黑色素的分离纯化、结构表征及体外抗氧化活性[J].中国农业科学, 2020, 53(12):2477-2492.LI J, JIA X C, ZHANG R F, et al.Isolation, structural characterization and antioxidant activity of black sesame melanin[J].Scientia Agricultura Sinica, 2020, 53(12):2477-2492.
[11] 曲媛鑫, 付英杰.阿胶化学成分、质量控制及药理作用研究进展[J].特产研究, 2023, 45(3):136-143.QU Y X, FU Y J.Advances in chemical constituents, quality control and pharmacological effects of asini corii Colla[J].Special Wild Economic Animal and Plant Research, 2023, 45(3):136-143.
[12] 姜一朴, 邸志权, 王延涛, 等.小分子阿胶抗疲劳、抗氧化及止血作用研究[J].中国药理学通报, 2019, 35(2):203-208.JIANG Y P, DI Z Q, WANG Y T, et al.Study on anti-fatigue, anti-oxidative and hemostatic effects of small molecule Asini Corii Colla[J].Chinese Pharmacological Bulletin, 2019, 35(2):203-208.
[13] 宋亚静, 林前锦, 吴妍欣, 等.茭白提取物及不同溶剂萃取物的抗氧化活性研究[J].粮食与油脂, 2023, 36(11):138-143.SONG Y J, LIN Q J, WU Y X, et al.Study on the antioxidant activity of extracts of Zizania latifolia and extracts from different solvents[J].Cereals &Oils, 2023, 36(11):138-143.
[14] 张成栋, 樊晓俞, 李丽宁, 等.紫花亚菊不同溶剂提取物对肿瘤细胞活性的影响[J].西藏医药, 2024,45(1):152-154.ZHANG C D, FAN X Y, LI L N, et al.Effects of different solvent extracts from Echinacea purpurea on tumor cell activity[J].Tibetan Medical Journal, 2024,45(1):152-154.
[15] 于群. 芦笋多酚结合热加工抑制酪氨酸酶活性的研究[D].无锡:江南大学,2021.YU Q.Study on asparagus polyphenols combined with thermal processing to inhibit tyrosinase activity[D].Wuxi:Jiangnan University, 2021.
[16] 苏小明, 王岳杨, 徐铭晨, 等.五味子丙素对H2O2诱导的HaCaT细胞衰老作用的影响及机制[J].解放军医学杂志, 2021, 46(3):221-230.SU X M, WANG Y Y, XU M C, et al.Anti-aging effects of schisandrin C on H2O2-induced HaCaT[J].Medical Journal of Chinese PLA, 2021, 46(3):221-230.
[17] 刘润华. 芝麻提取物对高脂模型诱导的小鼠肥胖的干预作用及机制研究[D].杨凌:西北农林科技大学,2018.LIU R H.Study on the intervention effect and mechanism of sesame extract on obesity induced by high fat model in mice[D].Yangling:Northwest A&F University, 2018.
[18] MENDIS E, RAJAPAKSE N, BYUN H G, et al.Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J].Life Sciences, 2005, 77(17):2166-2178.
[19] 郑琳. 抗氧化肽的构效关系及定向制备的研究[D].广州:华南理工大学,2015.ZHENG L.Study on the structure-activity relationship and directional preparation of antioxidant peptides[D].Guangzhou:South China University of Technology, 2015.