酒精性肝病(alcoholic liver disease,ALD)是长期饮酒过量引发的疾病[1]。酒精代谢过程中,乙醇被氧化为乙醛,乙醛会导致蛋白质变形及DNA损伤,进而引发氧化应激反应[2]。酒精性肝损伤的发病机制涉及包括氧化应激、炎症反应、脂质代谢紊乱以及肝细胞凋亡在内的多种生物学过程[3]。因此,寻找能够减轻或预防酒精性肝损伤的天然抗氧化剂成为当前肝病研究的重要方向之一。
鲟鱼是一种古老的硬骨鱼类,因其历史悠久,被称为“活化石”。根据《2023年中国渔业统计年鉴》的数据[4],2022年中国鲟鱼养殖业显著增长,产量达到了130 951 t,显示出中国在鲟鱼养殖领域的潜力。鲟鱼产品主要包括鱼子酱和鱼肉两大类[5]。鲟鱼不仅营养价值丰富,且肉质细嫩、无肌间刺,这使其成为烹饪和食用的理想选择[6]。近年来,许多学者开始关注鲟鱼副产品中的生物活性成分,尤其是抗氧化肽、抗菌肽和硫酸软骨素等,并探索了它们在不同领域的应用潜力。例如,尹剑等[7]研究发现,鲟鱼鱼皮的活性肽能够显著提升猪肉组织中抗氧化酶系的活性,证实了鲟鱼皮活性肽具有显著的抗氧化作用。李杰伦[8]的研究也表明,鲟鱼头骨肽具有较良好的抗氧化活性,其在5 mg/mL时羟自由基和超氧阴离子清除率可达70%~95%。饶承冬等[9]的研究发现,胃蛋白酶制备的鲟鱼鱼肠抗氧化肽在1.5 mg/mL时,清除DPPH自由基的能力相当于维生素C的83.64%,对羟自由基的清除率也高达78.06%。此外,XU等[10]成功地从鲟鱼的肌肉和鱼子中提取出了富含抗氧化成分的提取物,这些提取物不仅在体外实验中表现出强大的自由基清除效果,而且在细胞和小鼠模型中也显示出了卓越的活性,这些提取物的抗氧化活性与维生素C和人参提取物相当。
在鲟鱼籽酱生产加工过程中,为确保最终产品的品质和外观,通常会进行严格的筛选和分级,该过程难免会出现一些破碎、黏连的鱼籽,其往往被视作废物丢弃掉。但实际上它们同样含有丰富的营养,包括蛋白质、不饱和脂肪酸、必需氨基酸等。目前关于鲟鱼籽酶解液冻干粉(sturgeon roe enzymatic hydrolysate powder,SREHP)在预防酒精性肝损伤方面的研究还不够充分,尤其是其与市售产品的对比研究方面。基于此,本研究拟采用适当的酶解技术从破碎鱼籽中提取得到SREHP,并将其与市售解酒玉米低聚肽(corn oligopeptide,COP)进行对比,评估两者在天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)以及细胞凋亡水平等多项生化指标,从而提高鲟鱼籽的综合利用率和经济价值,旨在为开发新型天然抗氧化剂和保肝药物提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 原料和试剂
新鲜鲟鱼籽,贵州省千鲟生物科技有限公司;COP,广东华缘食品科技有限公司;碱性蛋白酶(200 U/mg)、T-AOC试剂盒,上海源叶生物科技有限公司;HepG2 细胞,上海安为生物科技有限公司;杜氏改良Eagle培养基(Dulbecco’s modified eagle medium,DMEM)、磷酸盐缓冲液(phosphate buffer saline,PBS)、0.25%胰酶细胞消化液、青霉素-链霉素双抗溶液,美国Gibco公司;胎牛血清(fetal bovine serum,FBS),Hyclone公司;细胞存活率测定试剂盒(cell counting kit-8,CCK-8)、SOD含量检测试剂盒,碧云天生物技术公司;ALT、AST含量检测试剂盒,南京建成生物工程研究所;MDA含量检测试剂盒,北京索莱宝科技有限公司;Annexvin V APC/PI双染试剂盒,武汉伊莱瑞特生物科技股份有限公司。
1.1.2 仪器
T25均质机,德国IKA公司;SHA-B恒温振荡器,上海力辰仪器科技有限公司;KjeltecTM 8400全自动凯氏定氮仪,丹麦福斯分析仪器公司;SX2-512-N箱式马弗炉,上海一恒公司;全自动索氏抽提仪,德国格哈特公司;3110 Series二氧化碳培养箱,美国Thermo公司;InfiniteM 200 Pro 酶标仪,奥地利 TECAN 公司;D2060R Novocyte 流式细胞仪,安捷伦科技有限公司。
1.2 实验方法
1.2.1 SREHP的制备
参照课题组前期的研究方法[11],采用酶解法对鲟鱼籽进行处理。最佳酶解条件:10 g鲟鱼籽样品与去离子水按固液比1∶6(g∶mL)混合,进行8 000 r/min、1 min的均质处理,随后使用碱性蛋白酶在1%(质量分数)的加酶量、pH 8.0及55 ℃的条件下酶解鲟鱼籽,酶解持续时间为8 h。灭酶离心后收集上清液,冻干得到SREHP。
1.2.2 SREHP基本营养成分测定
水分参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中105 ℃干燥恒重法;粗蛋白参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法;粗脂肪参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏抽提法;灰分参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中550 ℃马弗炉干法灰化法。
1.2.3 HepG2细胞培养
根据文献[12]的实验流程,以高糖DMEM、10%(体积分数)FBS和1%(体积分数)双抗配制完全培养基,对HepG2细胞进行培养,培养条件为37 ℃、5% CO2。当细胞密度达到90%左右时,按照1∶4的比例进行传代。其余细胞冻存于-80 ℃或液氮中。
1.2.4 细胞存活率测定
CCK-8实验是一种常用于检测细胞的增殖情况以及细胞毒性的方法。通过检测450 nm波长处的吸光度,可反映活细胞的数目。采用CCK-8法评估细胞增殖、细胞毒性或药物的细胞效应[13]。
1.2.5 不同乙醇浓度对HepG2细胞活力的影响
参照杨彬君等[14]的方法,将对数生长期的HepG2细胞稀释,以2×105个/mL的密度接种于96孔板,每孔添加100 μL的细胞悬液。接种完成后,将微孔板放入含有5% CO2的培养箱中进行预培养。48 h后,弃去培养基,每孔加入100 μL含有不同浓度乙醇(0、100、200、400、500、600、800、1 000、1 200、1 500 mmol/L)的培养基,损伤24 h。向每个孔中加入10 μL的CCK-8溶液,然后使用酶标仪在450 nm波长处测量吸光度。根据公式(1)计算HepG2细胞相对活力。每组做6个复孔,重复3次。
细胞相对活力![]()
(1)
1.2.6 SREHP和COP对HepG2细胞存活率的影响
待HepG2细胞生长至对数生长期,以每孔2×104个的密度接种入96孔板中,预培养24 h。细胞充分贴壁后,弃去培养基,分成对照组及给药组。给药组分别加入100 μL含SREHP(蛋白质量浓度为0.1、0.2、0.5、1.0 mg/mL)和含COP(蛋白质量浓度为0.1、0.2、0.5、1.0 mg/mL)的完全培养基,对照组给予等体积完全培养基。继续培养24 h后,按照1.2.5节的方法测定吸光度,计算相对细胞活力。
1.2.7 SREHP和COP对酒精损伤的HepG2细胞存活率的影响
按1.2.6节的方法,将细胞培养24 h后分成对照组、模型组、阳性组和给药组。对照组和模型组加100 μL完全培养基,阳性组用含不同蛋白质量浓度(0.2、0.5、1.0 mg/mL)COP的完全培养基进行处理,给药组用含不同蛋白质量浓度(0.2、0.5、1.0 mg/mL)的SREHP进行处理,孵育24 h后弃去上清液。除正常对照组外,其余孔均加入 800 mmol/L 的乙醇溶液诱导损伤,24 h后加入CCK-8试剂盒检测细胞活力。
1.2.8 SREHP和COP对酒精损伤的HepG2细胞中转氨酶的影响
参考ZHANG等[15]的方法,将细胞以4.5×105个/mL 浓度接种于6孔板中,每孔2 mL。培养细胞24 h至充分贴壁后,移除旧培养基,将六孔板进行分组:对照组、模型组、阳性组和给药组,对照组和模型组给予2 mL完全培养基处理,阳性组用蛋白质量浓度为1.0 mg/mL的COP培养基处理,给药组则给予蛋白质量浓度为1.0 mg/mL的SREHP培养基。药物预保护24 h后,用800 mmol/L的乙醇溶液损伤24 h。损伤结束后,吸弃培养上清液,每孔加2 mL PBS润洗,细胞被收集至冰水浴环境下进行超声波处理,参数设置为功率200 W,每次破碎持续4 s,中间间隔30 s,每组破碎过程重复20次,即可得到充分裂解后的细胞匀浆,参照说明书操作检测细胞中AST、ALT的含量。
1.2.9 SREHP和COP对酒精损伤的HepG2细胞中MDA、SOD及T-AOC含量的影响
按照1.2.8节的方法进行培养处理。损伤结束后,吸弃培养上清液,每孔加2 mL PBS润洗,随后按各试剂盒说明书操作收集细胞,分别检测细胞中MDA、SOD及T-AOC的含量。
1.2.10 HepG2细胞凋亡检测
参照GUO等[16]的方法,略有修改。按照1.2.8节的方法收集对照组、模型组、阳性组和给药组的HepG2细胞。参照Annexin V APC/PI双染试剂盒说明书,加入各试剂后,通过D2060R Novocyte 流式细胞仪检测HepG2的凋亡情况。
1.3 数据处理
所有实验均重复3次。统计显著性分析采用SPSS软件版本27.0进行,其中结果的显著性水平设定为P<0.05。实验数据通过GraphPad Prism软件版本9.5进行绘图,所有数据结果均以“平均值±标准差”的形式呈现。
2 结果与分析
2.1 SREHP基本营养成分
SREHP中含量最高的是粗蛋白,达到了总重的(83.80±1.27)%,粗脂肪含量占(10.14±0.17)%,显示出其高蛋白、低脂肪的特性。通常情况下,如果原料的脂肪含量较高,在酶解过程中可能会产生不良风味,同时也会缩短产品的保质期。因此,高蛋白、低脂肪含量的鲟鱼籽适用于制备肽类物质。SREHP水分和灰分含量均较低,分别为(2.16±0.14)%和(3.58±0.14)%。
鲟鱼籽作为一种高蛋白原料,通过酶解处理后,可以得到多种生物活性肽。这些肽是由不同的氨基酸序列组成的,它们具有特定的生物活性。在课题组前期研究[11]中,通过质谱分析联合计算机虚拟筛选,得到了鲟鱼籽酶解产物中的潜在生物活性多肽序列,如ALPLDPK、LGGL、KYPL、LPG和FLPR等。
2.2 不同乙醇浓度对HepG2细胞活力的影响
细胞存活率是衡量细胞损伤程度的直观指标之一。如图1所示,随着乙醇浓度的增加,细胞相对活力表现出下降趋势,当乙醇浓度超过200 mmol/L时,细胞的增殖能力会受到显著的抑制。800 mmol/L乙醇处理下的增殖抑制率达到(51.29±0.85)%,1 000 mmol/L乙醇抑制率达(47.82±3.52)%,1 200 mmol/L乙醇抑制率高达(41.11±4.01)%。构建细胞氧化应激模型,应当选择细胞活力在50%~70%作为造模浓度[17]。因此,本实验选择800 mmol/L的乙醇作用24 h诱导HepG2细胞酒精性氧化损伤。
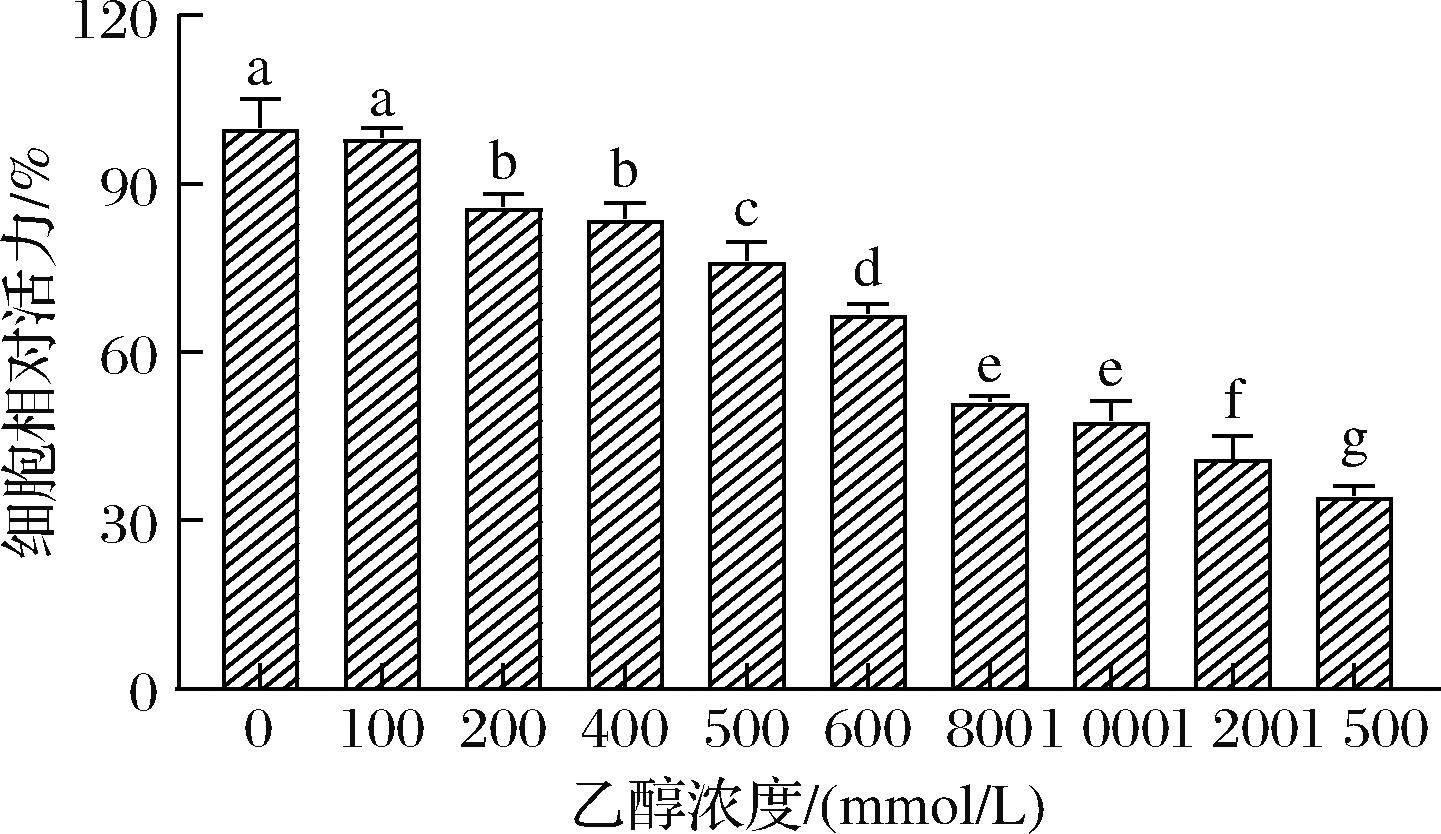
图1 不同乙醇浓度对HepG2细胞活力的影响
Fig.1 Effect of different ethanol concentrations on HepG2 cell viability
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 SREHP、COP对HepG2细胞存活率的影响
如图2所示,HepG2细胞分别与0.1~1.0 mg/mL的SREHP、COP共培养24 h后,细胞存活率均高于95%。这一结果表明,在0.1~1.0 mg/mL的浓度范围内,SREHP、COP对HepG2细胞没有明显的毒性影响。综合考虑,选择蛋白质量浓度为0.2、0.5、1.0 mg/mL 的SREHP、COP作为后续实验的低、中、高浓度组,以进一步探究其对HepG2细胞的影响。
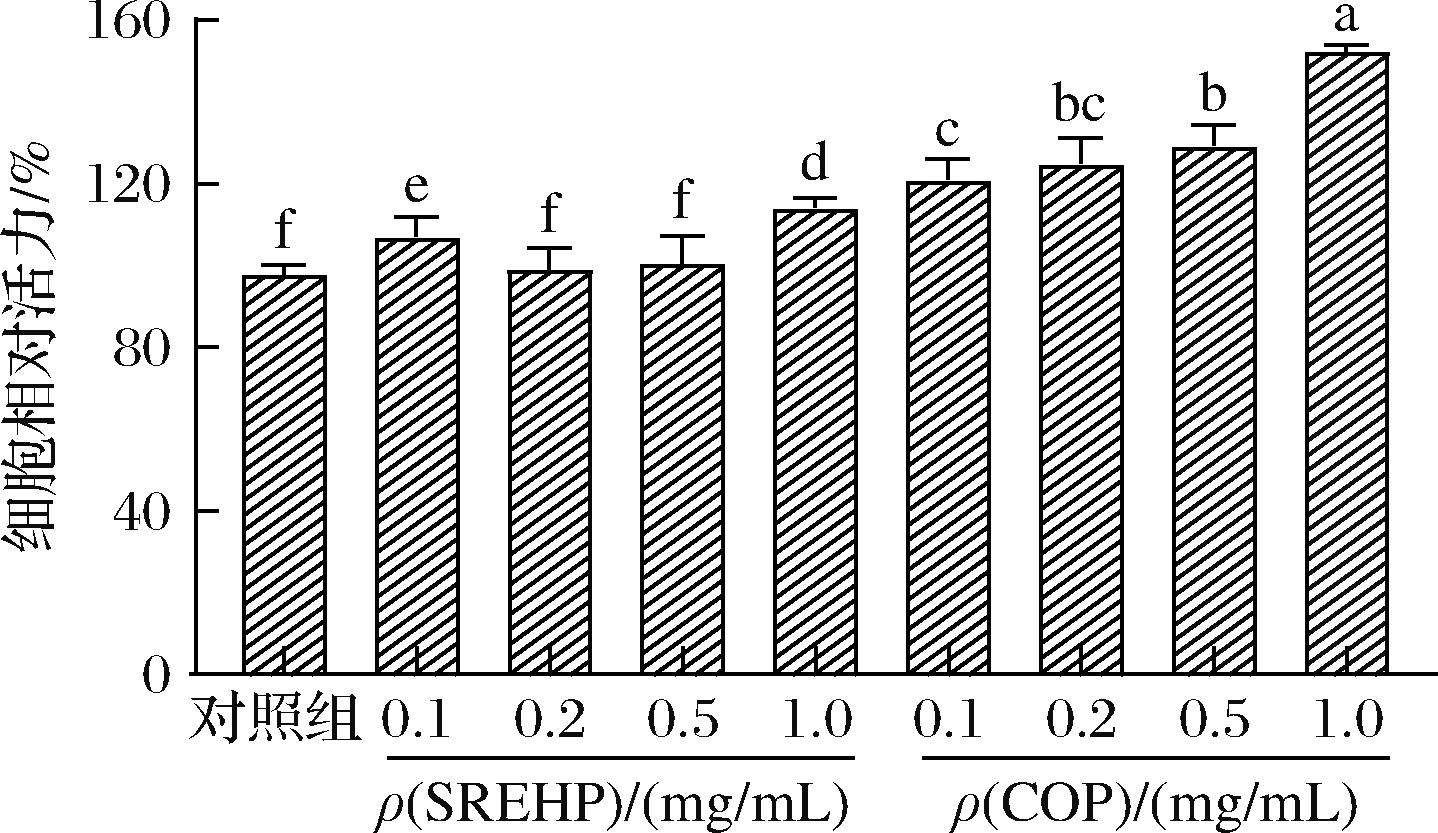
图2 SREHP、COP对HepG2细胞存活率的影响
Fig.2 Effect of SREHP and COP on the viability of HepG2 cells
2.4 SREHP、COP对酒精损伤的HepG2细胞存活率的影响
如图3所示,在酒精诱导的HepG2细胞损伤模型中,细胞的相对活力降低至(50.54±3.36)%,与对照组相比具有显著性差异(P<0.05)。与模型组相比,0.2 mg/mL的COP组细胞活力无显著性变化(P>0.05),而其余各预处理组均能显著提高细胞活力(P<0.05),并且表现出剂量依赖性增加。在0.2、0.5、1.0 mg/mL 蛋白质量浓度的SREHP作用下,HepG2 细胞的存活率分别提高了25.73%、51.11%、75.24%,显示出明显的保护作用。与COP相比,相同蛋白质量浓度下,SREHP处理组的细胞活力均高于COP处理组(P<0.05)。具体来说,1.0 mg/mL SREHP处理组的细胞存活率达到了(88.57±3.96)%,显著高于1.0 mg/mL COP处理组的(80.07±5.53)%(P<0.05)。而0.5 mg/mL SREHP处理组的细胞存活率为(76.37±2.57)%,与1.0 mg/mL COP组之间不具有显著性差异(P>0.05),表明两者对细胞的保护作用相当。实验结果表明,SREHP在3个质量浓度下均能显著提升受到氧化应激损伤的HepG2细胞的存活率(P<0.05),并且其保护效果在一定程度上优于COP处理组。课题组前期研究[11]发现,酶解8 h获得的鲟鱼籽酶解液可提高乙醇脱氢酶(alcohol dehydrogenase,ADH)的活性,并且鉴定出了5条活性肽(ALPLDPK、LGGL、KYPL、LPG和FLPR),它们的分子质量均小于1 000 Da,属于小分子肽范畴。小分子肽因其尺寸较小,更容易穿过生物膜,从而在细胞内发挥其生物活性。基于此,推测SREHP通过激活ADH来加速乙醇的代谢,减轻酒精引起的肝细胞损伤。同时,这些小分子肽段中的氨基酸,如赖氨酸(Lys)、酪氨酸(Tyr)、亮氨酸(Leu)、脯氨酸(Pro)、甘氨酸(Gly)、苯丙氨酸(Phe)和精氨酸(Arg),都可能通过不同的机制增强机体的抗氧化能力,保护细胞免受氧化损伤,从而提高了细胞的存活率。
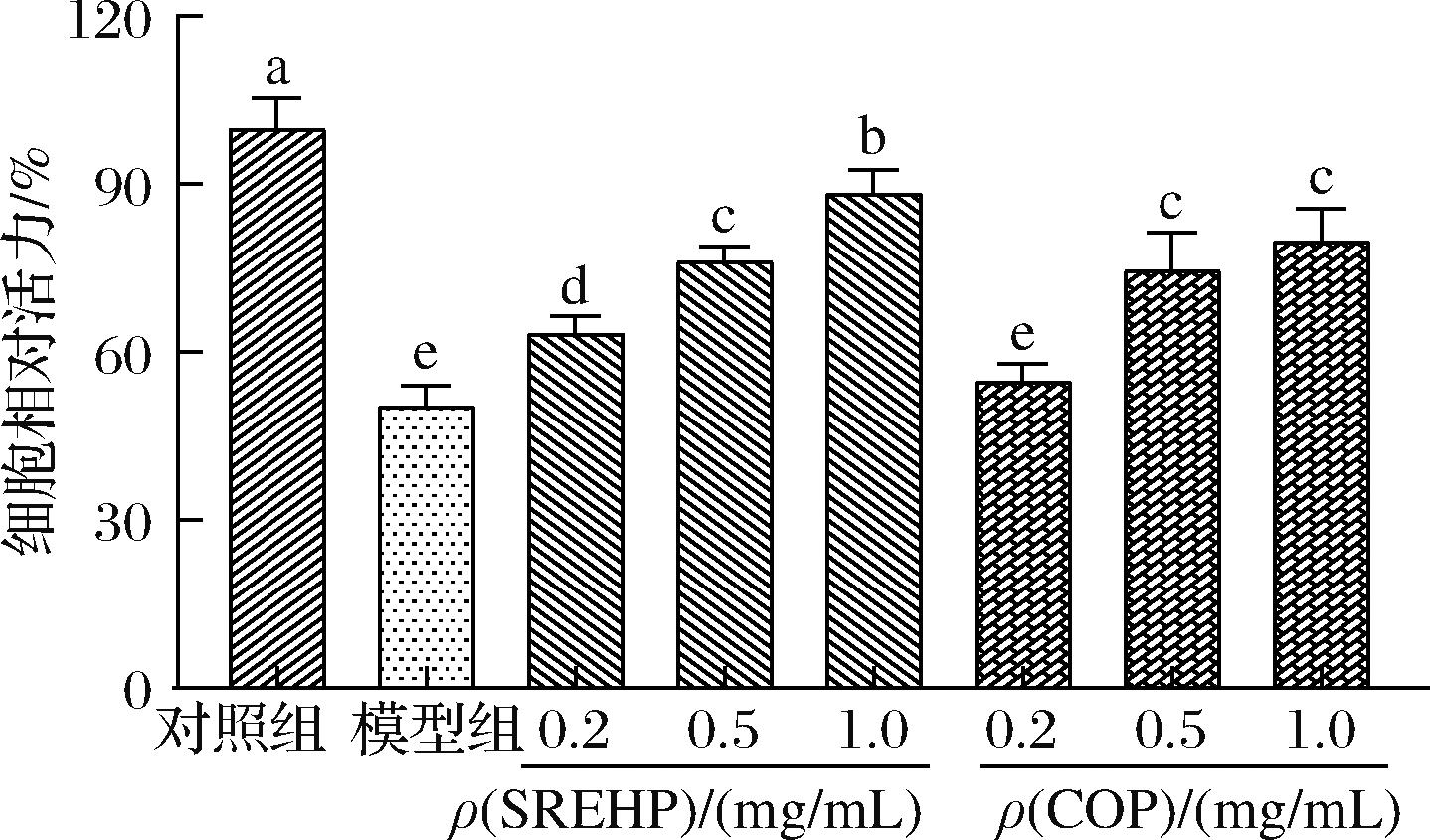
图3 SREHP、COP对酒精损伤的HepG2细胞存活率的影响
Fig.3 Effect of SREHP and COP on the survival of alcohol-damaged HepG2 cells
2.5 SREHP、COP对酒精损伤的HepG2细胞转氨酶的影响
转氨酶包括AST和ALT,它们在肝细胞损伤时从细胞内释放到血液中,导致血液中的AST和ALT水平升高,因此这2种酶的活性升高在临床上具有重要的诊断意义[18]。由图4-a、图4-b可知,与对照组相比,模型组AST和ALT水平显著升高(P<0.05),而SREHP、COP处理均可显著降低酒精损伤HepG2细胞中的AST和ALT水平(P<0.05),并且SREHP组显著低于COP组(P<0.05)。这表明SREHP对减轻由酒精引起的肝细胞损伤具有显著效果,且其效果优于COP。
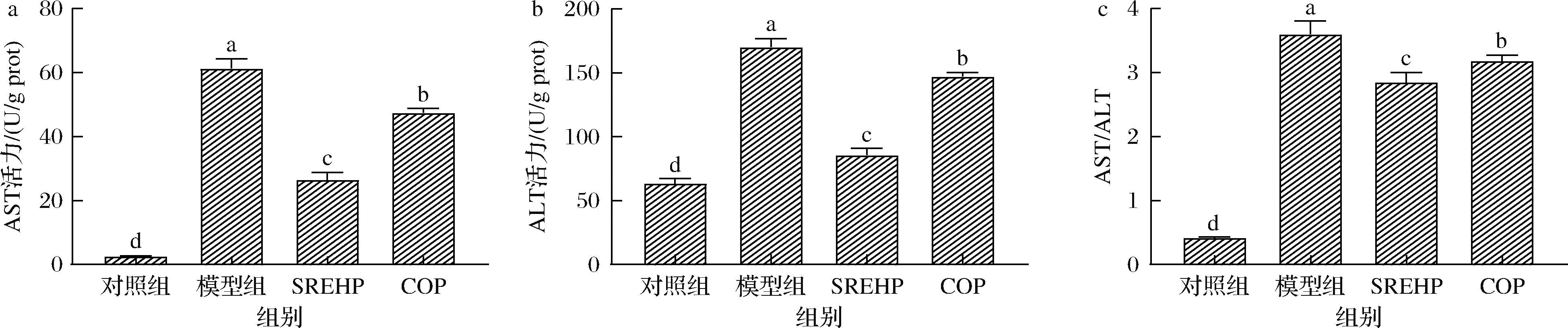
a-AST;b-ALT;c-AST/ALT
图4 SREHP、COP对酒精损伤的HepG2细胞转氨酶的影响
Fig.4 Effects of SREHP and COP on aminotransferase in alcohol-damaged HepG2 cells
临床上常通过AST/ALT比值评估肝损伤的严重程度。通常,AST/ALT<1表明肝细胞状态良好,肝损伤较轻;而当AST/ALT>1时,提示肝细胞损伤加重,导致大量酶的释放,AST显著升高[19]。实验结果显示,对照组的AST/ALT<1处于正常范围,而经过酒精损伤处理后,AST/ALT比值显著升高至3.60,表明酒精对肝细胞造成了显著的损伤。与模型组相比,经过SREHP、COP的预保护处理后,再次接受酒精损伤的细胞,其AST/ALT比值显著降低(P<0.05),提示2种物质对酒精诱导的肝细胞损伤具有一定的保护作用。此外,SREHP处理组的AST/ALT比值较COP处理组有更明显的下降,表明SREHP在保护肝细胞方面具有更为优越的效果,与2.4节结果保持一致。这可能是由于SREHP中的Lys和Arg含有自由氨基,能够作为H+的供体,直接与自由基发生反应,减少氧化应激对肝脏的损伤。此外,Lys、Arg还可能通过与Fe、Cu等金属离子结合成稳定的复合物,减少羟自由基的生成,有助于维持细胞内环境的稳定,从而降低机体内AST、ALT的水平。
2.6 SREHP、COP对酒精损伤的HepG2细胞MDA、SOD及T-AOC含量的影响
MDA是脂质过氧化的产物,可与硫代巴比妥酸反应产生化合产物,并用酶标仪测定吸光度值,可通过MDA含量检测细胞受氧化损伤程度[20]。如图5-a所示,与对照组相比,酒精模型组的MDA含量显著上升至(2.36±0.06) nmol/mg prot(P<0.05)。在1.0 mg/mL SREHP、COP的预保护作用下,MDA含量分别显著下降了44.35%和35.63%。MDA是生物体内的自由基与细胞膜上多不饱和脂肪酸发生脂质过氧化反应而形成的产物,其水平的降低意味着SREHP、COP均能减轻由酒精引发的氧化性细胞损伤。SREHP中含有Tyr和Phe,它们的结构中均含有芳香环,能够通过电子共振或离域效应稳定各类活性氧,将其转化为更稳定的苯氧基,从而抑制自由基介导的过氧化链式反应,增强细胞的抗氧化活性,减少MDA的生成。
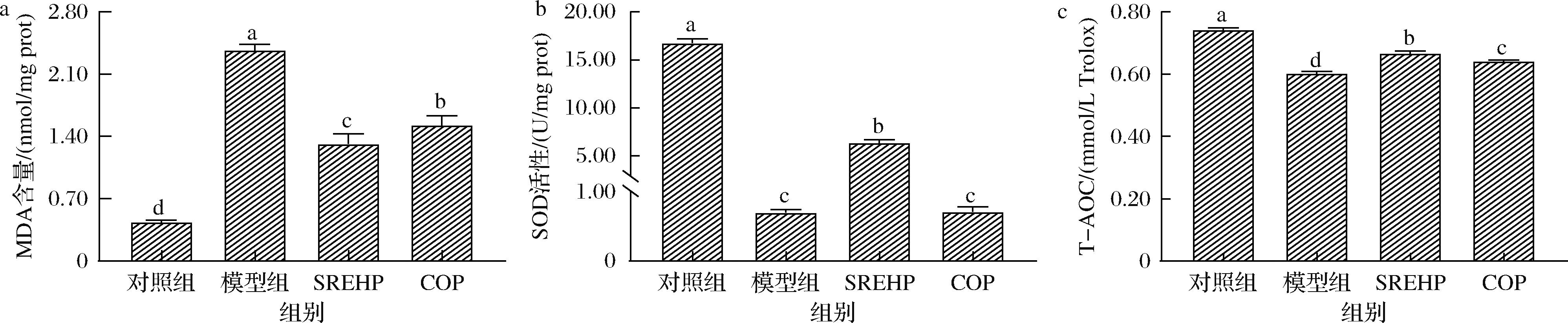
a-MDA;b-SOD;c-T-AOC
图5 SREHP、COP对酒精损伤的HepG2细胞MDA、SOD、T-AOC含量的影响
Fig.5 Effects of SREHP and COP on MDA, SOD, and T-AOC contents in alcohol-damaged HepG2 cells
SOD作为细胞内部抗氧化防线的关键组分,其作用在于消除氧化应激状态下产生的过量自由基,可有效抑制可能对细胞造成损害的过度氧化反应[21]。图5-b显示,对照组细胞的SOD活性较高,其值为(16.74±0.46) U/mg prot。经800 mmol/L乙醇氧化应激损伤24 h后,SOD活性显著降低至(0.70±0.04) U/mg prot。用1.0 mg/mL SREHP预保护细胞,可以显著提升SOD活性至(6.33±0.34) U/mg prot(P<0.05),高于COP处理组的(0.71±0.07) U/mg prot。这一结果表明,与COP相比,SREHP在提升SOD活性方面表现出更为显著的效果。经SREHP处理的细胞中SOD活性升高,推测原因可能是SREHP中的碱性氨基酸(Lys、Arg)及酸性氨基酸(天冬氨酸,Asp)通过调节细胞内和溶酶体的pH值来影响抗氧化酶SOD的活性。
T-AOC是指机体内多种抗氧化活性物质及酶系统的整体含量,是衡量机体抗氧化应激能力的重要指标[22]。如图5-c所示,酒精诱导HepG2细胞的T-AOC显著下降(P<0.05)。经SREHP、COP预保护的细胞,其T-AOC分别提高了10.67%和6.53%,表明这2种物质均能增强细胞的抗氧化防御,并且SREHP的效果更为显著(P<0.05)。这可能是因为SREHP富含多种氨基酸,其中Leu、Asp、Gly等均具有较强的抗氧化特性,能消除机体内部的自由基,增强细胞的抗氧化能力,保护细胞免受氧化应激的损伤。这一结果与SOD活性的变化趋势相一致,进一步证实了SREHP在提升细胞抗氧化能力方面的积极作用。
2.7 HepG2细胞凋亡检测
如图6所示,正常对照组的凋亡率为5.03%,酒精模型组的为54.61%,表明了酒精对HepG2细胞有明显的凋亡诱导作用。然而,当细胞预先用1.0 mg/mL的SREHP、COP处理后,酒精诱导的细胞凋亡率有所下降,其中COP预处理组的凋亡率为43.37%,高于SREHP组的21.32%。
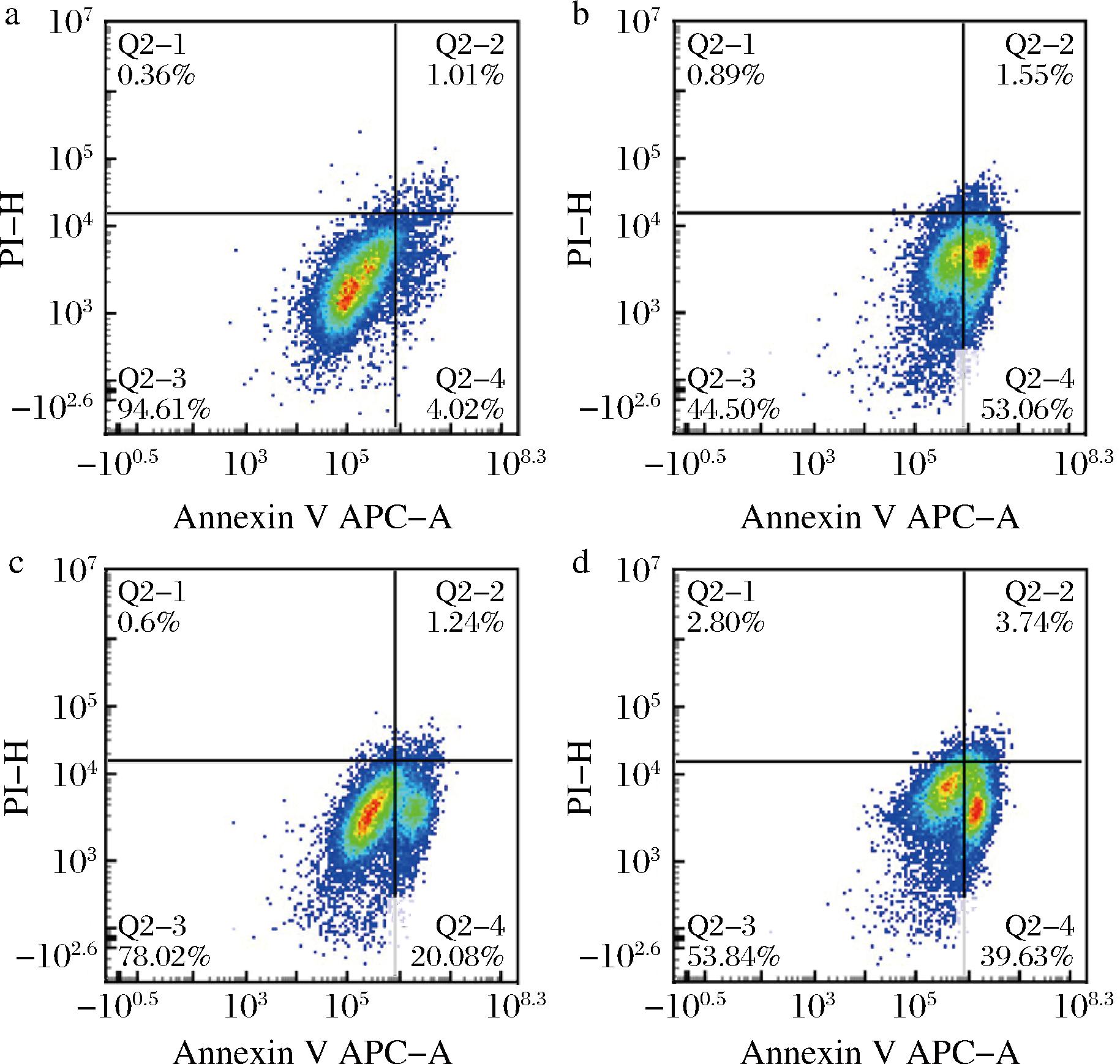
a-对照组;b-模型组;c-SREHP组(1.0 mg/mL);d-COP组(1.0 mg/mL)
图6 SREHP、COP对酒精诱导细胞凋亡的影响
Fig.6 Effects of SREHP and COP on alcohol-induced apoptosis
凋亡实验结果表明,SREHP、COP均能抑制酒精诱导的细胞凋亡,但SREHP在减少细胞凋亡方面的效果更为优越。这可能是由于前期鉴定出来的5条生物活性肽中含有较多疏水性氨基酸,如Leu、Pro、丙氨酸(Ala)、Gly等,它们可以提高肽在脂相中的溶解度,有利于多肽与脂溶性自由基结合,终止脂质过氧化反应,同时疏水性高的抗氧化肽可能更容易穿过细胞膜进入细胞内部发挥抗氧化作用,减少细胞凋亡,从而有助于维持细胞的稳定性和延长细胞寿命。
3 结论
在本研究中,对SREHP与COP在肝损伤细胞保护、抗氧化能力、脂质过氧化抑制及细胞凋亡等方面进行了详细的比较。在0.2、0.5、1.0 mg/mL的SREHP作用下,HepG2 细胞的存活率分别提高了25.73%、51.11%、75.24%,在同等蛋白质量浓度下,SREHP处理组的细胞活力均高于COP处理组。在脂质过氧化方面,发现经1.0 mg/mL SREHP和COP预保护的MDA含量水平分别下降了44.35%和35.63%。此外,SREHP在提升SOD活性和T-AOC方面具有更强的作用效果。在细胞凋亡方面的研究也表明,SREHP和COP均能够有效减少凋亡细胞的比例,但前者效果更显著。这进一步证明了SREHP在维持细胞生存和功能方面的重要作用。总体而言,SREHP在各项抗氧化指标上的表现均优于COP,提示其在解酒及保健品领域具有广泛的应用潜力。研究结果不仅实现了鲟鱼籽资源的高效利用,还为开发新型抗氧化剂及功能性解酒产品提供了科学依据。
[1] MACKOWIAK B, FU Y J, MACCIONI L, et al.Alcohol-associated liver disease[J].The Journal of Clinical Investigation, 2024, 134(3):e176345.
[2] NG W J, WONG F C, ABD MANAN F, et al.Antioxidant peptides and protein hydrolysates from tilapia:Cellular and in vivo evidences for human health benefits[J].Foods, 2024, 13(18):2945.
[3] YANG X T, TANG C H, ZHAO Q Y, et al.Melanin:A promising source of functional food ingredient[J].Journal of Functional Foods, 2023, 105:105574.
[4] 中华人民共和国农业农村部. 2022年农业主推技术[M].北京:中国农业出版社, 2023.
[5] WEI Q W, ZOU Y, LI P, et al.Sturgeon aquaculture in China:Progress, strategies and prospects assessed on the basis of nation-wide surveys (2007—2009)[J].Journal of Applied Ichthyology, 2011, 27(2):162-168.
[6] LI X F, XIE W, BAI F, et al.Influence of thermal processing on flavor and sensory profile of sturgeon meat[J].Food Chemistry, 2022, 374:131689.
[7] 尹剑, 武瑞赟, 阿热爱·巴合提, 等.酶解法制备鲟鱼皮活性肽条件优化及抗氧化能力[J].肉类研究, 2020, 34(2):33-39.YIN J, WU R Y, AREAI B, et al.Optimization of the conditions for the enzymatic preparation of antioxidant peptides from sturgeon skin[J].Meat Research, 2020, 34(2):33-39.
[8] 李杰伦. 鲟鱼头活性物质提取工艺优化及生产车间设计[D].大连:大连海洋大学, 2024.LI J L.Optimization of extraction process of active substances insturgeon head and design of production workshop[D].Dalian:Dalian Ocean University, 2024.
[9] 饶承冬, 柯勤勤, 郑杨杨, 等.鲟鱼鱼肠抗氧化肽的提取及抗氧化性[J].基因组学与应用生物学, 2020, 39(1):88-95.RAO C D, KE Q Q, ZHENG Y Y, et al.Preparation and antioxidant activity of antioxidant peptides from sturgeon(Acipenser sinensis) intestine[J].Genomics and Applied Biology, 2020, 39(1):88-95.
[10] XU L J, LIU Y, JIAO Y, et al.Enzyme-free method for preparation of sturgeon extracts with antioxidant, hepatoprotective and immune-enhancing functions[J].Food Chemistry, 2024, 459:140327.
[11] 张李君, 赵甜甜, 陈杰琼, 等.鲟鱼子酶解产物对酒精损伤肝细胞的保护作用及活性肽虚拟筛选[J].食品工业科技, 2024, 45(19):316-324.ZHANG L J, ZHAO T T, CHEN J Q, et al.Protective effects of enzymatic products from sturgeon roe on alcohol-induced hepatic cell damage and virtual screening of active peptides[J].Science and Technology of Food Industry, 2024, 45(19):316-324.
[12] DE SEVILLA U, BAUTISTA J.Ergothioneine rich Agaricus bisporus extracts decreases lipid accumulation induced by oleic acid in HepG2 cells:Possible implications in the treatment of nonalcoholic liver fatty disease[J].Food Science and Nutrition, 2019, 5(2):1-7.
[13] 刘晓凤, 卢晓琴, 钟浩, 等.人参皂苷对过氧化氢诱导的Caco-2细胞氧化损伤的保护作用[J].食品与发酵工业, 2024, 50(7):46-50.LIU X F, LU X Q, ZHONG H, et al.Protective effect of ginsenosides on hydrogen peroxide-induced oxidative damage of Caco-2 cells[J].Food and Fermentation Industries, 2024, 50(7):46-50.
[14] 杨彬君, 冯彩玲, 吴岩斌, 等.牛樟芝多糖对HepG2细胞酒精性氧化损伤的保护作用[J].菌物学报, 2021, 40(6):1549-1560.YANG B J, FENG C L, WU Y B, et al.Protective effect of Taiwanofungus camphoratus polysaccharides on alcohol-induced oxidative injury in HepG2 cells[J].Mycosystema, 2021, 40(6):1549-1560.
[15] ZHANG M J, ZHANG G S, MENG X X, et al.Reduction of the oxidative damage to H2O2-induced HepG2 cells via the Nrf2 signalling pathway by plant flavonoids quercetin and hyperoside[J].Food Science and Human Wellness, 2024, 13(4):1864-1876.
[16] GUO Y S, CAI X S, LU H W, et al.17β-estradiol promotes apoptosis of HepG2 cells caused by oxidative stress by increasing Foxo3a phosphorylation[J].Frontiers in Pharmacology, 2021, 12:607379.
[17] HU Y D, ZHANG H, LU R Q, et al.Enabling the biosynthesis of Antroquinonol in submerged fermentation of Antrodia camphorata[J].Biochemical Engineering Journal, 2014, 91:157-162.
[18] 张丽杰. 血清转氨酶的测定及临床意义[J].中国医药指南, 2012, 10(9):298-299.ZHANG L J.Determination and clinical significance of serum transaminase[J].Guide of China Medicine, 2012, 10(9):298-299.
[19] 廖彩玉. 松脂皱皮孔菌多糖提取、抗氧化及对酒精性肝细胞损伤的保护作用[D].长春:吉林大学,2023.LIAO Caiyu.Extraction, antioxidant, and protective effects on alcoholic hepatocyte damage of polysaccharide from Ischnoderma resinosum[D].Changchun:Jilin University, 2023.
[20] ISLAMIANA D, PRABOWO R, PRAMANINGTYAS M D.The effect of orange water kefir on malondialdehyde (MDA) level and superoxide dismutase (SOD) inhibition rate in kidney tissue of the hyperlipidemic rat (Rattus norvegicus)[J].Atherosclerosis, 2020, 315:e264.
[21] 周泓妍, 郑怡, 王海东, 等.南、北五味子蛋白抗氧化活性和对HepG2细胞氧化应激损伤的修复作用[J].食品与发酵工业, 2024, 50(7):51-60.ZHOU H Y, ZHENG Y, WANG H D, et al.Antioxidant activity of Schisandra sphenanthera and Schisandra chinensis protein on HepG2 cells[J].Food and Fermentation Industries, 2024, 50(7):51-60.
[22] JIA R, DU J L, CAO L P, et al.Effects of dietary baicalin supplementation on growth performance, antioxidative status and protection against oxidative stress-induced liver injury in GIFT tilapia (Oreochromis niloticus)[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology, 2021, 240:108914.