L-丝氨酸被认为是化工领域30种极具潜力的化合物之一[1],用于多个领域,如医药、农业和化工等。由于L-丝氨酸工业化生产困难导致其市场价格居高不下[2-3]。目前,国内外主要研究谷氨酸棒杆菌(Corynebacterium glutamicum)和大肠杆菌进行微生物发酵法生产L-丝氨酸[1]。刘安倩[4]对谷氨酸棒杆菌A36中L-丝氨酸合成途径的关键基因serA、serC和serB进行加强表达,发酵后L-丝氨酸产量为43.89 g/L。MUNDHADA等[5]敲除大肠杆菌MG1655中L-丝氨酸降解途径的关键基因(sdaA、sdaB、tdcG和glyA),随后加强表达L-丝氨酸合成途径3个关键基因(serA、serC和serB),最后利用合成进化(TARSyn)筛选获得高产L-丝氨酸的菌株。相较于大肠杆菌,谷氨酸棒杆菌是被美国联邦药监局(Food and Drug Administration, FDA)认证用于生产安全食品和药品的菌株[2]。因此,谷氨酸杆菌发酵生产L-丝氨酸具有重要意义。本实验室对一株产L-丝氨酸的野生型谷氨酸棒杆菌SYPS-062进行诱变及代谢工程改造,获得谷氨酸棒杆菌A36-AB[4],发酵120 h后L-丝氨酸产量为43.89 g/L[生产强度为0.36 g/(L·h)],但仍存在发酵周期长和生产强度低等问题。
诱变育种是生物育种的主要方法之一,常温常压等离子体诱变技术(atmospheric and room temperature plasma,ARTP)作为新兴诱变技术,具有安全、环保和成本低等优点[6]。ARTP技术广泛应用于细菌[7]、真菌[8]、放线菌[9]和微藻[10]的诱变,以提高目标产物的产量和改善菌株性状。ARTP技术可以简便高效地构建突变库,但从巨大的突变库中筛选出优良性状的突变株费时费力。本实验室前期构建了L-丝氨酸生物传感器,其能够将L-丝氨酸浓度转化为绿色荧光信号[11-12],可将该传感器用于高通量筛选L-丝氨酸高产突变株。
对菌株进行发酵培养基优化也是提高其产量的重要方法。培养基营养成分比例对产量影响较大。培养基优化的方法主要包括单因素试验和响应面法等[13]。单因素试验用于确定显著因素和优化范围。响应面法利用多元高次方程拟合因素与响应值之间的函数关系,用尽可能少的实验次数对发酵培养基的变量进行优化,以求得最优策略[13-14]。具有操作简便和成本较低等优点。
本文以实验室前期构建的产L-丝氨酸谷氨酸棒杆菌A36-AB为出发菌株,将L-丝氨酸生物传感器pDer[15]转入菌株A36-AB中,构建菌株A36-AB-pDser。对菌株A36-AB-pDser进行ARTP诱变结合高通量筛选,获得L-丝氨酸高产突变株,并对突变菌株进行发酵优化,进一步提高菌株的L-丝氨酸生产强度,为工业化生产L-丝氨酸奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
谷氨酸棒杆菌A36-AB:源自土壤中的野生型谷氨酸棒杆菌SYPS-062经过代谢途径改造和诱变所得[4]。
谷氨酸棒杆菌A36-AB-pDser:菌株A36-AB导入L-丝氨酸生物传感器pDser所得。
谷氨酸棒杆菌A36-AB-pDser-6:菌株A36-AB-pDser经过ARTP诱变后筛选所得。
1.1.2 培养基与磷酸缓冲溶液
种子培养基(g/L):葡萄糖 20;MgSO4·7H2O 0.5、(NH4)2SO4 10、脑心浸液 37;NaH2PO4 0.3、K2HPO4 0.2;灭菌条件:115 ℃,20 min。(固体种子培养基另加20 g/L琼脂粉)。
初始发酵培养基(g/L):蔗糖 100;KH2PO4 3、(NH4)2SO4 30、MgSO4·7H2O 0.5、MnSO4·H2O 0.02、FeSO4·7H2O 0.02、生物素 5×10-5、盐酸硫胺素 4.5×10-4、原儿茶酸0.03、CaCO3 60;pH值为7,灭菌条件:115 ℃,20 min。
PBS(g/L):NaCl 8、KCl 0.2、KH2PO4 0.24、Na2HPO4 1.44、pH值为7.4,灭菌条件:121 ℃,20 min。
脑心浸液,北京博润莱特科技有限公司;其余试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
超净工作台,苏州安泰公司;往复式摇床,太仓强乐实验设备有限公司;生化培养箱,上海博讯实业有限公司;高压蒸汽灭菌锅,日本TOMY Digital Biology公司;分析天平,美国OHAUS公司;紫外分光光度计,上海翱艺仪器;台式高速冷冻离心机,日本日立公司;常压室温等离子体诱变仪器,无锡天木生物公司;FACSCalibur流式细胞仪,美国BD公司;安捷伦1260高效液相色谱仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 菌株保藏与培养
菌株保藏:将谷氨酸棒杆菌菌液与60%(体积分数)甘油等体积混合,放置于-80 ℃冰箱保存。
种子液培养:将保存的菌液在固体种子培养基平板划线,于30 ℃恒温培养箱培养3 d,从三线板上挑取单菌落于种子培养基平板上密集划线,置于30 ℃恒温培养箱培养3 d。刮取平板上的菌体到种子培养基中于30 ℃,120 r/min的往复式摇床培养约12 h。
发酵培养:吸取2 mL种子液到初始发酵培养基中,置于30 ℃,120 r/min的往复式摇床培养。
1.3.2 ARTP诱变、致死率计算与高通量筛选
ARTP诱变:用PBS溶液洗涤菌体并涡旋制备成菌悬液,取10 μL菌悬液涂在ARTP专用载片上,放置到响应孔位,设置仪器的功率为100 W,设置处理时间,气体流量为10 SLM,开始样品处理。
致死率计算:诱变处理时间设置为0、15、30、45、60、90、120、150 s。将诱变后每个时间点的菌悬液进行10-3~10-5的梯度稀释并涂布平板,置于30 ℃培养箱培养3 d。对生长出来的单菌落进行计数,致死率计算如公式(1)所示:
致死率![]()
(1)
高通量筛选:用PBS溶液洗涤菌体后并制成菌悬液,参考文献进行筛选[16]。将收集的高荧光区域细胞经过培养后置于96孔板中,通过酶标仪检测其荧光强度。
1.3.3 发酵培养基优化
单因素试验:以L-丝氨酸产量为主要指标,在初始发酵培养基的基础上探究碳源种类、氮源种类以及主要营养成分质量浓度对菌株A36-AB-pDser-6产L-丝氨酸和生物量的影响。分别以蔗糖、葡萄糖、果糖、乳糖和麦芽糖为碳源,通过发酵筛选最适碳源。分别以硫酸铵、氯化铵、尿素、蛋白胨和玉米粉为氮源,通过发酵筛选最适氮源。探究发酵培养基中主要营养成分(葡萄糖、硫酸铵、生物素、原儿茶酸和盐酸硫胺素)质量浓度对菌株发酵的影响。
最陡爬坡试验:根据单因素试验的分析结果确定影响L-丝氨酸产量的显著因素。通过单因素试验的质量浓度范围确定了最陡爬坡试验的高水平和低水平,根据最陡爬坡试验的结果确定BBK(Box-Behnken Design)试验的中心点[17-18]。
BBK试验:选定A(硫酸铵)、B(生物素)和C(原儿茶酸)作为因素,并通过最陡爬坡试验确定各因素的3个水平(-1、0、1),以L-丝氨酸的产量为指标使用Design-Expert软件设计响应面试验。
1.3.4 基因组学分析
用PBS溶液洗涤菌体后离心,将保留菌体寄送至苏州金唯智生物科技有限公司,利用Illumina二代技术进行测序。使用FastQC对测序数据质量评估并使用Cutadapt清理低质量数据及接头序列。将过滤后的高质量序列与参考基因组A36-AB进行比对,并使用Samtools与GATK的Unified Genotyper模块分析基因组,检测单碱基变异(single nucleotide variant,SNV)和插入缺失(insertion and deletion,InDel)。
1.3.5 分析方法
菌株生物量测定:利用稀盐酸将发酵液稀释至合适倍数,使用紫外分光光度计于562 nm处测定OD562值作为生物量。
糖浓度测定:利用HPLC测定糖浓度,HPLC程序参考文献[19]。
氨基酸浓度测定:利用HPLC测定氨基酸浓度,HPLC程序参考文献[19]。
2 结果与分析
2.1 ARTP致死率曲线
诱变菌液稀释培养后计算致死率,结果如图1所示,随照射时间延长,致死率也随之增加。当照射时间为60、90、120 s时,致死率分别为85.71%、96%和100%。为确保足够的突变株,常选择致死率为90%左右的诱变时间作为最佳照射时间,因此选择90 s的照射时间,此时的致死率达到96%。
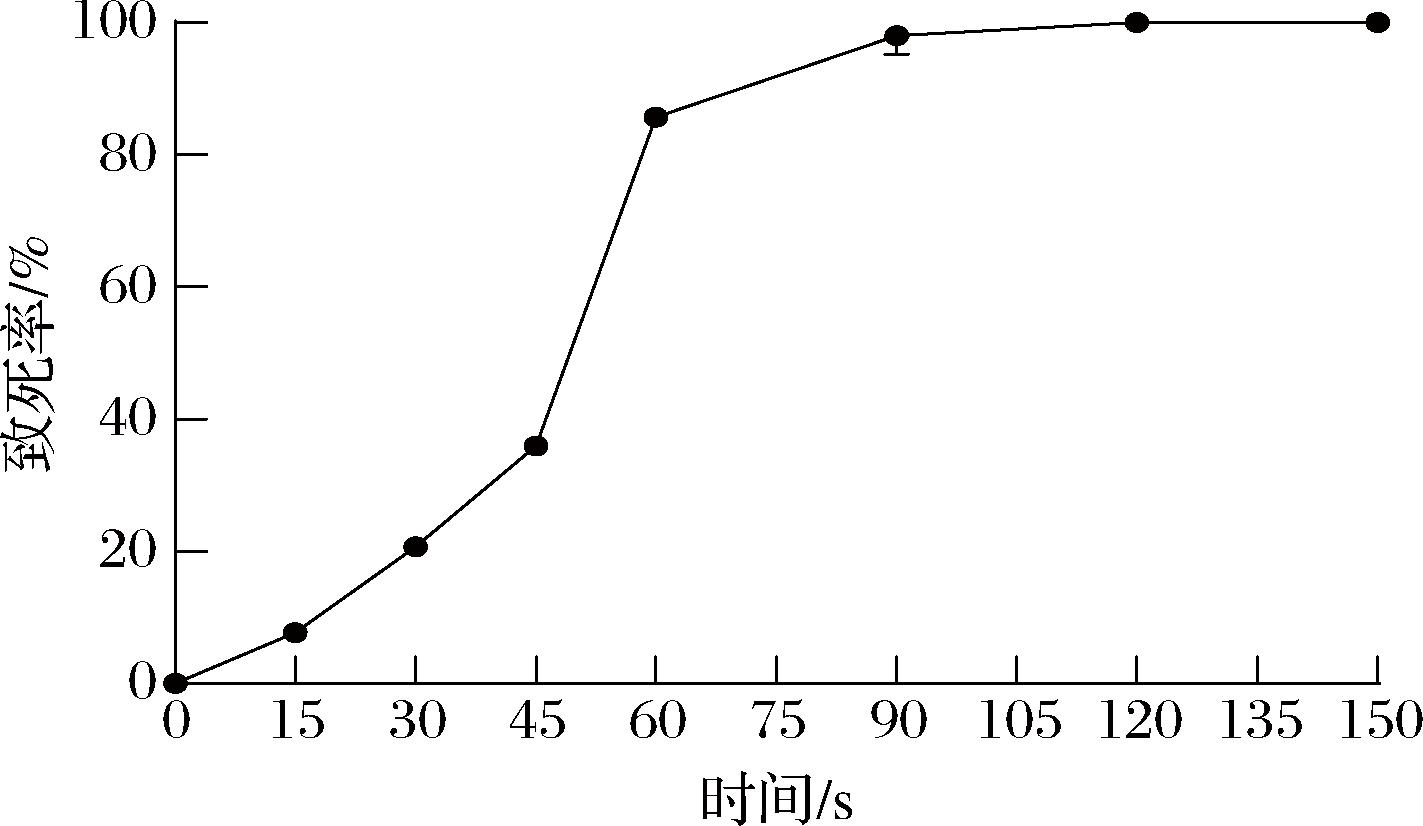
图1 致死率曲线
Fig.1 Mortality rate curve
2.2 FACS高通量筛选
将诱变后的菌株按照1.3.2节中的高通量筛选的步骤进行流式分选,筛选出荧光前5%的菌株,将收集到的菌株涂布平板。接着将平板长出的96个单菌落置于24深孔板中培养,然后使用酶标仪检测各个菌株的荧光强度,结果如图2所示。对其中9株荧光强度较高的菌株与对照菌株A36-AB-pDser进行摇瓶发酵筛选,L-丝氨酸产量如图3-a所示。
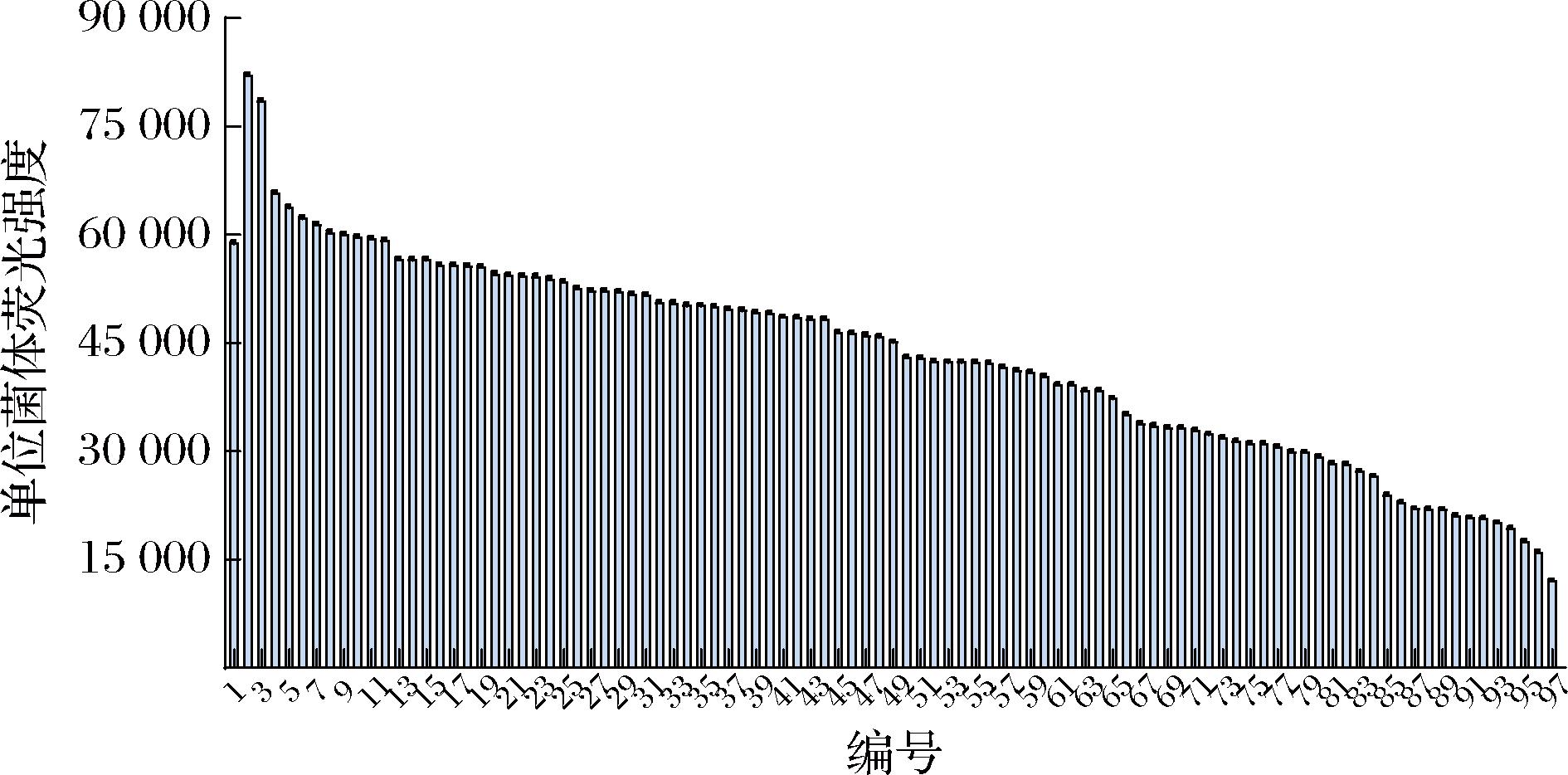
图2 通过高通量筛选与酶标仪筛选L-丝氨酸高产突变株
Fig.2 High-yield L-serine-producing mutant strains were selected through high-throughput screening and enzyme-based assay screening

a-突变菌株L-丝氨酸产量;b-突变菌株摇瓶验证;c-出发菌株突变菌株A36-AB-pDser与A36-AB-pDser-6的发酵过程曲线
图3 通过发酵筛选L-丝氨酸的高产突变株
Fig.3 Screening for high-yield mutant strains of L-serine through fermentation
将图3-a中L-丝氨酸产量最高的6株突变株进行摇瓶发酵验证,结果如图3-b所示,发酵60 h时,菌株A36-AB-pDser-6的L-丝氨酸产量最高,为15.60 g/L;而此时对照菌株A36-AB-pDser的产量为11.48 g/L;诱变后L-丝氨酸产量提高了24.8%。菌株A36-AB-pDser与突变菌株A36-AB-pDser-6的发酵过程如图3-c所示,突变菌株A36-AB-pDser-6前期生长速率与L-丝氨酸产量明显高于对照菌株A36-AB-pDser,因此将其作为后续发酵优化的研究对象。
2.3 单因素试验结果
2.3.1 碳源种类对菌株生长和产酸的影响
碳源是促进细胞生长和代谢的主要营养物质,与菌株生长和代谢产物积累直接相关[20]。不同种类的碳源对菌株A36-AB-pDser-6生长和产酸的影响如图4所示,菌株A36-AB-pDser-6可以以蔗糖、葡萄糖和果糖作为碳源但无法利用乳糖和麦芽糖。以葡萄糖为碳源时,生物量OD562值和L-丝氨酸产量均是最高,分别为31.7、17.93 g/L,显著高于其他碳源。相较于蔗糖,葡萄糖作为速效碳源可被菌株快速利用促进菌株生长,菌株前期生物量提高,L-丝氨酸产量也随之提高。因此确定葡萄糖为菌株A36-AB-pDser-6产L-丝氨酸的最适碳源。
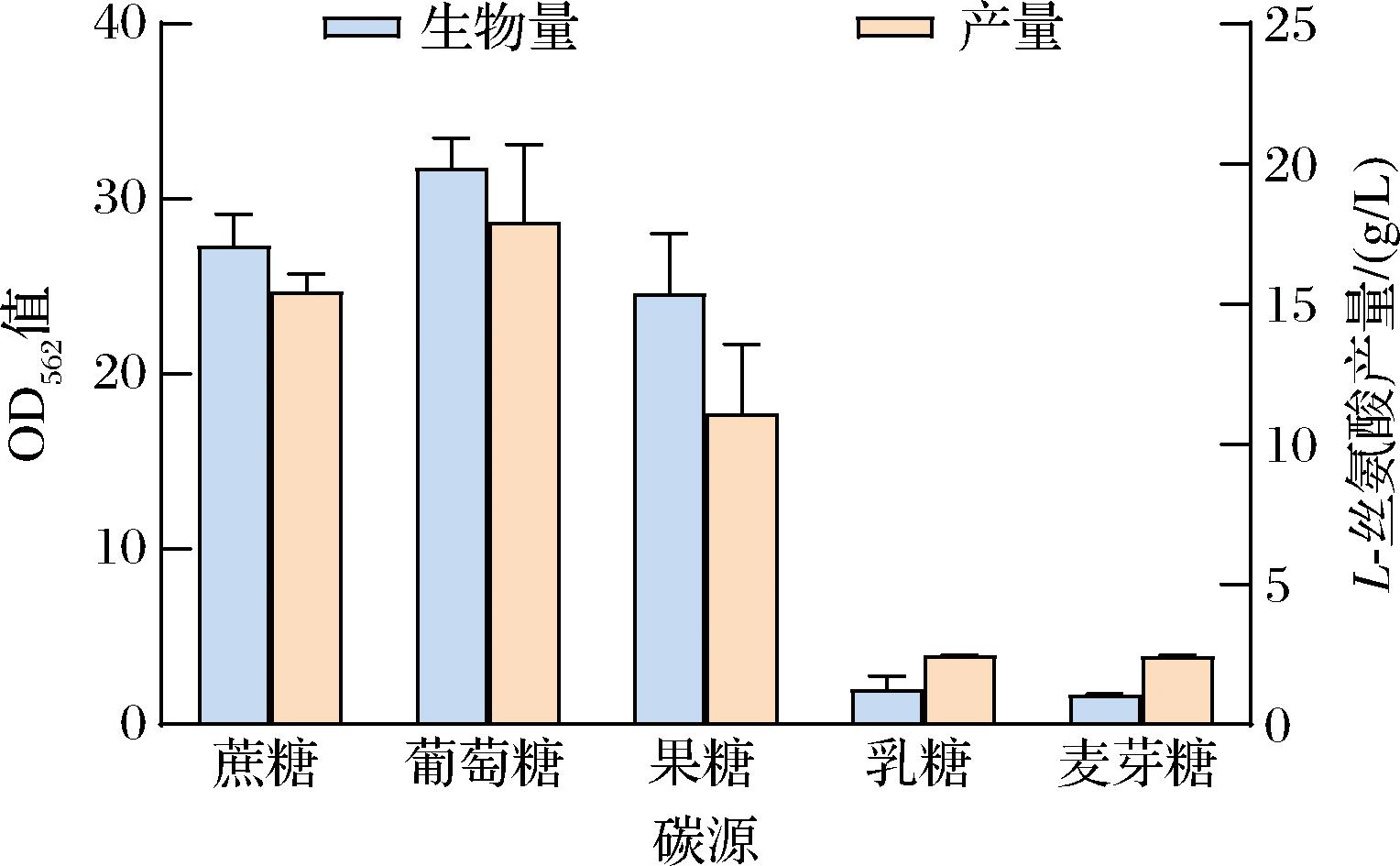
图4 不同碳源对菌株生长和产酸的影响
Fig.4 The effect of different carbon sources on strain growth and acid production
2.3.2 氮源种类对菌株生长和产酸的影响
氮源是促进菌体合成蛋白质与核酸的营养来源[21-22]。不同种类的氮源对菌株A36-AB-pDser-6生长和产酸的影响如图5所示,除尿素外,其余几种氮源均可被菌株用于生长和产酸。能被利用的不同氮源对菌株生长的影响不大,但是对L-丝氨酸产量影响较大,其中无机氮源的产酸明显高于有机氮源,推测是由于有机氮源促进其他代谢途径导致L-丝氨酸被降解。以硫酸铵为氮源时,菌株的L-丝氨酸产量最高为16.81 g/L。
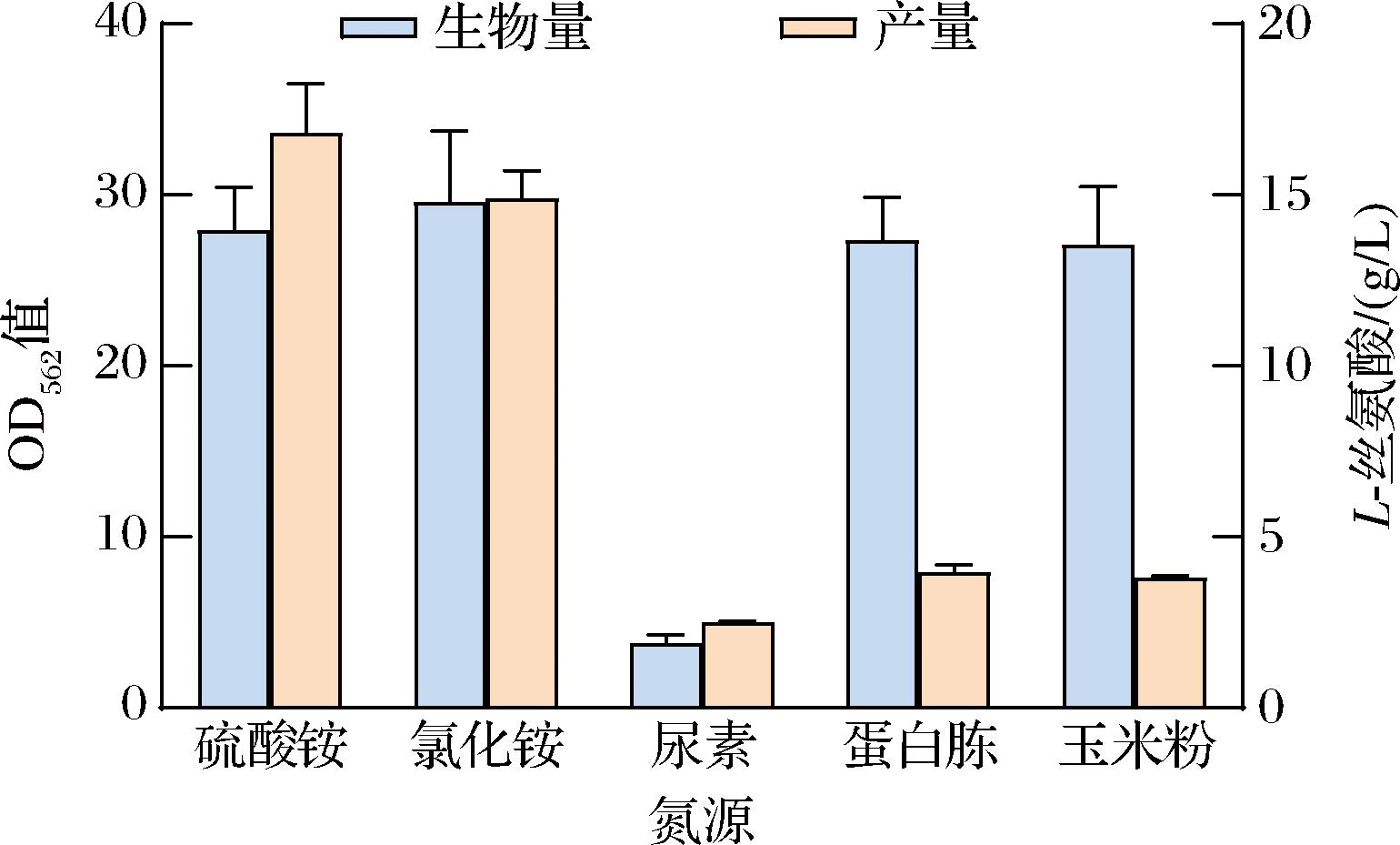
图5 不同氮源对菌株生长和产酸的影响
Fig.5 The effect of different nitrogen sources on strain growth and acid production
2.3.3 营养成分的质量浓度对菌株生长和产酸的影响
培养基中主要营养成分的质量浓度对菌株的生长和产酸的影响如图6所示,由图6-a可知,当葡萄糖质量浓度为110 g/L时,L-丝氨酸产量最高为17.25 g/L,较初始质量浓度提高了12.96%,菌株生物量则变化不显著。当糖质量浓度较低时,碳源不足导致产酸较低;而当糖质量浓度过高时则会影响细胞膜的通透性,使L-丝氨酸无法排出胞外从而使产量降低。由图6-b可知,当硫酸铵质量浓度为40 g/L时,L-丝氨酸产量最高为19.02 g/L,较初始质量浓度提高了15.98%,菌株生物量则变化不显著。适量的氮源可促进菌体生长增殖进而提高L-丝氨酸产量,但是氮源含量过高可能会影响碳源流向产酸的代谢路径导致产量减少。由图6-c可知,当生物素质量浓度为0.15 mg/L时,L-丝氨酸产量最高为17.64 g/L,较初始质量浓度的提高了20.32%,菌株生物量则变化不显著。推测是生物素的质量浓度较低导致菌株生长受损使产量降低,而质量浓度过高则会使细胞膜结构完整,胞内的L-丝氨酸出胞困难导致产量降低。适宜质量浓度的原儿茶酸对谷氨酸棒杆菌生长有促进作用[23]。由图6-d可知,当原儿茶酸质量浓度为60 mg/L时,L-丝氨酸产量最高为22.20 g/L,较初始质量浓度提高了37.50%,菌株生物量则变化不显著。由图6-e可知,盐酸硫胺素作为微量营养物质对菌株生长和产酸没有较大影响。由此确定各营养成分的最适添加量和对菌株产酸影响较大的营养物质。
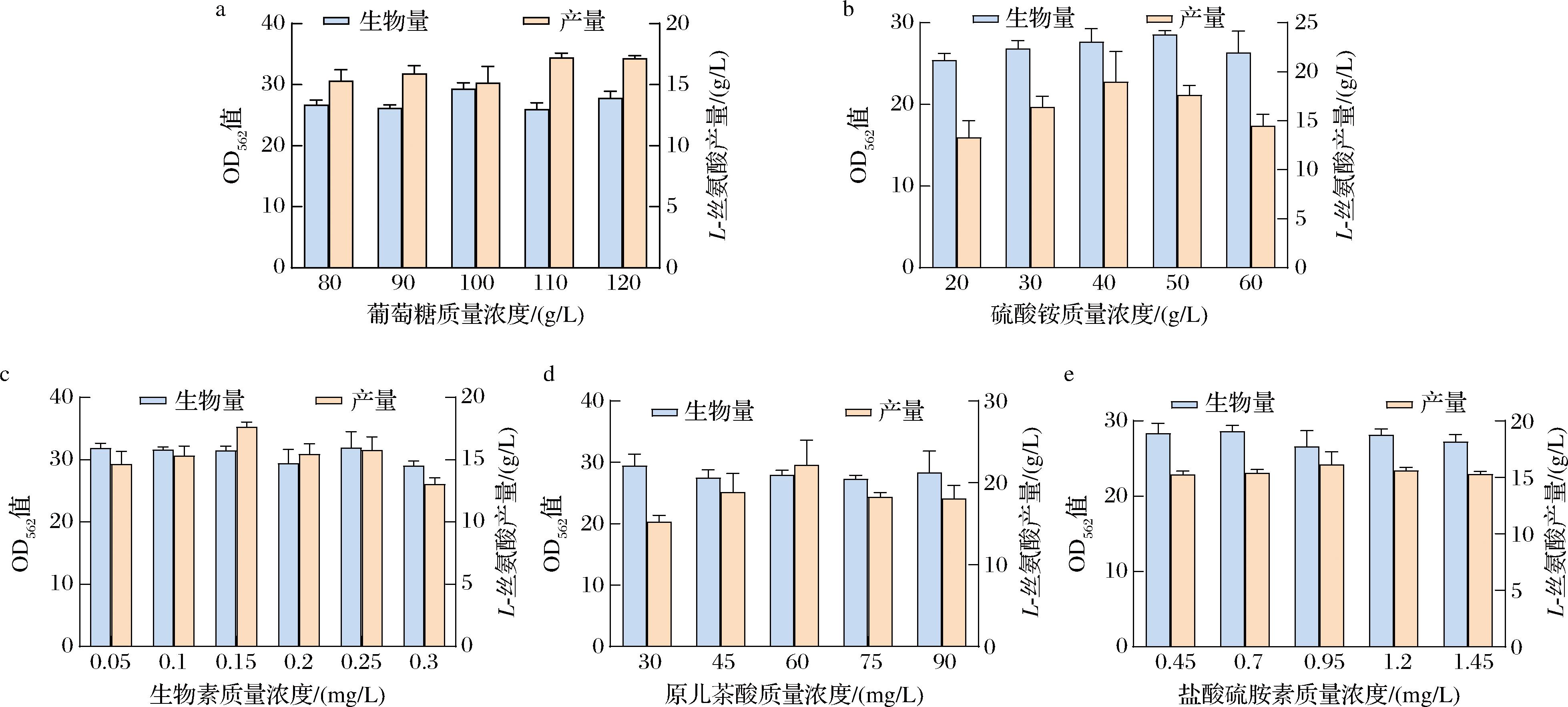
a-葡萄糖质量浓度;b-硫酸铵质量浓度;c-生物素质量浓度;d-原儿茶酸质量浓度;e-盐酸硫胺素质量浓度
图6 葡萄糖、硫酸铵、生物素、原儿茶酸和盐酸硫胺素不同质量浓度对菌株生长和产酸的影响
Fig.6 The effects of different concentrations of glucose, ammonium sulfate, biotin, protocatechuic acid, and thiamine hydrochloride on strain growth and acid production
2.4 爬坡试验结果
基于单因素试验的结果,选择硫酸铵、生物素和原儿茶酸作为最陡爬坡试验的3个因素。具体最陡爬坡试验设计及结果如表1所示,L-丝氨酸的产量随着3个显著因素硫酸铵、生物素和原儿茶酸的变化呈现类抛物线趋势,并且于第3组试验时出现峰值,因此将硫酸铵(40 g/L)、生物素(0.15 mg/L)和原儿茶酸(60 mg/L)作BBK试验设计的中心点。
表1 最陡爬坡试验
Table 1 Steepest climbing test
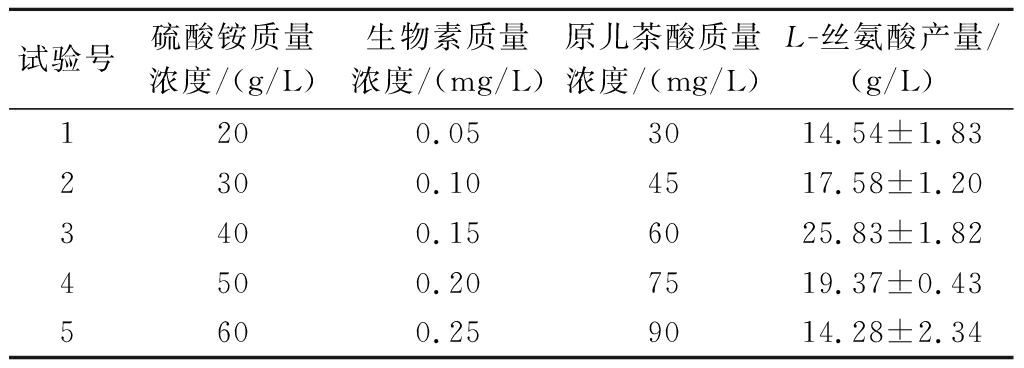
试验号硫酸铵质量浓度/(g/L)生物素质量浓度/(mg/L)原儿茶酸质量浓度/(mg/L)L-丝氨酸产量/(g/L)1200.053014.54±1.832300.104517.58±1.203400.156025.83±1.824500.207519.37±0.435600.259014.28±2.34
2.5 响应面试验结果
2.5.1 BBK试验结果与分析
以L-丝氨酸产量(Y)为响应值,采用Design-Expert 8.0.6设计BBK试验,结果如表2所示,方差回归模型分析如表3所示。采用Design-Expert 8.0.6对表2试验结果进行拟合,得到回归方程:Y=25.97+0.87A-0.074B+0.28C-0.75×10-3AB-0.90AC+0.00BC-7.27A2-3.61B2-3.51C2。回归模型F值为16.17(P<0.01),试验误差很小,失拟项的F值为0.5且回归模型中R2=0.954 1,说明回归模型显著。综上,该实验模型可用于预测L-丝氨酸最大产量。
表2 BBK试验设计与结果
Table 2 BBK experiment design and results
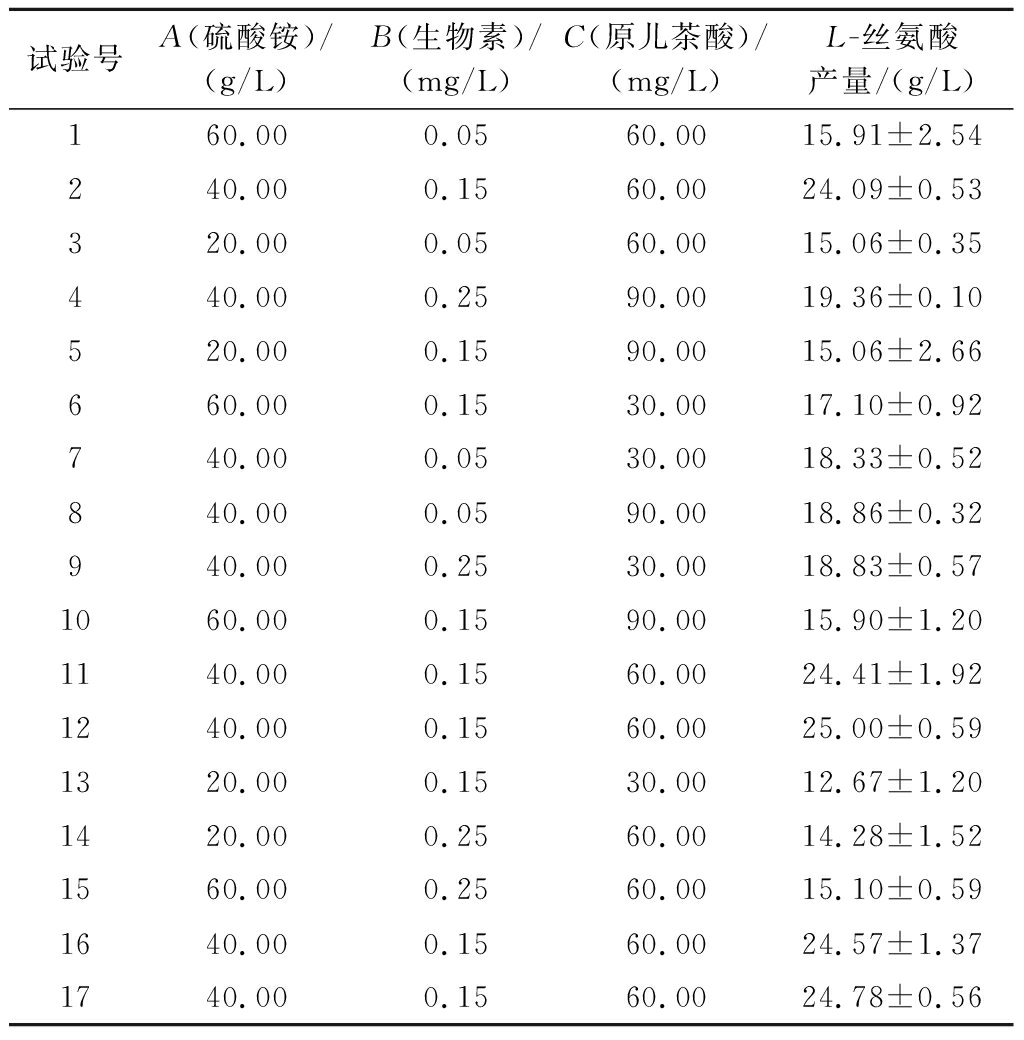
试验号A(硫酸铵)/(g/L)B(生物素)/(mg/L)C(原儿茶酸)/(mg/L)L-丝氨酸产量/(g/L)160.000.0560.0015.91±2.54240.000.1560.0024.09±0.53320.000.0560.0015.06±0.35440.000.2590.0019.36±0.10520.000.1590.0015.06±2.66660.000.1530.0017.10±0.92740.000.0530.0018.33±0.52840.000.0590.0018.86±0.32940.000.2530.0018.83±0.571060.000.1590.0015.90±1.201140.000.1560.0024.41±1.921240.000.1560.0025.00±0.591320.000.1530.0012.67±1.201420.000.2560.0014.28±1.521560.000.2560.0015.10±0.591640.000.1560.0024.57±1.371740.000.1560.0024.78±0.56
表3 方差回归模型分析
Table 3 Variance regression model analysis
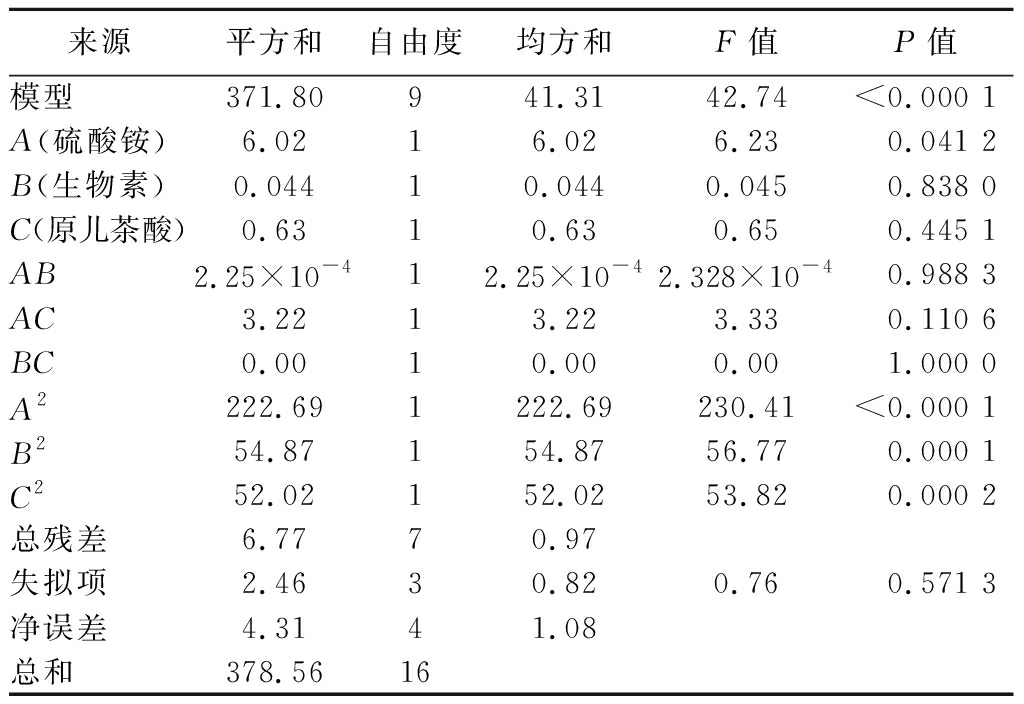
来源平方和自由度均方和F值P值模型371.80941.3142.74<0.000 1A(硫酸铵)6.0216.026.230.041 2B(生物素)0.04410.0440.0450.838 0C(原儿茶酸)0.6310.630.650.445 1AB2.25×10-412.25×10-42.328×10-40.988 3AC3.2213.223.330.110 6BC0.0010.000.001.000 0A2222.691222.69230.41<0.000 1B254.87154.8756.770.000 1C252.02152.0253.820.000 2总残差6.7770.97失拟项2.4630.820.760.571 3净误差4.3141.08总和378.5616
2.5.2 各因素间交互作用对L-丝氨酸产量的影响
等高线的形状越趋于椭圆形,则说明对应的2种因素之间交互作用越明显。使用 Design-Expert 8.0.6绘制各因素间交互作用对L-丝氨酸产量影响的响应曲面及等高线如图7所示,硫酸铵与生物素及硫酸铵与原儿茶酸的交互作用较强,响应曲面呈凸形,抛物面更陡,等高线呈椭圆形,与之前方差分析结果一致。
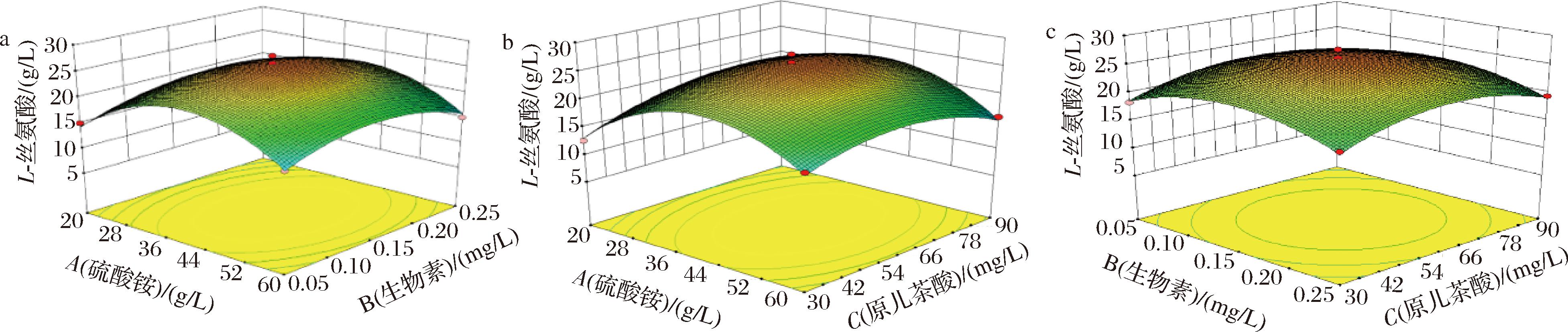
a-硫酸铵与生物素交互作用;b-硫酸铵与原儿茶酸交互作用;c-生物素与原儿茶酸交互作用
图7 各因素间交互作用对L-丝氨酸氨酸产量影响的响应曲面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction between various factors on L-serine production
2.5.3 响应面优化试验结果验证
将回归方程进行解析,最优发酵配比为:硫酸铵41.52 g/L、生物素0.15 mg/L和原儿茶酸62.07 mg/L。预测的L-丝氨酸产量为30.42 g/L。为操作便利,将最优发酵条件修正为硫酸铵41.50 g/L、生物素0.15 mg/L和原儿茶酸62.00 mg/L,在此条件下进行验证试验。如图8所示,优化后菌株生长速率、糖耗和产量明显优于优化前。优化后L-丝氨酸平均产量为29.23 g/L较优化前(15.60 g/L)提高了87.4%,生产强度0.48 g/(L·h)较优化前提高了84.6%。
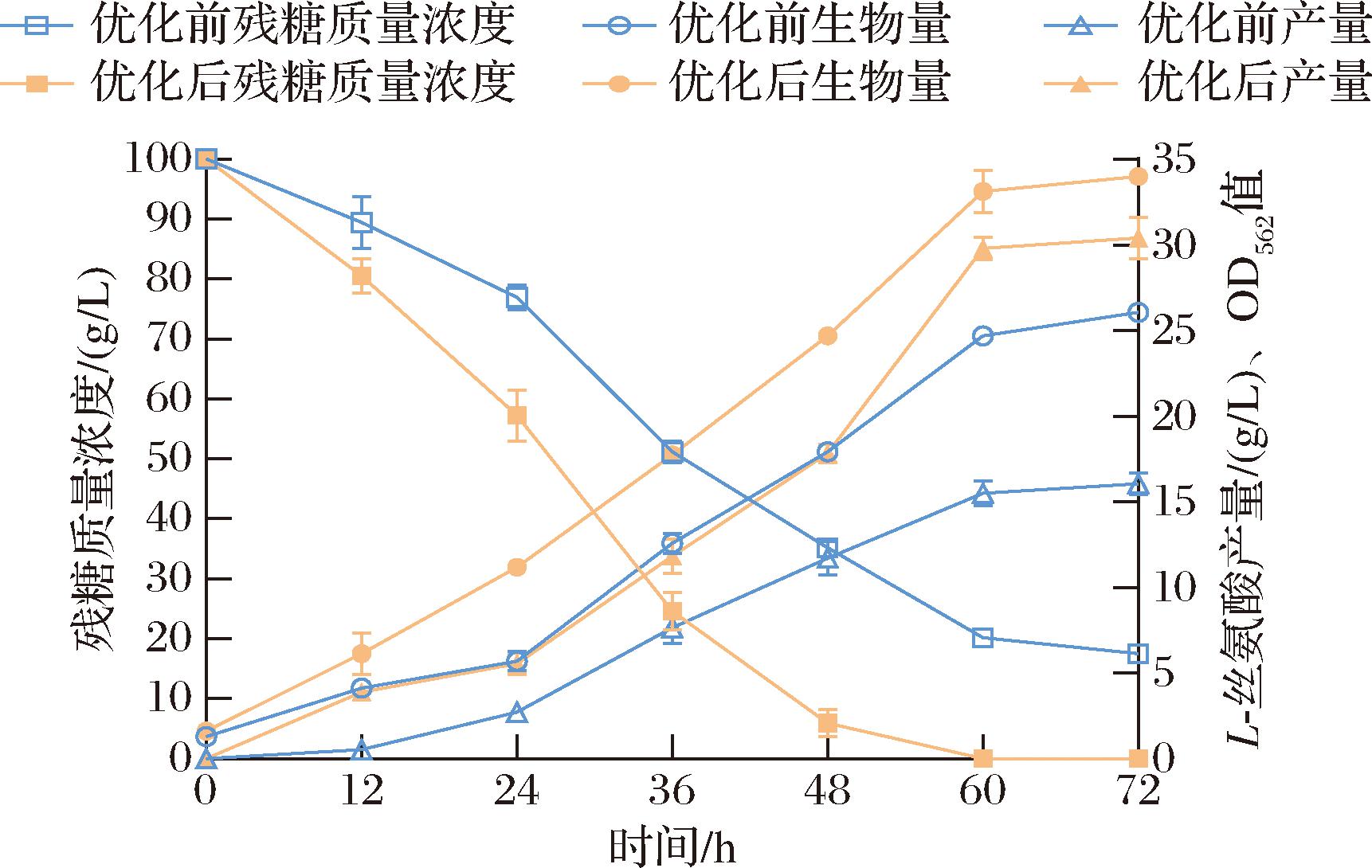
图8 优化前后突变菌株A36-AB-pDser-6的发酵过程曲线
Fig.8 Fermentation process curves of mutant strain A36-AB-pDser-6 before and after optimization
2.6 出发菌株及突变菌株的比较基因组分析
为探究突变株高产L-丝氨酸的机制,将出发菌株与突变株进行全基因组测序并进行比较组学分析。结果如表4所示。A36-AB与A36-AB-pDser-6之间存在12个SNV和15个InDel。双功能DNA甲酰胺嘧啶糖苷酶(由mutM基因编码)、ABC转运蛋白、糖酵解途径中的葡萄糖-6-磷酸异构酶(由pgi基因编码)以及D-己糖-6-磷酸变位酶发生突变。其中突出变位点较多的是催化葡萄糖-6磷酸与果糖-6磷酸相互转化的葡萄糖-6磷酸异构酶(由pgi基因编码),是糖酵解途径中的关键酶。推测该酶的突变是导致突变菌株生长周期缩短的主要原因。
表4 菌株A36-AB-pDser-6中SNV和InDel基因突变情况
Table 4 Mutation profile of SNV and InDel genes in strain A36-AB-pDser-6

编号功能氨基酸变化NCgl1993编码双功能DNA甲酰胺嘧啶糖苷酶G348A,L116LNCgl0817编码葡萄糖-6-磷酸异构酶T144G,V48V,T148A,S50T,42 delG,V48fs,146 delG,S49fs,150-151 insAAATGAGGGAATGT,S50-A51 delinsSKX,154-158 del,S52fs,161 dupA,Y54-G55 delinsX,162-163 insGGAACTC,Y54fsNCgl2246编码D-己糖-6-磷酸变位酶T386A,I129 N,412-413insC,G138fs,414-415 del,G138fsNCgl2218编码ABC转运蛋白C410T,S137L,G1474A,E492K
3 结论
本研究以A36-AB为出发菌株,通过ARTP诱变结合高通量筛选,筛选获得一株发酵周期短且高产L-丝氨酸的菌株A36-AB-pDser-6,为进一步提高L-丝氨酸的生产强度,利用响应面法确定了菌株A36-AB-pDser-6发酵培养基的最佳配方(g/L):葡萄糖 100、KH2PO4 3、(NH4)2SO4 41.5、MgSO4·7H2O 0.5、MnSO4·H2O 0.02、FeSO4·7H2O 0.02、生物素1.5×10-4、盐酸硫胺素4.5×10-4、原儿茶酸0.062、CaCO3 60。优化后L-丝氨酸产量达到29.23 g/L,较优化前(15.60 g/L)提高了87.4%,优化后菌株生产强度为0.48 g/(L·h),比出发菌株[0.36 g/(L·h)]提高了33%。本研究通过诱变育种与发酵优化显著提高了L-丝氨酸生产强度,为L-丝氨酸工业化奠定了基础。
[1] ZHANG X M, XU G Q, SHI J S, et al. Microbial production of L-serine from renewable feedstocks[J]. Trends in Biotechnology, 2018, 36(7):700-712.
[2] 陈剑, 张晓梅, 史劲松. 基于代谢组学分析理性强化三羧酸循环提高L-丝氨酸产量[J]. 食品与发酵工业, 2023, 49(24): 1-7.CHEN J, ZHANG X M, SHI J S. Enhancing tricarboxylic acid cycle based on comparative metabolomics analysis to increase L-serine production[J]. Food and Fermentation Industries, 2023, 49(24): 1-7.
[3] WENDISCH V F. Metabolic engineering advances and prospects for amino acid production[J]. Metabolic Engineering, 2020, 58:17-34.
[4] 刘安倩. 谷氨酸棒杆菌中L-丝氨酸合成的组合调控[D]. 无锡: 江南大学, 2023.LIU A Q. Combination regulation of L-serine synthesis in Corynebacterium glutamicum[D]. Wuxi: Jiangnan University, 2023.
[5] MUNDHADA H, SCHNEIDER K, CHRISTENSEN H B, et al. Engineering of high yield production of L-serine in Escherichia coli[J]. Biotechnology and Bioengineering, 2016, 113(4):807-816.
[6] ZHANG Q, MIAO R Y, FENG R C, et al. Application of atmospheric and room-temperature plasma (ARTP) to microbial breeding[J]. Current Issues in Molecular Biology, 2023, 45(8):6466-6484.
[7] CHENG L K, WANG J, ZHAO X B, et al. An antiphage Escherichia coli mutant for higher production of L-threonine obtained by atmospheric and room temperature plasma (ARTP) mutagenesis[J]. Biotechnology Progress, 2020, 36(6): e3058-e3058.
[8] HUANG H Z, DING L L, LU J, et al. Combinatorial strategies for production improvement of red pigments from Antarctic fungus Geomyces sp.[J]. Journal of Food Science, 2020, 85(10): 3061-3071.
[9] YU G H, PENG H F, CAO J, et al. Avilamycin production enhancement by mutagenesis and fermentation optimization in Streptomyces viridochromogenes[J]. World Journal of Microbiology and Biotechnology, 2022, 38(3):50.
[10] CAO S, ZHOU X, JIN W B, et al. Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J]. Bioresource Technology, 2017, 244: 1400-1406.
[11] ZHOU G J, ZHANG F Z. Applications and tuning strategies for transcription factor-based metabolite biosensors[J]. Biosensors, 2023, 13(4):428.
[12] WU Y F, ZHU L J, LI S T, et al. High content design of riboswitch biosensors: All-around rational module-by-module design[J]. Biosensors and Bioelectronics, 2023, 220:114887.
[13] 张昊月, 郭正彦. 应用响应面法优化发酵培养基提高达托霉素产量[J]. 微生物学通报, 2021, 48(1): 113-122.ZHANG H Y, GUO Z Y. Medium optimization with the response surface methodology to improve daptomycin production[J]. Microbiology China, 2021, 48(1): 113-122.
[14] HASHIZUME T, YING B W. Challenges in developing cell culture media using machine learning[J]. Biotechnology Advances, 2024, 70:108293.
[15] ZHANG X, ZHANG X M, XU G Q, et al. Integration of ARTP mutagenesis with biosensor-mediated high-throughput screening to improve l-serine yield in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2018, 102(14):5939-5951.
[16] BINDER S, SCHENDZIELORZ G, STABLER N, et al. A high-throughput approach to identify genomic variants of bacterial metabolite producers at the single-cell level[J].Genome Biology,2012,13(5):R40.
[17] FAHIMITABAR A, RAZAVIAN S M H, ALI REZAEI S. Application of RSM for optimization of glutamic acid production by Corynebacterium glutamicum in bath culture[J]. Heliyon, 2021, 7(6): e07359.
[18] KUMAR R S, MOORTHY I M G, BASKAR R. Modeling and optimization of glutamic acid production using mixed culture of Corynebacterium glutamicum NCIM2168 and Pseudomonas reptilivora NCIM2598[J]. Preparative Biochemistry and Biotechnology, 2013, 43(7): 668-681.
[19] WANG C Y, WU J J, SHI B C, et al. Improving L-serine formation by Escherichia coli by reduced uptake of produced l-serine[J]. Microbial Cell Factories, 2020, 19(1):66.
[20] ALVAREZ-Z
 IGA M T, CASTA
IGA M T, CASTA EDA GARC
EDA GARC A D, AGUILAR OSORIO G. Effect of different carbon sources on the growth and enzyme production of a toxigenic and a non-toxigenic strain of Aspergillus flavus[J]. Preparative Biochemistry &Biotechnology, 2021, 51(8):769-779.
A D, AGUILAR OSORIO G. Effect of different carbon sources on the growth and enzyme production of a toxigenic and a non-toxigenic strain of Aspergillus flavus[J]. Preparative Biochemistry &Biotechnology, 2021, 51(8):769-779.
[21] WANG Y H, ZHU H X, PAN S Y, et al. Effect of different nitrogen source and Saccharomyces cerevisiae strain on volatile sulfur compounds and their sensory effects in chardonnay wine[J]. Food Chemistry: X, 2024, 24:101793.
[22] 焦雯姝, 关嘉琦, 史佳鹭, 等. 响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基成分及发酵条件[J]. 食品科学, 2020, 41(6): 123-130.JIAO W Z, GUAN J Q, SHI J L, et al. Optimization of medium composition and fermentation conditions for folate production by Lactococcus lactis KLDS4.0325 by response surface methodology[J]. Food Science, 2020, 41(6): 123-130.
[23] AJIBOYE T O, HABIBU R S, SAIDU K, et al. Involvement of oxidative stress in protocatechuic acid-mediated bacterial lethality[J]. Microbiology Open, 2017, 6(4): e00472.