甜菜红素(betanin,BT)常见于红甜菜根、仙人掌果、火龙果果皮中,由发色基团甜菜醛氨酸和仲胺缩合而成,是天然的多酚类水溶性含氮色素[1]。据报道,BT不仅能作为天然着色剂应用于食品和化妆品领域,而且因具有抗炎、抗癌和抗糖尿病等有益特性,在医药行业应用广泛[2]。然而,BT稳定性较差,在提取和加工阶段容易受到温度、光照、酸碱度及金属离子等因素的影响而发生降解[3]。为了改善BT的稳定性,常采用络合、辅色、包埋等稳定化技术来减缓其降解。其中,大分子对BT的包埋过程通常只涉及物理作用,复合物制备工艺简单、产物安全性高,是提高BT稳定性最有效的途径。已有研究人员利用可食大分子对BT进行封装或络合,CAI等[4]利用麦芽糊精与淀粉对苋菜中的BT进行包埋处理,有效减少了BT的吸湿性,增强了贮藏稳定性。CHRANIOTI等[5]则将BT与麦芽糊精、壳聚糖等进行复合,发现其有利于维持BT的颜色稳定。
近年来,蛋白质因来源广泛、价格低廉、生物相容性好,以及营养丰富而备受关注,常作为负载基质用于活性小分子负载和递送。研究表明,大豆分离蛋白与BT通过疏水作用结合;结合后,BT的热保留率从55.3%提高到75.9%[6]。另外,水稻-豌豆复合植物蛋白与BT结合后,在4 ℃下保存28 d,复合物a*值的保留率保持在65%以上,仍呈现出BT原有的紫红色,即复合蛋白负载后减缓了BT的降解,提高了BT的贮藏稳定性[7]。
乳蛋白主要由乳清蛋白和酪蛋白组成,制备简单、价格低廉且营养价值高。乳蛋白负载可有效提升BT的稳定性[8]。据报道,乳清蛋白与BT主要通过范德华力和氢键形成复合物,可使BT在80 ℃下的保留率从6.17%增加到27.26%,提高了BT的热稳定性[9]。酪蛋白是动物乳中的大量蛋白质,约占乳蛋白总量的80%[10]。通过膜过滤制备的酪蛋白浓缩物为酪蛋白胶束(casein micelles,MC),其对活性小分子具有较高的亲和性,是活性小分子天然纳米载体的首选基质之一[11]。LANG等[12]的研究表明,酪蛋白结合能够增强蓝莓花青素在肠道消化过程中的稳定性,提高其抗氧化性能。课题组前期研究发现,MC与葛根素、黄豆苷元[13]、原花青素[14]均能形成稳定的复合物,有效提升活性分子的稳定性。然而MC与BT的相互作用以及MC负载对BT稳定性的影响研究鲜有报道。
本文以MC为基质,通过荧光分析法解析了MC与BT的结合作用及结合机理,采用多种光谱技术、测定粒径和Zeta电位等手段表征了BT-MC复合物结构,系统研究了在热处理、碱处理以及金属离子处理下BT-MC复合物中BT的稳定性变化规律。研究结果可为BT稳定性的提升提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜红甜菜根采自甘肃省张掖市;Na2HPO4、NaH2PO4、FeCl3、ZnCl2,天津市百世化工有限公司。所有试剂均为分析纯。
巴氏杀菌牛乳购自兰州庄园牧场股份有限公司,于4 000×g下离心脱脂20 min,过100 kDa有机膜,跨膜压力为0.4 MPa,流量为480 L/h,浓缩液冷冻干燥后制得MC,4 ℃冷藏备用[15]。
1.2 仪器与设备
H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;LC-10 N-50D真空冷冻干燥机,上海力辰邦西仪器科技有限公司;MAI-GZJ小型喷雾干燥机,上海那艾精密仪器有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司;RF-5301PC荧光分光光度计,日本日立仪器有限责任公司;Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;XH-T X射线多晶衍射仪,北京普析通用仪器有限责任公司;BT-Zeta100 Zeta电位/纳米粒度/分子量分析仪,丹东百特仪器有限公司;STA449F5热分析仪,德国耐驰仪器制造有限公司。
1.3 实验方法
1.3.1 甜菜红素的提取
挑选新鲜红甜菜根,去皮、清洗、切块、冷冻干燥、粉碎。粉末和蒸馏水按料液比1∶15(g∶mL)混合,于37 ℃恒温水浴中避光搅拌12 h后,在9 000 r/min下离心15 min,取上清液进行喷雾干燥,进口温度为140 ℃,物料流量为200 mL/h,即得BT粉末,于4 ℃下避光保存[16]。
1.3.2 BT-MC复合物制备
称取适量BT粉末溶于水,配制成浓度为1、2、3、4、5 mmol/L的BT水溶液,分别记为BT1、BT2、BT3、BT4、BT5,现配现用。BT-MC复合物制备参照瓦文强等[15]的方法,将MC溶解于0.05 mol/L、pH 6.86的磷酸盐缓冲溶液中,获得终质量浓度为30 g/L的MC溶液。称取适量BT粉末配制成浓度为2、4、6、8、10 mmol/L的BT水溶液,分别与等体积MC溶液混合,37 ℃水浴搅拌20 min,即得BT-MC复合物溶液;将复合物冷冻干燥48 h制得BT-MC复合物粉末,记为BT-MC1、BT-MC2、BT-MC3、BT-MC4、BT-MC5,4 ℃避光保存。
1.3.3 紫外-可见光谱测定
采用紫外-可见分光光度计在300~800 nm处对游离BT溶液及BT-MC复合物溶液的紫外-可见光谱进行测定。
1.3.4 荧光光谱测定
参照DAI等[17]的方法,使用荧光分光光度计测定BT-MC复合物溶液的荧光光谱,激发波长为280 nm、激发狭缝和发射狭缝均为5 nm,在300~450 nm测量。
由Stern-Volmer方程确定MC和BT之间的荧光猝灭机制;利用Double-logarithmic计算静态猝灭时MC与猝灭剂之间的结合常数Ka和每个蛋白的结合位点数n;用Van’t Hoff方程计算BT与MC结合过程的热力学参数。
1.3.5 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
将BT-MC复合物粉末置于衰减全反射元件上,使用红外光谱仪扫描500~4 000 cm-1的红外光谱,扫描次数32次,分辨率4 cm-1。参考ZHAO等[6]的方法,采用Peakfit4.12软件对酰胺Ⅰ带(1 600~1 700 cm-1)进行二阶导数计算,进而确定二级结构含量;其中,1 648~1 664 cm-1处为α-螺旋,1 615~1 637 cm-1和1 682~1 700 cm-1处为β-折叠,1 664~1 681 cm-1处为β-转角,1 637~1 648 cm-1处为无规卷曲。
1.3.6 X射线衍射(X-ray diffraction,XRD)测定
使用X射线多晶衍射仪,在Cu Kα辐射下对样品进行XRD扫描[18]。
1.3.7 粒径和Zeta电位测定
使用BT-Zeta100粒度仪,测定BT-MC复合物溶液的粒径及Zeta电位[19]。
1.3.8 热重-差示扫描量热(thermogravimetric-differential scanning calorimetry,TG-DSC)测定
参照郑杰等[20]的方法,称取10 mg样品于坩埚中,空坩埚作为空白对照,使用TG-DSC热分析仪测定BT-MC复合物在50~400 ℃的热分解特性,升温速率为5 ℃/min。
1.3.9 稳定性测定
1.3.9.1 温度对BT稳定性的影响
参照芦霞等[8]的方法并稍作修改,将不同浓度BT及复合物溶液避光置于40、60、80 ℃下,分别加热30、60、90、120 min后,用紫外-可见分光光度计测定溶液在536 nm处的吸光度,根据吸光度计算BT的保留率。
根据朗伯-比尔定律[A(λ)=K×b×c],保留率可用处理前后BT吸光度之比表示[21],计算见公式(1):
(1)
式中:R,BT保留率,%;A1,样品溶液的初始吸光度;A2,热处理后样品溶液的吸光度。
1.3.9.2 pH对BT稳定性的影响
将样品溶液pH值分别调为8.0和11.0,室温避光静置30、60、90、120 min后,采用紫外-可见分光光度计测定溶液在536 nm处的吸光度,根据吸光度计算BT的保留率[22]。
1.3.9.3 金属离子对BT稳定性的影响
将样品溶液分别以1∶1的体积比与0.01 mol/L FeCl3或0.01 mol/L ZnCl2溶液均匀混合,室温避光静置30、60、90、120 min,测定溶液在536 nm处的吸光度,根据吸光度计算BT的保留率[14]。
1.4 数据统计分析
所有实验均独立重复3次,所得数据通过Excel 软件进行处理,并以“平均值±标准差”表示。图表绘制采用Origin Pro 2021软件,数据的显著性差异分析使用IBM SPSS Statistics 22软件,采用Duncan 法进行各数据间的差异显著分析。
2 结果与分析
2.1 BT-MC复合物结构表征
2.1.1 紫外-可见光谱分析
图1为游离BT及BT-MC复合物在300~800 nm处的紫外光谱图。由图1-a可知,BT溶液在536 nm处出现最大吸收峰,且随着浓度的增加,最大吸光度也增加。由图1-b所示,随着BT浓度的增加,BT-MC复合物在536 nm附近的吸光度也增加,且其最大吸收波长红移至538 nm处,表明BT和MC形成复合物。胡婷等[9]研究发现,BT与乳清分离蛋白结合后,乳清分离蛋白的吸光度随BT浓度的增加而增大,证明BT与乳清分离蛋白形成复合物,与本文研究结果一致。
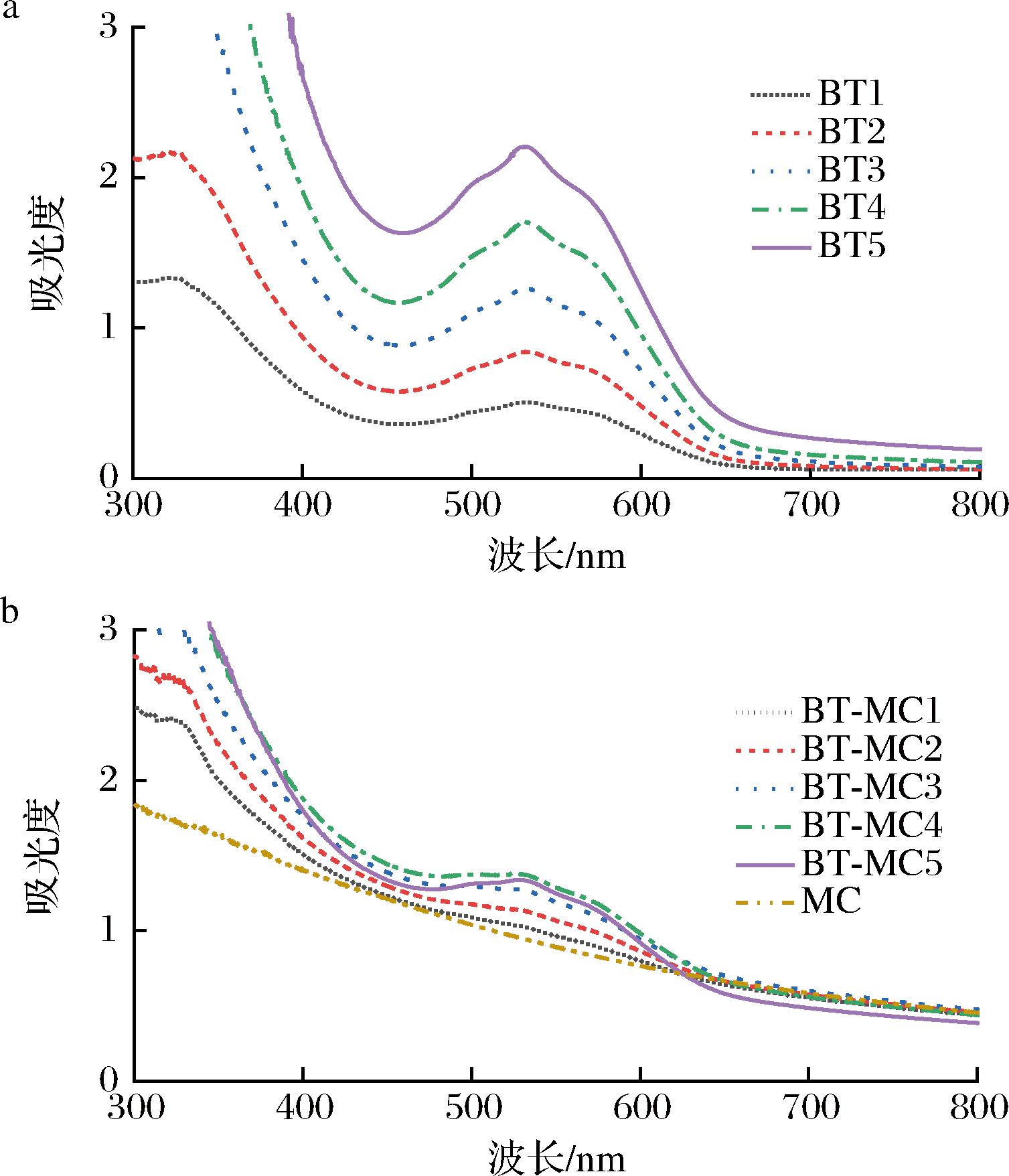
a-游离BT;b-BT-MC复合物
图1 游离BT及BT-MC复合物的紫外光谱图
Fig.1 UV-Vis spectra of BT and BT-MC complexes
2.1.2 荧光光谱分析
由图2可知,MC在352 nm处有最大荧光值(1 513.04),当BT浓度为10 mmol/L时,BT-MC复合物在355 nm处有最大荧光强度(266.59),且MC的最大荧光强度随BT浓度的增加而降低,同时最大发射波长出现红移,表明BT对MC有荧光猝灭作用,即BT与MC以非共价作用结合,形成BT-MC复合物。

图2 BT-MC复合物的荧光光谱图
Fig.2 Fluorescence spectra of BT-MC complexes
MART NEZ等[23]研究发现,BT对11S藜麦种子蛋白的内源荧光有猝灭作用,证实了复合物的形成。另外,BT与大豆分离蛋白结合后,蛋白质同步荧光强度随着BT浓度的增大出现明显下降和轻微红移,表明BT与大豆分离蛋白非共价结合[6]。
NEZ等[23]研究发现,BT对11S藜麦种子蛋白的内源荧光有猝灭作用,证实了复合物的形成。另外,BT与大豆分离蛋白结合后,蛋白质同步荧光强度随着BT浓度的增大出现明显下降和轻微红移,表明BT与大豆分离蛋白非共价结合[6]。
2.1.3 荧光猝灭机制及结合参数
从表1中可以看出,BT对MC的最小猝灭速率常数Kq为(3.22±0.49)×1010 L/(mol·s),大于猝灭剂对分子的最大动态猝灭速率2.0×1010 L/(mol·s),表明BT与MC为静态猝灭过程;随着温度的上升,结合常数Ka呈明显下降趋势,说明温度升高使BT与MC的结合作用减弱;对于结合位点n,温度对其影响较小,3种温度下的MC与BT的结合位点约为1。
表1 MC与BT的结合参数
Table 1 Binding parameters of MC and BT
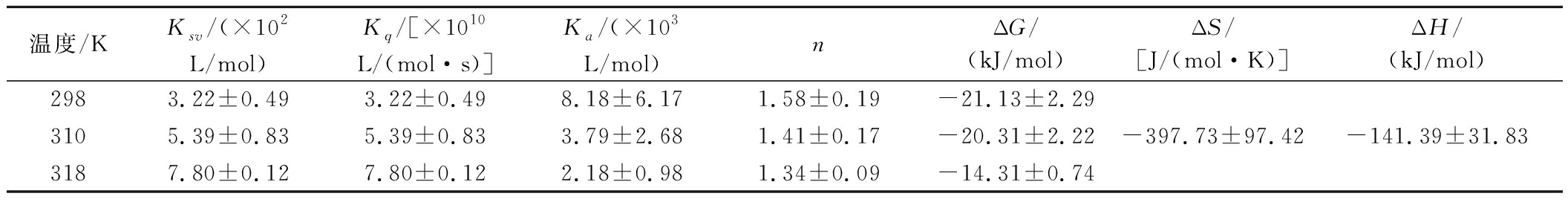
温度/KKsv/(×102L/mol)Kq/[×1010L/(mol·s)]Ka/(×103L/mol)nΔG/(kJ/mol)ΔS/[J/(mol·K)]ΔH/(kJ/mol)2983.22±0.493.22±0.498.18±6.171.58±0.19-21.13±2.293105.39±0.835.39±0.833.79±2.681.41±0.17-20.31±2.22-397.73±97.42-141.39±31.833187.80±0.127.80±0.122.18±0.981.34±0.09-14.31±0.74
由表1中的热力学参数可知,ΔG、ΔH及ΔS均小于零,表明BT与MC结合过程是焓驱动的自发过程,二者主要的相互作用力为范德华力和氢键[24]。
有研究表明,在298 K和310 K下,BT与乳清分离蛋白的结合常数分别为1.78×103 L/mol和2.60×102 L/mol,结合常数随温度的升高而降低,二者作用力为氢键及范德华力[9],与本研究结果一致。
2.1.4 FTIR分析
由图3可知,对于MC,酰胺Ⅰ带1 644.0 cm-1处是C![]() O的伸缩振动,酰胺Ⅱ带1 531.7 cm-1处为N—H的弯曲振动[25]。对于BT,980.14 cm-1处是C—H面外弯曲振动,1 411.2 cm-1处是C—H伸缩振动,1 613.6 cm-1处为C
O的伸缩振动,酰胺Ⅱ带1 531.7 cm-1处为N—H的弯曲振动[25]。对于BT,980.14 cm-1处是C—H面外弯曲振动,1 411.2 cm-1处是C—H伸缩振动,1 613.6 cm-1处为C![]() N伸缩振动,3 298.6 cm-1处为O—H伸缩振动[26]。加入BT后,MC酰胺Ⅰ带红移至1 652.2 cm-1,且BT在1 411.2 cm-1处的峰消失,表明BT与MC结合形成了BT-MC复合物。
N伸缩振动,3 298.6 cm-1处为O—H伸缩振动[26]。加入BT后,MC酰胺Ⅰ带红移至1 652.2 cm-1,且BT在1 411.2 cm-1处的峰消失,表明BT与MC结合形成了BT-MC复合物。
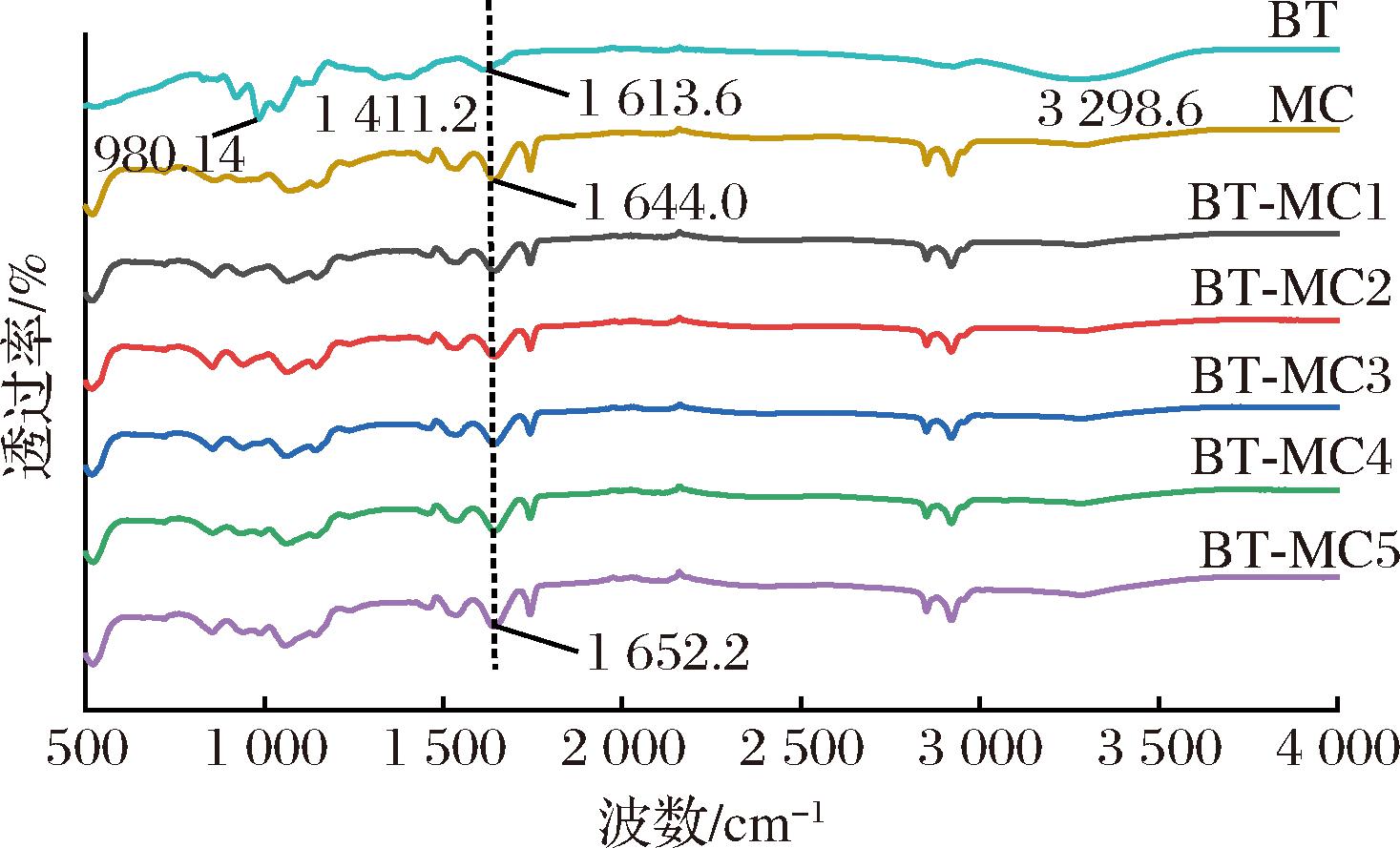
图3 BT-MC复合物的FTIR图
Fig.3 FTIR spectra of BT-MC complexes
对酰胺I带(1 700~1 600 cm-1)进行拟合,得出MC及BT-MC复合物的二级结构如表2所示。与MC相比,复合物中α-螺旋的含量显著增加(P<0.05),β-转角及无规卷曲的含量则降低。即添加BT后,MC二级结构改变,形成了稳定的BT-MC复合物。ZANG等[27]将预热乳清蛋白与花青素混合后,发现蛋白的α-螺旋和无规卷曲减少,β-折叠和β-转角增加,表明二者混合后形成了更稳定的复合物。
表2 BT-MC复合物的二级结构含量 单位:%
Table 2 Secondary structure contents of BT-MC complexes
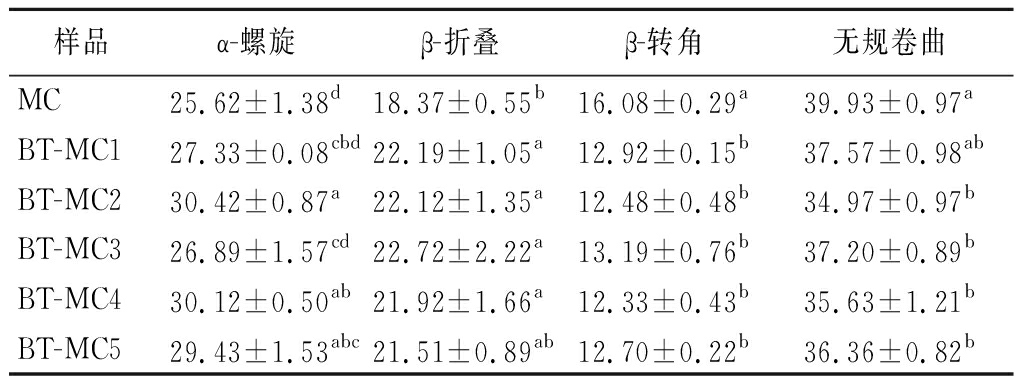
样品α-螺旋β-折叠β-转角无规卷曲MC25.62±1.38d18.37±0.55b16.08±0.29a39.93±0.97aBT-MC127.33±0.08cbd22.19±1.05a12.92±0.15b37.57±0.98abBT-MC230.42±0.87a22.12±1.35a12.48±0.48b34.97±0.97bBT-MC326.89±1.57cd22.72±2.22a13.19±0.76b37.20±0.89bBT-MC430.12±0.50ab21.92±1.66a12.33±0.43b35.63±1.21bBT-MC529.43±1.53abc21.51±0.89ab12.70±0.22b36.36±0.82b
注:不同小写字母表示样品间差异显著(P<0.05)。
2.1.5 XRD分析
由图4可知,MC在20°附近出现1个宽峰,而BT没有任何明显的衍射峰,表明两者均为无定形结构。BT与MC混合后,在32°处出现1个新的晶体衍射峰,且衍射峰强度随着BT浓度增加而略有增强,表明BT-MC复合物形成,且BT浓度越大,作用力越强。根据毕会敏等[28]的研究,添加花青素后,大豆分离蛋白膜在20°处出现衍射峰,说明两者之间形成了较强的分子间作用力,与本研究结果类似。

图4 BT-MC复合物XRD图
Fig.4 XRD patterns of BT-MC complexes
2.1.6 粒径及Zeta电位分析
由5-a可知,复合物粒径小于游离BT粒径,这是由于蛋白质与BT发生相互作用后形成了更紧密的结构,导致整体粒径的减小。另外观察到BT-MC复合物的粒径随着BT浓度的增大而增大,这是由于BT与MC结合,致使MC粒径增大。DAI等[29]的研究显示,随着儿茶素浓度的上升,大豆分离蛋白-儿茶素复合物的粒径增加,说明复合物的形成。另外,BT与大豆分离蛋白、乳铁蛋白以及β-乳球蛋白复合后,粒径均增大,证明形成稳定的体系[30]。
由图5-b可知,游离BT及BT-MC复合物均带负电荷,且BT-MC复合物Zeta电位的绝对值随着BT浓度的增大而增大,表明BT-MC复合物形成。复合物的电位绝对值增加,一方面是由于BT浓度的增加使溶液中负电量增加;另一方面,BT使MC的二级结构发生改变,这种变化可能会减少正电荷基团的暴露,并增加蛋白质的负电荷[19]。
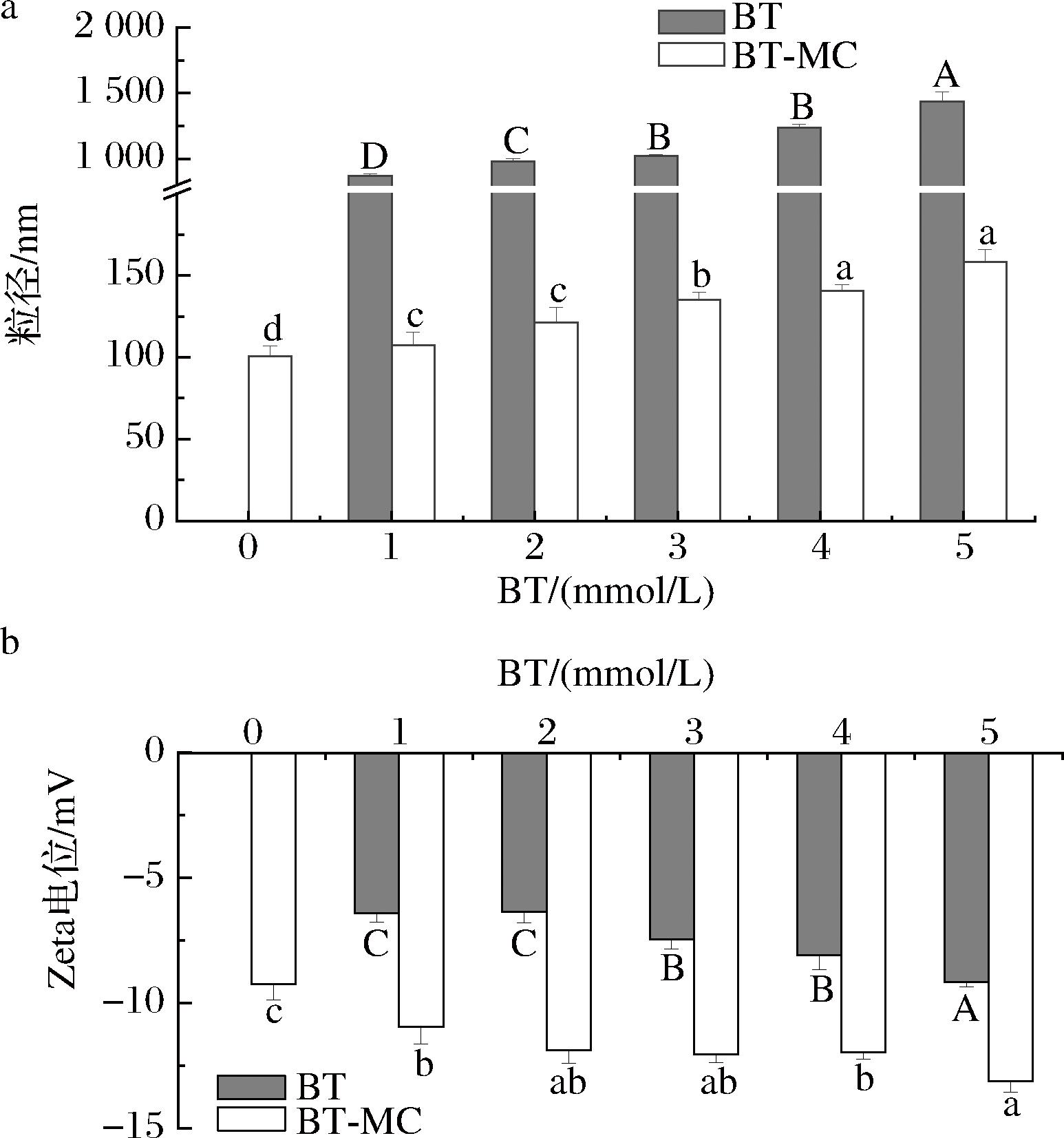
a-粒径;b-Zeta电位
图5 BT-MC复合物的粒径和Zeta电位图
Fig.5 Particle size and Zeta-potential of BT-MC complexes
注:图中不同大写字母表示BT样品间差异显著(P<0.05),不同小写字母表示BT-MC样品间差异显著(P<0.05)(下同)。
2.1.7 TG-DSC分析
图6为BT-MC复合物的DSC和TG曲线。由图6-a可以看出,BT在80 ℃附近出现吸热峰,是由水分的蒸发所致;随着温度继续上升,BT并未出现晶体的熔融吸热峰,说明BT具有无定形结构,与XRD结果一致。当BT与MC发生相互作用后,BT的特征吸热峰消失,与此同时在220 ℃附近出现一个显著的放热峰,这是由于复合物的热分解所致。
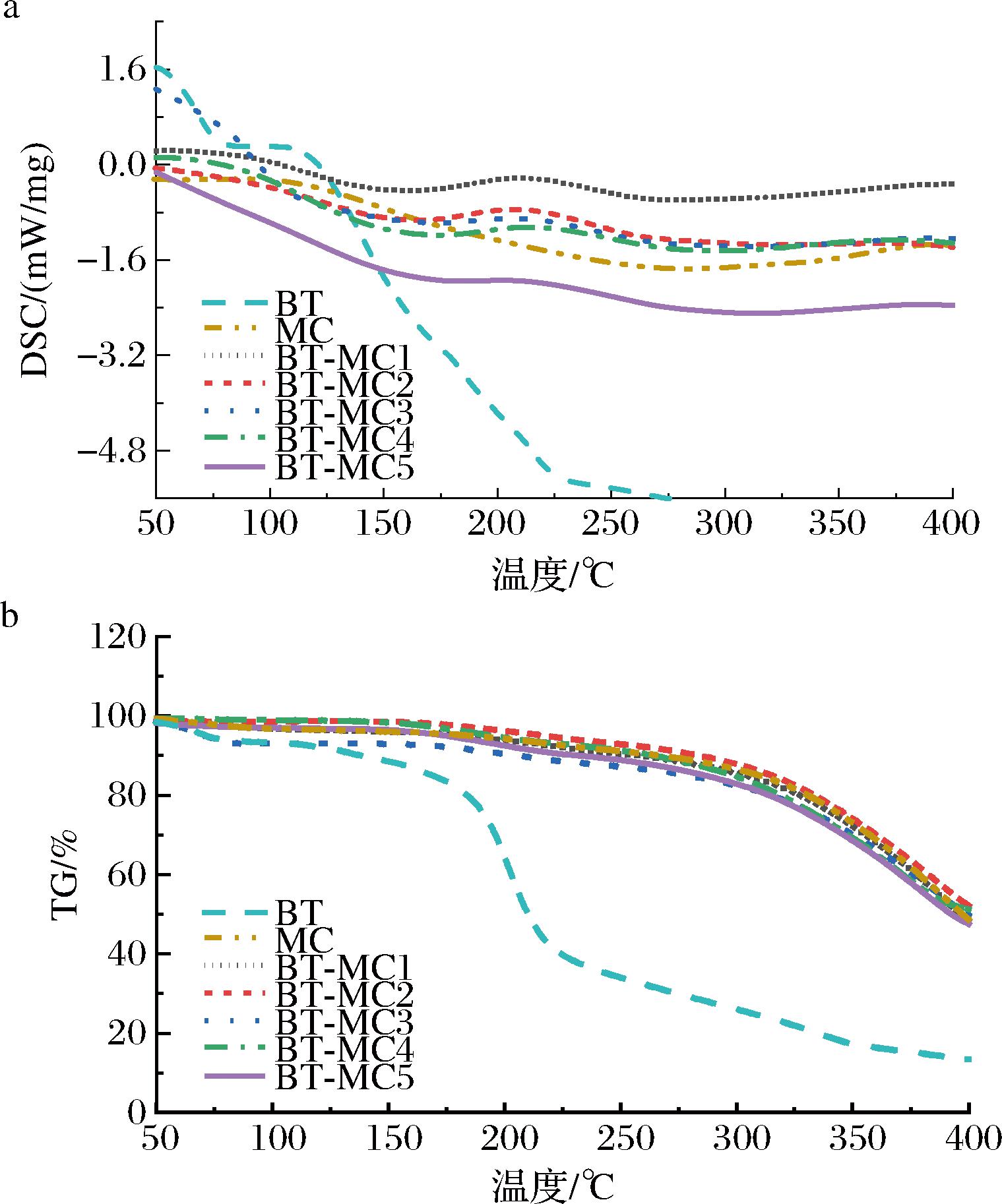
a-DSC;b-TG
图6 BT-MC复合物的DSC和TG曲线
Fig.6 DSC and TG curves of BT-MC complexes
由图6-b可知,游离BT在80 ℃附近出现第一次失重,为水分的蒸发阶段,质量损失为6.93%;第二次失重在180~210 ℃,为BT的热分解,质量损失为31.84%[31]。而BT-MC复合物失重则在200~300 ℃,质量损失约为6%,质量损失率明显低于游离BT,说明复合物的形成可以明显减缓BT的热分解,与MC复合后BT的热稳定性增加。有研究指出,微胶囊化的BT热降解率更低,蛋白质和麦芽糊精体系对BT的热降解起到保护作用[32],与本研究结果一致。
2.2 温度对BT-MC复合物稳定性的影响
2.2.1 不同温度热处理下BT的保留率分析
由图7可知,随着温度的升高,游离BT的保留率下降,且温度越高保留率下降趋势越大。研究指出,温度对BT的稳定性有显著影响,在温度超过40 ℃时,其吸光度明显下降[33]。在40、60、80 ℃的热处理条件下,复合物中的BT降解率均明显低于游离BT,且随着加热时间的延长,复合物中BT的保留率变化不大。其中,BT浓度为1 mmol/L时,在80 ℃高温处理120 min后游离BT的保留率为(29.22±1.64)%,而复合物中BT的保留率为(91.88±0.77)%;当BT浓度为5 mmol/L时,相同条件下BT的保留率从游离状态的(23.90±1.11)%提高至复合物中的(81.07±0.73)%。即,MC负载对BT起到了显著的保护作用,这是由于BT与MC的相互作用增强了其结构的稳定性,缓解了其在高温下的降解速率,进而提高了BT的保留率。综上所述,MC与BT的结合有效增强了BT的热稳定性。
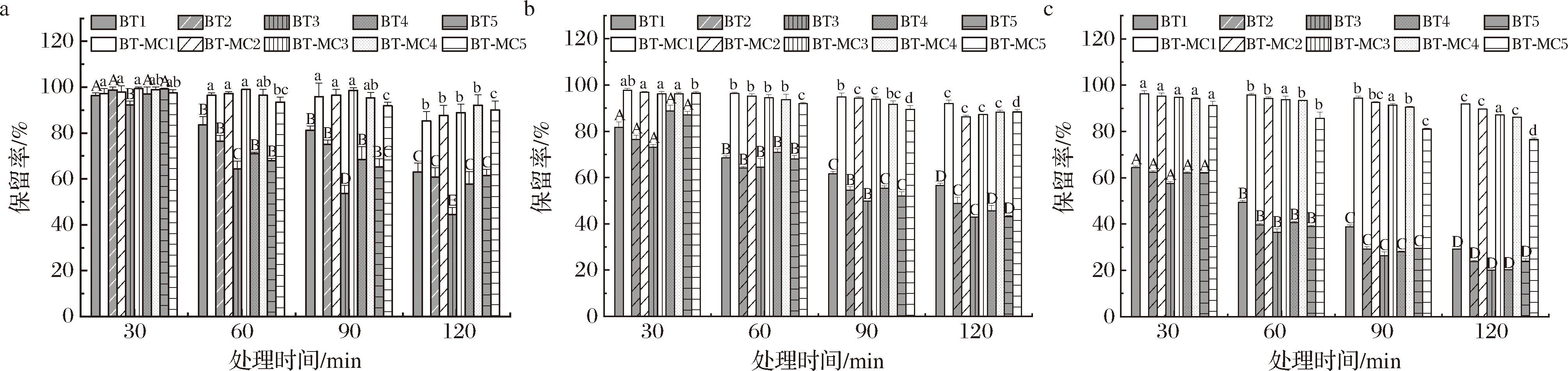
a-40 ℃;b-60 ℃;c-80 ℃
图7 不同温度处理下BT保留率
Fig.7 Retention rate of BT with different heat treatment
2.2.2 不同温度处理对BT-MC复合物粒径和Zeta电位的影响
为了进一步解释MC对BT热稳定性的影响,对40、60、80 ℃下加热120 min的BT-MC复合物进行粒径和Zeta电位分析,结果如图8所示。

a-粒径;b-Zeta电位
图8 不同温度处理120 min后BT及BT-MC复合物的粒径及Zeta电位
Fig.8 Particle size and Zeta-potential of BT and BT-MC complexes after heat treatment at different temperatures for 120 min
如图8-a所示,游离BT的粒径随着热处理温度的增加而明显减小,表明BT在高温下发生降解,且降解程度较高。而随热处理温度的增加,复合物的粒径维持稳定,基本保持在350 nm左右,说明与MC复合能明显改善BT在高温下的降解,与上述保留率的分析结果一致。
由图8-b可知,随着温度的升高,游离BT的负电荷增加,说明高温下BT发生降解。热处理后,BT-MC复合物Zeta电位的变化程度较小,且规律性不强,这是由于与MC复合防止了BT的热降解,提高了其结构稳定性。
2.3 pH对BT-MC复合物稳定性的影响
2.3.1 不同pH处理下BT保留率分析
BT及其衍生物在碱性条件下容易降解,生成甜菜醛氨酸和环多巴-β-葡萄糖苷[34],故选择pH 8.0和11.0条件下研究BT-MC复合物中BT稳定性的变化规律。图9-a和图9-b分别为pH 8.0和pH 11.0下处理不同时间后BT保留率变化。随着碱处理时间的延长,游离BT的保留率下降,表明碱性环境使BT的稳定性降低。但在pH 8.0和11.0条件下,复合物中BT的保留率高于游离BT,如pH 11.0下处理2 h后BT1的保留率为(47.62±0.33)%,而复合物BT-MC1中BT的保留率为(94.00±0.54)%;相同条件下游离BT5的保留率为(56.88±0.42)%,复合物BT-MC5中BT的保留率为(95.54±0.17)%,表明MC负载对BT起到了保护作用。这是由于BT与MC非共价结合后,防止其在强碱环境中水解,从而提高了BT的保留率。
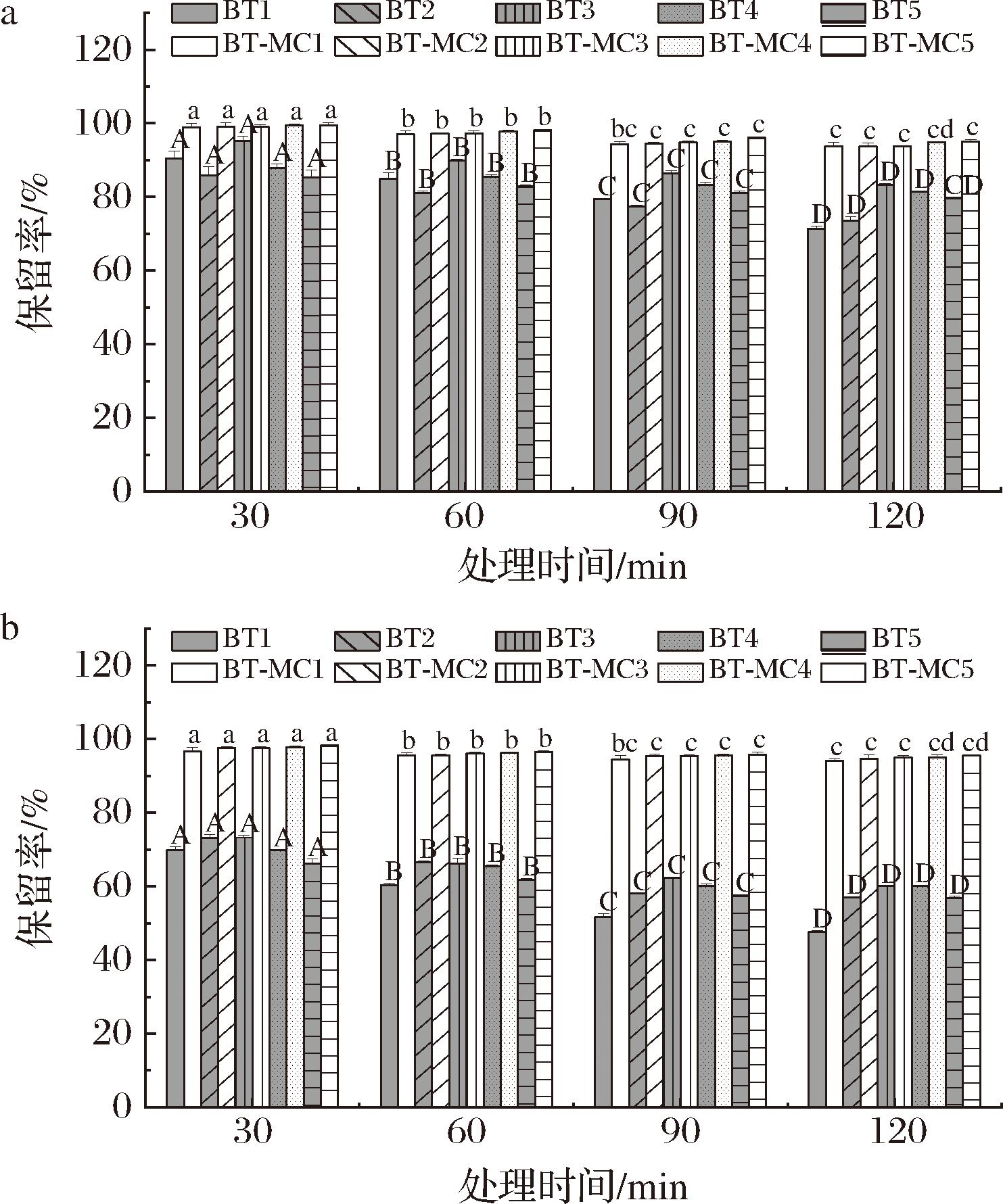
a-pH 8.0;b-pH 11.0
图9 不同pH处理下BT保留率
Fig.9 Retention rate of BT with different pH
2.3.2 pH 11.0处理对BT-MC复合物粒径和Zeta电位的影响
由图10-a可知,pH 11.0时,游离BT的粒径随处理时间的延长而减小,说明BT在强碱性条件下易降解成粒径更小的粒子,即BT大分子在碱性条件下水解成分子质量更小的物质,与上述保留率分析结果一致。就BT-MC复合物而言,随着碱处理时间的延长,粒径的变化程度不大且BT浓度对其影响较小,说明MC与BT复合后能增强BT对强碱的抵御能力,缓解醛胺键在强碱作用下的水解,使BT在碱性环境中的稳定性增加。
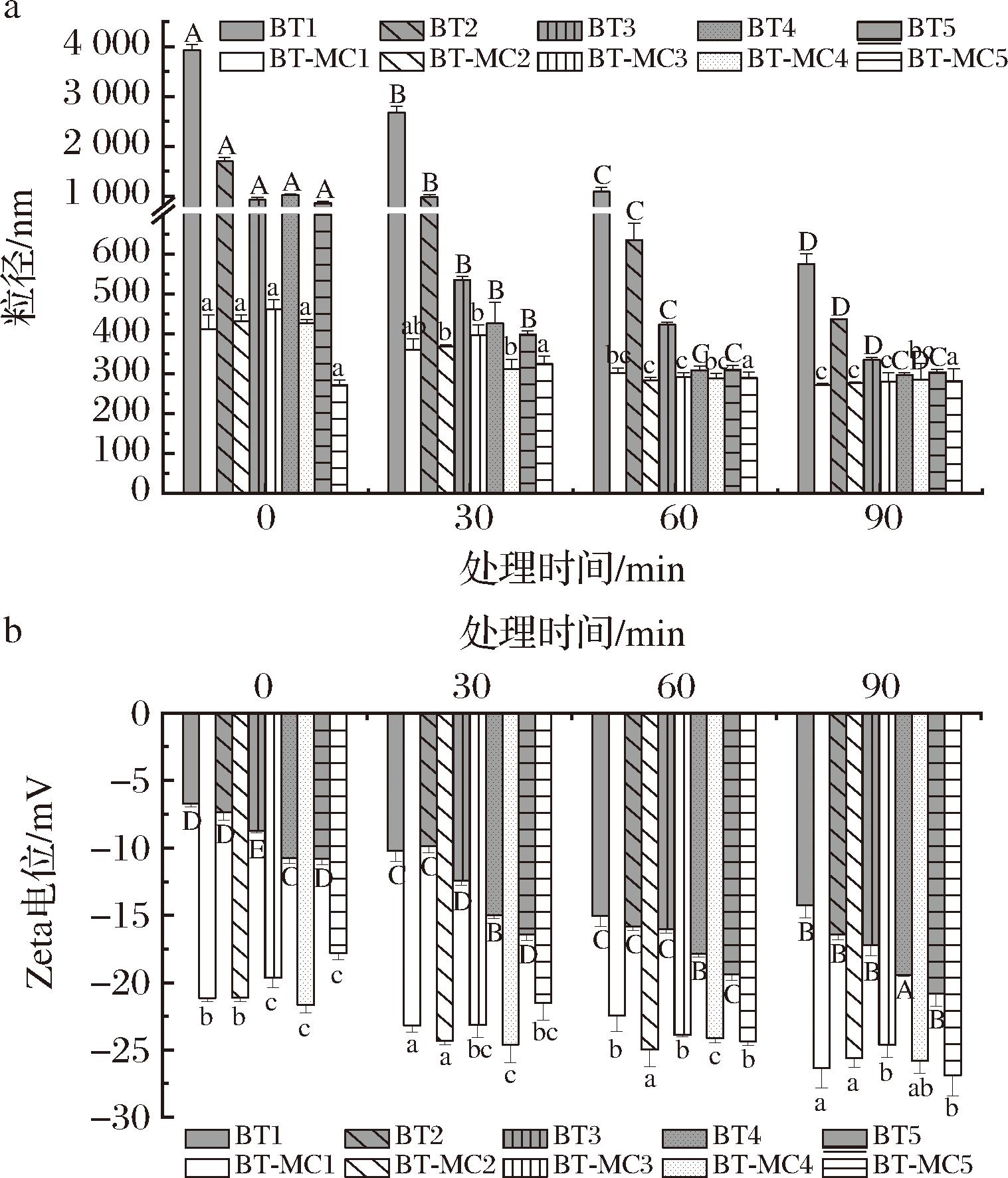
a-粒径;b-Zeta电位
图10 pH 11.0处理下BT及BT-MC复合物的粒径及Zeta电位
Fig.10 Particle size and Zeta-potential of BT and BT-MC complexes at pH 11.0
由图10-b可知,随着碱处理时间的延长,BT所带的负电荷呈现增长趋势,这一现象表明游离BT降解,形成带有更多负电荷基团的分子,而BT-MC复合物的Zeta电位增长趋势不大,即与MC结合后,BT降解程度大幅度减小,稳定性提升。由此可见,在碱性条件下,MC对BT具有较好的保护作用。
2.4 金属离子对BT-MC复合物稳定性的影响
2.4.1 不同金属离子处理下BT保留率分析
Cu2+和Ni2+对BT的稳定性影响较大[35],而Fe3+和Zn2+在食品基质中较为常见,但其对BT稳定性的影响研究较少,故此次选择FeCl3和ZnCl2处理,分析其对BT稳定性的影响。
图11-a和11-b分别为FeCl3和ZnCl2处理不同时间后的BT保留率变化。由图可知,BT的保留率随着金属离子处理时间的延长而降低,这是由于金属离子与BT发生反应,BT褪色。添加Al3+、Cu2+等金属离子后,BT的保留率显著下降,且伴随颜色变化[36]。
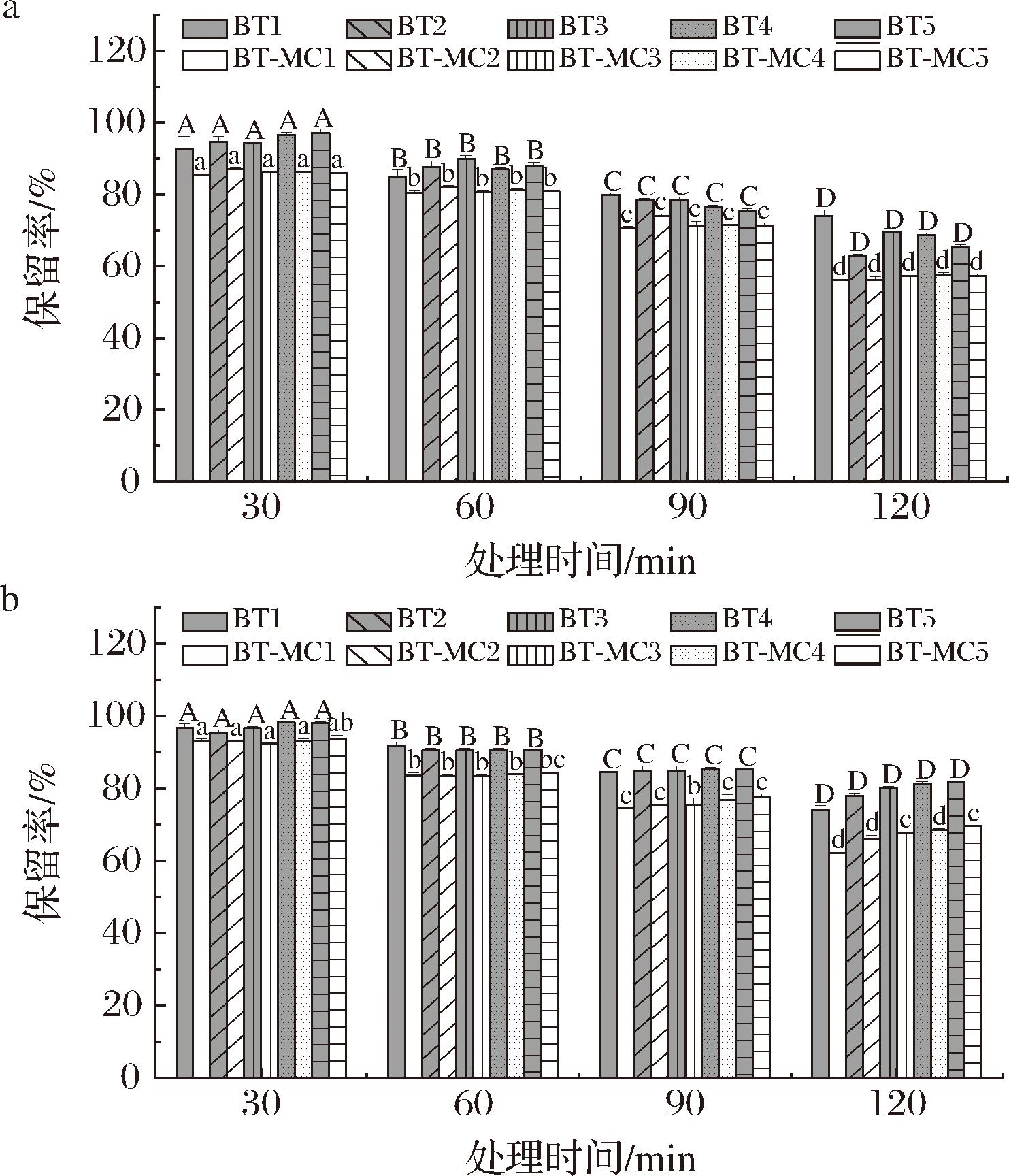
a-Fe3+;b-Zn2+
图11 Fe3+及Zn2+处理下BT保留率
Fig.11 Effect of Fe3+ and Zn2+ on the retention rate of BT
由图11-a可知,加入Fe3+后,与复合物相比,游离BT的保留率更高。加入Fe3+120 min后,1 mmol/L游离BT的保留率为(73.97±1.68)%,而复合物中BT保留率为(56.19±0.20)%。由图11-b可知,加入Zn2+后,游离BT及BT-MC复合物中BT的保留率变化趋势与Fe3+的一致。加入Zn2+120 min后,BT1和BT-MC1中BT的保留率分别为(73.97±1.26)%和(62.10±0.26)%。即在金属离子的处理下,复合物中BT的降解率更高,可见复合物对金属离子更敏感。这可能是Fe3+和Zn2+与蛋白质中的氨基酸残基形成配位键,中和蛋白质负电荷,改变蛋白质的构象,进而影响了MC对BT的保护作用。另一方面,游离BT与金属离子形成稳定的络合物,从而增加其结构的稳定性[1]。与MC结合后,BT与金属离子的络合作用减弱,稳定性下降。
2.4.2 Fe3+对BT-MC复合物粒径和Zeta电位的影响
由图12-a可知,游离BT粒径在加入Fe3+后迅速下降,说明Fe3+与BT反应,使其降解。随着Fe3+处理时间的延长,BT-MC复合物的粒径呈现增长趋势,这可能是Fe3+与MC反应生成了更大的分子,或是Fe3+与MC负载的BT发生络合作用,形成了更大的结构体系。
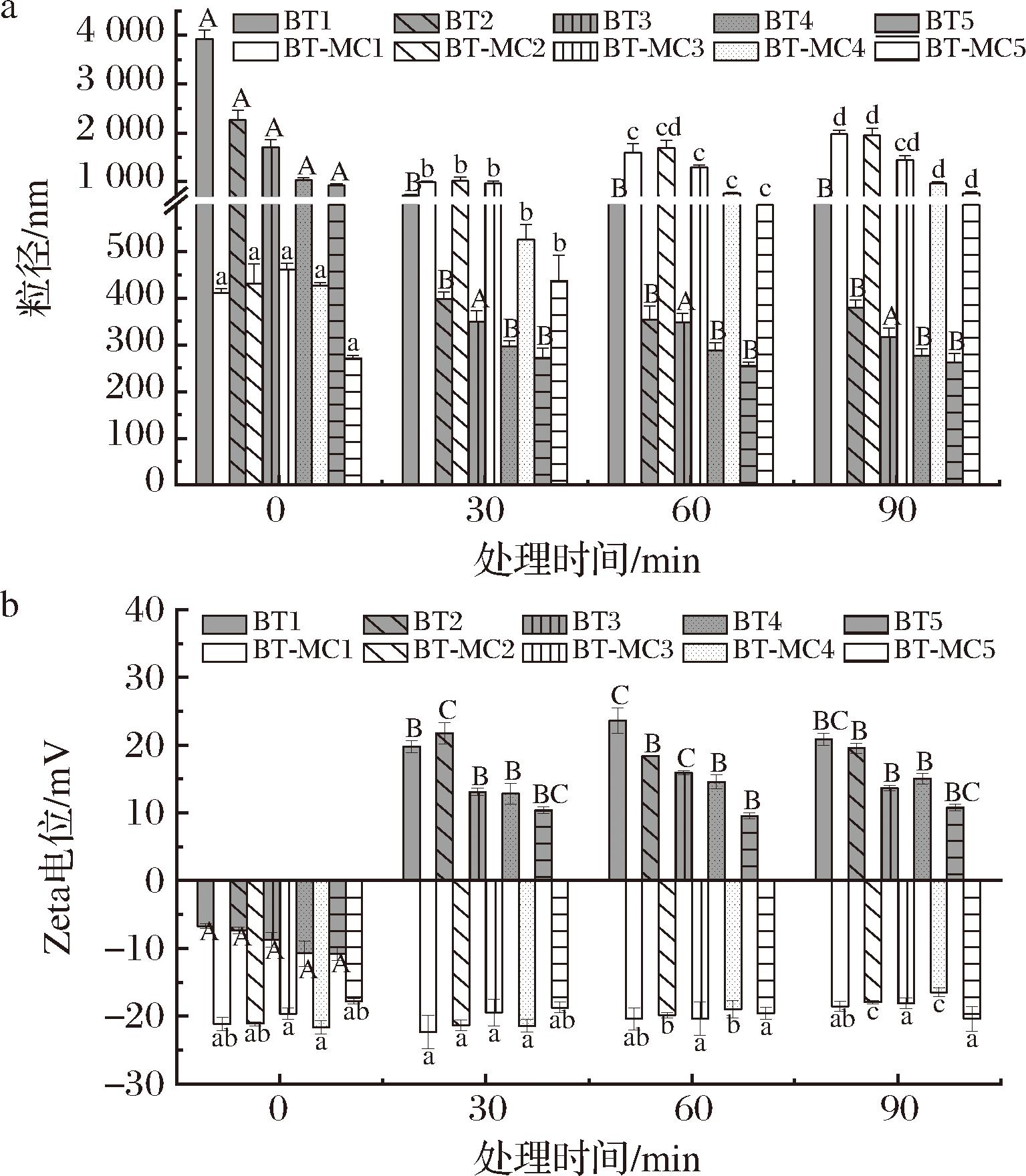
a-粒径;b-Zeta电位
图12 Fe3+处理下BT及BT-MC复合物的粒径及Zeta电位
Fig.12 Particle size and Zeta-potential of BT and BT-MC complexes with addition of Fe3+
由图12-b可以看出,Fe3+的加入使得游离BT的电荷从负变为正,表明Fe3+中和了BT的电荷。而加入Fe3+后,BT-MC复合物Zeta电位绝对值随着处理时间的延长而降低,但依然为负电,说明可能是Fe3+与MC形成了大分子,屏蔽了MC的部分负电荷。综上所述,加入MC使BT的金属离子稳定性下降。
3 结论
以MC为载体,制备了BT-MC非共价复合物。荧光光谱分析结果表明,MC对BT具有较高的亲和性,二者通过范德华力和氢键自发结合形成复合物,结合过程为放热过程。与BT结合后,MC的最大发射波长红移,荧光强度降低,二级结构改变。MC负载有效防止了BT的热降解,经40、60、80 ℃热处理后,复合物中BT的保留率显著高于游离BT。另外,MC负载有效提升了碱性条件下BT的稳定性,使其降解率降低。然而,与游离BT相比,BT-MC复合物中BT对Fe3+和Zn2+更加敏感,降解程度增加。综上所述,MC可作为载体基质,用于BT的负载,以改善其加工稳定性,扩大其在食品工业中的应用范围。
[1] 肖默艳, 黄燕芬, 王东伟, 等.甜菜红素提取、纯化、稳定性及抗氧化活性研究进展[J].食品工业科技, 2019, 40(16):304-311:319.XIAO M Y, HUANG Y F, WANG D W, et al.Advances in extraction, purification, stability and antioxidant activity of betacyanin[J].Science and Technology of Food Industry, 2019, 40(16):304-311;319.
[2] 刘亚昕, 闫桦, 唐玲, 等.红甜菜和甜菜红素的综合应用研究进展[J].中国农学通报, 2022, 38(13):157-164.LIU Y X, YAN H, TANG L, et al.Red beet and betacyanins:Research progress on comprehensive application[J].Chinese Agricultural Science Bulletin, 2022, 38(13):157-164.
[3] SADOWSKA-BARTOSZ I, BARTOSZ G.Biological properties and applications of betalains[J].Molecules, 2021, 26(9):2520.
[4] CAI Y Z, CORKE H.Production and properties of spray-dried Amaranthus betacyanin pigments[J].Journal of food science, 2000, 65(7):1248-1252.
[5] CHRANIOTI C, NIKOLOUDAKI A, TZIA C.Saffron and beetroot extracts encapsulated in maltodextrin, gum arabic, modified starch and chitosan:Incorporation in a chewing gum system[J].Carbohydrate Polymers, 2015, 127:252-263.
[6] ZHAO H S, MA Z, JING P.Interaction of soy protein isolate fibrils with betalain from red beetroots:Morphology, spectroscopic characteristics and thermal stability[J].Food Research International, 2020, 135:109289.
[7] GENG Q, HU T, CHEN J, et al.Emulsion stability enhancement against storage and environment stresses using complex plant protein and betanin[J].Food Bioscience, 2024, 59:104075.
[8] 芦霞, 胡飞.乳蛋白对甜菜红苷热稳定性的影响[J].中国食品学报, 2022, 22(12):94-103.LU X, HU F.Effect of milk proteins on the thermal stability of betanin[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):94-103.
[9] 胡婷, 耿勤, 付敏, 等.多光谱学与分子模拟技术表征甜菜苷与乳清蛋白的相互作用[J].食品工业科技, 2022, 43(23):86-94.HU T, GENG Q, FU M, et al.The interaction between betanin and whey protein:Based on multi-spectroscopy and molecular simulation[J].Science and Technology of Food Industry, 2022, 43(23):86-94.
[10] FOX P F, BRODKORB A.The casein micelle:Historical aspects, current concepts and significance[J].International Dairy Journal, 2008, 18(7):677-684.
[11] SADIQ U, GILL H, CHANDRAPALA J.Casein micelles as an emerging delivery system for bioactive food components[J].Foods, 2021, 10(8):1965.
[12] LANG Y X, LI B, GONG E S, et al.Effects of α-casein and β-casein on the stability, antioxidant activity and bioaccessibility of blueberry anthocyanins with an in vitro simulated digestion[J].Food Chemistry, 2021, 334:127526.
[13] WANG Y C, YANG M, QIN J J, et al.Interactions between puerarin/daidzein and micellar casein[J].Journal of Food Biochemistry, 2022, 46(2):e14048.
[14] 王楠, 杨敏, 郑杰, 等.酪蛋白胶束对原花青素稳定性的影响[J].食品与发酵工业, 2023, 49(3):164-174.WANG N, YANG M, ZHENG J, et al.Effect of micellar casein on the stability of proanthocyanidins[J].Food and Fermentation Industries, 2023, 49(3):164-174.
[15] 瓦文强, 秦娟娟, 杨敏, 等.酪蛋白胶束乳液凝胶性质及其在大黄素负载中的应用[J].食品与发酵工业, 2023, 49(1):132-139.WA W Q, QIN J J, YANG M, et al.Properties of emulsion gel based on casein micelles and its application in emodin loading[J].Food and Fermentation Industries, 2023, 49(1):132-139.
[16] 吕思润. 甜菜红素的提取纯化及其生物活性研究[D].哈尔滨:哈尔滨工业大学, 2024.LYU S M.Extraction and purification of beet erythropoietin and its biological activities[D].Harbin:Harbin Institute of Technology, 2024.
[17] DAI T T, LI R Y, LIU C M, et al.Effect of rice glutelin resveratrol interactions on the formation and stability of emulsions:A multiphotonic spectroscopy and molecular docking study[J].Food Hydrocolloids, 2019, 97:105234.
[18] QIN J J, YANG M, WANG Y C, et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry, 2021, 349:129154.
[19] LI D, ZHAO Y, WANG X, et al.Effects of (+)-catechin on a rice bran protein oil-in-water emulsion:Droplet size, Zeta-potential, emulsifying properties, and rheological behavior[J].Food Hydrocolloids, 2020, 98:105306.
[20] 郑杰, 杨敏, 甄晨波, 等.酪蛋白胶束与多元活性分子的相互作用及其复合物特性[J].食品科学, 2023, 44(14):8-19.ZHENG J, YANG M, ZHEN C B, et al.Interactions between casein micelles and various active molecules and properties of their complexes[J].Journal of Food Science, 2023, 44(14):8-19.
[21] 于明, 张谦, 过利敏, 等.甜菜红素理化性质及其稳定性研究[J].新疆农业科学, 2002, 39(6):331-334.YU M, ZHANG Q, GUO L M, et al.Study on the physicochemical property and stability of the beet red pigment[J].Xinjiang Agricultural Science, 2002, 39(6):331-334.
[22] 张琦, 孟宪军, 孙希云, 等.葡萄籽中原花青素的稳定性研究[J].沈阳农业大学学报, 2006, 37(2):232-234.ZHANG Q, MENG X J, SUN X Y, et al.Stabilization of ability proanthocyanidins from grape seeds[J].Journal of Shenyang Agricultural University, 2006, 37(2):232-234.
[23] MART NEZ J H, VEL
NEZ J H, VEL ZQUEZ F, BURRIEZA H P, et al.Betanin loaded nanocarriers based on quinoa seed 11S globulin.Impact on the protein structure and antioxidant activity[J].Food Hydrocolloids, 2019, 87:880-890.
ZQUEZ F, BURRIEZA H P, et al.Betanin loaded nanocarriers based on quinoa seed 11S globulin.Impact on the protein structure and antioxidant activity[J].Food Hydrocolloids, 2019, 87:880-890.
[24] ROSS P D, SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry, 1981, 20(11):3096-3102.
[25] KONG J L, YU S N.Fourier transform infrared spectroscopic analysis of protein secondary structures[J].Acta Biochimica et Biophysica Sinica, 2007, 39(8):549-559.
[26] AZTATZI-RUGERIO L, GRANADOS-BALBUENA S Y, ZAINOS-CUAPIO Y, et al.Analysis of the degradation of betanin obtained from beetroot using Fourier transform infrared spectroscopy[J].Journal of Food Science and Technology, 2019, 56(8):3677-3686.
[27] ZANG Z H, TIAN J L, CHOU S R, et al.Investigation on the interaction mechanisms for stability of preheated whey protein isolate with anthocyanins from blueberry[J].International Journal of Biological Macromolecules, 2024, 255:127880.
[28] 毕会敏, 徐柠檬, 范方宇.花青素/大豆分离蛋白智能包装膜特性及鱼肉新鲜度监测[J].食品与发酵工业, 2023, 49(7):232-240.BI H M, XU N M, FAN F Y.Characteristics of smart packaging films of anthocyanin/soy protein isolate and monitoring of fish meat freshness[J].Food and Fermentation Industries, 2023, 49(7):232-240.
[29] DAI S C, LIAN Z T, QI W J, et al.Non-covalent interaction of soy protein isolate and catechin:Mechanism and effects on protein conformation[J].Food Chemistry, 2022, 384:132507.
[30] 胡婷, 韩嘉龙, 耿勤, 等.动物蛋白与植物蛋白对甜菜苷的热保护作用机制研究[J].食品工业科技, 2023, 44(7):10-18.HU T, HAN J L, GENG Q, et al.Study of the thermal protection mechanism of animal proteins and plant proteins on betanin[J].Science and Technology of Food Industry, 2023, 44(7):10-18.
[31] DEVADIGA D, AHIPA T N.Betanin:A Red-Violet Pigment-Chemistry and Applications[M].Chemistry and Technology of Natural and Synthetic Dyes and Pigments.London:IntechOpen, 2020.
[32] 楚朝霞. 红甜菜中甜菜红素的提取纯化及其微胶囊制备的研究[D] 哈尔滨:哈尔滨工业大学, 2021.CHU Z X.Extraction and purification of beet erythropoietin from red beet and its microcapsule preparation[D].Harbin:Harbin Institute of Technology, 2021.
[33] 王萍, 闫明哲.红甜菜色素稳定性影响因素研究进展[J].食品与生物技术学报, 2021, 40(7):11-29.WANG P, YAN M Z.Research advances on influencing factors of betalains stability in red beet[J].Journal of Food Science and Biotechnology, 2021, 40(7):11-29.
[34] ABARNA S, ALKA J, SHRUTI S,et al.Betalains stability and antioxidant activity of beetroots:As a function of maturity stage[J].Sugar Tech, 2024, 26(1):77-86.
[35] WYBRANIEC S, STARZAK K, ![]() A,et al.Effects of metal cations on betanin stability in aqueous-organic solutions[J].Food Science and Biotechnology, 2013, 22(2):353-363.
A,et al.Effects of metal cations on betanin stability in aqueous-organic solutions[J].Food Science and Biotechnology, 2013, 22(2):353-363.
[36] 刘冰. 火龙果果皮甜菜红素提取及抗氧化保护作用研究[D].锦州:锦州医科大学, 2018.LIU B.The extraction and antioxidation protection of the betacyanin from the pitaya peel[D].Jinzhou:Jinzhou Medical University, 2018.