赤藓糖醇是一种新型甜味剂,甜度约为蔗糖的60%~70%,但热量仅为蔗糖的5%,同时由于其基本不被人体和肠道微生物利用,不改变血糖浓度和胰岛素水平,备受消费市场关注。赤藓糖醇于20世纪90年代先后被日本、美国、欧洲国家批准作为甜味剂使用,中国于2008年正式发布公告允许赤藓糖醇在食品中适量添加。但由于赤藓糖醇成本较高,其在食品工业中的应用还不广泛。
微生物发酵法是赤藓糖醇主要的工业生产方法,生产菌株以解脂耶氏酵母(Yarrowia lipolytica)为主。为实现赤藓糖醇在食品工业中更为广泛的应用,工业生产技术进步促使成本的持续降低是重要研究方向。近年来赤藓糖醇生产技术相关的要素研究主要从菌种选育、代谢工程、提取纯化工艺等方向展开[1-4]。而从培养基角度进行赤藓糖醇发酵工艺优化的报道相对较少[5-6],TOMASZEWSKA等[7]研究表明,培养基中添加200 μg/L硫胺素可促进酵母细胞生长和赤藓糖醇合成。裴疆森等[8]研究了金属离子对赤藓糖醇转化率的影响,显示Cu2+对转化率有促进作用,Co2+、Fe2+对转化率有抑制作用。
赤藓糖醇工业生产培养基,一般使用酵母浸出物作为有机氮源,而酵母浸出物是一种富含氨基酸、肽、碳水化合物、金属离子、维生素、辅酶等成分的复合营养源[9]。当培养基使用酵母浸出物等成分复杂的有机氮源时,发酵工艺的优化变得复杂,主要原因是有机氮源中影响菌体生长或产物代谢的关键组分难以被识别[10-11]。培养基消耗分析技术常被用于研究发酵过程中细胞吸收利用营养组分的偏好性,以识别影响发酵过程的关键因素,实现发酵工艺更高效的优化[12-13]。本文基于培养基消耗分析技术,研究了解脂耶氏酵母发酵产赤藓糖醇对培养基营养组分的利用偏好性,优化了培养基中磷源、氮源和发酵工艺,提高了赤藓糖醇的发酵技术水平,为降低赤藓糖醇的工业生产成本提供了参考。
1 材料与方法
1.1 菌种与培养基
1.1.1 菌种
解脂耶氏酵母(Yarrowia lipolytica),安琪酵母股份有限公司菌种室保藏。
1.1.2 培养基
摇瓶活化培养基:葡萄糖5 g/L,酵母浸粉5 g/L,其他成分参考文献[1]。
摇瓶种子培养基和发酵培养基,葡萄糖添加量分别为200、310 g/L,其他成分同摇瓶活化培养基。
1.1.3 试剂
酵母浸粉系列、小麦蛋白胨FP220,安琪酵母股份有限公司;酸水解粉,北京鸿润宝顺科技有限公司;氯化铵及其他无机盐,国药集团。
1.2 仪器与设备
M900生物传感器,西尔曼科技有限公司;Agilent 1260型高效液相色谱,美国安捷伦公司;八联5 L平行发酵罐,迪必尔生物工程有限公司;50 L发酵罐,上海保兴生物技术有限公司。
1.3 实验方法
1.3.1 种子培养工艺
酵母菌种在固体培养基完成活化后,挑取单菌落接种至活化培养基,500 mL挡板瓶装液量50 mL,220 r/min转速下30 ℃培养至对数期。后按照5%(体积分数)转接至摇瓶种子培养基,2 L挡板瓶装液量200 mL,240 r/min转速下30 ℃培养至OD600>18备用。
1.3.2 发酵工艺
5 L发酵罐初始装液量3 L,通气1.7 L/min,转速650 r/min。50 L发酵罐初始装液量37 L,发酵过程中转速维持500 r/min,通气量20 L/min。发酵过程pH不调控,接种量均为10%(体积分数)。发酵过程中取样测定葡萄糖、细胞干重、赤藓糖醇含量,每个取样点检测3次。当葡萄糖质量浓度低于5 g/L时放罐,确定发酵周期。
1.3.3 检测方法
a)酵母细胞湿重和干重:取发酵液100 g,5 000 r/min离心10 min,取重相称重,计算细胞湿重质量占比为w。重相按照GB/T 20886.2—2021《酵母产品质量要求 第2部分:酵母加工制品》中6.2节的方法检测水分,每100 g发酵液细胞干重计为 m1。建立OD600与细胞干重的关系式如公式(1)所示:
m1/%=F1×A
(1)
式中:m1,每100 g发酵液中的细胞干重,g/100 g;F1, OD600吸光值对应的每100 g发酵液中的细胞干重,测定值为0.047 3 g/100 g;A,OD600吸光值。
b)培养基中铵根来源氮的质量mH,按公式(2)计算:
mH/g=cH×F2×(1-w)×M
(2)
式中:mH,铵根来源氮质量,g;cH,铵根的质量分数,g/kg,参照GB 5009.234—2016《食品安全国家标准 食品中铵盐的测定》方法检测;F2,铵根中氮的分子质量占比,计算值为0.777 8;w,发酵液中细胞湿重占比,g/100 g;M,发酵液质量,kg,不同取样点发酵罐称量系统实时显示的质量。
培养基中酵母浸粉来源氮的质量mY,计算如公式(3)所示:
(3)
式中:cp,培养基酸溶蛋白质量分数,g/kg,检测方法参考GB/T 22492—2008《大豆肽粉》中附录B;F3,氮折算为蛋白质的系数,6.25。
c)培养基中不同分子质量肽的质量按公式(4)计算:
mPP/g=X×F3×mY
(4)
式中:mPP,不同分子质量肽的质量,g;X,不同分子质量肽的相对分布,%,检测方法参考GB/T 22492—2008《大豆肽粉》中附录A;
d)培养基中总磷质量mP、总硫质量mS分别按公式(5)、公式(6)计算:
mP/g=cP×(1-w)×M
(5)
式中:mP,总磷质量,g;cP,培养基中总磷质量分数,g/kg,参考GB/T 6437—2018《饲料中总磷的测定 分光光度法》检测。
mS/g=cS×(1-w)×M
(6)
式中:mS,总硫质量,g;cS,培养基中总硫质量分数,g/kg,参考GB/T 19203—2003《复混肥料中钙、镁、硫含量的测定》检测。
e)单位质量菌体生产强度按公式(7)计算:
(7)
式中:Rm,单位质量(每100 g发酵液所含的细胞干重)菌体生产强度,g/(L·h·g);ce,赤藓糖醇质量浓度,g/L,参考文献检测方法[8];t,发酵时间,h;m1,细胞干重,g/100 g。
菌体生产强度计算如公式(8)所示:
R/[g/(L·h)]=Rm×M1
(8)
f)糖醇转化率按公式(9)计算:
(9)
式中:q,糖醇转化率,%;v放,放罐体积,L;m补糖,批次流加葡萄糖的质量,g;m底糖,发酵0 h时培养基中葡萄糖质量,g;m残糖,放罐时培养基中残留葡萄糖质量,g。
g)葡萄糖检测方法,使用M900西尔曼生化分析仪。
h)单罐产量按照公式(10)计算:
p/g=ce×v放
(10)
式中:p,赤藓糖醇单罐产量,g。
1.4 数据统计与分析
所有试验均重复3次,实验数据采用Origin 9.0绘图及显著性分析(Turkey检验)。显著性分析结果采用字母分组法,标注有相同字母的为不显著,字母完全不同的为显著。P<0.05表示具有显著性差异。
2 结果与分析
2.1 培养基消耗分析
以酵母浸粉FM902为氮源,添加量5 g/L,在50 L发酵罐上进行赤藓糖醇发酵测试,发酵过程曲线如图1所示。结果显示,0~24 h为对数生长期,细胞干重迅速升高,24 h后,酵母生长进入稳定期,细胞干重维持在一定水平,葡萄糖快速消耗并合成赤藓糖醇;发酵至111 h放罐,赤藓糖醇产率达到188.15 g/L。
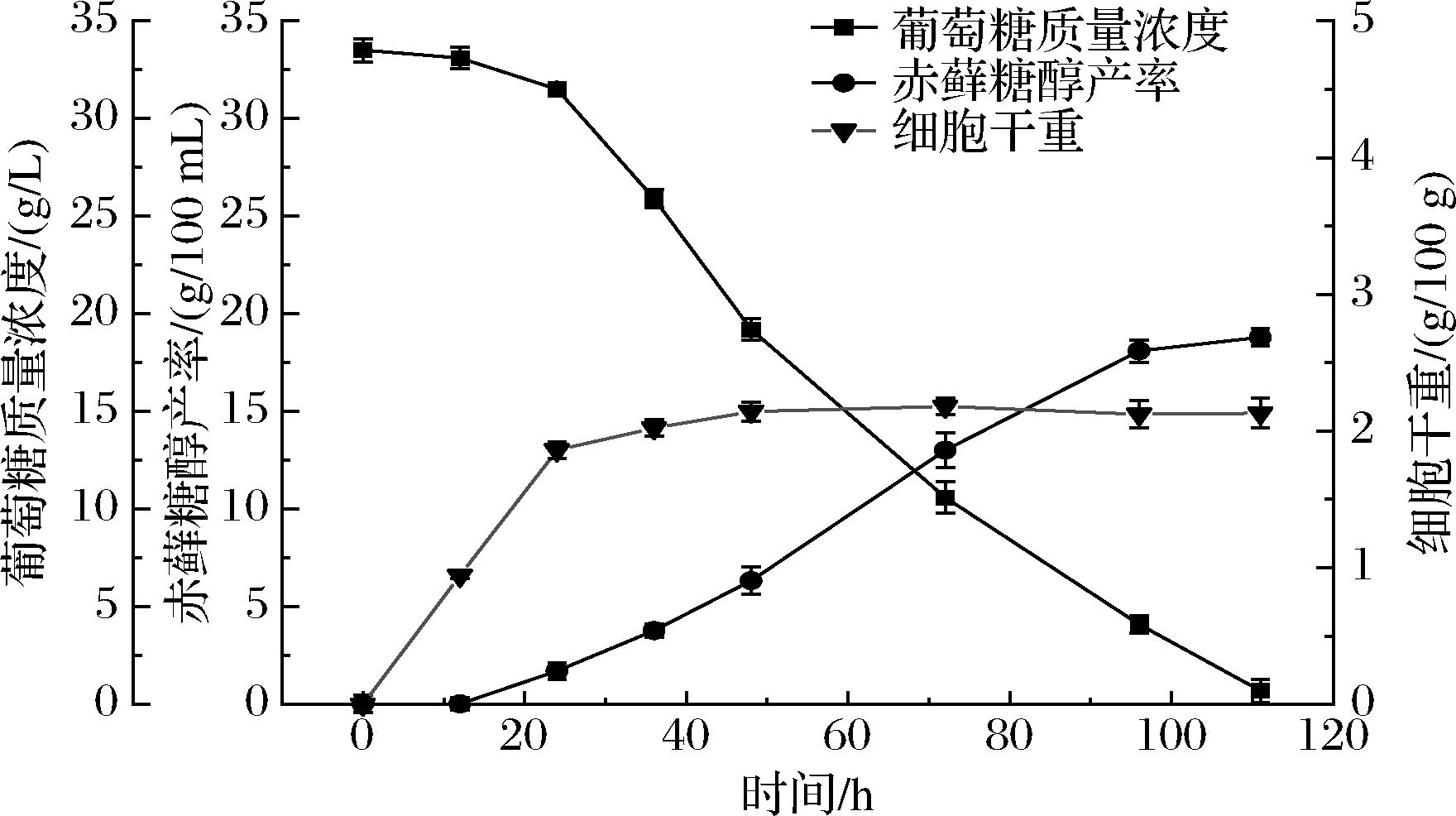
图1 赤藓糖醇发酵过程曲线
Fig.1 Process curves of erythritol fermentation
为了研究赤藓糖醇发酵过程中培养基组分对发酵技术指标的影响,每隔一段时间取样计算培养基中总磷、总硫,铵根来源氮、酵母浸粉来源氮的质量,以确定质量变化曲线。结果如图2-a所示,酵母生长对数期,铵根来源氮消耗率为87.11%,酵母浸粉来源氮消耗率为37.46%,说明菌体生长优先利用铵根;发酵结束时计算的总硫质量消耗率为44.40%,而总磷消耗率为100%,总磷在48 h时检测结果已经为0,表明培养基中磷源添加量不足。
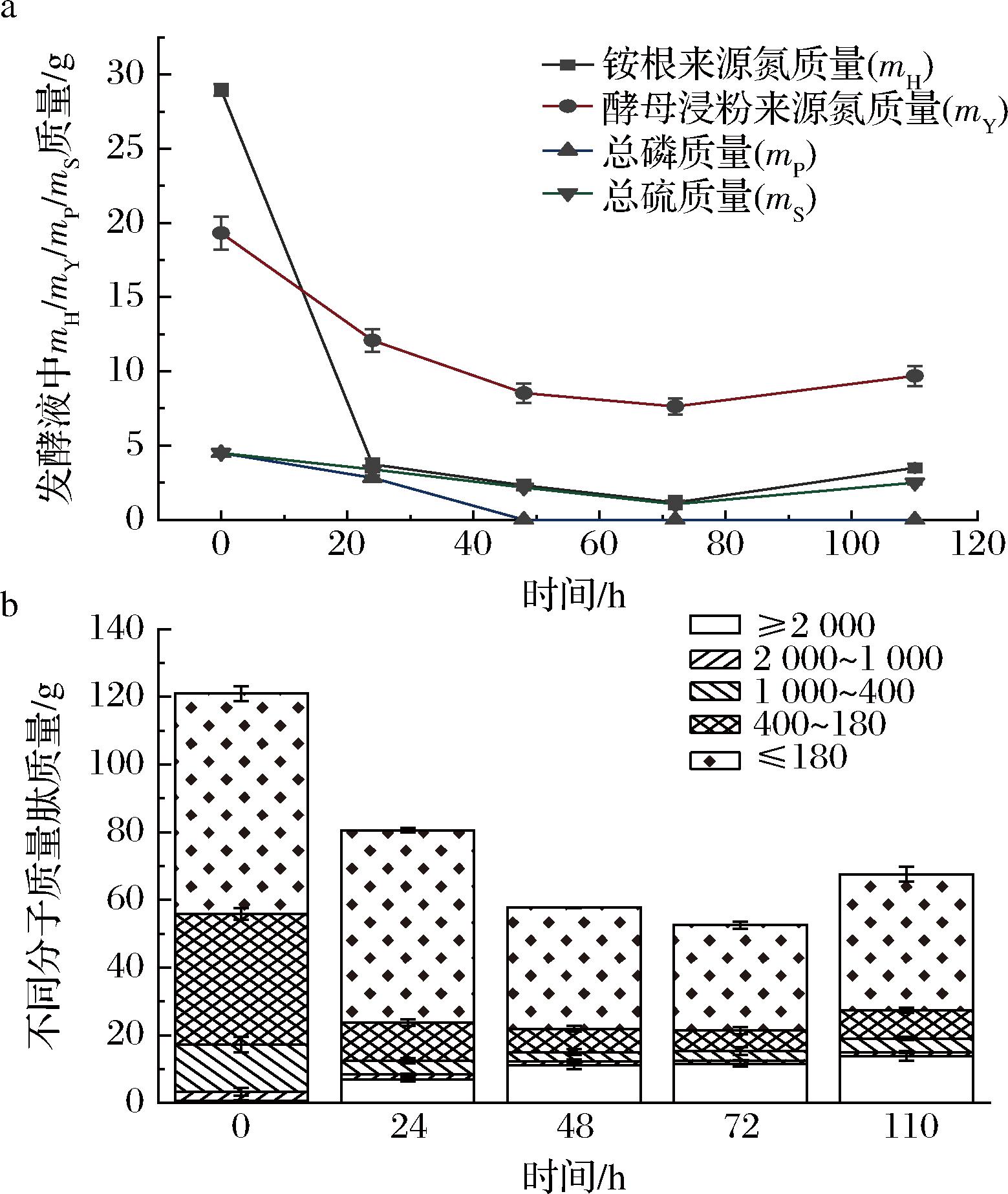
a-氮、磷、硫的质量变化趋势;b-不同分子质量肽的质量变化趋势
图2 培养基中不同营养组分的质量变化趋势
Fig.2 Mass change trend of different nutritional components in culture medium
酵母浸粉中氮源主要是由不同分子质量的肽组成。为了评估酵母细胞对不同肽段利用的偏好性,进一步对比了不同发酵时间培养基中不同分子质量肽的质量变化情况。由图2-b可知,0~72 h,培养基中肽总质量呈现下降趋势,表明肽被酵母细胞吸收消耗;72~110 h,肽总质量略微上升,而分子质量≥2 000 Da的肽在整个发酵过程中呈现上升趋势,这可能与酵母细胞自溶导致胞内蛋白和肽外溢有关。分析不同肽的消耗率,整个发酵过程≤180、180~400、400~1 000、1000~2 000 Da肽的消耗率分别为38.33%、78.04%、71.53%、55.85%,其中0~24 h对数生长期,各肽段的消耗率分别为12.7%、70.59%、70.79%、48.56%,说明酵母细胞在对数生长期优先利用180~1 000 Da的肽,其次是1 000~2 000 Da大分子肽,而≤180 Da的二肽和游离氨基酸最后被利用。
2.2 培养基磷源浓度对赤藓糖醇发酵影响的研究
通过培养基营养组分消耗分析发现,发酵至48 h时培养基中的磷即被消耗完,显示培养基中磷源可能不足。因此进一步对磷源添加量进行优化,分别向培养基中添加0.25、0.5、0.75、1 g/L的KH2PO4,在5 L 罐上进行发酵对比。
发酵对比结果如图3所示,当培养基中KH2PO4质量浓度从对照组的0.25 g/L分别提高至0.5、0.75、1 g/L时,细胞干重则从2.19 g/100 g分别提高到2.66、2.64、2.70 g/100 g,发酵周期分别从112 h缩短至101、101、102 h,单位质量菌体生产强度从0.77 g/(L·h·g)分别降低至0.73、0.74、0.72 g/(L·h·g),提高磷酸盐质量浓度的各试验组相较于对照组,细胞干重、发酵周期、单位菌体生产强度指标,统计学分析均存在显著差异,而试验组不同磷酸盐添加量对赤藓糖醇各发酵指标的影响差异不大。不同KH2PO4浓度对赤藓糖醇产率的影响不显著。试验结果表明,KH2PO4质量浓度提高到0.5 g/L即可显著缩短周期,后期试验采用此添加量。
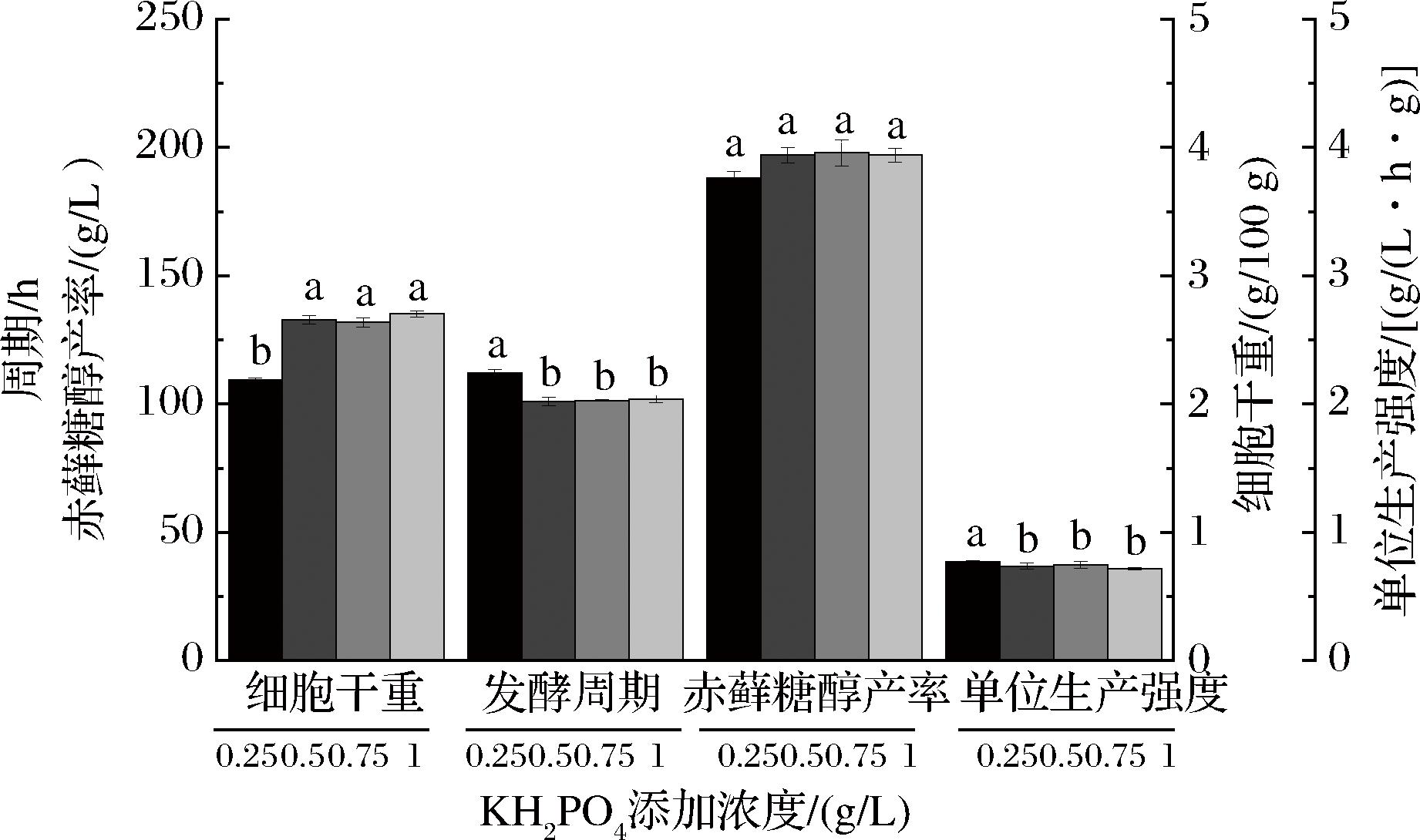
图3 KH2PO4添加浓度对赤藓糖醇发酵生产的影响
Fig.3 The effect of concentration of KH2PO4 on erythritol fermentation
注:不同小写字母表示具有显著性差异(P<0.05)(下同)。
2.3 不同氮源对酵母生长及耗糖速率的影响
培养基中氮的消耗数据分析显示,酵母生长优先利用![]() 中的氮,其次是分子质量180~1 000 Da的肽,因此进一步选择不同肽分子质量分布的氮源验证其对赤藓糖醇发酵的影响。以5 g/L酵母浸粉FM902的含氮量为基准氮浓度,根据氮浓度一致原则确定各氮源添加量,在5 L罐上进行赤藓糖醇发酵对比测试。不同氮源肽相对分子质量分布、含氮量及在本试验中的氮源添加量如表1所示。不同氮源的180~1 000 Da肽含量,小麦蛋白胨FP220、酵母浸粉FM860最高;其次为酵母浸粉FM902、酵母浸粉FM936,且肽含量与小麦蛋白胨FP220、酵母浸粉FM860存在显著差异;酸水解粉含量最低,肽含量与其他组差异显著。
中的氮,其次是分子质量180~1 000 Da的肽,因此进一步选择不同肽分子质量分布的氮源验证其对赤藓糖醇发酵的影响。以5 g/L酵母浸粉FM902的含氮量为基准氮浓度,根据氮浓度一致原则确定各氮源添加量,在5 L罐上进行赤藓糖醇发酵对比测试。不同氮源肽相对分子质量分布、含氮量及在本试验中的氮源添加量如表1所示。不同氮源的180~1 000 Da肽含量,小麦蛋白胨FP220、酵母浸粉FM860最高;其次为酵母浸粉FM902、酵母浸粉FM936,且肽含量与小麦蛋白胨FP220、酵母浸粉FM860存在显著差异;酸水解粉含量最低,肽含量与其他组差异显著。
表1 不同氮源肽分子质量分布及氮含量对比
Table 1 Comparison of molecular weight distribution and nitrogen content of different nitrogen sources
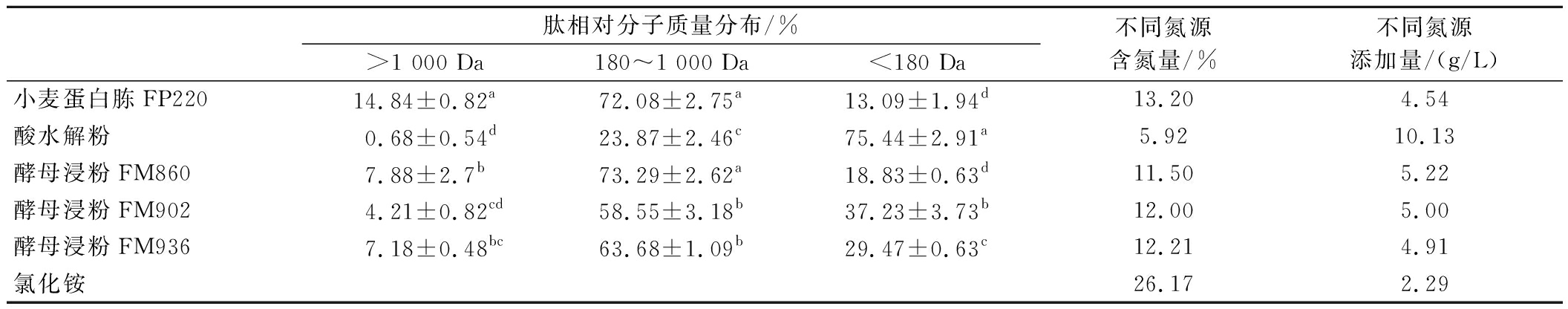
肽相对分子质量分布/%>1 000 Da180~1 000 Da<180 Da不同氮源含氮量/%不同氮源添加量/(g/L)小麦蛋白胨FP22014.84±0.82a72.08±2.75a13.09±1.94d13.204.54酸水解粉0.68±0.54d23.87±2.46c75.44±2.91a5.9210.13酵母浸粉FM8607.88±2.7b73.29±2.62a18.83±0.63d11.505.22酵母浸粉FM9024.21±0.82cd58.55±3.18b37.23±3.73b12.005.00酵母浸粉FM9367.18±0.48bc63.68±1.09b29.47±0.63c12.214.91氯化铵26.172.29
注:不同小写字母表示具有显著性差异(P<0.05)(下同)。
图4显示了不同氮源对酵母生长速率和耗糖速率的影响。由图4-a可知,酵母浸粉FM860、FM902和FM936试验组酵母生长速率整体高于其他组。其中,相较于酵母浸粉FM902和FM936试验组,180~1 000 Da肽含量更高的酵母浸粉FM860试验组酵母生长速率更快;而180~1000 Da肽含量相近的小麦蛋白胨FP220试验组酵母生长速率则更慢;氯化铵和酸水解粉试验组均表现出较差的酵母生长速率。
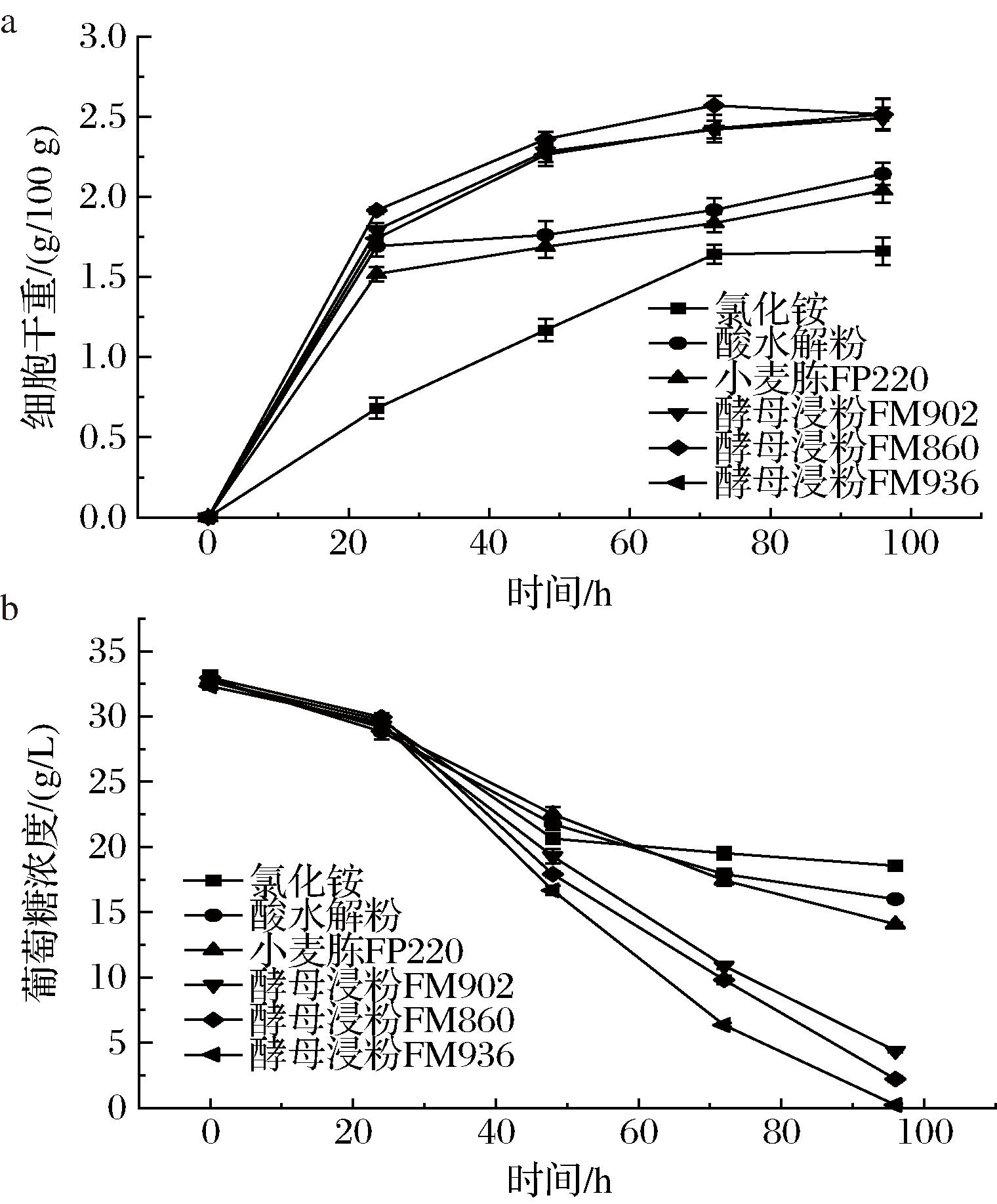
a-细胞干重变化曲线;b-葡萄糖浓度变化曲线
图4 不同氮源对酵母生长和耗糖速率的影响
Fig.4 The effect of different nitrogen sources on yeast growth and glucose consumption rate
从图4-b的耗糖速率来看,酵母浸粉FM936试验组耗糖速率最快,其次是酵母浸粉FM860和FM902试验组,而氯化铵、酸水解粉、小麦蛋白胨FP220试验组的耗糖速率远低于酵母浸粉组,其中氯化铵试验组耗糖速率最慢,特别是发酵48 h后耗糖几乎停滞。使用酵母浸粉FM936为氮源时,发酵周期最短,后期的优化试验围绕酵母浸粉FM936。
2.4 不同氮源组合对赤藓糖醇发酵生产的影响
由2.3节的试验结果可以推断,营养成分复杂的酵母浸粉对赤藓糖醇发酵生产起着关键作用,可能影响解脂耶氏酵母对NH4+和肽的吸收利用,从而影响细胞生长和转化利用葡萄糖的能力。因此进一步以酵母浸粉FM936搭配氯化铵,以及富含180~1 000 Da肽的小麦蛋白胨FP220、酵母浸粉FM860使用,验证氮源组合对赤藓糖醇发酵的影响。对照组为酵母浸粉FM936,试验组以1 g/L或2 g/L氯化铵、小麦蛋白胨FP220、酵母浸粉FM860搭配酵母浸粉FM936使用,有机氮源总添加量均为5 g/L。
由图5-a可知,当4 g/L酵母浸粉FM936,分别搭配1 g/L氯化铵、小麦蛋白胨FP220或酵母浸粉FM860时,酵母生长速率相较于对照组均实现了提高。但只有FP220和FM860试验组,耗糖速率高于对照。当3 g/L酵母浸粉FM936,分别搭配2 g/L氯化铵、小麦蛋白胨FP220或酵母浸粉FM860时,氯化铵、小麦蛋白胨FP220试验组酵母生长速率低于对照,酵母浸粉FM860试验组高于对照。而所有试验组,耗糖速率均低于对照组。
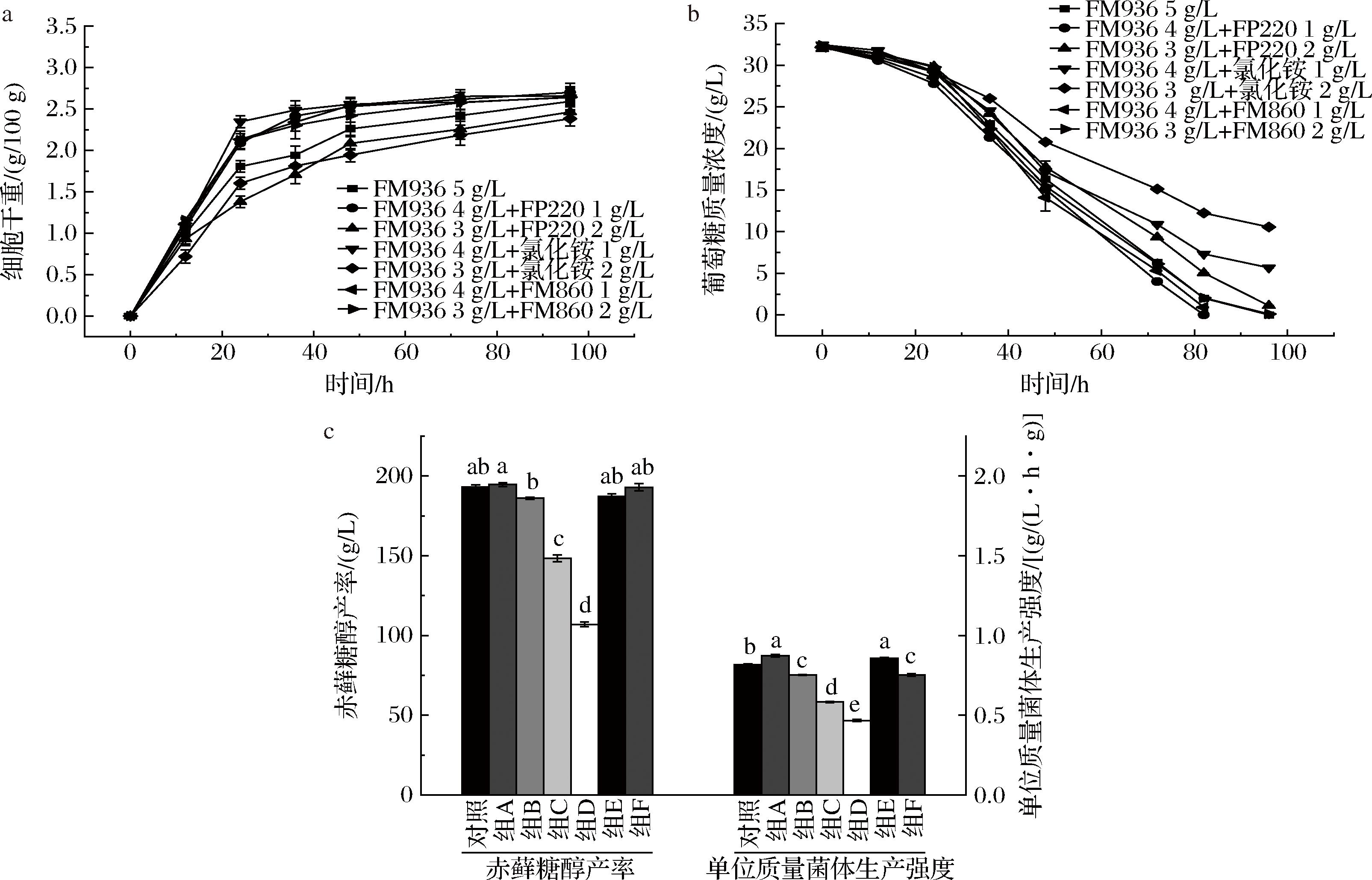
对照:FM936 5 g/L;组A:FM936 4 g/L+FP220 1 g/L;组B:FM936 3 g/L+FP220 2 g/L;组C:FM936 4 g/L+1 g/L氯化铵;组D:FM936 3 g/L+2 g/L氯化铵;组E:FM936 4 g/L+FM860 1 g/L;组F:FM936 3 g/L+FM860 2 g/L。a-细胞干重;b-葡萄糖浓度;c-单位质量菌体生产强度和赤藓糖醇产率
图5 不同氮源组合对赤藓糖醇发酵的影响
Fig.5 The effect of different nitrogen source combinations on erythritol fermentation
为了进一步研究氮源对葡萄糖转化能力的影响,对赤藓糖醇产率和单位质量菌体生产强度进行统计学分析。当酵母浸粉FM936分别搭配1 g/L酵母浸粉FM936或小麦蛋白胨FP220时,相较于对照组赤藓糖醇产率无显著性差异,但单位质量菌体生产强度从对照组的0.81 g/(L·h·g),分别升高至0.89、0.86 g/(L·h·g),差异均显著。但当酵母浸粉FM936添加量减少至3 g/L时,试验组单位质量菌体生产强度均显著下降。试验确定了最优的氮源组合方案为4 g/L FM936 +1 g/L FP220。
2.5 批次补糖工艺提高赤藓糖醇发酵技术水平
对比5 g/L酵母浸粉FM902,5 g/L酵母浸粉FM936及4 g/L FM936+1 g/L FP220在不同时间段的平均耗糖速率,结果如图6所示,耗糖速率呈现相似的变化趋势,即0~48 h逐渐升高,48 h后逐步降低。4 g/L FM936+1 g/L FP220相较于酵母浸粉FM902和FM936,耗糖速率在整个发酵周期内均实现了提高,至发酵放罐耗糖速率仍维持在3.99 g/L的较高水平。
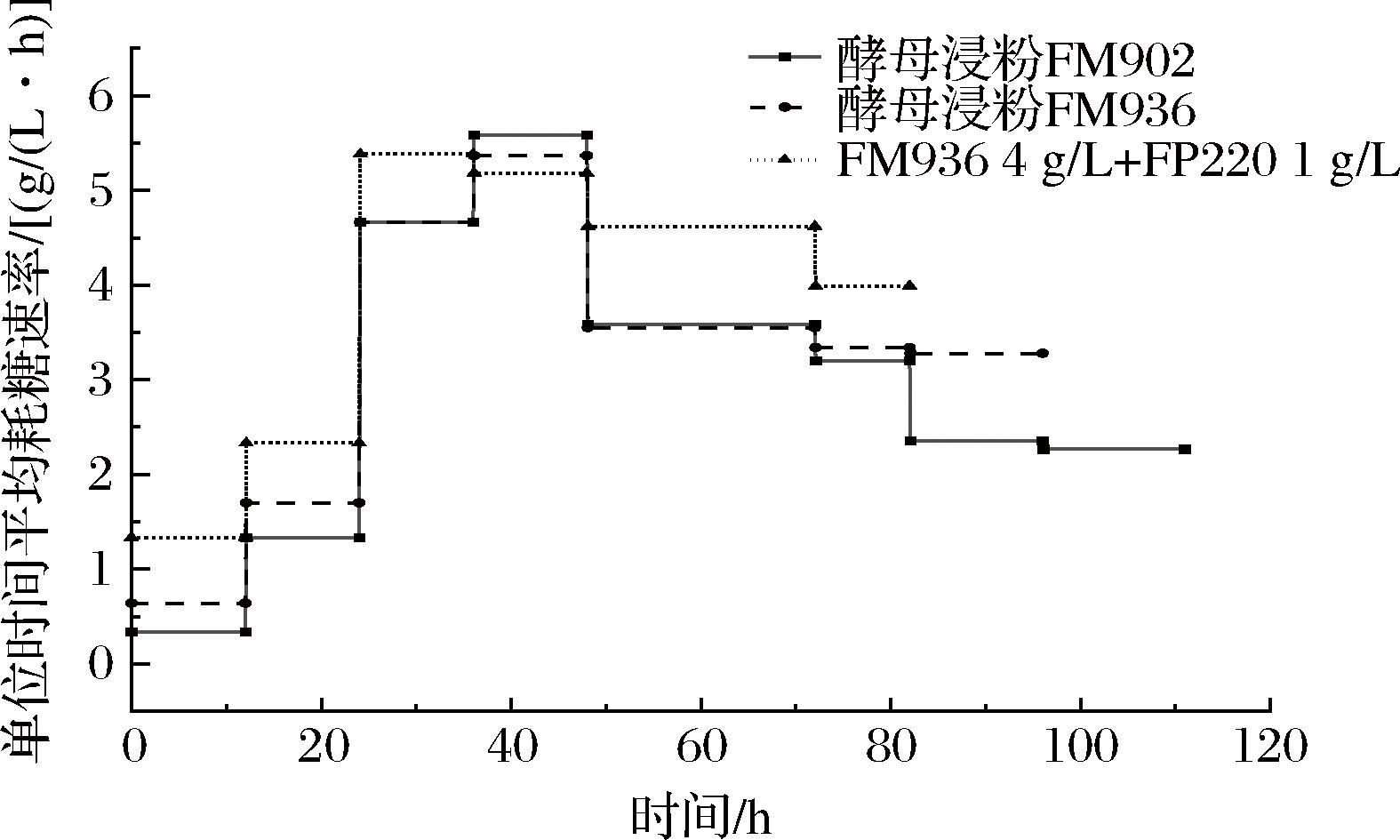
图6 不同氮源条件下耗糖速率对比
Fig.6 Comparison of sugar consumption rate using different nitrogen sources
根据行业经验,由于赤藓糖醇发酵中后期会产生大量的泡沫导致液位高,初始装液量一般为发酵罐体积的75%左右。但考虑到发酵周期内水分蒸发量约为初始发酵体积的8%。综合考虑耗糖速率和装液体积,发酵中后期批次补糖提高放罐体积以此提高发酵单罐产量。
为了验证补糖工艺,以4 g/L FM936+1 g/L小麦蛋白胨FP220为氮源,在50 L发酵罐上进行赤藓糖醇发酵测试,对照组使用酵母浸粉FM902为氮源且不补糖,试验组在第 48、60、72 h批次流加600 g/L的糖液3 L。发酵对比结果如图7所示,对照组赤藓糖醇产率、糖醇转化率、发酵周期结果分别为188.15 g/L、53.17%、111 h,而发酵48 h批次补糖试验组的结果为220.53 g/L、60.88%、94 h,发酵60 h批次补糖试验组结果为222.11 g/L、61.71%、92 h,发酵72 h批次补糖试验组结果为218.85 g/L、61.55%、93 h。统计学分析结果显示,试验组3种补糖工艺的赤藓糖醇产率、糖醇转化率相较对照组均显著提高,发酵周期显著缩短,而试验组不同时间批次补糖的3种工艺间发酵结果均无显著差异。赤藓糖醇单罐产量方面,对照组为6.4 kg,试验组48、60、72 h补糖工艺分别为8.17、8.24、8.23 kg,分别较对照组提高27.66%、28.75%、28.59%。生产强度方面,对照组为1.7 g/(L·h),而3种补糖工艺分别为2.35、2.41、2.35 g/(L·h),相较于对照提高38.24%、42.01%、38.24%。综合评估,发酵60 h批次补糖工艺效果最优。
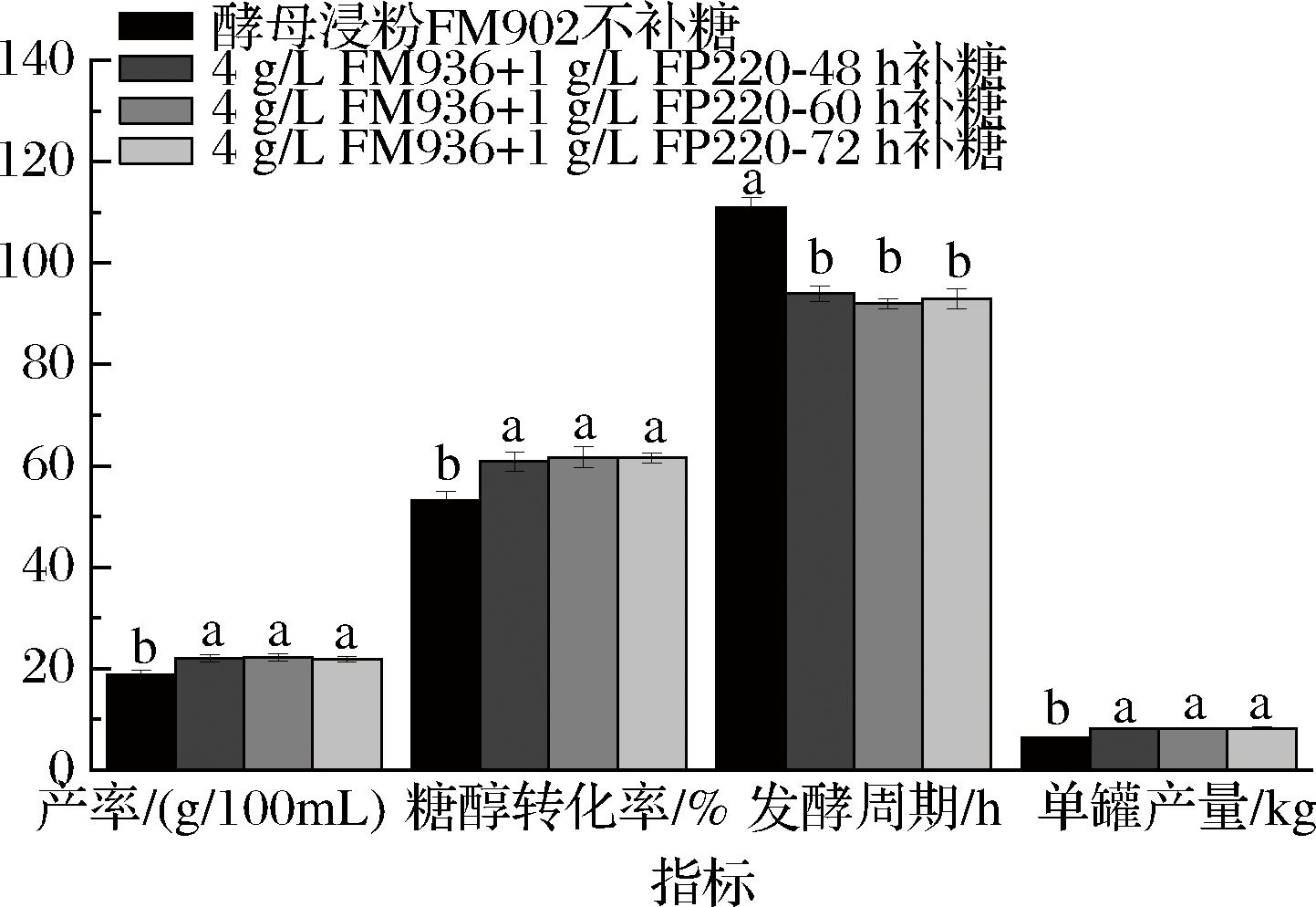
图7 发酵工艺优化前后结果对比
Fig.7 Comparison of results before and after optimization of fermentation process
3 结论与讨论
本文基于培养基消耗分析,研究了赤藓糖醇发酵过程中解脂耶氏酵母对磷、氮、硫的需求和利用偏好性,分析了磷源、不同氮源对解脂耶氏酵母生长和细胞活性的影响。
培养基消耗分析试验结果发现,培养基中磷源KH2PO4浓度不足,提高KH2PO4的添加量后,细胞干重显著提高,发酵周期显著缩短,赤藓糖醇产率差异性不大,单位质量菌体生产强度显著下降。试验结果表明,培养基中KH2PO4浓度提高,主要是解除了培养基中磷源的限制,提高了细胞干重,使得耗糖速率加快,从而发酵周期缩短。单位菌体生产强度下降,说明KH2PO4浓度的提高没有改善细胞活力,可能原因是培养基中原有![]() 浓度能够满足解脂耶氏酵母在高渗环境中细胞活性的维持和能量代谢的需要[14-15],而细胞增殖所有的磷元素是不足的。
浓度能够满足解脂耶氏酵母在高渗环境中细胞活性的维持和能量代谢的需要[14-15],而细胞增殖所有的磷元素是不足的。
解脂耶氏酵母对不同来源氮的利用偏好性研究结果显示,培养基中的NH4+、180~1 000 Da的肽被优先利用,氨基酸最后被利用,且利用率最低。王文丽等[16]和朱丹凤等[17]对罗伊氏乳杆菌、两歧双歧杆菌氮源利用偏好性研究结果也表明,乳酸菌生长优先利用肽而不是氨基酸,结果是一致的。但当以氯化铵、富含180~1 000 Da肽的小麦蛋白胨FP220为氮源时,解脂耶氏酵母的生长速率、耗糖速率均较180~1 000 Da肽含量低的酵母浸粉FM902、FM936更慢。试验结果表明,在赤藓糖醇高渗透压发酵中,成分复杂的酵母浸粉,相较于成分简单的小麦蛋白胨、氯化铵,具有更好促进细胞生长和转化利用葡萄糖的能力,这与JEYA等[18]的研究结果是一致的,类似的结论在酿酒酵母和大肠杆菌培养中被发现[19-20]。进一步使用酵母浸粉FM936搭配180~1 000 Da肽含量更高的小麦蛋白胨FP220或酵母浸粉FM860,验证添加酵母浸粉时补充肽对酵母生长和赤藓糖醇合成的影响,结果显示,当酵母浸粉FM936添加4 g/L,小麦蛋白胨FP220或酵母浸粉FM860添加1 g/L时,解脂耶氏酵母生长速率,细胞转化葡萄糖合成赤藓糖醇的能力均显著提高。YANG等[21]的研究结果也表明,肽相较于等量的氨基酸,具有更好地促进酵母增殖,提高细胞活性的作用。但当180~1 000 Da肽浓度进一步提高,酵母浸粉FM936浓度继续下降时,解脂耶氏酵母转化葡萄糖合成赤藓糖醇的能力显著下降,说明酵母浸粉FM936中可能存在影响细胞活力的关键成分。进一步对酵母浸粉FM936中影响赤藓糖醇合成的关键组分进行识别,这是未来工作的重要方向。
在磷源和氮源的优化的基础上,进一步开发了批次补糖工艺。相较于优化前使用酵母浸粉FM902不补糖工艺,使用4 g/L FM936+1 g/L FP220氮源组合方案并在发酵至60 h批次流加3 L 600 g/L的糖液时,糖醇转化率可提高16.06%,单罐产量提高了28.75%,生产强度提高了42.01%,大幅度提高了发酵技术水平[22-23]。这对于赤藓糖醇发酵工艺的优化和工业生产成本的降低具有重要的指导意义。
[1] 邱学良. 产赤藓糖醇亚罗解脂酵母的耐热机制分析及组合策略改造[D]. 江南大学, 2020.QIU X L. Thermotolerance mechanism analysis and combination strategy transformation of erythritol producing Yarrowia lipolytica[D]. Jiangnan University, 2020.
[2] WANG N, CHI P, ZOU Y W, et al. Metabolic engineering of Yarrowia lipolytica for thermoresistance and enhanced erythritol productivity[J]. Biotechnology for Biofuels, 2020, 13:176.
[3] YANG S L, PAN X W, YOU J J, et al. Systematic metabolic engineering of Yarrowia lipolytica for the enhanced production of erythritol[J]. Bioresource Technology, 2024, 391:129918.
[4] ![]() K, DAZA-SERNA L, MACH-AIGNER A R, et al. Investigation of ion-exchange membranes and erythritol concentration for the desalination of erythritol culture broth by electrodialysis[J]. Chemical Engineering and Processing-Process Intensification, 2023, 192:109494.
K, DAZA-SERNA L, MACH-AIGNER A R, et al. Investigation of ion-exchange membranes and erythritol concentration for the desalination of erythritol culture broth by electrodialysis[J]. Chemical Engineering and Processing-Process Intensification, 2023, 192:109494.
[5] SUWANAPETCH C, VANICHSRIRATANA W. Media optimization for erythritol production by Moniliella sp. BCC25224[J]. Sugar Tech, 2023, 25(1):257-261.
[6] SAVERGAVE L S, GADRE R V, VAIDYA B K, et al. Strain improvement and statistical media optimization for enhanced erythritol production with minimal by-products from Candida magnoliae mutant R23[J]. Biochemical Engineering Journal, 2011, 55(2):92-100.
[7] TOMASZEWSKA L, RYWINSKA A, MUSIAL I, et al. Effect of vitamins source on erythritol biosynthesis by Yarrowia lipolytica Wratislavia K1[J]. Current Opinion in Biotechnology, 2011, 22: S94-S95.
[8] 裴疆森, 黄玲, 张露, 等. 解脂亚罗酵母赤藓糖醇发酵过程的研究[J]. 食品与发酵工业, 2015, 41(4):28-33.PEI J S, HUANG L, ZHANG L, et al. Erythritol production with Yarrowia lipolitica[J]. Food and Fermentation Industries, 2015, 41(4):28-33.
[9] TACHIBANA S, WATANABE K, KONISHI M. Estimating effects of yeast extract compositions on Escherichia coli growth by a metabolomics approach[J]. Journal of Bioscience and Bioengineering, 2019, 128(4):468-474.
[10] BAPAT P M, BHARTIYA S, VENKATESH K V, et al. Structured kinetic model to represent the utilization of multiple substrates in complex media during rifamycin B fermentation[J]. Biotechnology and Bioengineering, 2006, 93(4):779-790.
[11] RICHARDSON J, SHAH B, BONDARENKO P V, et al. Metabolomics analysis of soy hydrolysates for the identification of productivity markers of mammalian cells for manufacturing therapeutic proteins[J]. Biotechnology Progress, 2015, 31(2):522-531.
[12] DODIA H, SUNDER A V, BORKAR Y, et al. Precision fermentation with mass spectrometry-based spent media analysis[J]. Biotechnology and Bioengineering, 2023, 120(10):2809-2826.
[13] DODIA H, MISHRA V, NAKRANI P, et al. Dynamic flux balance analysis of high cell density fed-batch culture of Escherichia coli BL21 (DE3) with mass spectrometry-based spent media analysis[J]. Biotechnology and Bioengineering, 2024, 121(4):1393-1405.
[14] XU Y C, YANG H R, BRENNAN C S, et al. Cellular mechanism for the improvement of multiple stress tolerance in brewer’s yeast by potassium ion supplementation[J]. International Journal of Food Science &Technology, 2020, 55(6):2419-2427.
[15] ARAOZ M, GRILLO-PUERTAS M, DE MORENO DE LEBLANC A, et al. Inorganic phosphate modifies stationary phase fitness and metabolic pathways in Lactiplantibacillus paraplantarum CRL 1905[J]. Frontiers in Microbiology, 2024, 15:1343541.
[16] 汪文丽, 崔树茂, 唐鑫, 等. 两歧双歧杆菌F35氮源利用的差异性解析[J]. 食品与发酵工业, 2021, 47(19):21-28.WANG W L, CUI S M, TANG X, et al. Various nitrogen source utilization in Bifidobacterium bifidum F35[J]. Food and Fermentation Industries, 2021, 47(19):21-28.
[17] 朱丹凤, 王园园, 崔树茂, 等. 罗伊氏乳杆菌氮源利用的选择性与特征分析[J]. 食品与发酵工业, 2018, 44(11):35-41.ZHU D F, WANG Y Y, CUI S M, et al. Selectivity and characteristic analysis of nitrogen source utilized by Lactobacillus reuteri[J]. Food and Fermentation Industries, 2018, 44(11):35-41.
[18] JEYA M, LEE K M, TIWARI M K, et al. Isolation of a novel high erythritol-producing Pseudozyma tsukubaensis and scale-up of erythritol fermentation to industrial level[J]. Applied Microbiology and Biotechnology, 2009, 83(2):225-231.
[19] BATISTOTE M, DA CRUZ S H, ERNANDES J R. Altered patterns of maltose and glucose fermentation by brewing and wine yeasts influenced by the complexity of nitrogen source[J]. Journal of the Institute of Brewing, 2006, 112(2):84-91.
[20] KIM J, KIM K H. Effects of minimal media vs. complex media on the metabolite profiles of Escherichia coli and Saccharomyces cerevisiae[J]. Process Biochemistry, 2017, 57:64-71.
[21] YANG H R, ZONG X Y, CUI C, et al. Peptide (Lys-Leu) and amino acids (Lys and Leu) supplementations improve physiological activity and fermentation performance of brewer’s yeast during very high-gravity (VHG) wort fermentation[J]. Biotechnology and Applied Biochemistry, 2018, 65(4):630-638.
[22] RZECHONEK D A, DOBROWOLSKI A, RYMOWICZ W, et al. Recent advances in biological production of erythritol[J]. Critical Reviews in Biotechnology, 2018, 38(4):620-633.
[23] KHATAPE A B, DASTAGER S G, RANGASWAMY V. An overview of erythritol production by yeast strains[J]. FEMS Microbiology Letters, 2022, 369(1): fnac107.