酒精性肝病(alcoholic liver disease,ALD)因其高发病率和高死亡率已经成为世界第二大肝脏疾病[1]。肝脏在酒精代谢中扮演着关键角色,过量饮酒会严重破坏其代谢功能[2],导致肝细胞发生坏死、病变等,并且降低机体抗氧化能力,进而诱导肝脏发生脂质过氧化,导致肝损伤疾病的发生[3-4]。世界卫生组织数据显示,全球每年因酒精滥用导致的死亡病例达300万例,占全球死亡人数的5.1%[5]。我国作为酒类消费大国,人均酒精消费量已达7.2 L/年,导致ALD发病率以年均4.7%的速度递增[6]。因此如何安全有效防治酒精性肝损伤已成为研究重点。
当前临床防治ALD的手段主要有戒酒、药物治疗和营养支持等,其中食源性活性成分因天然、温和且副作用小的特点备受关注。食源性生物活性肽的研究可以追溯到20世纪中期,迄今已有植物、动物和乳制品等多种来源,具有抗氧化、降血压、抗炎、抗菌等多种生物活性[7]。其中玉米肽[8]、鸡肉肽[9]、牡蛎肽[10]等已被证实具有预防或改善酒精性肝损伤的作用。温庆仕等[11]以乙醇脱氢酶 (alcohol dehydrogenase,ADH)的激活率为促乙醇代谢的指标从鱿鱼蛋白中提取高纯度小分子解酒护肝肽,其ADH激活率为122.71%,DPPH自由基清除率为92.01%。赵谋明等[12]以ADH激活率为高效醒酒活性的评价指标,酶解玉米粉制备玉米肽的ADH激活率为90.12%。
螺旋藻具有较高的营养价值,其蛋白质含量高达50%~70%,螺旋藻蛋白(Spirulina peptides,SPs)已被证实具有抗氧化、抗炎、抗癌、免疫调节[13-15]等作用,其抗氧化活性被证明是抗坏血酸的20倍[13]。因此,SPs是绝佳的活性肽来源,然而关于螺旋藻多肽的缓解酒精性肝损伤功能方面的报道鲜少。以螺旋藻所含丰富的蛋白质和氨基酸组成为基础,通过酶解的方法制备具有加速酒精代谢和缓解酒精性肝损伤功能的螺旋藻小分子肽,是进一步提升螺旋藻生物利用价值的有效途径。
本研究首先通过多指标优化(水解度、ADH激活率、抗氧化活性及小分子肽占比)筛选得到最佳酶解产物,通过动物实验验证其ALD防治功效,结合超高效液相色谱串联线性离子阱/静电场轨道阱高分辨质谱进行氨基酸序列鉴定,通过计算机辅助筛选得到目标肽段并进行体外活性验证,获得具有高体外ADH激活率及高抗氧化活性的螺旋藻小分子肽。
1 材料与方法
1.1 材料与试剂
螺旋藻粉,产自云南程海湖;碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、胃蛋白酶(15 U/mg)、胰蛋白酶(50 U/mg)、木瓜蛋白酶(6 U/mg)、风味蛋白酶(20 U/mg),上海源叶生物科技有限公司;Pierce BCA蛋白检测试剂盒,赛默飞世尔科技(中国)有限公司;ADH测试盒、乙醛脱氢酶(aldehyde dehydrogenase,ALDH)测试盒、谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒,南京建成生物工程研究所;葡聚糖凝胶G25,北京索莱宝科技有限公司;17种氨基酸标准品、5种分子质量标准品、乙醇脱氢酶、色谱级乙腈、甲酸、碳酸氢铵(NH4HCO3)、分析纯二硫苏糖醇(dithiothreitol, DTT)、碘乙酰胺(iodoacetamide, IAM),美国Sigma公司。
1.2 仪器与设备
DSHZ-300A水浴恒温振荡器,太仓市强文实验设备有限公司;CR22 N冷冻离心机,日本Hitachi公司;RJ-LDL型低速大容量多管离心机,无锡市瑞祥分析仪器有限公司;Varioskan Flash型全自动酶标仪,赛默飞世尔科技(中国)有限公司;RV8旋转蒸发仪,艾卡(中国)仪器设备有限公司;Agilent1100高效液相色谱系统,美国安捷伦公司;HD-21-2紫外检测仪,上海青浦沪西仪器厂;Waters 1525半制备液相色谱仪,美国沃特世公司;Easy-nLC 1200液相色谱仪,赛默飞世尔科技(中国)有限公司。
1.3 实验动物
C57BL/6 J雄性小鼠SPF级60只,8周龄,体重(20±2)g,购自北京维通利华实验动物技术有限公司。饲养条件:温度(23±2) ℃,湿度50%~60%,昼夜交替(12 h∶12 h),食水自由。动物实验的伦理审批单位为江南大学动物实验伦理审查委员会,批号:JN.NO20250113C060022[004]。
1.4 实验方法
1.4.1 螺旋藻酶解液制备
采用超声法对螺旋藻进行破壁处理。称取10 g螺旋藻按1∶20(g∶mL)料液比加入蒸馏水充分混匀,超声波功率为500 W、超声波时间为30 min,8 000 r/min离心20 min后收集上清液,经冷冻干燥后为蓝色粉末。
每次酶解均取3 g SPs,加去离子水溶解后,调节溶液温度和pH至相应蛋白酶的最适条件,按每克SPs加总活力为5 000 U的胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶和风味蛋白酶进行酶解,具体酶解条件见表1。酶解4 h后,100 ℃水浴10 min灭酶从而停止酶解,将酶解液在8 000 r/min条件下离心20 min,上清液即为SPs酶解液。
表1 酶解条件
Table 1 Hydrolysis conditions
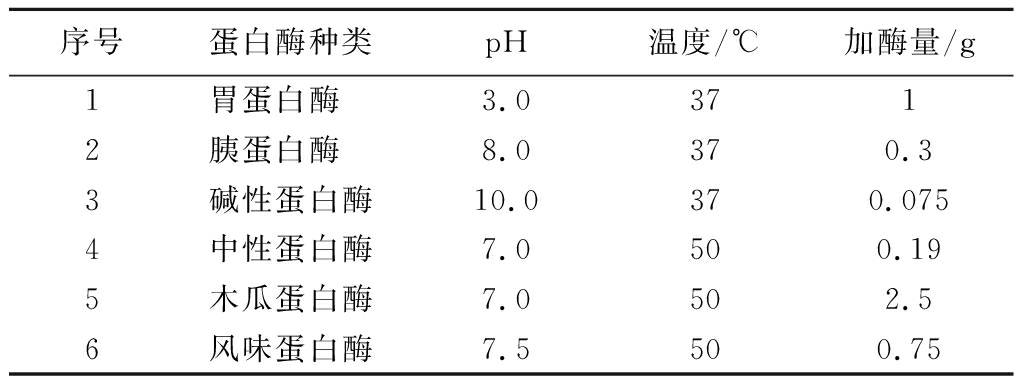
序号蛋白酶种类pH温度/℃加酶量/g1胃蛋白酶 3.03712胰蛋白酶 8.0370.33碱性蛋白酶10.0370.0754中性蛋白酶7.0500.195木瓜蛋白酶7.0502.56风味蛋白酶7.5500.75
1.4.2 水解度测定
配制6 mol/L的HCl溶液对SPs进行完全水解,水解条件为115 ℃下反应24 h,取100 μL水解液或完全水解液与现配的邻苯二甲基二甲醛(o-phthalaldehyde,OPA)试剂共同孵育2 min并于340 nm处测量其吸光度,使用丝氨酸标准曲线测定游离氨基酸的量,其中(NH2)t是水解t小时后释放的游离氨基酸的量,(NH2)t0是水解前的游离氨基酸的量,(NH2)T是完全水解后游离氨基酸的量[16]。水解度计算如公式(1)所示:
水解度![]()
(1)
1.4.3 抗氧化活性测定
参考检测试剂盒说明书对6种酶解产物的DPPH自由基清除能力及ABTS阳离子自由基清除能力进行测定。
1.4.4 ADH激活率测定
参考ZAN等[17]的方法,按照ADH试剂盒说明书的操作步骤进行。将样品溶液(50 μL)与工作溶液(150 μL)混合。在37 ℃下孵育5 min后,加入ADH溶液(0.2 U/mL,50 μL)进行反应。用酶标仪在波长340 nm条件下检测吸光度,每分钟测量一次,持续10 min。背景组使用蒸馏水代替ADH溶液,对照组用蒸馏水代替样品溶液,空白组用蒸馏水代替ADH溶液和样品溶液。初始反应速率和ADH活化速率的计算如公式(2)~公式(3)所示:
初始反应速率![]()
(2)
ADH激活率![]()
(3)
式中:t为反应时间,min; v样本为样品组初始反应速率;v背景为背景组初始反应速率;v对照为对照组初始反应速率;v空白为空白组初始反应速率。
1.4.5 分子质量分布测定
参考冯杨梦晓等[18]的方法,对6种水解物的分子质量分布进行测定。
采用高效液相色谱法测定分子质量分布。色谱柱为TSKgel 2000 SWXL(10 μm,300 mm×7.8 mm),流动相乙腈-水-三氟乙酸(体积比为40∶60∶0.1),流速0.5 mL/min,柱温为30 ℃,检测波长220 nm。
1.4.6 风味蛋白酶酶解时间优化
在风味蛋白酶最适温度和pH条件下,对风味蛋白酶酶解SPs的时间进行优化(2、3、4、5、6 h)。按照1.4.2节及1.4.4节的方法测定不同酶解时间酶解产物的水解度及ADH激活率。
1.4.7 SPs对小鼠早期ALD的保护作用
1.4.7.1 动物分组与建模
选用8周龄SPF级雄性C57BL/6 J小鼠60只,适应性饲养7 d后,随机分为6组,即空白对照组、酒精模型组、阳性对照组、SPs低、中和高剂量组,每组10只。参考BERTOLAA等[19]建立慢性酒精喂养加急性酒精灌胃的小鼠早期酒精性肝损伤(alcohol liver disease, ALD)模型。除空白组和模型组外,每天在固定时间(11:00~12:00)按照400 mg/kg BW海王金樽以及200、400、600 mg/kg BW SPs分别灌胃各组小鼠,空白组和酒精模型组则给予相等剂量的生理盐水。固定时间(12:00~13:00)更换液体饲料。流程如图1所示。
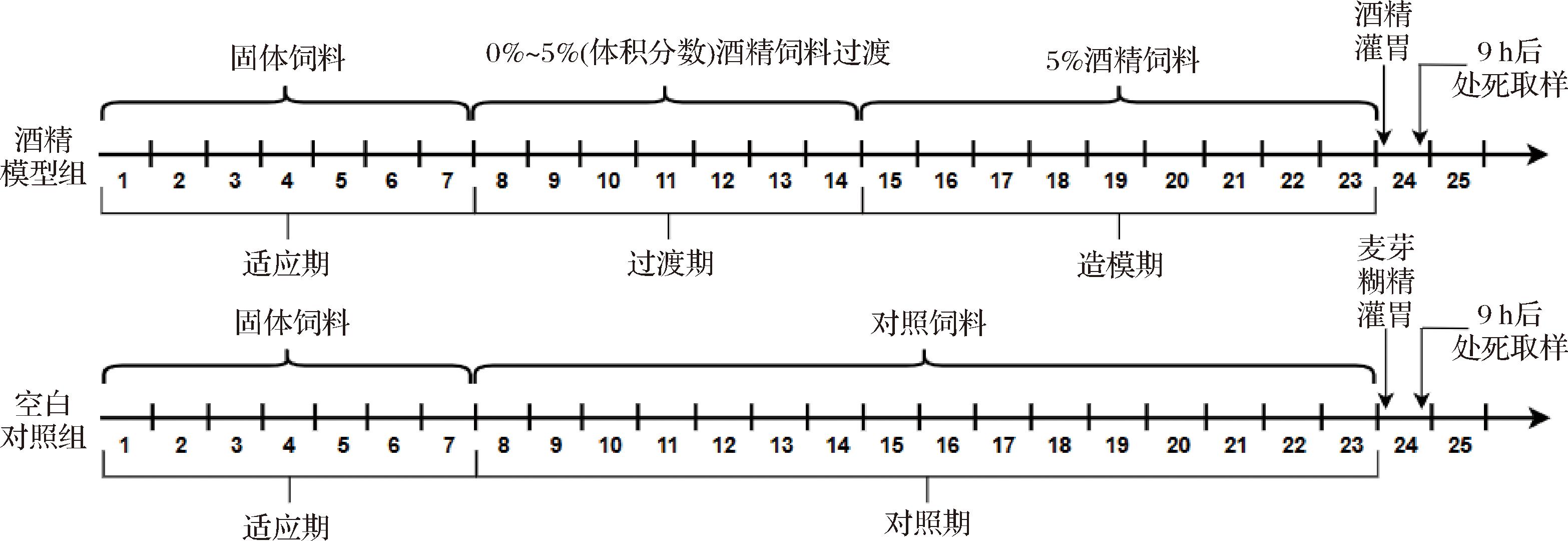
图1 小鼠早期ALD建模流程
Fig.1 Early mice ALD modeling process
1.4.7.2 样本采集
第24天按照1.3.1节中的剂量给各组小鼠进行最后一次阳性及样品干预,空白组和模型组灌等量的生理盐水。30 min后,除空白组外均灌胃12 mL/kg BW 体积分数为45%食用乙醇溶液,空白组灌胃等热量的麦芽糖糊精,经 9 h的禁食后用异氟烷麻醉。采用眼球后静脉丛取血的方法收集小鼠血液。取血结束后,脱颈处死小鼠并解剖,切下肝脏分成2份。将其一部分固定在4%(体积分数)多聚甲醛溶液中,而其余部分在液氮中快速冷冻并贮存在-80 ℃冰箱。
1.4.7.3 肝脏ADH、ALDH活力测定
称取一小块肝脏组织,按照1∶9(g∶mL)料液比加入4 ℃生理盐水,制成100 g/L的肝组织匀浆,3 000 r/min、4 ℃条件下离心10 min后取上清液,按照试剂盒说明书测定小鼠肝脏ADH、ALDH活力,结果统一以蛋白浓度表示。
1.4.7.4 血清ALT、AST含量测定
按照AST、ALT测定试剂盒说明书,取-80 ℃冻存的血清样品,测定小鼠血清指标。
1.4.7.5 肝组织病理学分析
先将肝组织用4%(体积分数)多聚甲醛溶液进行固定,石蜡包埋,然后切片,使用苏木素-伊红染色液染色,将制作好的切片置于光学显微镜下观察,对小鼠肝组织进行病理学分析。
1.4.8 螺旋藻水解物的超滤分级
用蒸馏水配置20 g/L的螺旋藻水解物,首先采用孔径为0.45 μm的微滤膜进行初步分离,压力为0.2 MPa,截留过滤后的料液。然后使用孔径为0.22 μm 的微滤膜再次进行分离。然后使用截留分子质量为3 kDa的超滤膜对料液进行再次分离,超滤膜板的压力为0.7 MPa。收集滤液进行旋转蒸发浓缩,冷冻干燥,得到螺旋藻水解物冻干粉末,-20 ℃贮存备用。
1.4.9 氨基酸序列鉴定
采用超高效液相色谱串联线性离子阱/静电场轨道阱高分辨质谱技术对超滤组分进行鉴定。样品前处理:精确称取3 mg样品,加入300 μL超纯水振荡溶解,取10 μL溶解后样品,用90 μL超纯水进行稀释10倍,NanoDrop测定样品浓度。取50 μg溶液样品,用超纯水将体积补至100 μL。加入1 μL 1 mol/L DTT使DTT终浓度为10 mmol/L,于56 ℃水浴中还原1 h;加入2 μL 1 mol/L IAM溶液,使IAM终浓度20 mmol/L,暗处室温反应40 min;加入1 μL 1 mol/L DTT溶液,使DTT终浓度为20 mmol/L,以中和未反应的IAM。用C18 stage-tip脱盐,于45 ℃真空干燥。LC-MS/MS检测:样品进入液相系统后,首先通过Reprosil-Pur 120 C18-AQ分析柱(150 μm×170 mm,1.9 μm)分离。流动相A:0.1%(体积分数)甲酸水溶液;流动相B:0.1%甲酸水溶液+80%乙腈,流速为600 nL/min,洗脱程序:0~2 min,4~8%B;2~45 min,8~28%B;45~55 min,28~40%B;55~56 min,40~95%B;56~66 min,95%B。
经液相色谱分离的肽组分依次进入质谱系统,采用电喷雾离子源将肽组分转变为带电离子。一级质谱采用正离子全扫描模式进行扫描,范围设置为100~1 500 m/z,积累时间100 ms,分辨率70 000。选择信号强度最高的前20个组分通过碰撞诱导解离,生成碎片离子,采用数据依赖型扫描模式,分辨率17 500,归一化碎裂能量28,累计时间50 ms。质谱原始文件使用软件检索目标蛋白数据库。
1.4.10 计算机辅助分析和筛选
1.4.10.1 肽段预筛选
根据氨基酸序列分析结果中的肽段得分、相对丰度以及肽段长度对所得到的肽段进行预筛选,筛选得到的结果进行进一步活性预测。
1.4.10.2 潜在生物活性预测
采用Peptide Ranker软件(http://distilldeep.ucd.ie/PeptideRanker/)预测具有潜在生物活性的肽段。它使用一种新型的N-to-1神经网络(N1-NN)进行五倍交叉验证,预测多肽具有生物活性的概率(0~1),预测概率越接近1,该肽越有可能具有生物活性[20]。
1.4.10.3 潜在抗氧化活性预测
采用AnOxPePred软件(https://services.healthtech.dtu.dk/services/AnOxPePred-1.0/)预测具有潜在抗氧化活性的肽段。它使用深度学习来预测肽的抗氧化特性,包括自由基清除活性(free radical scavenging,FRS)和金属螯合性能(chelating properties,CHEL)。输出数值为0~1,数值越接近1,该肽的潜在抗氧化活性概率越高[21]。
1.4.10.4 潜在毒性预测
采用ToxinPred软件(https://webs.iiitd.edu.in/raghava/toxinpred/)筛选出具有治疗潜力且不具有毒性的多肽。预测结果显示为Non-Toxin或者Toxin,结果为Non-Toxin表明该肽无毒性。
1.4.10.5 计算机模拟胃肠道消化
采用ExPASy PeptideCutter软件(http://web.expasy.org/peptidecutter/)模拟多肽在胃肠道中模拟消化状态,选定胰凝乳蛋白酶、胃蛋白酶(pH 1.3和pH>2)以及胰蛋白酶,可预测给定蛋白质序列中潜在的蛋白酶切割位点和被化学物质切割的位点。若无法被切割,则该多肽可以抗胃肠道消化[22]。
1.4.11 肽段合成及体外活性验证
委托吉尔生化(上海)有限公司合成纯度为95%的目标肽段,检测合成肽的体外ADH激活率及抗氧化活性。
1.5 数据与分析
采用IBM SPSS 25.0统计软件进行显著性检验和统计描述, 定量数据以“平均值±标准差”表示,以P<0.05作为差异显著性的标准,使用Origin 2018进行绘图。
2 结果与分析
2.1 SPs水解酶的筛选
采用超声方法对螺旋藻进行破壁处理,料液比1∶20(g∶mL)、超声波功率为500 W、超声波时间为30 min,8 000 r/min离心20 min后收集上清液即为SPs粗提液,经冷冻干燥得到SPs粗提物,蛋白质得率为28.78%,于4 ℃冷藏备用。酶的种类是影响酶解效果的关键因素,选取6种不同的常用蛋白酶,以提取的SPs为原料,以抗氧化活性及ADH激活率为主要指标,水解度及分子质量分布为次要指标,筛选综合效果最佳的蛋白酶。
2.1.1 不同酶解产物水解度比较
蛋白质水解时释放的肽的各种生物活性取决于蛋白质的种类、水解度以及蛋白酶的特异性等,MORAIS等[23]发现水解度和游离氨基酸含量之间存在显著相关性。采用OPA法对不同酶的水解度进行比较,结果如图2所示。
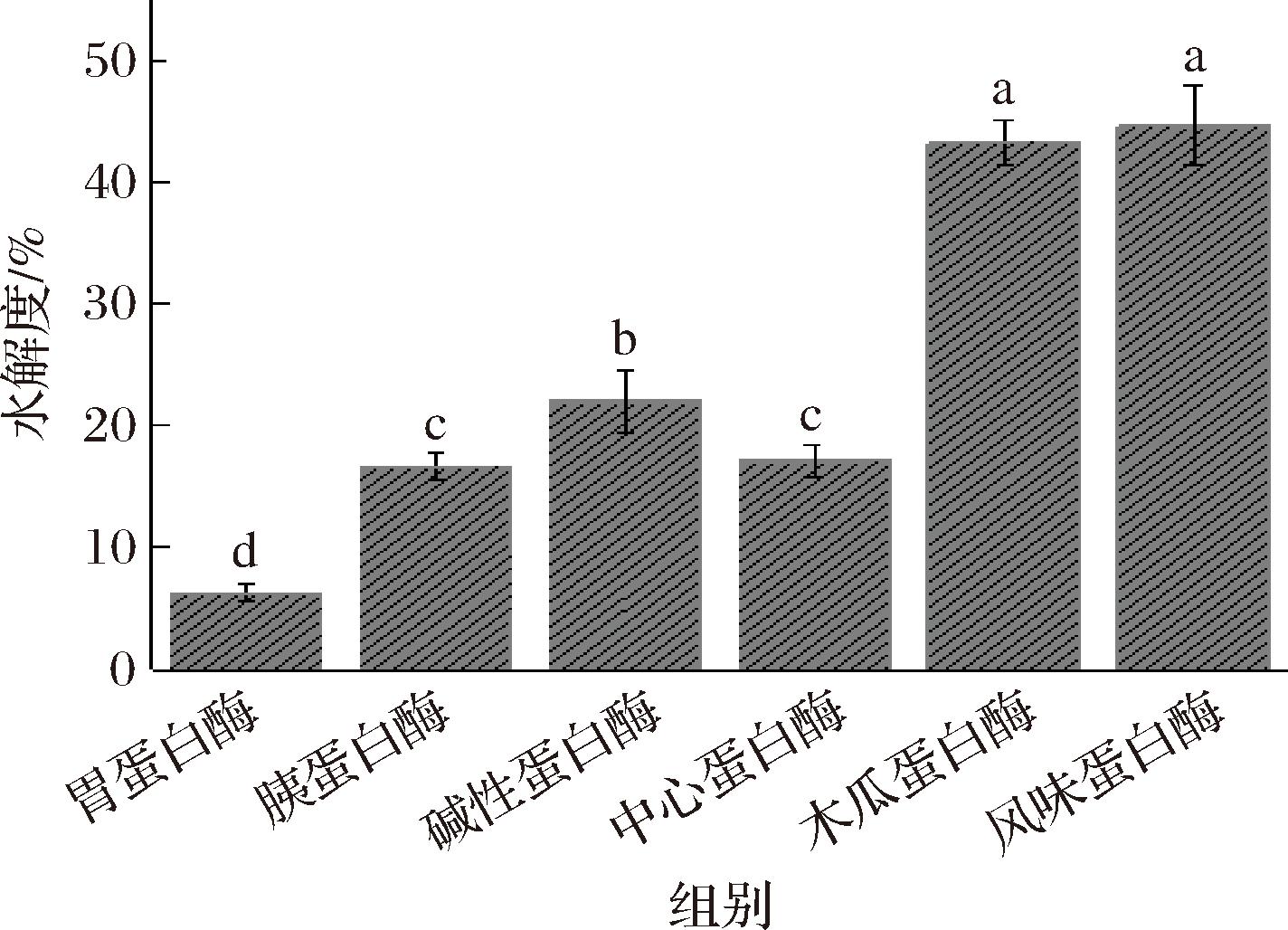
图2 不同水解物水解度比较
Fig.2 Comparison of hydrolysis degree of different hydrolysates
注:不同小写字母表示差异显著(P<0.05)(下同)。
由图2中6种水解物的水解度可知,在酶各自的最适条件下酶解,风味蛋白酶对底物的水解度最高,水解度为48.65%。这可能是因为风味蛋白酶作为一种复合酶,具有内切酶和外切酶的作用特性,酶切位点广泛。
2.1.2 抗氧化活性测定
参考检测试剂盒说明书对6种酶解产物的DPPH自由基清除能力及ABTS阳离子自由基清除能力进行测定,结果如图3所示。

a-DPPH自由基;b-ABTS阳离子自由基
图3 不同水解物抗氧化活性比较
Fig.3 Comparison of antioxidant activity of different hydrolysates
由图3可知,6种蛋白酶酶解SPs后均可获得具有DPPH自由基及ABTS阳离子自由基清除功效的水解产物,但不同蛋白酶酶解产物的抗氧化活性具有差异(P<0.05)。其中风味蛋白酶水解SPs的DPPH自由基及ABTS阳离子自由基清除率最高,分别为86.18%和80.07%。有研究表明,蛋白水解度越高,其酶解产物的抗氧化活性越高[24]。由2.1.1节可知,风味蛋白酶水解产物的水解度高于其他蛋白酶水解物,这可能是其DPPH自由基清除和ABTS阳离子自由基清除能力高于其他蛋白酶的主要原因。
2.1.3 ADH激活率比较
测定6种酶解产物的ADH激活率,并以海王金樽作为阳性对照,结果如表2所示。
表2 不同水解物ADH激活率比较
Table 2 Comparison of ADH activation rates of different hydrolysates

序号样品名称ADH激活率/%阳性对照海王金樽 107.01±4.26c1胃蛋白酶 96.01±7.75d2胰蛋白酶 107.48±5.08c3碱性蛋白酶102.93±7.06cd4中性蛋白酶117.51±5.66b5木瓜蛋白酶111.78±12.37c6风味蛋白酶126.80±4.41a
注:不同小写字母表示差异显著(P<0.05)(下同)。
由表2可知,阳性对照组海王金樽的ADH激活率为107.01%,胰蛋白酶、中性蛋白酶、木瓜蛋白酶、风味蛋白酶组的ADH激活率高于阳性对照组,其中风味蛋白酶(126.80%)和中性蛋白酶组(117.51%)的ADH激活率显著高于阳性对照组(P<0.05)。海王金樽的有效成分为牡蛎精粉、维生素C、L-半胱氨酸和牛磺酸。3种样品ADH激活率显著高于海王金樽的原因可能为样品中的小分子肽和其他活性物质含量多于海王金樽。
2.1.4 分子质量分布分析
使用高效液相色谱法检测6种螺旋藻水解物的分子质量分布,结果如表3所示。
表3 不同水解物分子质量分布比较 单位:g/100 g
Table 3 Comparison of molecular weight distribution of different hydrolysates
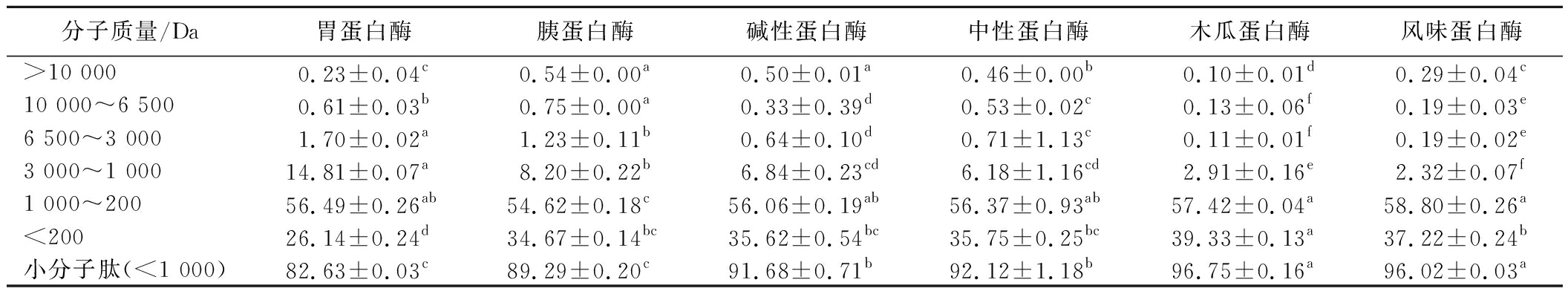
分子质量/Da胃蛋白酶胰蛋白酶碱性蛋白酶中性蛋白酶木瓜蛋白酶风味蛋白酶>10 0000.23±0.04c0.54±0.00a0.50±0.01a0.46±0.00b0.10±0.01d0.29±0.04c10 000~6 5000.61±0.03b0.75±0.00a0.33±0.39d0.53±0.02c0.13±0.06f0.19±0.03e6 500~3 0001.70±0.02a1.23±0.11b0.64±0.10d0.71±1.13c0.11±0.01f0.19±0.02e3 000~1 00014.81±0.07a8.20±0.22b6.84±0.23cd6.18±1.16cd2.91±0.16e2.32±0.07f1 000~20056.49±0.26ab54.62±0.18c56.06±0.19ab56.37±0.93ab57.42±0.04a58.80±0.26a<20026.14±0.24d34.67±0.14bc35.62±0.54bc35.75±0.25bc39.33±0.13a37.22±0.24b小分子肽(<1 000)82.63±0.03c89.29±0.20c91.68±0.71b92.12±1.18b96.75±0.16a96.02±0.03a
螺旋藻经6种蛋白酶水解后分子质量基本都在3 000 Da以下,其中木瓜蛋白酶组和风味蛋白酶组分子量分布在1 000 Da以下的占比显著高于其他组别(P<0.05),达到96.75%和96.02%。因此风味蛋白酶组样品可能在活性肽的组成上具有一定优势。
2.1.5 风味蛋白酶酶解时间优化
综合水解度、抗氧化活性、体外ADH激活率及分子量分布4个指标,选取风味蛋白酶作为水解螺旋藻的优势蛋白酶。在风味蛋白酶的最适温度和pH条件下,对风味蛋白酶酶解SPs的时间进行优化(2、3、4、5、6 h)。测定酶解产物的水解度及ADH激活率,结果如图4所示。
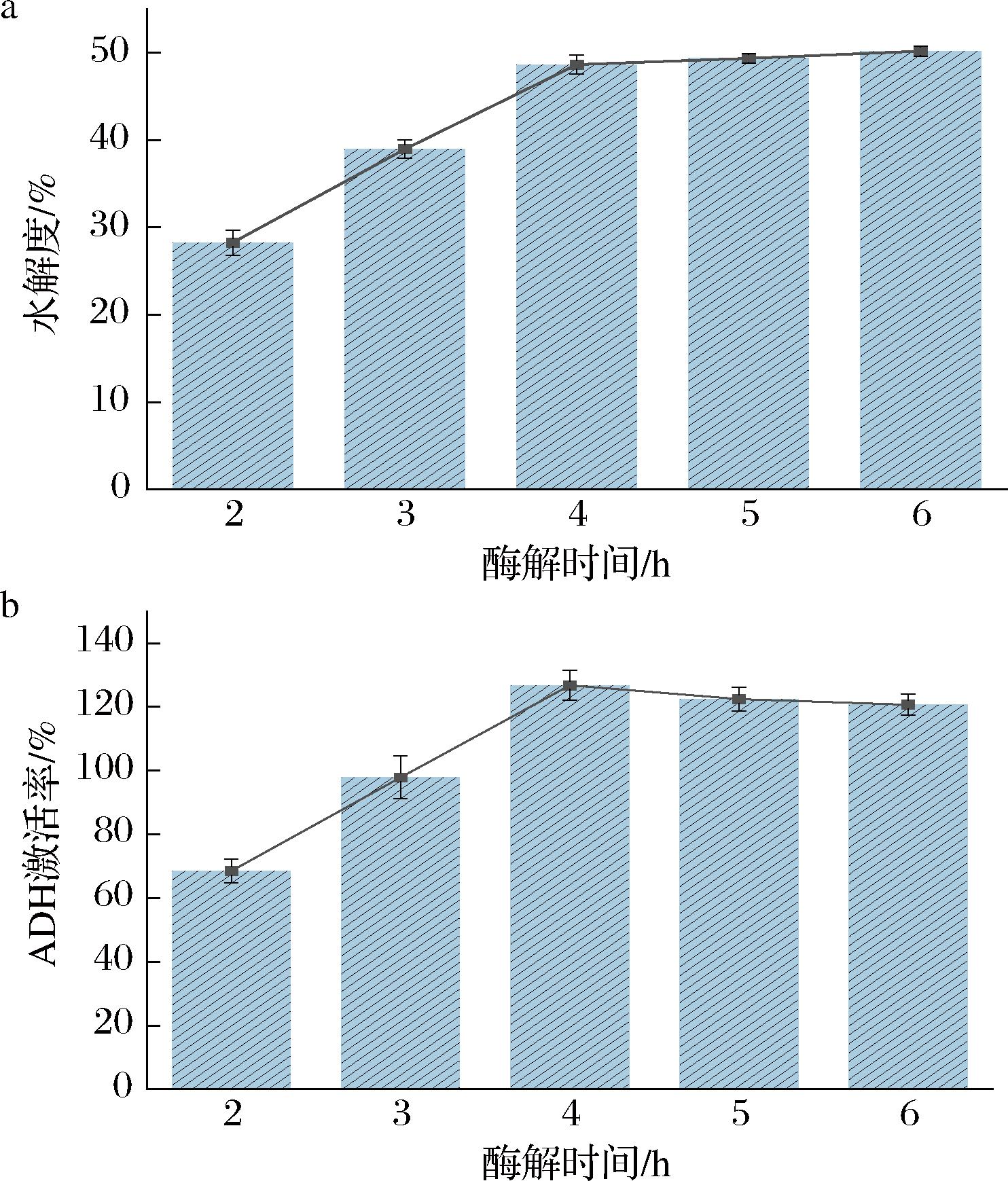
图4 风味蛋白酶酶解时间优化
Fig.4 Optimization of the enzymatic hydrolysis time of flavourzyme
结果表明,随着水解时间的延长,水解度不断增大,4 h的水解度达到48.65%,4 h后增加缓慢,最后趋于平稳;随着水解进程,ADH激活率明显增加,4 h时ADH激活率达到最高为126.8%,随后激活率开始降低。最终选取酶解4 h的酶解产物,100 ℃进行灭活,离心取上清液后冷冻干燥,得到SPs贮存于-20 ℃供后续实验。
2.2 SPs对小鼠早期ALD的保护作用
2.2.1 SPs对小鼠肝脏酒精代谢酶系的影响
ADH和ALDH是催化酒精代谢的关键标志物,在酒精代谢过程中发挥重要作用。人体摄入的乙醇80%经过ADH氧化转化为乙醛,乙醛在ALDH的催化下转化为乙酸。测定小鼠早期ALD肝脏中ADH和ALDH的活力,结果如图5所示。
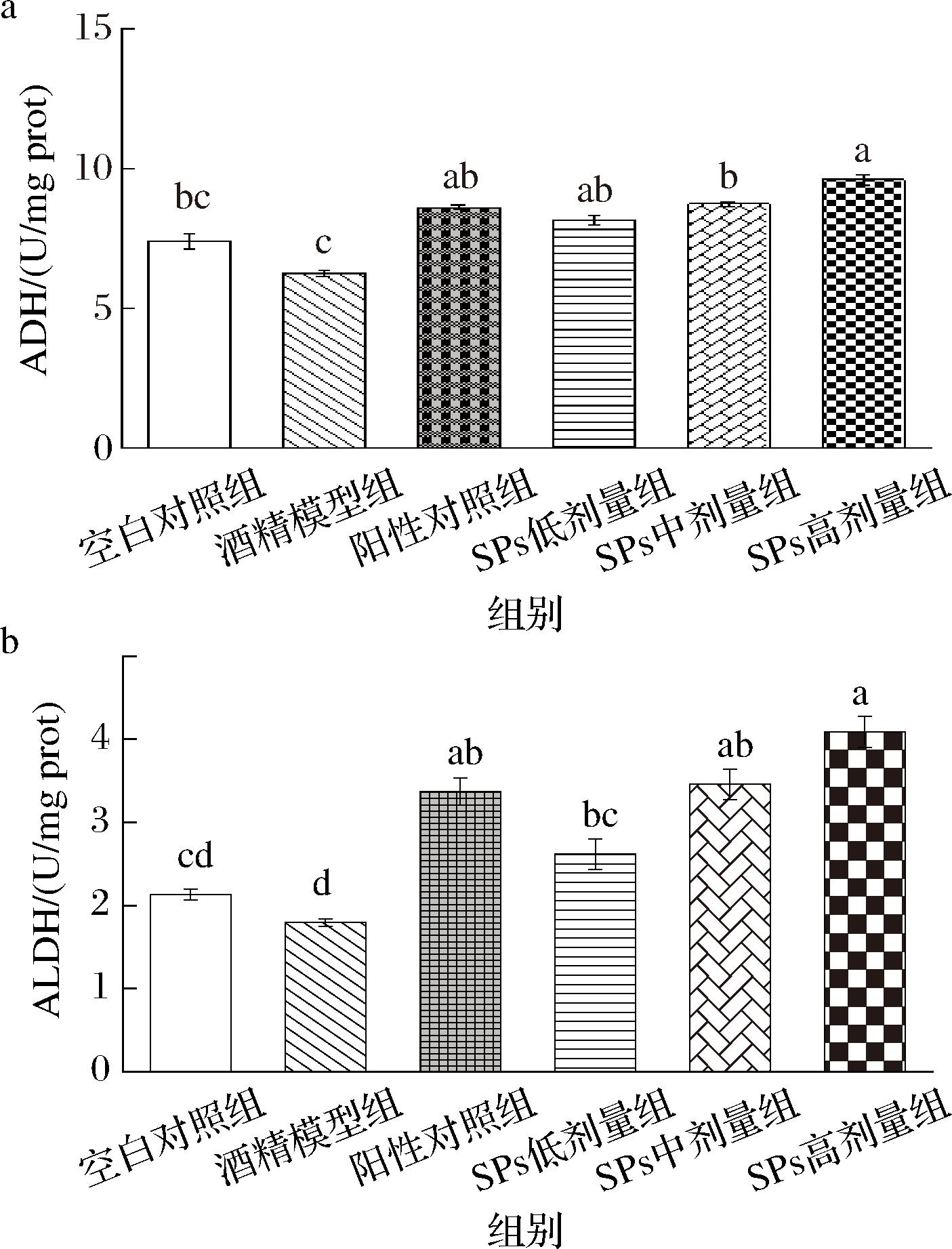
图5 SPs摄入对小鼠肝脏酒精代谢酶系的影响
Fig.5 Effects of SPs intake on the hepatic alcohol-metabolizing enzyme system in mice
与酒精模型组相比,SPs干预组的ADH和ALDH活力显著上升(P<0.05),并且其增活效果与SPs给药量成正比。其中,SPs高剂量组小鼠肝脏ADH和ALDH活力分别提高了57.62%和90.47%。结合2.1.3节体外ADH激活率的实验结果,SPs对ADH的激活效果在体内和体外均有明显表现。
2.2.2 SPs对小鼠血清肝功能酶系的影响
AST和ALT是临床常用的肝功能检测指标,其数值变化对肝脏健康评估具有重要意义,肝损伤可导致血液中ALT和AST含量上升。测定小鼠早期ALD血清中ALT和AST的含量,结果如图6所示。
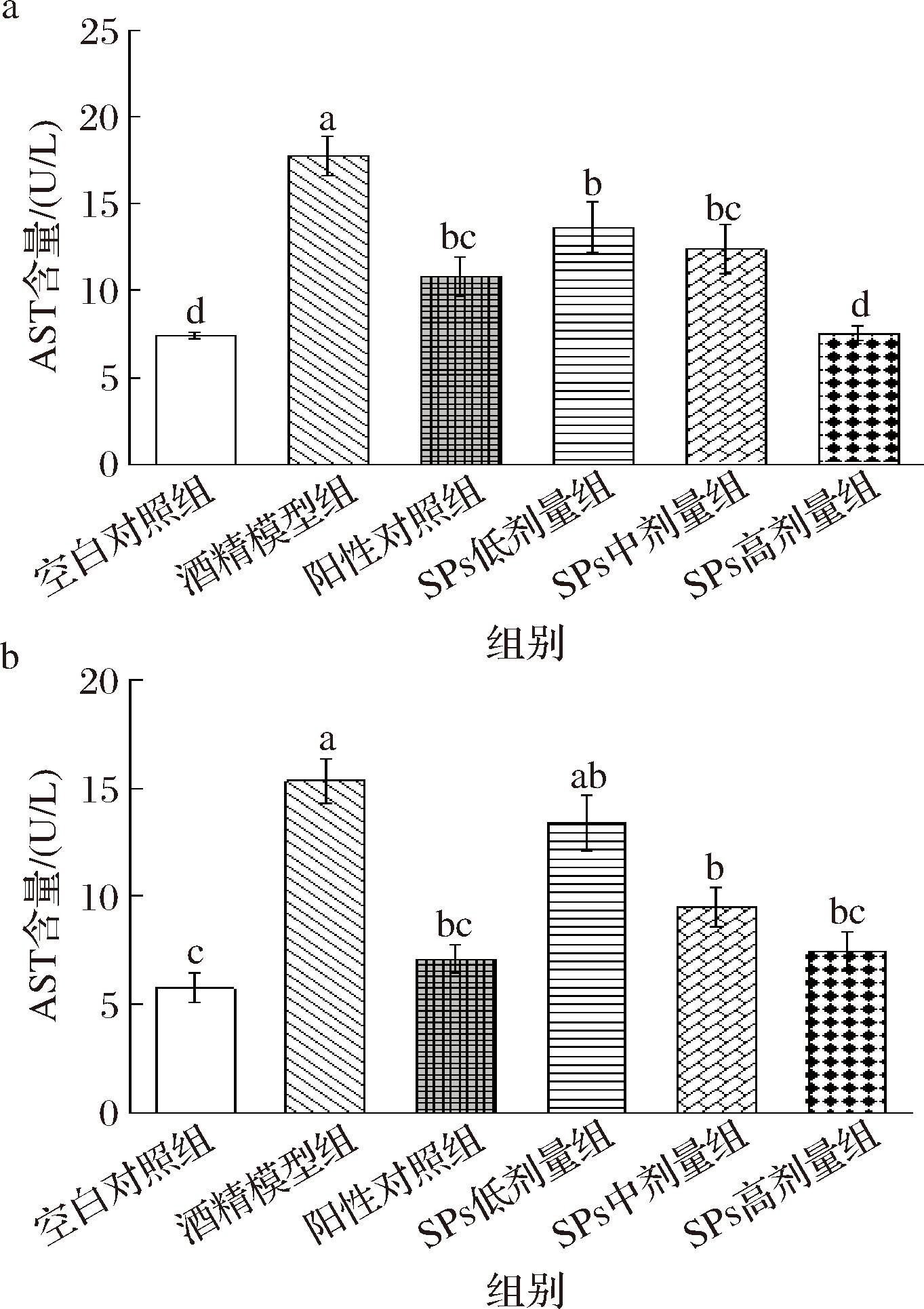
图6 SPs摄入对小鼠血清肝功能酶系的影响
Fig.6 Effects of SPs intake on hepatic enzyme profile in mice serum
与空白组相比,酒精模型组中小鼠血清ALT和AST含量显著升高(P<0.05),表明小鼠肝细胞已经严重受损。SPs高剂量组的AST活力和ALT活力较酒精模型组分别减少了40.27%和43.63%,并且与空白对照组比较,没有显著差异(P>0.05)。由实验结果可知,SPs干预对小鼠早期ALD受损肝细胞具有一定的保护作用。
2.2.3 SPs对小鼠肝脏组织病理的影响
早期ALD的表现为酒精性脂肪肝,表现为脂肪变性,即肝细胞体积增大,胞浆内可见大小不一、境界清晰的圆形空泡。对小鼠的肝脏切片进行观察,结果如图7所示。

a-空白对照组;b-酒精模型组;c-阳性对照组;d-SPs低剂量组;e-SPs中剂量组;f-SPs高剂量组
图7 小鼠肝组织病理切片
Fig.7 Pathological section of mice liver tissue
由图7可知,空白组小鼠肝细胞排列整齐,无明显损伤症状,酒精组大量肝细胞出现水肿及微泡脂肪变性的情况。而SPs干预小鼠酒精肝的症状可以得到不同程度的缓解,其中SPs高剂量组可明显观察到小鼠肝损伤程度减轻,说明SPs干预对小鼠酒精性肝损伤具有一定保护作用。
2.3 小分子解酒肽的分离鉴定及合成验证
2.3.1 氨基酸序列鉴定
对超滤得到的组分(<3 kDa)进行氨基酸序列鉴定,通过SPs数据库匹配共得到了9 672条肽段,总离子流图及二级质谱图见附图(https://doi.org/10.13995/j.cnki.11-1802/ts.042776)。
2.3.2 计算机辅助分析和筛选
对氨基酸序列鉴定得到的9 672条肽段进行预筛选,筛选条件为肽段得分(>25)、相对丰度(>2×106)、肽段长度(<10),共得到838条肽段。使用计算机辅助模拟分析了838条多肽的潜在生物活性、自由基清除活性、螯合能力评分、毒性以及胃肠道消化酶抵抗性,最终得到13条目标肽段,结果如表4所示。由表4可知,13条多肽的Peptide Ranker评分均大于0.5,说明这些序列更倾向于有某种或某些生物活性。酒精氧化代谢产生的自由基是影响人体健康的主要风险因子,它们以多种方式协同诱导细胞和组织损伤,因此抗氧化能力在解酒护肝的作用途径中扮演着至关重要的角色[25]。除了清除自由基外,与金属螯合也是一种常见的抗氧化手段。13条多肽相较于金属螯合能力更倾向于拥有清除自由基的能力。此外,胃肠道内分布着丰富的水解酶,多肽能够抵抗水解酶的完全消化,完整的通过小肠屏障到达肝脏是发挥出激活ADH作用的基础。通过选定的胰凝乳蛋白酶、胃蛋白酶(pH 1.3和pH>2)以及胰蛋白酶多肽进行模拟水解,13条多肽均可以以完整的形式在肝脏中发挥作用。
表4 计算机辅助分析多肽序列
Table 4 Computer assisted analysis of peptide sequences
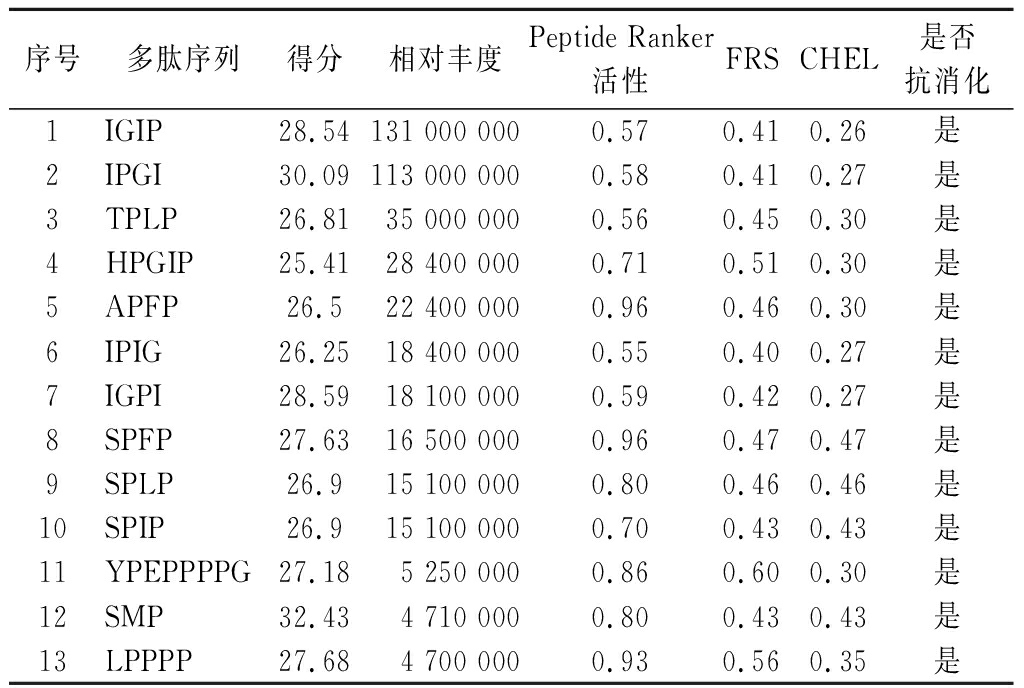
序号多肽序列得分相对丰度Peptide Ranker活性FRSCHEL是否抗消化1IGIP28.54131 000 0000.570.410.26是2IPGI30.09113 000 0000.580.410.27是3TPLP26.8135 000 0000.560.450.30是4HPGIP25.4128 400 0000.710.510.30是5APFP26.522 400 0000.960.460.30是6IPIG26.2518 400 0000.550.400.27是7IGPI28.5918 100 0000.590.420.27是8SPFP27.6316 500 0000.960.470.47是9SPLP26.915 100 0000.800.460.46是10SPIP26.915 100 0000.700.430.43是11YPEPPPPG27.185 250 0000.860.600.30是12SMP32.434 710 0000.800.430.43是13LPPPP27.684 700 0000.930.560.35是
2.3.3 肽段合成及体外活性验证
基于上述分析与筛选,选择表5中的13条肽段进行体外合成,获得纯度为95%的合成肽。对13条肽段的体外活性进行测定,包括体外ADH激活率及抗氧化活性,结果见表5。
表5 不同肽段ADH激活率 单位:%
Table 5 ADH activation rate of different peptides
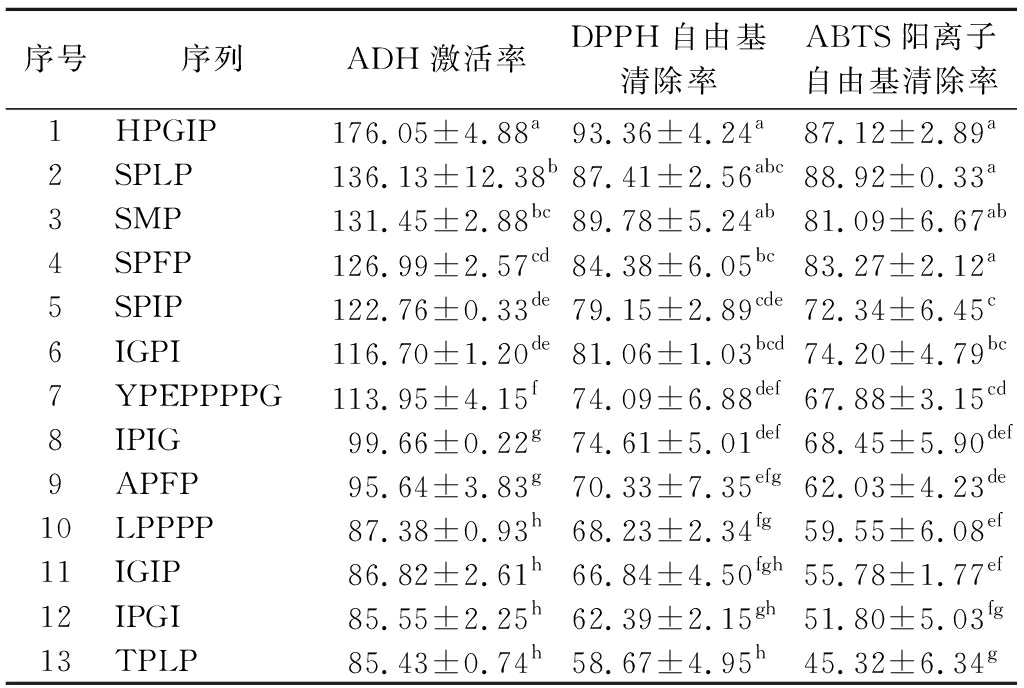
序号序列ADH激活率DPPH自由基清除率ABTS阳离子自由基清除率1HPGIP176.05±4.88a93.36±4.24a87.12±2.89a2SPLP136.13±12.38b87.41±2.56abc88.92±0.33a3SMP131.45±2.88bc89.78±5.24ab81.09±6.67ab4SPFP126.99±2.57cd84.38±6.05bc83.27±2.12a5SPIP122.76±0.33de79.15±2.89cde72.34±6.45c6IGPI116.70±1.20de81.06±1.03bcd74.20±4.79bc7YPEPPPPG113.95±4.15f74.09±6.88def67.88±3.15cd8IPIG99.66±0.22g74.61±5.01def68.45±5.90def9APFP95.64±3.83g70.33±7.35efg62.03±4.23de10LPPPP87.38±0.93h68.23±2.34fg59.55±6.08ef11IGIP86.82±2.61h66.84±4.50fgh55.78±1.77ef12IPGI85.55±2.25h62.39±2.15gh51.80±5.03fg13TPLP85.43±0.74h58.67±4.95h45.32±6.34g
由表5可知,有7条肽段体外ADH激活率显著高于阳性对照组海王金樽(浓度均为1 mg/mL),有4条肽段的DPPH自由基清除率和ABTS阳离子自由基清除率均高于80%,且这4条均为未报道的具有体外ADH激活率和抗氧化双活性的肽段。温庆仕等[11]报道以鱿鱼为蛋白原料的制备蛋白肽纯度为95.33%,其中分子质量小于3 000 Da的组分ADH的激活率为122.71%,DPPH自由基的清除率为92.01%;赵谋明等[12]制备具有醒酒活性的玉米肽其活性最高组分ADH激活率为90.12%。与已有报道相比,本研究制备的多肽的ADH激活率和抗氧化活性均更高。
3 结论
本研究以SPs为原料,筛选得到综合效果最好的目标酶解物。其中,风味蛋白酶酶解SPs具有最高的水解度(48.65%),同时酶解产物具有最高的DPPH自由基清除能力(86.18%)、ABTS阳离子自由基清除能力(80.07%)、体外ADH激活率(126.80%)及小分子肽含量(96.02%)。通过动物实验进行体内活性验证,发现小鼠肝脏ADH和ALDH活力分别提高了57.62%和90.47%,AST活力和ALT活力分别降低了40.27%和43.63%,对早期肝损伤具有一定保护作用。最后对目标酶解物进行氨基酸序列鉴定,并采用计算机模拟辅助筛选,最终得到13条评分较高的肽段并进行体活性验证,得到4条未经报道的具有较高体外ADH激活率和抗氧化双活性的肽段,其中HPGIP的ADH激活率达到176.05%,DPPH自由基与ABTS阳离子自由基清除率分别为93.36%和87.12%。研究结果表明,本实验制备的螺旋藻小分子肽具有较高的ADH激活率和抗氧化活性,具有潜在加速酒精代谢及缓解酒精性肝损伤的能力,在功能性食品领域具有广阔的应用前景。
[1] WILLIAMS R, AITHAL G, ALEXANDER G J, et al. Unacceptable failures: The final report of the Lancet Commission into liver disease in the UK[J]. The Lancet, 2020, 395(10219):226-239.
[2] 庞宇辰,郑俊侨,张思璐,等.解酒护肝胶囊对大鼠酒精性肝损伤保护作用研究[J]. 广东药科大学学报, 2024, 40(2):1-6. PANG Y C, ZHENG J Q, ZHANG S L, et al. Protection effect of alcoholic liver injury by Jiejiu Hugan Capsules in rats [J]. Journal of Guangdong Pharmaceutical University, 2024, 40(2):1-6.
[3] YOKOYAMA H, BARAONA E, LIEBER C S. Upstream structure of human ADH7 gene and the organ distribution of its expression[J]. Biochemical and Biophysical Research Communications, 1995, 216(1):216-222.
[4] CENI E, MELLO T, GALLI A. Pathogenesis of alcoholic liver disease: Role of oxidative metabolism[J]. World Journal of Gastroenterology, 2014, 20(47):17756-17772.
[5] 杨胜涛.两种海藻多糖抑制肿瘤转移和血管新生作用及机制研究[D]. 湛江:广东海洋大学,2021. YANG S T. Study on the effect and mechanism of two kinds of seaweed polysaccharide in inhibiting tumormetastasis and angiogenesis [D]. Zhanjiang: Guangdong Ocean University, 2021.
[6] PEACOCK A, LEUNG J, LARNEY S, et al. Global statistics on alcohol, tobacco and illicit drug use: 2017 status report[J]. Addiction, 2018, 113(10):1905-1926.
[7] SREELEKSHMI P J, DEVIKA V, AISWARYA L S, et al. Recent advances in bioactive peptides as functional food for Health Promotions and medicinal applications[J]. Protein &Peptide Letters, 2023, 30(8):626-639.
[8] GIORDANO M, LUONGO G, DAVINELLI S, et al. Silybum marianum: Not just silymarin and flavonolignans [J]. Records of Natural Products, 2021, 15(4):243-253.
[9] XIAO C Q, ZHAO M M, ZHOU F B, et al. Data on bioactive peptides derived from chicken hydrolysate with potential alcohol dehydrogenase stabilizing activity and in silico analysis of their potential activity and applicability[J]. Data in Brief, 2020, 29:105163.
[10] 刘文颖,冯晓文,李国明,等.牡蛎低聚肽的结构表征及体外抗氧化作用[J].中国食品学报,2021,21(12):261-269.LIU W Y, FENG X W, LI G M, et al. Structure characterization and antioxidant effects in vitro of oyster oligopeptides [J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):261-269.
[11] 温庆仕,魏荷芬,周精卫,等.一种高纯度小分子解酒护肝肽的制备[J].食品与发酵工业,2023,49(7):174-180.WEN Q S, WEI H F, ZHOU J W, et al. Preparation of a high purity small molecule anti-alcoholic liver protecting peptide [J]. Food and Fermentation Industries, 2023, 49(7):174-180.
[12] 赵谋明,马梅,苏国万,等.具有醒酒活性的玉米肽的制备、富集和鉴定[J].中国食品学报,2020,20(9):86-94.ZHAO M M, MA M, SU G W, et al. Preparation, Enrichment and Identification of Corn Peptides with Facilitating Alcohol Metabolism Activity [J]. Journal of Chinese Institute of Food Science and Technology, 2020 ,20(9):86-94.
[13] ROMAY C, GONZALEZ R. Phycocyanin is an antioxidant protector of human erythrocytes against lysis by peroxyl radicals[J]. Journal of Pharmacy and Pharmacology, 2000, 52(4):367-368.
[14] HOSEINI S M, KHOSRAVI-DARANI K, MOZAFARI M R. Nutritional and medical applications of Spirulina microalgae[J]. Mini-Reviews in Medicinal Chemistry, 2013, 13(8):1231-1237.
[15] REDDY M C, SUBHASHINI J, MAHIPAL S V K, et al. C-Phycocyanin, a selective cyclooxygenase-2 inhibitor, induces apoptosis in lipopolysaccharide-stimulated RAW264.7 macrophages[J]. Biochemical and Biophysical Research Communications, 2003, 304(2):385-392.
[16] TONG X Y, PRASANNA G, ZHANG N, et al. Spectroscopic and molecular docking studies on the interaction of phycocyanobilin with peptide moieties of C-phycocyanin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 236:118316.
[17] ZAN R, ZHU L, WU G C, et al. Identification of novel peptides with alcohol dehydrogenase (ADH) activating ability in chickpea protein hydrolysates[J]. Foods, 2023, 12(8):1574.
[18] 冯杨梦晓,任青兮,刘双平,等.海洋蛋白源解酒护肝水解物的筛选制备及功效评价[J].食品与发酵工业,2025,51(3):1-11.FENG Y M X, REN Q X, LIU S P, et al. Screening, preparation, and efficacy evaluation of hydrolysates from marine protein sources for sobering up and liver protection [J]. Food and Fermentation Industries, 2025, 51(3):1-11.
[19] BERTOLA A, MATHEWS S, KI S H, et al. Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J]. Nature Protocols, 2013, 8(3):627-637.
[20] MOONEY C, HASLAM N J, POLLASTRI G, et al. Towards the improved discovery and design of functional peptides: Common features of diverse classes permit generalized prediction of bioactivity[J]. PLoS One, 2012, 7(10): e45012.
[21] OLSEN T H, YESILTAS B, MARIN F I, et al. AnOxPePred: Using deep learning for the prediction of antioxidative properties of peptides[J]. Scientific Reports, 2020, 10:21471.
[22] WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein Identification and Analysis Tools in the ExPASy Server[M]. 2-D Proteome Analysis Protocols. New Jersey: Humana Press, 2003:531-552.
[23] MORAIS H A, SILVE M P C, SILVA V D M, et al. Correlation between the degree of hydrolysis and the peptide profile of whey protein concentrate hydrolysates: Effect of the enzyme type and reaction time[J]. American Journal of Food Technology, 2012, 8(1):1-16.
[24] TRAN H C, LE H A T, LE T T, et al. Effects of enzyme types and extraction conditions on protein recovery and antioxidant properties of hydrolysed proteins derived from defatted Lemna minor[J]. Applied Science and Engineering Progress, 2021,5(3):360-369.
[25] MARTINEZ-HURTADO J, CALO-FERNANDEZ B, VAZQUEZ-PADIN J. Preventing and mitigating alcohol toxicity: A review on protective substances[J]. Beverages, 2018, 4(2):39.