白假丝酵母(Candida albicans)是念珠菌属中常见的条件致病菌之一,广泛存在于自然界当中以及人体黏膜部位,当机体免疫力下降时,会引发念珠菌病。有研究报道,白假丝酵母在食品加工过程中可能从外界环境迁移至食品中,EL-SHAROUD等[1]和WANDERLEY等[2]在奶酪中检出白假丝酵母,而这种非发酵剂外源酵母的存在可能对乳制品的感官特性产生不良影响。RAJKOWSKA等[3]认为食源性假丝酵母是发酵蔬菜成膜的主要腐败菌,不仅影响产品的感官特性,还可能引发食源性疾病,严重威胁食品加工从业者和消费者的健康。目前,对白假丝酵母的研究主要集中在流行病学和耐药性[4],针对食品中白假丝酵母的抑制方法的研究仍显不足,亟需进一步深入探讨以保障食品安全。
植物精油富含萜烯类、酚类、醛类等化合物[5],因其安全性和有效性而受到越来越多的关注,其中D-柠檬烯(D-limonene,DL)是柑橘类果皮精油中常见的一种单环萜烯。大量研究表明D-柠檬烯具有抗菌[6]、抗氧化[7]和抗肿瘤[8]等生理特性,被《联邦法规》列为公认安全(Generally Recognized as Safe,GRAS)的食品添加剂和抗菌剂,但是其易受光、热影响氧化挥发[9],导致其在食品加工过程中利用率低,近年来,新兴的纳米包封技术已被广泛应用于生物活性物质的包埋和递送,为了保护DL在加工和贮存过程中免受恶劣条件的影响,可以通过纳米封装技术提高其稳定性。
纳米颗粒是以聚合物为载体,将活性较强的芯材包封成为微米级或纳米级的微小粒子,从而提高芯材的生物利用度和稳定性[10]。在制备纳米颗粒的原料中,多糖以其高生物降解性、低毒性等优点,备受活性物质包封领域研究人员关注,壳聚糖(chitosan, CS)是天然水溶性阳离子多糖,因结构中存在D-氨基葡萄糖所以对pH比较敏感[11],能够控制生物活性物质的靶向释放位点,因此CS具有在构建不同的活性物质传递系统时使物质活性倍增的优势。三聚磷酸钠(sodium tripolyphosphate,TPP)是通过离子交联制备CS水凝胶的最常用交联剂,TIAN等[12]选择CS作为基材,选择TPP作为交联剂。通过离子交联法制备了负载啤酒花中β-酸的壳聚糖纳米颗粒,结果表明CS纳米粒对β-酸的负载量为2.00%~18.26%,包封率为0.58%~55.94%,且包封后的β-酸对金黄色葡萄球菌、大肠杆菌有显著的抑制效果。
CS-DL纳米颗粒训作机制如图1所示,以壳聚糖作为壁材包埋DL,DL为芯材,利用离子交联法制备D-柠檬烯-壳聚糖(chitosan-D-limonene,CS-DL)纳米颗粒,以包封率和粒径评估CS-DL纳米颗粒的制作的最优条件,通过透射电子显微镜(transmission electron microscopy, TEM)、扫描电子电镜(scanning electron microscope, SEM)、傅里叶变换红外光谱(Fourier-transform infrared,FTIR)进行CS-DL纳米颗粒的微观结构和组成进行分析,并探讨了CS-DL纳米颗粒对白假丝酵母的抑菌效果,为CS-DL纳米颗粒在食品工业中对白假丝酵母控制提供理论依据。
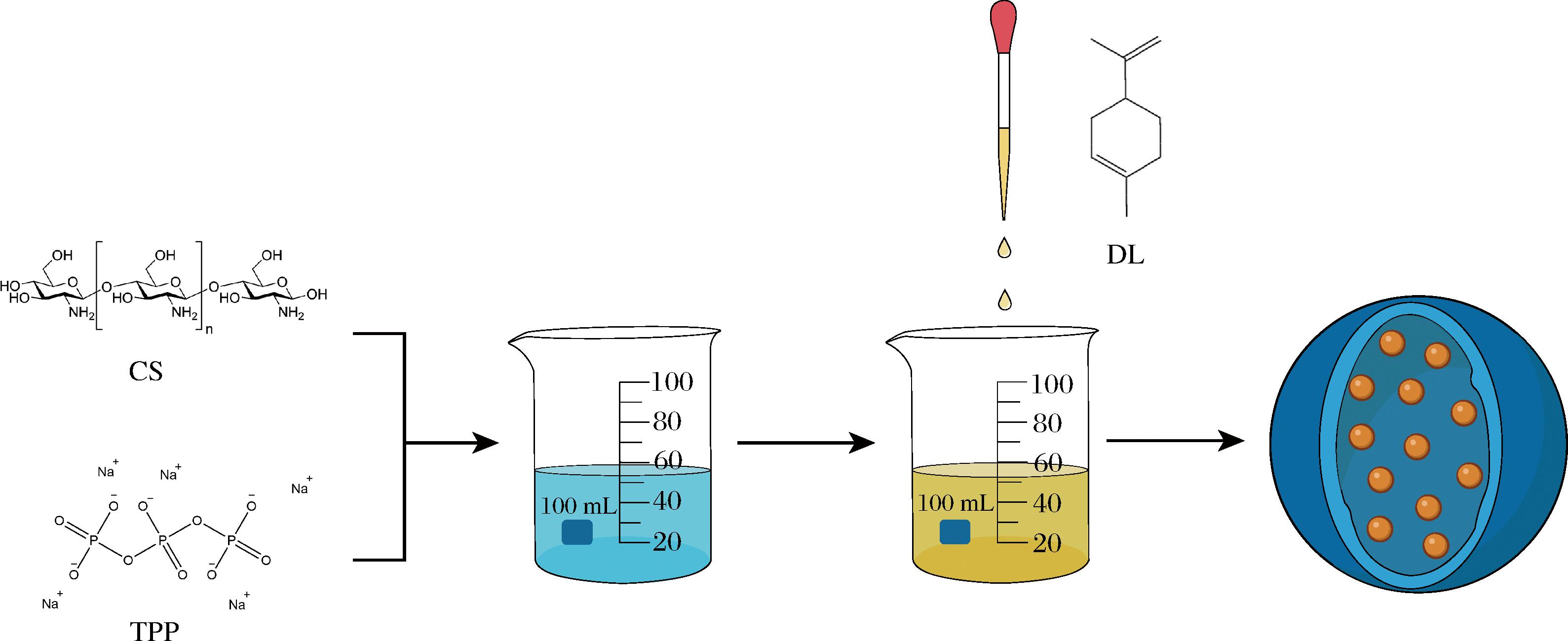
图1 CS-DL纳米颗粒制作机制图
Fig.1 Mechanism diagram of CS-DL nanoparticles
1 材料与方法
1.1 材料与试剂
白假丝酵母,四川省微生物重点实验室保藏;氢氧化钠、氯化钠、冰乙酸、浓盐酸、正己烷、无水乙醇,成都市科隆化学品有限公司;YPD固体培养基、YPD液体培养基,青岛高科技工业园海博生物技术有限公司;DL,成都艾科达化学试剂有限公司;DL标准品,江西佰草源生物科技有限公司;TPP,天津市登峰化学试剂厂;CS,上海阿拉丁科技股份有限公司。
1.2 仪器与设备
Zetasizer Nano ZS激光粒度仪,英国马尔文仪器有限公司;SHJ-4A 数显磁力搅拌水浴锅,常州金坛精达仪器制造有限公司;5804R台式高速冷冻离心机,上海力辰邦西仪器科技有限公司;Scientz-WSQ 自动微生物生长曲线分析仪,宁波新芝生物科技股份有限公司;FDU-1100真空冷冻干燥机,东京理化器械株式会社;DY8000傅里叶变换红外,铂金埃尔默股份有限公司;TH-F120低压透射电镜,QUANTUM 量子科学仪器贸易有限公司;Apreo 2 扫描电镜,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 CS-DL纳米颗粒的制备
参考RAHAIEE等[13]的方法制备CS-DL纳米颗粒,并做出调整。
CS浓度对CS-DL纳米颗粒粒径、Zeta电位和包封率的影响:将450 μL吐温80作为表面活性剂加入pH值为4.0的30 mL CS醋酸溶液(质量浓度为1.5、2、2.5、3 mg/mL)中,并在室温下搅拌2 h,得到均匀的CS溶液。随后将72 mg DL,逐滴滴入上述CS溶液中,在室温下搅拌30 min,CS与DL质量比为1∶1.2,得到水包油乳液。向制得的水包油乳液中逐滴滴入6 mL 2.5 mg/mL的TPP溶液,CS与TPP的质量比为4∶1,滴加完成后用磁力搅拌器持续搅拌30 min,制备得到CS-DL纳米颗粒悬浮液。按照相同的程序制备不含DL的空白纳米颗粒。
CS溶液pH对CS-DL纳米颗粒粒径、Zeta 电位和包封率的影响:其他制备工艺参数不变,探究CS溶液pH(3.5、4.0、4.5、5.0)对CS-DL纳米颗粒粒径、Zeta 电位和包封率的影响、确定最适的CS溶液pH。
TPP溶液浓度对CS-DL纳米颗粒粒径、Zeta 电位和包封率的影响:其他制备工艺参数不变,探究TPP溶液质量浓度(1.5、2、2.5、3 mg/mL)对CS-DL纳米颗粒粒径、Zeta电位和包封率的影响,确定最适的TPP溶液浓度。
CS与DL质量比对CS-DL纳米颗粒粒径、Zeta电位和包封率的影响:其他制备工艺参数不变,探究CS与DL质量比(1∶1、1∶1.2、1∶1.4、1∶1.6)对CS-DL纳米颗粒粒径、Zeta电位和包封率的影响确定最适的CS与DL质量比。
1.3.2 CS-DL纳米颗粒粒径及Zeta电位的测定
将制备的CS-DL纳米颗粒悬浮液稀释1 000倍,置于马尔文纳米粒度分析仪测定粒径和Zeta电位。采用动态光散射技术,测定温度为25 ℃、散射角为90°、折射率为1.460,每组样重复测定3次。
1.3.3 CS-DL纳米颗粒包封率的测定
根据YANG等[14]研究中描述的方法使用分光光度计测定CS-DL纳米颗中DL含量,DL标准曲线的绘制:配制DL质量浓度为1.6、2、2.4、2.8、3.6 mg/mL的标准溶液,以正己烷作为空白对照,用紫外可见分光光度计在波长252 nm处测定吸光度,以DL质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
取5 mL CS-DL纳米颗粒悬浮液加入5 mL正己烷,涡旋混匀1 min后45 ℃超声处理20 min,超声功率100 W,冷却至室温后4 000 r/min室温离心20 min,取油相液体于紫外分光光度计252 nm测定吸光值,将吸光值代入标曲计算处DL的浓度,最后代入如下公式(1):
包封率![]()
(1)
1.3.4 FTIR分析
称取一定质量冻干后的CS-DL纳米颗粒与干燥的KBr按照1∶100的质量比进行混合、研磨后,再通过压片机挤压成规整的圆片。使用FTIR光谱仪在400~4 000 cm-1的波数内进行扫描,扫描频率为4 cm-1,扫描次数为64,FTIR图谱使用Origin 2022绘制。
1.3.5 TEM分析
将最佳制备条件下的CS纳米颗粒和CS-DL纳米颗粒悬液用磷钨酸染色后滴加到200目镀碳膜的铜网上,干燥后在透射电子显微镜下观察,低压为90 kV,放大倍数为3 000~30 000。
1.3.6 CS-DL纳米颗粒抑菌曲线的测定
通过KRISHNAMOORTHY等[15]的方法,实验组为向YPD液体培养基中加入1 mL最佳制备条件的CS-DL纳米颗粒悬浮液,以2%的接菌量接种处于对数期的白假丝酵母菌悬液,使体系中含白假丝酵母菌105~106 CFU/mL。分别以无菌水为对照,相同浓度DL(与CS-DL纳米颗粒悬浮液中DL浓度相同)为阳性对照,未包埋的CS纳米颗粒悬浮液(CS nanoparticle suspension,CSNPs)为阴性对照1;CS溶液(质量浓度为2 mg/mL)为阴性对照2,将上述样品放入全自动微生物生长曲线分析仪,设置参数为:温度30 ℃、转速150 r/min、波长600 nm、采样间隔时间30 min,恒温箱培养36 h后,导出数据绘制抑菌曲线。
1.3.7 CS-DL纳米颗粒对白假丝酵母细胞形态的影响
参考孙月等[5]的实验方法通过扫描电镜探讨CS-DL纳米颗粒、DL、以及CS对白假丝酵母细胞形态的影响。
2 结果与分析
2.1 CS-DL纳米颗粒工艺的制备
2.1.1 不同因素对CS-DL纳米颗粒浊度、粒径和Zeta电位的影响
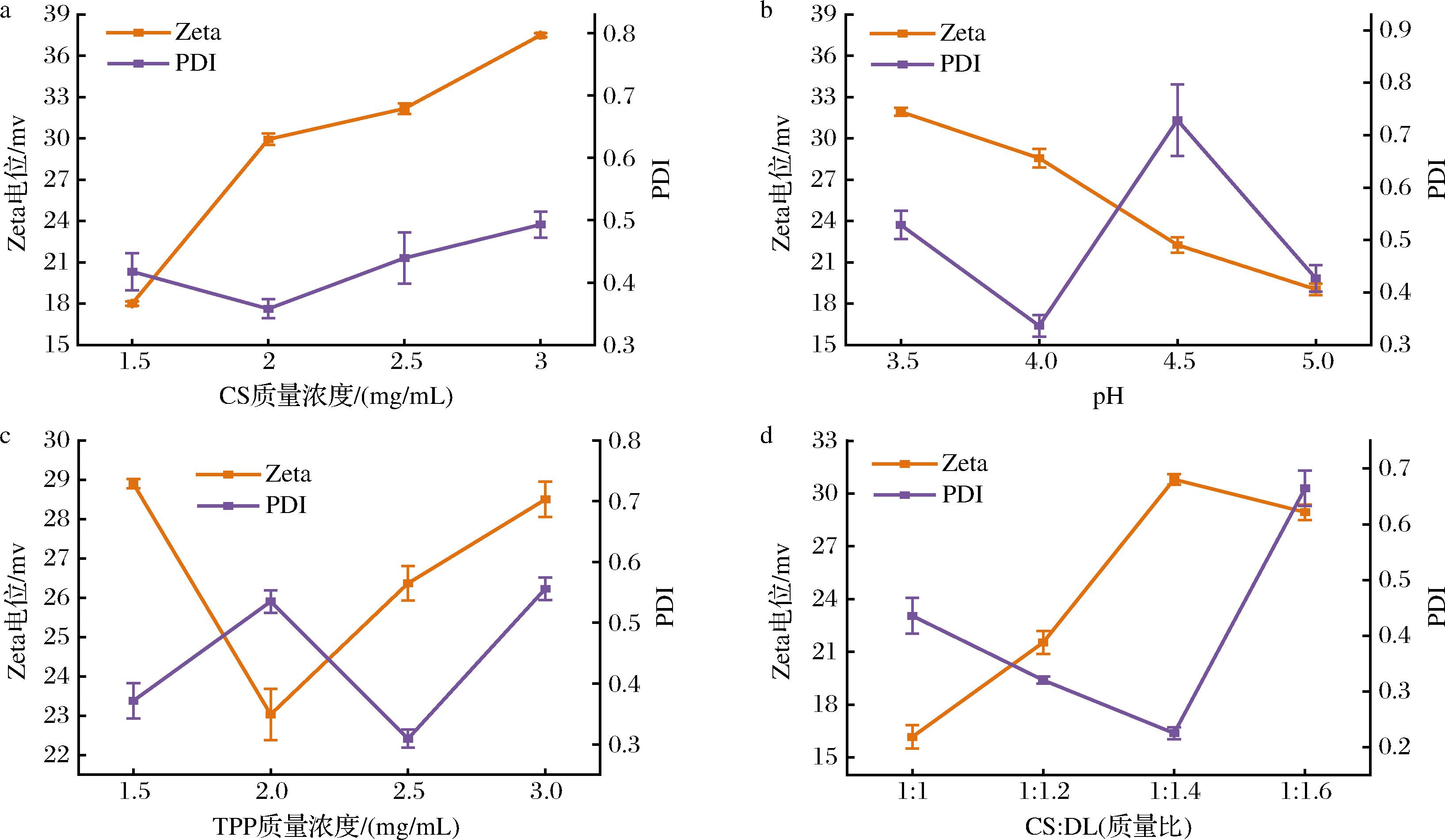
Zeta电位是表征胶体分散系稳定性的重要指标。多分散指数(polydispersity index,PDI)可以用于评估纳米液滴的尺寸分布是否均匀,当PDI<0.5时,证明体系分散性较好,当PDI<0.3时,证明体系分散性良好,具有物理稳定性。如图2所示,不同制备条件下纳米颗粒悬浮液呈半透明状,泛有蓝色乳光,体系均匀,无分层现象。如图2-a所示,随着CS质量浓度的增加,CS-DL纳米颗粒的浊度和粒径均呈现先增大后减小的趋势,其中在CS质量浓度为2 mg/mL时在600 nm处的吸光度为0.031,粒径为219.6 nm,由于CS溶液的浓度逐渐增加,CS表面所带正电荷会相应增加[16],与磷酸基团的相互作用增加,使最后CS-DL纳米颗粒的稳定性增加。但CS溶液浓度过高会导致体系黏度增加,导致粒径的增加。如图3-a所示,随着CS溶液浓度的增加,纳米颗粒的电位也随之增加,且表面带正电荷,虽PDI<0.5,体系的分散性较高,但是由于体系中过量的正电荷会吸引大量的磷酸基团,导致纳米颗粒的粒径增大。

a-CS质量浓度;b-CS溶液pH;c-TPP质量浓度;d-CS∶DL(质量比)
图2 不同因素对CS-DL纳米颗粒的浊度、粒径影响
Fig.2 Effect of different factors on turbidity and particle size of CS-DL nanoparticles
a-CS质量浓度;b-CS溶液pH;c-TPP质量浓度;d-CS∶DL(质量比)
图3 不同因素对CS-DL纳米颗粒Zeta电位和PDI的影响
Fig.3 Effect of different factors on Zeta potential and PDI of CS-DL nanoparticles
由于CS-TPP的机理是基于离子凝胶化,因此溶液的pH对于CS-DL纳米颗粒的形成和包埋过程至关重要[17],由图2-b可知,CS-DL纳米颗粒的浊度随着pH的增加而减少,粒径呈现先减后增的趋势,在pH值为4.0时,CS-DL纳米颗粒粒径最小为192.9 nm。如图3-b所示,随着CS溶液pH值转至低酸性条件时,纳米颗粒电位逐渐降低,且在CS溶液pH值为4.0时,PDI最低,体系分散性最好,可能由于此条件下CS与TPP的静电相互作用更强,随着pH的增加,颗粒之间产生较多凝聚导致粒径增加。
TPP是与CS发生交联作用的磷酸盐,TPP的浓度对纳米颗粒的稳定性有较大影响[18]。随着TPP溶液浓度增加,过量带负电荷的磷酸基团无法与CS形成稳定的交联,纳米颗粒的粒径和浊度随着TPP溶液浓度的增加,呈现先减小后增加的趋势,TPP溶液质量浓度为2.5 mg/mL时,粒径最小为202.9 nm,浊度为0.032。如图3-c所示,当TPP质量浓度为2 mg/mL时,体系中少量的磷酸基团与CS交联,CS的静电结合位点减少,虽然此时纳米颗粒的电位较大体系分散性较好,但粒径较大。当TPP质量浓度为2.5 mg/mL时,CS静电结合位点增多,纳米颗粒收缩粒径减小,随着TPP溶液浓度的增加,会使在搅拌时导致颗粒间的黏连,形成聚集体导致粒径增大[19]。
当CS与DL质量比从1∶1增长至1∶1.6时,CS-DL纳米颗粒的浊度和粒径呈现先减少后增加的趋势,这可能由于,当DL浓度较低时,乳化剂过量乳化导致聚集,粒径较大,随着DL含量的增加,浊度在1∶1.2时达到最小值0.034,而粒径在质量比1∶1.4时达到最小值144.3 nm,如图3-d所示,CS-DL纳米颗粒在质量比为1∶1.4时,Zeta电位达到最大值30.8 mV,PDI为0.225,体系有良好的分散性,随着DL含量进一步增大,由于存在未涂覆的DL,导致Zeta电位的增加和分散性降低。
2.1.2 微观形态的影响
使用显微镜在物镜(40×)下观察了不同制备条件下纳米颗粒悬浮液的微观形态,如图4所示,可观察到各条件下制备的CS-DL纳米颗粒均呈现圆形或近似圆形,少数呈聚集不规则形。

图4 单因素制备CS-DL纳米颗粒悬浮液显微形态
Fig.4 Microscopic morphology of CS-DL nanoparticle suspensions prepared by one-factor preparation
2.1.3 不同因素对对包封率的影响
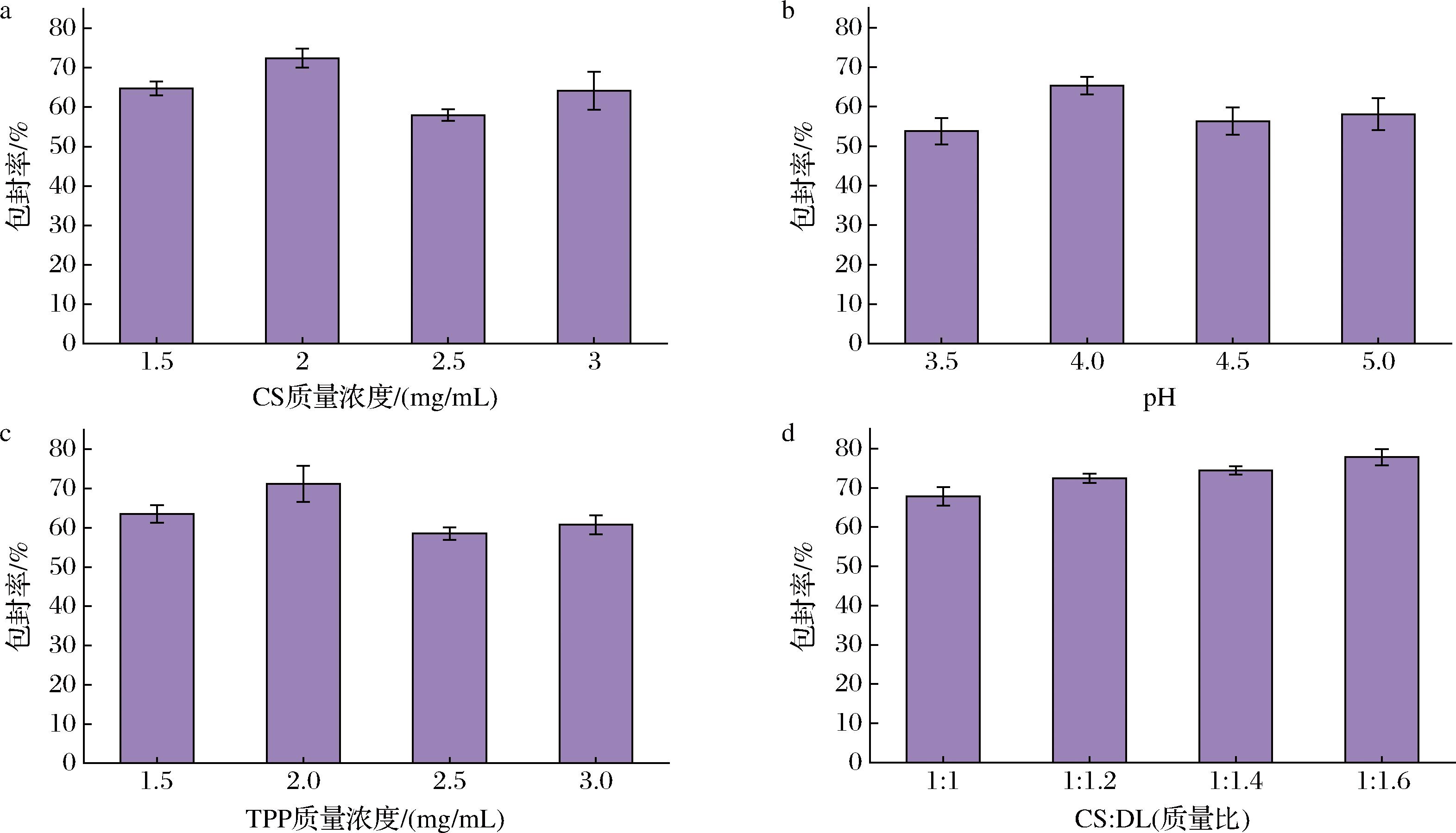
包封率是评估CS-DL纳米颗粒质量的一个重要指标,不同因素对CS-DL纳米颗粒的包封率的影响如图5所示,随着CS溶液质量浓度从1.5 mg/mL增加到3 mg/mL,纳米颗粒的包封率呈现先增加后下降的趋势,当CS溶液质量浓度为2 mg/mL时包封率最大为72.42%,且此时粒径最小为219.6 nm,PDI<0.5,体系较为均匀稳定,因此选取CS溶液质量浓度为2 mg/mL为最适条件。由于CS本身带电荷,在制备纳米颗粒过程中会与多聚阴离子发生反应,因此整个离子交联的过程对CS溶液pH有一定要求,pH会影响CS-DL纳米颗粒的物理化学性质,当CS溶液pH值为4.0时包封率最大,为65.32%,并且此时CS-DL纳米颗粒粒径最小,为192.9 nm,PDI<0.5,体系较为均匀稳定,因此选取pH值为4.0为最适条件。TPP是与CS发生交联作用的磷酸盐,TPP的浓度对纳米颗粒的稳定性有较大影响[20],随着TPP溶液质量浓度从1.5 mg/mL增加到3 mg/mL,纳米颗粒的包封率先增加后趋于稳定,TPP溶液质量浓度为2 mg/mL时包封率最大,为71.19%,此时粒径为229.5 nm,大小适中,因此选取TPP溶液质量浓度为2 mg/mL为最适条件。随着壁材CS和芯材DL的质量比的变化,纳米颗粒的包封率随着DL含量的增加而增加,包封率在质量比1∶1.6时达到最高77.83%,但由于此时CS-DL纳米颗粒的粒径大于250 nm,粒径较大,并且其分散性较差,因此选用CS与DL质量比1∶1.4为最适条件,此时粒径最小且分散性良好。
a-CS质量浓度;b-CS溶液pH;c-TPP质量浓度;d-CS∶DL(质量比)
图5 不同因素对纳米颗粒包封率的影响
Fig.5 Effect of different factors on the encapsulation efficiency of CS-DL nanoparticles
综上所述,CS-DL纳米颗粒的最佳制备条件为:CS溶液质量浓度为2 mg/mL,pH值为4.0,TPP溶液质量浓度为2 mg/mL,CS与DL质量比为1∶1.4。
2.2 FTIR
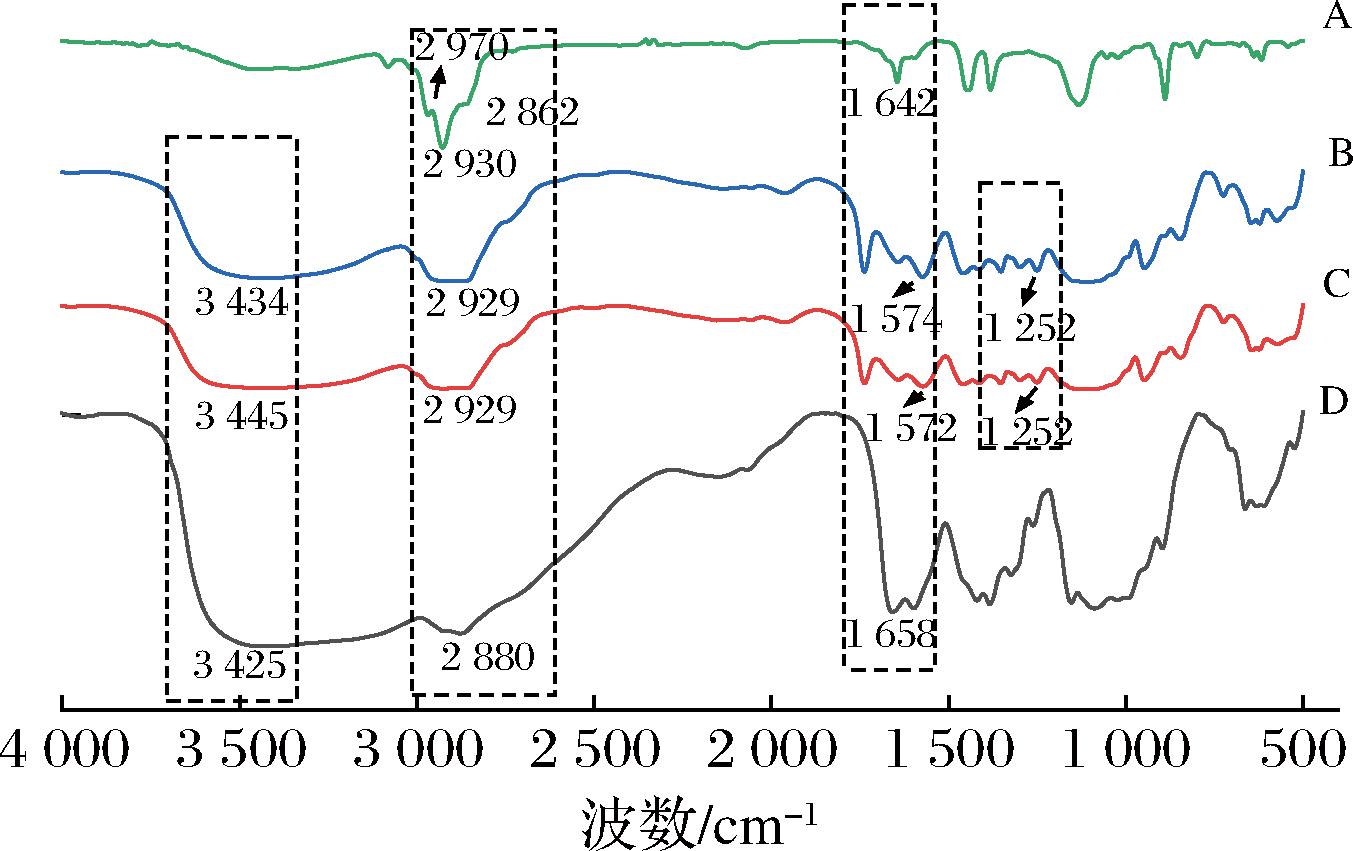
FTIR是一种用于确认分子指纹的振动光谱技术,通过FTIR对CS粉末、CS纳米颗粒、DL、CS-DL纳米颗粒进行化学组成分析。其中图6显示了DL、CS-DL纳米颗粒、CS纳米颗粒、CS粉末的FTIR图谱。其中CS粉末在2 880 cm-1(—CH拉伸)[21]、1 658 cm-1(酰胺基团的C![]() O伸缩振动)、1 090 cm-1(C—O—C拉伸)显示出特征峰(图6-D)。对于CS纳米颗粒(图6-C)来说,在3 434 cm-1(—OH伸缩)、1 737 cm-1(羰基基团中的羰基拉伸)、1 572 cm-1(酰胺基C—N伸缩并且NH弯曲)出现特征峰,并且1 252 cm-1出现的特征峰属于TPP离子中PO2基团的反对称[12]。DL的吸收峰2 970 cm-1(CH)、2 930 cm-1(CH2)、2 862 cm-1(CH3)对应C—H键伸缩,1 443 cm-1对应C—H弯曲和角变形,1 642 cm-1对应C
O伸缩振动)、1 090 cm-1(C—O—C拉伸)显示出特征峰(图6-D)。对于CS纳米颗粒(图6-C)来说,在3 434 cm-1(—OH伸缩)、1 737 cm-1(羰基基团中的羰基拉伸)、1 572 cm-1(酰胺基C—N伸缩并且NH弯曲)出现特征峰,并且1 252 cm-1出现的特征峰属于TPP离子中PO2基团的反对称[12]。DL的吸收峰2 970 cm-1(CH)、2 930 cm-1(CH2)、2 862 cm-1(CH3)对应C—H键伸缩,1 443 cm-1对应C—H弯曲和角变形,1 642 cm-1对应C![]() C伸缩振动(图6-A)。而对于CS-DL纳米颗粒(图6-B),—OH的峰值从3 434 cm-1偏移至3 445 cm-1,说明在加入DL后,纳米颗粒的氢键发生改变[22],2 929 cm-1的峰值增加,说明其显示CS中的C—H键和DL中的C—H键伸缩,1 252 cm-1出现的特征峰表明CS的NH3+与TPP的磷酸基团之间因静电作用形成复合[23]。1 574 cm-1表示CS酰胺基N—H弯曲振动[24]。CS-DL纳米颗粒特征峰的变化证明了DL的包埋成功。
C伸缩振动(图6-A)。而对于CS-DL纳米颗粒(图6-B),—OH的峰值从3 434 cm-1偏移至3 445 cm-1,说明在加入DL后,纳米颗粒的氢键发生改变[22],2 929 cm-1的峰值增加,说明其显示CS中的C—H键和DL中的C—H键伸缩,1 252 cm-1出现的特征峰表明CS的NH3+与TPP的磷酸基团之间因静电作用形成复合[23]。1 574 cm-1表示CS酰胺基N—H弯曲振动[24]。CS-DL纳米颗粒特征峰的变化证明了DL的包埋成功。
A-DL;B-CS-DL纳米颗粒;C-CS纳米颗粒;D-CS粉末。
图6 DL、CS-DL纳米颗粒、CS纳米颗粒、CS粉末傅里叶红外光谱
Fig.6 FTIR pattern of DL, CS-DL nanoparticles, CS nanoparticles and CS
2.3 TEM分析
使用TEM观察了最佳制备条件下的CS纳米颗粒和CS-DL纳米颗粒的形貌和轮廓,如图7所示,未负载DL的纳米颗粒和负载DL的纳米颗粒都呈现圆形和椭圆形,尺寸分布均匀,没有出现严重的黏连和聚集现象。在30 000放大倍数下可以观察到,相较于CS纳米颗粒,负载DL的纳米颗粒尺寸比较大,粒径分布为100~200 nm,与所测得粒径178.3 nm结果相符。

a-CS纳米颗粒,放大倍数3 000;b-CS纳米颗粒,放大倍数30 000;c-CS-DL纳米颗粒,放大倍数3 000;d-CS-DL纳米颗粒,放大倍数30 000
图7 CS纳米颗粒与CS-DL纳米颗粒TEM图
Fig.7 TEM of CS nanoparticles and CS-DL nanoparticles
2.4 CS-DL纳米颗粒对白假丝酵母生长的影响
通过在不同时间段检测菌的光密度值(OD600nm值)表征白假丝酵母的生长趋势。从CS-DL纳米颗粒对白假丝酵母的抑菌曲线(图8)可以看出,空白对照,以及CS、CS纳米颗粒处理组均对白假丝酵母生长没有明显影响,而与添加相同量未包埋的DL和CS纳米颗粒相比,最佳条件制备的CS-DL纳米颗粒处理组在8 h时明显抑制白假丝酵母且在16 h时明显延缓了白假丝酵母的生长,说明与等量的DL相比,负载CS-DL纳米颗粒对白假丝酵母的生长抑制作用更强,CS本身具有抗真菌性,根据Pawel研究表明,CS纳米颗粒对真菌的抑制作用要明显高于CS分子[25],由此可见,CS纳米颗粒的包埋可以改善DL的抑菌活性。
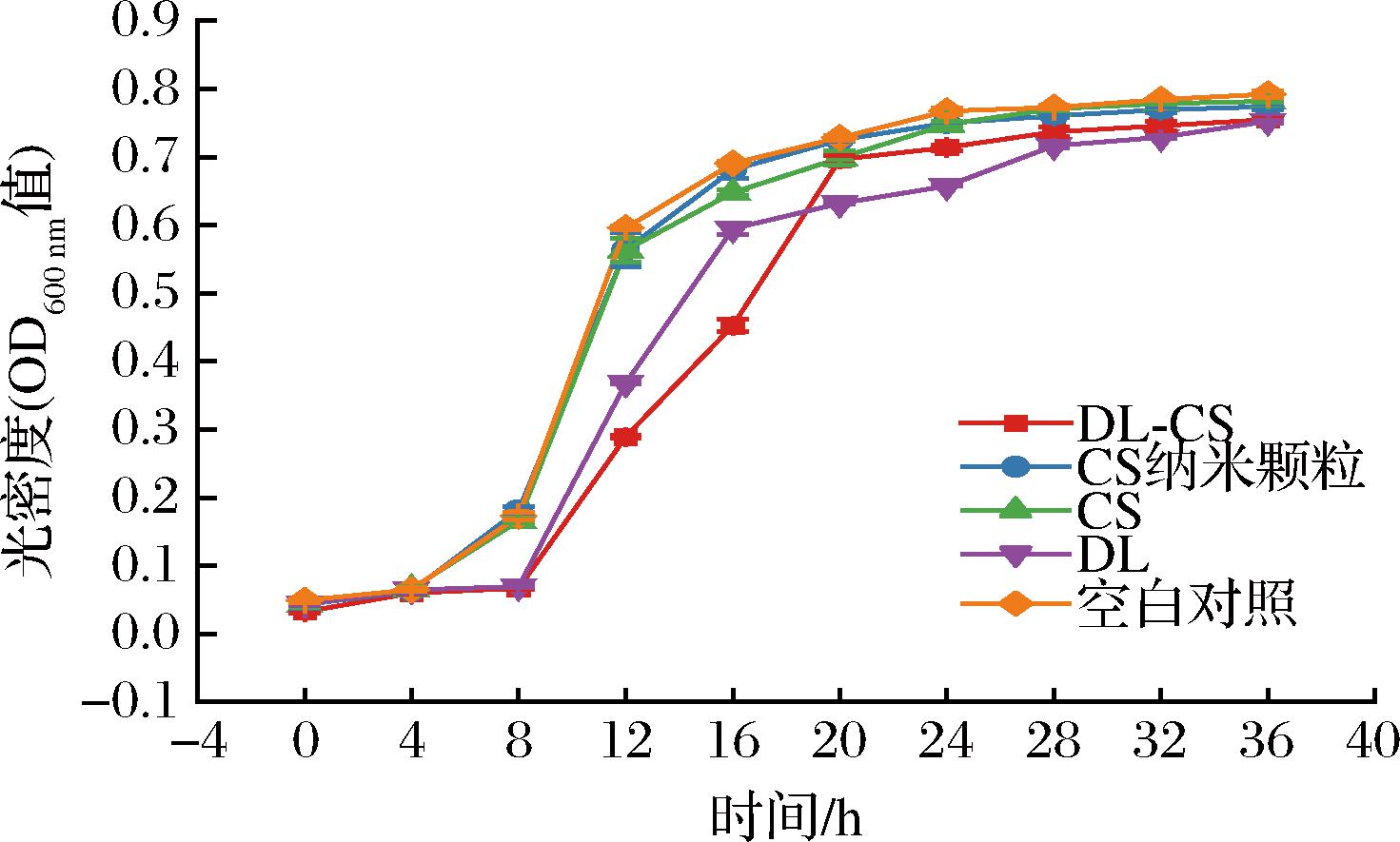
图8 DL微胶囊化前后对白假丝酵母生长抑制影响
Fig.8 The effect of DL on the inhibition of Candida albicans growth before and after encapsulation
2.5 CS-DL纳米颗粒对白假丝酵母细胞形态的影响
细胞形态改变大多是因为细胞壁表面恶化、细胞肿胀和细胞膜破裂。通过SEM结果(图9)观察,未经任何处理的白假丝酵母呈椭圆形,细胞结构完整且表面光滑,经过CS处理的白假丝酵母表面没有出现明显的改变,与空白对照相比,经DL处理后部分细胞出现了不同程度的凹陷。同样,包埋后的DL处理后的细胞形态发生改变,出现了形态不规则以及粘黏的现象。结合图8可以看出,DL对白假丝酵母有较强的抑菌性,而经过CS-DL纳米颗粒处理的白假丝酵母生长相较于DL处理的白假丝酵母受到明显的延缓,且在SEM图中观察到明显的细胞形态变化,由此可以看出,包埋后CS-DL纳米颗粒对白假丝酵母同样具有较强的抑菌效果。

a-未经处理的白假丝酵母;b-经壳聚糖处理的白假丝酵母;c-经D-柠檬烯处理的白假丝酵母经;d-CS-DL纳米颗粒处理的白假丝酵母
图9 白假丝酵母形态变化SEM图
Fig.9 SEM imaging of morphological changes in Candida albicans
注:L表示图像在显示器的物理宽度,主要用于计算实际尺寸,L为固定值127 mm;1 000为放大倍数。
3 结论与讨论
本研究以CS作为壁材包埋DL,最佳制备条件为:CS溶液pH值为4.0,CS与DL质量比为1∶1.4,TPP溶液质量浓度为2 mg/mL,CS溶液质量浓度为2 mg/mL。在此条件下的CS-DL纳米颗粒的包封率为72.64%,粒径为178.3 nm,微观形态呈现出均匀分布的圆形和椭圆形,FTIR进一步证明CS对DL的包埋是成功的。与CS以及DL对照相比,CS-DL纳米颗粒对白假丝酵母的生长有明显的抑制作用,且通过SEM证实了CS-DL纳米颗粒对白假丝酵母细胞形态的破坏。综上所述,CS-DL纳米颗粒延缓了DL的释放且改善了DL的抑菌活性,扩展的DL的使用范围,为抑制食源性白假丝酵母提供了理论基础。
[1] EL-SHAROUD W M, BELLOCH C, PERIS D, et al.Molecular identification of yeasts associated with traditional Egyptian dairy products[J].Journal of Food Science, 2009, 74(7):M341-M346.
[2] WANDERLEY L, BIANCHIN A, TEO C R P A, et al.Occurrence and pathogenicity of Candida spp.in unpasteurized cheese[J].Revista Brasileira de Biociências, 2013, 11(2):146-148.
[3] RAJKOWSKA K, ![]() A.Typing and virulence factors of food-borne Candida spp.isolates[J].International Journal of Food Microbiology, 2018, 279:57-63.
A.Typing and virulence factors of food-borne Candida spp.isolates[J].International Journal of Food Microbiology, 2018, 279:57-63.
[4] ARIKAN-AKDAGLI S, GHANNOUM M, MEIS J F.Antifungal resistance:Specific focus on multidrug resistance in Candida auris and secondary azole resistance in Aspergillus fumigatus[J].Journal of Fungi, 2018, 4(4):129.
[5] 孙月, 曾朝懿, 李梓钰, 等.山苍子精油对白假丝酵母菌细胞膜屏障影响的机理[J].食品科学, 2023, 44(17):29-35.SUN Y, ZENG C Y, LI Z Y, et al.Mechanism for the effect of Litsea cubeba essential oil on Candida albicans cell membrane barrier[J].Food Science, 2023, 44(17):29-35.
[6] WANG R J, VEGA P, XU Y, et al.Exploring the anti-quorum sensing activity of a D-limonene nanoemulsion for Escherichia coli O157∶H7[J].Journal of Biomedical Materials Research Part A, 2018, 106(7):1979-1986.
[7] 王广超, 梁惠, 韩磊, 等. D-柠檬烯对乙醇性肝损伤大鼠抗氧化活性与NF-κB及COX-2表达影响[J]. 青岛大学医学院学报, 2015, 51(4):441-444.WANG G C, LIANG H, HAN L, et al. Effects of D-limonene on antioxidant ability and the expressions of NF-κB and cox-2 in rats with alcohol-induced hepatic injury[J]. Acta Academiae Medicinae Qingdao Universitatis, 2015, 51(4):441-444.
[8] ASSALI M, JARADAT N, MAQBOUL L.The formation of self-assembled nanoparticles loaded with doxorubicin and D-limonene for cancer therapy[J].ACS Omega, 2022, 7(46):42096-42104.
[9] 陈思远. D-柠檬烯对污泥厌氧发酵产酸的影响及机理研究[D].赣州:江西理工大学, 2021.CHEN S Y.Effect of D-limonene on acid production by anaerobic fermentation of sludge and its mechanism[D].Ganzhou:Jiangxi University of Science and Technology, 2021.
[10] 张兰. 丁香精油壳聚糖纳米微胶囊的研究及在蓝莓保鲜中的应用[D].西安:陕西科技大学, 2021.ZHANG L.Study on clove essential oil chitosannano-microcapsules and its application in blueberry preservation[D].Xi’an:Shaanxi University of Science &Technology, 2021.
[11] AMINABHAVI T M, DHARUPANEEDI S P.12-Production of Chitosan-Based Hydrogels for Biomedical Applications[M].Chitosan Based Biomaterials Volume 1.Cambridge:Woodhead Publishing, 2017:295-319.
[12] TIAN B R, QIAO X, GUO S L, et al.Synthesis of β-acids loaded chitosan-sodium tripolyphosphate nanoparticle towards controlled release, antibacterial and anticancer activity[J].International Journal of Biological Macromolecules, 2024, 257:128719.
[13] RAHAIEE S, SHOJAOSADATI S A, HASHEMI M, et al.Improvement of crocin stability by biodegradeble nanoparticles of chitosan-alginate[J].International Journal of Biological Macromolecules, 2015, 79:423-432.
[14] YANG K, LIU A P, HU A X, et al.Preparation and characterization of cinnamon essential oil nanocapsules and comparison of volatile components and antibacterial ability of cinnamon essential oil before and after encapsulation[J].Food Control, 2021, 123:107783.
[15] KRISHNAMOORTHY R, GASSEM M A, ATHINARAYANAN J, et al.Antifungal activity of nanoemulsion from Cleome viscosa essential oil against food-borne pathogenic Candida albicans[J].Saudi Journal of Biological Sciences, 2021, 28(1):286-293.
[16] NEGI A, KESARI K K.Chitosan nanoparticle encapsulation of antibacterial essential oils[J].Micromachines, 2022, 13(8):1265.
[17] PAN C L, QIAN J Q, FAN J, et al.Preparation nanoparticle by ionic cross-linked emulsified chitosan and its antibacterial activity[J].Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2019, 568:362-370.
[18] KALOTI M, BOHIDAR H B.Kinetics of coacervation transition versus nanoparticle formation in chitosan-sodium tripolyphosphate solutions[J].Colloids and Surfaces B:Biointerfaces, 2010, 81(1):165-173.
[19] 杜志阳. 壳聚糖自组装递送体系的构建及其对活性物质的缓控效用[D].长春:吉林大学, 2020.DU Z Y.Fabrication of self-assembled chitosan-based delivery systems for the effects of sustained and controlled release of bioactive compounds[D].Changchun:Jilin University, 2020.
[20] DU Z Y, LIU J B, ZHANG T, et al.A study on the preparation of chitosan-tripolyphosphate nanoparticles and its entrapment mechanism for egg white derived peptides[J].Food Chemistry, 2019, 286:530-536.
[21] ALEHOSSEINI E, JAFARI S M, SHAHIRI TABARESTANI H.Production of D-limonene-loaded Pickering emulsions stabilized by chitosan nanoparticles[J].Food Chemistry, 2021, 354:129591.
[22] TANG Y, GAO C C, ZHANG Y, et al.Structure and functionality of cinnamaldehyde/chitosan/gum Arabic complex particles[J].Food Hydrocolloids, 2024, 146:109220.
[23] 邢承宇, 王璐, 陈星光, 等.香芹酚-壳聚糖纳米颗粒的制备及抑菌活性研究[J].食品与发酵工业, 2022, 48(22):82-88.XING C Y, WANG L, CHEN X G, et al.Preparation and antifungal activity of chitosan nanoparticle loaded with carvacrol[J].Food and Fermentation Industries, 2022, 48(22):82-88.
[24] ALIPANAH H, FARJAM M, ZARENEZHAD E, et al.Chitosan nanoparticles containing limonene and limonene-rich essential oils:Potential phytotherapy agents for the treatment of melanoma and breast cancers[J].BMC Complementary Medicine and Therapies, 2021, 21(1):186.
[25] XING Y G, WANG X M, GUO X L, et al.Comparison of antimicrobial activity of chitosan nanoparticles against bacteria and fungi[J].Coatings, 2021, 11(7):769.