白酒是世界六大蒸馏酒之一[1]。据统计,目前已确定了12种香型,其中“酱、浓、清、米”等4种香型是其基本香型,其他8种香型均是在这4种香型的基础上衍生而来的特定香型[2]。“凤香型”是继“浓、酱、清、米”后第一个被正式确立的白酒香型,也是最早从“其他香型”中分离出来的香型,凤香型白酒以乙酸乙酯和己酸乙酯为主体复合香,具有口感醇厚、诸味谐调的特点[3]。凤香型白酒的酿造环境主要由大曲、酒醅和窖泥等所组成,来自于其中的微生物可以通过复杂的生物化学反应将淀粉、糖、氨基酸和脂肪酸,进一步转化成醇、酯、醛、酮和酸等其他香气成分[4]。在生产中,大曲作为糖化发酵剂,被直接加入到酒醅中参与发酵,窖泥是微生物生长代谢的良好培养基,与酒醅接触之后,其中的微生物会迁移到酒醅中,参与白酒发酵[5],上述微生物的代谢活动及其协同作用共同决定白酒的风味和品质。
近年来,随着组学技术的快速发展,微生物群落和风味物质的相关性被不断得到深入研究,如曹丹等[6]对3种不同凤香型大曲的理化、真菌群落及挥发性物质进行显著差异和相关性分析,结果表明,真菌群落与理化特性和挥发性物质之间密切相关,菌群不同,代谢类型不同,从而导致大曲品质差异。姜政飞等[7]以赤水河产区5个不同酒厂为研究对象,研究其中酒醅微生物群落结构差异,结果表明,酿造环境中的微生物差异会影响酒醅初始群落的形成,从而使其产生的风味物质有所不同。TAO等[8]研究发现窖泥中的微生物群落结构与风味物质的种类和含量密切相关。目前,关于凤香型白酒酿造微生物的研究主要集中在分析单一因素,如分析大曲或酒醅,对白酒品质的影响,而对整个酿造环境中微生物群落组成及其与风味物质之间相互关系的研究仍较为稀缺。此外,原料和气候条件的差异也会导致中国各地白酒风格多样[9]。陕西长武地区金醇古酒是“陕西老字号”品牌,秉承凤香型白酒酿造技艺,在酿造过程中坚持古法酿造,纯粮发酵,所使用的醇古(鹑觚)酿造技艺于2018年被列入陕西省第六批非物质文化遗产名录,产品具有窖香浓郁,幽雅细腻,绵甜爽净,回味悠长的风格。目前对其相关研究尚处在起步阶段,因此深入探究该地区白酒的酿造微生物资源、理化特性及其与风味物质的代谢调控机制,对于揭示其品质特征具有重要意义。在白酒酿造过程中,大曲、酒醅和窖泥形成了复杂的微生态系统,大曲作为发酵剂,为酒醅提供了丰富的微生物资源,窖泥则为酒醅提供了厌氧微生物来源,进一步丰富了酒醅的微生物多样性[5],而酒醅则通过复杂的代谢活动生成了主要的风味物质。三者功能相互补充、相互影响,共同决定了白酒的品质和风味特征。一般来说,白酒的风味是决定其品质的最重要因素,是微生物群在水分、酸度、温度等各种理化参数的作用下所形成的[9]。因此,通过对微生物群落、理化因子和风味化合物三者间的关联性进行分析,可以更好地了解白酒的发酵过程,增强发酵稳定性,从而提高白酒的质量。
为此,本研究采用Illumina MiSeq高通量测序(high throughput sequencing, HTS)技术和顶空固相微萃取-气相色谱质谱联用(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术研究该地区酒厂来源大曲、酒醅和窖泥微生物群落以及挥发性风味物质,同时还对其理化性质进行检测,并通过关联性分析探究微生物与风味和理化之间的联系,旨在全面分析凤香型白酒在生产过程中不同原料之间的差异,为长武地区金醇古酒厂酿造工艺的提升提供一些理论数据参考。
1 材料与方法
1.1 材料与试剂
大曲、酒醅、窖泥和原酒均采集自陕西金醇古酒业有限责任公司(陕西省咸阳市长武县)15号窖池的圆窖阶段样品,取样时间2024年4月,分别编号为(DQ、JP、JN、YJ),其中大曲采用五点取样法,将其混合均匀为1个样品(DQ1、DQ2、DQ3);酒醅采用九点取样法,将发酵结束后的立体酒醅分为上中下3层,每层取3个点,将9个点的样本均匀混合作为1个样品(JP1、JP2、JP3);窖泥采用五点取样法对其窖池的窖壁泥、窖底泥进行取样,并将其混合为1个样品(JN1、JN2、JN3);原酒取自于蒸馏前期的酒样,编号为(YJ1、YJ2、YJ3)。每个样品采集3个平行样品,再平均分为2份,一份贮存在-80 ℃冰箱,用于分析微生物群落结构;另一份置于4 ℃冰箱保藏,用于理化指标,风味物质的检测。
氢氧化钠、葡萄糖、乙醇、次甲基蓝、盐酸、酒石酸钾钠、碘、硫酸铜、氯化钠(均为分析纯),天津市天力化学试剂有限公司;乙酸正戊酯(标准品):上海麦克林生物科技有限公司。
1.2 仪器与设备
GC-MS-2030气相色谱-质谱联用仪、Inert Cap Wax毛细管色谱柱,岛津企业管理有限公司;57330-U SPME 固相微萃取手动手柄、57375-U SPME 固相微萃取操作平台、50/30 μmDVB/CAR/PDMS 三相固相微萃取头,美国Supelco公司。
1.3 方法
1.3.1 基本理化指标测定
根据QB/T 4257—2011 《酿酒大曲通用分析方法》对样品进行水分、酸度、淀粉、还原糖含量的检测。
1.3.2 挥发性风味化合物测定
样品前处理:参照文献[10]并略有调整,取1 g样品,加入饱和NaCl溶液10 mL,加入10 μL质量浓度为87.6 μg/mL的乙酸正戊酯作为内标,放入20 mL顶空瓶中,在60 ℃下水浴15 min,在相同温度下用萃取头提取45 min,结束后,将SPME纤维萃取头插入气相色谱进样口250 ℃下解吸7 min,上述实验重复3次,检测其挥发性组分。
GC条件:30 m×0.25 mm×0.25 μm 色谱柱,进样口温度250 ℃,载气He,流速1 mL/min,不分流模式,进样量1 μL,程序升温:50 ℃保持2 min,以6 ℃/min速率升温至250 ℃,并保持3 min。
MS条件:EI电离源,电子能量70 eV,离子源温度240 ℃,质量扫描范围35~350 amu,溶剂延迟时间3 min。
数据首先在ChromaTOF软件中处理,然后通过标准谱库(NIST)检索后,筛选并去除相似度<80%的峰和硅氧烷类杂质, 鉴定出大曲、酒醅、窖泥和原酒样品中的挥发性化合物。采用半定量的方法,以乙酸正戊酯作为内标,挥发性风味物质的质量浓度可通过其峰面积与内标峰面积的比值乘以内标的质量浓度来计算。
1.3.3 基因组提取及高通量测序
样品前处理方法参照文献[11],根据土壤DNA提取试剂盒操作说明书提取微生物总DNA。PCR扩增及扩增体系参照文献[10-11]的方法。
PCR扩增定量:以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物和高效高保真酶进行PCR,确保扩增效率和准确性。使用正向引物338F(ACTCCTACGGGAGGCAGCA)和反向引物806R(GGACTACHVGGGTWTCTAAT)对细菌16S V3V4区进行扩增。使用正向引物ITS5-1737F(GGAAGTAAAAGTCGTAACAAGG)和反向引物ITS2-2043RGCTGCGTTCTTCATCGATGC)对真菌ITS1区进行扩增。将样品送至上海派森诺生物科技股份有限公司对大曲、酒醅和窖泥进行16S rRNA和真菌ITS高通量测序,获得的原始数据由该公司提供的云平台分析系统进行深度处理和分析。
1.4 数据处理
使用GraphPad Prism 8.0和Origin 2021软件进行作图,SIMCA14.1软件进行偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA),使用R语言代码计算大曲、酒醅和窖泥中的优势菌属与关键风味物质及理化参数的Spearman相关系数,并选取相关系数绝对值>0.6且相关性显著P<0.05的物质进行关联网络可视化。
2 结果与分析
2.1 长武地区凤香型白酒大曲、酒醅和窖泥理化特性分析
在酿造过程中,理化因子作为微生物活动的重要指标,不仅驱动着微生物群的动态变化,还直接决定了白酒的最终口感[12]。白酒发酵系统中微生物群和理化因子动态变化,它们相互关联、相互影响。因此,本研究测定了长武地区凤香型白酒的大曲、酒醅和窖泥样本的酸度、水分、淀粉和还原糖理化指标,检测结果见图1。
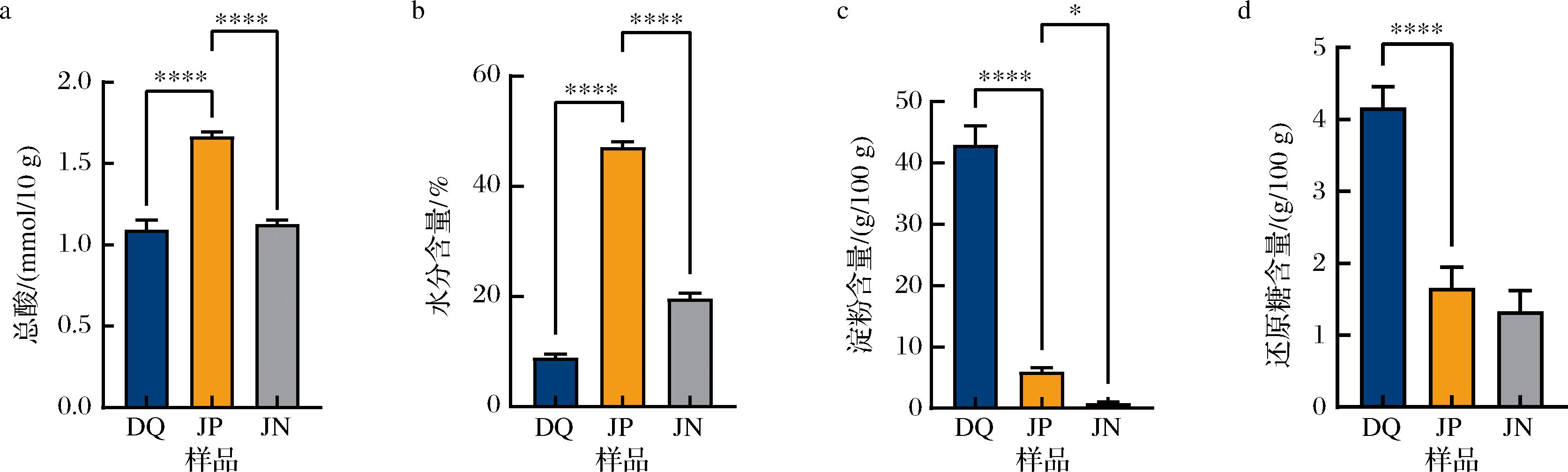
a-总酸;b-水分含量;c-淀粉含量;d-还原糖含量
图1 长武地区凤香型白酒大曲、酒醅和窖泥的理化指标测定结果
Fig.1 Determination results of physicochemical indexes of Fengxiang Baijiu Daqu, fermented grains, and pit mud samples in Changwu area
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1
由图1-a可知,该企业生产的大曲样品酸度为1.093 mmol/10 g;酒醅酸度为1.667 mmol/10 g;窖泥酸度为1.127 mmol/10 g。其中大曲的酸度为1.0~3.5 mmol/10 g最为适宜[13],较高或较低的酸度均不利于微生物的生长繁殖[14],该酒厂大曲酸度含量适宜,为大曲微生物的生长创造了良好的环境条件。
由图1-b可知,大曲、酒醅和窖泥的水分含量分别为8.933%、47.133%和19.667%。适当的水分能够为大曲中的微生物提供良好的生存和繁殖环境,水分含量过高过低都会影响大曲的质量,因而大曲的水分含量通常应在12.5%以下[15]。大曲水分含量低于12.5%,水分含量适宜;酒醅的水分含量相对较高,这为微生物的生长提供了充足的水分条件。
由图1-c可知,酒醅和窖泥中的淀粉含量分别为5.972、0.822 g/100 g,大曲的淀粉含量为42.947 g/100 g,符合大曲的淀粉含量标准(≤60 g/100 g),大曲的淀粉含量可以反映大曲中能水解利用微生物的水平[6]。
由图1-d可知,大曲、酒醅和窖泥中的还原糖含量分别为4.167、1.659、1.333 g/100 g,其中大曲的还原糖含量最高,表明该大曲具有较高的糖化能力,大曲作为糖化发酵剂,表明该大曲在糖化过程中可以高效地将淀粉转化为可发酵的还原糖,提供糖源供微生物使用。
2.2 长武地区凤香型白酒酿造过程中挥发性风味化合物分析
采用HS-SPME-GC-MS技术,分别对长武地区金醇古酒厂来源大曲、酒醅、窖泥和原酒的挥发性风味物质进行检测。其中主要挥发性风味化合物有99种,包括酯类43种、醇类17种、醛酮类11种、酸类11种、酚类6种和其他类11种。
由图2可知,原酒中的酯类含量最高,占原酒中总挥发性风味化合物的79.35%,其次是酒醅,相对含量达到54.18%。醇和酚类物质在大曲中相对含量最高,达到63.87%和5.67%,酸类在窖泥中相对含量最高,达到58.40%。原酒中主要挥发性风味化合物以酯类和醇类为主,付欢[16]对不同等级凤香型西凤白酒的挥发性风味物质进行分析,结果表明醇酯类物质在风味物质中占比最多,与本实验结果相似。
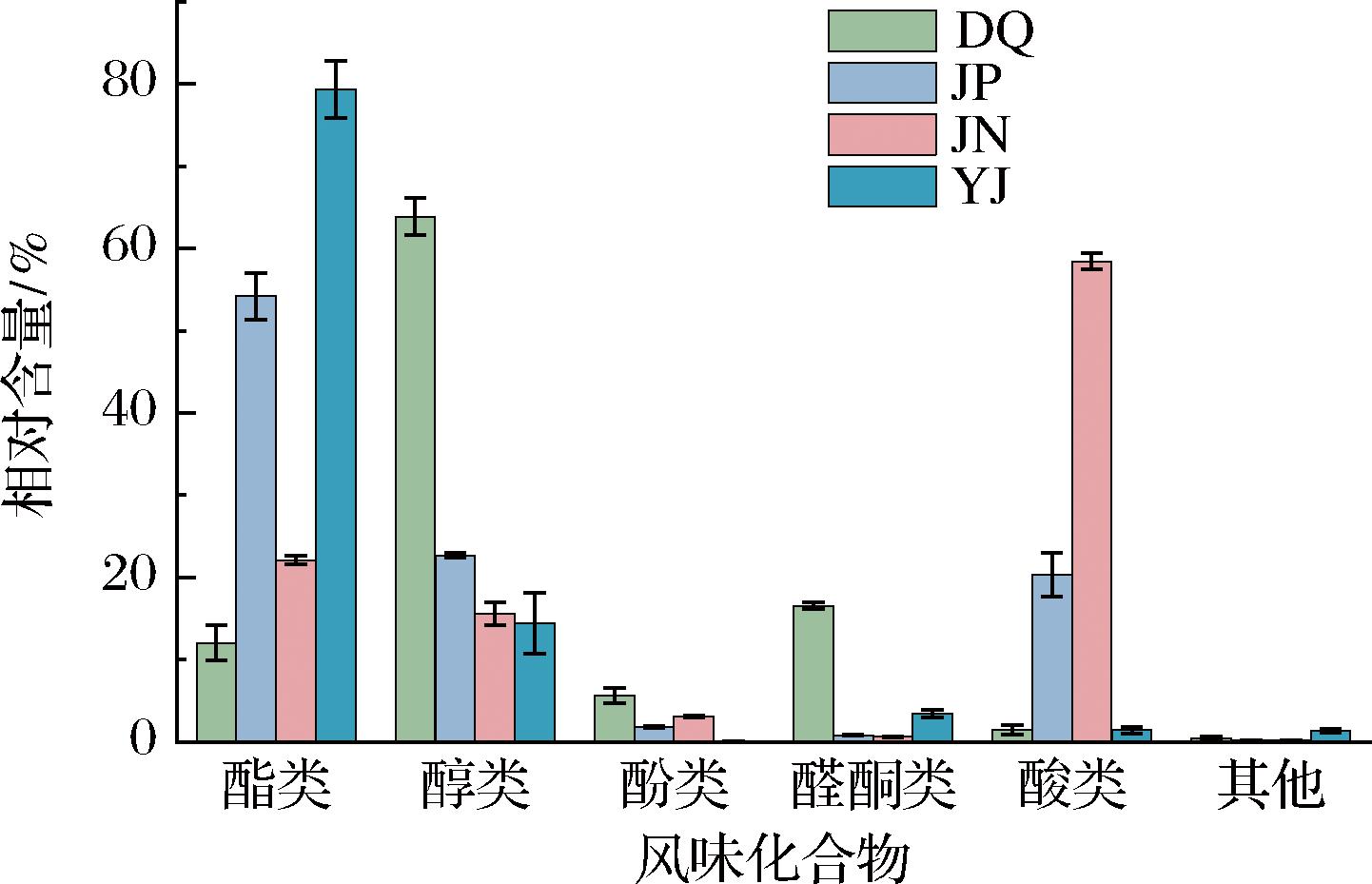
图2 长武地区凤香型白酒大曲、酒醅、窖泥和原酒挥发性风味化合物相对含量
Fig.2 Relative contents of volatile flavour compounds in Daqu, fermented grains, pit mud, and base liquor of Fengxiang Baijiu in Changwu area
大曲、酒醅、窖泥和原酒的风味物质半定量分析结果如图3所示,这些样品在风味物质含量上存在显著差异。大曲中苯乙醇、正己醇、苯甲醛和正戊醇等物质含量较高,分别为254.16、165.62、119.70、29.40 μg/mL,其中苯乙醇具有甜香和玫瑰花香,此类物质对白酒风味具有突出贡献[17]。酒醅的主要风味物质包括乳酸乙酯(741.76 μg/mL)、苯乙醇(438.14 μg/mL)、丁酸(207.52 μg/mL)和乙酸乙酯(138.82 μg/mL)等。窖泥的主要风味物质有正戊酸(1 674.19 μg/mL)、丁酸(1 336.23 μg/mL)、乳酸乙酯(538.17 μg/mL)、正丁醇(256.81 μg/mL)、苯乙醇(158.37 μg/mL)和己酸乙酯(128.63 μg/mL)等。原酒的酯类和醇类占主导地位,主要包括四大酯类物质“己酸乙酯(1 206.13 μg/mL)、丁酸乙酯(764.89 μg/mL)、乙酸乙酯(603.82 μg/mL)、乳酸乙酯(482.40 μg/mL)”以及正丁醇(387.01 μg/mL)和异戊醇(263.66 μg/mL)等。
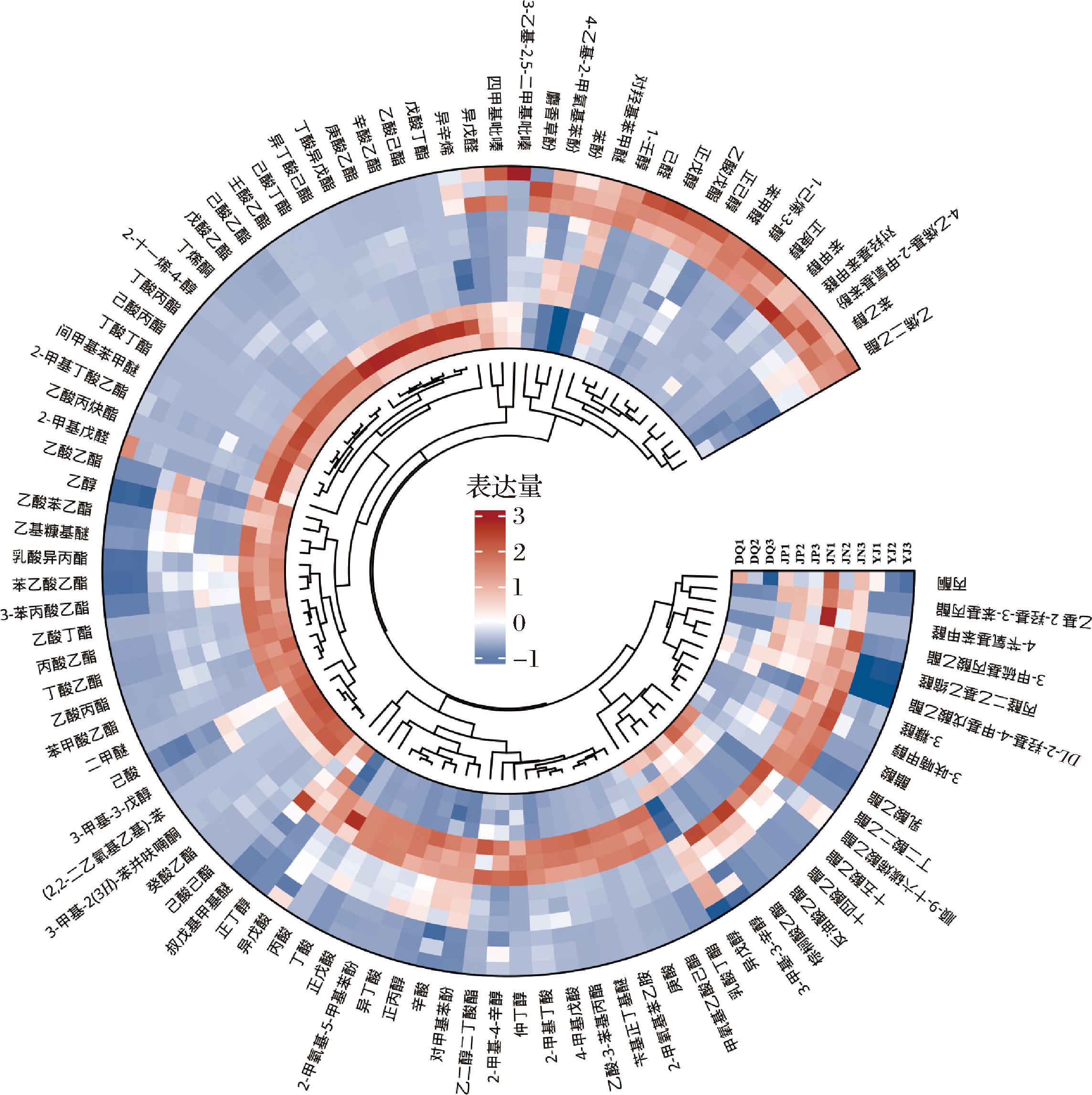
图3 长武地区凤香型白酒大曲、酒醅、窖泥和原酒挥发性风味化合物聚类分析热图
Fig.3 Clustering heatmap of volatile flavour compounds in Daqu, fermented grains, pit mud, and base Baijiu of Fengxiang Baijiu in Changwu area
乳酸乙酯在酒醅、窖泥和原酒中含量均较高,但在原酒中的含量低于酒醅,原因可能为乳酸乙酯是一种水溶性酯类化合物,且具有较高的沸点,在蒸馏的前期,由于酒精度较高、温度较低,乳酸乙酯难以从酒醅中有效挥发出来,因此其含量较少。而乳酸乙酯的释放通常发生在蒸馏的后期,此时其浓度较高。因此,通过对不同蒸馏阶段的酒液进行分类贮存,可以有效调控白酒中乳酸乙酯的含量[18]。酒醅中的乳酸乙酯含量最高,窖泥中乳酸乙酯含量低于酒醅,这可能与厌氧发酵过程中乳酸的积累有关,从而导致酒醅中乳酸乙酯含量的增加[19]。然而,乳酸乙酯含量过高会导致酒质酸涩感较重。目前,我国白酒都普遍存在乳酸乙酯含量过高的问题,因此生产时可通过在白酒发酵体系中添加延胡索酸或者通过提高大曲质量,使用陈化大曲、强化窖泥和优化工艺等操作来降低乳酸乙酯的含量,从而提高白酒的品质[20]。
研究发现,酒醅中的乙酸乙酯、己酸乙酯、丁酸乙酯在蒸馏过程中进入到原酒中,并且在原酒中的含量显著提升,这验证了“生香靠发酵,提香靠蒸馏”的说法[21]。此外,检测结果显示,酒醅和原酒中乙酸乙酯、乳酸乙酯、己酸乙酯和丁酸乙酯的含量均高于大曲中的含量。这些酯类化合物很可能是微生物代谢的产物,或者是在酒醅中酸与醇发生酯化反应后生成的[21]。苯乙醇、丁酸和醋酸等挥发性风味物质在酒醅中含量很高,但在原酒中含量却很小,原因可能与原酒取样在蒸馏前期有关[22]。部分风味物质在酒醅中并未被检测到,但却在原酒中出现,这表明在蒸馏的高温条件下,物质间可能发生了化学反应,生成了新的化合物,使原酒的特点不同于酒醅[23]。
对大曲、酒醅、窖泥和原酒样本的挥发性风味物质进行PLS-DA分析,结果见图4,12个样品各自聚为四类,表明样本之间的代谢物组成具有显著差异。该模型的R2X、R2Y和Q2分别为0.721、0.993、0.95,其中R2和Q2均大于0.5,说明该模型构建成功。

图4 长武地区凤香型白酒大曲、酒醅、窖泥和原酒挥发性风味物质PLS-DA分析
Fig.4 PLS-DA analysis of volatile flavour compounds in Daqu, fermented grains, pit mud, and base liquor of Fengxiang Baijiu in Changwu area
采用SIMCA14.1软件中的置换检验来验证模型的可靠性,如图5可知,经200次交叉验证后,左侧的R2和Q2值低于右侧R2和Q2值,且模型Q2仍与横坐标交叉,截距为负值,表明该模型没有过拟合,且有较好的预测能力,该模型稳定可靠[24]。
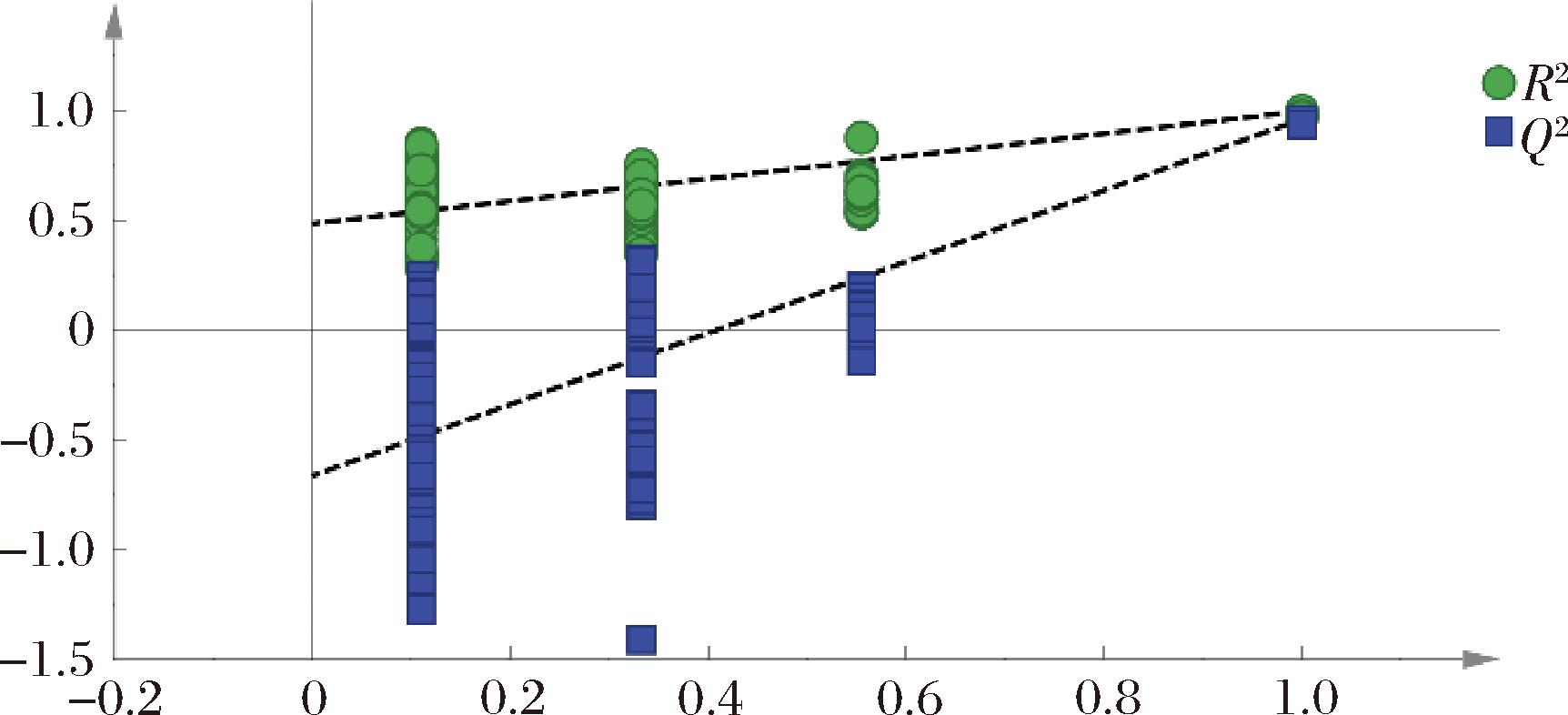
图5 长武地区凤香型白酒大曲、酒醅、窖泥和原酒挥发性组分置换验证图
Fig.5 Permutation test of volatile flavour compounds in Daqu, fermented grains, pit mud, and base liquor of Fengxiang Baijiu in Changwu area
变量重要性投影(variable importance in the projection,VIP)表征了风味物质在样品中的重要程度,通常将VIP>1和P<0.05作为筛选关键差异代谢物的标准,利用SIMCA 14.1软件筛选大曲、酒醅、窖泥和原酒样品中关键差异代谢物,共筛选出15种差异代谢物,分别为乳酸乙酯、正戊酸、苯乙醇、丁酸、正己醇、己酸乙酯、苯甲醛、棕榈酸乙酯、丁二酸二乙酯、乙酸乙酯、3-糠醛、庚酸、正庚醇、正戊醇和乙酸丁酯,说明这部分物质在凤香型白酒的酿造过程中对其风味影响较大,可以被认为是其关键标志物质。
2.3 长武地区凤香型白酒酿造环境微生物群落结构分析
对长武地区大曲、酒醅和窖泥样品的微生物菌群进行测序分析,通过对细菌16S rRNA基因V3~V4区、真菌ITS1区域进行扩增子测序,分别获得993 697条和104 279 5条原始序列,经去引物,质量过滤,去噪,拼接和去嵌合体等步骤得到优化序列702 749(细菌)条和937 132(真菌)条,细菌序列长度为239~438 bp,真菌序列长度为228~423 bp,平均长度约为410.88 bp(细菌)和260.33 bp(真菌)。
2.3.1 长武地区凤香型白酒酿造环境微生物群落组成
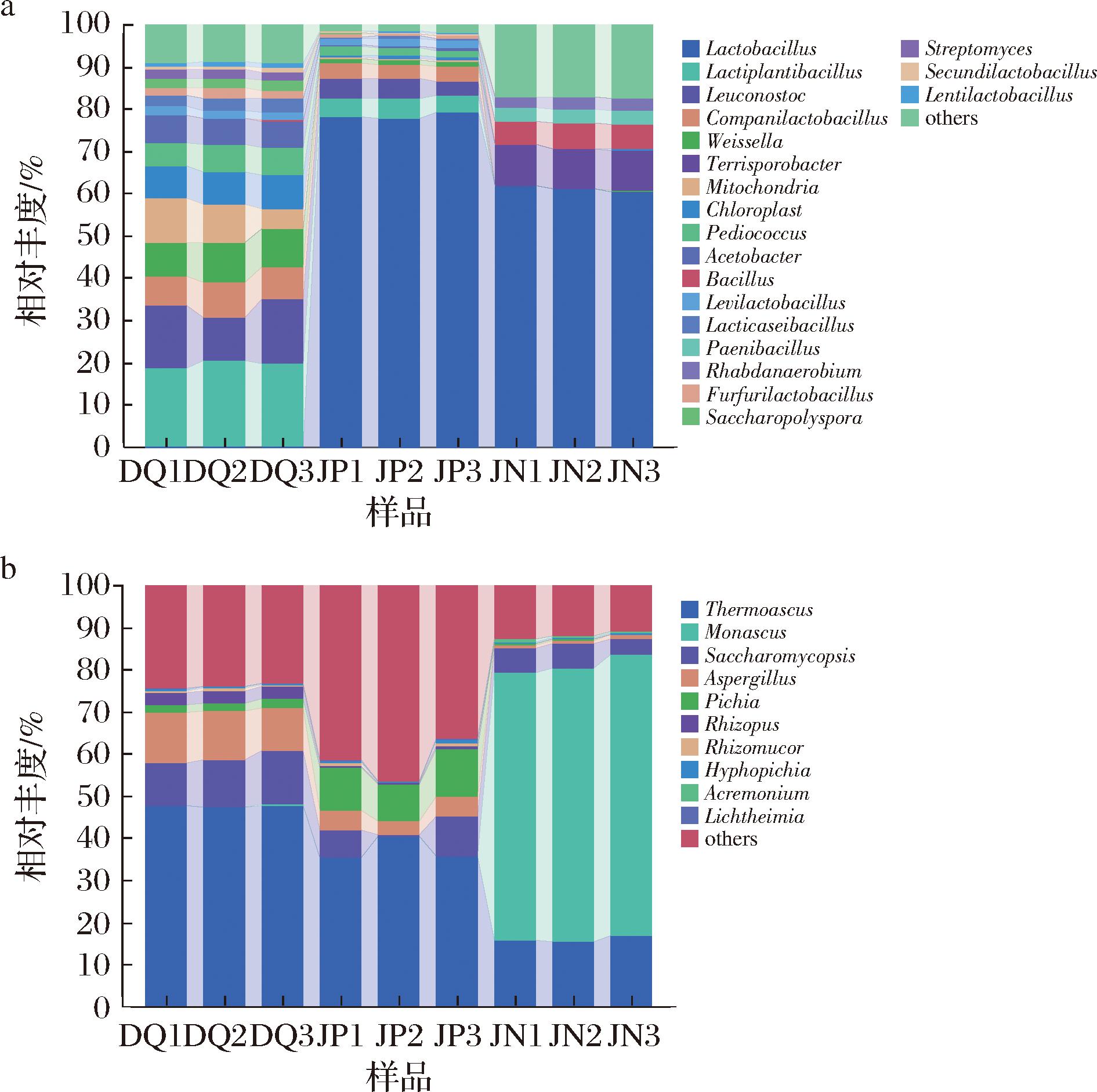
基于属分类水平发现,由图6-a可知,大曲、酒醅和窖泥中共检测出18个优势细菌属(平均相对丰度>1%),大曲中相对丰度占比比较大的有植物乳植杆菌属(Lactiplantibacillus,19.7%)、明串珠菌属(Leuconostoc,13.39%)、魏斯氏菌属(Weissella, 8.86%)和伴生乳杆菌属(Companilactobacillus,7.59%)等优势细菌属;酒醅和窖泥中占据第一位的优势细菌属为乳杆菌属(Lactobacillus),占比分别为78.48%、61.18%。其中乳杆菌属的大量生长繁殖会导致发酵酒醅中乳酸含量的增加,造成酸度升高,pH降低[25]。
a-细菌;b-真菌
图6 长武地区凤香型白酒大曲、酒醅和窖泥基于属水平的微生物群落结构
Fig.6 Microbial community structure of Daqu, fermented grains, and pit mud of Fengxiang Baijiu in Changwu area based on genus level
由图6-b可知,检测出8个优势真菌属(平均相对丰度>1%),分别是嗜热子囊菌属(Thermoascus)、复膜孢酵母属(Saccharomycopsis)、曲霉属(Aspergillus)、红曲霉属(Monascus)、毕赤酵母属(Pichia)、根霉属(Rhizopus)、根毛霉属(Rhizomucor)和丝孢毕赤酵母属(Hyphopichia),其中嗜热子囊菌属(Thermoascus)为大曲中的第一优势菌属,相对丰度达47.63%,其次是曲霉属(Aspergillus,11.17%)和复膜孢酵母属(Saccharomycopsis,11.58%);酒醅中的第一优势菌属为嗜热子囊菌属(Thermoascus, 37.28%),其次是毕赤酵母属(Pichia,10.04%)、复膜孢酵母属(Saccharomycopsis,5.47%)和曲霉属(Aspergillus,4.16%);窖泥中的第一优势菌属为红曲霉属(Monascus, 65.09%),其次是嗜热子囊菌属(Thermoascus,16.05%)和复膜孢酵母属(Saccharomycopsis,5.15%)。
基于实验结果可知,在所有样品中均检测出Thermoascus和Saccharomycopsis,其中Thermoascus能够将淀粉降解为葡萄糖[26],提高淀粉的利用率,从而有效提高出酒品质; Saccharomycopsis不仅能够产生淀粉酶来降解淀粉,还可以将可发酵的糖转化为酒精,同时它也有一定的能力生成香味成分[27]。曹丹等[6]研究了3种凤香型大曲的中心区域,发现这3种大曲的第一优势菌属均为Aspergillus,而本研究中Thermoascus占比最高。此外,该检测中长武地区的窖泥里Monascus的含量最高,而陕西宝鸡地区的凤香型白酒窖泥的Pichia的含量最高[28]。这一研究结果表明,即便是同种香型的白酒,由于地域差异,其原料中的微生物组成也会有所差异。
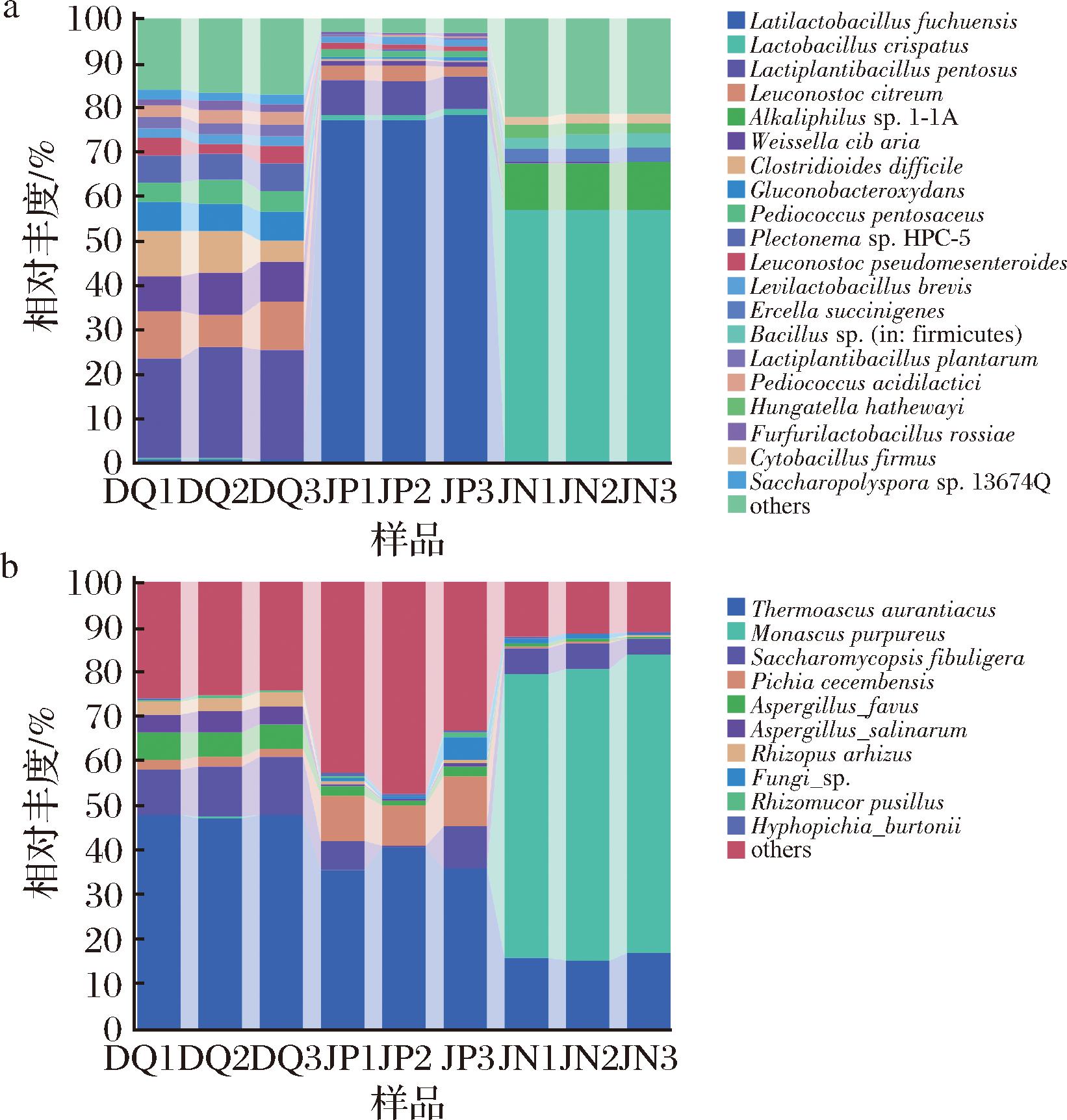
在种水平上,由图7-a可知,3个样品中优势细菌的种类、分布差异显著。戊糖乳杆菌(Lactiplantibacillus pentosus)和柠檬明串珠菌(Leuconostoc citreum)在大曲和酒醅中均有检测到,而窖泥中则未检出。Lactiplantibacillus pentosus在大曲和酒醅中的相对丰度分别为24.14%和7.68%,Leuconostoc citreum的相对丰度分别为9.58%和2.88%。此外,卷曲乳杆菌(Lactobacillus crispatus)在窖泥中的相对丰度最高,为56.6%,其对乳酸的生成有重要贡献[29]。琥珀色艾氏菌(Ercella succinigenes)仅在窖泥中检测到,表明其可能在窖泥的厌氧环境中发挥重要作用[30],参与有机物的分解和代谢产物的生成。
a-细菌;b-真菌
图7 长武地区凤香型白酒大曲、酒醅和窖泥基于种水平的微生物群落结构
Fig.7 Microbial community structure of Daqu, fermented grains, and pit mud of Fengxiang Baijiu in Changwu area based on species level
由图7-b可知,橙色嗜热子囊菌(Thermoascus aurantiacus)在大曲和酒醅中均为第一优势菌种,相对丰度分别为47.59%和37.27%。窖泥中的第一优势菌种为紫色红曲霉(Monascus purpureus),相对丰度为65.09%,且仅在窖泥中能够检测到。研究发现,Monascus purpureus能够产生酯化酶,在白酒发酵的过程中,这些酯化酶可以催化酯化反应,使之生成乙酸乙酯、己酸乙酯等风味物质,从而影响白酒风味的生成[31]。此外,由于窖泥中厌氧、高乙醇的极端条件,导致窖泥的真菌种类较少,而Monascus purpureus作为关键的酯化型微生物,在其中发挥了重要作用[32]。酵母类的微生物,如扣囊复膜孢酵母(Saccharomycopsis fibuligera)在大曲中相对丰度最高,为11.58%,在酒醅和窖泥中的相对丰度分别为5.47%和5.15%。Saccharomycopsis fibuligera通过产生水解酶,能够有效分解大曲、酒醅和窖泥中的大分子物质,为白酒发酵过程中的其他微生物提供营养[33]。
通过对微生物种属差异的比较分析,可以发现大曲和窖泥通过提供特定的细菌和真菌,对酒醅微生物的多样性和功能起到了重要的贡献。大曲和酒醅样品在细菌及真菌种属类型上表现出较高的相似性,与前人研究一致,大曲作为白酒生产中的糖化发酵剂,它不仅为酒醅提供了丰富的微生物资源,还确保了发酵过程中微生物群落的一致性和稳定性[5]。因此,大曲对酒醅的发酵以及后续白酒风味的形成具有一定的协同作用。相比之下,由于窖泥的环境较为恶劣,导致微生物种类相对较少,但检测出的微生物如Monascus purpureus和Saccharomycopsis fibuligera则分别能够参与风味物质的生成和有机物的分解,在白酒发酵过程中起着重要的贡献[32-33]。
2.3.2 长武地区凤香型白酒酿造环境微生物菌群的Alpha多样性分析
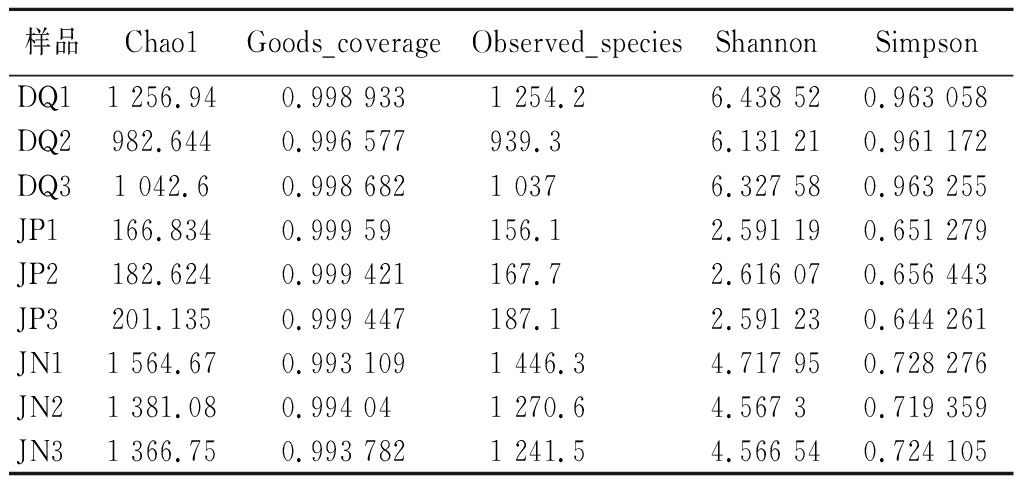
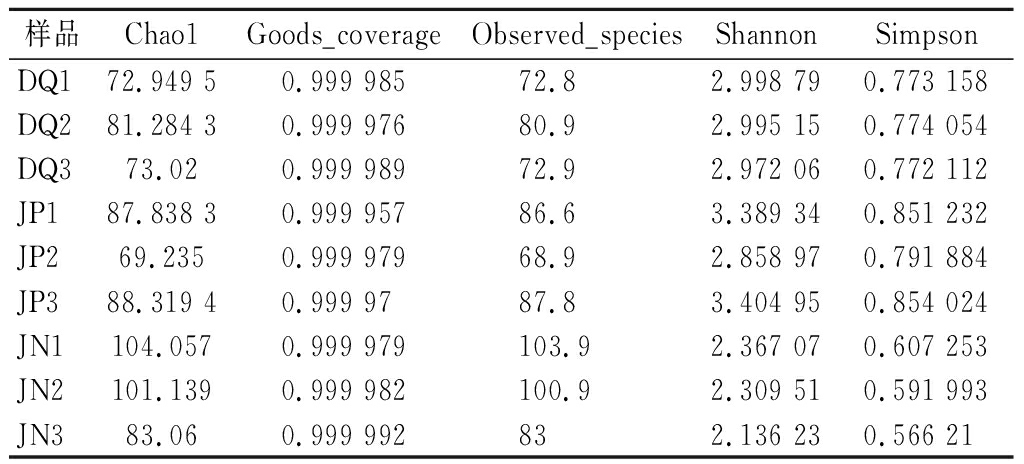
长武地区凤香型白酒酿造环境微生物菌群的Alpha 多样性分析如表1所示,所有样品的Goods coverage指数都在0.996以上且接近于1,说明测序的量可以囊括所有样品的信息。Chao1指数和Observed species指数是用于衡量物种丰富度的指数,Chao1指数和Observed species指数越高就说明物种的丰富度越高。表1和表2的Chao1指数和Observed species指数表明大曲、酒醅和窖泥细菌群落的丰富度高于真菌;Shannon指数和Simpson指数都是用来衡量物种多样性的指数,表1和表2的Shannon指数和Simpson指数表明大曲和窖泥细菌群落的多样性高于真菌,而酒醅真菌群落的多样性高于细菌。
表1 大曲、酒醅和窖泥细菌Alpha多样性指数
Table 1 Alpha diversity index of bacteria in Daqu, fermented grains, and pit mud
样品Chao1Goods_coverageObserved_speciesShannonSimpsonDQ11 256.940.998 9331 254.26.438 520.963 058DQ2982.6440.996 577939.36.131 210.961 172DQ31 042.60.998 6821 0376.327 580.963 255JP1166.8340.999 59156.12.591 190.651 279JP2182.6240.999 421167.72.616 070.656 443JP3201.1350.999 447187.12.591 230.644 261JN11 564.670.993 1091 446.34.717 950.728 276JN21 381.080.994 041 270.64.567 30.719 359JN31 366.750.993 7821 241.54.566 540.724 105
表2 大曲、酒醅和窖泥真菌Alpha多样性指数
Table 2 Alpha diversity index of fungi in Daqu, fermented grains, and pit mud
样品Chao1Goods_coverageObserved_speciesShannonSimpsonDQ172.949 50.999 98572.82.998 790.773 158DQ281.284 30.999 97680.92.995 150.774 054DQ373.020.999 98972.92.972 060.772 112JP187.838 30.999 95786.63.389 340.851 232JP269.2350.999 97968.92.858 970.791 884JP388.319 40.999 9787.83.404 950.854 024JN1104.0570.999 979103.92.367 070.607 253JN2101.1390.999 982100.92.309 510.591 993JN383.060.999 992832.136 230.566 21
2.4 长武地区凤香型白酒酿造微生物群落与挥发性化合物及理化参数的相关性分析
利用Spearman相关系数分析大曲、酒醅和窖泥中优势菌属与风味物质之间的相互作用。由图8可知, Lactobacillus与乙酸乙酯(r=0.93)、丁二酸二乙酯(r=0.90)、乳酸乙酯(r=0.85)呈显著正相关;苯乙醇与Companilactobacillus(r=0.97)、Lactobacillus(r=0.93)、Weissella(r=0.93)、Lactiplantibacillus(r=0.92)等大多数细菌属呈现正相关,可知其由大多数微生物共同作用; Rhabdanaerobium与丁酸(r=0.80)、正戊酸(r=0.80)、乙酸丁酯(r=0.86)和己酸乙酯(r=0.84)呈显著正相关。Monascus与乙酸丁酯(r=0.87)、丁酸(r=0.83)、庚酸(r=0.90)、己酸乙酯(r=0.87)和正戊酸(r=0.87)呈显著正相关,与苯乙醇(r=0.87)呈负相关; Pichia与3-糠醛(r=0.87)和棕榈酸乙酯(r=0.97)呈显著正相关;Rhizomucor与棕榈酸乙酯(r=0.77)和苯乙醇(r=0.92)呈显著正相关,与其他多数酸和醇类物质呈现负相关;Saccharomycopsis(r=0.83)和Thermoascus(r=0.86)与苯乙醇呈显著正相关。已有研究发现,苯乙醇能够提高Thermoascus和Aspergillus的相对丰度,并使他们成为优势菌属,与本实验结果相似[34]。

a-细菌属;b-真菌属(实线为正相关,虚线为负相关)
图8 大曲、酒醅和窖泥的优势菌属与挥发性风味物质的相关性分析
Fig.8 Correlation analysis between dominant genera and volatile flavor compounds in Daqu, fermented grains, and pit mud
在酿造过程中,理化因子是影响微生物群落多样性的重要因素[12],利用Spearman相关系数分析大曲、酒醅和窖泥中的优势菌属与理化指标之间的相互作用。由图9可知, Hyphopichia、Lactobacillus与水分、酸度呈极显著正相关, Pichia与水分呈极显著正相关,与酸度呈正相关。Lactobacillus与淀粉、还原糖呈极显著负相关,其余大部分菌群都与淀粉、还原糖呈正相关。Lactobacillus与酸度呈正相关,原因可能为Lactobacillus的大量生长繁殖会导致发酵酒醅中乳酸含量的增加,造成酸度升高。可见,大曲、酒醅和窖泥中的优势菌群对其理化性质有着显著的影响。通过研究分析,将微生物群落与理化指标相关联,这对于揭示酿酒过程中的微生物与理化因素相互作用机理、提升凤香型白酒的品质以及提高发酵效率具有重要意义。
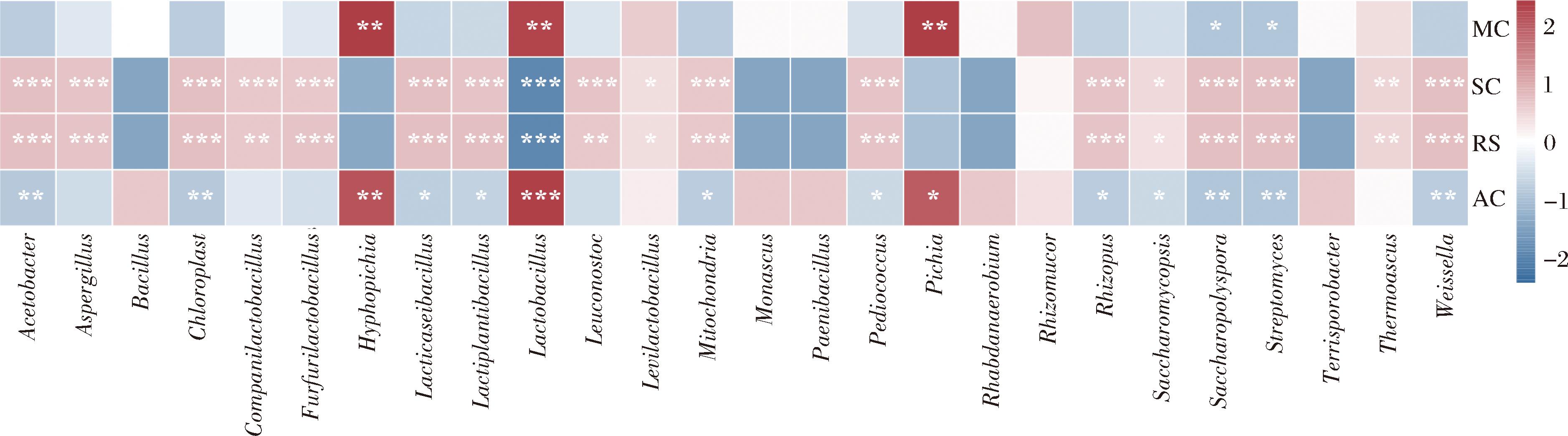
图9 大曲、酒醅和窖泥的优势菌属与理化指标的相关性分析
Fig.9 Correlation analysis between dominant genera and physicochemical indexes in Daqu, fermented grains, and pit mud
注:MC-水分含量;SC-淀粉含量;RS-还原糖含量;AC-可滴定酸度;r<0为负相关,r>0为正相关;*表示P<0.05,**表示P<0.01,***表示P<0.001。
3 结论
本研究采用HTS技术和HS-SPME-GC-MS技术研究该地区酒厂来源大曲、酒醅和窖泥微生物群落结构以及挥发性风味物质,同时还对其理化性质进行检测,并通过关联性分析探究微生物与风味和理化之间的相关性。结果表明:大曲、酒醅、窖泥和原酒中共检测出99种主要挥发性风味物质,包括酯类43种、醇类17种、醛酮类11种、酸类11种、酚类6种和其他类11种。酿造环境中相对丰度占比比较大的优势细菌属有Lactiplantibacillus和Leuconostoc,优势真菌属有Thermoascus、Aspergillus和Saccharomycopsi。通过对微生物种属差异的比较分析发现,大曲和窖泥通过提供特定的细菌和真菌,对酒醅微生物的多样性和功能起到了重要的贡献。其中,大曲作为糖化发酵剂,为酒醅提供了丰富的微生物资源;而窖泥中的第一优势菌种,如Monascus purpureus作为关键的酯化型微生物,在白酒发酵过程中发挥重要的作用。相关性结果表明, Lactobacillus与大多数酯类、水分、酸度呈正相关, Pichia与3-糠醛、棕榈酸乙酯、水分和酸度呈正相关, Rhabdanaerobium、Monascus对长武地区凤香型白酒的酯类和酸类物质有重要贡献。研究结果对于优化长武地区凤香型白酒的酿造工艺具有重要的理论意义和实践价值。该研究阐明了通过调节理化因素及微生物群落来控制白酒风味和品质的可能性,这为优化白酒的酿造工艺提供了参考依据。
[1] ZHENG X W, HAN B Z.Baijiu (白酒), Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[2] 任金玫,陈君平,李志健,等.十二种香型白酒相关研究概况[J].中国酿造,2022,41(4):13-19.REN J M,CHEN J P,LI Z J, et al.Research overview of twelve flavor types Baijiu[J].China Brewing, 2022,41(4):13-19.
[3] 白莉圆,陈雪,张艳,等.西凤酒酒醅发酵过程中挥发性风味物质分析[J].酿酒科技,2021(10):29-35.BAI L Y,CHEN X,ZHANG Y, et al.Analysis of volatile flavor compounds in fermented grains of Xifeng liquor[J].Liquor-Making Science &Technology, 2021(10):29-35.
[4] 谭映月,胡萍,谢和.我国白酒酿造微生物多样性的研究现状及展望[J].酿酒科技,2011(11):100-105.TAN Y Y,HU P, XIE H.Present research status and prospects of the diversity of liquor-making microbes in China[J].Liquor-Making Science &Technology, 2011(11):100-105.
[5] 谭光迅.基于活菌数据的浓香型白酒酿造微生物组成、来源和变化规律研究[D].武汉:华中农业大学,2020.TAN G X.Research on composition, source and dynamic change regularity of microorganisms related to Chinese strong flavor liquor brewing based on viable microorganisms data [D].Wuhan:Huazhong Agricultural University,2020.
[6] 曹丹,吕嘉枥,楚京嬴,等.3种凤香型大曲中心区域特性的多维度表征及其差异性和相关性分析[J].食品科学,2024,45(20):20123-20135.CAO D,LYU J L,CHU J Y, et al.Central regions of three types of Fengxiangxing Daqu: Multidimensional characterization and difference and correlation Analysis[J].Food Science,2024,45(20):20123-20135.
[7] 姜政飞.赤水河产区酱香型白酒酿造微生物来源及环境微生物分布[D].无锡:江南大学,2023.JIANG Z F.Microbial sources and environmental microbial distribution of the sauce-flavor Baijiu in the Chishui River producing region[D].Wuxi:Jiangnan University,2023.
[8] TAO Y, WANG X, LI X Z, et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J].Microbial Biotechnology, 2017, 10(6):1603-1615.
[9] PAN F S, QIU S Y, LYU Y Y, et al.Exploring the controllability of the Baijiu fermentation process with microbiota orientation[J].Food Research International, 2023,173:113249.
[10] LI Y P, QIAO H J, ZHANG R, et al.Microbial diversity and volatile flavor compounds in Tibetan flavor Daqu[J].Foods, 2023, 12(2):324.
[11] 张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.ZHANG Q M,ZHAO X R,LI J H, et al.The relationship between microbial community and flavors of three types of Daqu[J].Food and Fermentation Industries, 2022,48(10):1-8.
[12] GUAN T W, LIN Y J, CHEN K B, et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese strong-flavor Baijiu[J].Frontiers in Microbiology, 2020, 11:2090.
[13] 唐佳代,赵益梅,冉光耀,等.基于第三代测序与理化指标评价不同压曲工艺酱香大曲品质[J].中国酿造,2022,41(12):74-78.TANG J D,ZHAO Y M,RAN G Y, et al.Evaluation of the quality of sauce-flavor Daqu with different molding processes based on third-generation sequencing and physicochemical indexes [J].China Brewing, 2022,41(12):74-78.
[14] 熊翔,余有贵,王文达,等.曲坯含水量对机压包包曲品质的动态影响[J].中国酿造,2010,29(6):141-143.XIONG X,YU Y G,WANG W D,et al.Dynamic influence of water content of starter on quality of wrapped starter suppressed by machinery[J].China Brewing,2010,29(6):141-143.
[15] 王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015(6):6-10.WANG Q, GUO D Y, WANG X L, et al.Comparative analysis of physiochemical properties of Baijiu (liquor) starter of different flavor types[J].Liquor-Making Science &Technology, 2015(6):6-10.
[16] 付欢.凤香型西凤白酒风味物质及其对肝损伤和肠道菌群的影响研究 [D].西安:陕西科技大学,2022.FU H.Study on the Flavor Compounds of Feng-Flavor Baijiu and Their Effects on Liver Injury and Intestinal Flora [D].Xian:Shaanxi University of Science and Technology, 2022.
[17] 程伟,陈雪峰,陈兴杰,等.HS-SPME-GC-MS结合感官评价分析金种子馥合香白酒的风味成分[J].食品与发酵工业,2022,48(3):250-256;265.CHENG W,CHEN X F,CHEN X J,et al.Analysis of flavor components in Jinzhongzi Fuhe-flavor Baijiu by HS-SPME-GC-MS combined with sensory evaluation[J].Food and Fermentation Industries, 2022,48(3):250-256;265.
[18] 杨荣,华进,周亚宾.白酒酿造过程中乳酸乙酯产生机理及“降乳”技术研究进展[J].食品工业科技,2024,45(20):398-406. YANG R,HUA J,ZHOU Y B.Progress in the research of the mechanism of ethyl lactate production and “Ethyl lactate reduction” techniques in the Baijiu brewing process[J].Science and Technology of Food Industry,2024,45(20):398-406.
[19] 贺雨杰,唐雨润,蒋小清,等.泸州产区浓香型白酒酿造微环境-风味相关性分析[J].中国酿造,2024,43(2):98-105.HE Y J,TANG Y R,JIANG X Q,et al.Correlation analysis between brewing microenvironment and flavor of strong-flavor Baijiu in Luzhou producing area[J].China Brewing,2024,43(2):98-105.
[20] ZHAO Q S, YANG J G, ZHANG K Z, et al.Lactic acid bacteria in the brewing of traditional Daqu liquor[J].Journal of the Institute of Brewing, 2020, 126(1):14-23.
[21] 肖辰.泸型酒中温大曲微生物群落的演替及其对酒醅发酵的贡献[D].无锡:江南大学,2018.XIAO C.Succession of mid-temperature Daqu microbiota and its contribution to the fermentation of Luzhou-flavor Baijiu[D].Wuxi:Jiangnan University,2018.
[22] 郎召伟.泸型酒酿造过程中风味物质变化分析[D].无锡:江南大学,2015.LANG Z W.Analysis of flavor compounds in the production of Luzhou-flavor liquor[D].Wuxi:Jiangnan University,2015.
[23] DING X F, WU C D, HUANG J, et al.Changes in volatile compounds of Chinese Luzhou-flavor liquor during the fermentation and distillation process[J].Journal of Food Science, 2015, 80(11):C2373-C2381.
[24] 欧阳红军,刘义军,袁源,等.HS-SPME-GC-MS结合OPLS-DA分析提取方法对牛油果油挥发性香气化合物的影响[J].南方农业学报,2021,52(3):779-788.OUYANG H J,LIU Y J,YUAN Y,et al.HS-SPME-GC-MS coupled with OPLS-DA to analyze the effects of extraction methods on volatile aroma compounds of avocado oil[J].Journal of Southern Agriculture,2021,52(3):779-788.
[25] 刘兰兰.酱香型白酒糟醅核心微生物菌群的解析及分离筛选研究[D].贵阳:贵州大学,2023.LIU L L.Study on the analysis and isolation of the core microflora in the fermented grains of Jiang -flavor Baijiu[J].Guiyang:Guizhou University, 2023.
[26] TANG Y J, ZHAO W, CUI M L, et al.Identification and functional prediction of the key fungus of Hongxinqu for Light-flavor Baijiu brewing[J].LWT-Food Science and Technology, 2024, 194:115605.
[27] YAN C Y, ZHANG Q, WANG J W, et al.Characteristics of four yeasts and the effects of yeast diversity on the fermentation of Baijiu[J].Food Bioscience, 2023, 56:103094.
[28] 高丽娜,张永利,郑欣欣,等.凤香型白酒窖泥理化特性及微生物多样性分析[J].中国酿造,2023,42(11):128-133.GAO L N,ZHANG Y L,ZHENG X X,et al.Analysis on physicochemical characteristics and microbial diversity of pit mud from Feng-flavor Baijiu[J].China Brewing, 2023,42(11):128-133.
[29] 彭珊珊.乳杆菌发酵驴奶性能及其两者复配对小鼠免疫力及肠道菌群影响的研究[D].南昌:南昌大学,2013.PEN S S.Studies of fermentation of donkey milk with Lactobacillus and co-effect of the complex on the immune system and intestinal flora in mice[D].Nanchang:Nanchang University,2013.
[30] VAN GELDER A H, SOUSA D Z, RIJPSTRA W I C, et al.Ercella Succinigenes gen.nov., sp.nov., an anaerobic succinate-producing bacterium[J].International Journal of Systematic and Evolutionary Microbiology, 2014,64(Pt 7):2449-2454.
[31] 胡娜,吴鑫颖,李付丽,等.紫色红曲霉FBKL3.0018产酯化酶的酶学性质研究[J].中国酿造,2017,36(5):123-127.HU N,WU X Y,LI F L,et al.Enzymatic properties of esterifying enzyme from Monascus purpureus FBKL3.0018[J].China Brewing, 2017,36(5):123-127.
[32] 王钎.白酒窖泥产香细菌新种的鉴定及分离菌株的碳源代谢研究[D].济南:山东大学,2016.WANG X.The specified identification of new species in the pit mud of Chinese liquors and the research on the metabolism of carbon sources[D].Jinan:Shandong University, 2016.
[33] ZHANG Y J, SUN Q, LIU X Y, et al.Screening, identification, and fermentation condition optimization of a high-yield 3-methylthiopropanol yeast and its aroma-producing characteristics[J].Foods, 2024, 13(3):418.
[34] CHEN X, WU Y X, ZHU H, et al.Turning over fermented grains elevating heap temperature and driving microbial community succession during the heap fermentation of sauce-flavor Baijiu[J].LWT,2022, 172:114173.