酱油是我国传统酿造技术的瑰宝,是日常生活中高频使用的调味品。口感表现是评价酱油质量高低的重要维度,而鲜味是酱油的重要口感属性。在呈鲜贡献中,除比较熟知的氨基酸、核苷酸外,还有一类分子质量在1 000 Da以下的小分子肽类也发挥了重要的作用。鲜味肽氨基酸骨架通常结构式为-O-(C)n-O-,n=3~9,当n=4~6 时表现出最强鲜味[1,2]。目前比较多的研究工作集中在对于鲜味肽的分离、鉴定方面,对于其和鲜味受体间的互作关系研究仍不够明确。
鲜味受体是一类能够识别并响应鲜味物质的蛋白质分子,目前研究表明其主要包括有异源二聚体味觉受体第一家族亚型1/3(taste receptor type 1/3,T1R1/T1R3)[3]、胞外钙敏感受体(calcium-sensing receptor,CaSR)[4]、味型代谢性谷氨酸受体4(metabotropic glutamate receptor 4,mGluR4)[5]和G蛋白偶联受体C家族6组A亚型(G protein-coupled receptor family C group 6 member a receptor,GPRC6A)[6]这四类。其中的T1R1与T1R3 是感受鲜味的主要受体,而mGluR4因蛋白质结构与前两者存在明显差异,被评估是鲜味感受的辅助受体[5,7-9],各研究人员也主要利用前2种受体开展其与小分子配体的具体对接情况研究:YAO等[10]针对从西瓜酱中分离的AKEKFD、LAELK和LTFVER这3种鲜味肽与T1R1、T1R3进行分子对接,发现氢键和范德华力在对接过程中起到了重要作用。而GU等[11]先对切达干酪进行肽组学分析,再综合采用生物信息学、感官鉴评等方式获得了5种鲜味肽。通过进一步将5种鲜味肽与T1R1、T1R3进行分子对接,发现鲜味肽与鲜味受体亲水氨基酸间形成的氢键对于稳定配套-受体复合物结构有着重要作用,并且获得了奶酪源鲜味肽与受体结合的关键位点。赵孟斌等[12]研究了鱼露来源的含有脯氨酸和谷氨酸的鲜味二肽与T1R1、T1R3、CaSR这3种受体的对接构效关系,发现了其对接成键中的疏水作用对于稳定配体-受体复合物构象也发挥着重要作用。
本研究以从酱油中鉴定得到的具有呈鲜特质的二肽或者三肽为研究对象,通过分子对接技术来进一步分析其与T1R1、T1R3这2种主要鲜味受体的结合模式,寻找酱油源鲜味肽与鲜味受体的关键结合位点,选取整体结合能低、结合构象稳定的T1R3受体-配体复合物结构,分析呈鲜的构效机理关系。
1 材料与方法
1.1 材料与数据库
谷氨酸钠:食品级,阜丰营销有限公司;蔗糖:食品级,广州嘉利高糖业有限公司;柠檬酸:食品级,广州利成实业有限公司;氯化钠:食品级,湖南省湘衡盐化有限责任公司。奎宁:色谱纯,上海泰坦科技股份有限公司。
根据前期实验分离鉴定得到的10个酱油鲜味小肽序列:亮氨酸-组氨酸(leucine-histidine,Leu-His)、异亮氨酸-组氨酸(isoleucine-histidine,Ile-His)、亮氨酸-精氨酸(leucine-arginine,Leu-Arg)、异亮氨酸-精氨酸(isoleucine-arginine,Ile-Arg)、亮氨酸-赖氨酸(leucine-lysine,Leu-Lys)、异亮氨酸-赖氨酸(isoleucine-lysine,Ile-Lys)、谷氨酸-亮氨酸(glutamic acid-leucine,Glu-Leu)、谷氨酸-谷氨酸(glutamic acid-glutamic acid,Glu-Glu)、谷氨酸-甘氨酸-甘氨酸(glutamic acid-glycine-glycine,Glu-Gly-Gly)、谷氨酸-甘氨酸-脯氨酸(glutamic acid-glycine-proline,Glu-Gly-Pro),委托吉尔生化(上海)有限公司采用化学固相合成法合成并进行脱盐处理,使纯度≥98%。
鲜味受体蛋白均来自 Uniprot 蛋白数据库:T1R1、T1R3 的检索号分别对应为 Q7RTX1、Q7RTX0。模板蛋白来自 PDB 数据库。序列对比、同源建模及模型评估涉及的平台:SWISS-MODEL、NCBI、SAVES v6.0。
1.2 实验方法
1.2.1 合成肽的鲜味阈值评估测定
感官评价小组由 10 名味觉正常人员组成(6男4女,年龄为25~35岁),并依据 GB/T 16291.1—2012《感官分析 选拔、培训与管理评价员一般导则 第1部分:优选评价员》进行感官培训以辨别5种基本味觉(酸、甜、苦、咸、鲜)。参考丛艳君等[13]分别以柠檬酸(0.8 mg/mL)、蔗糖(10 mg/mL)、奎宁(0.8 mg/mL)、氯化钠(3.5 mg/mL)和谷氨酸钠(3.5 mg/mL)作为酸、甜、苦、咸、鲜的评价标准。
各合成肽的鲜味阈值采用滋味稀释分析法测定:具体参考王春叶等[14]的方法并稍作修改。各合成肽样品使用去离子水进行溶解,配置成初始质量浓度为1 mg/mL的溶液。而后再将该溶液使用去离子水按照1∶1(体积比)进行逐级稀释。在感官鉴评室[对应温度控制为(26±2) ℃]组织鉴评:评价小组反馈无法品尝出溶液中的鲜味,则该合成肽的呈鲜阈值即为倒数第2个合成肽溶液的质量体积浓度值。采用各感官评价成员评定结果的平均值,并且每个评定员之间的误差不超过2个稀释度水平。
1.2.2 鲜味受体同源建模及评估
鲜味受体的同源建模方法参考余霞琴[15]的方法,略有调整,具体如下:登录Uniprot 蛋白数据库,下载T1R1、T1R3鲜味受体蛋白的序列。再利用Swissmodel在线同源建模工具,输入上述鲜味受体蛋白分子的氨基酸序列,根据模板与鲜味受体序列的一致性选取建模模板,最后点击“build model”输出获得对应的同源建模结构。利用拉氏图对建模结构进行评估:将完成构建的模型以pdb文档格式上传至SAVES v6.0上的PROCHECK功能版块进行建模质量评价。
1.2.3 各鲜味肽配体准备
使用绘制软件ChemDraw进行各鲜味肽的绘制:打开ChemDraw软件,创建一个新的文件。在工具栏中选择“Paste Special”中的“FASTA Peptide”功能,再在菜单栏中选取“Structure”命令栏中的“Expand Label”功能,展开获得具体多肽结构图,最后选择导出为“.mol”格式文件。获得配体的初步结构文件后,使用Discovery Studio 4.0对各个鲜味肽配体结构进行再调整:先使用 “Simulation”模块的“Change Forcefiled”功能为各鲜味肽初始结构添加“Charmm36”型号分子力场,再利用“Minimization”功能对各肽段结构进行能量优化。最大能量优化步骤设置为10 000步,隐式溶剂介电常数值调整为80。
1.2.4 各鲜味肽配体与受体分子对接
分子对接时采用余霞琴[15]的方法,具体操作流程如下:第一步,先进行配体文件与受体文件的准备。将受体与配体的原pdb格式结构文件通过ADT工具转变为pdbqt格式,同时使用ADT工具检测导入的配体是否加了电荷,如果没有,则增加上Gasteiger电荷。第二步是进行格点参数文件准备及 Autogrid4的运行。首先是导入受体文件,在ADT的格点模块(Grid)中的格点盒子(Grid Box)工具栏中设置格子的大小及中心位置,设置完成后保存“.gpf”参数文件,然后在命令框中输入对应的命令运行程序AutoGrid4。需要特别说明的是在本研究中选取的格点盒子均为覆盖受体蛋白的全结构域,以全面分析对接位点分布情况。第三步是完成对接参数文件准备及运行AutoDock4 软件。具体对应为导入受体文件与配体的pdbqt 格式的文件,在ADT的对接模块(Docking)设置搜索参数:各组对接均统一选择为遗传算法,设置对接产生构象为100 个,另外选择拉马克遗传算法输出文件,然后保存“.dpf”格式的对接参数文件,最后启动运行程序AutoDock4,最终得到“.dlg”格式的对接记录文件。
1.3 数据处理
采用 Excel 2016对鲜味阈值数据进行统计分析,数据用“平均值±标准差”表示,实验重复3次。分子对接所用软件为AutoDock4.0。二肽与鲜味受体结合的 2D 模式图利用分析软件Discovery Studio 4.0得出。
2 结果与分析
2.1 合成肽的感官评价与鲜味阈值评估
对委外合成的10条小肽进行感官评价,结果如表1所示。各小肽的呈鲜阈值存在较大的区别:其中三肽Glu-Gly-Gly的呈鲜阈值最低,为0.06 mg/mL,明显低于味精呈鲜阈值(0.3 mg/mL)。其次为二肽Glu-Glu、Glu-Leu、Ile-His以及Ile-Arg:具体呈鲜阈值为0.08~0.14 mg/mL。另外,三肽Glu-Gly-Pro的呈鲜阈值则处于偏高水平,达到了0.4 mg/mL,高于味精的呈鲜阈值。而Leu-His、Leu-Arg、Leu-Lys则呈现稍低于味精的呈鲜阈值的情况,Ile-Lys的呈鲜阈值则与味精一致。同时,从鉴评人员的滋味描述来看,所有的小肽均未表现出苦味,而呈鲜效果较好的小肽也呈现出酸味、甜味的情况,与ZHANG等[16]的研究情况一致:鲜味肽具有多种呈味效果,其他味感对于其呈鲜也有辅助支持作用。
表1 合成肽的感官评价与鲜味阈值
Table 1 Sensory evaluation of synthetic peptides and umami threshold
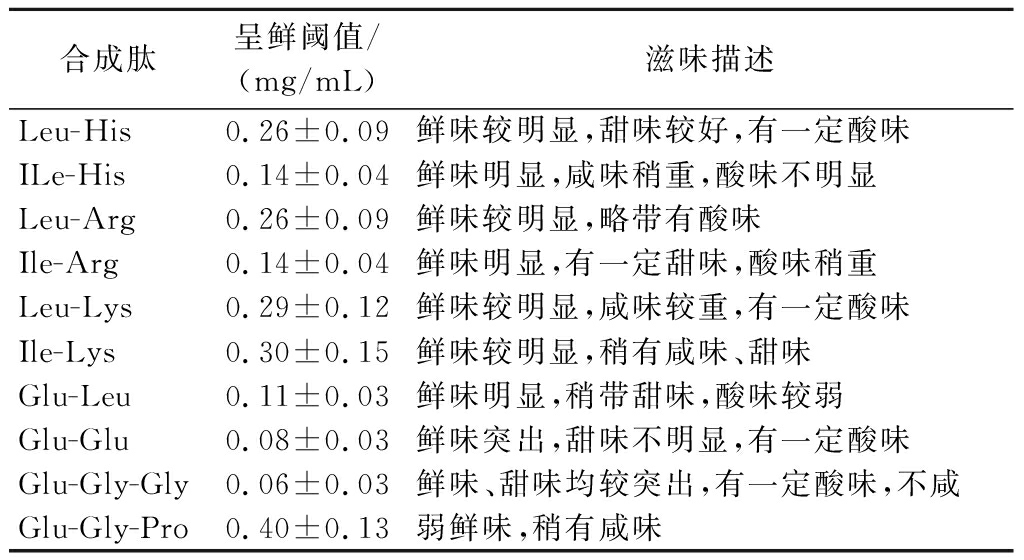
合成肽呈鲜阈值/(mg/mL)滋味描述Leu-His0.26±0.09鲜味较明显,甜味较好,有一定酸味ILe-His0.14±0.04鲜味明显,咸味稍重,酸味不明显Leu-Arg0.26±0.09鲜味较明显,略带有酸味Ile-Arg0.14±0.04鲜味明显,有一定甜味,酸味稍重Leu-Lys0.29±0.12鲜味较明显,咸味较重,有一定酸味Ile-Lys0.30±0.15鲜味较明显,稍有咸味、甜味Glu-Leu0.11±0.03鲜味明显,稍带甜味,酸味较弱Glu-Glu0.08±0.03鲜味突出,甜味不明显,有一定酸味Glu-Gly-Gly0.06±0.03鲜味、甜味均较突出,有一定酸味,不咸Glu-Gly-Pro0.40±0.13弱鲜味,稍有咸味
另外,发现当二肽的羧基端为碱性氨基酸His或者Arg时,若氨基端结合的为Ile(异亮氨酸),则其呈鲜效果较氨基端结合是Leu(亮氨酸)的二肽更强。但是如果羧基端替换为Lys,则氨基氮结合为Ile或者Leu则对于二肽的呈鲜效果影响不大。而在含有Glu的三肽中,如果羧基末端的氨基酸由Gly(甘氨酸)被替换为Pro(脯氨酸)时,也会出现呈鲜阈值大幅上升的情况。因此不同氨基酸组成的二肽、三肽在呈鲜效果方面存在明显的区别,很有可能是肽与受体结合情况存在差异导致。
2.2 鲜味受体T1R1、T1R3的同源建模
T1R1、T1R3 受体同源模板结果如表2、表3所示,2种鲜味受体模板序列的覆盖率分别对应不低于76.19%、78.25%。同时,序列相似性则分别处于29%~32%。参考李伟[17]的研究工作:序列相似性在30%及以上组进行优选考虑。另外,在最终模板选取中,还有2项最为关键的评价指标:其中TM得分是表征蛋白质结构拓扑相似性的关键度量指标,该值越接近1,则表明与其选择的目标蛋白更为相似。均方根误差(root mean squared error,RMSD)用于量化各模板蛋白质与目标蛋白质结构之间的差异,该值越接近于0,则表示这两者间的差异越小。综合上述考虑,最终对应选取7 m3j、7 dd5作为上述2种鲜味受体的建模模板。
表2 T1R1同源模板序列比对结果
Table 2 Sequence alignment results of T1R1 homologous template
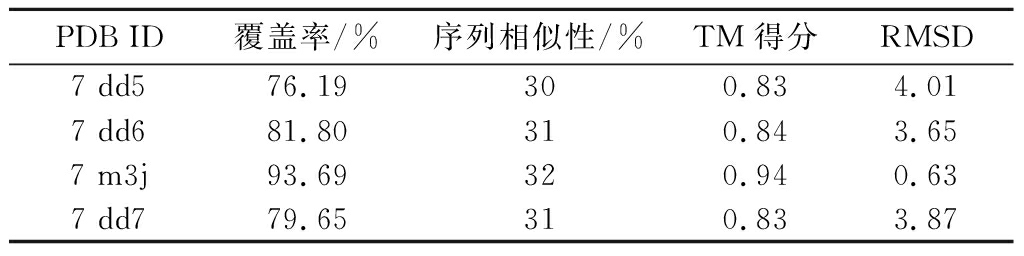
PDB ID覆盖率/%序列相似性/%TM得分RMSD7 dd576.19 300.834.017 dd681.80 310.843.657 m3j93.69 320.940.637 dd779.65 310.833.87
表3 T1R3同源模板序列比对结果
Table 3 Sequence alignment results of T1R3 homologous template
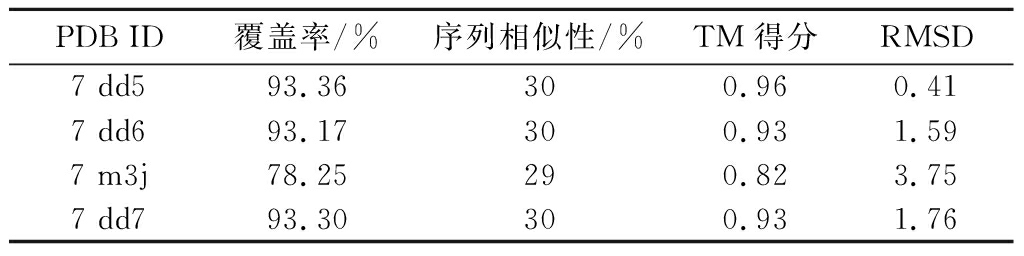
PDB ID覆盖率/%序列相似性/%TM得分RMSD7 dd593.36 300.960.417 dd693.17 300.931.597 m3j78.25 290.823.757 dd793.30 300.931.76
2.3 鲜味受体T1R1、T1R3的同源建模模型质量评估
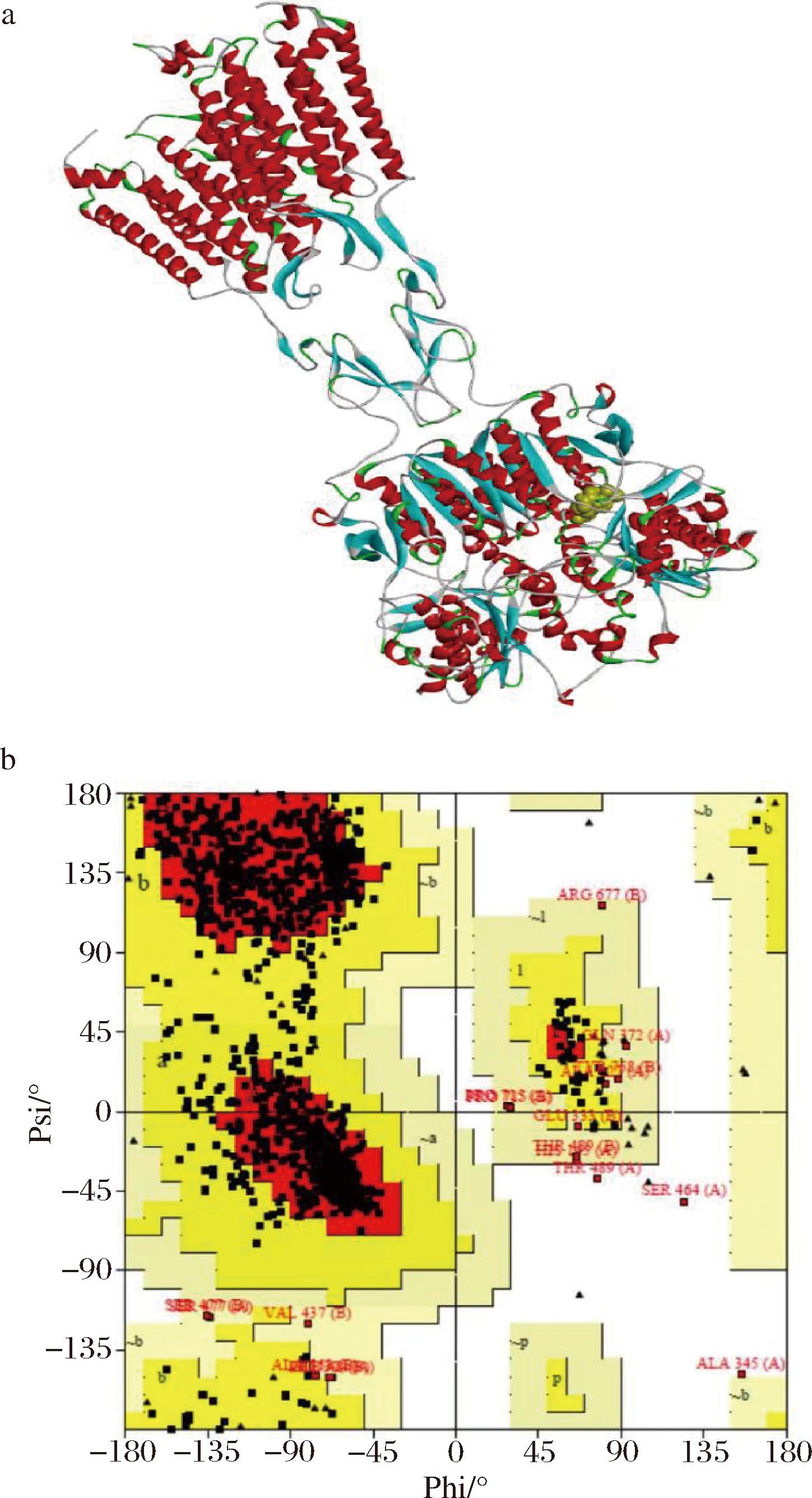
T1R1、T1R3受体的模型图及拉氏图如图1~图2所示。各图中的a图为受体蛋白的模型图,而b图则为拉氏图。模型图可以直观地反映待研究分析的蛋白质分子的主要结构域情况。而在SAVES v6.0平台上输出的拉氏图报告中,每一个正方形小图块代表蛋白质的氨基酸残基,其所在区域的大色块颜色则对应表示如下:红色区域里的氨基酸残基构象是最为合理的,而黄色及粉色区域的氨基酸残基构象为可以接受;最后,白色区域中为不可接受区的氨基酸残基构象。另外,为便于研究者快速评估出蛋白质模型的合理性,SAVES v6.0会在输出的拉式图报告下方提供各氨基酸残基构象在最适区、可接受区和不可接受区的具体比例情况:一般认为,当处于最适区和可接受区的氨基酸残基占比达到90%及以上,则可以认为该蛋白质的模型是比较合理的,可以用于进一步的配体对接研究分析工作[15]。

a-模型图;b-拉氏图
图1 T1R1 的同源模拟受体模型图和拉式图
Fig.1 Homology model of T1R1 receptor and ramachandran plot
a-模型图;b-拉氏图
图2 鲜味受体 T1R3 的同源模拟受体模型图和拉式图
Fig.2 Homology model of T1R3 receptor and ramachandran plot
从表4的统计结果来看,T1R1模型中99.3%氨基酸残基处于合理区:其中88.6%处于最适区域,10.7%处于可接受区;T1R3模型中99.8%氨基酸残基处于合理区:其中87.5%处于最适区域,12.3%处于可接受区。综上分析,评估这2个模型的结构合理。
表4 T1R1、T1R3鲜味受体模型拉氏图的氨基酸残基构象统计
Table 4 Amino acid residue conformation statistics of the ramachandran plot for umami receptor models of T1R1/T1R3

鲜味受体模型总氨基酸残基数/个处于最适区域处于可接受区域处于不可接受区域氨基酸残基数/个氨基酸残基占比/%氨基酸残基数/个氨基酸残基占比/%氨基酸残基数/个氨基酸残基占比/%T1R11 4071 24688.6 15110.7100.7T1R31 3921 21887.5 17112.330.2
从图1、图2的受体模型图可知,这2种鲜味受体的主要结构均是由2条大的肽链所组成:各条肽链均是由多螺旋结构的前端和膨大的后端铰链结合区2大部分组成。不同受体分子蛋白在细分结构方面存在比较直观的差异:T1R1的多螺旋结构前端分散得较开,而T1R3结合得更近。
2.4 各鲜味肽与受体分子对接分析
2.4.1 对接能量统计分析
10条鲜味肽与各鲜味受体分子的对接结合能如表5所示:结合能数值越低,一般表明鲜味肽与受体分子间更易形成对接复合物,并且该构象就越为稳定。整体来看,Ile-His、Ile-Arg、Glu-Glu、Glu-Leu、Glu-Gly-Gly与鲜味受体的结合能较低,基本均小于-6.0 kcal/mol,而Glu-Gly-Pro、Leu-Arg的结合能则比较高。同时,各鲜味肽结合能的测算数值与其鲜味阈值评估呈现正相关性:结合能越低,鲜味阈值也越低:可以进一步通过统计结合能更低组的具体结合氨基酸残基位点来分析各鲜味受体对接过程中起到关键作用的氨基酸残基位置。同时,与T1R3结合时较与T1R1对接的结合能整体要更低,表明T1R3受体分子可能是酱油源鲜味小肽呈鲜的重要受体,可以重点对比其与各鲜味小肽的结合差异来解析背后的呈鲜构效关系。而单一的MSG(考虑到其溶解后为解离状态,对接时采用谷氨酸结构式)与T1R1、T1R3的对接结合能整体处于偏高水平:可能在人体实际品尝时,其解离的Na+及谷氨酸阴根离子也可辅助呈鲜。
表5 鲜味肽与T1R1、T1R3受体对接结合能 单位:kcal/mol
Table 5 The docking energy of umami peptides with T1R1/T1R3 receptors
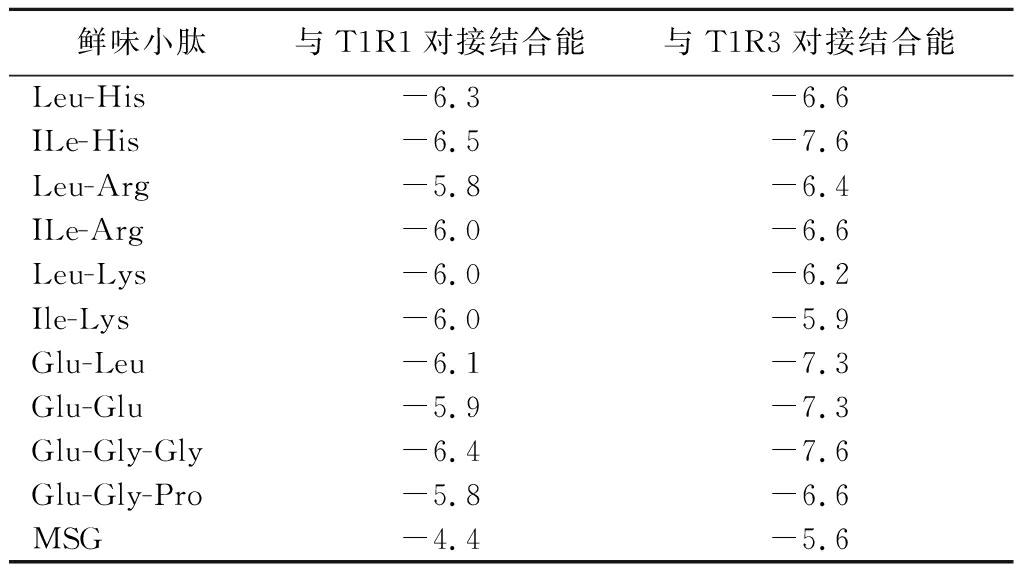
鲜味小肽与T1R1对接结合能与T1R3对接结合能Leu-His-6.3-6.6ILe-His-6.5-7.6Leu-Arg-5.8-6.4ILe-Arg-6.0-6.6Leu-Lys-6.0-6.2Ile-Lys-6.0-5.9Glu-Leu-6.1-7.3Glu-Glu-5.9-7.3Glu-Gly-Gly-6.4-7.6Glu-Gly-Pro-5.8-6.6MSG-4.4-5.6
2.4.2 关键结合氨基酸残基分析
表6和表7中具体统计了10种鲜味肽以及MSG与T1R1的结合位点统计,其中表格左侧为发生结合情况的氨基酸残基,而形成的结合键按照氢键(以1个“+”表示1次结合)与非氢键(以1个“-”表示1次结合)进行计数区分。
表6 鲜味肽与T1R1受体(A链)的结合位点及成键统计
Table 6 Binding sites and bonding statistics of umami peptides with the T1R1 receptor (chain A)

氨基酸残基Leu-HisILe-HisLeu-ArgIle-ArgLeu-LysIle-LysGlu-LeuGlu-GluGlu-Gly-GlyMSG结合氢键数量结合非氢键数量总结合键数量Asp108++++++++808Ser109+++++-516Leu116-+112Ser120+101Gly123+101Asn150+++303Ala157+101Ser160+101Arg180+++++-516Gln181++202Pro183-011Asp218+101Phe247---033Leu279---033鲜味肽的氢键结合数0323645150鲜味肽的非氢键结合数1021221001鲜味肽总结合键数1344866151
注:形成的结合键按照氢键(以1个“+”表示1次结合)与非氢键(以1个“-”表示1次结合)进行计数区分(表7~表8同)。
表7鲜味肽与T1R1受体(B链)的结合位点及成键统计
Table 7 Binding sites and bonding statistics of umami peptides with the T1R1 receptor (chain B)

氨基酸残基Leu-HisILe-HisLeu-ArgIle-ArgLeu-LysIle-LysGlu-GluGlu-Gly-GlyMSG结合氢键数量结合非氢键数量总结合键数量Leu51++202Gln52-+++++516Arg54-+112His55+-+++415Arg56++202Thr60+101Asp108++202Ala110-011Tyr113--022Leu116--022Arg117--022Leu119--022Ser120+101Ile127--022Arg180+++303Gln181++202鲜味肽的氢键结合数103211753鲜味肽的非氢键结合数550310000鲜味肽总结合键数653521753
注:三肽Glu-Gly-Pro与T1R11受体分子的对接中,对接结合键均发生在B链,但结合氨基酸与上表中均不相同,具体对应为:有氢键形成的为Ala170(2个氢键)、Ser172(2个氢键)、Glu301(1个氢键)及Asn388(1个氢键);而表现为非氢键作用力的氨基酸残基则为Tyr220、Ser276:成键数量均为1个。
整体来看,10种鲜味肽中除Glu-Gly-Pro的结合位点比较特殊:其所有的结合位点都在T1R1分子的B链上,但是形成具体结合键的氨基酸残基与其他鲜味肽均不一样。这有可能是Glu-Gly-Pro呈鲜表现效果弱的重要影响因素。同时,鲜味二肽Glu-Leu只与T1R1受体分子的A链形成结合位点。另外,A链上与各配体形成的氢键总数也明显高于B链:前者达到了29个,而后者只有23个。故判断A链上的结合位点在T1R1受体蛋白分子在传导鲜味感受信号上更为重要。另外,从各鲜味肽配体与T1R1所形成结合作用的氢键数来看,呈现的规律基本为呈鲜效果优者,所表现结合形成氢键的数量也更多。如Glu-Leu、Glu-Glu、Leu-His这3组小肽对比:在A链的结合中,呈鲜效果优的前2种小肽的氢键数为5个、1个,而呈鲜一般的Leu-His没有与受体结合形成氢键;在B链的结合中,Leu-His只形成了1个氢键,但是Glu-Glu的氢键数达到7个。同时,统计各氨基酸残基与各鲜味肽的结合键的情况:发现T1R1受体分子A链上的Asp108、Ser109、Arg180及B链上的Gln52是结合形成氢键数较高的位点。并且MSG在与T1R1受体对接时,与B链上的Gln52位置也有形成氢键。综合对比各肽的呈鲜情况:确定上述位点是T1R1受体的关键结合位点。
表8统计了这10种鲜味肽以及MSG与T1R3的结合情况:所有的结合氨基酸残基位点都是在该受体分子的A链上,没有出现如T1R1中在B肽链上也有结合的情况。而对比在2.3节中同源建模的分析,T1R3的分子构造与T1R1是在前端的锚定区有明显的差异:T1R3分子间空间位置靠得更近,没有太明显的分隔。
表8 鲜味肽与T1R3受体的结合位点及成键统计
Table 8 Binding sites and bonding statistics of umami peptides with the T1R3 receptor
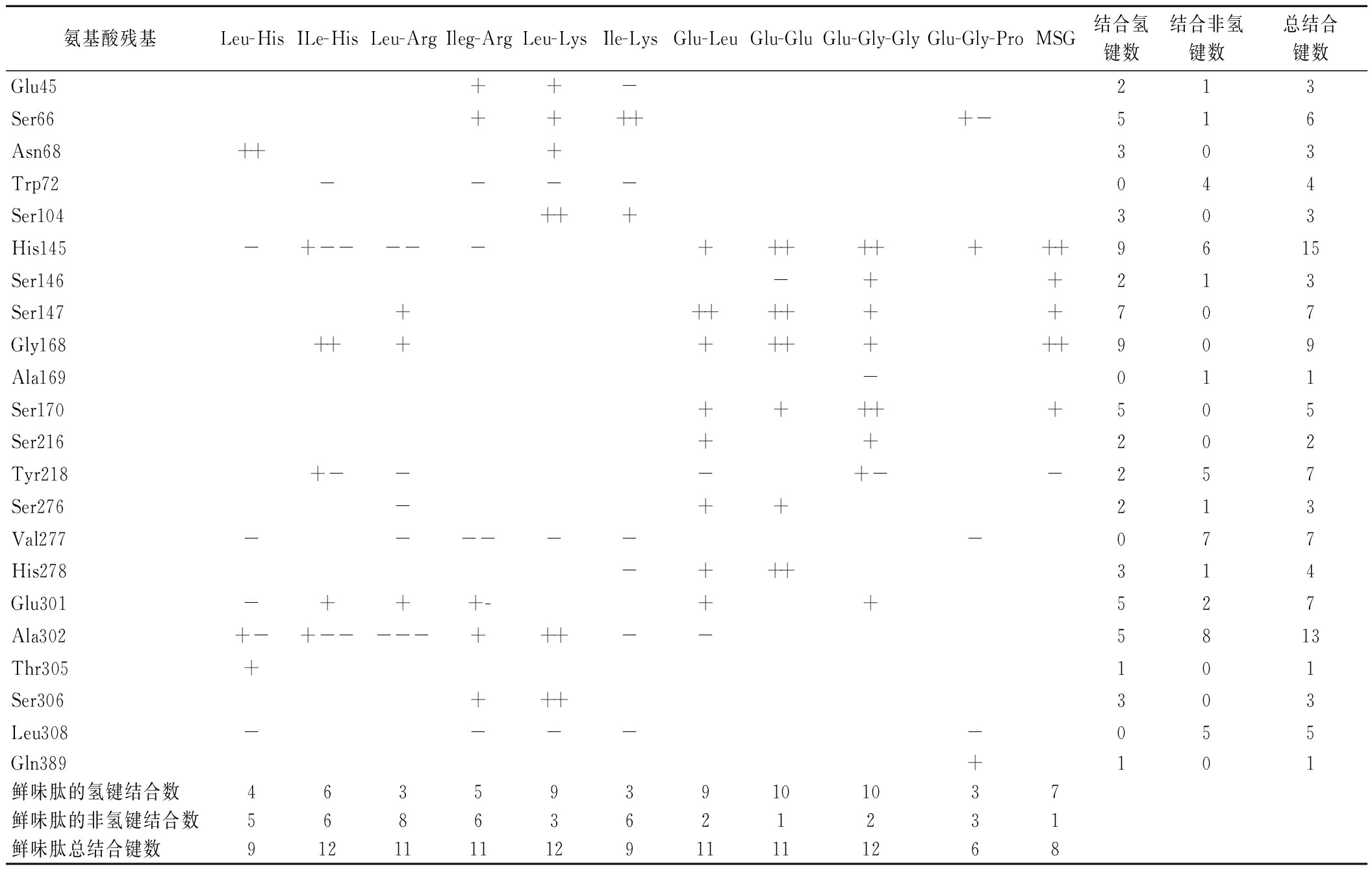
氨基酸残基Leu-HisILe-HisLeu-ArgIleg-ArgLeu-LysIle-LysGlu-LeuGlu-GluGlu-Gly-GlyGlu-Gly-ProMSG结合氢键数结合非氢键数总结合键数Glu45++-213Ser66+++++-516Asn68+++303Trp72----044Ser104+++303His145-+-----++++++++9615Ser146-++213Ser147+++++++707Gly168+++++++++909Ala169-011Ser170+++++505Ser216++202Tyr218+---+--257Ser276-++213Val277-------077His278-+++314Glu301-+++-++527Ala302+-+-----+++--5813Thr305+101Ser306+++303Leu308-----055Gln389+101鲜味肽的氢键结合数4635939101037鲜味肽的非氢键结合数56863621231鲜味肽总结合键数912111112911111268
另外,从各鲜味肽配体与T1R3所形成结合作用的氢键数来看,呈现的规律也是基本为呈鲜效果优者,结合形成氢键的数量也更多。仍以Glu-Leu、Glu-Glu、Leu-His这3组小肽对比为例:呈鲜效果优的前2种小肽的氢键数为9个、10个,而呈鲜一般的Leu-His只与T1R3受体结合形成了4个氢键;再如Ile-Arg与Leu-Arg对比,也是呈鲜阈值更低的二肽组结合形成的氢键数更多。另外,需要注意的一点是Leu-Lys与Ile-Lys对比,从鲜味感官来看,两者的呈鲜效果差异不大,但是Leu-Lys的氢键结合数却明显高于Ile-Lys。造成该差异的原因是与配体、受体间形成氢键是否为关键结合位点的氨基酸残基有关:当配体与受体结合形成的氢键只是普通氨基酸残基处,有可能其表现的鲜味强度差异并不突出。此次与T1R3的分子对接中,形成氢键频次较高的氨基酸残基有His145、Gly168、Ser147、Ala302、Ser66、Glu301和Ser170。其中His145、Ser147、Gly168、Ser170是已经报道为T1R3受体蛋白的关键呈味结合位点[18],同时MSG分子与T1R3对接时,均有与这4个结合位点形成氢键。再次证明了T1R3的关键结合呈味位点是His145、Ser147、Gly168、Ser170这4组残基。
2.4.3 鲜味肽与T1R3呈鲜构效关系
从2.4.2节的研究情况来看,T1R3鲜味受体分子在与各酱油源鲜味小肽的分子对接中较T1R1对接中存在有明显的差异性:其受体-配体化合物的结合位点均在A链上,可进一步开展其具体呈鲜构效的关系研究。重点依次对比呈鲜强的小肽Ile-His、Ile-Arg、Glu-Gly-Gly和呈鲜一般的小肽Leu-His、Leu-Arg、Glu-Gly-Pro的受体-配体结合情况,进一步探究各组间呈鲜效果差异的原因。
图3显示为Ile-His与T1R3受体的His145、Gly168、Glu301、Ala302残基形成氢键(成键表示为绿色),并且与His145、Ala302这2组残基形成氢键的同时还存在3组疏水键的情况(成键表示为粉色)。图4中Leu-His与T1R3的成键只有3组氢键:Asn68、Ala302与Thr305。上述形成氢键的残基中只有Ala302出现了一组疏水键。有研究表明,疏水相互作用也有利于增加配体与受体的结合亲和力[19]。对比这组小肽,Ile-His氢键与疏水键的组合更多,更有利于其受体-配体成分的稳定,最终体现为更强的鲜味。
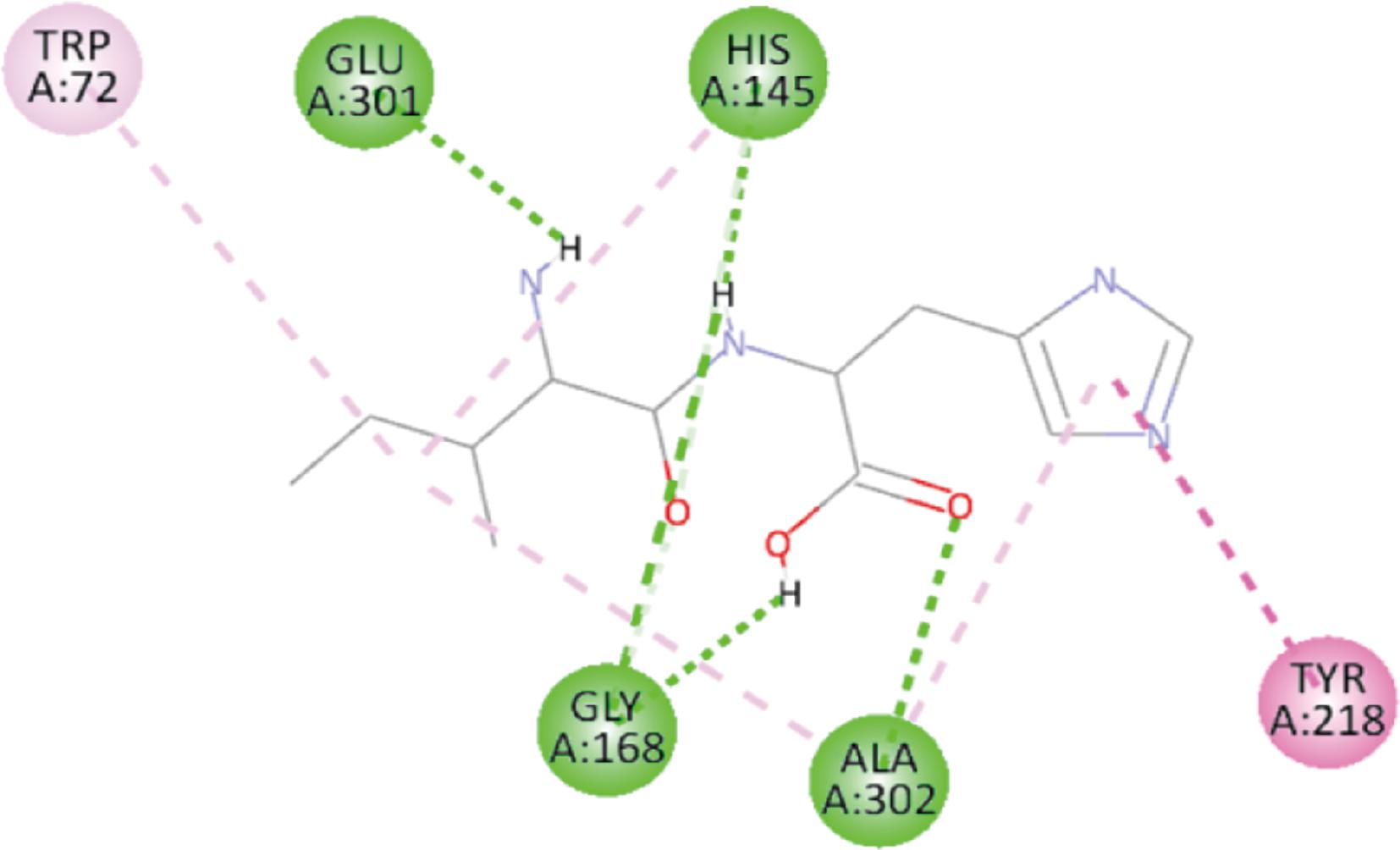
图3 Ile-His与T1R3受体结合模式图
Fig.3 Binding pattern of Ile-His to T1R3 receptor
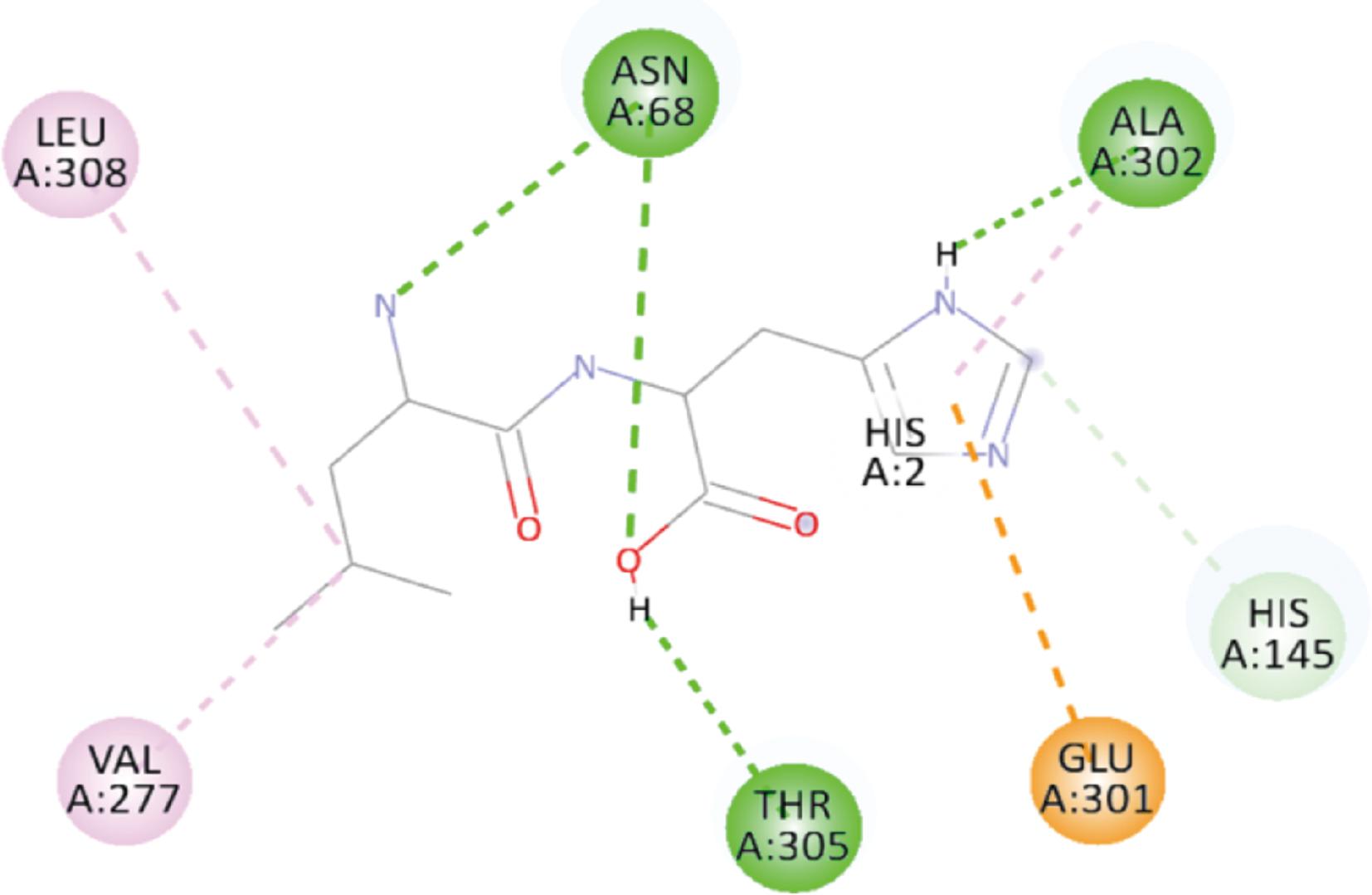
图4 Leu-His与T1R3受体结合模式图
Fig.4 Binding pattern of Leu-His to T1R3 receptor
图5中Ile-Arg小肽与T1R3受体的Glu45、Ser66、Glu301、Ala302和Ser306形成了氢键,并且在Glu301残基位还有1个静电键(成键表示为棕黄色),其也能起到稳定氢键构象的作用。除此之外,其还有Trp72等5组疏水键,虽未与氢键组直接作用在同一个原子上,但是其具有的排出水分子的效应,也能达到进一步稳定复配物构象的效果,故判断能够抵消掉Asn68残基的不利成键构象影响(成键表示为红色)。反观图6中Leu-Arg的成键情况,其只与Ser147、Gly168和Glu301残基形成了氢键,并且存在的静电键是单独成键在Tyr218残基上,对于稳定受体-配套化合物的构象稳定性有限,故呈现的鲜味要弱。
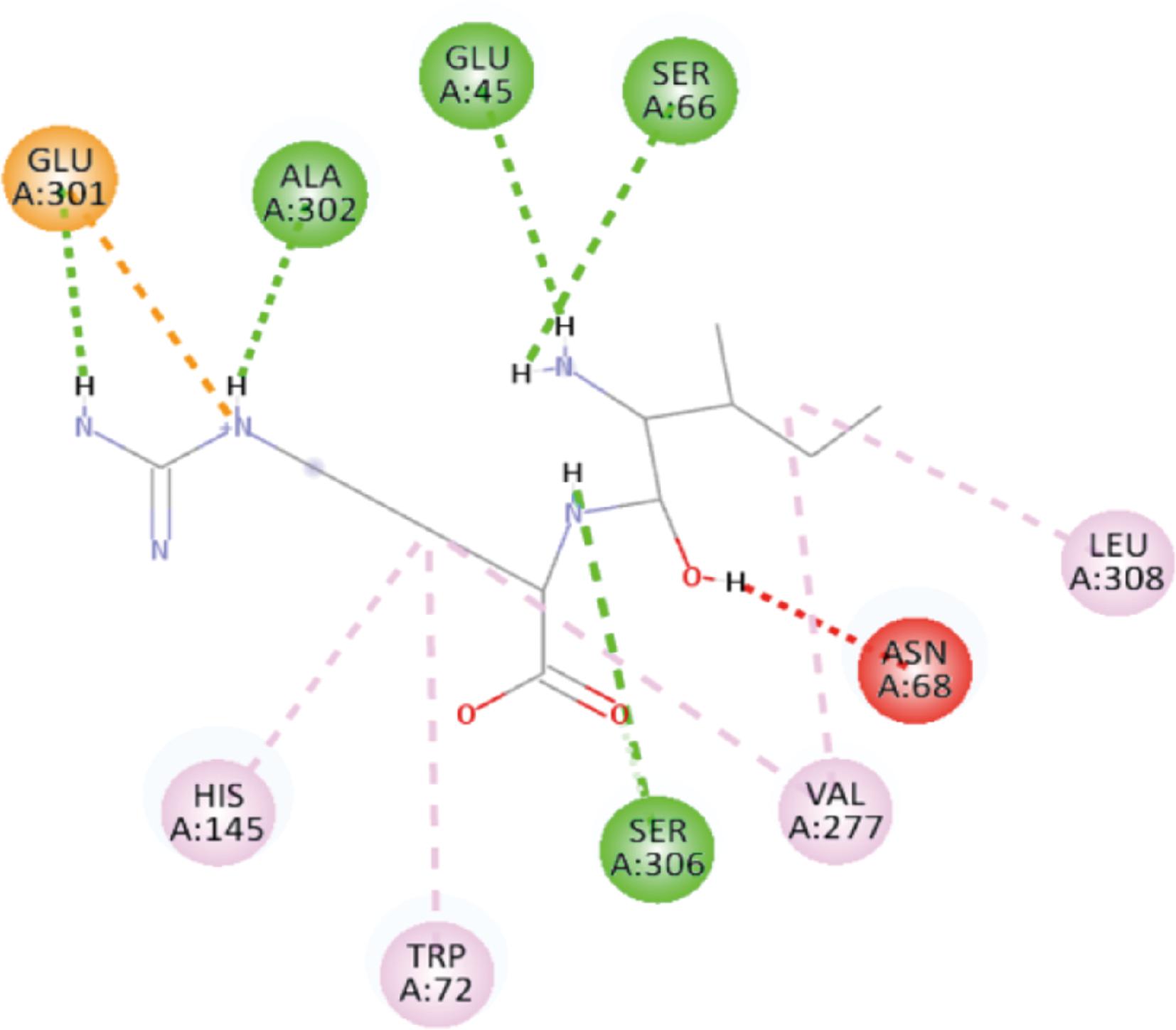
图5 Ile-Arg与T1R3受体结合模式图
Fig.5 Binding pattern of Ile-Arg to T1R3 receptor
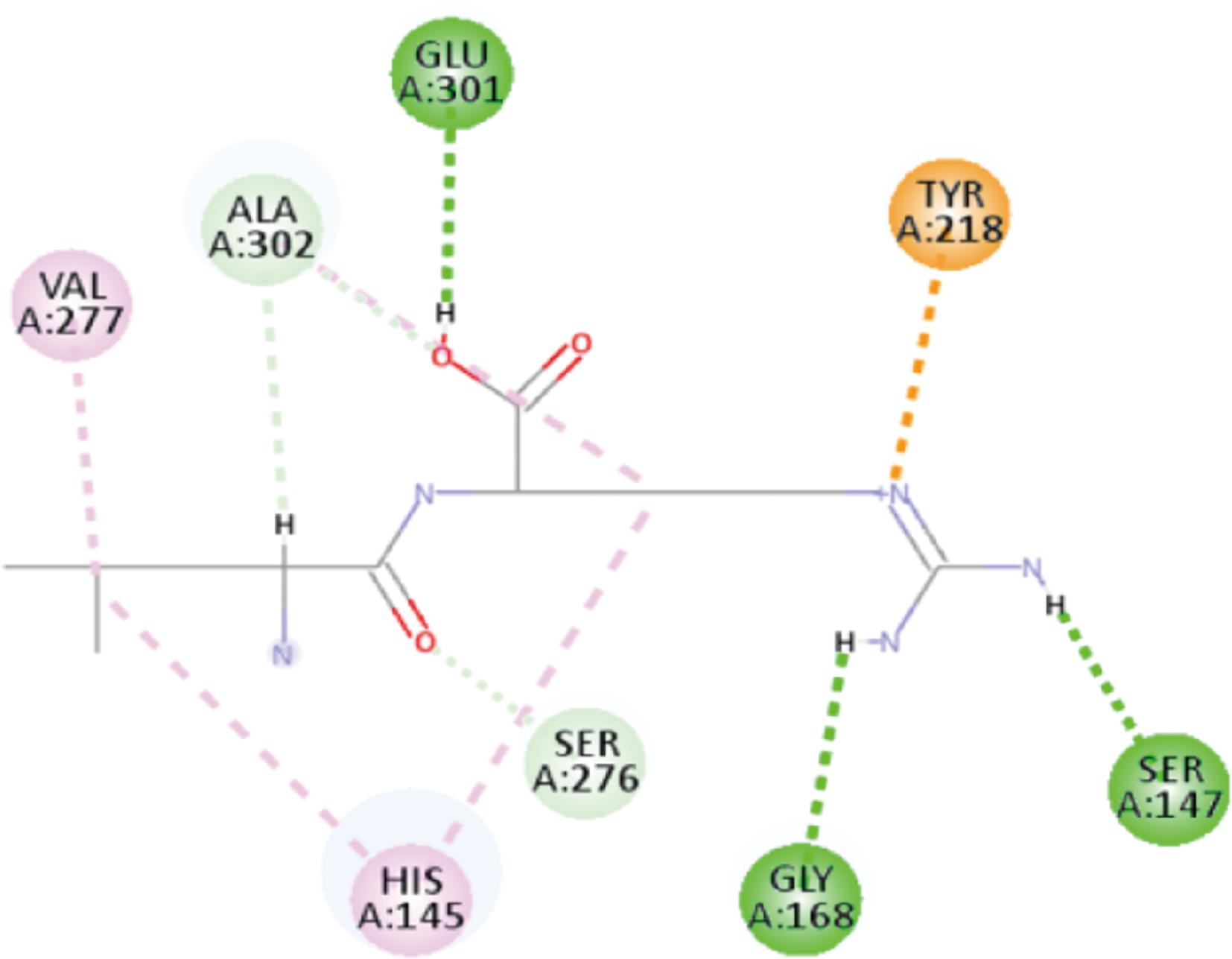
图6 Leu-Arg与T1R3受体结合模式图
Fig.6 Binding pattern of Leu-Arg to T1R3 receptor
在图7的Glu-Gly-Gly与T1R3的结合图中,可以看到其和His145、Ser146、Ser147等8个氨基酸残基形成了10个氢键。并且His145、Ser170这2处残基都是有2个氢键形成,同时Tyr218残基还形成1个疏水键,上述多种成键模式保障了该受体-配体复合物的结构稳定。而图8中Glu-Gly-Pro与T1R3结合时,只有Ser66、His145和Gln389这3组残基形成氢键,另外2个与Val277、Leu308残基形成的疏水键均是结合在另一侧Pro的杂环结构上,无法形成牢固的复合物结构,表现为呈味方面鲜味弱。
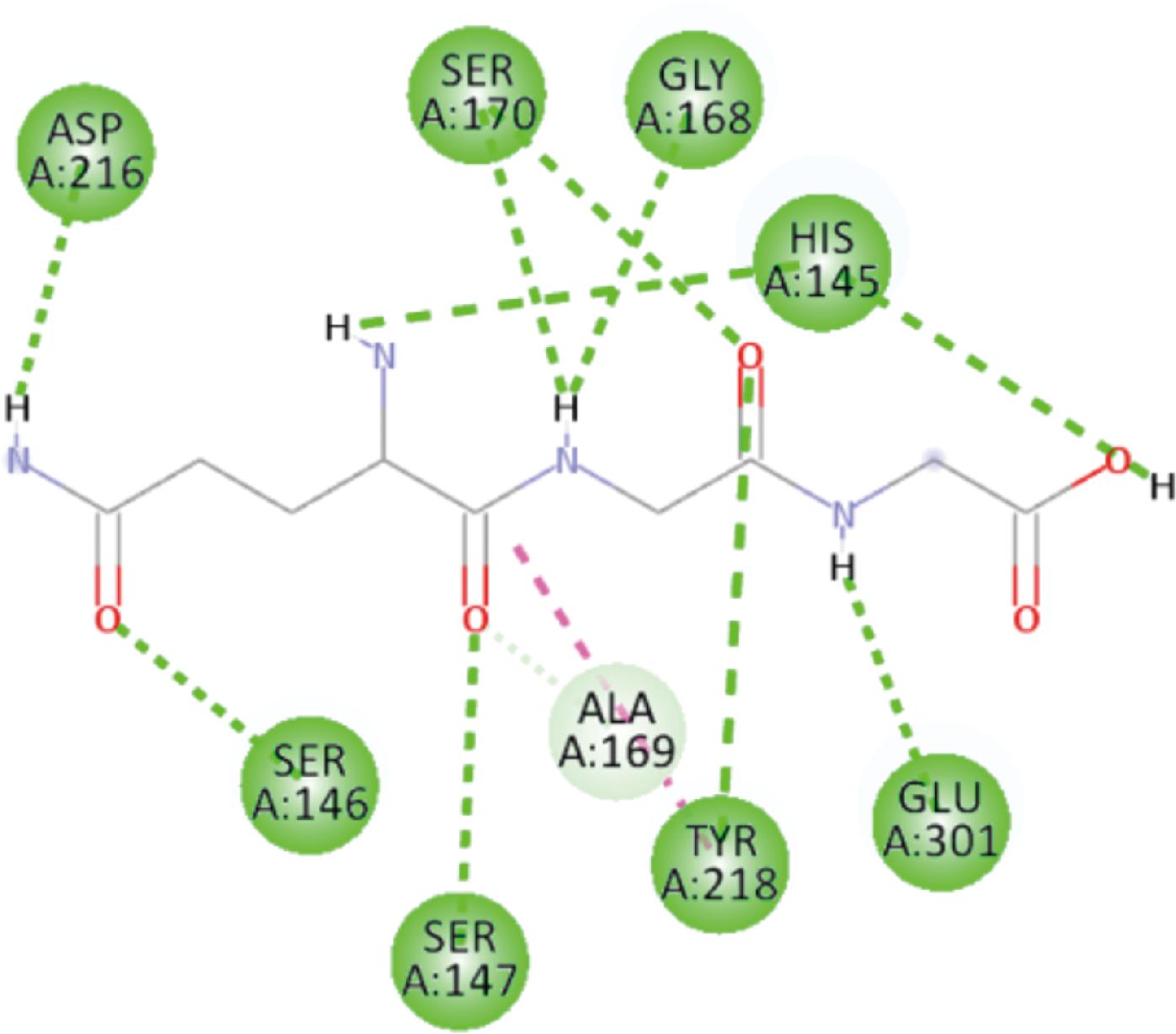
图7 Glu-Gly-Gly与T1R3受体结合模式图
Fig.7 Binding pattern of Glu-Gly-Gly to T1R3 receptor
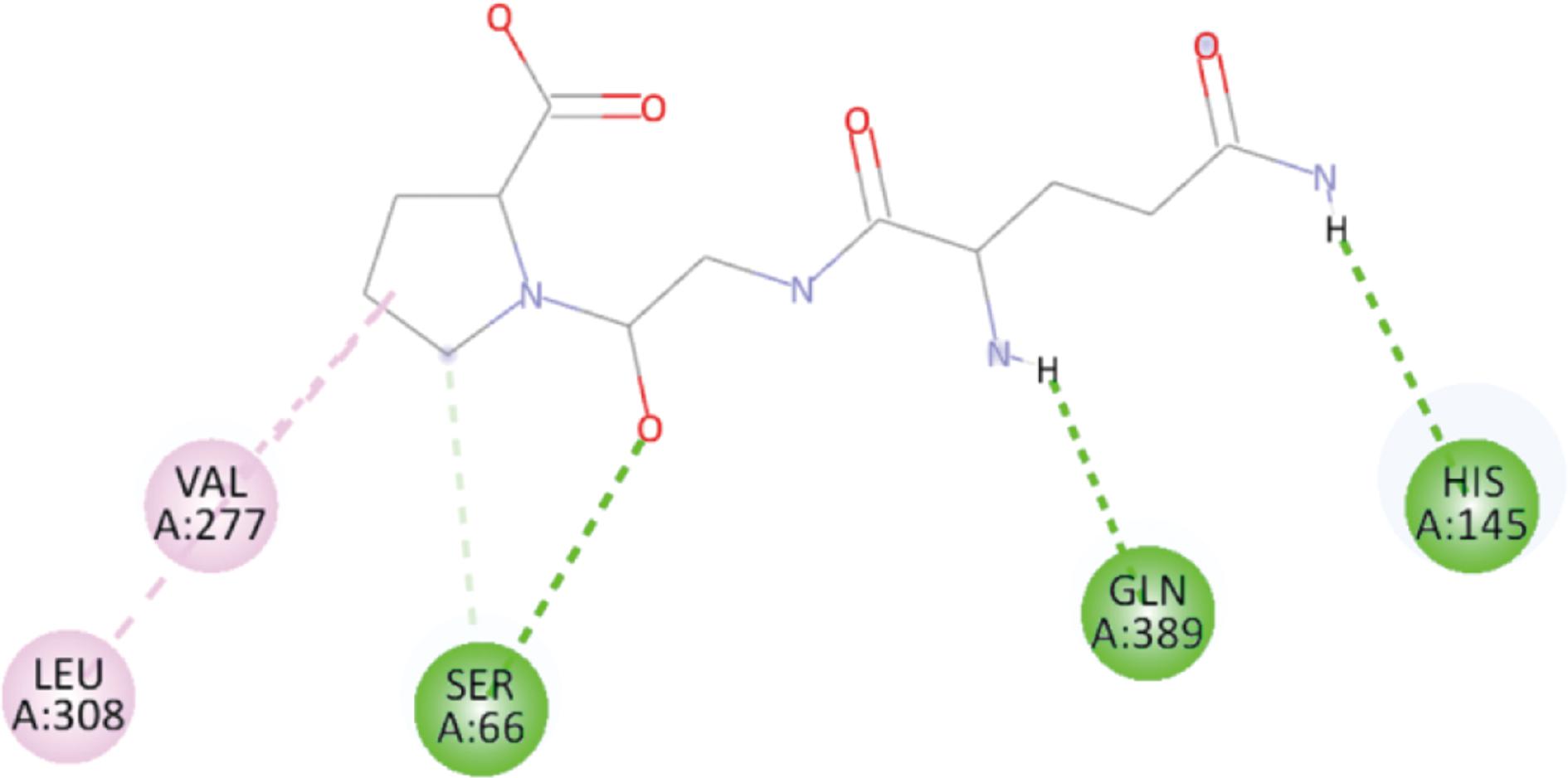
图8 Glu-Gly-Pro与T1R3受体结合模式图
Fig.8 Binding pattern of Glu-Gly-Pro to T1R3 receptor
3 结论与讨论
本研究以感官评价为基础,利用同源建模和分子对接技术研究Leu-His 等8种二肽和Glu-Gly-Gly、Glu-Gly-Pro这2组三肽与典型鲜味受体T1R1和T1R3的构效关系。结果表明:除Glu-Gly-Pro的呈鲜阈值高于谷氨酸钠阈值(0.3 mg/mL)、Ile-Lys的呈鲜阈值与谷氨酸钠持平外,其余鲜味小肽的呈鲜阈值均低于谷氨酸钠阈值。其中Glu-Gly-Gly的呈鲜阈值最低,为0.06 mg/mL。
酱油源鲜味小肽与T1R1的关键结合位点是A链上的Asp108、Ser109、Arg180及B链上的Gln52;与T1R3的关键结合位点是其A链上的His145、Ser147、Gly168、Ser170。发现在对接过程中其成键均是在A链上。选取与各鲜味肽结合时整体能量较低的T1R3受体进行构效关系研究,表明各鲜味小肽主要是通过氢键的作用来形成稳定受体-配体复合物,而其中的疏水键、静电键均能起到稳定构象的效果,特别是针对同一个残基已形成有氢键情况下,再在同键位上形成疏水键或者静电键能够起到更强的结合效果。同时,同一个残基若能形成多个氢键时,也能表现出增强受体-配体复合物稳定的效应。
本研究创新采用覆盖全受体蛋白结构域的方式,对比分析了酱油源鲜味肽与T1R1、T1R3这2种主要鲜味受体分子的对接情况,获得了其关键结合位点,明晰了影响受体-配体复合物结构稳定性的重点成键因素,有助于进一步阐明鲜味肽与各鲜味受体分子的相互作用机制,为酿造酱油的深层次呈鲜机理解析和后续产业应用中的鲜味品质升级提供理论指导。
[1] 王莉,伍圆明,孙伟峰,等. 鲜味肽与鲜味受体的研究进展[J].中国调味品,2019,44(2):182-189.WANG L, WU Y M, SUN W F, et al. Research advances in umami peptides and umami receptors[J]. Chinese Seasonings,2019,44(2):182-189.
[2] 刘义,赵钺沁,周怡梅,等.鲜味肽的研究进展[J].西华大学学报(自然科学版),2016,35(3):21-25.LIU Y, ZHAO Y Q, ZHOU Y M, et al. Research advances in umami peptides [J]. Journal of Xihua University (Natural Science Edition) ,2016,35(3):21-25.
[3] NELSON G, CHANDRASHEKAR J, HOON M A, et al. An amino-acid taste receptor[J]. Nature, 2002, 416(6877):199-202.
[4] BYSTROVA M F,ROMANOV R A,ROGACHEVSKAJA O A,et al.Functional expression of the extracellular-Ca2+-sensing receptor in mouse taste cells[J].Journal of Cell Science,2010,123(6):972-982.
[5] PAL CHOUDHURI S, DELAY R J, DELAY E R. Metabotropic glutamate receptors are involved in the detection of IMP and l-amino acids by mouse taste sensory cells[J]. Neuroscience, 2016, 316:94-108.
[6] WELLENDORPH P, BR UNER-OSBORNE H. Molecular cloning, expression, and sequence analysis of GPRC6A, a novel family C G-protein-coupled receptor[J]. Gene, 2004, 335:37-46.
UNER-OSBORNE H. Molecular cloning, expression, and sequence analysis of GPRC6A, a novel family C G-protein-coupled receptor[J]. Gene, 2004, 335:37-46.
[7] YASUMATSU K, OGIWARA Y, TAKAI S, et al. Umami taste in mice uses multiple receptors and transduction pathways[J]. The Journal of Physiology, 2012, 590(5):1155-1170.
[8] NICOLETTI F, BOCKAERT J, COLLINGRIDGE G L, et al. Metabotropic glutamate receptors: From the workbench to the bedside[J]. Neuropharmacology, 2011, 60(7-8):1017-1041.
[9] JYOTAKI M, SHIGEMURA N, NINOMIYA Y. Multiple umami receptors and their variants in human and mice[J]. Journal of Health Science, 2009, 55(5):674-681.
[10] YAO Y X, SHI Y L, YI J J, et al. Three novel umami peptides from watermelon soybean paste and the revelation of the umami mechanism through molecular docking with T1R1/T1R3[J]. Food Bioscience, 2024, 59:104155.
[11] GU Y X, ZHANG J C, NIU Y J, et al. Screening and characterization of novel umami peptides in cheddar cheese using peptidomics and bioinformatics approaches[J]. LWT, 2024, 194:115780.
[12] 赵孟斌,顾华蓉,穆洪涛,等.基于感官评价和分子对接的Pro、Glu二肽与鲜味受体构效关系[J].现代食品科技,2023,39(9):123-136.ZHAO M B, GU H R, MU H T, et al. The structure-activity relationship between pro-Glu dipeptides and umami receptor based on sensory evaluation and molecular docking [J]. Modern Food Technology, 2023,39(9):123-136.
[13] 丛艳君,易红,郑福平.基于电子舌技术不同超声处理时间的奶酪滋味区分[J].食品科学,2015,36(6):114-118.CONG Y J, YI H, ZHENG F P. Taste discrimination of cheese with different ultrasonic treatment times based on electronic tongue technology[J]Food Science, 2015,36(6):114-118.
[14] 王春叶,童华荣.滋味稀释分析及其在食品滋味活性成分分析中的应用[J].食品与发酵工业,2007,33(12):117-121.WANG C Y, TONG H R, Taste dilution analysis and its application in the analysis of taste-active components in food[J]. Food and Fermentation Industries,2007,33(12):117-121.
[15] 余霞琴. 鲜味受体T1R1/T1R3 的结构模拟及其与鲜味六肽作用研究[D].上海:上海海洋大学, 2017.YU X Q. Structural modeling of the umami receptor T1R1/T1R3 and its interaction with umami hexapeptides[D]Shang Hai: Shanghai Ocean University,2017.
[16] ZHANG J N, ZHAO M M, SU G W, et al. Identification and taste characteristics of novel umami and umami-enhancing peptides separated from peanut protein isolate hydrolysate by consecutive chromatography and UPLC-ESI-QTOF-MS/MS[J]. Food Chemistry, 2019, 278:674-682.
[17] 李伟.小分子甜味剂与甜/苦味受体的相互作用以及甜度构效关系预测[D].无锡:江南大学,2019.Li W. Interactions of low-molecular-weight sweeteners with sweet/bitter taste receptors and prediction of sweetness structure-activity relationships[D]. Wuxi: Jiangnan University,2019.
[18] L PEZ CASCALES J J, OLIVEIRA COSTA S D, DE GROOT B L, et al. Binding of glutamate to the umami receptor[J]. Biophysical Chemistry, 2010, 152(1-3):139-144.
PEZ CASCALES J J, OLIVEIRA COSTA S D, DE GROOT B L, et al. Binding of glutamate to the umami receptor[J]. Biophysical Chemistry, 2010, 152(1-3):139-144.
[19] WANG Y, LIU M, GAO J. Enhanced receptor binding of ARS-CoV-2 through networks of hydrogen-bonding and hydrophobic interactions [J]. Proceedings of the National Academy of Sciences, 2020, 117(25): 13967-13974.