金耳(Tremella aurantialba)是我国特有的一种珍稀胶体食药用菌[1],其多糖是一种极具开发价值的生物大分子活性物质[2-3]。刘子骐等[4]采用双酶法提取金耳酵母状孢子多糖并测定了抗氧化性;李兴恺等[5]对金耳菌丝体胞外多糖的结构、抗氧化活性进行测定,魏涛等[6]研究了金耳菌丝体多糖对四氧嘧啶致高血糖模型小鼠血糖及糖耐量的调节作用,降低了小鼠的血糖并增加了小鼠对葡萄糖的耐受力,张雯等[7]研究发现金耳菌丝体多糖可有效降低实验性2型糖尿病大鼠的血糖水平,金耳菌丝体以其发酵周期短、产量高、成本低等优点,成为研究金耳多糖的主要材料。与之相比,关于金耳子实体多糖的研究较少,且自然条件下金耳菌丝长势较弱,分解纤维素的能力很弱,几乎没有独立生长发育的能力,必须与粗毛韧革菌伴生培育,黄年来等[8]报道,金耳子实体表层是由金耳菌丝组成,内部是由粗毛韧革菌组成;田果廷等[9]报道得出同样的结论;刘勇等[10]认为金耳子实体是由金耳菌丝和粗毛韧革菌菌丝共同组成,两者相互穿插混合组成子实体,在其内部两者之间没有明显的界限。金耳子实体与金耳菌丝体之间存在本质上的区别,不能以金耳菌丝体多糖研究结果完全替代子实体多糖研究,且菌种、产地、培育过程等生长条件的差异也会不同程度地影响金耳品质以及其所含有的活性物质。本文以西北地区-甘肃兰州培育的金耳子实体为原料,进行多糖的分离纯化、结构分析并研究其降血糖活性潜力,以期为西北地区金耳的高值化利用提供一定的理论基础和数据支撑。
1 材料与方法
1.1 材料
金耳子实体(甘肃兰州地区培育),甘肃睿康现代生物科技有限公司;细胞(HepG2),武汉普诺赛生命科技有限公司。
1.2 仪器与设备
Nicolet iS10红外光谱仪,赛默飞世尔科技有限公司;XDB-C18色谱柱,安捷伦科技有限公司;LC-20A高效液相色谱分析仪,日本岛津公司;Infinite 200 Pro多功能酶标仪,美国TECAN公司。
1.3 实验方法
1.3.1 金耳多糖的分离纯化
金耳子实体冻干粉碎后,经水提醇沉,Sevag法除蛋白后得金耳粗多糖(Tremella aurantialba crude polysaccharide,TACP)。DEAE柱层析法纯化TACP,NaCl溶液(NaCl:0-0.1-0.2-0.3-0.4-0.5-0.6 mol/L)梯度洗脱,分管收集。苯酚-硫酸法测定各管收集液中糖含量,绘制吸光度-管号洗脱曲线,收集0.3 mol/L NaCl洗脱组分,3 500 Da透析袋除盐后冷冻干燥得金耳纯多糖(Tremella aurantialba pure polysaccharide, TAPP)。参照PAN等[11]方法采用HPLC测定TAPP和葡聚糖标准品(T-10、T-40、T-70、T-110、T-500和T-20000),绘制标准品分子质量对数(lgMw)-保留时间(Rt)的标准曲线,根据TAPP液相色谱图分析其分子质量分布及相对分子质量(色谱柱:TSK gel G4000PWXL 7.8 mm×300 mm;柱温:30 ℃;检测器:RID;检测温度:35 ℃;流动相:超纯水;流速:0.6 mL/min;进样量:20 μL;检测时间:20 min)。
1.3.2 TAPP的理化分析
1.3.2.1 单糖组成分析
参照WANG等[12]方法并稍作修改,加入100 μL 10 mg/mL的样品溶液和70 μL 2.5 mol/L硫酸溶液,110 ℃油浴2 h,水解完成后加入NaOH溶液调节pH至中性,进行PMP法衍生,氯仿萃取,取上层水相,0.22 μm滤膜过滤后HPLC检测(色谱柱:Agilent ZORBAX Eclipse XDB-C18 4.6 mm×250 mm,5 μm;柱温:30 ℃;检测波长:250 nm;流动相:0.02 mol/L pH=6.7 磷酸盐缓冲液-乙腈(体积比83∶17);流速:1 mL/min;进样量:10 μL,检测时间:80 min)。
1.3.2.2 傅立叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参照JRIDI等[13]的方法,精确称取TAPP 1.0 mg与150 mg KBr放入玛瑙研钵,充分研磨混合后在压片机上把混合样品粉末压成透明薄片,红外光谱仪检测,4 000 cm-1~400 cm-1扫描16次,分辨率4 cm-1。
1.3.2.3 刚果红实验
参照汤陈鹏等[14]方法并稍作修改:取2 mL 1 mg/mL的TACP和TAPP溶液分别与2 mL 80 mmol/L的刚果红溶液充分混合,加入1 mol/L NaOH使溶液的氢氧化钠终浓度为 0、0.1、0.2、0.3、0.4、0.5 mol/L。充分混匀后,静置10 min。用紫外-可见分光光度计在波长 400~600 nm范围内扫描。
1.3.2.4 扫描电子显微镜(scanning electron microscope,SEM)
取适量的TAPP,粘着于附有铜胶带的样品台上,样品台置于离子溅射仪中镀上一层导电金粉。工作条件如下:加速电压为5 kV,观测倍数分别选用200倍、1 000倍、2 000倍、5 000倍,选取适当视野拍照记录,每个样品拍照重复3次,排除样品干扰及系统误差。
1.3.2.5 热重分析(thermogravimetric analysis,TGA)
称取2.0~5.0 mg的TAPP样品,在流速为60 mL/min的氩气氛围下,温度由30 ℃升至600 ℃,升温速率为10 ℃/min,扫描速度为1 ℃/min,进行TGA分析。
1.3.3 TAPP降血糖活性潜力分析
1.3.3.1 TAPP对α-淀粉酶的体外活性抑制
根据文献[15]描述方法测定TAPP对α-淀粉酶活性的抑制率,以阿卡波糖作阳性对照,取0.3 mL TAPP溶液、0.3 mL α-淀粉酶溶液于试管内,在37 ℃反应15 min后,加入0.3 mL可溶性淀粉溶液,37 ℃反应15 min后,加入1 mL DNS试剂终止反应,100 ℃煮沸15 min,冷却,定容至10 mL,于540 nm波长处测量吸光度A1,抑制率计算如公式(1)所示:
抑制率![]()
(1)
式中:A0,以等体积蒸馏水取代待测溶液;A2,以等体积磷酸盐缓冲液取代α-淀粉酶溶液;A3,以等体积蒸馏水和磷酸盐缓冲液分别取代待测溶液和α-淀粉酶溶液。
1.3.3.2 TAPP对α-葡萄糖苷酶的体外活性抑制
采用对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside, PNPG)法[16]测定TAPP对α-葡萄糖苷酶活性的抑制率,取20 μL TAPP溶液,40 μL α-葡萄糖苷酶溶液放入96孔板,于37 ℃恒温箱保湿10 min,加入40 μL的PNPG溶液引发反应,37 ℃反应30 min后,加入0.2 mol/L 100 μL碳酸钠终止反应,使用酶标仪在405 nm波长下测定吸光度值A1,阿卡波糖作正对照,抑制率计算如公式(2)所示:
抑制率![]()
(2)
式中:A0,以等体积蒸馏水取代待测溶液;A2,以等体积磷酸钠缓冲液取代α-葡萄糖苷酶溶液;A3,以等体积蒸馏水和磷酸钠缓冲液分别取代待测溶液和α-葡萄糖苷酶溶液。
1.3.3.3 TAPP对HepG2-IR模型的胰岛素抵抗改善效果分析
取传代培养后的对数期HepG2细胞用于实验分析。
CCK-8法检测TAPP对HepG2细胞活力影响:HepG2细胞经96孔板培养贴壁后,分别加入0、62.5、125、250、500 μg/mL无菌TAPP溶液100 μL进行干预,以正常培养组为对照组,无细胞组为空白组,每组设置3组平行,在培养箱中分别孵育12、24、36、48 h,移除培养液,每孔加入10 μL CCK-8的检测液,37 ℃避光反应2 h,450 nm处测定吸光度值。
HepG2-IR模型构建:100 μL HepG2细胞悬液96孔板培养贴壁后,移除培养液,生理盐水洗涤2~3次,建模组中分别加入含0.2、0.4、0.6、0.8、1.0 mmol/L棕榈酸培养液,正常组加入普通培养液,每组设置3组平行,分别培养12、24、36、48 h,移除培养液,生理盐水洗涤2~3次,更换普通培养液,孵育24 h,以各组葡萄糖消耗量为指标确定HepG2-IR建模的棕榈酸浓度和作用时间[17],HepG2-IR模型建立后,以普通培养液继续培养,每隔12 h取上清液测定一次葡萄糖消耗量,从而确定模型的持续时间,检测模型的稳定性。
TAPP对HepG2-IR模型葡萄糖消耗量的影响:设置正常组、模型组、给药组、阳性对照组。给药组、阳性对照组中的TAPP、盐酸二甲双胍的浓度梯度均为25、50、75、100 μg/mL。给药培养24 h后更换为普通培养液,24 h后测定各组的葡萄糖消耗量。
1.4 数据分析
所有试验均以3次重复测定得最终数据,结果以“平均值±标准差”表示。采用SPSS 27软件进行方差分析和邓肯多极差检验,Origin 2023软件绘制图形。
2 结果与分析
2.1 金耳多糖的分离纯化
图1为TACP在190~400 nm的全波长扫描图谱,其在260~280 nm无吸收峰,表明无核酸和蛋白质的存在。TACP的DEAE柱层析洗脱曲线如图2所示,收集0.3 mol/L NaCl洗脱组分并命名为TAPP,糖含量测定结果表明TAPP中多糖含量达到含量为(91.98±1.53)%。图3-a所示为TAPP的液相色谱图,除溶剂峰外,只有一个保留时间为9.299 min的色谱峰,表明TAPP分子质量分布较为均一。根据图3-b所示葡聚糖标准品lgMw-Rt的标准曲线回归方程(lgMw=-0.337 2Rt+9.323 6,R2=0.997 9)计算得出TAPP分子质量主要集中于1.54×106 Da。
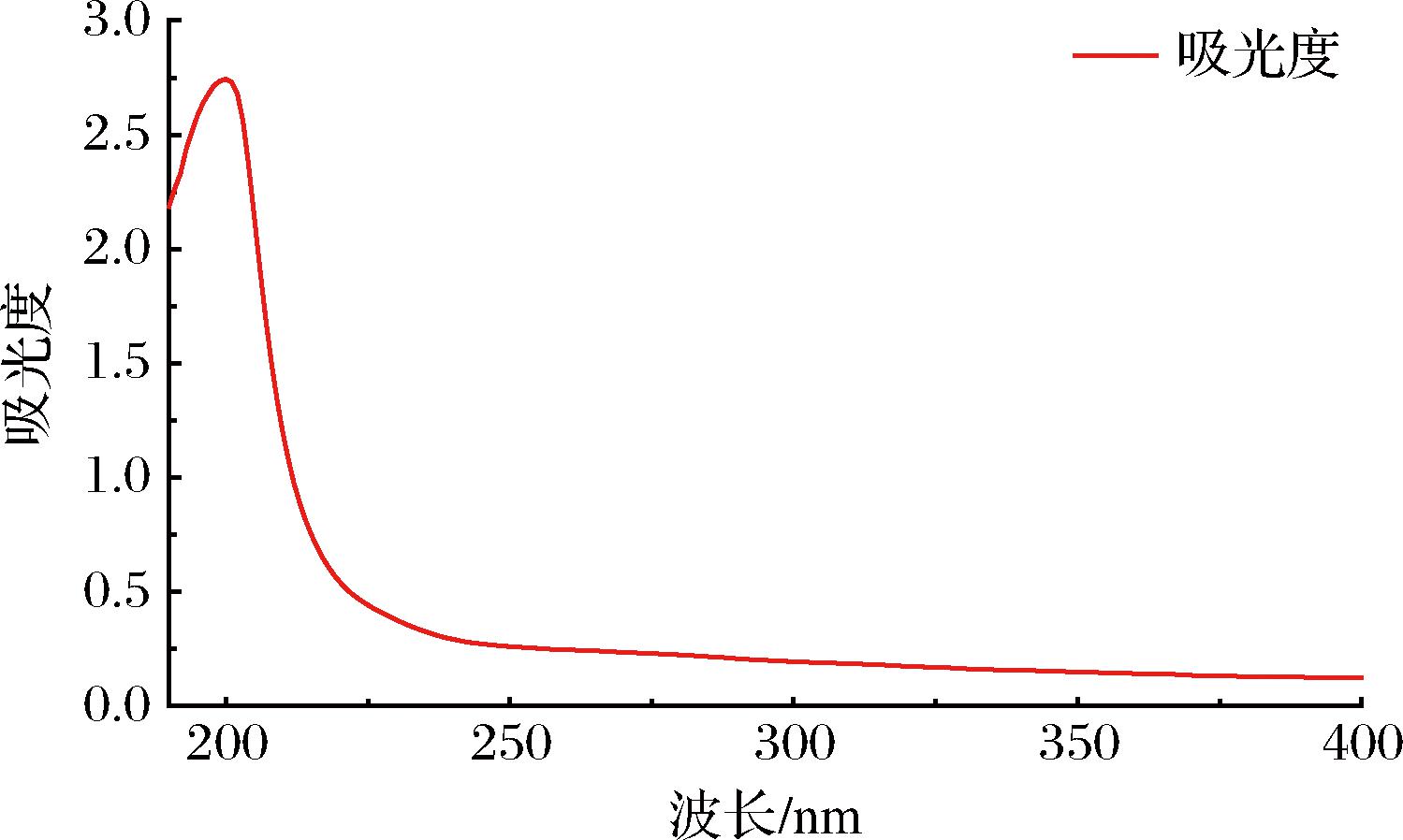
图1 TACP的全波长扫描图(190~400 nm)
Fig.1 Full wavelength scan of TACP (190-400 nm)
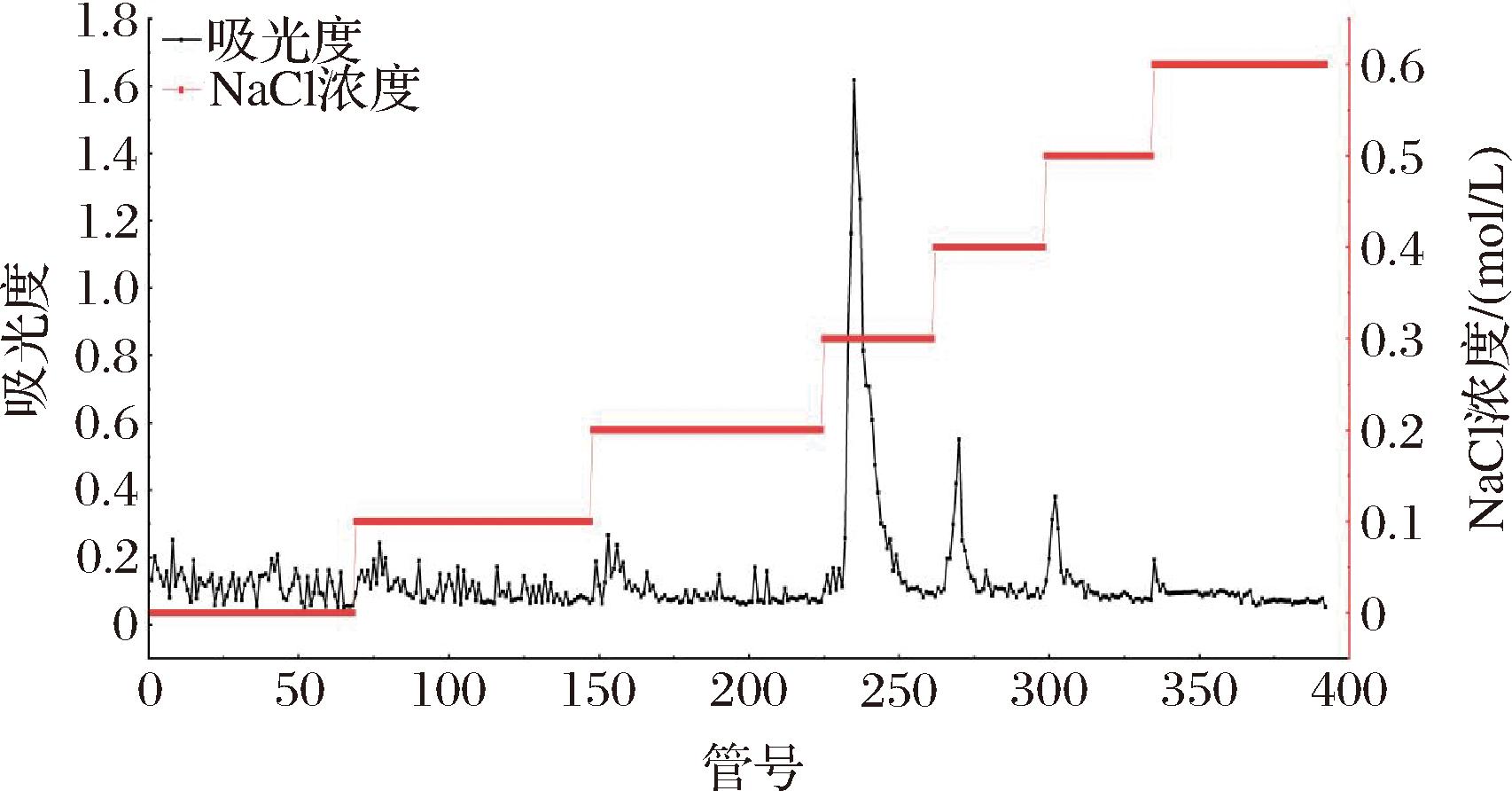
图2 DEAE-52分离TACP的洗脱曲线
Fig.2 Elution curve of TACP by DEAE-52
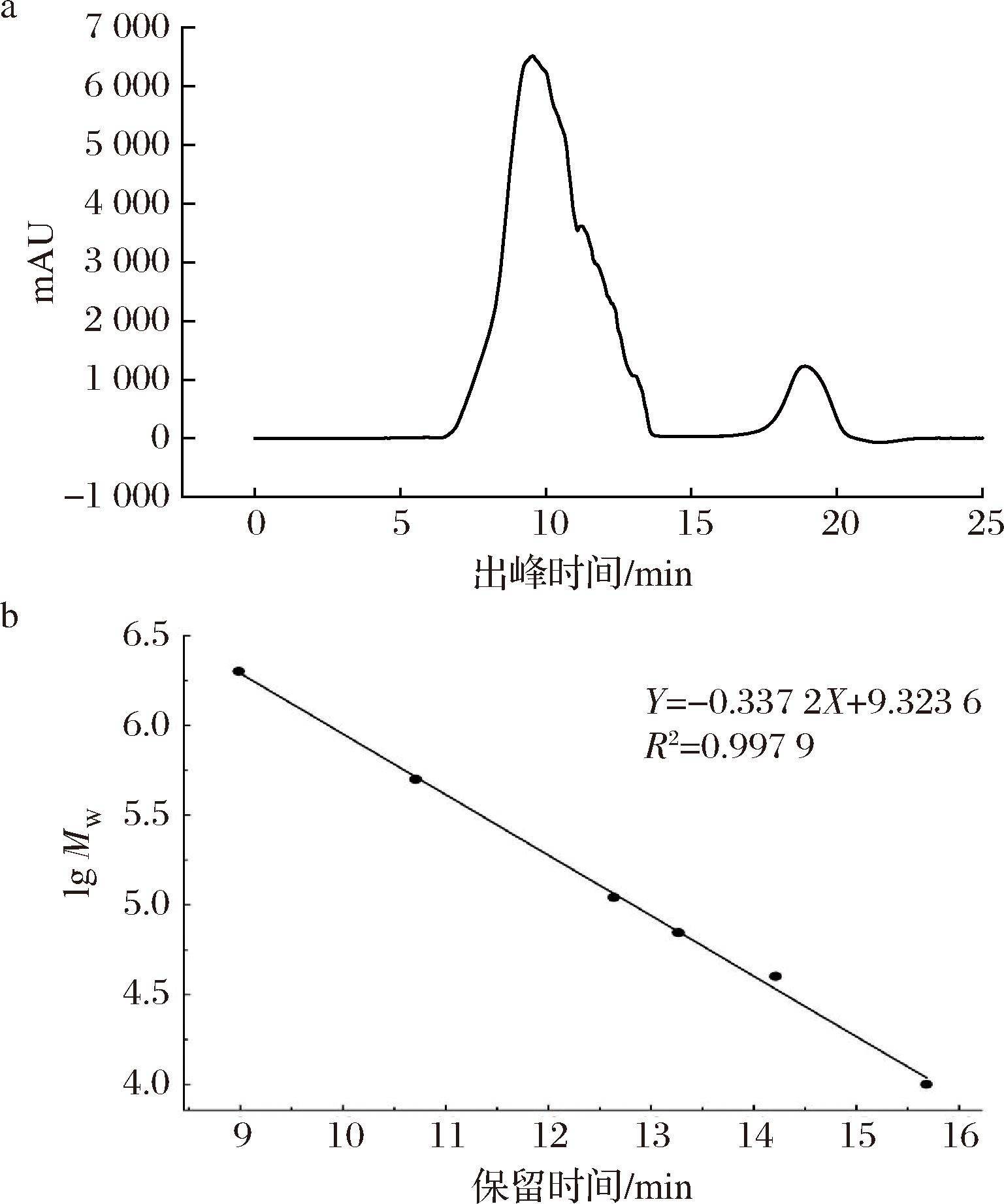
a-TAPP和流动相的HPLC色谱图;b-分子质量标准曲线(lgMw-Rt)
图3 TAPP纯度和分子质量HPLC分析
Fig.3 Purity and molecular weight analysis of TAPP by HPLC
2.2 TAPP的理化分析
2.2.1 单糖组成分析
图4所示为单糖组分析的HPLC图谱,TAPP的单糖组成主要为甘露糖、葡萄糖醛酸、葡萄糖、木糖摩尔比为55.20∶9.76∶14.81∶20.23,及少量半乳糖和半乳糖醛酸。李卫旗等[18]从金耳子实体分离出来的JP-2的主要单糖为甘露糖、葡萄糖、木糖、鼠李糖和半乳糖。PENG等[19]分离纯化的金耳多糖单糖组成为甘露糖、木糖、葡萄糖醛酸、葡萄糖、岩藻糖、阿拉伯糖摩尔比为59.2∶23.2∶13.9∶1.6∶1.7∶0.4,不同学者研究得到的单糖组成与本实验结果存在差异,差异的形成与产地、生长环境,以及金耳在提取和分离过程中条件和方法的不同均有关系。
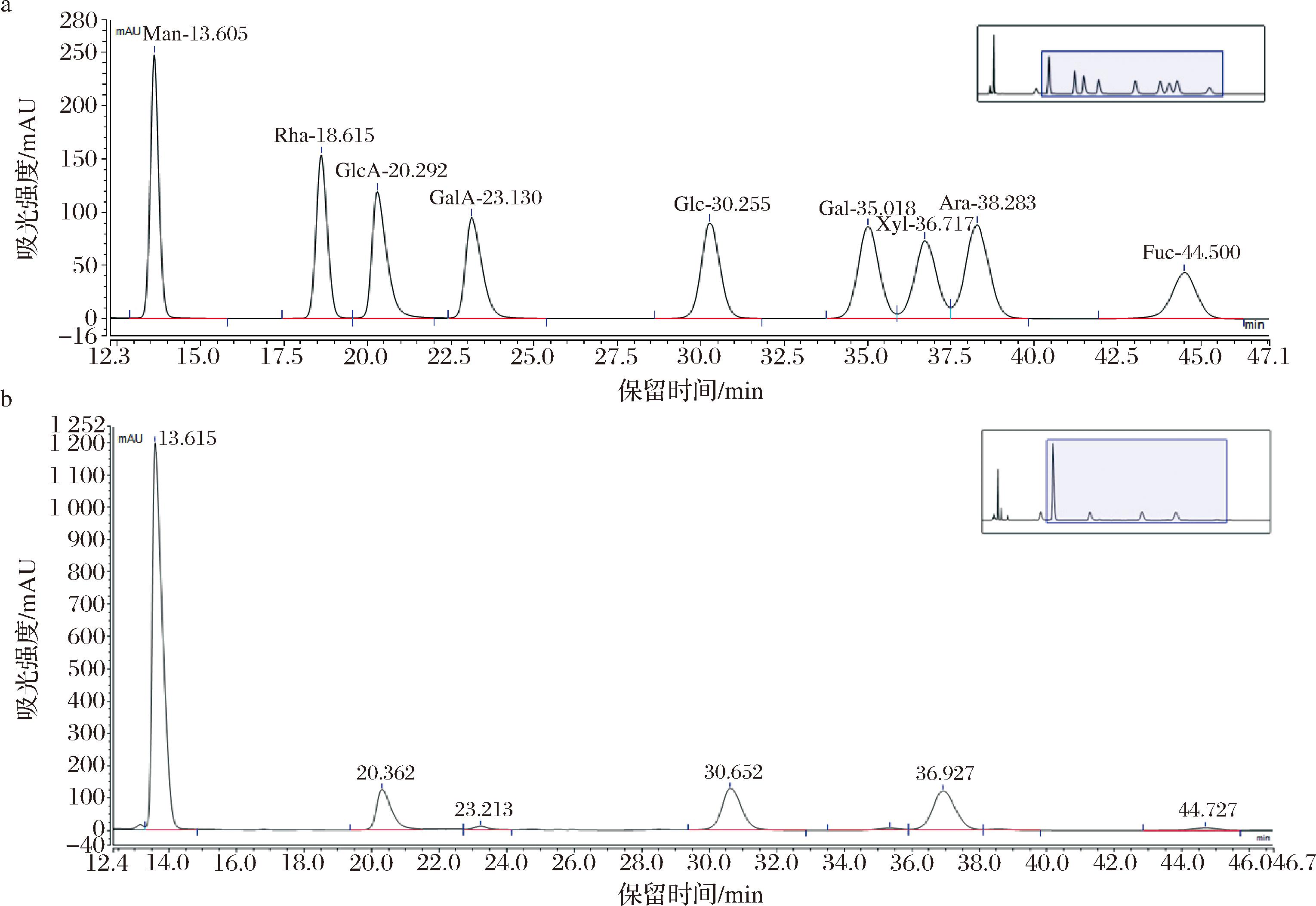
a-单糖标准品的PMP衍生化分析;b-TAPP的PMP衍生化分析
图4 TAPP的单糖组成分析
Fig.4 Monosaccharide composition analysis of TAPP
注:鼠李糖-Rha,半乳糖醛酸-GlcA,葡萄糖醛酸-GalA,半乳糖-Glc,葡萄糖-Gal,木糖-Xyl,阿拉伯糖-Ara,岩藻糖-Fuc。
2.2.2 FTIR分析
TAPP中的典型化学键在图5所示的FTIR光谱中显示,3 410 cm-1处的宽峰归属于O—H的伸缩振动;2 930 cm-1处的窄峰属于C—H(—CH2)的伸缩振动[20];1 617 cm-1处的尖峰归属于糖半缩醛中C![]() O拉伸振动;1 730 cm-1处的吸收峰归因于酯化的羧基(COO—CH3)的伸缩振动;1 053 cm-1处的峰归属于C—O拉伸振动,属于吡喃糖苷的特征吸收峰,892 cm-1的吸收峰表明存在β-糖苷键[21]。综上表明TAPP的化学键与酸性杂多糖相符合,与单糖组成分析结果相一致。
O拉伸振动;1 730 cm-1处的吸收峰归因于酯化的羧基(COO—CH3)的伸缩振动;1 053 cm-1处的峰归属于C—O拉伸振动,属于吡喃糖苷的特征吸收峰,892 cm-1的吸收峰表明存在β-糖苷键[21]。综上表明TAPP的化学键与酸性杂多糖相符合,与单糖组成分析结果相一致。
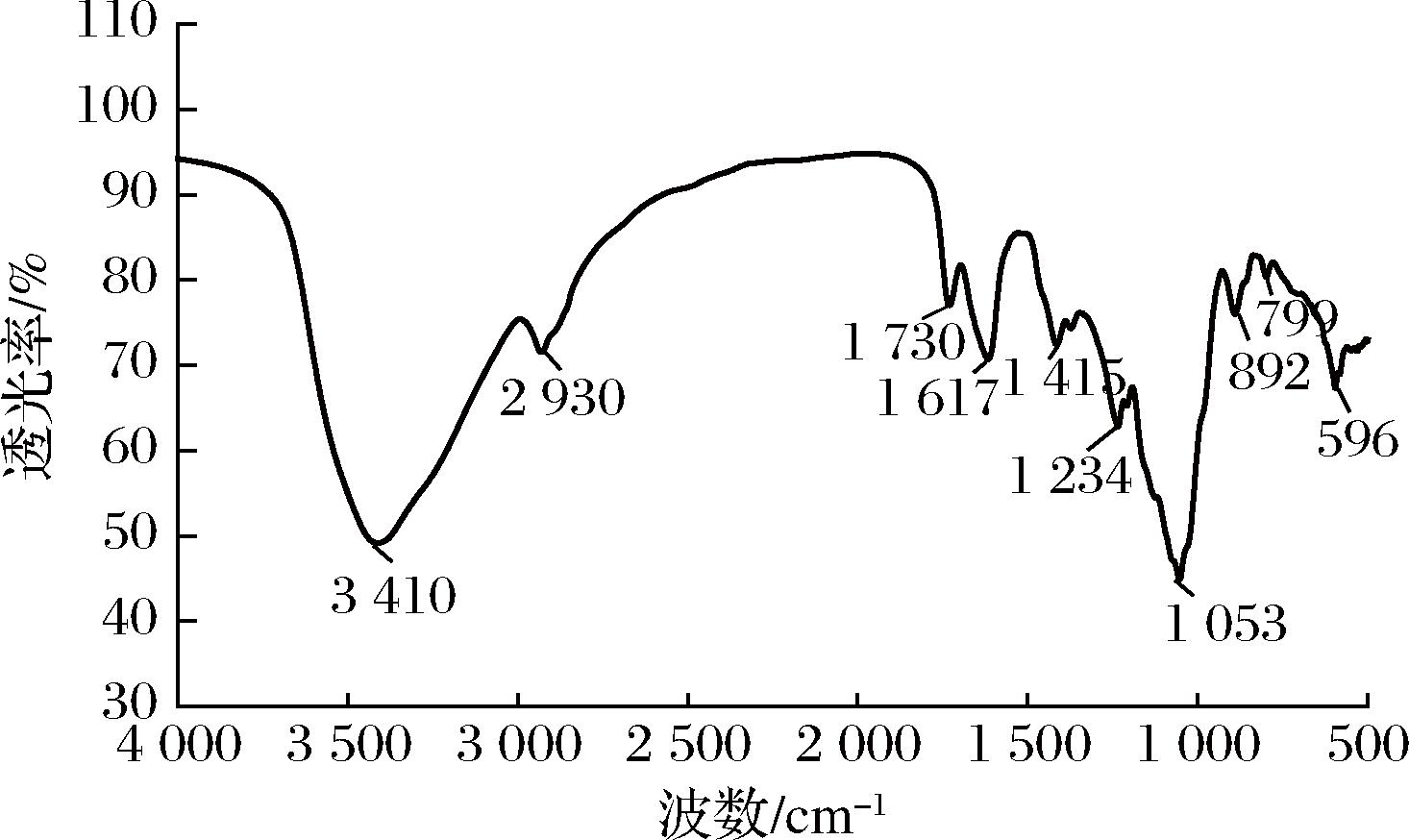
图5 TAPP的红外光谱图
Fig.5 FTIR spectrum of TAPP
2.2.3 刚果红实验
具有螺旋结构的多糖与刚果红形成的络合物会使其最大吸收波长(λmax)红移。如图6所示,随着NaOH终浓度的不断增加,TACP、TAPP与刚果红形成的络合物的λmax均呈现先升后降的趋势,且始终高于刚果红的最大吸收波长,λmax红移,表明金耳多糖中存在螺旋结构。当NaOH终浓度达到0.1 mol/L后,出现拐点,说明其螺旋结构开始被高浓度的NaOH破坏。
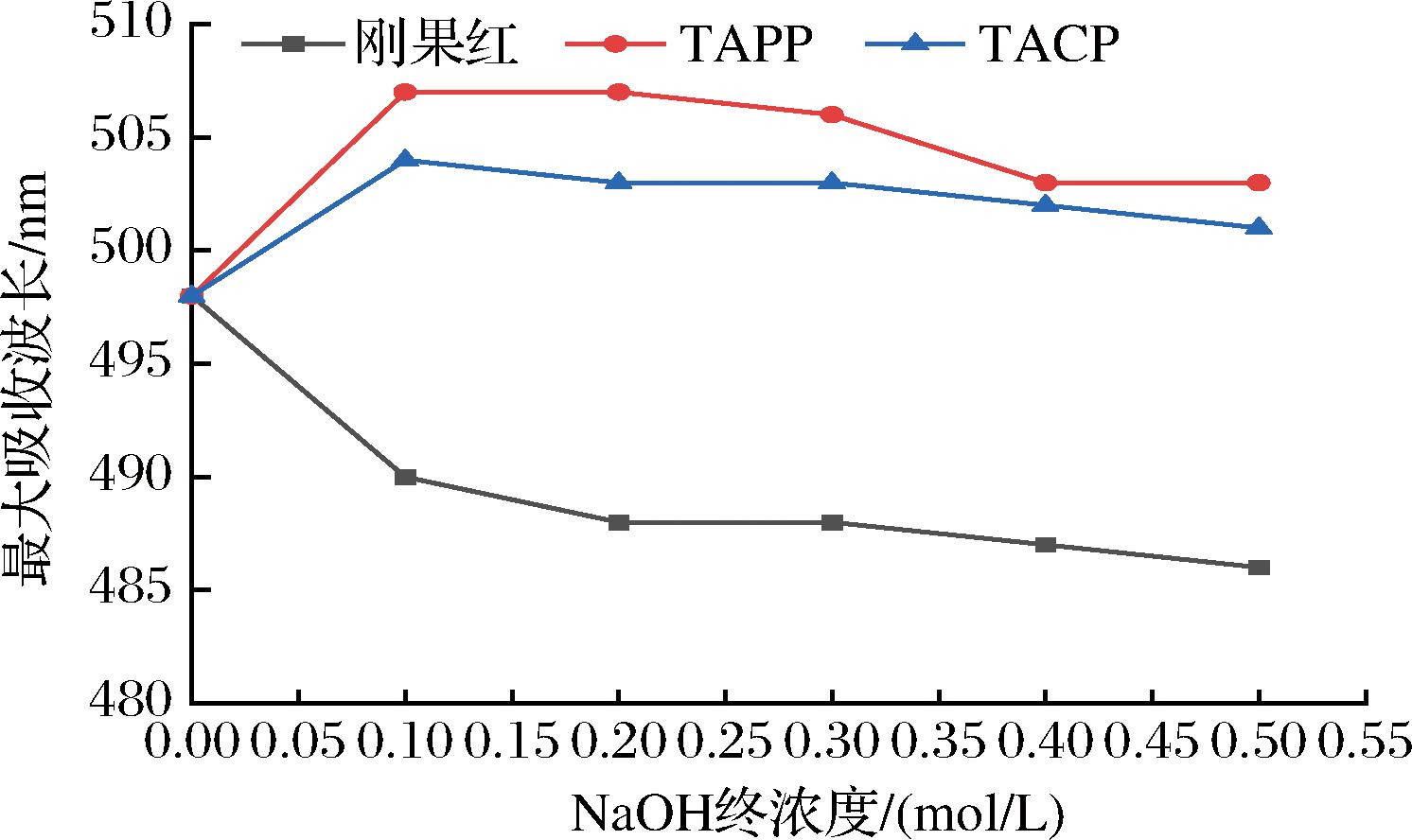
图6 TAPP和TACP的刚果红实验
Fig.6 Congo red results of TAPP and TACP
2.2.4 SEM分析
微观结构是多糖的特殊性之一,TAPP的SEM图像(图7)显示其微观结构呈片状无规则的聚集状态,中间有裂缝和空洞,表面相对光滑,略微凹凸和弯曲。

图7 TAPP的扫描电镜图
Fig.7 SEM images of TAPP
2.2.5 TGA
如图8所示,TAPP的热损失分为2个阶段,第一阶段30~123 ℃,失重率为11.42%,主要是多糖中水分的蒸发和丢失;第二阶段123~170 ℃,失重率为0;第三阶段在170~550 ℃,此阶段质量损失率为62.61%,在该温度范围内多糖发生了分解,化学键受到了破坏,出现了结构组分的解聚,在264.5 ℃时质量损失率最高。综上所述,温度低于170 ℃ 时,加热造成的质量损失为水分丢失,TAPP结构稳定,热稳定性良好。

图8 TAPP的热重分析
Fig.8 TGA of TAPP
2.3 TAPP降血糖活性潜力分析
2.3.1 α-淀粉酶抑制
如图9所示,TAPP在1~5 mg/mL内,TAPP和阿卡波糖对α-淀粉酶的抑制效果呈现剂量依赖性,随浓度的升高,TAPP与阿卡波糖对α-淀粉酶的抑制效果差距在减小,在浓度为5 mg/mL时,抑制率分别达到(78.10±0.98)%和(97.56±1.20)%;IC50分别为2.623 mg/mL和0.506 1 mg/mL。综上所述,TAPP和阿卡波糖对α-淀粉酶的抑制效果存在一定的差距,可能跟多糖的糖苷键种类、连接方式以及空间结构有关,进而影响了多糖的降血糖活性[22],但TAPP仍具有一定的降血糖开发潜力。
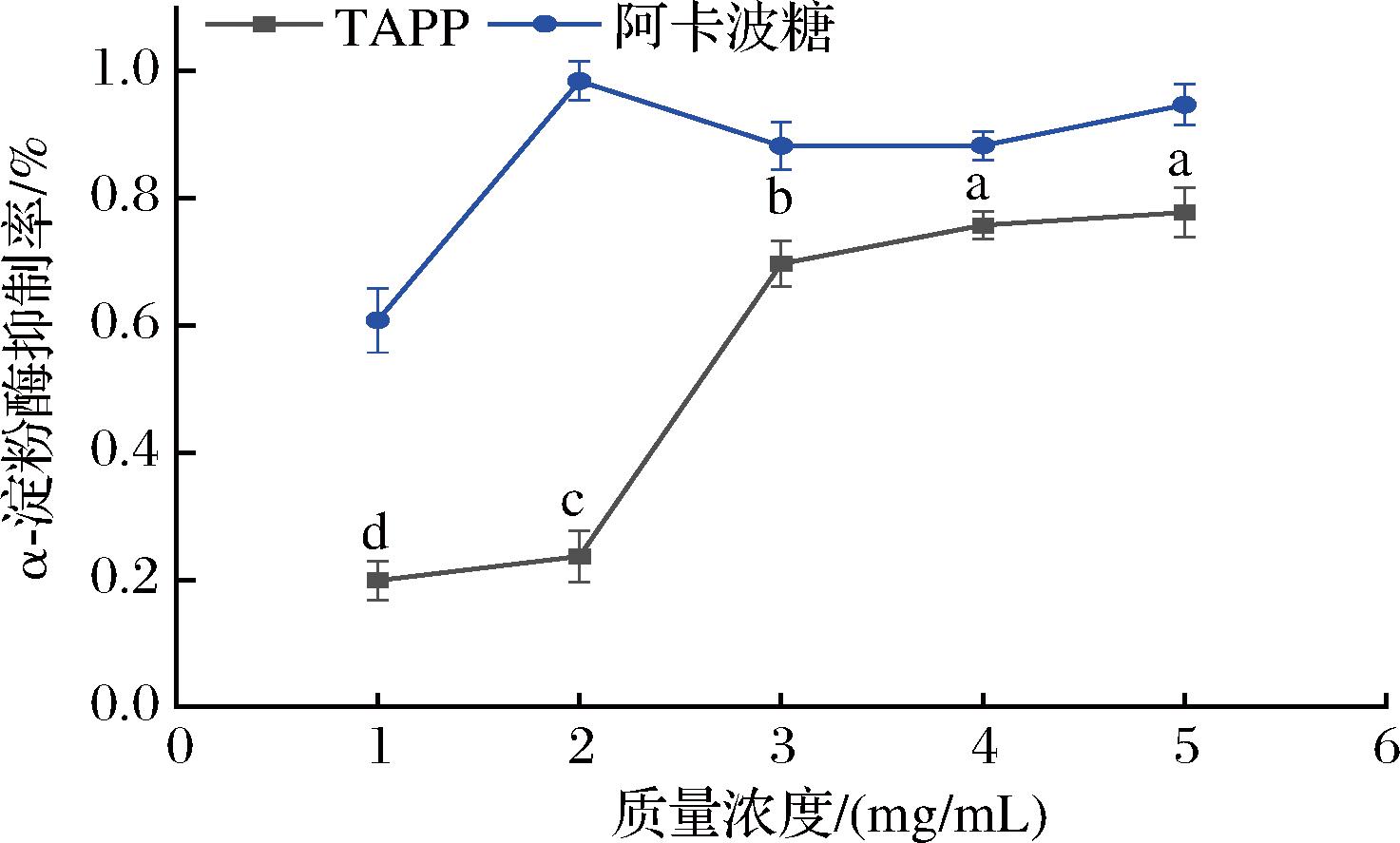
图9 TAPP对α-淀粉酶活性抑制率的影响
Fig.9 Inhibitory activity of TAPP on α-amylase
注:有一个相同标记字母的即为差异不显著,具不同标记字母的即为差异显著(下同)。
2.3.2 α-葡萄糖苷酶抑制
如图10所示,TAPP和阿卡波糖对α-葡萄糖苷酶的抑制随着浓度的增加而增加,IC50分别为1.900 mg/mL和0.027 mg/mL。尽管二者IC50相差较大,但是当TAPP浓度增加至2.0 mg/mL时,TAPP对α-葡萄糖苷酶的抑制率为(93.32±1.09)%,几乎接近于阿卡波糖的抑制效果。综上所述TAPP对α-葡萄糖苷酶具有较好的抑制效果,可作为一种潜在的α-葡萄糖苷酶的抑制剂,具有较好的降血糖的开发潜力。
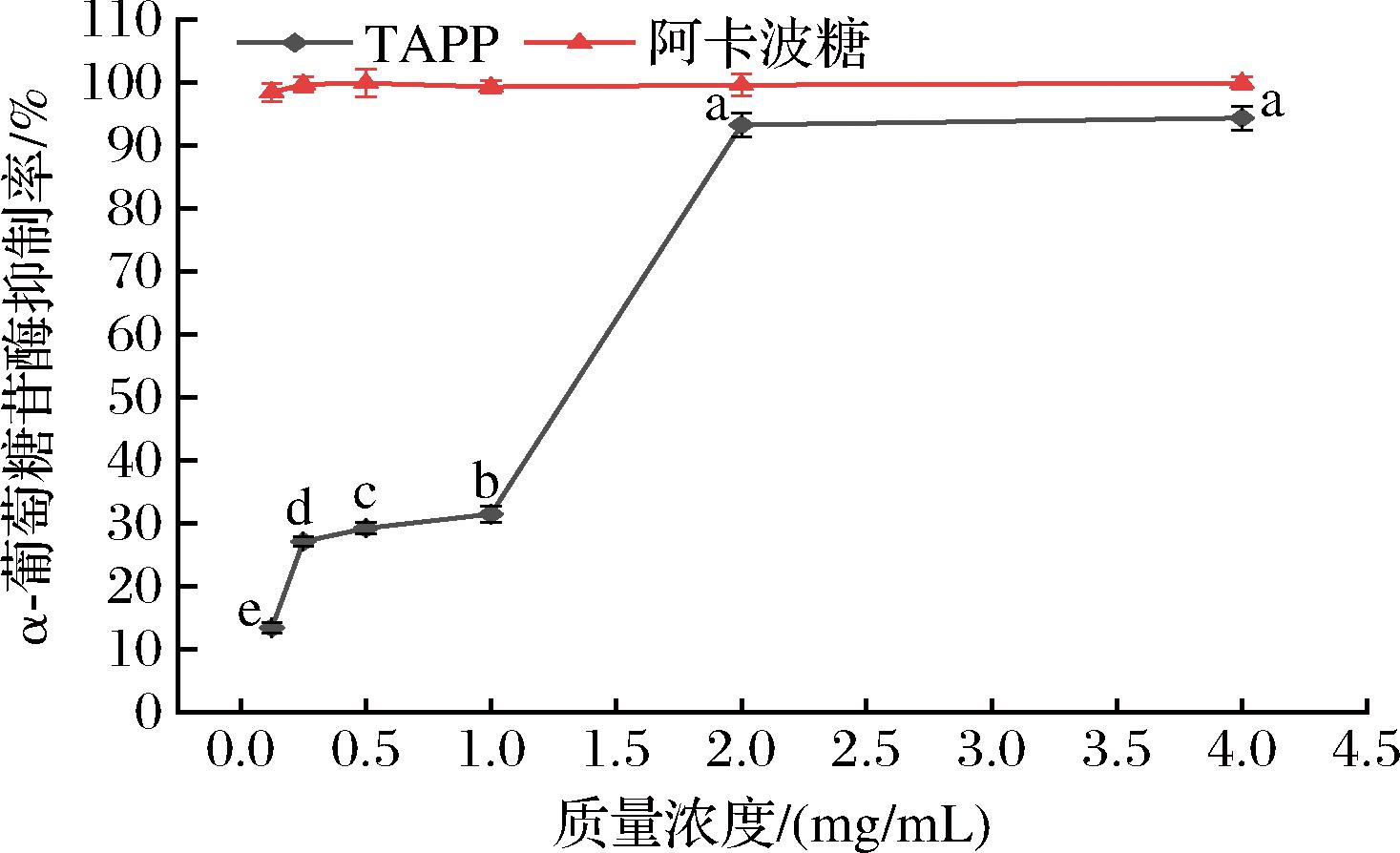
图10 TAPP对α-葡萄糖苷酶活性抑制率的影响
Fig.10 Inhibitory activity of TAPP on α-glycosidase
2.3.3 TAPP对HepG2-IR模型的胰岛素抵抗改善效果分析
2.3.3.1 TAPP对HepG2细胞活力的影响
图11所示为不同TAPP浓度对HepG2细胞活力的影响,与正常组相比,加入不同浓度的TAPP(0~500 μg/mL)细胞存活率并未与正常组表现出明显差异,说明TAPP在0~500 μg/mL对HepG2细胞无细胞毒性作用。
图11 TAPP对HepG2细胞活力的影响
Fig.11 Effects of TAPP on cell viability of HepG2
2.3.3.2 HepG2-IR模型的构建
如图12所示,当棕榈酸浓度为0.8 mmol/L、培养时间为24 h时,棕榈酸诱导组相比于正常组的葡萄糖消耗量减少了(30.99±0.62)%,表明在该条件下诱导的HepG2细胞胰岛素抵抗程度最高,确定的建模条件为:棕榈酸浓度为0.8 mmol/L、培养时间为24 h。
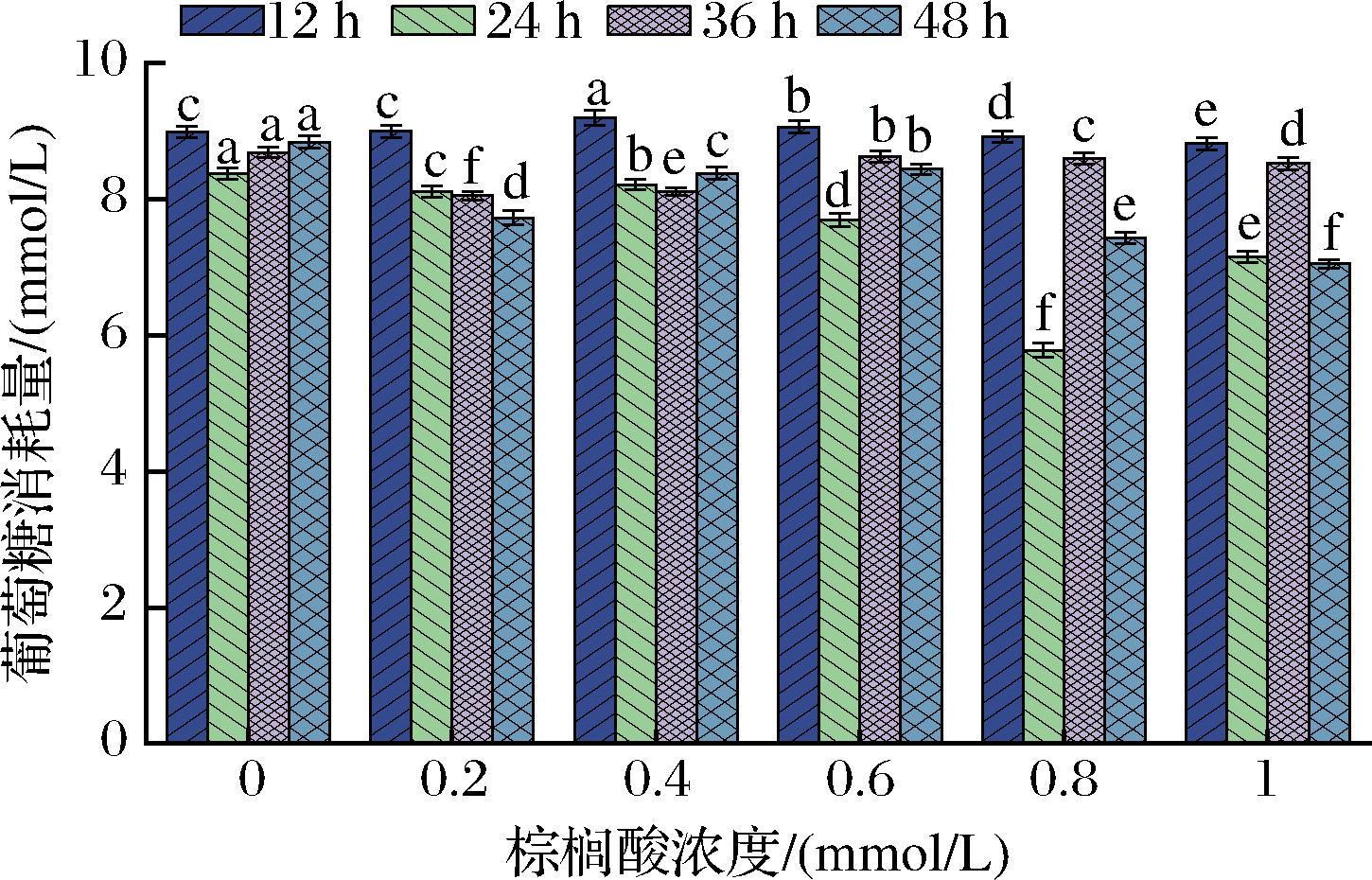
图12 HepG2-IR模型的建立
Fig.12 Establishment of HepG2-IR
2.3.3.3 HepG2-IR 模型的持续时间
由图13结果可知,培养时间在12~60 h,HepG2-IR模型组细胞与正常组细胞的葡萄糖消耗量都存在极显著差异(P<0.01),即存在胰岛素抵抗。同时,在培养60 h内,模型组的葡萄糖消耗量存在显著差异,表示胰岛素抵抗能力仍然较好,HepG2-IR模型稳定。

图13 HepG2-IR模型的稳定性
Fig.13 Stability of HepG2-IR
2.3.3.4 TAPP对HepG2-IR模型细胞葡萄糖消耗量的影响
如图14所示,模型组的葡萄糖消耗量显著低于对照组,盐酸二甲基双胍处理组与不同TAPP浓度处理组均明显提高了HepG2-IR模型细胞的葡萄糖消耗量,但均低于正常组。葡萄糖消耗量与TAPP浓度呈正相关,TAPP-25、TAPP-50、TAPP-75葡萄糖消耗量增加显著,表明TAPP可以有效增加HepG2-IR模型细胞的葡萄糖消耗量,改善胰岛素抵抗,具有降血糖开发的潜力。
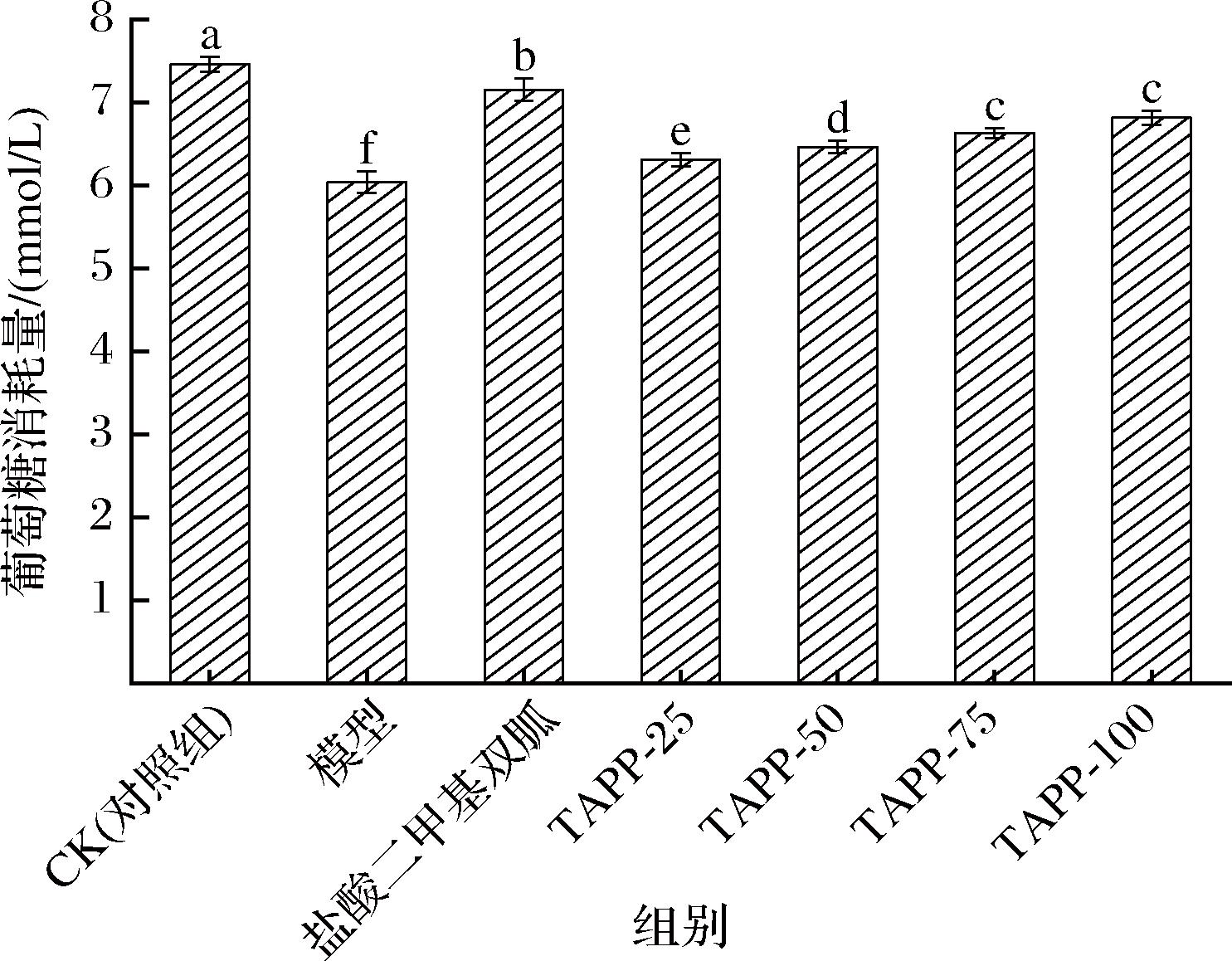
图14 TAPP对HepG2-IR模型细胞葡萄糖消耗量的影响
Fig.14 Effect of TAPP on glucose consumption of cells from HepG2-IR model
3 结论
从甘肃兰州地区培育金耳子实体中分离得到的TAPP是一种分子质量分布均一的酸性杂多糖(Mw=1.54×106 Da),其主要单糖组成为甘露糖、葡萄糖、木糖及葡萄糖醛酸。酶抑制实验结果表明,TAPP对α-淀粉酶和α-葡萄糖苷酶的抑制效果与浓度呈正相关,且对α-葡萄糖苷酶抑制效果尤为明显,当TAPP浓度为2.0 mg/mL时,对α-葡萄糖苷酶的抑制率达到(93.32±1.09)%,与阿卡波糖效果相近。TAPP浓度低于500 μg/mL时对HepG2无细胞毒性作用;当TAPP给药浓度达到75 μg/mL时,可以有效提高HepG2-IR模型细胞的葡萄糖消耗量,胰岛素抵抗症状改善情况显著(P<0.05)。综上所述,TAPP在降血糖应用方向具有一定的开发潜力,本研究为不同产地的金耳子实体多糖开发和高值化利用提供理了一定的理论基础和数据支撑。
[1] 杨林雷, 李荣春, 曹瑶, 等. 金耳的学名及分类地位考证[J]. 食药用菌, 2020, 28(4):252-255; 276.YANG L L, LI R C, CAO Y, et al. Research on the scientific name and taxonomic status of “Jin Er”[J]. Edible and Medicinal Mushrooms, 2020, 28(4):252-255; 276.
[2] 董昌金. 金耳菌丝体液体深层发酵和多糖提取研究[J]. 安徽农业科学, 2010, 38(1):342-344.DONG C J. Study on the liquid-submerged fermentation and polysaccharide extraction of Tremella aurantialba mycelia[J]. Journal of Anhui Agricultural Sciences, 2010, 38(1):342-344.
[3] 康林芝, 林小乔, 金磊, 等. 金耳深层发酵培养基筛选和条件优化研究[J]. 食用菌, 2019, 41(2):13-15; 39.KANG L Z, LIN X Q, JIN L, et al. Study on optimization of submerged fermentation medium and conditions for Tremella aurantialba Mycelium[J]. Edible Fungi, 2019, 41(2):13-15; 39.
[4] 刘子骐, 李众琪, 丁强, 等. 金耳酵母状孢子多糖双酶法提取工艺及其抗氧化性[J]. 食品研究与开发, 2023, 44(11):129-135;187.LIU Z Q, LI Z Q, DING Q, et al. Dual-enzymatic extraction process and antioxidant activity of polysaccharide from yeast-like conidia of Naematelia aurantialba[J]. Food Research and Development, 2023, 44(11):129-135; 187.
[5] 李兴恺, 张耀根, 姚皓昱, 等. 毛韧革菌胞外多糖的结构表征、抗氧化活性研究及发酵条件优化[J]. 食品与发酵工业, 2022, 48(21):36-41.LI X K, ZHANG Y G, YAO H Y, et al. Structure characterization, antioxidant activity and fermentation optimization of exopolysaccharide from Stereum hirsutum NX-22[J]. Food and Fermentation Industries, 2022, 48(21):36-41.
[6] 魏涛, 张静, 高兆兰. 金耳菌丝体多糖对高血糖小鼠血糖作用的研究[J]. 安徽农业科学, 2012, 40(12):7034-7035; 7052.WEI T, ZHANG J, GAO Z L. Hypoglycemic activity of polysaccharides extracted from Tremella aurantialba Mycelium in experimental diabetic mice[J]. Journal of Anhui Agricultural Sciences, 2012, 40(12):7034-7035; 7052.
[7] 张雯, 赵旌旌, 王捷思, 等. 金耳菌丝体多糖对实验性2型糖尿病大鼠的降血糖作用研究[J]. 天然产物研究与开发, 2010, 22(1):49-53.ZHANG W, ZHAO J J, WANG J S, et al. Hypoglycemic activity of polysaccharides extracted from Tremella aurantialba mycelia in experimental type 2 diabetic rats[J]. Natural Product Research and Development, 2010, 22(1):49-53.
[8] 黄年来, 吴经纶. 金耳菌种分离法初步研究[J]. 食用菌, 1983, 5(6):1-2.HUANG N L, WU J L. Preliminary study on isolation method of Auricularia auricula strains[J]. Edible Fungi, 1983, 5(6):1-2.
[9] 田果廷, 赵丹丹, 赵永昌. 金耳有效菌种的制备技术研究[J]. 西南农业学报, 2010, 23(5):1620-1624.TIAN G T, ZHAO D D, ZHAO Y C. Study on technology for spawn preparation for Tremella aurantialba[J]. Southwest China Journal of Agricultural Sciences, 2010, 23(5):1620-1624.
[10] 刘勇, 李春农. 金耳袋栽高产技术[J]. 农村科技开发, 1994(2):20.LIU Y, LI C N. High-yield techniques of Auricularia auricula bag cultivation[J]. Rural science and technology development, 1994(2):20.
[11] PAN L C, ZHU Y M, ZHU Z Y, et al. Chemical structure and effects of antioxidation and against α-glucosidase of natural polysaccharide from Glycyrrhiza Inflata Batalin[J]. International Journal of Biological Macromolecules, 2020, 155:560-571.
[12] WANG Y P, GUO M R. Purification and structural characterization of polysaccharides isolated from Auricularia cornea var. Li[J]. Carbohydrate Polymers, 2020, 230:115680.
[13] JRIDI M, NASRI R, MARZOUGUI Z, et al. Characterization and assessment of antioxidant and antibacterial activities of sulfated polysaccharides extracted from cuttlefish skin and muscle[J]. International Journal of Biological Macromolecules, 2019, 123:1221-1228.
[14] 汤陈鹏, 吕峰, 王蓉琳. 孔石莼多糖锌结构表征与体外降血糖活性[J]. 食品科学, 2020, 41(7):52-58.TANG C P, LÜ F, WANG R L. Structural characterization and hypoglycemic activity in vitro of Ulva pertusa polysaccharides-zinc complex[J]. Food Science, 2020, 41(7):52-58.
[15] WANG C, LI W W, CHEN Z Q, et al. Effects of simulated gastrointestinal digestion in vitro on the chemical properties, antioxidant activity, α-amylase and α-glucosidase inhibitory activity of polysaccharides from Inonotus obliquus[J]. Food Research International, 2018, 103:280-288.
[16] 陈建中, 葛水莲, 杨明建, 等. 太行菊黄酮对α-葡萄糖苷酶活性的抑制作用[J]. 食品与生物技术学报, 2023, 42(8):95-102.CHEN J Z, GE S L, YANG M J, et al. Inhibition of the α-glucosidase activity by the flavonoids from Opisthopappus taihangensis (Ling) Shih[J]. Journal of Food Science and Biotechnology, 2023, 42(8):95-102.
[17] CHEN L, TENG H, CAO H. Chlorogenic acid and caffeic acid from Sonchus oleraceus Linn synergistically attenuate insulin resistance and modulate glucose uptake in HepG2 cells[J]. Food and Chemical Toxicology, 2019, 127:182-187.
[18] 李卫旗, 何国庆, 李志昂. 金耳水溶性多糖JP-2的分离及化学结构的研究[J]. 中国食品学报, 2003, 3(3):13-17.LI W Q, HE G Q, LI Z A. Study on separation and chemical structure of water soluble polysaccharide JP-2 in Tremella aurantialba[J]. Journal of Chinese Institute of Food Science and Technology, 2003, 3(3):13-17.
[19] PENG G, WANG S S, ZHANG H S, et al. Tremella aurantialba polysaccharides alleviate ulcerative colitis in mice by improving intestinal barrier via modulating gut microbiota and inhibiting ferroptosis[J]. International Journal of Biological Macromolecules, 2024, 281:135835.
[20] XIE J H, WANG Z J, SHEN M Y, et al. Sulfated modification, characterization and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Food Hydrocolloids, 2016, 53:7-15.
[21] CHENG Y, XIE Y, GE J C, et al. Structural characterization and hepatoprotective activity of a galactoglucan from Poria cocos[J]. Carbohydrate Polymers, 2021, 263:117979.
[22] CHEN X, FANG D L, ZHAO R Q, et al. Effects of ultrasound-assisted extraction on antioxidant activity and bidirectional immunomodulatory activity of Flammulina velutipes polysaccharide[J]. International Journal of Biological Macromolecules, 2019, 140:505-514.