乌鳢(Channa argus),原产于中国、俄罗斯和朝鲜,是鲈形目鳢科、鳢属的底栖性鱼类,又称黑鱼、蛇头鱼等。它的营养含量丰富,鱼肉细腻,味道鲜美可口,无肌间刺,可食率高,深受大众喜爱,根据《2024中国渔业统计年鉴》[1]显示,2023年我国乌鳢的年产量为60.54万t,比2022年增长了9.44%,是我国的特色淡水鱼养殖品种。但由于乌鳢的水分与蛋白含量较高,因此其在被宰杀后品质下降较快,易导致鱼体的腐败变质,产生异味。基于此,在加工过程中,需要高效安全的保鲜方法。
微冻保鲜是低温保鲜的一种,它是将食品冷却至初始冰点的±0.5 ℃,使内部5%~30%的水分冻结形成冰晶的一种方法,它可以在延长货架期的同时,尽量减少冰晶对于鱼肉的破坏,抑制微生物活性以及酶分解速率。之前的研究结果表明[2-4],微冻保鲜相较于冷却保鲜(0~4 ℃),可以延长其保质期,相较于冷冻保鲜(-18 ℃),可以减少冰晶大量生成造成的损伤。但WU等[5]指出,相较于冷却保鲜,微冻保鲜会使持水力下降,可能导致从微冻状态恢复到常温后,食品更易腐败,但对于此研究的数据还较少。
因此,本实验以乌鳢为研究对象,将乌鳢分为2组,在冷却贮藏与微冻贮藏分别至二级鲜度后取出,置于10 ℃环境贮藏,并在此期间考察其菌落总数、挥发性盐基氮(total volatile base nitrogen,TVB-N)、pH值、硫代巴比妥酸(thiobarbituric acid,TBA)值、持水性(water holding capacity, WHC)、肌原纤维蛋白的含量、K值、质构特性、色泽、感官评价与微观结构等变化,为乌鳢在冷却、微冻以及在冷却与微冻状态恢复到10 ℃的保鲜研究提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
乌鳢(活体运输),购自上海市浦东新区芦潮港海鲜批发市场,每尾700~800 g,体长35~40 cm,尽量保持其体重、体长一致。
平板计数琼脂(plate count agar,PCA),广州环凯微生物科技有限公司;高氯酸、氢氧化钠、三氯乙酸、TBA,氯化钠、轻质氧化镁,国药集团化学试剂有限公司;Tris-HCl缓冲液,默克生命科学技术有限公司;ATP及其代谢物标准品(色谱纯),上海碧云天生物技术股份有限公司;BCA试剂盒,南京建成正浩科技有限公司。
1.2 仪器与设备
精创RC-4HC温湿度记录仪,江苏省精创电气股份有限公司;Kjeltec8400全自动凯氏定氮仪,丹麦FOSS公司;H-1850离心机,湖南湘怡实验室仪器开发有限公司;BS-210电子天平,德国Sartorius Instruments有限公司;CTX质构仪,美国Brookfield公司;U-3900/3900H分光光度计,日立高新技术(上海)国际贸易有限公司;CR-400色彩色差仪,柯尼卡美能达有限公司;FE28-Standard pH计,梅特勒托利多科技(中国)有限公司;Waters E2695高效液相色谱仪,美国Waters公司;XUEKE制冰机,深圳市森德制冰系统有限公司。
1.3 实验方法
1.3.1 样品处理
将活体乌鳢敲晕后清洗宰杀,去除头部、尾部、内脏与鱼皮,取背部肌肉,沿垂直脊柱方向切开,切为12 cm×5 cm×1.5 cm的鱼片,用蒸馏水清洗后擦干表面水分,分装至无菌袋中,置于碎冰中快速冷却。将乌鳢鱼片随机分为2组,第1组放置于4 ℃冰箱中冷却贮藏,记为C组;第2组置于密封袋中用冰盐混合物微冻法进行贮藏,记为S组。待C组与S组鱼肉分别达到二级鲜度后,分别随机取出一半鱼肉置于10 ℃环境贮藏,分别记为CT组与ST组。其中,C组与S组每3 d测一次指标,CT组与ST组每天测一次指标,直至鱼肉腐坏。
1.3.2 冻结点的测定
参照郑稳等[6]的方法,稍加改动,使用温度记录仪,连接电脑,设置记录时间间隔为10 s,持续时间8 h。将探头插入乌鳢背部肌肉中,确保鱼肉与探头紧密贴合、无空隙后,将乌鳢放入-18 ℃冰箱中冷冻,结束后将数据导入电脑,绘制乌鳢肌肉温度随时间变化的曲线,分析可得其冻结点。
1.3.3 菌落总数的测定
根据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》进行检测。
1.3.4 TVB-N的测定
根据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的自动凯氏定氮法进行检测。
1.3.5 pH值的测定
参考ZHOU等[7]的方法,称取5.0 g鱼肉,放入45 mL的煮沸并冷却的蒸馏水(鱼肉与水的配比为1∶9),用匀浆机匀浆,静置30 min后,用pH计进行测量,每个样品平行测定3次。
1.3.6 TBA的测定
参考ZHU等[8]的方法,稍加改动,称取2.0 g乌鳢鱼肉,搅碎,加入20 mL的质量分数为7.5%的三氯乙酸。均质摇匀后,静置30 min,在4 ℃下10 000 r/min离心10 min。用移液枪准确吸取5 mL上清液,其中加入5 mL 0.02 mol/L的TBA溶液,混匀,90 ℃水浴锅中水浴30 min后取出,冷却至室温,取上层溶液,在532 nm处测定吸光度。
1.3.7 WHC的测定
参考任丽琨等[9]的方法,准确称5.0 g鱼肉,包裹滤纸,在4 ℃下5 000 r/min离心10 min。除去滤纸、鱼肉表层和管内壁的汁液,称取鱼肉的总质量。测定重复3次。WHC按公式(1)计算:
(1)
式中:WHC,持水率,%;m0,离心前鱼肉质量,g;m1,离心后鱼肉质量,g。
1.3.8 肌原纤维蛋白的提取及测定
参考ZHANG等[10]的方法,稍加,提取肌原纤维蛋白。取2.0 g鱼背部肌肉搅碎,加入20 mL 0.05 mol/L KCl缓冲液A(pH为7.0),在冰水浴下均质,直至肌肉破碎。随后使用冷冻离心机以4 ℃,10 000 r/min离心15 min,收集沉淀,重复2次以上操作。加入20 mL 0.05 mol/L KCl缓冲液B(pH值为7.0),冰水浴下均质至肌肉破碎。静置2 h后,4 ℃,10 000 r/min离心15 min,取其上清液即为肌原纤维蛋白原液。缓冲液皆用0.02 mol/L Tris-HCl调整pH值为7.0,采用总蛋白定量测定试剂盒测定吸光度值并计算蛋白浓度。
1.3.9 K值的测定
参照SC/T 3048—2014《鱼类鲜度指标K值的测定 高效液相色谱法》进行测定。取2 g鱼背部肌肉搅碎,用高氯酸提取,用NaOH溶液将pH值调至6.0,沉淀,0.22 μm微孔滤膜过滤,置于-80 ℃下存放备用。用高效液相色谱通过紫外检测器进行检测,用标准样品对照,得出乌鳢鱼肉ATP及其降解产物的含量,通过计算得到K值。K值按公式(2)计算:
(2)
式中:次黄嘌呤核苷(hypoxanthine riboside,HxR),μmol/g;次黄嘌呤(hypoxanthine,Hx),μmol/g;三磷酸腺苷(adenosine triphosphate,ATP)的含量,μmol/g;二磷酸腺苷(adenosine diphosphate,ADP)的含量,μmol/g;一磷酸腺苷(adenosine monophosphate,AMP)的含量,μmol/g;一磷酸肌苷(inosine monophosphate,IMP),μmol/g。
1.3.10 质构分析
选取1.5 cm×1.5 cm×1.5 cm的乌鳢背部肌肉块,采用质构仪每组随机取5块,选用P50探头,测前速度3 mm/s,测试速度1 mm/s,测试后速度4 mm/s,维持时间5 s,触发力5 g,形变量50%,来回2次,对乌鳢的硬度、弹性、咀嚼性、凝聚性、胶黏性、回复性等进行测定,取平均值。
1.3.11 色泽分析
随机选取乌鳢鱼肉,测量前,使用标准白色和黑色板校准,使用色彩色差仪对其亮度L*、红绿值a*、黄蓝值b*进行测定,每个样品平行测定5次并取平均值。
1.3.12 感官评价
根据LI等[11]的方法对生乌鳢鱼片进行感官分析,并稍加改动。选出10名训练有素的专门小组成员按照表1对乌鳢鱼片的色泽、气味、组织与弹性等4个方面进行感官评价。加权感官值(the weighted sensory index, SI)的总分100分,当SI≤60时,表明乌鳢鱼片已经腐败不可接受。
(3)
表1 乌鳢感官评价表
Table 1 Sensory evaluation table of Channa argus

色泽气味组织弹性分值色泽乳白有光亮鱼香味 组织细密 弹性好,按压后凹陷部位立即消失81~100色泽乳白稍有光亮无异味 组织较细密弹性较好,按压后凹陷部位消失较快61~80色泽乳白光泽稍差略有异味组织略松散弹性一般,按压后凹陷部位消失慢41~60色泽较黄光亮淡腥臭味 组织松散 弹性不好,按压后凹陷部位消失很慢21~40暗黄发绿无光泽腐败臭味组织散乱 无弹性,按压后凹陷部位不恢复0~20
式中:SI,加权感官值,分;C,色泽的分值,分;O,气味的分值,分;T,组织的分值,分;E,弹性的分值,分。
1.3.13 微观结构
取乌鳢背部肌肉,切为薄片,先用体积分数为2.5%戊二醛溶液浸泡24 h,再根据体积分数50%、70%、80%、95%、100%的乙醇依次脱水,每次10 min,然后将鱼肉作冻干、喷金处理,用扫描电镜进行观察。
1.4 数据处理
所有实验均基于完全随机区组设计,使用Excel 2019进行数据记录与整理,用IBM SPSS Statistics 27进行单因素方差分析、最小显著性差异分析(P<0.05),并进行邓肯(Duncan)检验,使用Origin 2022进行图形的绘制。
2 结果与分析
通过预实验对于TVB-N、菌落总数及感官品质等综合测定与分析,乌鳢鱼肉的新鲜状态在4 ℃冷却贮藏的第3天与在-2 ℃微冻贮藏的第6天十分相近,因此选用这2天的乌鳢鱼肉作为CT组与ST组,将两者置于10 ℃条件下贮藏,观察冷却与微冻过的乌鳢鱼肉在新鲜状态几乎相同的情况下,恢复到10 ℃左右后的腐败情况并进行比较。
2.1 冻结点的确定
乌鳢的冻结曲线如图1所示。本实验采用自动测温仪,在-18 ℃的环境中,未出现过冷现象,鱼肉从初始温度13.4 ℃,在90 min内释放显热,快速降温至-0.9 ℃,而后出现平坦时期,稳定在-0.9 ℃处轻微波动,此时鱼肉中大部分水冻结为冰,放出大量相变潜热,而温度没有明显变化,持续约180 min后,温度快速下降,直至冻结终温。由此可得乌鳢的冻结点为-0.9 ℃,微冻温度通常为冻结点±0.5 ℃[12],而介质温度通常微低于被冻鱼的温度,因此,选用-2 ℃作为乌鳢的微冻贮藏温度。
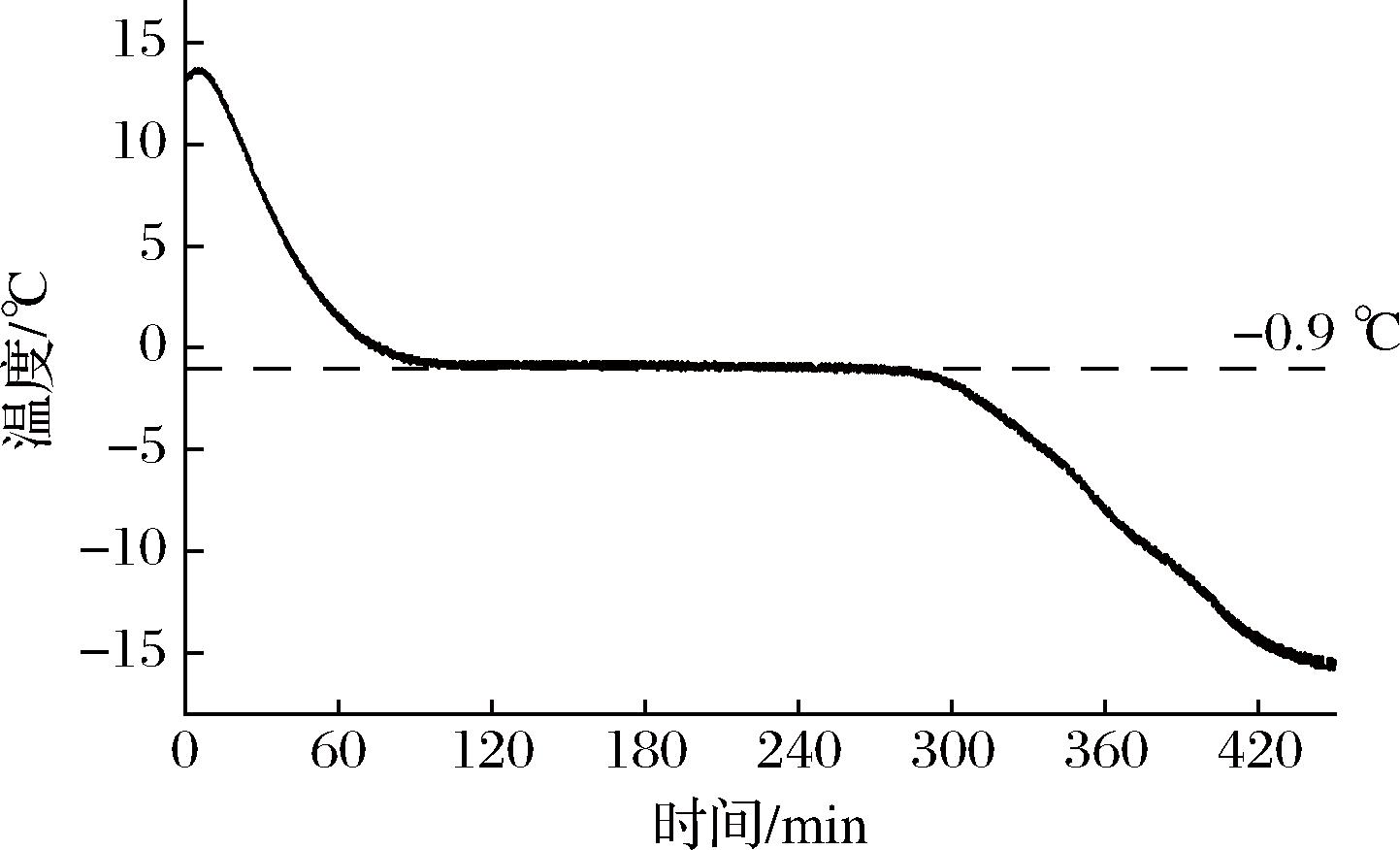
图1 乌鳢冻结曲线
Fig.1 Freezing curve of Channa argus
2.2 菌落总数
乌鳢贮藏期间菌落总数的变化如图2所示。乌鳢鱼肉的初始菌落总数为3.92 lg CFU/g,C组的菌落总数在鱼肉贮藏期间快速增加,在第12天到达7.02 lg CFU/g,超过了国际微生物规格委员会(ICMSF)食品微生物限量规定[13]对于淡水鱼的微生物的可接受极限(7.00 lg CFU/g)。S组鱼肉菌落的生长显著慢于C组(P<0.05),在第21天时达到7.16 lg CFU/g,比C组晚9 d超过可接受极限。CT组与ST组在贮藏第3天、第6天置于10 ℃后,分别在第6天、第9天时达到6.68 lg CFU/g、5.73 lg CFU/g,此时C组第6天的菌落总数为5.50 lg CFU/g,S组第9天的菌落总数为4.84 lg CFU/g,置于10 ℃后,CT组与ST组菌落总数快速增加。CT组在置于10 ℃后的第4天达到7.23 lg CFU/g,ST组在置于10 ℃后的第5天达到7.04 lg CFU/g,超过食用极限,2组菌落总数增加速度相近,无显著差异。微冻对于鱼肉的菌落生长的抑制作用优于冷却贮藏,这与ELIASSON等[14]在考察微冻对大西洋鳕鱼货架期影响时的结果相似,微冻使鱼肉内5%~30%的水分冻结,细胞胞浆浓度增加,抑制了微生物活性,减缓了微生物繁殖的速度[15]。
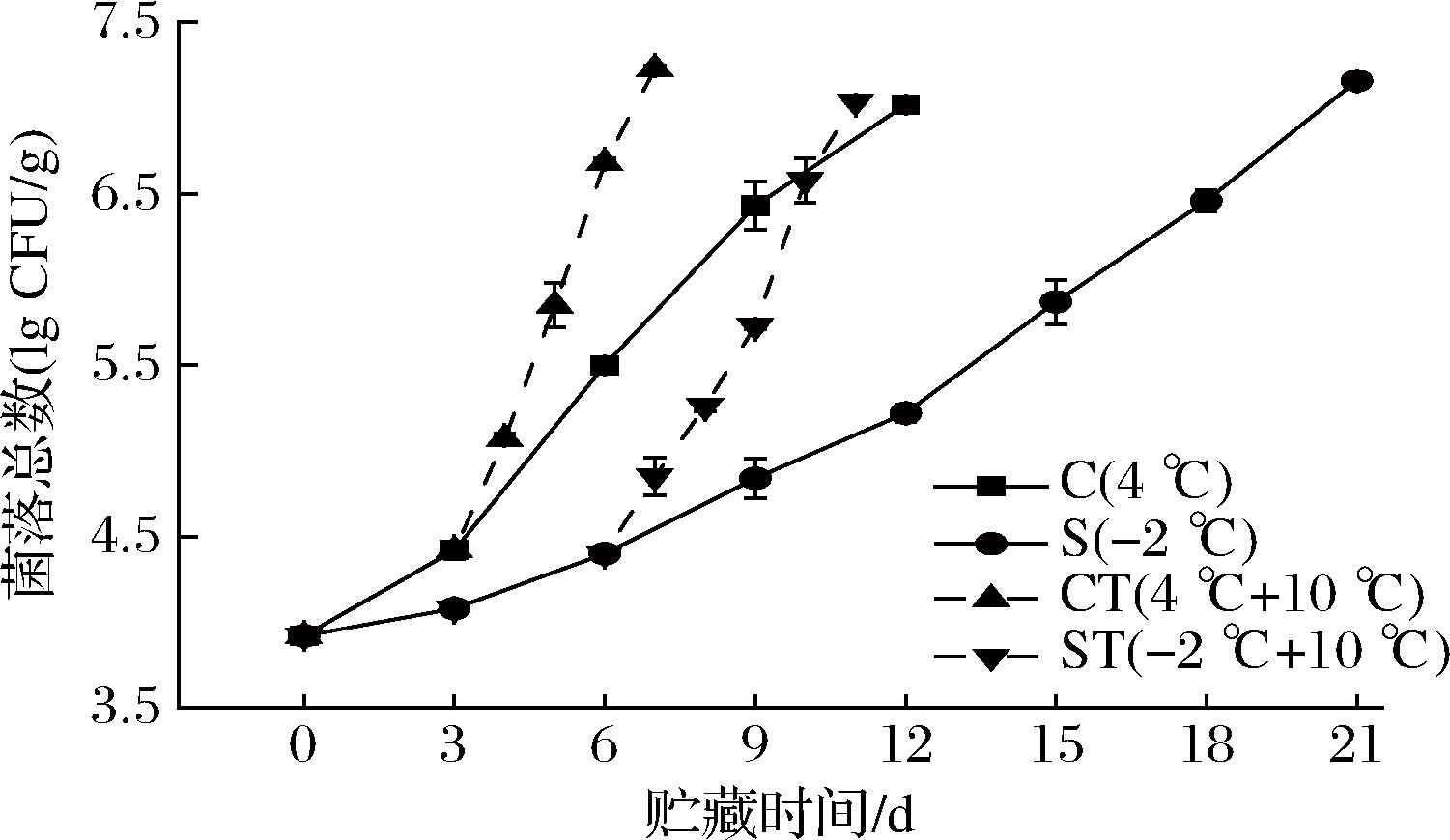
图2 乌鳢贮藏期间菌落总数的变化
Fig.2 Changes in TVC of C.argus during storage
2.3 TVB-N值
TVB-N常被用作蛋白质和胺降解的生物标志物,它与微生物活动及自身内源酶有关,常用于评价水产品的新鲜度。根据GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》,淡水鱼虾的TVB-N限值为20 mgN/100 g。如图3所示,各组初始值为8.65 mgN/100 g,C组与S组前6 d数值平缓上升,没有显著性,自第6天开始,4 ℃下贮藏的C组数值相较S组显著上升(P<0.05),这与菌落总数的菌落增长趋势相似。在第12天,C组与S组的TVB-N值分别为22.04 mgN/100 g与14.48 mgN/100 g,微冻的处理显著延缓了TVB-N的积累,这是因为微冻抑制了微生物活动与酶的活性,使得蛋白质的分解减缓,碱性含氮物质积累较少[16]。S组鱼肉的TVB-N值在第18天达到20.43 mg N/100 g,超过食用极限,较C组推迟了6 d。CT组与ST组置于10 ℃后,TVB-N值增长迅速,分别在贮藏的第7、11天超过国家限定值,但它们的TVB-N值没有显著性(P>0.05),其增长速率相似,可能是因为在置于10 ℃断链之前,微冻对于乌鳢鱼肉冰晶的生成所致的机械伤害较小,前期较低的温度抑制了蛋白的降解与其他含氮物质的积累,因此在10 ℃环境下,CT组与ST组没有出现与持水性指标中相似的显著差别。
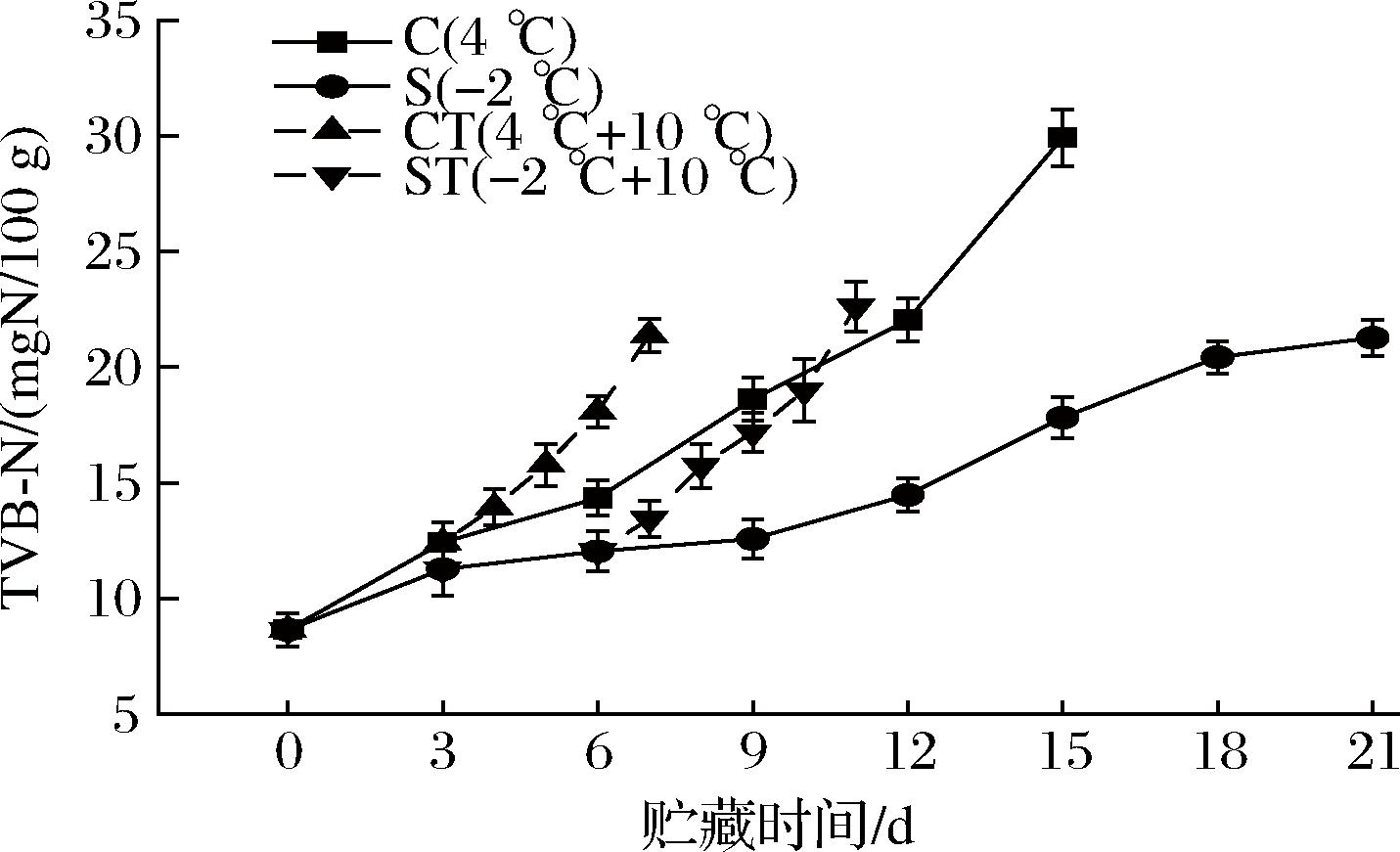
图3 乌鳢贮藏期间TVB-N的变化
Fig.3 Changes in TVB-N of C.argus during storage
2.4 pH值
随着鱼体的死亡,其体内进行糖酵解反应,乳酸蓄积,导致鱼肌肉的pH不断下降;而在鱼体自溶阶段,蛋白质被水解酶(如蛋白酶等)分解为氨基酸及碱性物质,鱼肌肉的pH便又会上升。如图4所示,各组pH值均先降低后升高,初始pH值为6.64。C组冷却贮藏于第6天降至最低点6.19,S组微冻于第9天降至最低点6.12,而后皆呈上升趋势,S组微冻上升较C组冷却上升缓慢,趋势显著(P<0.05),这是因为pH的上升与鱼体自溶的快慢有关,温度是影响自溶的主要因素。较低的温度使S组鱼肉的水解酶活性降低,使蛋白质分解的速度下降,碱性物质产生较慢,因此pH增长减缓。
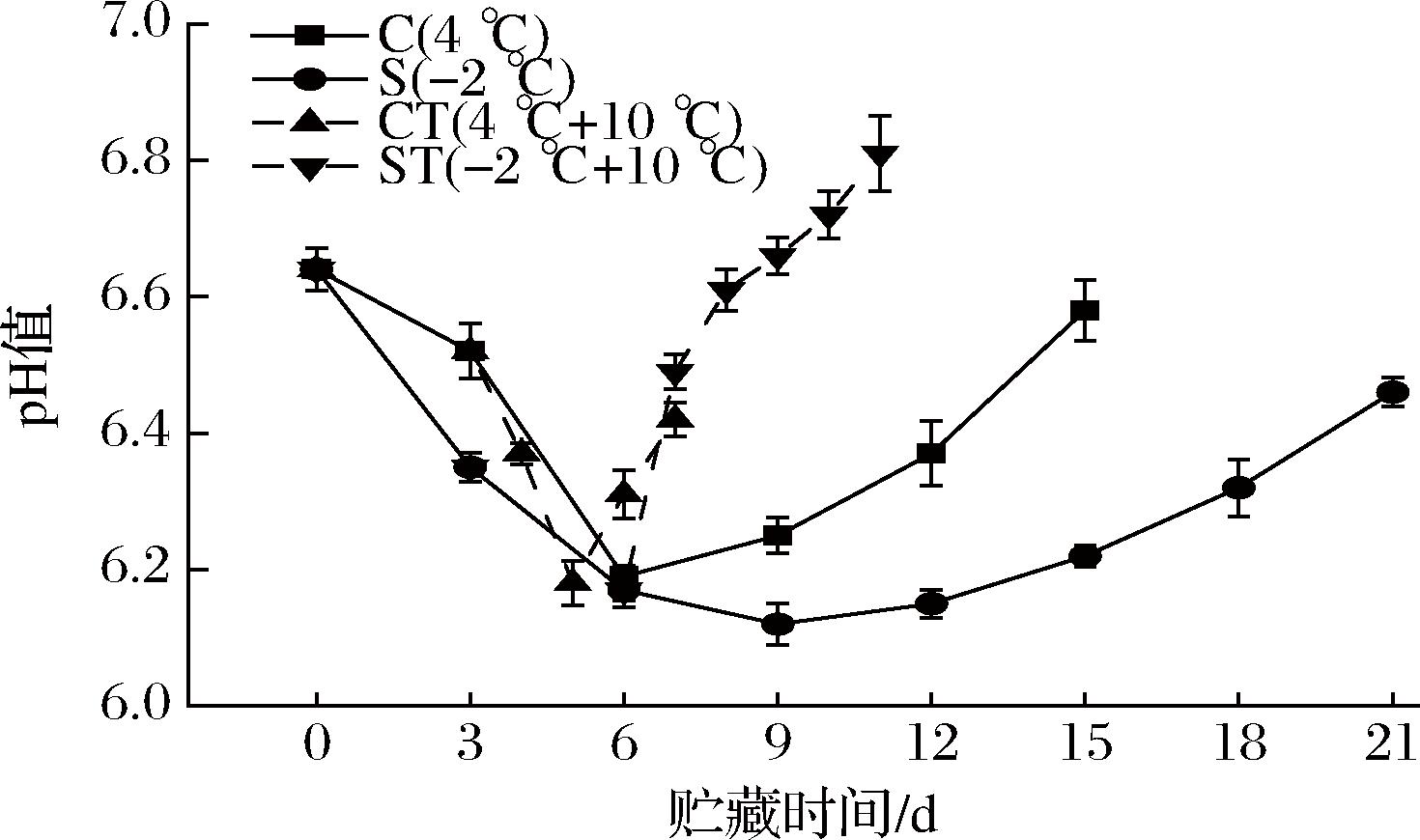
图4 乌鳢贮藏期间pH的变化
Fig.4 Changes in pH of C.argus during storage
CT组自置于10 ℃后的第2天快速降至最低点6.18,与C组的最低点相近,而后快速上升;ST组于pH值为6.17时置于10 ℃后,pH未再下降,直接上升,在置于10 ℃后的第5天上升至6.81。pH的升高与TVB-N的含量有很强的正相关关系,这与较高pH下特定腐败微生物增殖的有利环境有关[17]。在乌鳢鱼肉置于10 ℃后,pH上升显著,这可能是因为高pH加剧了微生物从糖原依赖型向蛋白质降解型的逐步转变,作用于氨基酸等低分子化合物的微生物和内源性酶在高pH值时生长更加旺盛,分解碱性氨化合物,进而提高pH值[18]。
2.5 TBA值
TBA是可以反映水产品脂质氧化程度的指标。丙二醛(malondialdehyde,MDA)是多不饱和脂肪酸氧化过程中形成的脂质氢过氧化物和过氧化物的降解产物之一,通过一个分子的MDA与2个分子的2-硫代巴比妥酸反应,形成粉红色络合物的分光光度进行测定[19]。如图5所示,贮藏过程中,各组TBA值都呈上升趋势,在第3天到第6天时,都显著增加(P<0.05)。贮藏的第6天,C组冷却贮藏的TBA从初始的0.09 mg MDA/kg快速升高到0.75 mg MDA/kg后,上升趋势变缓,而S组微冻贮藏在0.60 mg MDA/kg后就开始变缓,上升幅度小于C组,在第15天时,C组TBA达到0.96 mg MDA/kg,此时S组为0.86 mg MDA/kg,说明微冻可以减缓脂质的氧化,可能是因为低温抑制乌鳢鱼肉内脂肪氧化酶的活性,这与陈依萍等[20]对于微冻鲟鱼肉脂肪氧化所描述的一致。而ST组微冻后置于10 ℃的鱼肉开始的TBA值比CT组冷却后置于10 ℃的鱼肉较高,在贮藏后期趋于一致,这可能是因为微冻给乌鳢肌肉造成的机械性损伤所致。
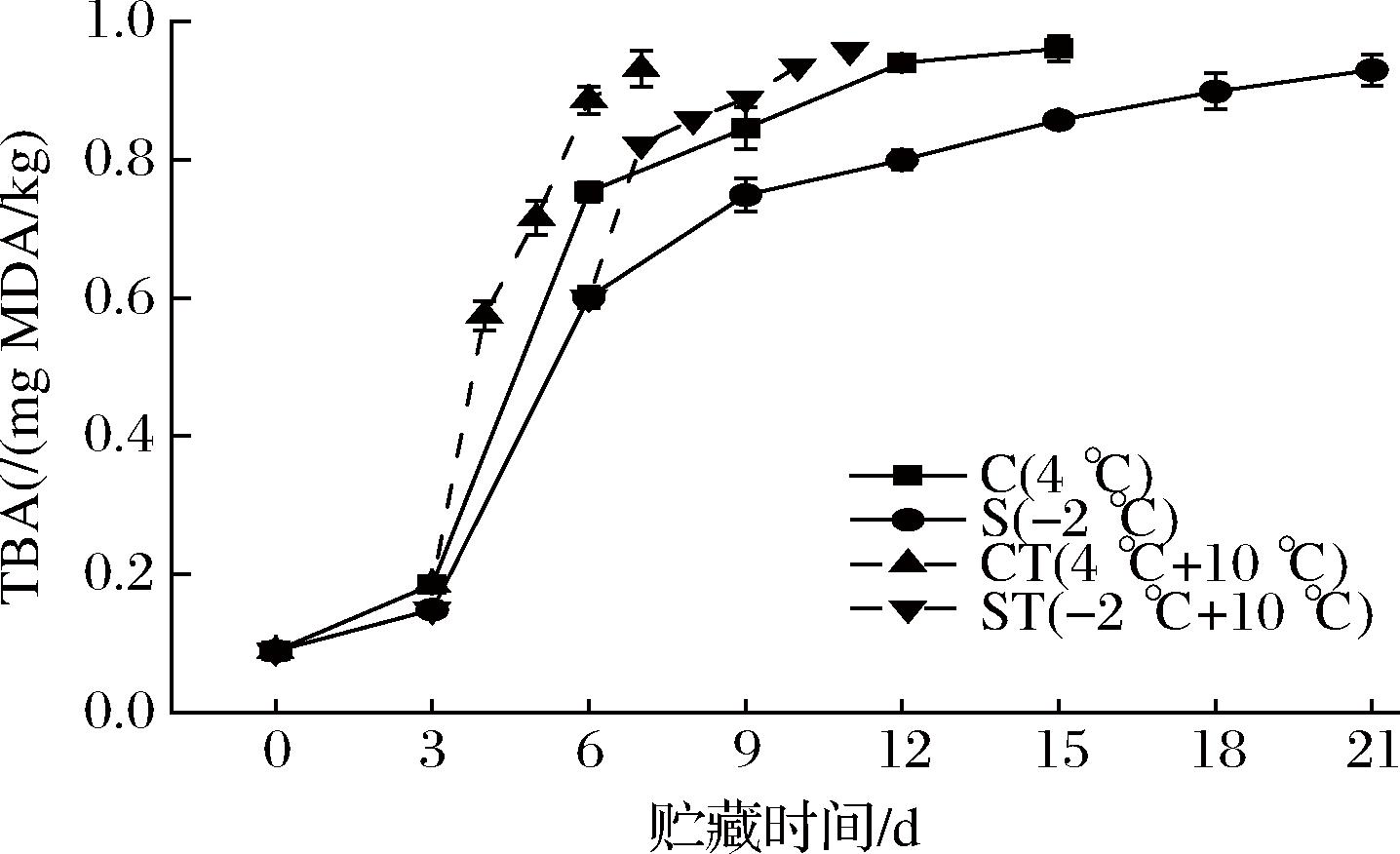
图5 乌鳢贮藏期间TBA的变化
Fig.5 Changes in TBA of C.argus during storage
2.6 WHC
WHC是肌肉的持水能力,表现为肌肉受到外力的作用时,保持原本水分的能力[21],它是判断鱼肉品质的一个重要参数。如图6所示,随着贮藏时间的延长,各组持水性呈下降趋势。贮藏末期,C组和S组的持水性分别比初期下降了13.88%、22.06%。在0~6 d时,微冻贮藏的S组的持水性比冷却贮藏的C组高,而6 d后,S组持水性迅速下降,这是可能因为在微冻过程前期,鱼肉部分冻结,但冰晶生成较少,蛋白降解和膜结构的破坏较小,因此下降较为缓慢,而冷却贮藏的鱼肉在僵硬和解僵过程中,肌原纤维收缩,使得其内部的水分逐渐被挤压到外面,造成鱼肉的持水力下降[22]。一段时间后,微冻组由于贮藏时不可避免的温度波动,导致冰晶反复冻融,生成重结晶,冰晶的增加破坏了细胞结构,造成其机械损伤,蛋白质高分子网状立体结构被破坏,导致汁液流失,持水能力下降[23]。ST组在微冻到第6天置于10 ℃后,持水性较CT组显著下降,可能是因为微冻时部分水结冰,酶的浓度增加,剩余水中的盐浓度增加,导致蛋白质变性[24],置于10 ℃后,冰晶造成的机械损伤相较于CT组更多,因此持水性下降更快。在贮藏末期,各组持水性均略有上升,这是因为蛋白质的降解产物带来更多的静电荷,使肌纤维重新将滞留在细胞膜和肌束膜之间的水分重新吸收,因此会获得较好的持水性[25]。
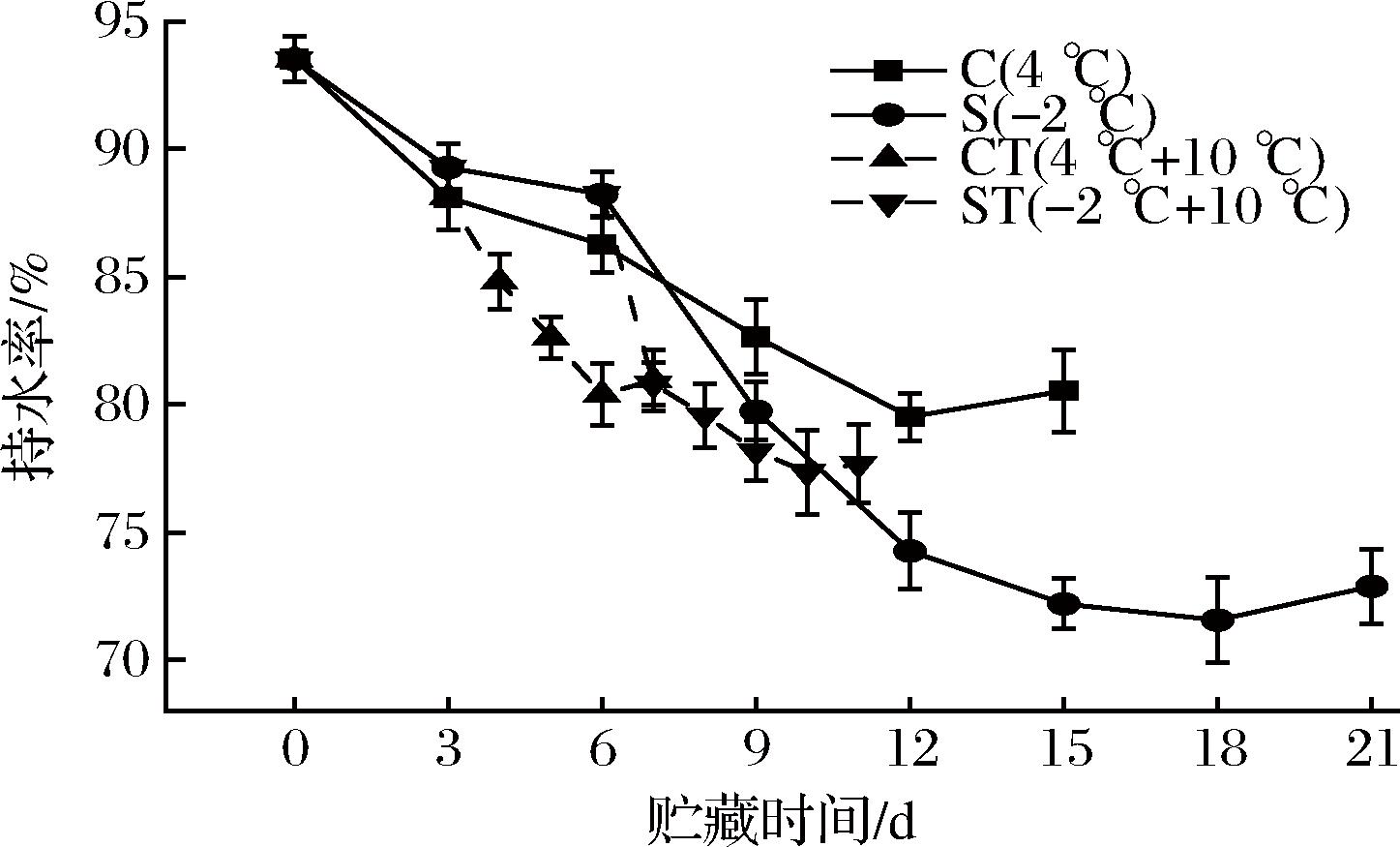
图6 乌鳢贮藏期间持水性的变化
Fig.6 Changes in WHC of C.argus during storage
2.7 肌原纤维蛋白的含量
肌原纤维蛋白主要由肌球蛋白、原肌球蛋白、肌动蛋白等小分子蛋白组成,它占肌肉总蛋白的55%~65%,是鱼肉蛋白的主要成分,它的含量与蛋白质的功能性质,如凝胶性质、流变性质和乳化性质高度相关[26]。如图7所示,4组的蛋白含量均呈下降趋势,初始肌原纤维蛋白含量为5.58 mg/mL,在第15天,冷却C组与微冻S组分别降为2.61 mg/mL、3.55 mg/mL,下降了53.23%、36.38%。实验结果表明,温度越低,对乌鳢鱼肉的肌原纤维蛋白的变性抑制效果越好。在置于10 ℃后,CT组与ST组的蛋白含量皆迅速下降,相比较来说差异不显著(P>0.05),在置于10 ℃的4天中,CT组与ST组分别下降了41.54%、41.28%。这个结果说明,微冻的低温并没有对乌鳢鱼肉的肌原纤维蛋白造成明显的破坏,以至于在新鲜度相似的条件下置于10 ℃后,与冷却保鲜的鱼肉蛋白降解程度相近。
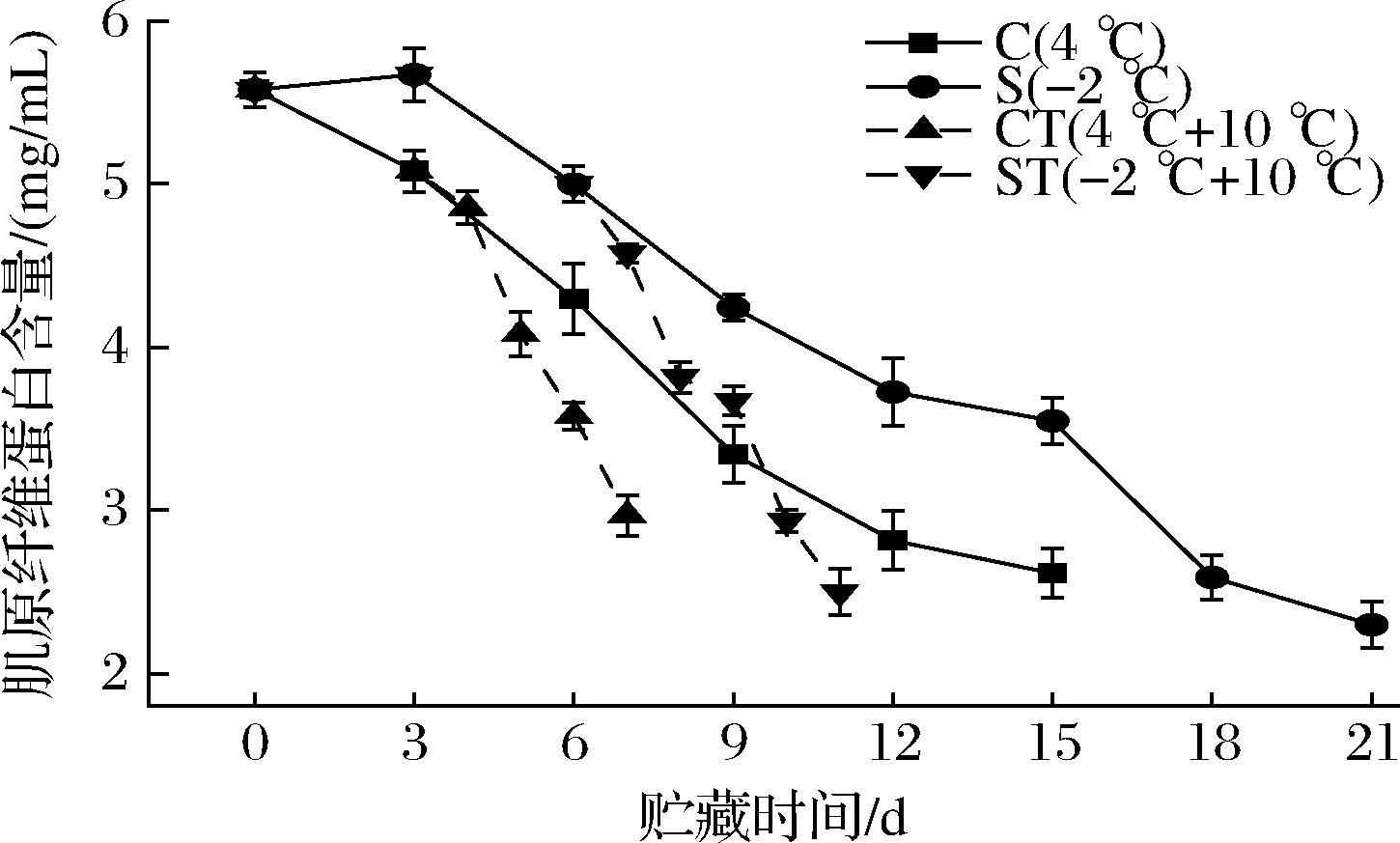
图7 乌鳢贮藏期间肌原纤维蛋白含量的变化
Fig.7 Changes in MP content of C.argus during storage
2.8 K值
K值是ATP的降解产物HxR、Hx的量之和与ATP关联化合物——ATP、ADP、AMP、IMP、HxR、Hx的总量的百分比,它是评价水产品新鲜度的一种指标。一般认为,K值<10%为新鲜水产品,K值>70%为腐败水产品[27]。乌鳢鱼肉在冷却与微冻贮藏期间的K值变化如图8所示,随着贮藏时间的变化呈上升趋势。微冻贮藏的S组的上升趋势相较于冷却贮藏的C组更加平缓一些,C组在第12天K值就达到了71.28%,超过了可食用的限制,而S组在第18天的K值为75.06%,延长了6 d时间。这表明微冻贮藏能够抑制ATP酶等内源酶的活性,减缓了ATP及其降解产物的分解进程。经过冷却与微冻贮藏后置于10 ℃的乌鳢鱼肉K值如图8所示。在初始K值相似的情况下,经过微冻贮藏的ST组的K值增长速率高于经过冷却贮藏的CT组,但在贮藏末期其K值趋于相等,几乎同时超过70%,这可能是因为微冻导致的冰晶生成所造成的机械损伤使得肌质网中的Ca2+被加速释放,将肌球蛋白头部带有的ATP酶激活,加速分解ATP,以至于K值快速增加。
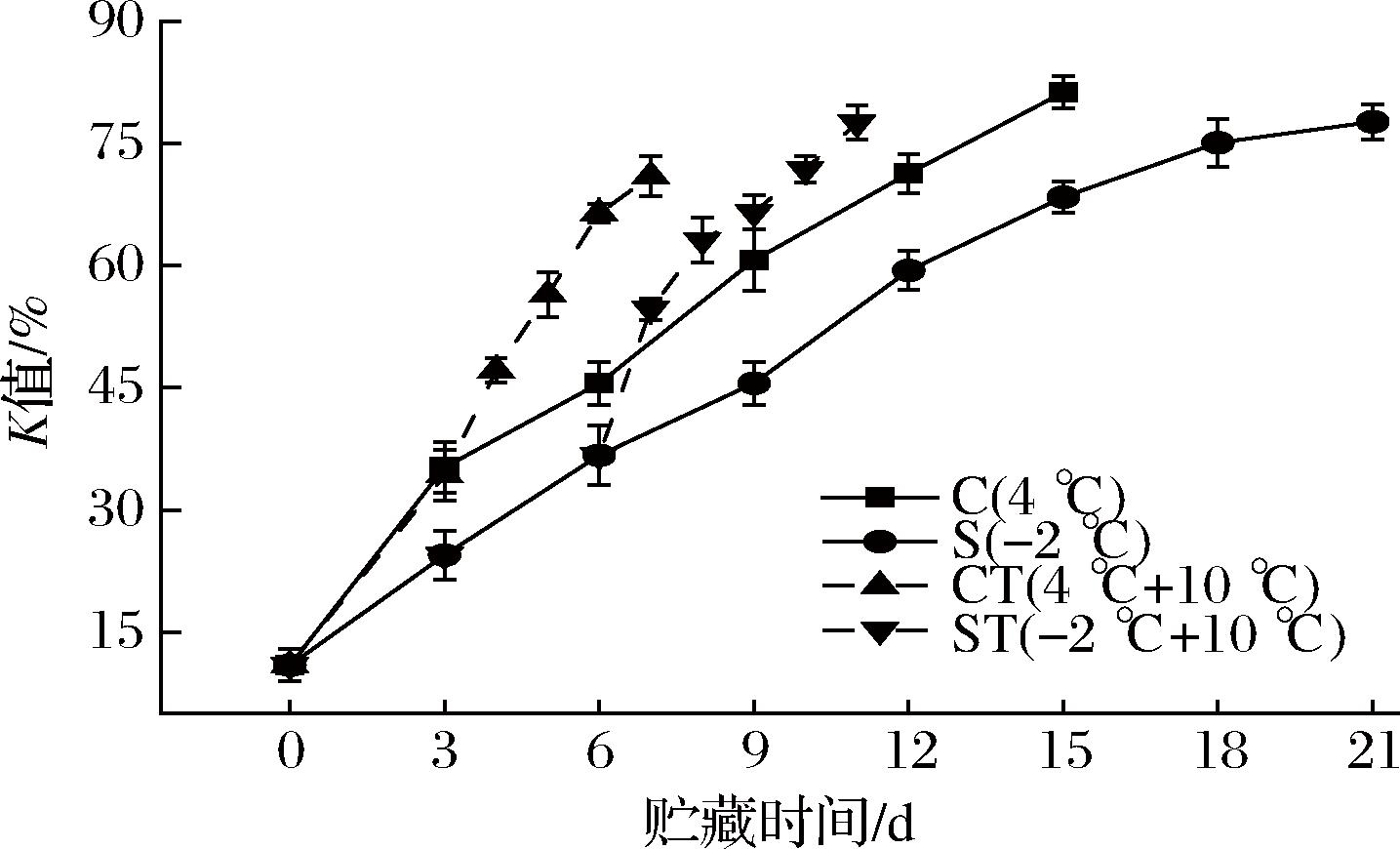
图8 乌鳢贮藏期间K值的变化
Fig.8 Changes in K values of Channa argus during storage
2.9 质构特性分析
鱼被宰杀后其组织结构发生变化,会导致鱼肉质构特性的改变。其中,质构特性包括硬度、弹性、胶黏性等,能够直观地反映鱼肌肉在贮藏期间质构的劣化,是评价水产品的重要指标。如表2所示,C组、S组乌鳢鱼肉的硬度呈先上升后下降的趋势,这与胶黏性、咀嚼性的变化一致。这是因为乌鳢在宰杀后进入了僵直期,鱼肌肉收缩,保水性下降,导致其硬度上升,而后鱼肉在自溶期时,由于水解酶(包括蛋白酶、脂肪酶、淀粉酶等)的作用,蛋白质逐渐分解,肌肉松弛变软,硬度下降[28]。C组、S组乌鳢鱼肉在第15天时硬度分别下降了56.43%、43.22%,胶黏性分别下降了69.97%、45.70%,咀嚼性分别下降了76.30%、51.58%。结果表明,微冻能抑制水解酶的活性,减缓鱼肉蛋白的分解,这与下文冷却与微冻条件下肌原纤维蛋白含量的变化吻合。如表3所示,CT组与ST组鱼肉的硬度皆呈下降趋势,在置于10 ℃后第4天时,相较于刚放入10 ℃,CT组与ST组乌鳢鱼肉的硬度分别下降了65.92%、41.49%,胶黏性分别下降了68.56%、54.12%,咀嚼性分别下降了65.80%、12.90%。而下文CT、ST组肌原纤维蛋白的变化不显著,这可能是因为微冻抑制了乌鳢僵直期时ATP酶的活性,使得乌鳢的僵直期延长,因此ST组的硬度下降较慢。
表2 乌鳢冷却与微冻贮藏期间质构的变化
Table 2 Changes in TPA of C.argus during chilling and superchilling storage

组别时间/d硬度/g弹性凝聚性胶黏性咀嚼性回复性C04 027.48±424.54ab0.83±0.03a0.61±0.01a2 436.47±240.06b1 958.98±50.90a0.36±0.01a34 796.01±311.60a0.69±0.03b0.57±0.01b2 994.59±227.46a1 981.69±77.75a0.31±0.01b63 502.99±415.30b0.67±0.01bc0.54±0.01bc1 872.77±133.88c1 255.71±99.68b0.30±0.03b92 585.22±411.19c0.61±0.02d0.52±0.01c1 638.60±77.51cd887.32±35.71c0.28±0.01b122 196.57±283.12c0.63±0.02cd0.52±0.01c1 247.96±186.76d788.08±116.84c0.28±0.03b151 754.78±337.38c0.58±0.03d0.50±0.03c731.76±55.10e464.34±54.02d0.27±0.01bS04 027.48±424.54b0.83±0.03a0.61±0.01a2 436.47±240.06b1 958.98±50.90b0.36±0.01a35 296.01±395.51a0.81±0.01a0.59±0.02ab3 214.81±283.90a2 448.80±105.17a0.36±0.01a63 777.87±289.59b0.78±0.04a0.58±0.02abc2 008.60±113.15c1 671.29±52.41c0.34±0.01a92 859.21±330.13c0.69±0.02b0.55±0.01bcd1 562.28±112.64d1 093.57±21.89d0.33±0.01ab122 529.46±210.65cd0.63±0.01c0.56±0.02bcd1 412.81±76.14de967.78±26.08de0.31±0.02bc152 286.98±323.66cd0.60±0.04c0.54±0.01cd1 322.95±34.27def948.56±46.68e0.30±0.01bc182 008.91±116.06d0.62±0.01c0.56±0.01de1 167.05±13.34ef862.07±44.85e0.29±0.01cd211 949.05±128.54d0.59±0.01c0.50±0.01e989.59±55.70f587.23±50.33f0.27±0.02d
注:同列不同的小写字母表示同组在不同贮藏时间差异显著(P<0.05),(下同)。
表3 乌鳢置于10 ℃后冷却与微冻贮藏期间质构的变化
Table 3 Changes in TPA of C.argus during chilling and superchilling storage after exposure to 10 ℃
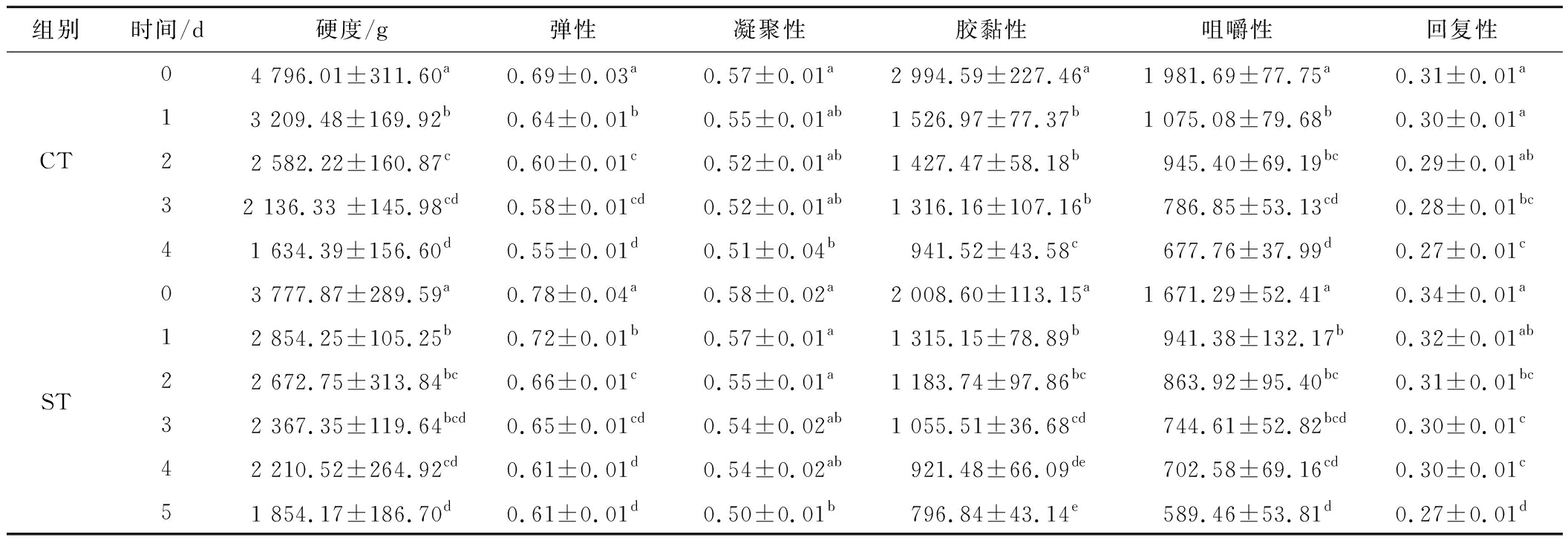
组别时间/d硬度/g弹性凝聚性胶黏性咀嚼性回复性CT04 796.01±311.60a0.69±0.03a0.57±0.01a2 994.59±227.46a1 981.69±77.75a0.31±0.01a13 209.48±169.92b0.64±0.01b0.55±0.01ab1 526.97±77.37b1 075.08±79.68b0.30±0.01a22 582.22±160.87c0.60±0.01c0.52±0.01ab1 427.47±58.18b945.40±69.19bc0.29±0.01ab32 136.33 ±145.98cd0.58±0.01cd0.52±0.01ab1 316.16±107.16b786.85±53.13cd0.28±0.01bc41 634.39±156.60d0.55±0.01d0.51±0.04b941.52±43.58c677.76±37.99d0.27±0.01cST03 777.87±289.59a0.78±0.04a0.58±0.02a2 008.60±113.15a1 671.29±52.41a0.34±0.01a12 854.25±105.25b0.72±0.01b0.57±0.01a1 315.15±78.89b941.38±132.17b0.32±0.01ab22 672.75±313.84bc0.66±0.01c0.55±0.01a1 183.74±97.86bc863.92±95.40bc0.31±0.01bc32 367.35±119.64bcd0.65±0.01cd0.54±0.02ab1 055.51±36.68cd744.61±52.82bcd0.30±0.01c42 210.52±264.92cd0.61±0.01d0.54±0.02ab921.48±66.09de702.58±69.16cd0.30±0.01c51 854.17±186.70d0.61±0.01d0.50±0.01b796.84±43.14e589.46±53.81d0.27±0.01d
如表2、表3所示,乌鳢鱼肉的弹性、凝聚性与回复性皆呈下降趋势。C组与S组在第15天时乌鳢鱼肉的弹性分别下降了30.12%、27.71%,凝聚性分别下降了18.03%、11.48%,回复性分别下降了25.00%、16.67%;在置于10 ℃后第4天时,CT组与ST组乌鳢鱼肉的弹性分别下降了20.29%、21.79%,凝聚性分别下降了10.53%、6.90%,回复性分别下降了57.96%、11.76%。其中,CT组与ST组在弹性的变化上不明显,这可能是因为肌原纤维蛋白变化不显著有关。
2.10 色泽分析
色泽的变化可以直观反映鱼肉劣变,是评价水产品品质的重要指标,它与蛋白质变性和降解、水分流失、脂肪氧化与微生物作用等有关[29]。新鲜的乌鳢被宰杀后,随着贮藏时间的延长会逐渐变为褐色。如图9所示,总体上来看,随着贮藏时间的延长,各组L*值呈下降趋势,C组与S组显著下降(P<0.05),在第15天时,C组与S组分别下降了38.59%、29.76%,CT组与ST组在置于10 ℃后L*值显著下降(P<0.05),在第4天时,分别下降了30.02%、10.22%,其值分别为41.40、42.17。S组变暗的速度低于C组,可能是因为鱼肉中的脂肪和一些营养成分发生氧化,氧化产物的积累使鱼肉的颜色变得暗淡,通过上文TBA的测定,微冻贮藏的乌鳢脂肪氧化的速度较慢,因此亮度变化较小,而置于10 ℃后,CT组的亮度迅速变小,在贮藏末期与ST组相近,也与TBA的结果相似。
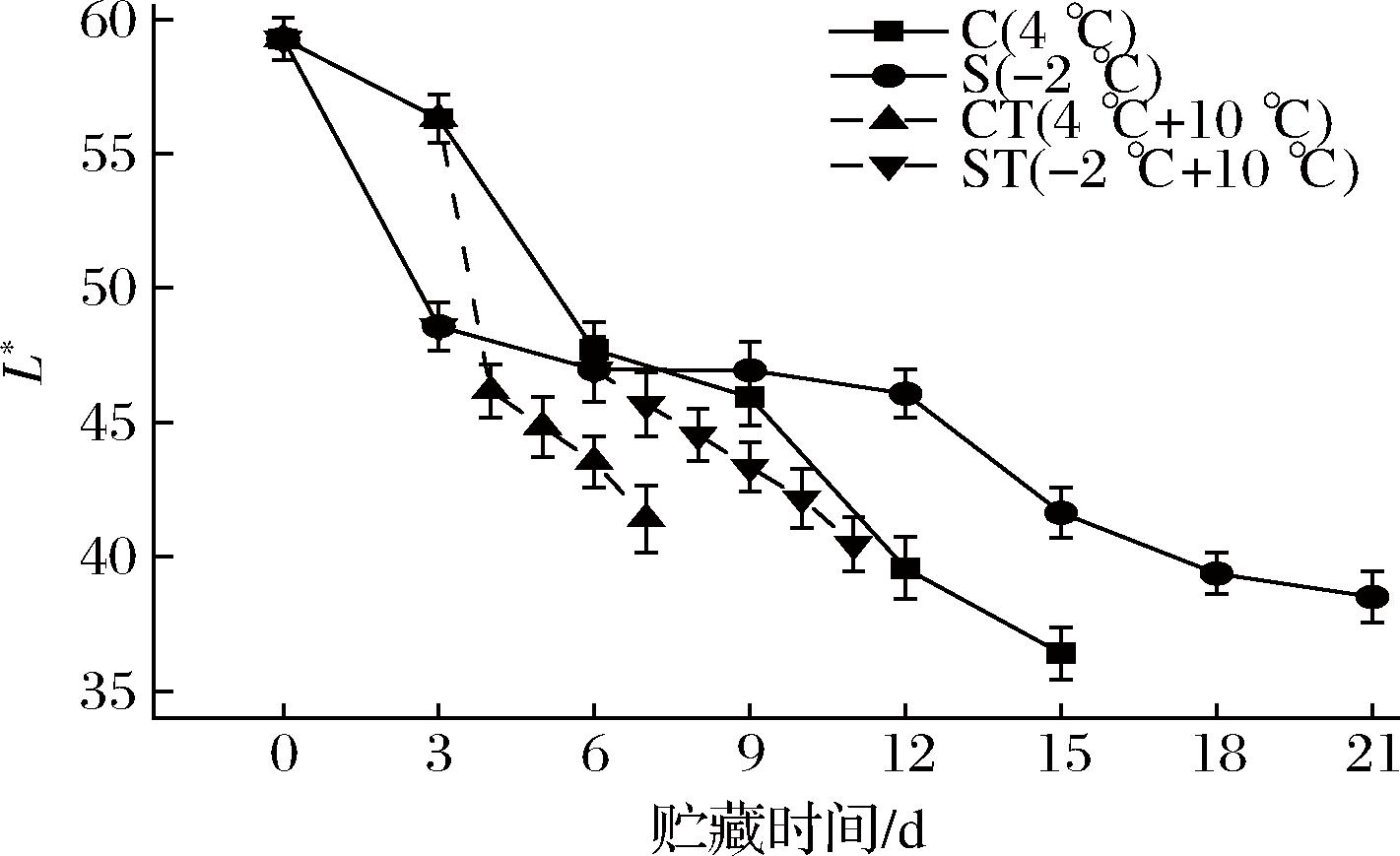
图9 乌鳢贮藏期间L*值的变化
Fig.9 Changes in L* values of C.argus during storage
如图10,各组a*值随着贮藏时间的变化皆显著下降(P<0.05)。第0天时,a*值为2.2,在第15天时,C组与S组分别下降至-1.30、0.067;置于10 ℃后的4 d时间里,CT组从1.63下降至-1.53,而ST组从0.57下降至-2.13。C组降幅要大于S组,CT组的降幅大于ST组,这一方面是因为贮藏过程中,S组微冻较低的温度减缓了肌红蛋白血色素中的亚铁离子被氧化成铁离子,形成高铁肌红蛋白的速度,使得鱼肉a*值降低的幅度小于C组;另一方面是因为随着贮藏时间的延长,鱼肉中的蛋白质会发生降解以及色素与肌肉蛋白结合的现象[30],使a*值降低,而微冻可以减缓蛋白质的降解,这与下文MP的测定结果相似。
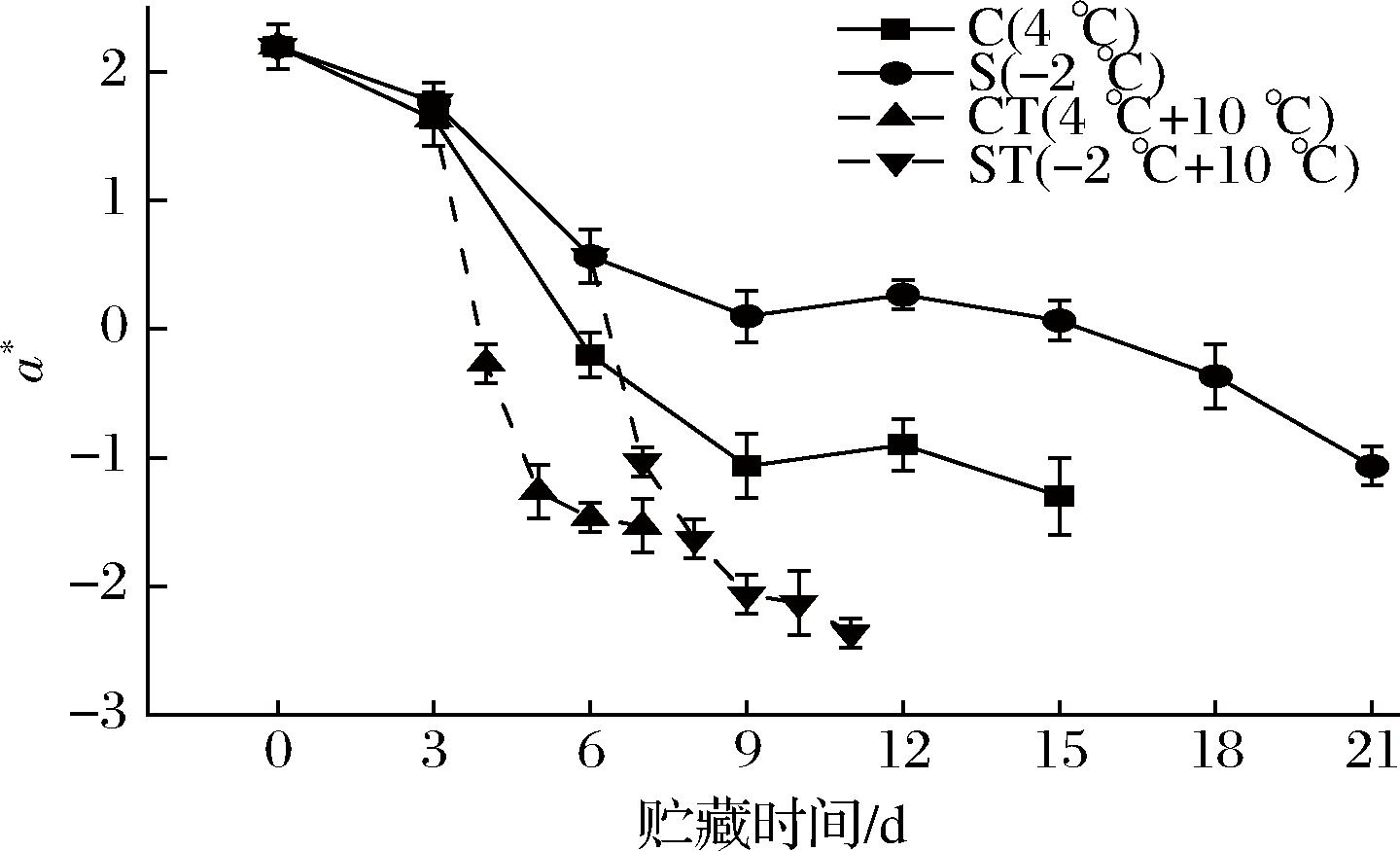
图10 乌鳢贮藏期间a*值的变化
Fig.10 Changes in a* values of C.argus during storage
如图11所示,随着贮藏时间的延长,各组b*值显著上升(P<0.05)。第0天时,b*值为2.93,C组与S组在第15天时分别增加至12.40、7.07;在置于10 ℃后的4 d时间里,CT组从5.33增至9.43,而ST组从4.60增至9.63,贮藏末期的b*值相似。鱼肉中的脂肪和一些成分会发生氧化,氧化产物(如不饱和脂肪酸的氧化产生的醛、酮等化合物)可能呈现出黄色;而蛋白质逐渐变性和降解,其结构的改变可能会影响它与色素分子的结合,加上蛋白质降解产物可能具有黄色调,使得b*值上升。C组b*值增幅大于S组,CT组b*值增幅大于ST组,这可能因为微冻贮藏减缓了脂肪氧化的程度,而CT组ST组末期的b*值结果相近,也与上文TBA的测定结果相吻合。
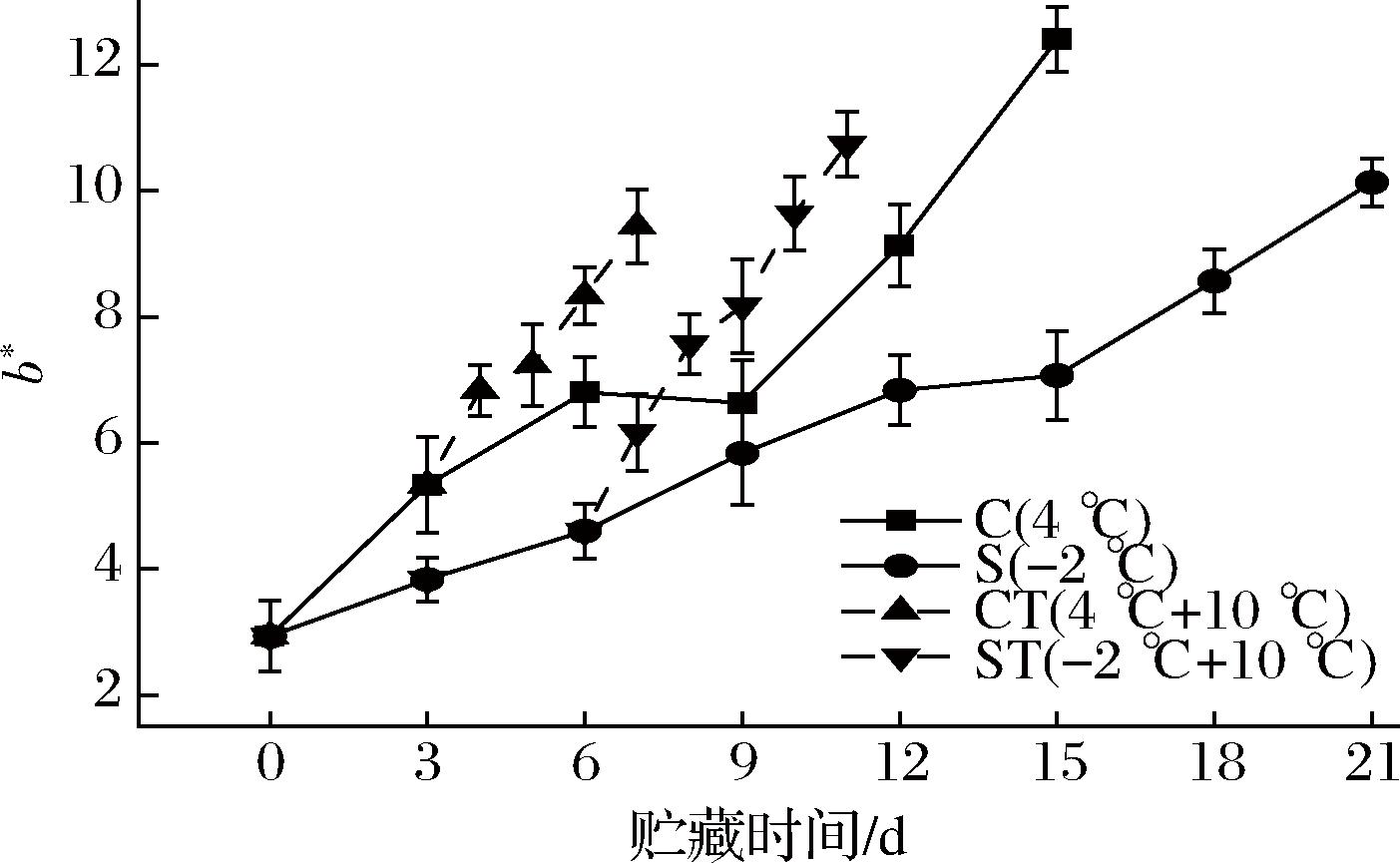
图11 乌鳢贮藏期间b*值的变化
Fig.11 Changes in b* values of C.argus during storage
2.11 感官评价
感官评价是能通过嗅觉、味觉、视觉等来感知食品及其他特征性质的一种检验方法,可以较为直观地体现食品的品质[31]。由图12可知,随着贮藏时间的延长,4组乌鳢鱼肉品质皆呈显著下降趋势(P<0.05)。S组鱼肉的评分在第3天之后皆显著高于C组鱼肉(P<0.05),C组于第12天时,感官评分降为52.1±2.1,此时鱼肉表面黏腻、弹性低、表面微黄、组织松散、散发出浓重的鱼腥味,处于感官不可接受状态;S组鱼肉于第18天评分降为56.5±2.4,此时鱼肉组织松散、弹性低、但鱼腥味较淡,这是因为微冻贮藏的温度低于冷却贮藏,且在微冻贮藏时,鱼肉表面会形成1~3 mm的冻结层,可以有效抑制微生物的生长与酶的活性,减缓蛋白质分解与脂肪氧化,保持较好的鱼体色泽[5]。
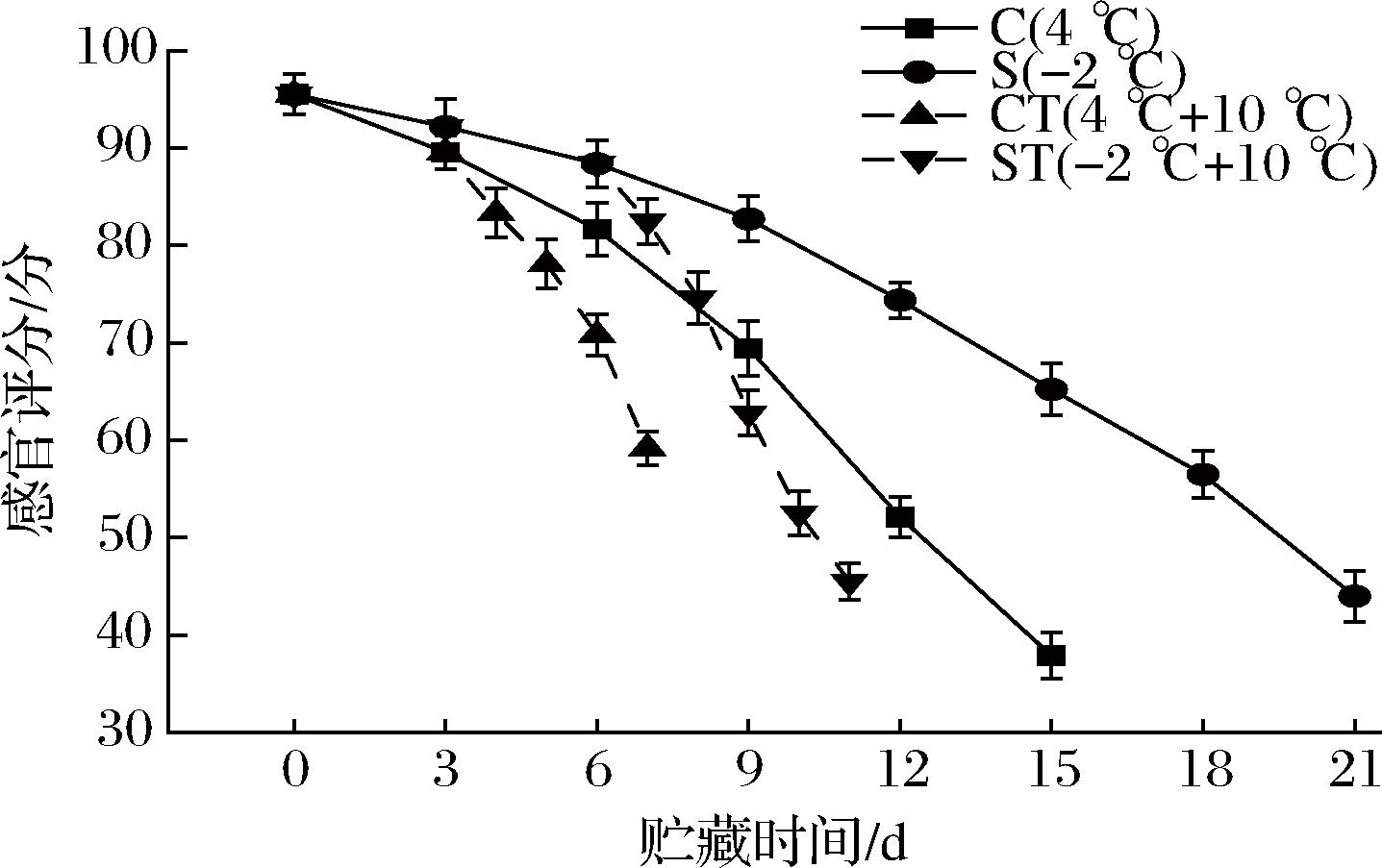
图12 乌鳢贮藏期间的感官评分
Fig.12 Sensory scores of C.argus during storage
CT组与ST组鱼肉分别于第3天、第6天置于10 ℃后,感官评分相较于C组与S组显著下降(P<0.05),并分别于置于10 ℃后的第4天降至59.2±1.7、52.5±2.3,处于感官不可接受状态。置于10 ℃后,由于周围温度的升高,CT组与ST组腐坏的速度加快,ST组感官评分下降速率较之CT组高18.25%,这可能因为在前6天的微冻过程中,鱼肉在冻结点附近反复冻融,导致鱼肉内部组织损伤,因此在10 ℃下解冻后,ST组鱼肉的感官评分下降较快。
2.12 微观结构
图13为乌鳢贮藏期间的微观结构扫描电镜图。第0天的新鲜乌鳢肌肉肌原纤维排列紧密,轮廓清晰,肌肉纤维间的间隙较小。冷却贮藏3 d及微冻贮藏6 d后,C组与S组的肌纤维出现了少许的粘连与扭曲,轮廓略有模糊,但没有出现明显的卷曲与肌肉纤维的分离,这可能是因为此时贮藏的时间较短,低温还未对肌肉纤维造成巨大破坏。在断链后置于10 ℃的4 d后,CT组与ST组出现了大量的肌纤维扭曲,肌肉间的缝隙变大,边缘有絮状物,并有粘连、断裂的产生,这可能是因为在贮藏末期,蛋白在酶与微生物作用下降解所致。冷却与微冻贮藏15 d后,C组的肌肉纤维出现明显的扭曲与分离,这可能与蛋白降解有关,而S组的肌肉纤维排列无序,粘连较多,除了蛋白在贮藏过程中的降解,还可能是因为微冻贮藏下大小不一的冰晶生成,对肌肉纤维造成了机械性损伤[32]。

A1-0 d;B1-C组3 d;C1-CT组7 d;D1-C组15 d;A2-0 d;B2-S组6 d;C2-ST组10 d;D2-S组15 d
图13 乌鳢贮藏期间的微观结构变化
Fig.13 Changes of microstructure in C.argus during storage
3 结论
本文研究了乌鳢肌肉在C组(4 ℃冷却)、S组(-2 ℃微冻)、CT组(4 ℃冷却+10 ℃)与ST组(-2 ℃微冻+10 ℃)贮藏过程中的品质变化。结果表明,随着贮藏时间的延长,菌落总数、TVB-N值、TBA值、K值、b*值均呈上升趋势,上升速度为CT组>ST组>C组>S组;感官评分、持水性、L*值、a*值、肌原纤维蛋白的含量、弹性、凝聚性与回复性皆呈下降趋势,微冻条件下的持水性总体低于冷却条件,但在感官评分、肌原纤维蛋白的含量、质构、色泽等其他方面优于冷却贮藏,置于10 ℃断链后,CT组与ST组的下降速度分别超过了同时期的C组与S组;pH值呈现先下降后上升的趋势;硬度、胶黏性与咀嚼性在贮藏前期上升而后持续下降。综合考虑各项指标,发现微冻贮藏(S组)比冷却贮藏(C组)的乌鳢品质保持效果更佳,贮藏期限延长了6~9 d;在置于10 ℃断链后,先微冻贮藏处理(ST组)比先冷却贮藏处理(CT组)效果略好一些,延长了1 d左右。由于微冻贮藏持水性方面的缺陷,后续实验应从减少水分损失方向进行,进一步实验,对微冻贮藏时乌鳢鱼肉的蛋白特性、水分状态、冰晶形态等变化规律等进行探索。
[1] 中华人民共和国国家统计局. 中国渔业统计年鉴[M].北京:中国统计出版社, 2024.National Bureau of Statistics of China.China fishery statistical year book[M].Beijing:China Statistics Press, 2024.
[2] 刘欢, 马翼飞, 单钱艺, 等.冰藏和微冻贮藏对大鲵肌肉品质的影响[J].食品与发酵工业, 2021, 47(23):199-204.LIU H, MA Y F, SHAN Q Y, et al.Effects of ice and micro-frozen storage on the quality of Andrias davidianus[J].Food and Fermentation Industries, 2021, 47(23):199-204.
[3] 阙婷婷, 郑家闻, 陈士国, 等.微冻保鲜与冻藏保鲜对乌鳢品质的影响[J].中国食品学报, 2015, 15(6):136-147.QUE T T, ZHENG J W, CHEN S G, et al.Effect of super-chilling and frozen on the meat quality of snakehead[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(6):136-147.
[4] TAO Y M, MA L, LI D D, et al.Changes in oxidation and secondary structure of myofibrilla protein, water distribution, and quality of vacuum packaged Tan mutton during storage at different temperatures[J].Journal of Food Processing and Preservation, 2021, 45(7):e15647.
[5] WU C H, YUAN C H, YE X Q, et al.A critical review on superchilling preservation technology in aquatic product[J].Journal of Integrative Agriculture, 2014, 13(12):2788-2806.
[6] 郑稳, 庄文静, 宫萱, 等.冷藏和微冻贮藏对大口黑鲈鱼品质的影响[J].食品与发酵工业, 2024, 50(5):218-225.ZHENG W, ZHUANG W J, GONG X, et al.Effect of chilling and superchilling storage on quality of Micropterus salmoides[J].Food and Fermentation Industries, 2024, 50(5):218-225.
[7] ZHOU Q Q, LI P Y, FANG S Y, et al.Preservative effects of gelatin active coating containing eugenol and higher CO2 concentration modified atmosphere packaging on Chinese Sea bass (Lateolabrax maculatus) during superchilling (-0.9 ℃) storage[J].Molecules, 2020, 25(4):871.
[8] ZHU Y C, MA L Z, YANG H, et al.Super-chilling (-0.7 ℃) with high-CO2 packaging inhibits biochemical changes of microbial origin in catfish (Clarias gariepinus) muscle during storage[J].Food Chemistry, 2016, 206:182-190.
[9] 任丽琨, 李婷婷, 赫彬彬, 等.黑鱼鱼片复合保鲜剂的选择及其保鲜效果[J].中国食品学报, 2019, 19(9):210-220.REN L K, LI T T, HE B B, et al.Selection of compound preservatives and their freshness-keeping effect on snakeheaded[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):210-220.
[10] ZHANG Z Y, YANG Y L, TANG X Z, et al.Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel[J].Food Science and Technology Research, 2015, 21(4):597-605.
[11] LI Y, ZHUANG S, LIU Y Y, et al.Effect of grape seed extract on quality and microbiota community of container-cultured snakehead (Channa argus) fillets during chilled storage[J].Food Microbiology, 2020, 91:103492.
[12] KAALE L D, EIKEVIK T M.The development of ice crystals in food products during the superchilling process and following storage:A review[J].Trends in Food Science &Technology, 2014, 39(2):91-103.
[13] International Commission on Microbiological Specifications for Foods (ICMSF).Microorganisms in Foods 2.Sampling for Microbiological Analysis:Principles and Specific Applications[M].Toronto:University of Toronto Press, 1986, 181-196.
[14] ELIASSON S, ARASON S, MARGEIRSSON B, et al.The effects of superchilling on shelf-life and quality indicators of whole Atlantic cod and fillets[J].LWT, 2019, 100:426-434.
[15] KAALE L D, EIKEVIK T M, BARDAL T, et al.A study of the ice crystals in vacuum-packed salmon fillets (Salmon salar) during superchilling process and following storage[J].Journal of Food Engineering, 2013, 115(1):20-25.
[16] LAN Y, SHANG Y B, SONG Y, et al.Changes in the quality of superchilled rabbit meat stored at different temperatures[J].Meat Science, 2016, 117:173-181.
[17] SUN Y W, FU M J, LI Z C,et al.Evaluation of freshness in determination of volatile organic compounds released from pork by HS-SPME-GC-MS[J].Food Analytical Methods, 2018, 11(5):1321-1329.
[18] LYU F, SHEN K J, DING Y T, et al.Effect of pretreatment with carbon monoxide and ozone on the quality of vacuum packaged beef meats[J].Meat Science, 2016, 117:137-146.
[19] FAN W J, ZHANG Y K, CHEN Y C, et al.TBARS predictive models of pork sausages stored at different temperatures[J].Meat Science, 2014, 96(1):1-4.
[20] 陈依萍, 崔文萱, 高瑞昌, 等.冷藏与微冻贮藏过程中鲟鱼肉品质变化[J].渔业科学进展, 2020, 41(1):178-186.CHEN Y P, CUI W X, GAO R C, et al.Changes in quality of sturgeon fillet during 4 ℃ and -3 ℃ partial freezing storage[J].Progress in Fishery Sciences, 2020, 41(1):178-186.
[21] 刘彩华, 邱恒恒, 朱新荣, 等.冷藏温度对白斑狗鱼肌肉质构特性的影响[J].食品与发酵工业, 2017, 43(12):137-143.LIU C H, QIU H H, ZHU X R, et al.Effect of different refrigeration temperature on textural properties of Esox lucius muscle[J].Food and Fermentation Industries, 2017, 43(12):137-143.
[22] WILKINSON R J, PATON N,PORTER M J R.The effects of pre-harvest stress and harvest method on the stress response, rigor onset, muscle pH and drip loss in barramundi (Lates calcarifer)[J].Aquaculture, 2008, 282(1-4):26-32.
[23] 贾哲, 陈晓婷, 蔡水淋, 等.双斑东方鲀在冷藏保鲜过程中的水分迁移与品质变化[J].食品工业科技, 2021, 42(10):287-294.JIA Z, CHEN X T, CAI S L, et al.Water migration and quality changes of Takifugu bimaculatus during cold storage[J].Science and Technology of Food Industry, 2021, 42(10):287-294.
[24] DUUN A S,RUSTAD T.Quality of superchilled vacuum packed Atlantic salmon (Salmo salar) fillets stored at -1.4 and -3.6 ℃[J].Food Chemistry, 2008, 106(1):122-131.
[25] 周光宏. 肉品学[M].北京:中国农业科学技术出版社, 1999.ZHOU G H.Meat Science[M].Beijing:China’s agricultural science and technology press, 1999.
[26] PEI J X, MEI J, YU H J, et al.Effect of gum tragacanth-sodium alginate active coatings incorporated with epigallocatechin gallate and lysozyme on the quality of large yellow croaker at superchilling condition[J].Frontiers In Nutrition, 2021, 8:812741.
[27] SAITO T, ARAI K I, MATSUYOSHI M.A new method for estimating the freshness of fish[J].Nippon Suisan Gakkaishi, 1959, 24(9):749-750.
[28] 刘欣荣. 不同贮藏方式对红鳍东方鲀品质的影响研究[D].河北:河北农业大学, 2020.LIU X R.Study on the effects of different storage methods on the quality of Takifugu rubripes[D].Hebei:Hebei Agricultural University, 2020.
[29] JIANG Q Q, NAKAZAWA N, HU Y Q, et al.Changes in quality properties and tissue histology of lightly salted tuna meat subjected to multiple freeze-thaw cycles[J].Food Chemistry, 2019, 293:178-186.
[30] CIARAMELLA M A, NAIR M N, SUMAN S P, et al.Differential abundance of muscle proteome in cultured channel catfish (Ictalurus punctatus) subjected to ante-mortem stressors and its impact on fillet quality[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 2016.20:10-18.
[31] 杨丹, 李敏, 龙银晴, 等.感官分析文献综述[J].轻工标准与质量, 2019(3):74-76.YANG D, LI M, LONG Y Q, et al.Sensory analysis literature review[J].Standard &Quality of Light Industry, 2019(3):74-76.
[32] 谢晶, 谭明堂, 范敏浩.冰晶的形成和影响因素及其对水产品品质的影响[J].粮食与油脂, 2023, 36(9):1-6.XIE J, TAN M T, FAN M H.Formation and influencing factors of ice crystals and impact on the quality of aquatic products[J].Cereals &Oils, 2023, 36(9):1-6.