肌少症是一种与衰老密切相关的全身性骨骼肌疾病,主要表现为肌肉质量、肌肉力量和功能的加速丧失,与跌倒、失能和死亡等不良风险的增加有关[1],降低了老年人生活质量。欧洲平均年龄85岁的老年人中,肌少症发病率为21%;我国65岁以上人群中,男性肌少症患病率约为8.2%,女性患病率约为12.5%[2]。2016年全世界约有5千万人罹患肌少症,预计至2050年将高达5亿人[3]。作为与增龄密切相关的多因素综合作用下的复杂综合征,肌少症的发生和发展与机体内部的炎症、氧化应激状态失衡有关[4]。在最新发布的《营养在社区老年人肌肉健康中的作用——亚洲肌少症工作组循证专家共识》中推荐老年人口服含有β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate, HMB)的营养补充剂[5],HMB被证实可以补充能量,同时还可通过减轻炎症反应改善肌少症[6]。研究表明益生菌可通过调控宿主肠道微生物群稳态[7]、改善氧化应激状态等方式改善肌少症,其中植物乳植杆菌(Lactiplantibacillus plantarum)不仅可以通过调节瘦组织质量改善肌少症[8],而且在改善氧化应激方面也具有出色优势。目前关于益生菌与HMB联合改善肌少症的研究报道不多。
基于目前研究现状,本研究首先筛选出具有良好抗氧化能力的植物乳植杆菌,再建立D-半乳糖(D-galactose,D-gal)诱导的肌少症模型,进一步探究植物乳植杆菌联合HMB对肌少症的改善效果,为研究与开发基于益生菌和HMB的改善肌少症特殊膳食补充剂提供理论依据。
1 材料与方法
1.1 材料与试剂
实验所用植物乳植杆菌和鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus GG,LGG)保存于中国海洋大学功能性乳品与益生菌工程研究室。
实验所用小鼠成肌细胞(C2C12细胞)购自武汉普诺赛生物科技有限公司。
MRS肉汤培养基,青岛海博生物技术有限公司;30%(质量分数)H2O2、邻苯三酚、盐酸、硫酸亚铁、三氯乙酸、浓硫酸,国药集团化学试剂有限公司;过硫酸钾、铁氰化钾、无水三氯化铁,上海麦克林生化科技股份有限公司;ABTS、DPPH、邻菲啰啉、D-半乳糖,上海源叶生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(WST-1法)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒,南京建成生物科技有限公司;Tris-HCl(0.05 mol, pH=8.2)、苏木素伊红(hematoxylin-eosin,H&E)染色试剂盒、中性树胶、抗荧光衰减封片剂,北京索莱宝科技有限公司;MYH1,Proteintech Group生物技术公司;CCK-8试剂盒,碧云天生物技术有限公司。
1.2 仪器与设备
LDZX-75KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-1D洁净工作台,苏州净化设备有限公司;DK-98-IIA电热恒温水浴锅,天津市泰斯特仪器有限公司;LRH-250生化培养箱,上海一恒科学仪器有限公司;TG20KR-D高速冷冻离心机,长沙东旺实验仪器有限公司;SCIENTZ-IID超声破碎仪,宁波新芝生物科技有限公司;BIOTEK POWERWAVE XS全波长酶标仪,美国BIO-TEK公司;Nikon A1R HD25激光共聚焦显微镜,上海尼康仪器有限公司;MultiMode8 原子力显微镜,上海铂悦仪器有限公司;HERAcell 240二氧化碳培养箱,赛默飞有限公司。
1.3 实验方法
1.3.1 菌株的活化
80株植物乳植杆菌均以2%(体积分数)的比例接种到MRS肉汤培养基中,在37 ℃恒温培养箱内培养24 h活化,2代之后进行试验。
1.3.2 抗氧化菌株的初筛
参考SHI等[9]的方法并稍作修改,测定候选菌株H2O2的耐受性。使用无菌肉汤培养基调整所有试验菌株的菌数为等量的标准细胞浓度(A600nm=1±0.05,1×108 CFU/mL),并以2%(体积分数)的浓度分别接种于含有10 mmol/L、12 mmol/L H2O2的MRS肉汤培养基(pH=5.7±0.2)中37 ℃孵育8 h,每个样本做3次重复。
1.3.3 抗氧化菌株的复筛
1.3.3.1 样品制备
参考杨婷玉[10]的方法分别制备初筛后菌株的无细胞提取物(cell-free extract,CFE)、发酵上清液(CFS)及完整细胞组(IC)。
1.3.3.2 DPPH自由基清除能力的测定
参考LIN等[11]的方法并稍作修改,对初筛得到菌株的各组分进行DPPH自由基清除能力的测定,每个样本做3次重复,以LGG作阳性对照。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:Ai为样品组吸光度;Aj为对照组吸光度;A0为空白组吸光度。
1.3.3.3 超氧阴离子自由基![]() 清除能力的测定
清除能力的测定
参考GAO等[12]的方法并稍作修改,对菌株各组分进行![]() 清除能力的测定,每个样本做3次重复,以LGG作阳性对照。
清除能力的测定,每个样本做3次重复,以LGG作阳性对照。![]() 清除率计算如公式(2)所示:
清除率计算如公式(2)所示:
![]() 清除率
清除率![]()
(2)
式中:Ai为样品组吸光度;Aj为对照组吸光度;A0为空白组吸光度。
1.3.3.4 ABTS阳离子自由基清除能力的测定
参考KUT等[13]的方法并稍作修改,对菌株各组分进行ABTS阳离子自由基清除能力的测定,每个样本做3次重复,以LGG作阳性对照。ABTS阳离子自由基清除率计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
式中:Ai为样品组吸光度;Aj为对照组吸光度;A0为空白组吸光度。
1.3.3.5 羟自由基(·OH)清除能力测定
参考AHIRE等[14]的方法并稍作修改,对菌株各组分进行·OH清除能力的测定,每个样本做3次重复,以LGG作阳性对照。·OH清除率计算如公式(4)所示:
·OH清除率![]()
(4)
式中:Ai为样品组吸光度;Aj为对照组吸光度;As为损伤组;Aw为未损伤组;A0为空白组吸光度。
1.3.3.6 总超氧化物歧化酶(total SOD,T-SOD)活性的测定
采用T-SOD测定试剂盒(WST-1法)对菌株各组分进行T-SOD活性测定,方法及试剂配制参照产品说明书进行。
1.3.3.7 总还原力的测定
参考WU等[15]的方法并稍作修改,对菌株各组分进行总还原力的测定,每个样本做3次重复,以LGG作阳性对照。总还原力的计算如公式(5)所示:
总还原力![]()
(5)
式中:Ai为样品组吸光度;A0为空白组吸光度。
1.3.3.8 T-AOC的测定
采用T-AOC试剂盒对菌株各组分进行总抗氧化能力的测定,以Trolox作为标准品进行总抗氧化检测,抗氧化能力用TEAC表示,具体方法及试剂配制参照产品说明书进行。
1.3.4 C2C12细胞培养
C2C12小鼠成肌细胞用含有10%(体积分数)胎牛血清和1%(体积分数)青霉素-链霉素-两性霉素B混合溶液的DMEM高糖培养基培养,置于37 ℃、5%(体积分数)CO2的培养箱中,待细胞密度达到80%左右时,进行细胞传代和铺板。
1.3.5 C2C12肌管分化
吸出孔板中原有培养基,预冷PBS缓冲液润洗2遍,换含有2%(体积分数)特级马血清和1%青霉素-链霉素-两性霉素B混合溶液的DMEM高糖分化培养基进行诱导分化,每48 h更换一次培养基;分化培养第5天有大量肌管形成,即可准备进行实验干预。
1.3.6 肌少症体外模型的建立
通过CCK-8法测定不同质量浓度(5、10、15、20、25、30、35、40、45、50 g/L)D-gal干预下的C2C12细胞存活率,筛选得到对细胞无毒害作用的浓度范围;再通过H&E染色测量肌管直径,确定建立肌少症体外模型的条件。
1.3.7 不同干预组合对肌管直径的影响
通过H&E染色对单一及复合菌株分别和HMB复配的不同干预组合的肌管直径进行测量,在图像上用Image J软件进行量化,每组随机选取50个视野场下至少1 000个肌管的平均直径(沿肌管长轴的3次测量平均值),并得到最优改善肌少症的方案。
1.3.8 肌管力学特性的测定
用原子力电子显微镜(atomic force microscope,AFM)分析正常组、模型组和植物乳植杆菌与HMB最佳组合下的肌管力学特性,包括表面粗糙度和刚度。每组随机选取3个视野场对至少5个固定细胞进行AFM成像,对每个样品扫描的15个固定细胞的力学数据进行计数分析。
1.3.9 快肌纤维基因MYH1的测定
通过免疫荧光法对正常组、模型组和植物乳植杆菌与HMB最佳组合下的MYH1进行染色及相对荧光强度分析。
1.4 数据统计分析
试验设置3次重复,所得数据采用SPSS 26.0软件进行方差分析,差异显著性检验采用独立样本t检验和单因素方差分析(one way ANOVA)进行统计。所有数据均用“平均值±标准差”表示,P<0.05为统计学上有显著差异。运用Image J软件进行量化,Graphpad Prism 9.5软件作图。
2 结果与分析
2.1 抗氧化植物乳植杆菌菌株的初筛
H2O2扩散性高、作用时间较长,可直接造成氧化损伤[16],因此本实验用细菌在H2O2中的耐受能力作为抗氧化菌株的初筛指标。测定80株植物乳植杆菌在不同H2O2浓度下的耐受性,发现不同菌株对H2O2的耐受能力存在较大差异。结果表明,57株菌对10 mmol/L H2O2的耐受率高于60%,其中16株菌的耐受率高于100%。这表明植物乳植杆菌属于厌氧或兼性厌氧菌,而且具有菌株特异性;上述部分植物乳植杆菌菌株适应能力强,在有氧环境中可以进行有氧呼吸,促进了菌株生长。随着H2O2浓度的增加,有15株菌在H2O2浓度为12 mmol/L时的耐受率大于60%。对比15株菌在10 mmol/L H2O2与12 mmol/L H2O2下的耐受率,L.plantarum SHG-1、L.plantarum HCG4-2在不同浓度H2O2条件下,表现稳定。综合10 mmol/L H2O2与12 mmol/L H2O2耐受率的影响,最终选择15株抗氧化活性较强的菌株:L.plantarum JLSC1-1、L.plantarum JLSC2-3、L.plantarum SXPCYK-3、L.plantarum LQ-1、L.plantarum SHG-1、L.plantarum XC-2、L.plantarum HZZC-3、L.plantarum NDF100S-2、L.plantarum HG-2、L.plantarum HG-3、L.plantarum JNS-2、L.plantarum HZXLHG-1、L.plantarum HCG3-2、L.plantarum HCG4-2、L.plantarum WT-2进行复筛(表1)。
表1 菌株对不同浓度过氧化氢耐受能力的初步筛选结果
Table 1 Preliminary screening results of the tolerance of bacterial strains to hydrogen peroxide at different concentrations
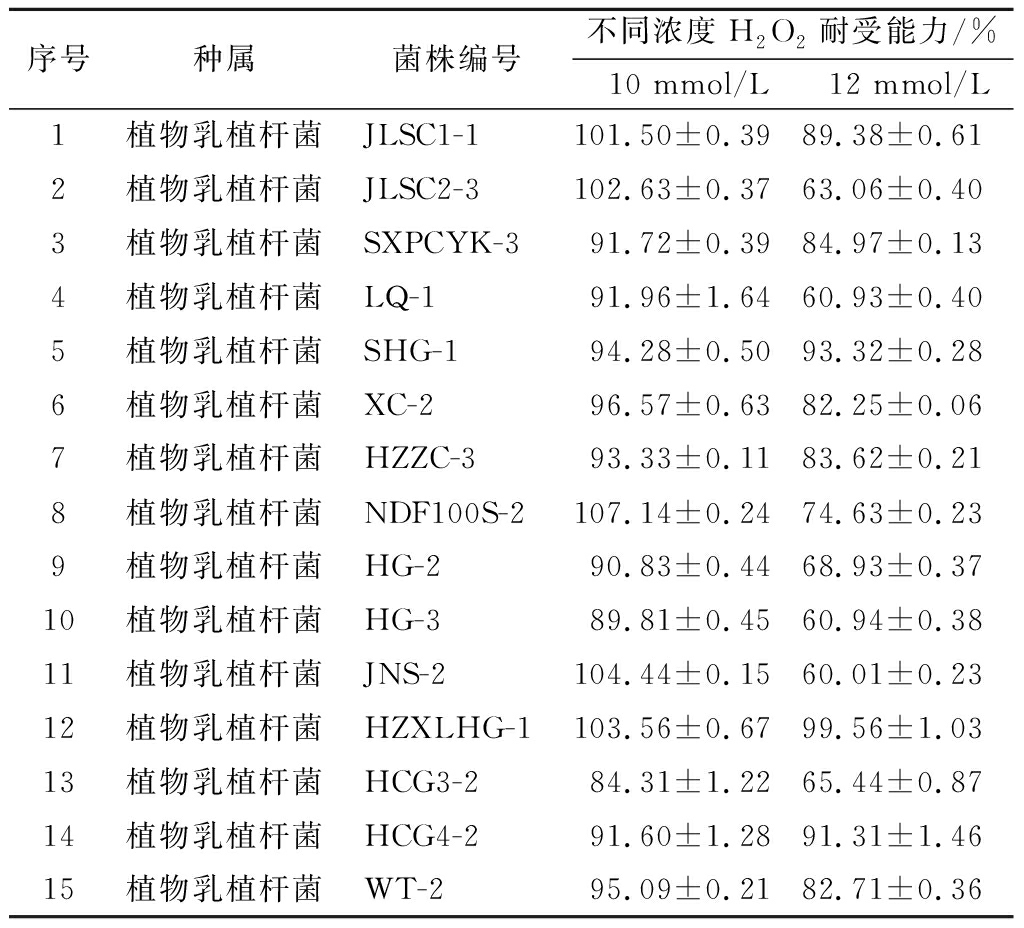
序号种属菌株编号不同浓度H2O2耐受能力/%10 mmol/L12 mmol/L1植物乳植杆菌JLSC1-1101.50±0.3989.38±0.612植物乳植杆菌JLSC2-3102.63±0.3763.06±0.403植物乳植杆菌SXPCYK-391.72±0.3984.97±0.134植物乳植杆菌LQ-191.96±1.6460.93±0.405植物乳植杆菌SHG-194.28±0.5093.32±0.286植物乳植杆菌XC-296.57±0.6382.25±0.067植物乳植杆菌HZZC-393.33±0.1183.62±0.218植物乳植杆菌NDF100S-2107.14±0.2474.63±0.239植物乳植杆菌HG-290.83±0.4468.93±0.3710植物乳植杆菌HG-389.81±0.4560.94±0.3811植物乳植杆菌JNS-2104.44±0.1560.01±0.2312植物乳植杆菌HZXLHG-1103.56±0.6799.56±1.0313植物乳植杆菌HCG3-284.31±1.2265.44±0.8714植物乳植杆菌HCG4-291.60±1.2891.31±1.4615植物乳植杆菌WT-295.09±0.2182.71±0.36
2.2 抗氧化植物乳植杆菌菌株的复筛
2.2.1 不同菌株DPPH自由基清除能力的测定
DPPH自由基被广泛用于评价抗氧化能力[17],其清除率与抗氧化能力成正相关。结果如表2所示,15株植物乳植杆菌的CFE、CFS和IC组均表现出了DPPH自由基清除能力,但不同菌株的DPPH自由基清除能力表现不同,同一株菌不同组分的DPPH自由基清除能力也具有显著差别。CFS整体DPPH自由基清除能力为77%~99%,IC整体DPPH自由基清除能力为37%~75%,CFE整体DPPH自由基清除能力为23%~47%,CFS的DPPH自由基清除能力高于IC和CFE,表明菌株中具有DPPH自由基清除能力的活性物质主要为胞外代谢产物,分布在发酵上清液中,有研究表明可能为植物乳植杆菌的代谢产物中的胞外多糖,多糖具有供氢能力,通过氢原子转移或电子转移[18],与DPPH自由基中和起到清除效果,但本研究发现菌株的IC和CFE也具有一定的DPPH自由基清除能力,表明菌株的IC和CFE也存在清除DPPH自由基的活性物质,但具体是哪种物质发挥作用还有待进一步深入研究。由表2可知,L.plantarum HZZC-3 CFS的DPPH自由基清除能力最强,高达99.23%,高于对照菌株LGG。
表2 菌株无细胞提取物、发酵上清液、完整细胞组对DPPH自由基的清除能力
Table 2 DPPH free radical scavenging rates of CFE, CFS, and IC

序号种属菌株编号DPPH自由基清除率/%CFECFSIC1植物乳植杆菌 SXPCYK-323.89±2.05h87.20±3.09bc55.86±1.02e2植物乳植杆菌 HCG3-225.49±2.56gh92.31±6.26ab67.35±5.13bcd3植物乳植杆菌 LQ-135.34±4.96cd82.94±4.16bc66.56±3.43bcd4植物乳植杆菌 HCG4-231.83±2.73de85.32±8.14bc75.37±4.87a5植物乳植杆菌 WT-229.64±1.29ef77.73±3.46c70.93±4.87ab6植物乳植杆菌 JNS-234.04±2.84cd82.37±1.68bc70.17±4.32abc7植物乳植杆菌 JLSC1-127.07±3.94fgh88.24±7.69abc48.89±4.76fgh8植物乳植杆菌 JLSC2-323.59±1.40h88.66±6.83abc42.28±3.67hi9植物乳植杆菌 HZZC-337.62±1.00c99.23±3.24a42.59±6.36ghi10植物乳植杆菌 XC-231.38±0.57de85.93±10.55bc46.39±0.47fgh11植物乳植杆菌 SHG-123.46±0.19h94.00±6.54ab64.47±2.63bcd12植物乳植杆菌 NDF100S-224.25±0.94h77.73±10.52c51.26±1.82ef13植物乳植杆菌 HZXLHG-156.17±1.62a85.84±3.51bc63.41±3.40cd14植物乳植杆菌 HG-228.44±2.15efg82.61±3.23bc62.82±4.50d15植物乳植杆菌 HG-324.73±1.52gh93.97±8.05ab49.27±3.33efg16鼠李糖乳酪杆菌LGG47.65±0.42b87.77±2.48abc37.08±4.19i
注:数据表示为“平均值±标准差”(n=3),同一组不同字母经邓肯多范围检验差异显著(P<0.05)(下同)。
2.2.2 不同菌株![]() 清除能力的测定
清除能力的测定
![]() 清除能力作为评估生物样本抗氧化能力的重要指标,测定结果如表3所示,结果表明菌株的CFS、IC的
清除能力作为评估生物样本抗氧化能力的重要指标,测定结果如表3所示,结果表明菌株的CFS、IC的![]() 清除率显著高于CFE(P<0.05),L.plantarum HG-2、L.plantarum HZZC-3、L.plantarum XC-2的CFS
清除率显著高于CFE(P<0.05),L.plantarum HG-2、L.plantarum HZZC-3、L.plantarum XC-2的CFS![]() 清除率都在50%以上,其中L.plantarum HG-2的清除率为69.88%,高于阳性对照菌株LGG;L.plantarum HG-3、L.plantarum HG-2、L.plantarum JLSC1-1的IC组分对
清除率都在50%以上,其中L.plantarum HG-2的清除率为69.88%,高于阳性对照菌株LGG;L.plantarum HG-3、L.plantarum HG-2、L.plantarum JLSC1-1的IC组分对![]() 的清除率排在前3,所有菌株CFE的
的清除率排在前3,所有菌株CFE的![]() 清除率都在5%以下,有5株几乎不表现清除能力,表明
清除率都在5%以下,有5株几乎不表现清除能力,表明![]() 的清除主要依靠代谢产物及胞内活性物质的辅助协同作用,这与张开屏等[19]的研究结果相似。
的清除主要依靠代谢产物及胞内活性物质的辅助协同作用,这与张开屏等[19]的研究结果相似。
表3 菌株无细胞提取物、发酵上清液、完整细胞对![]() 的清除能力
的清除能力
Table 3 ![]() scavenging rates of CFE, CFS, and IC
scavenging rates of CFE, CFS, and IC
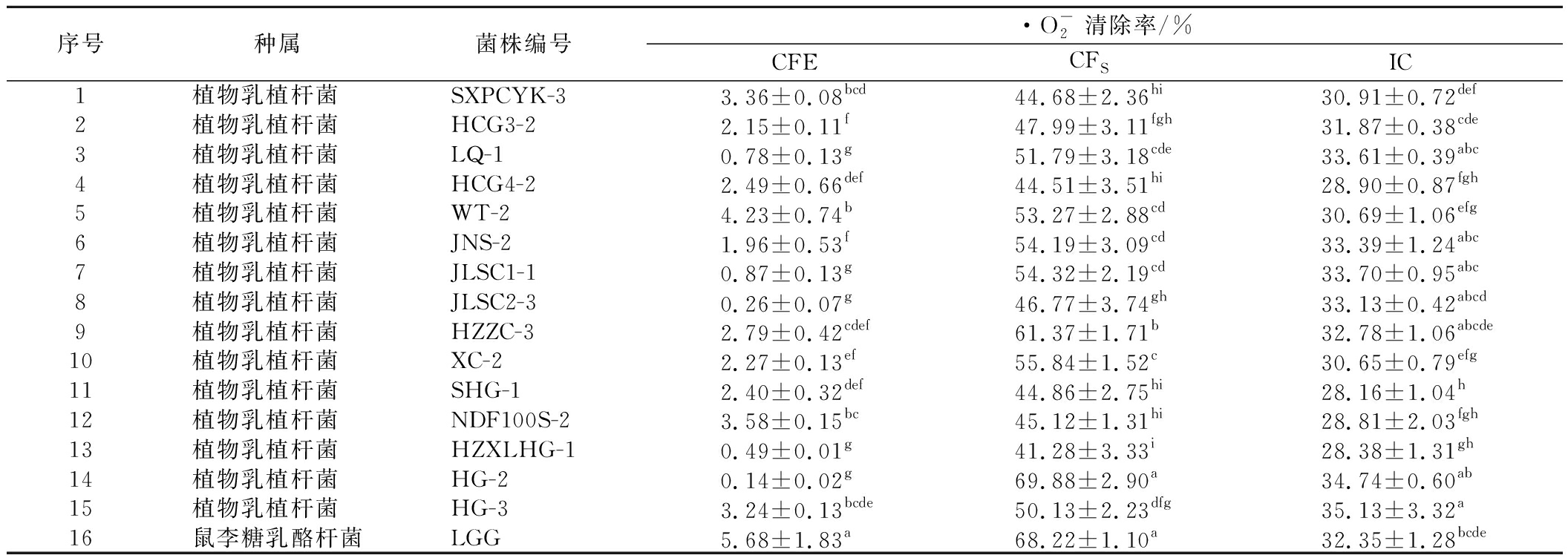
序号种属菌株编号·O-2清除率/%CFECFSIC1植物乳植杆菌 SXPCYK-33.36±0.08bcd44.68±2.36hi30.91±0.72def2植物乳植杆菌 HCG3-22.15±0.11f47.99±3.11fgh31.87±0.38cde3植物乳植杆菌 LQ-10.78±0.13g51.79±3.18cde33.61±0.39abc4植物乳植杆菌 HCG4-22.49±0.66def44.51±3.51hi28.90±0.87fgh5植物乳植杆菌 WT-24.23±0.74b53.27±2.88cd30.69±1.06efg6植物乳植杆菌 JNS-21.96±0.53f54.19±3.09cd33.39±1.24abc7植物乳植杆菌 JLSC1-10.87±0.13g54.32±2.19cd33.70±0.95abc8植物乳植杆菌 JLSC2-30.26±0.07g46.77±3.74gh33.13±0.42abcd9植物乳植杆菌 HZZC-32.79±0.42cdef61.37±1.71b32.78±1.06abcde10植物乳植杆菌 XC-22.27±0.13ef55.84±1.52c30.65±0.79efg11植物乳植杆菌 SHG-12.40±0.32def44.86±2.75hi28.16±1.04h12植物乳植杆菌 NDF100S-23.58±0.15bc45.12±1.31hi28.81±2.03fgh13植物乳植杆菌 HZXLHG-10.49±0.01g41.28±3.33i28.38±1.31gh14植物乳植杆菌 HG-20.14±0.02g69.88±2.90a34.74±0.60ab15植物乳植杆菌 HG-33.24±0.13bcde50.13±2.23dfg35.13±3.32a16鼠李糖乳酪杆菌LGG5.68±1.83a68.22±1.10a32.35±1.28bcde
2.2.3 不同菌株ABTS阳离子自由基清除能力的测定
ABTS阳离子自由基清除能力是评估抗氧化效果的常用方法,通过检测候选物质对ABTS阳离子自由基的清除能力评估其抗氧化活性。由表4可知,相同菌株的ABTS阳离子自由基清除能力中,CFS的ABTS阳离子自由基清除能力显著高于 IC 和CFE(P<0.05),表明清除ABTS阳离子自由基的活性物质主要存在于菌株的代谢产物中。L.plantarum XC-2、L.plantarum NDF100S-2的CFs表现出较高的ABTS阳离子自由基清除能力,分别为81.24%、80.59%,均显著高于阳性对照菌株LGG的CFs的ABTS阳离子自由基清除能力(P<0.05)。
表4 菌株无细胞提取物、发酵上清液、完整细胞组对ABTS阳离子自由基的清除能力
Table 4 ABTS cationic free radical scavenging rates of CFE, CFS, and IC

序号种属菌株编号ABTS阳离子自由基清除率/%CFECFSIC1植物乳植杆菌 SXPCYK-315.45±1.99bcd53.94±3.00f14.31±0.35cd2植物乳植杆菌 HCG3-217.64±0.63b77.89±11.14ab17.12±2.11ab3植物乳植杆菌 LQ-117.64±1.65b74.13±7.08abc14.80±2.26bc4植物乳植杆菌 HCG4-210.10±0.21g67.88±7.18bcde14.90±2.47bc5植物乳植杆菌 WT-215.17±1.71bcd62.92±10.32cdef18.53±1.75a6植物乳植杆菌 JNS-222.23±2.05a56.87±8.15ef17.02±1.71ab7植物乳植杆菌 JLSC1-113.15±2.06def61.39±7.78def11.88±1.36e8植物乳植杆菌 JLSC2-311.13±1.77efg57.81±3.74ef10.24±1.23e9植物乳植杆菌 HZZC-314.04±1.72cde70.55±4.30abcd4.69±0.47fg10植物乳植杆菌 XC-213.56±1.39cde81.24±4.79a3.63±0.54g11植物乳植杆菌 SHG-110.44±0.12fg71.58±3.71abcd0.46±0.02h12植物乳植杆菌 NDF100S-211.30±1.89efg80.59±1.80a5.27±0.20fg13植物乳植杆菌 HZXLHG-116.13±0.62bc52.41±0.97f6.23±0.11f14植物乳植杆菌 HG-212.98±1.08defg36.73±7.70g12.43±1.13de15植物乳植杆菌 HG-312.53±1.48defg56.19±6.94ef3.32±0.20g16鼠李糖乳酪杆菌LGG17.02±1.94b67.50±7.86bcde15.51±0.23bc
2.2.4 不同菌株·OH清除能力的测定
·OH是机体新陈代谢过程中产生的,对生物体具有毒性,导致细胞结构和功能受损。·OH清除能力是衡量物质抗氧化能力的重要指标之一。由表5可知,15株植物乳植杆菌的CFE、CFS和IC组均表现出了·OH清除能力,CFE·OH清除能力为47%~86%,CFS·OH清除能力为48%~84%,IC·OH清除能力为6%~92%,不同菌株生成清除自由基的活性物质含量和种类不同,清除能力存在差异。清除·OH的活性物质可能存在菌体胞内并通过代谢作用释放,最终以代谢产物的形式发挥作用,这与刘少敏[20]的研究结果相似。L.plantarum SXPCYK-3、L.plantarum HCG3-2、L.plantarum HZZC-3排在CFE ·OH清除率的前3位,分别为85.13%、84.32%、71.80%,均高于阳性对照菌株LGG(69.11%, P<0.05);L.plantarum JLSC2-3、L.plantarum HCG4-2、L.plantarum XC-2排在CFS ·OH清除率的前3位,分别为83.65%、82.97%、81.70%,均高于阳性对照菌株LGG(73.89%,P<0.05);L.plantarum SXPCYK-3、L.plantarum HCG3-2的IC ·OH清除率同样很高,分别为91.25%、87.62%,显著高于LGG(23.42%,P<0.05)。
表5 菌株无细胞提取物、发酵上清液、完整细胞组对·OH的清除能力
Table 5 ·OH scavenging rates of CFE, CFS, and IC
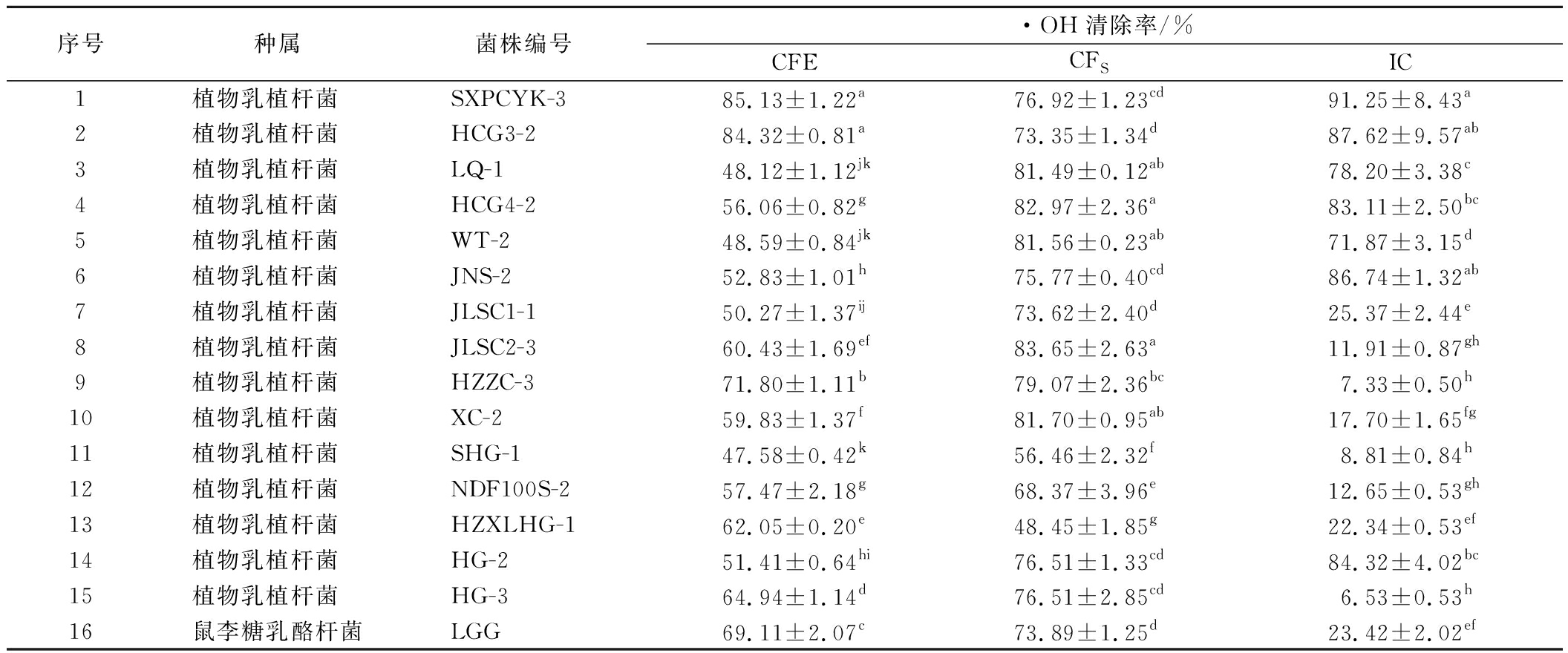
序号种属菌株编号·OH清除率/%CFECFSIC1植物乳植杆菌 SXPCYK-385.13±1.22a76.92±1.23cd91.25±8.43a2植物乳植杆菌 HCG3-284.32±0.81a73.35±1.34d87.62±9.57ab3植物乳植杆菌 LQ-148.12±1.12jk81.49±0.12ab78.20±3.38c4植物乳植杆菌 HCG4-256.06±0.82g82.97±2.36a83.11±2.50bc5植物乳植杆菌 WT-248.59±0.84jk81.56±0.23ab71.87±3.15d6植物乳植杆菌 JNS-252.83±1.01h75.77±0.40cd86.74±1.32ab7植物乳植杆菌 JLSC1-150.27±1.37ij73.62±2.40d25.37±2.44e8植物乳植杆菌 JLSC2-360.43±1.69ef83.65±2.63a11.91±0.87gh9植物乳植杆菌 HZZC-371.80±1.11b79.07±2.36bc7.33±0.50h10植物乳植杆菌 XC-259.83±1.37f81.70±0.95ab17.70±1.65fg11植物乳植杆菌 SHG-147.58±0.42k56.46±2.32f8.81±0.84h12植物乳植杆菌 NDF100S-257.47±2.18g68.37±3.96e12.65±0.53gh13植物乳植杆菌 HZXLHG-162.05±0.20e48.45±1.85g22.34±0.53ef14植物乳植杆菌 HG-251.41±0.64hi76.51±1.33cd84.32±4.02bc15植物乳植杆菌 HG-364.94±1.14d76.51±2.85cd6.53±0.53h16鼠李糖乳酪杆菌LGG69.11±2.07c73.89±1.25d23.42±2.02ef
2.2.5 不同菌株T-SOD活性的测定
SOD作为一种重要的酶促抗氧化防御机制,能够通过歧化反应特异清除衰老启动因子![]() 由表6可知,15株植物乳植杆菌CFS的T-SOD活性整体最高,显著高于CFE和IC(P<0.05)。L.plantarum HZZC-3、L.plantarum XC-2、L.plantarum JLSC1-1排在CFs T-SOD活性的前3位,分别为118.03、117.65、117.24 U/mL,高于阳性对照菌株LGG。L.plantarum HZZC-3的CFE T-SOD活性为15.33 U/mL,IC T-SOD活性为8.34 U/mL;L.plantarum XC-2的CFE T-SOD活性为13.39 U/mL,IC T-SOD活性为1.00 U/mL;L.plantarum JLSC1-1的CFE T-SOD活性为2.95 U/mL,IC T-SOD活性为1.01 U/mL。综合来看,L.plantarum HZZC-3的T-SOD活性最高。
由表6可知,15株植物乳植杆菌CFS的T-SOD活性整体最高,显著高于CFE和IC(P<0.05)。L.plantarum HZZC-3、L.plantarum XC-2、L.plantarum JLSC1-1排在CFs T-SOD活性的前3位,分别为118.03、117.65、117.24 U/mL,高于阳性对照菌株LGG。L.plantarum HZZC-3的CFE T-SOD活性为15.33 U/mL,IC T-SOD活性为8.34 U/mL;L.plantarum XC-2的CFE T-SOD活性为13.39 U/mL,IC T-SOD活性为1.00 U/mL;L.plantarum JLSC1-1的CFE T-SOD活性为2.95 U/mL,IC T-SOD活性为1.01 U/mL。综合来看,L.plantarum HZZC-3的T-SOD活性最高。
表6 菌株无细胞提取物、发酵上清液、完整细胞组中T-SOD的活性
Table 6 The T-SOD activity of CFE, CFS, and IC
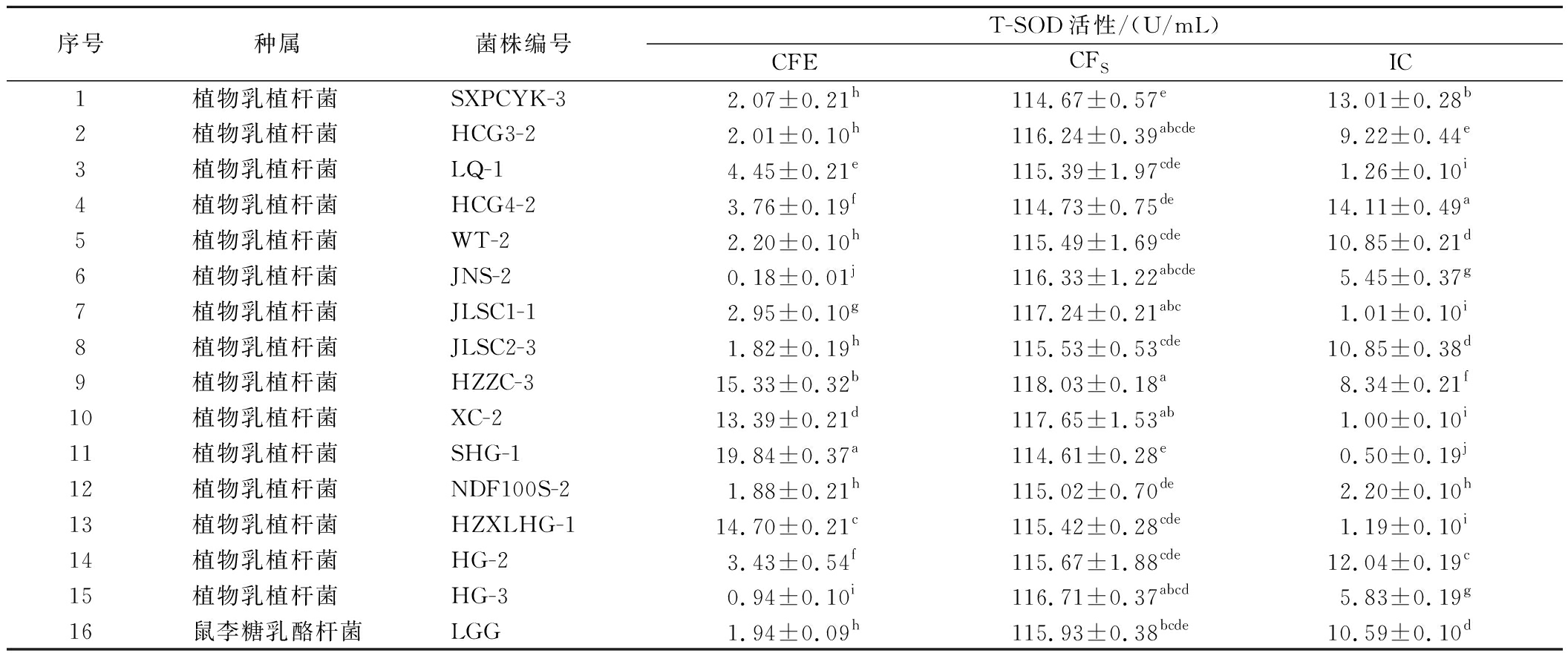
序号种属菌株编号T-SOD活性/(U/mL)CFECFSIC1植物乳植杆菌 SXPCYK-32.07±0.21h114.67±0.57e13.01±0.28b2植物乳植杆菌 HCG3-22.01±0.10h116.24±0.39abcde9.22±0.44e3植物乳植杆菌 LQ-14.45±0.21e115.39±1.97cde1.26±0.10i4植物乳植杆菌 HCG4-23.76±0.19f114.73±0.75de14.11±0.49a5植物乳植杆菌 WT-22.20±0.10h115.49±1.69cde10.85±0.21d6植物乳植杆菌 JNS-20.18±0.01j116.33±1.22abcde5.45±0.37g7植物乳植杆菌 JLSC1-12.95±0.10g117.24±0.21abc1.01±0.10i8植物乳植杆菌 JLSC2-31.82±0.19h115.53±0.53cde10.85±0.38d9植物乳植杆菌 HZZC-315.33±0.32b118.03±0.18a8.34±0.21f10植物乳植杆菌 XC-213.39±0.21d117.65±1.53ab1.00±0.10i11植物乳植杆菌 SHG-119.84±0.37a114.61±0.28e0.50±0.19j12植物乳植杆菌 NDF100S-21.88±0.21h115.02±0.70de2.20±0.10h13植物乳植杆菌 HZXLHG-114.70±0.21c115.42±0.28cde1.19±0.10i14植物乳植杆菌 HG-23.43±0.54f115.67±1.88cde12.04±0.19c15植物乳植杆菌 HG-30.94±0.10i116.71±0.37abcd5.83±0.19g16鼠李糖乳酪杆菌LGG1.94±0.09h115.93±0.38bcde10.59±0.10d
2.2.6 不同菌株总还原力的测定
还原力是评价物质抗氧化能力的重要指标。抗氧化活性物质通过还原作用清除自由基,还原能力越强,抗氧化活性越强。由表7可知,15株植物乳植杆菌的CFE、CFS和IC组均表现出了还原力,CFE总还原力为4%~94%,CFS总还原力为71%~88%,IC总还原力为6%~93%,不同菌株间CFE和IC的还原力表现出较大的差异。在冯美琴等[22]的研究中,CFE总还原力明显低于IC、CFS,与本研究结果略有不同,这可能与不同菌株的特异性有关。L.plantarum XC-2、L.plantarum HCG3-2的CFE总还原力最强,为93.49%,高于阳性对照菌株LGG;L.plantarum NDF100S-2、L.plantarum SHG-1、L.plantarum XC-2排在CFS总还原力的前3位,分别为87.86%、87.72%、87.28%,均高于阳性对照菌株LGG(66.00%, P<0.05);L.plantarum NDF100S-2、L.plantarum HG-2的IC总还原力超过90%,显著高于阳性对照菌株LGG(57.72%, P<0.05)。分析结果显示,大部分植物乳植杆菌菌株的CFE、CFS和IC均表现出较高水平的还原力,推测植物乳植杆菌的还原力与菌体表面活性物质、胞外释放物和胞内物质均相关。
表7 菌株无细胞提取物、发酵上清液、完整细胞组中的总还原力
Table 7 Total reducing ability of CFE, CFS, and IC
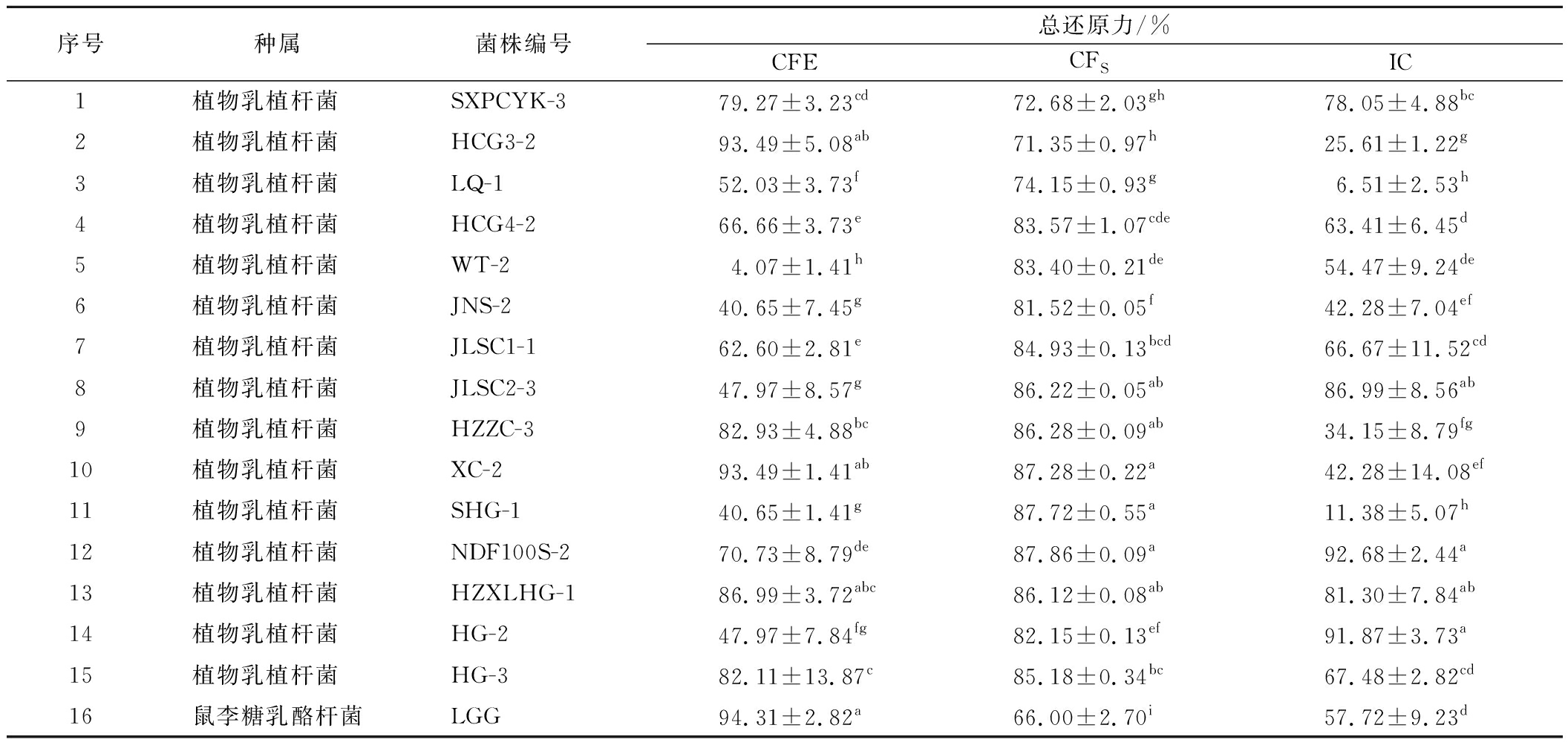
序号种属菌株编号总还原力/%CFECFSIC1植物乳植杆菌 SXPCYK-379.27±3.23cd72.68±2.03gh78.05±4.88bc2植物乳植杆菌 HCG3-293.49±5.08ab71.35±0.97h25.61±1.22g3植物乳植杆菌 LQ-152.03±3.73f74.15±0.93g6.51±2.53h4植物乳植杆菌 HCG4-266.66±3.73e83.57±1.07cde63.41±6.45d5植物乳植杆菌 WT-24.07±1.41h83.40±0.21de54.47±9.24de6植物乳植杆菌 JNS-240.65±7.45g81.52±0.05f42.28±7.04ef7植物乳植杆菌 JLSC1-162.60±2.81e84.93±0.13bcd66.67±11.52cd8植物乳植杆菌 JLSC2-347.97±8.57g86.22±0.05ab86.99±8.56ab9植物乳植杆菌 HZZC-382.93±4.88bc86.28±0.09ab34.15±8.79fg10植物乳植杆菌 XC-293.49±1.41ab87.28±0.22a42.28±14.08ef11植物乳植杆菌 SHG-140.65±1.41g87.72±0.55a11.38±5.07h12植物乳植杆菌 NDF100S-270.73±8.79de87.86±0.09a92.68±2.44a13植物乳植杆菌 HZXLHG-186.99±3.72abc86.12±0.08ab81.30±7.84ab14植物乳植杆菌 HG-247.97±7.84fg82.15±0.13ef91.87±3.73a15植物乳植杆菌 HG-382.11±13.87c85.18±0.34bc67.48±2.82cd16鼠李糖乳酪杆菌LGG94.31±2.82a66.00±2.70i57.72±9.23d
2.2.7 不同菌株总抗氧化能力的测定
总抗氧化能力是抗氧化剂体系抵御活性氧自由基的总体能力,是衡量体内抗氧化剂数量和活性的指标,可以反映物质对抗自由基和氧化应激的能力。由表8可知,15株植物乳植杆菌CFS的TEAC活性整体最高,显著高于CFE和IC(P<0.05),表明具有TEAC的活性物质主要存在于菌株的胞外代谢产物,分布在发酵上清液中。
表8 菌株无细胞提取物、发酵上清液、完整细胞组中的总抗氧化能力
Table 8 Total antioxidant ability of CFE, CFS, and IC
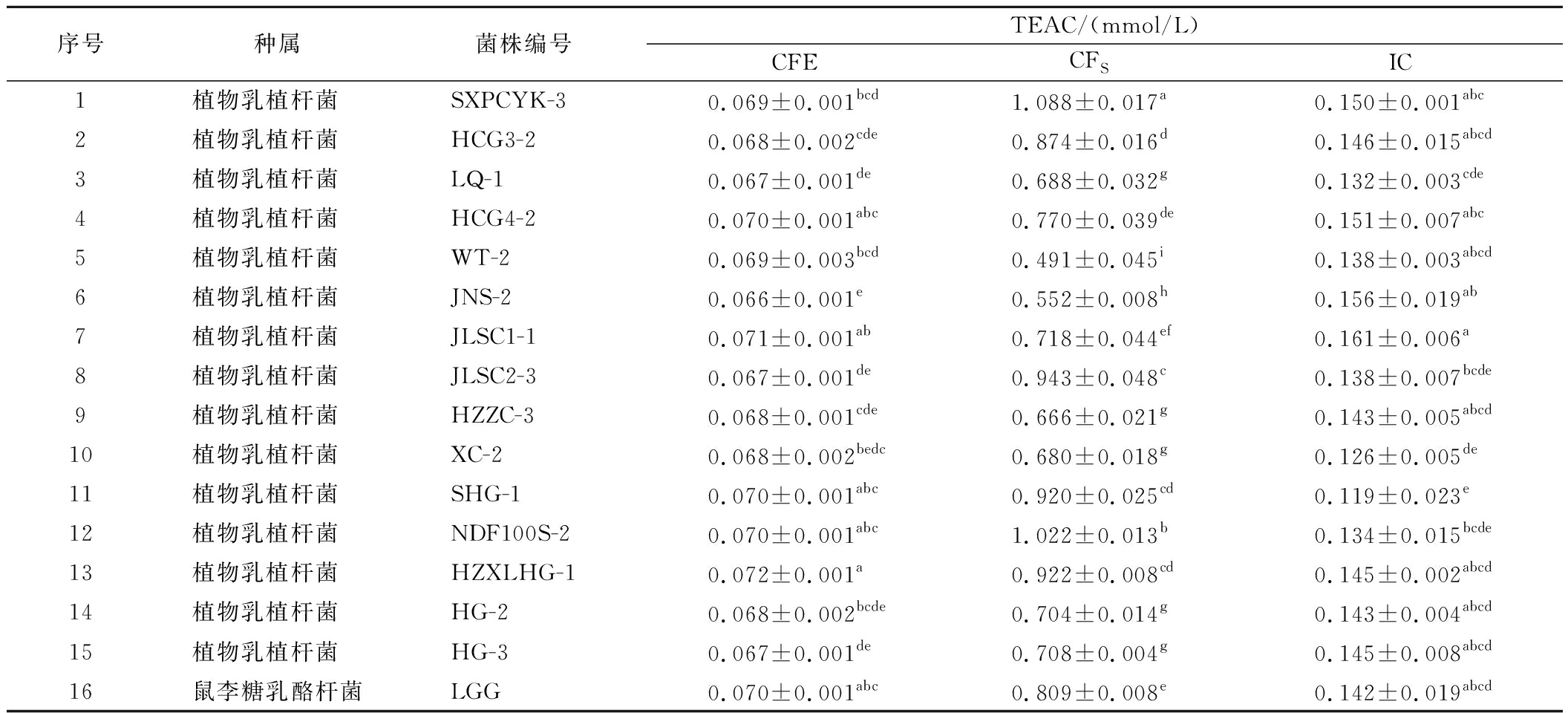
序号种属菌株编号TEAC/(mmol/L)CFECFSIC1植物乳植杆菌 SXPCYK-30.069±0.001bcd1.088±0.017a0.150±0.001abc2植物乳植杆菌 HCG3-20.068±0.002cde0.874±0.016d0.146±0.015abcd3植物乳植杆菌 LQ-10.067±0.001de0.688±0.032g0.132±0.003cde4植物乳植杆菌 HCG4-20.070±0.001abc0.770±0.039de0.151±0.007abc5植物乳植杆菌 WT-20.069±0.003bcd0.491±0.045i0.138±0.003abcd6植物乳植杆菌 JNS-20.066±0.001e0.552±0.008h0.156±0.019ab7植物乳植杆菌 JLSC1-10.071±0.001ab0.718±0.044ef0.161±0.006a8植物乳植杆菌 JLSC2-30.067±0.001de0.943±0.048c0.138±0.007bcde9植物乳植杆菌 HZZC-30.068±0.001cde0.666±0.021g0.143±0.005abcd10植物乳植杆菌 XC-20.068±0.002bedc0.680±0.018g0.126±0.005de11植物乳植杆菌 SHG-10.070±0.001abc0.920±0.025cd0.119±0.023e12植物乳植杆菌 NDF100S-20.070±0.001abc1.022±0.013b0.134±0.015bcde13植物乳植杆菌 HZXLHG-10.072±0.001a0.922±0.008cd0.145±0.002abcd14植物乳植杆菌 HG-20.068±0.002bcde0.704±0.014g0.143±0.004abcd15植物乳植杆菌 HG-30.067±0.001de0.708±0.004g0.145±0.008abcd16鼠李糖乳酪杆菌LGG0.070±0.001abc0.809±0.008e0.142±0.019abcd
L.plantarum SXPCYK-3、L.plantarum NDF100S-2、L.plantarum JLSC2-3排在CFS总抗氧化能力的前3位,分别为1.088、1.022、0.943 mmol/L,显著高于阳性对照菌株LGG(P<0.05)。
综合以上不同菌株不同组分的抗氧化活性结果,筛选确定3株具有改善肌少症潜力的植物乳植杆菌菌株:L.plantarum XC-2、L.plantarum NDF100S-2、L.plantarum HZZC-3。
2.3 肌少症体外模型的建立
利用D-gal建立肌少症体外模型。通过CCK-8法测定不同浓度D-gal干预下的细胞存活率,得到结果如图1-a所示;计算得到IC50值为34.11 g/L(图1-b)。综上,选取5、10、15 g/L的无毒害质量浓度进行下一步探究,与正常组相比,15 g/L D-gal干预时肌管萎缩程度最显著(图1-c、图1-d)。确定15 g/L D-gal干预C2C12细胞24 h为肌少症的造模条件。
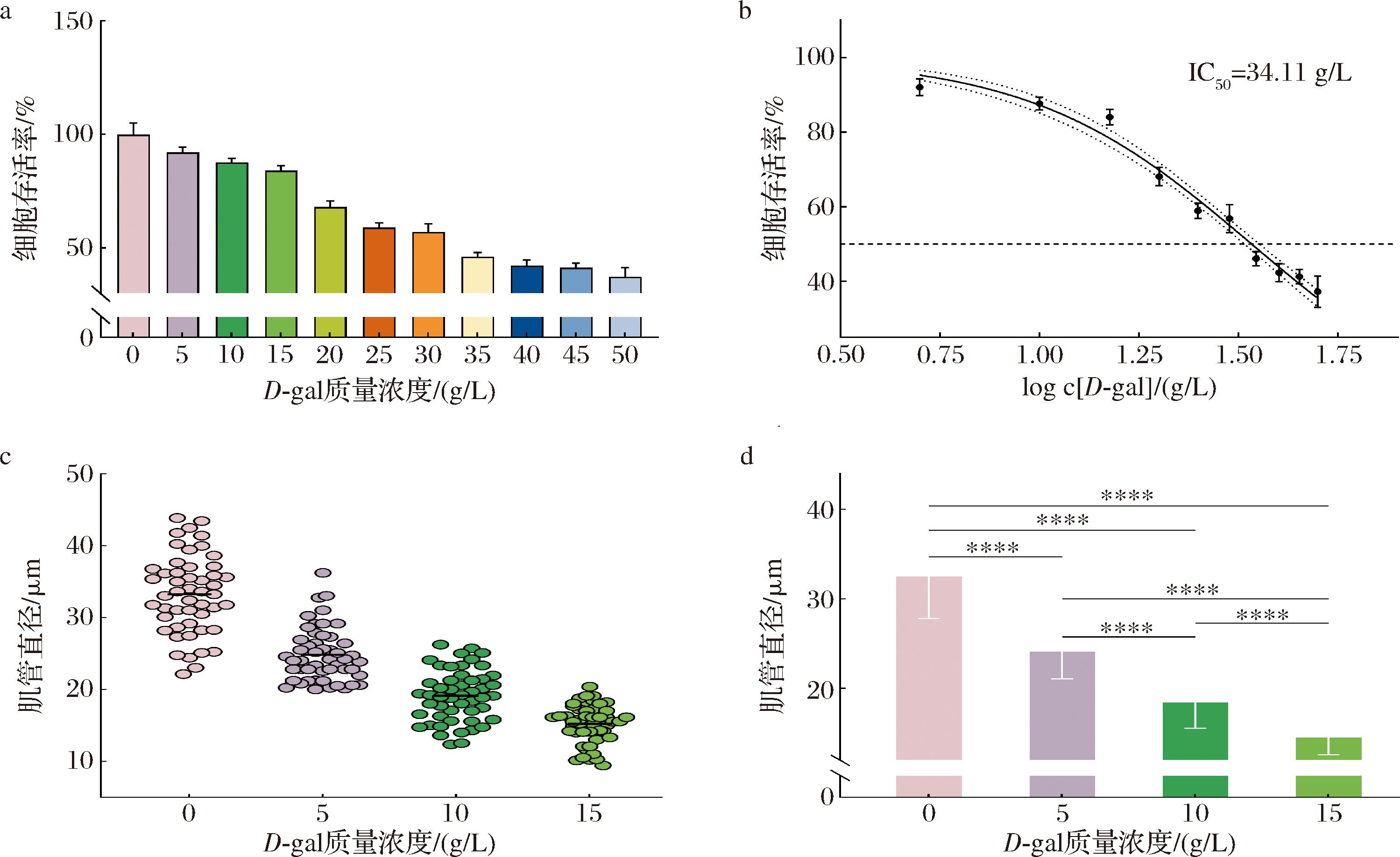
a-不同浓度D-gal干预下的细胞存活率;b-IC50值;c-不同浓度D-gal干预下的肌管直径分布图(n=50);d-不同浓度D-gal干预下的肌管直径显著性分析
图1 D-gal诱导的肌少症体外模型的建立
Fig.1 Establishment of an in vitro model of D-gal induced sarcopenia
注:****代表差异极显著,P<0.000 1(下同)。
2.4 不同植物乳植杆菌与HMB组合对肌管直径的影响
肌管系统是与肌纤维的收缩功能密切相关的重要结构。肌管直径可用来评估肌肉的健康状况,其变化可以反映肌肉的萎缩程度和肌肉功能的改变。由图2可知,与空白(CON)组相比,D-gal组的肌管直径显著下降(P<0.05);与D-gal组相比,PL-1(L.plantarum XC-2)、PL-2(L.plantarum NDF100S-2)、PL-3(L.plantarum HZZC-3)、HMB、PL-1/HMB、PL-2/HMB、PL-3/HMB、PL-1/PL-2/HMB、PL-1/PL-3/HMB、PL-2/PL-3/HMB共10组不同组合均显著改善了由肌少症诱发的肌管直径萎缩。单一菌株与HMB的复配效果显著高于单一菌株及HMB的单独作用,复合菌株与HMB的复配效果又显著高于单一菌株与HMB的复配效果,提示不同菌株之间、菌株与HMB之间均具有联合改善作用。通过比较各组间肌管直径,确定改善肌管直径的最优组合为PL-2/ PL-3/HMB,即L.plantarum NDF100S-2、L.plantarum HZZC-3和HMB的组合。
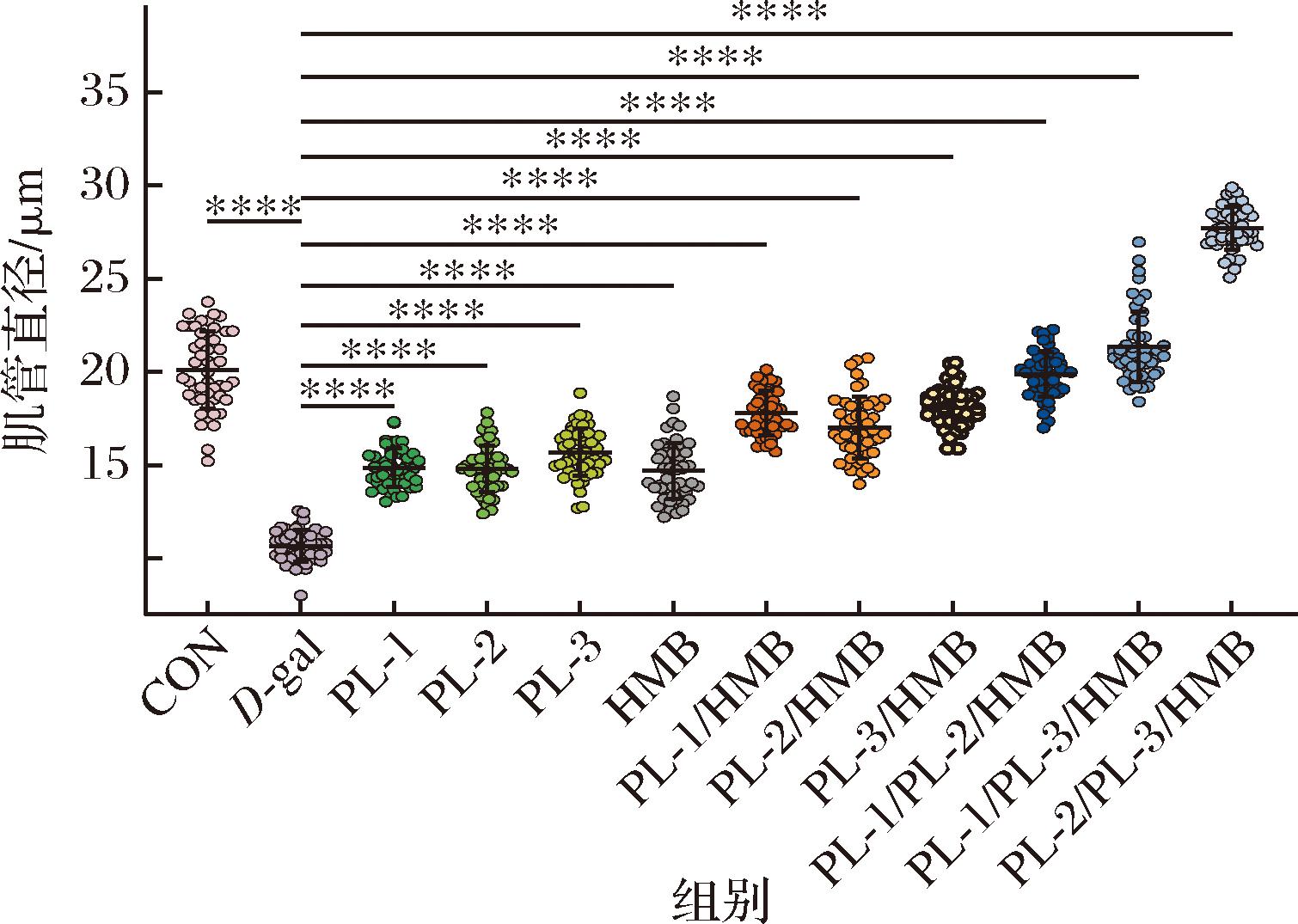
图2 植物乳植杆菌与HMB不同组合的肌管直径
Fig.2 Myotube diameters with different combinations of L. plantarum and HMB
2.5 PL-2/PL-3/HMB组合对肌管力学特性的影响
AFM是一种用于研究物质表面结构和性质的超高分辨率分析仪器[23],通过观察细胞表面形态和三维结构,获得细胞表面积、厚度、宽度和体积等量化参数,从而反映外源条件对细胞特性的影响。利用AFM研究了PL-2/PL-3/HMB组合对肌管力学特性的影响。从不同条件下的肌管表面粗糙度形貌图(图3-a)可知,与正常分化的肌管相比,D-gal处理后的肌管表面的粗糙度和刚度均明显异常增加,肌管表面粗糙度从12.85 nm增加到36.78 nm,肌管刚度从1.88 pN/nm增加到9.86 pN/nm;由图3-b和图3-c可知,L.plantarum NDF100S-2、L.plantarum HZZC-3和HMB联合使用缓解了肌管表面粗糙度和刚度的异常。
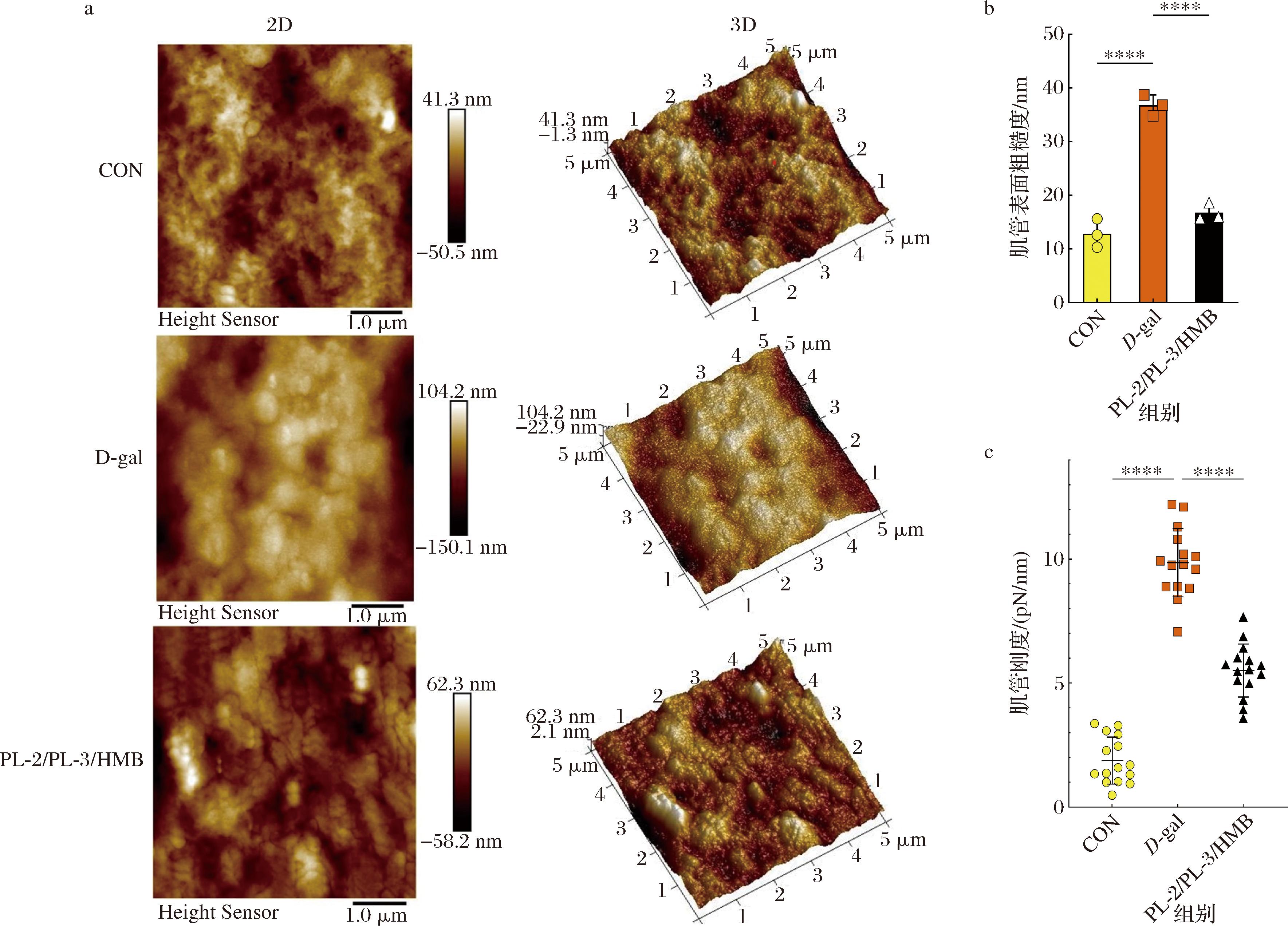
a-不同条件的肌管表面形态;b-不同条件对肌管表面粗糙度的影响;c-不同条件对肌管刚度的影响
图3 植物乳植杆菌NDF100S-2、HZZC-3和HMB联合干预对肌管力学特性的影响
Fig.3 Effects of combined intervention of L. plantarum NDF100S-2, L. plantarum HZZC-3, and HMB on the mechanical properties of myotubes
2.6 PL-2/PL-3/HMB组合对快肌纤维MYH1蛋白的影响
MYH1是肌球蛋白的组成成分和快肌纤维的标记物,参与骨骼肌的发育过程,负责肌肉的收缩和运动。肌少症主要表现为骨骼肌纤维,尤其是快肌纤维的体积和数量减少,且已有研究在老年肌肉中已观察到快肌纤维MYH1蛋白的丢失[24],快肌纤维MYH1蛋白的缺失可能是导致老年人肌少症的重要诱因。利用荧光染色法研究了L.plantarum NDF100S-2、L.plantarum HZZC-3和HMB组合对快肌纤维MYH1蛋白表达的影响。结果如图4-a所示,与D-gal相比,PL-2/PL-3/HMB组合显著上调了快肌纤维MYH1蛋白的表达量,MYH1相对荧光强度分析结果(图4-b)发现PL-2/PL-3/HMB组合恢复了D-gal导致的荧光强度降低,进一步验证表明PL-2/PL-3/HMB可能通过调控快肌纤维MYH1蛋白的表达延缓肌纤维的流失,从而延缓肌少症。
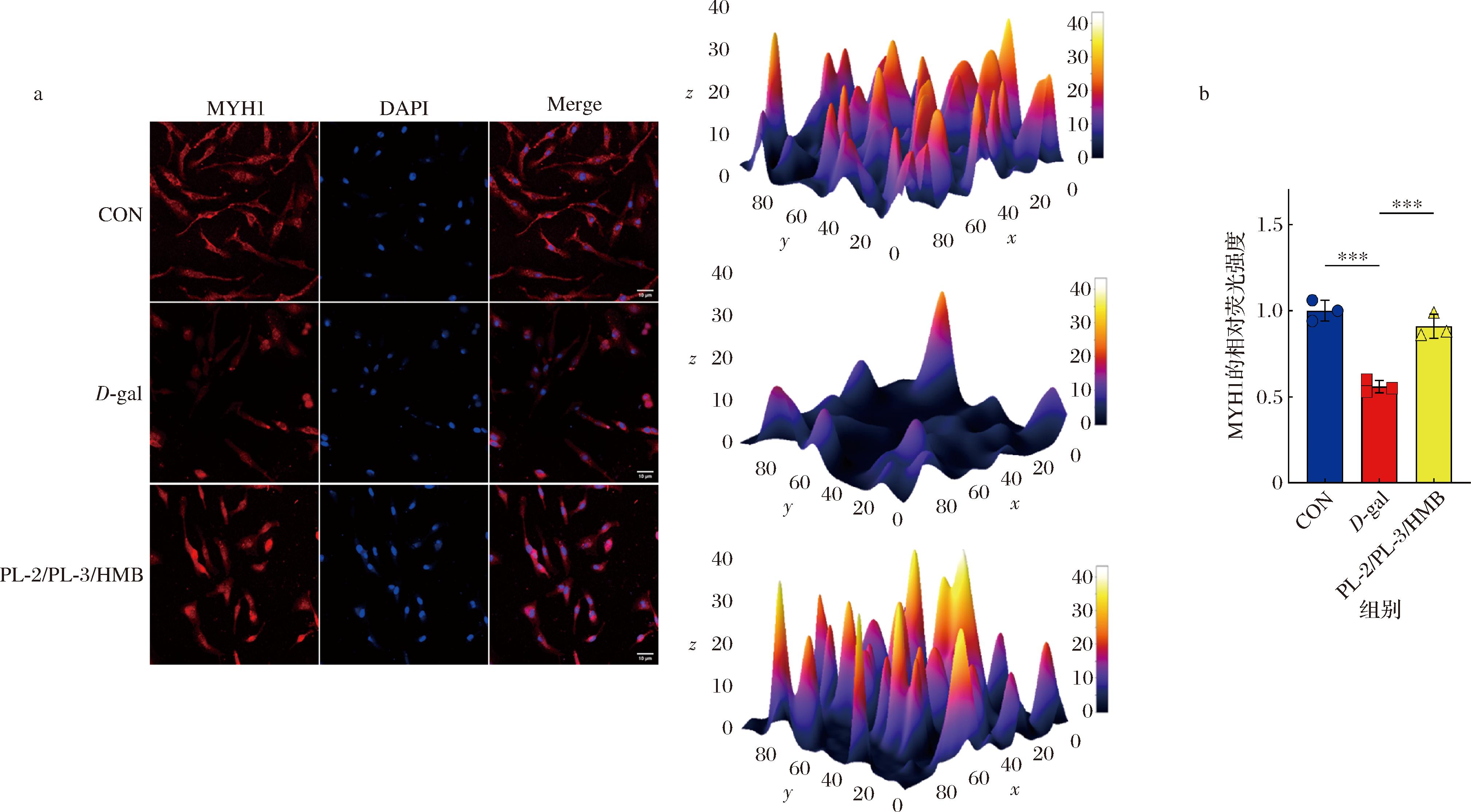
a-肌管的MYH1蛋白荧光染色图;b-MYH1蛋白的相对荧光强度
图4 植物乳植杆菌NDF100S-2、HZZC-3和HMB组合对快肌纤维MYH1蛋白表达量的影响
Fig.4 Effect of the combination of L.plantarum NDF100S-2, L.plantarum HZZC-3, and HMB on MYH1 protein expression in fast muscle fibers
注:***代表差异极显著(P<0.001)。
3 结论
筛选出了3株具有改善肌少症潜力的L.plantarum XC-2、L.plantarum NDF100S-2、L.plantarum HZZC-3,然后利用肌少症细胞模型,探究了单一植物乳植杆菌及复合菌株和HMB联合对肌少症的改善作用。结果发现植物乳植杆菌联合HMB具有显著改善肌少症的效果,L.plantarum NDF100S-2、L.plantarum HZZC-3和HMB为最优复配组合,优于益生菌和HMB单独使用效果;该组合改善了肌少症诱发的肌管表面力学特性异常,提高了快肌纤维MYH1蛋白的表达量,但植物乳植杆菌和HMB联合作用机制还有待进一步深入研究。综上,本研究为开发基于植物乳植杆菌和HMB联合改善肌少症的功能食品或膳食补充剂提供了理论依据。
[1] GIELEN E, BECKWÉE D, DELAERE A, et al.Nutritional interventions to improve muscle mass, muscle strength, and physical performance in older people:An umbrella review of systematic reviews and meta-analyses[J].Nutrition Reviews, 2021, 79(2):121-147.
[2] WU X, LI X, XU M H, et al.Sarcopenia prevalence and associated factors among older Chinese population:Findings from the China Health and Retirement Longitudinal Study[J].PLoS One, 2021, 16(3):e0247617.
[3] 肌少症共识[J].中华骨质疏松和骨矿盐疾病杂志, 2016, 9(3):215-227.Sarcopenia consensus[J].Chinese Journal of Osteoporosis and Bone Mineral Salt Diseases, 2016, 9(3):215-227.
[4] PICCA A, FANELLI F, CALVANI R, et al.Gut dysbiosis and muscle aging:Searching for novel targets against sarcopenia[J].Mediators of Inflammation, 2018, 2018(1):7026198.
[5] CHEN L K, ARAI H, ASSANTACHAI P, et al.Roles of nutrition in muscle health of community-dwelling older adults:Evidence-based expert consensus from Asian Working Group for Sarcopenia[J].Journal of Cachexia, Sarcopenia and Muscle, 2022, 13(3):1653-1672.
[6] YANG C, SONG Y, LI T, et al.Effects of beta-hydroxy-beta-methylbutyrate supplementation on older adults with sarcopenia:A randomized, double-blind, placebo-controlled study[J].The Journal of Nutrition, Health &Aging, 2023, 27(5):329-339.
[7] SANDERS M E.Probiotics and microbiota composition[J].BMC Medicine, 2016, 14(1):82.
[8] CHEN Y M, WEI L, CHIU Y S, et al.Lactobacillus plantarum TWK10 supplementation improves exercise performance and increases muscle mass in mice[J].Nutrients, 2016, 8(4):205.
[9] SHI Y J, CUI X Y, GU S S, et al.Antioxidative and probiotic activities of lactic acid bacteria isolated from traditional artisanal milk cheese from Northeast China[J].Probiotics and Antimicrobial Proteins, 2019, 11(4):1086-1099.
[10] 杨婷玉. 青藏高原抗氧化特性乳酸菌筛选及其对肠道微生态的调节作用[D].兰州:兰州大学, 2023.YANG T Y.Screening of lactic acid bacteria with antioxidant properties in Tibetan Plateau and its regulatory effect on intestinal microecology[D].Lanzhou:Lanzhou University, 2023.
[11] LIN M Y, CHANG F J.Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J].Digestive Diseases &Sciences, 2000, 45(8):1617-1622.
[12] GAO D W, GAO Z R, ZHU G H.Antioxidant effects of Lactobacillus plantarum via activation of transcription factor Nrf2[J].Food &Function, 2013, 4(6):982-989.
[13] KUT K, BARTOSZ G, ![]() M, et al. Antioxidant properties of hispidulin[J]. Natural Product Research, 2022, 36(24):6401-6404.
M, et al. Antioxidant properties of hispidulin[J]. Natural Product Research, 2022, 36(24):6401-6404.
[14] AHIRE J J, MOKASHE N U, PATIL H J, et al.Antioxidative potential of folate producing probiotic Lactobacillus helveticus CD6[J].Journal of Food Science &Technology, 2013, 50(1):26-34.
[15] WU H C, CHEN H M, SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J].Food Research International, 2003, 36(9-10):949-957.
[16] 王佳敏. 新疆传统奶酪中抗氧化乳酸菌优选及微胶囊化[D].石河子:石河子大学, 2022.WANG J M.Optimization and microencapsulation of antioxidant lactic acid bacteria in Xinjiang traditional cheese[D].Shihezi:Shihezi University, 2022.
[17] ![]() S,
S, ![]() B S.A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochemistry, 2006, 68(2):175-180.
B S.A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochemistry, 2006, 68(2):175-180.
[18] 王惋, 侯俊财, 于彤, 等.具有抗氧化和抑菌能力的益生性乳酸菌筛选及鉴定[J].食品与发酵工业, 2020, 46(3):43-49.WANG W, HOU J C, YU T, et al.Screening and identification of probiotic lactic acid bacteria strains with antioxidative and antimicrobial abilities[J].Food and Fermentation Industries, 2020, 46(3):43-49.
[19] 张开屏, 赵艳红, 李权威, 等.乳酸菌抗氧化特性及其katA基因分析[J].中国食品学报, 2021, 21(7):37-43.ZHANG K P, ZHAO Y H, LI Q W, et al.Antioxidant properties of Lactobacillus and its katA gene analysis[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):37-43.
[20] 刘少敏. 不同乳酸菌抗氧化能力比较及其机制的研究[D].哈尔滨:东北农业大学, 2015.LIU S M.Comparison of antioxidant capacity of different lactic acid bacteria and its mechanism[D].Harbin:Northeast Agricultural University, 2015.
[21] MAKRAS L, DE VUYST L.The in vitro inhibition of Gram-negative pathogenic bacteria by bifidobacteria is caused by the production of organic acids[J].International Dairy Journal, 2006, 16(9):1049-1057.
[22] 冯美琴, 栾晓旭, 孙健.3株发酵香肠源乳酸菌体外功能特性的比较[J].食品科学, 2020, 41(24):39-45.FENG M Q, LUAN X X, SUN J.Comparative study on the in vitro functional characteristics of three strains of lactic acid bacteria isolated from fermented sausages[J].Food Science, 2020, 41(24):39-45.
[23] LIU C W, LIU A L, ZHOU J H, et al.Role and mechanism of theaflavins in regulating skeletal muscle inflammation[J].Journal of Agricultural and Food Chemistry, 2022, 70(41):13233-13250.
[24] WANG Y N, KEDLIAN V R.Systematic analysis of muscle aging using joint single-cell and single-nucleus sequencing[J].Nature Aging, 2024, 4(5):621-622.