西兰花,十字花科一年生作物,富含维生素、膳食纤维、多酚和硫代葡萄糖苷等多种生物活性成分,其中硫代葡萄糖苷生成的产物异硫氰酸酯具有显著的防癌、抗癌等功效,而萝卜硫素就是其中含量最高的异硫氰酸酯,也是目前已知的抗癌活性最强的天然物质[1]。许多研究已经报道了西兰花对于肝脏脂肪变性、心血管疾病和降低某些癌症风险具有促进健康作用[1]。因此,西兰花是一种具有保健潜力的功能性食品。然而,新鲜西兰花的水分含量、呼吸速率和酶活性高,极易变质变黄,严重影响其食用品质[1]。因此,降低水分水平来抑制微生物的生长,最大限度地减少生化反应,从而延长西兰花的保质期已成为研究热点。
对于果蔬来说,适当的前处理不仅可以增加热质传递以提高干燥效率,而且还可以减少终端产品的质量劣化[2-3]。前期蒸煮、漂烫、微波等预处理工艺在改善原料的色泽、物理加工性能,降低营养损失,缩短干燥时间方面有良好的效果[4]。热烫是水果和蔬菜中广泛使用的一种前处理方法,漂烫可以软化组织,促进渗透性和热质传递[3]。微波烫漂的技术优势在于穿透力强,传热够快且营养流失较少[5]。WANG等[6]发现,蒸1~3 min可以使西兰花中萝卜硫素(sulforaphane,SF)的含量显著提高。TABART等[7]发现,经过60 s的微波处理后,西兰花中萝卜硫素的含量增加了4倍。因此,本文首先比较3种预处理方式(微波、蒸汽漂烫和热烫)对西兰花花、茎的干燥特性的影响,探究其水分含量及干燥速率的变化趋势,建立相关干燥模型;其次了解热处理对西兰花花、茎的理化性质[萝卜硫苷(glucoraphanin,GLP)、萝卜硫素、多酚]及粉体性质(色泽、休止角、滑动角、堆积密度)的影响;最后根据西兰花的理化性质和粉体性质,评价3种预处理之间的相关性与差异性,为西兰花粉末功能性产品的开发提供新思路。
1 材料与方法
1.1 材料与试剂
新鲜西兰花(购于叮咚买菜):选择完整无虫害的新鲜西兰花,清洗干净后将茎部与花部切分后分开储存。多酚标准品(没食子酸、丁香酸、芦丁、4-羟基肉桂酸、阿魏酸、槲皮素)、GLP、SF,购于上海远业生物科技有限公司。甲醇、乙腈、福林酚,由中国医药集团(国药集团)提供。其他化学试剂均为分析级。
1.2 仪器与设备
JM·A 1002电子天平,诸暨市超泽衡器设备有限公司;微波炉,格兰仕微波炉电器有限公司;不锈钢蒸锅,广东保力实业有限公司;HS-12加热数显磁力搅拌机,群安实验仪器有限公司;CR-400/DP-400色差仪,中国柯尼卡美能达投资有限公司;粉碎机,上海青柠贸易有限公司;旋转蒸发仪,巩义市瑞德仪器设备有限公司;热风干燥箱,上海热丽科技有限公司;L8型紫外可见分光光度计,上海仪电分析仪器有限公司;DK-S 24型电热恒温水浴锅,龙口市先科仪器公司;LC-20 AT高效液相色谱仪,苏州市莱顿科学仪器有限公司。
1.3 实验方法
1.3.1 原料预处理方法
选择无病虫害、无破损的新鲜西兰花,去除多余梗部,并进行清洗,将茎部(S)与花部(F)切分贮存。西兰花的花和茎干燥前采用了3种前处理,包括微波处理(microwave,MT)、热水漂烫(water blanching,WBT)和蒸汽漂烫(steam blanching,SBT),以未经处理的西兰花和花茎为对照。
WBT处理:将切好的花或茎放入装有蒸馏水的烧杯(85 ℃)中浸泡1.5 min,然后将花或茎置于冰水中2.5 min停止反应,并用吸水纸滤干。
SBT处理:将花、茎分别暴露在由蒸汽锅产生的常压蒸汽中1.5 min,然后将处理过的西兰花用冰水冷却2.5 min,并排出多余的水。
MT处理:大约200 g花或茎在家用微波炉中以700 W的功率煮1.5 min。烹调后用冰水冷却2.5 min。
1.3.2 干燥特性研究
在60 ℃、相对湿度为6%、风速为3 m/s的烘箱中,将处理后的西兰花的花和茎均匀地分布在托盘上,恒重干燥。在开始干燥之前,打开烤箱30 min,以达到规定的条件。干燥结束后,取适量烘干西兰花的花和茎放入粉碎机中,于20 000 r/min下粉碎5 s,重复3次,得到西兰花的花和茎粉末用其他指标的测定。
1.3.2.1 含水率(moisture rate, MR)
3种预处理方法在干燥性能上的差异可以通过MR与干燥时间的关系来表示。MR用于预测干燥行为,由公式(1)计算[4]:
(1)
式中:Me为西兰花干燥到平衡时的干基含水率,%;Mt为t时刻西兰花的干基含水率,%;M0为初始时刻西兰花的干基含水率,%。
1.3.2.2 干燥速率(drying rate,DR)
西兰花样品的干燥速率由干燥过程中每15 min蒸发的水分量估算,由公式(2)计算得到[8]:
(2)
式中:Mt1和Mt2分别为t1和t2时的样品含水率。
1.3.2.3 扩散系数Deff
西兰花样品的干燥过程可描述为费克第二扩散定律,见公式(3):
(3)
式中:Deff为有效水分扩散系数,m2/s;L为西兰花样品厚度的一半;m、n为正整数(n=0,1,2…)。lnMR与时间的关系图显示直线斜率为(-π2 Deff/4 L2)。因此,对公式(3)进行了简化,可写成公式(4):
(4)
1.3.3 干燥动力学模型
不同预处理条件下西兰花花和茎的干燥数据拟合到6种常用的干燥动力学模型中,这些模型目前在水果和蔬菜中广泛使用(表1)[4,8-9]。以相关系数(r2)为主要判别标准,均方误差(mean-square error, MSE)表示模型对结果的适合度。
表1 果蔬薄层干燥数学模型
Table 1 Mathematical model of thin layer drying of fruits and vegetables

序号模型名称模型方程1LewisMR=exp(-kt)2Henderson-PabisMR=aexp(-kt)3LogarithmMR=a-bln(t+c)4Two-termMR=aexp(-k0t)+bexp(-k1t)5Two-term Exp.MR=aexp(-kt)+(1-a)exp(-kat)6PageMR=exp(-ktn)
1.3.4 色差的测定
使用色差仪测量样品(新鲜和干燥的西兰花)外观颜色的颜色参数,并表示为L(0=黑色;100=白色),a(-a= 绿色,+a=红色)和b(-b=蓝色,+b=黄色)。每组进行了6次重复测量。h值按公式(5)计算[10]:
(5)
1.3.5 GLP含量的测定
西兰花中的GLP含量用70%(体积分数)甲醇(10 mL)提取0.5 g样品中的GLP,搅拌均匀后在水浴(70 ℃,30 min)中孵育,以固定频率振荡。提取后,混合物在4 ℃(10 000×g,15 min)下离心,收集上清液,重复提取一次,上清液在35 ℃下用旋转蒸发器干燥,用2 mL 超纯水重新溶解干燥的样品,所得溶液通过0.22 μm 膜过滤器进行测定。
采用高效液相色谱仪,以ODSSP C18反相色谱柱(4.6 mm×250 mm,5 μm)为检测器,检测波长230 nm。流动相为5%乙腈-95%水-0.1%甲酸(均为体积分数);等量洗脱,流速1 mL/min,流速25 ℃,洗脱时间6 min。采用GLP标准品建立标准曲线,以mg/g DW表示含量。
1.3.6 SF含量的测定
将2 g西兰花粉与2 mL超纯水混合,并涡旋1 min。将20 mL乙酸乙酯加入到泥浆中,4 ℃条件下超声处理5 min,并振荡20 min,然后于15 000×g下离心10 min,取上清液,15 mL乙酸乙酯对剩下物质重复提取一次。2次上清液混合后于35 ℃下旋蒸,用 2 mL 30%(体积分数)的乙腈重溶,过0.22 μm膜,-20 ℃保存。
在用于测定GLP含量相同的C18色谱柱上进行层析分离,用于测定SF含量。流动相A为0.1%(体积分数)冰醋酸的水溶液,流动相B为0.1%(体积分数)冰醋酸的乙腈溶液。分离条件为:0~2 min,10% B;2~5 min,25% B;5~10 min,10% B;检测波长201 nm;柱温30 ℃;进样量20 μL;根据标准曲线测定SF的含量。
1.3.7 总酚含量的测定
取各组样品0.50 g,加入15 mL 70%(体积分数)乙醇溶液,覆盖保鲜膜后置于磁力搅拌器上搅拌40 min,滤出滤液,将剩余物倒入烧杯,再加入15 mL 70%(体积分数)的乙醇,反复进行萃取。将2次滤液合并。将滤液倒入蒸馏烧瓶中,用旋转蒸发仪65 ℃、0.1 MPa真空蒸发至干,随后往蒸馏烧瓶中加入甲醇,超声辅助溶解,并定容至10 mL,最后置于15 mL离心管中封口放入4 ℃冰箱中冷藏。取各组样品提取液0.1 mL,加入0.5 mL的福林酚试剂和2 mL的7.5%(体积分数)碳酸钠溶液,然后将其补水到10 mL,置于70 ℃水浴锅中水浴30 min,在750 nm处测定吸光值。同时以标准没食子酸溶液作标准曲线。
1.3.8 单体酚含量的测定
样品中单体酚的测定参照HPLC-UV方法。所用色谱柱与上述实验相同(Waters,4.6 mm×150 mm,3 μm粒径)。流动相A为5%(体积分数)乙腈,流动相B为95%(体积分数)乙腈,时间程序为:0~5 min,30% B;5~25 min,60% B;25~30 min,100% B;30~35 min,7% B。进样体积为20 μL。
1.3.9 堆积密度的测定
分别精确称取15 g热风干燥粉,将其送入50 mL量筒,过程中尽量使其与筒壁的黏连最小化,充分振实,直至量筒内粉体体积不发生改变为止。读取粉体体积,每个样品重复测定3次,取平均值。计算如公式(6)所示:
堆积密度![]()
(6)
1.3.10 休止角的测定
将一漏斗竖直地固定在铁架平台上,漏斗底部与水平面有一段距离,使适量的样品粉末均匀地穿过漏斗,直至粉末堆积的锥形顶端接触到漏斗的底部,然后测量该锥形的直径D,对每一试样重复进行5次测量。计算如公式(7)所示:
(7)
式中:θ为粉体的休止角,°;H为漏斗最下端距离水平表面的距离,cm;D为粉末堆积的圆锥体的直径,cm。
1.3.11 滑动角的测定
称取5 g粉末放在一长方形光滑玻璃板中央,玻璃板一边固定,然后缓慢抬起另一边,直至超过90%粉体滑落。此时玻璃板与水平面之间的角度即为滑动角θ(°),每个样品重复进行5次测量。
1.4 数据分析
数据结果表示为“平均值±标准差”。采用IBM SPSS Statistics 22(IBM,Chicago, USA),通过Duncan多范围测试在95%置信水平(P<0.05)上对数据进行显著性分析,除非特别说明,试验均需重复3次。
2 结果与分析
2.1 干燥过程中西兰花花和茎的MR及DR变化
图1-A和图1-B分别显示了花、茎的MR随干燥时间的变化,其干燥曲线均符合一般食品干燥特性曲线。在初期,水分的蒸发速度很快,但在干燥后期,水分的蒸发速度没有明显的变化,干燥曲线呈现出平缓的趋势。此外,对照组的干燥时间最长,其中花的干燥时间为255 min,而经MT、SBT、WBT处理后的干燥时间分别减少到165、195、210 min,这表明3种预处理方式可以显著缩短西兰花的干燥时间。最初,主要的水分被蒸发,这可能归因于更快地去除表面水分;在105 min后,MR迅速下降,因为水分向物料表面扩散的速度减慢[11]。在南瓜、白芨、苹果等其他食物中也发现了类似的趋势[4,12-13]。DR曲线如图2-A和图2-B所示,花、茎的DR值均呈现先增加后减小的趋势。不同的是,在花的干燥过程中,没有出现恒定的干燥阶段,在0.25 h左右达到峰值,然后进入降速阶段;而茎在0.25~0.5 h经历了一个短暂的平台期,但整个干燥过程也属于降速阶段。3种预处理后的初始阶段干燥速率均比对照组的干燥速率更快,推测初始的DR值高可能是由于游离水易蒸发所致[11]。0.75 h后,大部分自由水被蒸发掉,此后蒸发的主要是结合水,同时热风干燥过程中的表面积收缩也可能会抑制水分的迁移,因此后期DR值较低。此外,热风干燥过程中西兰花表面的收缩可能会抑制水分的迁移[14]。总的来说,MT-F和MT-S具有最高的DR值,这可能是由于热能显著影响了西兰花中的水分运动。在芒果片和山药片中也具有类似的干燥过程现象[11,15]
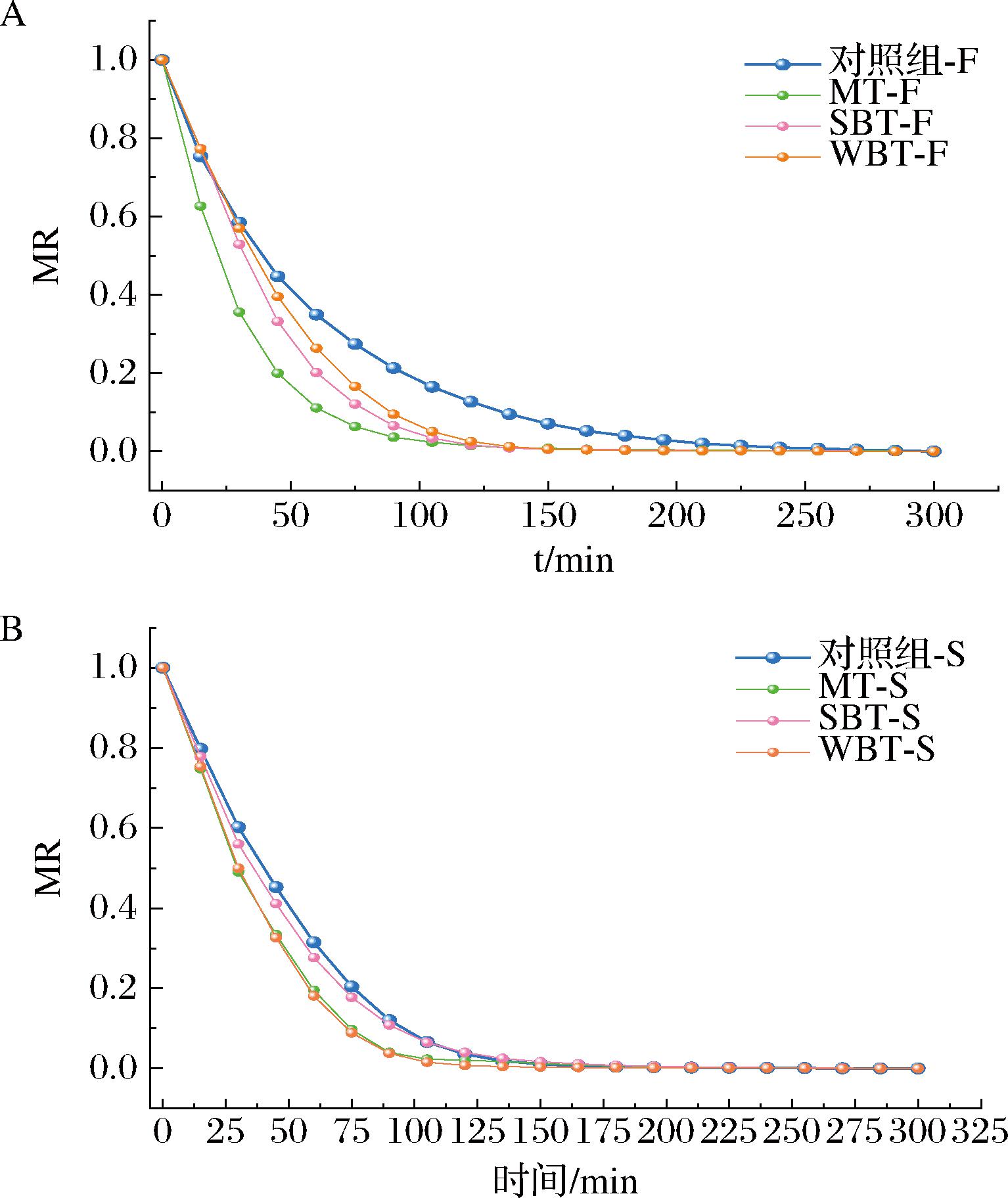
A-花;B-茎
图1 不同预处理对西兰花花和茎MR的影响
Fig.1 Effect of different pretreatment on MR of flower and stem of broccoli
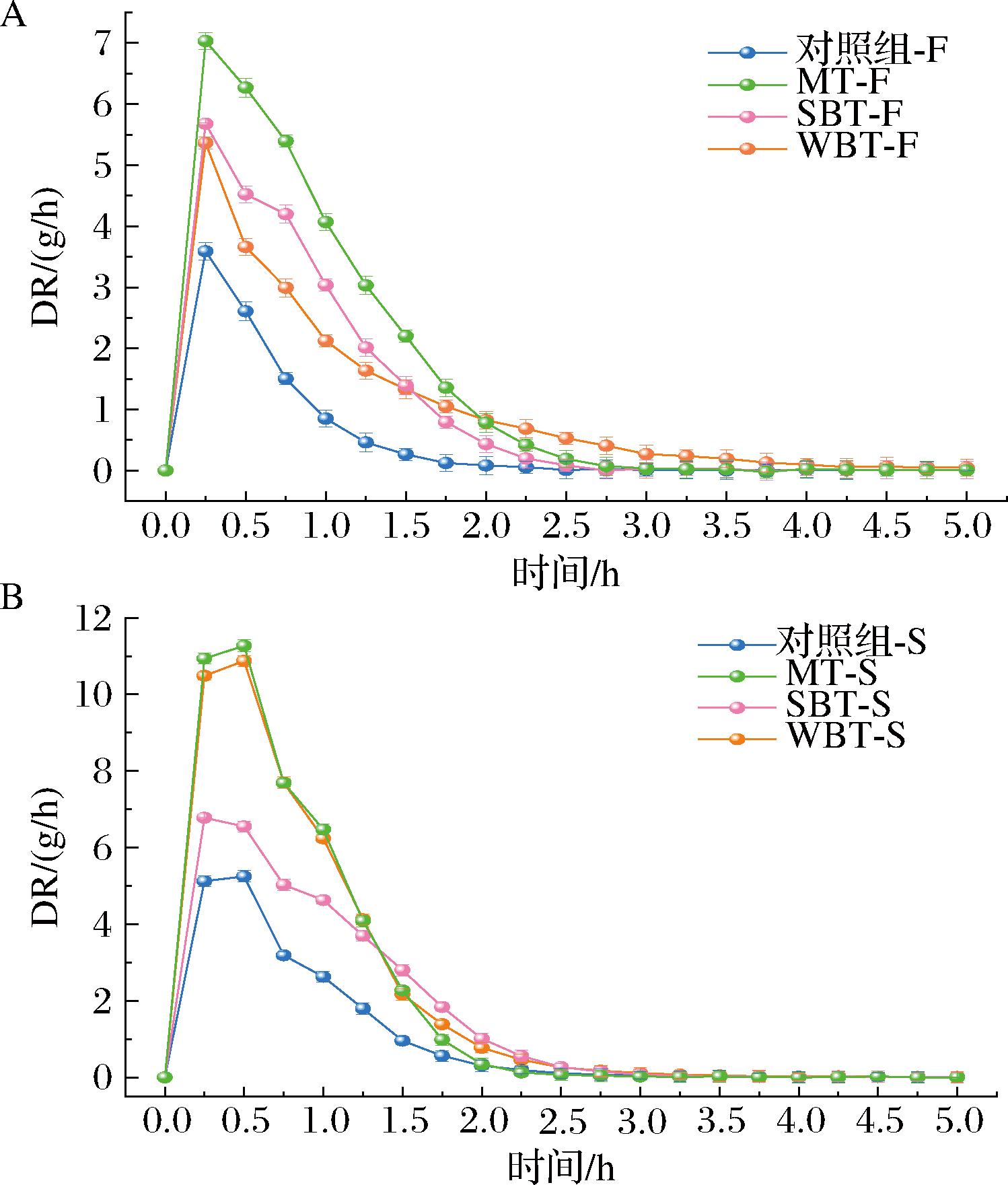
A-花;B-茎
图2 不同预处理对西兰花花和茎DR变化的影响
Fig.2 Effects of different pretreatment on DR of broccoli and stem
2.2 有效水分扩散系数Deff的变化分析
经不同预处理后的花、茎干燥过程中的Deff值如图3所示,样品的Deff值在2.14×10-7~3.59×10-7 m2/s变化,其中花、茎中WBT样品的Deff值均为最高,分别为3.38×10-7 m2/s和3.59×10-7 m2/s。与对照组相比可以发现,经MT、SBT和WBT处理后,水分子由于克服了来自西兰花基质的阻力使得有效水分扩散系数增加。由图3可知,SBT和WBT引起的软化部分比MT诱导的部分对降低传质阻力的贡献更大。因此,细胞间隙的增大更容易使细胞内的水分子向外扩散。西兰花花、茎干燥过程中出现的这一复杂现象与水分在液体和蒸气状态下的状态有关。Deff是决定干燥过程中传质的重要指标,它随含水量的变化是一个复杂的过程。它依赖于内部的传质过程,如液体扩散、蒸汽扩散、表面扩散、毛细流动和流体动力流动,而影响其内部传质的因素很多,如温度、基质特性、前处理等。RAJORIYA等[16]发现热风辅助折光窗干燥的苹果片的Deff值为2.0×10-10~1.4×10-9 m2/s。CHAO等[4]的研究结果表明,经漂烫、超声波和冻融处理后,热风干燥籽用南瓜的Deff值为2.5×10-6~4.7×10-6 m2/s,其中样品厚度、前处理、干燥方法和基质特性等因素都对Deff值有影响。水份扩散率受样品厚度、预处理、干燥方式和基质特性等因素的影响。有趣的是,SBT和WBT可以去除植物细胞和组织中被困的空气,并通过细胞软化来增加水分扩散率,从而减少阻碍[17]。
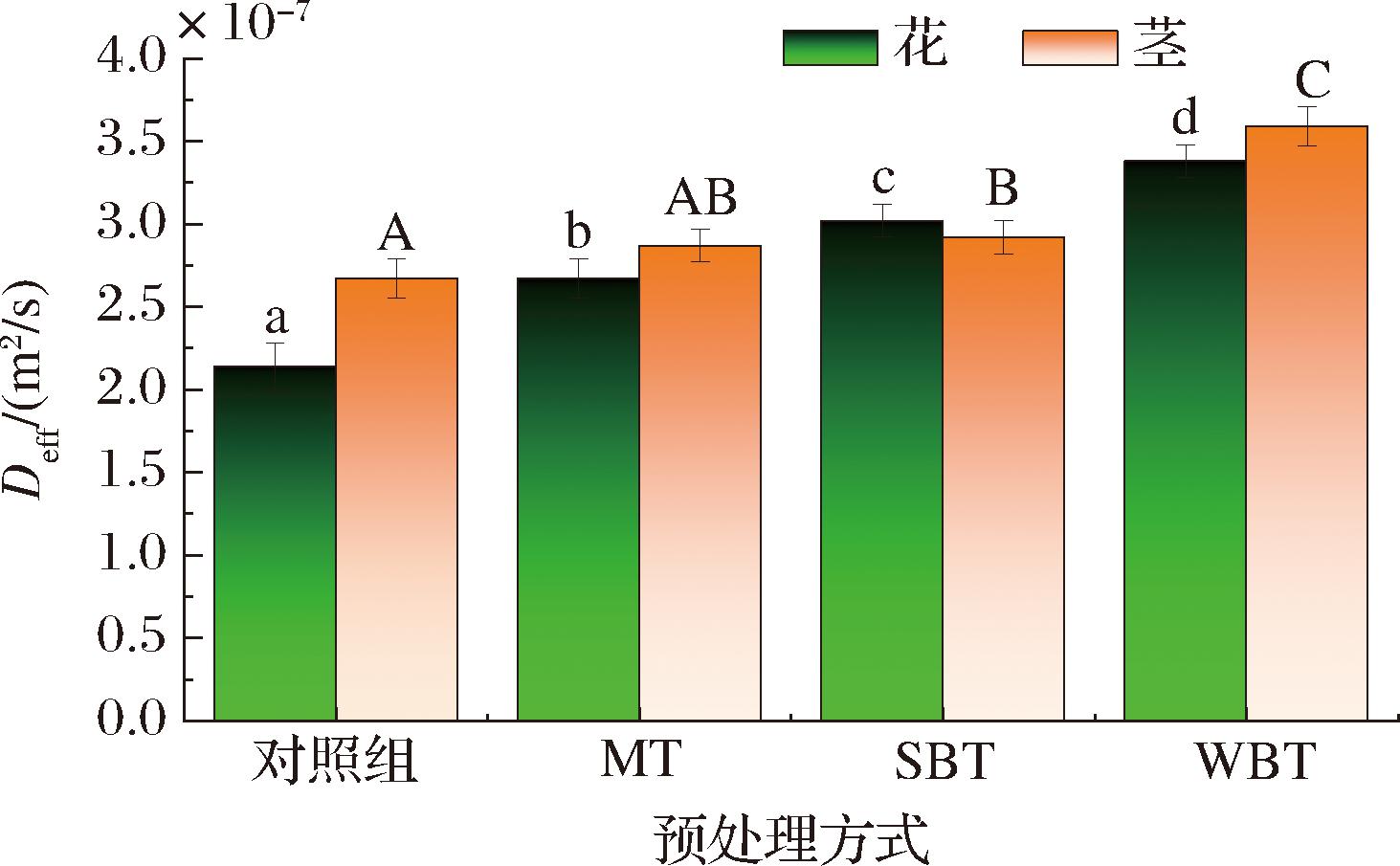
图3 不同预处理后的西兰花花和茎的Deff值
Fig.3 Deff values of broccoli flowers and stems after different pretreatment
注:不同大写字母代表茎中组间差异显著(P<0.05);不同小写字母代表花中组间差异显著(P<0.05)(下同)。
2.3 西兰花干燥模型拟合结果分析
图4-A~图4-H显示了6个模型对实验数据和预测结果的差异,其中5个模型(Lewis,Henderson-Pabis,Two-term,Two-term Exp.,Page)可以很好地描述花、茎的干燥过程。此外,可以根据表2中r2和MSE值的统计数据比较,在6个模型中,r2和MSE值分别在0.761 02~0.999 95和3.998 03×10-6~7.21×10-3变化。在所有模型中,Page模型对于8个样品(对照组-F、MT-F、SBT-F、WBT-F、对照组-S、MT-S、SBT-S和WBT-S)有着最高的r2值和最低的MSE值。因此,Page模型能较好地描述西兰花花、茎的干燥过程。另外,Page模型也被用来预测许多蔬菜和水果的干燥特性,如南瓜,番石榴,卷心菜[4,8,18]。另一方面,定义不同预处理后西兰花干燥动力学的最佳干燥模型是不同的。由于r2值较高(0.999 68, 0.999 41),MSE值较低(2.458 6×10-5, 4.307 3×10-4),Two-term模型是描述对照组-F和对照组-S干燥行为的最佳模型。Two-term模型的适应度优于Lewis和Henderson-Pabis模型。

A-对照组-F;B-对照组-S;C-MT-F;D-MT-S;E-SBT-F;F-SBT-S;G-WBT-F;H-WBT-S
图4 干燥模型拟合
Fig.4 Drying model fitting
表2 不同预处理条件下西兰花花和茎的模型参数
Table 2 Model parameters of broccoli flower and stem under different pretreatment conditions

模型参数样品名称对照组-FMT-FSBT-FWBT-F对照组-SMT-SSBT-SWBT-SLewisk0.017 60.034 650.024 980.022 430.020 400.025 480.021 740.026 59r20.999 580.998 770.988 890.989 940.986 950.990 050.992 770.987 38MSE3.222 4×10-57.915 8×10-58.828 5×10-48.282 6×10-41.13×10-37.623 0×10-45.908 3×10-49.833 1×10-4a0.992 411.012 531.050 821.045 911.000 41.000 51.040 81.048 8Henderson-Pabisk0.017 470.035 030.026 070.023 320.025 80.025 480.022 520.027 68r20.999 620.998 850.990 580.991 30.958 730.989 550.993 90.988 81MSE2.925 4×10-57.380 7×10-57.486 8×10-47.166 3×10-43.58×10-38.005 3×10-44.985 8×10-48.722 8×10-4a1.220 860.900 930.828 50.969 571.094 121.182 720.991 30.767 58b0.224 190.171 470.158 250.184 260.206 950.224 340.187 380.147 4Logarithmc-7.619 170-13.658 8-12.328 9-11.220 60-12.124 6-13.95r20.975 010.761 020.912 940.915 410.919 280.809 460.928 690.899 01MSE1.1×10-35.58×10-33.58×10-33.81×10-34.08×10-37.21×10-33.2×10-33.92×10-3a0.994 571.012 771.059 141.055 891.066 971.048 381.049 261.058 28b-0.683 85-0.341 38-9.475 72-3.601 89-8.010 3-3.435 04-9.092 2-0.206 4Two-termk00.017 190.034 980.025 130.022 280.020.026 350.021 570.026 61k11.159 061.567 481.539 556.221 692.089 511.3651.502 880.629 23r20.999 680.998 720.990 760.988 320.999 410.991 270.994 530.989 15MSE2.458 6×10-58.236 6×10-57.343 5×10-49.620 4×10-44.307 3×10-46.689 9×10-44.469 8×10-48.459 0×10-4a0.882 810.998 371.892 071.819 691.844 831.837 261.858 481.895 0Two-term Exp.k0.017 860.029 470.036 290.031 280.028 780.036 930.020 780.038 49r20.999 560.987 240.999 820.998 960.998 070.998 720.992 370.998 77MSE3.388 13×10-58.209 47×10-41.408 93×10-58.553 91×10-51.669 27×10-49.778 07×10-56.229 74×10-49.603 39×10-5k0.018 930.024 230.007 190.007 480.005 840.008 870.008 790.007 16Pagen0.982 981.099 631.320 141.272 861.303 561.280 631.223 471.340 97r20.999 630.999 780.999 950.999 40.998 830.998 990.999 60.999 42MSE2.839 59×10-51.402 85×10-53.998 03×10-64.906 1×10-56.013 36×10-47.721 64×10-53.271 56×10-54.484 54×10-5
6个模型计算出的参数如表2所示,干燥常数与物料性能密切相关[19]。在Lewis和Henderson-Pabis模型中,MT、SBT和WBT后的干燥常数值有所提高。k值的升高趋势可以解释为西兰花样品的细胞结构和成分的变化,这直接影响了干燥特性。由此可见,西兰花经MT、SBT和WBT处理后的预测MR值和试验MR值与干燥时间相吻合。此外,不同预处理后MR的变化与干燥时间密切相关。因此,Page模型和Two-term模型可以很好地描述样品性质随时间的变化,以评价预处理后西兰花花和茎的干燥过程。
2.4 不同预处理对GLP和SF含量的影响
GLP来自甲硫氨酸,是广泛存在于十字花科植物中的一种特有的次生代谢产物,在西兰花中的硫代葡萄糖苷中占比50%以上[1]。西兰花的花、茎中测得的GLP含量的结果如图5-A和图5-B所示,GLP的增加率如图5-C和图5-D所示。其中对照组-F、MT-F、SBT-F和WBT-F的GLP含量分别为8.89、24.24、47.04、19.78 mg/g DW。理论上来说,SF的产生直接影响西兰花中GLP的含量。同时,SF是西兰花中重要的生物活性成分,具有防癌作用,并能影响西兰花的苦味[1]。由图5-A和图5-C可知,对照-F和对照组-S的SF含量分别为57.70 μg/g DW和49.41 μg/g DW。在3种预处理的干燥过程中,西兰花花和茎中SF的含量呈现一致的变化规律。经MT、SBT和WBT处理的西兰花的花中SF含量分别降至41.08、13.94、52.39 μg/g DW。SF含量降低的原因主要分为2个方面。一方面,SF是细胞破碎后,在黑芥子酶的催化下,GLP降解产生的[1]。黑芥子酶是一种β-硫代葡萄糖苷酶葡萄糖水解酶,它可以裂解GLP的葡萄糖苷键并产生中间体,根据不同的pH、上皮指示蛋白(enterococcus surface protein,ESP)的存在等重新排列成萝卜硫素或萝卜硫素腈[20]。因此,热预处理下黑芥子酶的失活不利于萝卜硫素的产生。另一方面,SF是高度不稳定的,其不稳定性主要取决于缓冲溶液、黑芥子酶和ESP的活性、pH、温度、光照[1],这些因素使西兰花干燥过程中SF的产生和积累复杂化。同样,JONES等[21]报道,西兰花煮沸2~5 min后,SF含量可降低约95%。TABART等[7]观察到,在微波炉加热3 min后,西兰花中的SF下降到无法检测的水平。相反,LU等[22]测量了MT后西兰花中SF的含量,发现高功率MT可以增加SF的含量,并保持SF的生物利用度。
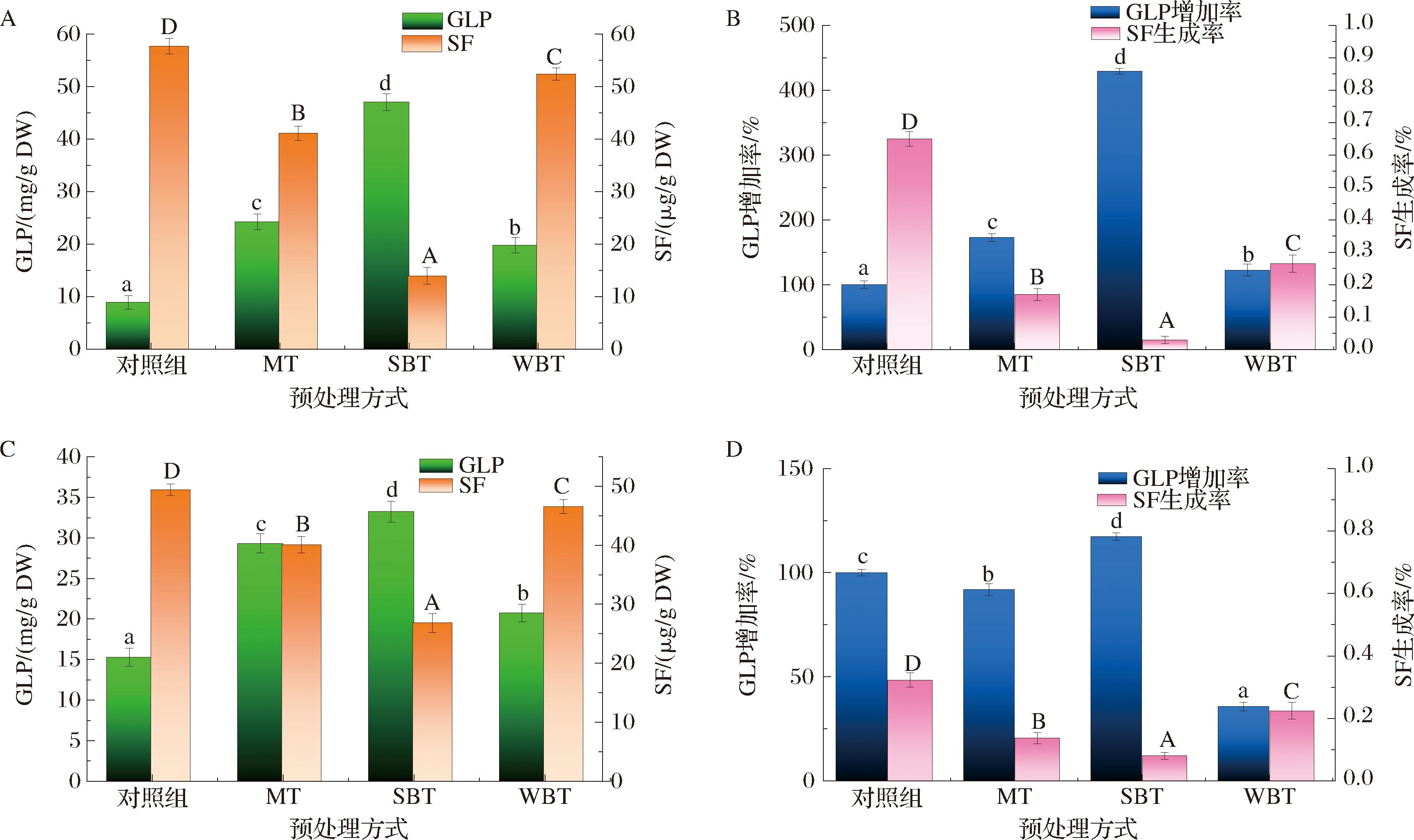
A-花中GLP和SF含量;B-花中GLP增加率和SF生成率;C-茎中GLP和SF含量;D-茎中GLP增加率和SF生成率
图5 预处理对西兰花花和茎中GLP和SF含量以及花和茎中GLP增加率和SF生成率的影响
Fig.5 The influence of pretreatment on the content of GLP and SF in broccoli flower and stem, as well as the increase rate of GLP and the generation rate of SF in flower and stem
2.5 不同预处理对西兰花总酚和单体酚含量的影响
多酚类物质是西兰花中重要的营养和生物活性成分。图6显示了经MT、SBT和WBT处理后热风干燥的花、茎的总酚含量。花的总酚含量为4.69~6.96 mg/g DW,茎的总酚含量为2.51~3.73 mg/g DW,数据显示对应预处理组的花的总酚含量均高于茎。这一现象与之前THOMAS等[23]研究结果一致,在论文中,西兰花中总酚含量为3.8~6.1 mg/g DW。且花的总酚比茎高出63%。与对照组相比,MT、SBT和WBT处理提高了西兰花中总酚的含量,且3种处理间差异显著。总酚含量在MT、SBT和WBT后分别增加39%、48%和16%,其中,SBT-F样品的总酚含量最高,为6.96 mg/g DW。主要原因可能有以下几个方面。首先,热预处理可能导致细胞破坏,导致氧化酶失活[24]。3种处理后多酚含量的增加主要是由于高温下多酚氧化酶的活性下降甚至失活,从而阻止酚类物质被进一步氧化[4]。其次,热预处理导致细胞结构的破坏,包括细胞膜和细胞壁的破裂,促使某些多酚物质的释放,因此增加了酚类物质的萃取率[4]。多酚包括游离态多酚和结合态多酚,多酚含量的增加与结合多酚的释放密切相关。多酚和胞内蛋白质之间的共价键和氢键在热处理过程中可能被破坏,因此结合多酚被释放并转化为游离多酚[25]。KIM等[26]的一项研究表明,微波2~4 min后西兰花的总酚含量得以增加,这与实验结果一致,原因可能是由于酚类物质之间分子间相互作用的破坏。然而,ZHANG等[10]研究表明,与对照样品相比,微波2 min的西兰花总酚含量降低。不同微波样品的不同结果可能是不同的微波炉功率和样品大小造成的。此外,在100 ℃下漂烫的西兰花比在60 ℃漂烫的对应小花的总酚含量更低,这也可能是由于酚类化合物的热降解[27]。
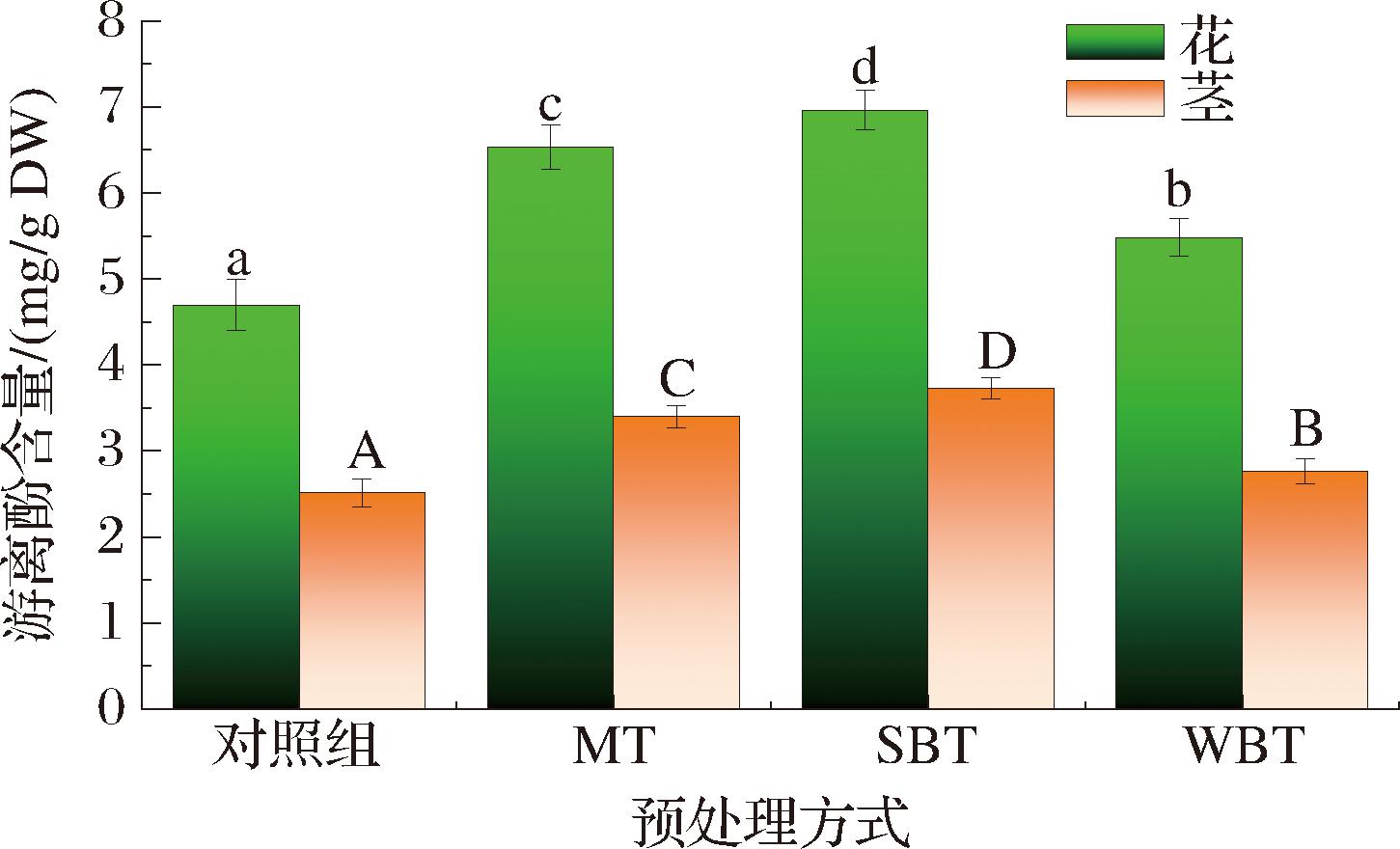
图6 不同预处理下西兰花花和茎中总酚含量
Fig.6 Total polyphenols content of broccoli flower and stem under different pretreatment
如表3所示,丁香酸、芦丁和槲皮素是花中主要的单体酚,其含量分别为68.82、562.14、120.87 μg/g。而在MT-F中,丁香酸、芦丁和槲皮苷的含量分别增加到185.65、869.60、129.64 μg/g。而FEKI等[28]的研究可以解释这一现象,他讨论了微波对霍霍巴籽多酚提取的影响,表明吸收的微波能量转化为热能并积累在基质中,所以提高温度更有利于多酚类物质的提取。MT-F样品中芦丁的含量为869.60 μg/g,是所有样品中含量最高的。这是由于芦丁不具有热不稳定特性,所以经热处理后,芦丁成分可以保持较高的含量。此外,茎中的单体酚含量均小于花。根据表3,茎中没食子酸、丁香酸、芦丁和槲皮素的含量分别为4.48~41.10、9.68~18.80、108.59~162.19、49.17~53.61 μg/g,而4-羟基肉桂酸和阿魏酸在茎中未检测到。然而,茎中的游离酚也表现出了类似花一样的趋势,特别是丁香酸的含量,相比对照增加了94%。这些变化可能有2个方面的原因。一方面,多酚可能会经历几个衍生反应,而美拉德反应可能会产生新的酚类物质。另一方面,由于细胞结构的改变,纤维素与酚类之间的黏附性会减弱,游离酚被释放出来[29]。总而言之,总酚和单体酚分析都表明,与茎相比,花中的多酚含量更高。3种处理(MT、SBT和WBT),特别是MT处理后的样品,多酚含量显著提高,而对于单体酚来说有正面或者负面的影响。
表3 不同预处理下西兰花花、茎单体酚含量 单位:μg/g
Table 3 Content of individual polyphenols in flower and stem of broccoli under different pretreatment

样品没食子酸丁香酸芦丁4-羟基肉桂酸阿魏酸槲皮素分子结构花(F)42.22b±0.3668.82a±0.36562.14b±0.5621.51c±0.3894.06d±0.26120.87a±1.73MT-F59.07d±0.29185.65d±0.29869.60d±1.3617.38b±0.5672.35c±0.29129.64b±1.06SBT-F55.40c±0.74124.39c±0.74777.75c±0.7916.40b±0.4762.97b±0.26141.91c±0.67WBT-F29.40a±0.5885.06b±0.58145.41a±1.4813.74a±0.3939.33a±0.26156.87d±0.38茎(S)37.89c±0.179.68a±0.17154.95c±0.65NDND49.17a±0.68MT-S41.10d±0.1818.80c±0.18162.19d±0.29NDND49.37a±0.72SBT-S30.47b±0.1711.94b±0.17147.70b±0.49NDND52.42b±0.65WBT-S4.48a±0.1611.70b±0.16108.59a±0.67NDND53.61b±0.83
注:ND表示未检测到,不同小写字母代表花和茎中组间差异显著(P<0.05)(下同)。
2.6 预处理对西兰花色泽的影响
测定3种预处理后西兰花的颜色参数(L、a、b和h)变化。L值表示西兰花样品的亮度,如图7所示,干燥后花、茎的L值分别为60~68和70~79。值得注意的是,经预处理后,MT-F、SBT-F和WBT-F的L值都均高于对照组。对于红绿值a,所有样本都显示负值,并且在经MT、SBT和WBT 3种预处理之后,绿色程度都有所增加。对照-F样品的a值最低,为-4.78,而经MT、SBT和WBT后的a值分别增加了16%、33%和12%。可以观察到,SBT-F样品的绿度最高,为-6.41,这表明SBT是其中保护西兰花绿度最有效的方法。同样地,通过图7-C可以发现,对照-F组表现出黄色,经预处理后花的黄度减小。研究表明,西兰花在热风干燥过程中容易发生褐变,这与多酚氧化酶、抗坏血酸氧化、美拉德和焦糖反应密切相关[29]。此外,色调角被认为是视觉上的关键颜色外观,图7-D显示的色调角反映了颜色的综合变化[29]。西兰花在经MT、SBT和WBT处理后h值增加,可能是由于酶的失活和成分的流失导致了更高的反射率[30]。这些数据表明,MT、SBT和WBT有助于保护西兰花的颜色,其中特别是SBT,对西兰花的绿度有显著的保护作用。
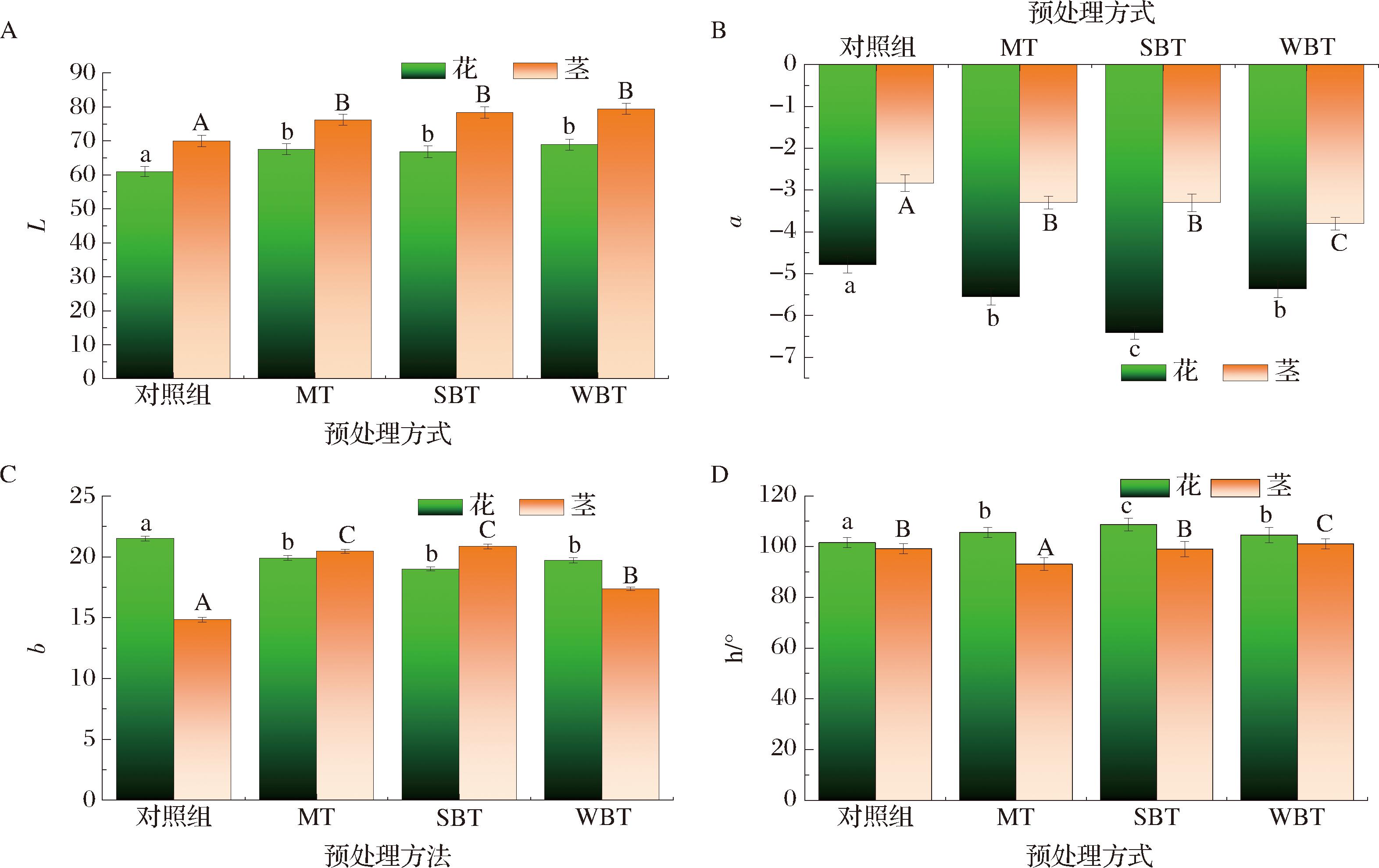
A-L值;B-a值;C-b值;D-h值
图7 不同预处理对西兰花花和茎色泽的影响
Fig.7 Effect of different pretreatment on flower and stem color of broccoli
2.7 预处理对西兰花粉体流动性和压缩成型性的影响
良好的粉体流动性是保障片剂、胶囊等制剂正常生产的前提。休止角和滑动角能体现粉体的流动性的好坏,休止角愈小,摩擦力愈小,流动性愈好。通常认为:休止角 θ≤30°时,流动性较好;休止角 θ≤40°时,能够满足工艺的流动性需求。由表4可得,休止角大小顺序依次为,MT>对照>SBT>WBT,滑动角结果与其基本一致。堆积密度影响压片成型的效果,研究发现,堆积密度愈大,对压片成型的作用愈明显。SBT和WBT样品的堆积密度要显著大于其他2种(P<0.05),更有利于压片成型。
表4 不同预处理方式对粉体流动性和压缩成型性的影响
Table 4 Effect of different pretreatment methods on fluidity and compression formability of powder
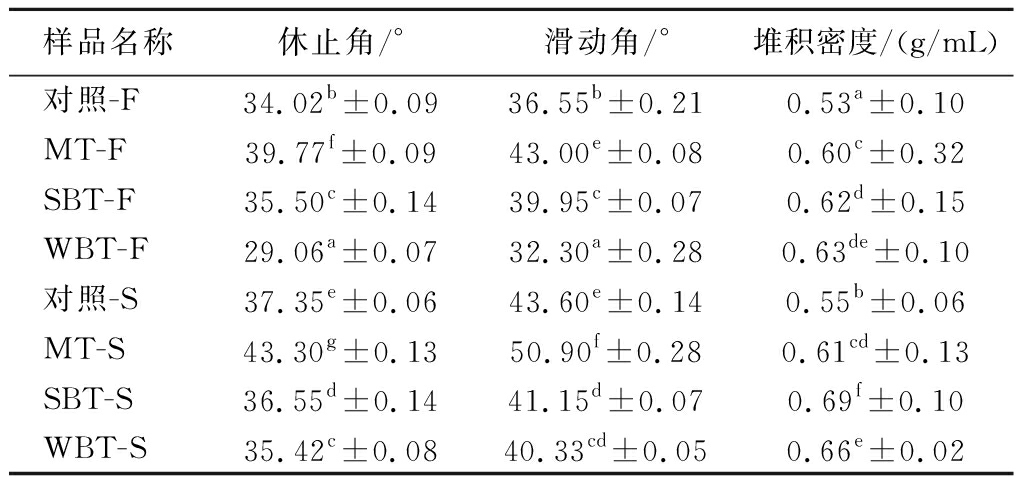
样品名称休止角/°滑动角/°堆积密度/(g/mL)对照-F34.02b±0.0936.55b±0.210.53a±0.10MT-F39.77f±0.0943.00e±0.080.60c±0.32SBT-F35.50c±0.1439.95c±0.070.62d±0.15WBT-F29.06a±0.0732.30a±0.280.63de±0.10对照-S37.35e±0.0643.60e±0.140.55b±0.06MT-S43.30g±0.1350.90f±0.280.61cd±0.13SBT-S36.55d±0.1441.15d±0.070.69f±0.10WBT-S35.42c±0.0840.33cd±0.050.66e±0.02
3 结论
本研究采用MT、SBT和WBT的预处理方式分别对西兰花的花、茎进行热风干燥。对处理后的花、茎干燥过程的评价表明,整个干燥过程属于降速干燥阶段。经MT、SBT、WBT处理后,西兰花在干燥过程中的平衡时间分别缩短了36%、24%和18%,3种前处理均能有效地促进传质过程。实验数据与Page模型吻合较好(r2>0.99),可较好地用于评价西兰花花、茎的干燥过程。此外,与MT和WBT相比,SBT对西兰花的绿度有显著的保护作用。3种预处理均有利于提高样品的总酚含量,其中WBT-F的多酚类物质含量最高,相比对照组增加了48%,特别是丁香酸,在花、茎中的含量分别增加了169%和94%。SBT和WBT粉体的流动性较好而堆积密度较大,因此更适合于片剂等剂型产品的开发。
[1] LIU B N,TAO Y,MANICKAM S, et al.Influence of sequential exogenous pretreatment and contact ultrasound-assisted air drying on the metabolic pathway of glucoraphanin in broccoli florets[J].Ultrasonics Sonochemistry,2022,84:105977.
[2] VARGAS L,KAPOOR R,NEMZER B,et al.Application of different drying methods for evaluation of phytochemical content and physical properties of broccoli, kale, and spinach[J].LWT,2022,155:112892.
[3] ZHU R,JIANG S R,LI D D, et al.Dehydration of apple slices by sequential drying pretreatments and airborne ultrasound-assisted air drying:Study on mass transfer, profiles of phenolics and organic acids and PPO activity[J].Innovative Food Science &Emerging Technologies,2022, 75:102871.
[4] CHAO E P,LI J W,FAN L P.Enhancing drying efficiency and quality of seed-used pumpkin using ultrasound, freeze-thawing and blanching pretreatments[J].Food Chemistry, 2022, 384:132496.
[5] JIANG H Y,LING B,ZHOU X,et al.Effects of combined radio frequency with hot water blanching on enzyme inactivation, color and texture of sweet potato[J].Innovative Food Science &Emerging Technologies,2020,66:102513.
[6] WANG G C,FARNHAM M,JEFFERY E H.Impact of thermal processing on sulforaphane yield from broccoli (Brassica oleracea L.ssp.Italica)[J].Journal of Agricultural and Food Chemistry,2012, 60(27):6743-6748.
[7] TABART J, PINCEMAIL J, KEVERS C, et al.Processing effects on antioxidant, glucosinolate, and sulforaphane contents in broccoli and red cabbage[J].European Food Research and Technology, 2018, 244(12):2085-2094.
[8] HAWA L C, UBAIDILLAH U, MARDIYANI S A, et al.Drying kinetics of cabya (Piper retrofractum Vahl) fruit as affected by hot water blanching under indirect forced convection solar dryer[J].Solar Energy, 2021, 214:588-598.
[9] DHURVE P, KUMAR ARORA V, KUMAR YADAV D, et al.Drying kinetics, mass transfer parameters, and specific energy consumption analysis of watermelon seeds dried using the convective dryer[J].Materials Today:Proceedings, 2022, 59:926-932.
[10] ZHANG Z W, LI J Y, FAN L P.Evaluation of the composition of Chinese bayberry wine and its effects on the color changes during storage[J].Food Chemistry, 2019, 276:451-457.
[11] SAHOO M, TITIKSHYA S, ARADWAD P, et al.Study of the drying behaviour and color kinetics of convective drying of yam (Dioscorea hispida) slices[J].Industrial Crops and Products, 2022, 176:114258.
[12] LU J D, WANG Z, QIN L H, et al.Drying methods affect bioactive compound contents and antioxidant capacity of Bletilla striata (Thunb.) Reichb.f.flower[J].Industrial Crops and Products, 2021, 164:113388.
[13] KHUDYAKOV D, SOSNIN M, SHORSTKII I, et al.Cold filamentary microplasma pretreatment combined with infrared dryer:Effects on drying efficiency and quality attributes of apple slices[J].Journal of Food Engineering, 2022, 329:111049.
[14] YAMAKAGE K, YAMADA T, TAKAHASHI K, et al.Impact of pre-treatment with pulsed electric field on drying rate and changes in spinach quality during hot air drying[J].Innovative Food Science &Emerging Technologies, 2021, 68:102615.
[15] NAGEL A, NEIDHART S, KUEBLER S, et al.Applicability of fruit blanching and intermittent microwave-convective belt drying to industrial peel waste of different mango cultivars for the recovery of functional coproducts[J].Industrial Crops and Products,2017, 109:923-935.
[16] RAJORIYA D, SHEWALE S R, BHAVYA M L, et al.Far infrared assisted refractance window drying of apple slices:Comparative study on flavour, nutrient retention and drying characteristics[J].Innovative Food Science &Emerging Technologies, 2020, 66:102530.
[17] MUKHERJEE S, CHATTOPADHYAY P K.Whirling bed blanching of potato cubes and its effects on product quality[J].Journal of Food Engineering, 2007, 78(1):52-60.
[18] MUGI V R, V.P C.Comparison of drying kinetics, thermal and performance parameters during drying guava slices in natural and forced convection indirect solar dryers[J].Solar Energy, 2022, 234:319-329.
[19] GOZTEPE B, KAYACAN S, BOZKURT F, et al.Drying kinetics, total bioactive compounds, antioxidant activity, phenolic profile, lycopene and β-carotene content and color quality of Rosehip dehydrated by different methods[J].LWT, 2022, 153:112476.
[20] WU Y F, LYU C Z, ZOU L G, et al.Approaches for enhancing the stability and formation of sulforaphane[J].Food Chemistry, 2021, 345:128771.
[21] JONES R B, FRISINA C L, WINKLER S, et al.Cooking method significantly effects glucosinolate content and sulforaphane production in broccoli florets[J].Food Chemistry, 2010, 123(2):237-242.
[22] LU Y J, PANG X Y, YANG T B.Microwave cooking increases sulforaphane level in broccoli[J].Food Science &Nutrition, 2020, 8(4):2052-2058.
[23] THOMAS M,BADR A,DESJARDINS Y,et al.Characterization of industrial broccoli discards (Brassica oleracea var.Italica) for their glucosinolate, polyphenol and flavonoid contents using UPLC MS/MS and spectrophotometric methods[J].Food Chemistry, 2018, 245:1204-1211.
[24] FEUMBA DIBANDA R, PANYOO AKDOWA E, RANI P A, et al.Effect of microwave blanching on antioxidant activity, phenolic compounds and browning behaviour of some fruit peelings[J].Food Chemistry, 2020, 302:125308.
[25] LI M Y, CHEN X M, DENG J,et al.Effect of thermal processing on free and bound phenolic compounds and antioxidant activities of hawthorn[J].Food Chemistry, 2020, 332:127429.
[26] KIM D S, HWANG E S, LEE J E, et al.Sphingosine-1-phosphate decreases melanin synthesis via sustained ERK activation and subsequent MITF degradation[J].Journal Of Cell Science, 2003, 116(Pt 9):1699-1706.
[27] LI H, XIA Y, LIU H Y, et al.Nutritional values, beneficial effects, and food applications of broccoli (Brassica oleracea var.Italica Plenck)[J].Trends in Food Science &Technology, 2022, 119:288-308.
[28] FEKI F, KLISUROVA D, ALI MASMOUDI M, et al.Optimization of microwave assisted extraction of simmondsins and polyphenols from Jojoba (Simmondsia chinensis) seed cake using Box-Behnken statistical design[J].Food Chemistry, 2021, 356:129670.
[29] TAO Y, LI D D, CHAI W S, et al.Comparison between airborne ultrasound and contact ultrasound to intensify air drying of blackberry:Heat and mass transfer simulation, energy consumption and quality evaluation[J].Ultrasonics Sonochemistry, 2021, 72:105410.
[30] OH M, OH I, JEONG S, et al.Optical, rheological, thermal, and microstructural elucidation of rutin enrichment in Tartary buckwheat flour by hydrothermal treatments[J].Food Chemistry, 2019, 300:125193.