灰树花(Grifola frondosa)又称贝叶多孔菌、舞茸,被誉为“食用菌王子”和“华北人参”[1],是一种药食两用的真菌,菌盖呈灰色至浅褐色,主要分布在中国和日本,多产于热带至温带森林中[2-3]。灰树花的子实体肉质柔软,呈层叠状,含有多糖、蛋白质等多种活性成分[4-5],具有抗氧化、抗炎、抗肿瘤及免疫调节效果[6-7],广泛应用于药品和食品等领域[5,8-9]。微生物发酵过程中产生的酶有助于细胞壁的破裂,可以促进活性物质的释放[10];产生的短链脂肪酸具有促进营养物质吸收等多种生物活性[11-12]。大量研究表明,通过微生物发酵能够显著提升产品中的活性成分含量,具有增强其抗氧化、抗炎以及皮肤屏障修复的功能[13-14]。闫雅倩等[15]发现,相较于水提液,黄花菜发酵液具有更优的抗氧化、抗炎和美白功效。莫秋婷等[16]发现,丹参发酵液中多糖和黄酮的含量均高于丹参水提液,且发酵液具有更优的抑制丙二醛和活性氧合成的能力。叶琳琳等[17]发现,发酵后的竹叶能有效抑制炎症因子的表达,增强丝聚蛋白基因的表达,具有抗炎和增强皮肤屏障功能的功效。
发酵过程中常用的微生物种类包括细菌和真菌[18],裂褶菌是裂褶菌属的一种兼具药用和食用价值的真菌,可以栖息在枯木上[19]。裂褶菌在生长过程中能够产生漆酶、过氧化物酶和纤维素酶等多种酶类,这些酶可以分解细胞壁中的木质素、纤维素和半纤维素,使细胞破裂,增大细胞间隙,从而促进活性成分的释放[20-22]。本研究以灰树花子实体为原料,采用裂褶菌进行发酵,制备灰树花发酵液(Grifola frondosa fermentation broth, GFF),并测定其生物活性含量和体外抗氧化活性。本实验基于UVB 照射人永生化角质形成细胞(human immortalized keratinocytes, HaCaT)建立损伤模型,以灰树花未发酵液(unfermented Grifola frondosa solution, GF)为对照,探究GFF对活性氧(reactive oxygen species, ROS)、抗氧化酶、炎症因子以及皮肤屏障相关蛋白的影响。此外,通过红细胞溶血实验评估其安全性。
1 材料与方法
1.1 材料与试剂
灰树花子实体,中国北京同仁堂(集团)有限责任公司;裂褶菌菌株编号:CGMCC NO.40388;MEM(minimum essential medium)培养基、胎牛血清、链霉素、青霉素和体积分数0.25% 胰蛋白酶,Gibco生命技术公司;DPPH,阿尔法埃莎化学有限公司;PBS溶液、Cell Counting Kit-8(CCK-8)试剂盒、BCA蛋白定量检测试剂盒、酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒,北京百瑞极生物科技有限公司;HaCaT细胞,中国检验检疫科学研究院;Trizol (总RNA抽提试剂)、总抗氧化能力检测试剂盒ABTS法和(ferric ion reducing antioxidant power, FRAP)FRAP 法、活性氧检测试剂盒,上海碧云天生物技术有限公司;双氧水(质量分数30%),国药集团化学试剂有限公司;EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、TransStart®Top Green qPCR SuperMix试剂盒,全氏三金生物科技有限公司。
1.2 仪器与设备
LDZX-30L-I高压蒸汽灭菌器,上海申安医疗器械;DZKW-4恒温水浴锅,北京中兴伟业;MA203E/A 精密天平,梅特勒-托利多仪器;ZN-04B小型粉碎机,北京兴时利和科技发展有限公司;Multiskan FC 酶标仪、HeracellTM VIOS 250i CO2恒温培养箱、QuantStudioTM 3 荧光定量 PCR 仪,赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 样品制备
灰树花发酵液制备:将灰树花子实体粉碎并过50目筛,取2 g灰树花粉末和0.2 g葡萄糖加入100 mL去离子水中,121 ℃ 高温高压灭菌30 min后,接入10 mL 的裂褶菌菌液。将其置于温度为28 ℃,转速为180 r/min恒温摇床中培养72 h。发酵完成后,在4 800 r/min条件下,离心20 min,取上清液冻干备用。
灰树花未发酵液的制备方法与上述相同,但不添加裂褶菌菌液。
1.3.2 活性物质含量的测定
1.3.2.1 蛋白含量测定
采用BCA蛋白定量检测试剂盒测定GF和GFF中的蛋白质含量。操作步骤参照试剂盒说明书进行。
1.3.2.2 总糖含量测定
采用苯酚-硫酸法测定GF和GFF中的总糖含量。将1 mg/mL葡萄糖溶液稀释成不同浓度的标准品。取1 mL标准品溶液放入离心管,加入0.5 mL体积分数为5%的苯酚溶液和2.5 mL浓硫酸溶液,混合均匀后,密封管口,置于沸水浴中加热1 h。然后取出冷却至室温,在490 nm波长处测定其吸光度,并绘制标准曲线。取1 mL GF和GFF按照同样方法进行试验,测定A490,代入标准曲线计算样品中的总糖含量。
1.3.2.3 总酚含量测定
采用Folin-Ciocalteu法测定GF和GFF中的总酚含量。将没食子酸稀释成不同浓度的标准品,取200 μL标准品溶液、200 μL去离子水、100 μL稀释2倍后的福林-酚加入到2 mL的离心管中,混合均匀后再加入300 μL体积分数为26.7% Na2CO3溶液,加去离子水至2 mL,室温反应2 h后,于760 nm处测定吸光度,绘制标准曲线。取200 μL GF和GFF按照同样方法进行试验,测定A760,代入标准曲线计算样品中的总酚含量。
1.3.3 体外抗氧化活性测定
1.3.3.1 DPPH自由基清除率
将样品配置成不同浓度的溶液,配制2×10-4 mol/L DPPH溶液,DPPH溶液需避光保存。将1 mL DPPH溶液与等体积的不同浓度GF和GFF溶液混合,记为样品管;将1 mL无水乙醇与等体积的DPPH溶液混合均匀,记为对照管;将1 mL不同浓度的GF和GFF溶液与等体积的无水乙醇混合均匀,记为空白管。混合物在黑暗中反应30 min后,在517 nm波长处测定其吸光度。DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
1.3.3.2 羟自由基清除率
配制0.02 mmol/L H2O2溶液、3 mmol/L乙醇-水杨酸溶液和8 mmol/L FeSO4溶液。将0.3 mL FeSO4溶液、1 mL乙醇-水杨酸溶液、1.45 mL去离子水和0.25 mL H2O2溶液混合均匀,记为空白管。用等体积的不同浓度GF和GFF溶液替代空白管中的1 mL去离子水,记为样品管;用等体积的不同浓度GF和GFF溶液替代空白管中的1 mL乙醇-水杨酸溶液,记为样品本底管。混匀后放置到37 ℃恒温箱1 h,4 000 r/min离心10 min,取其上清液进行测定。在510 nm波长处测定吸光度。羟自由基清除率按公式(2)计算:
羟自由基清除率![]()
(2)
1.3.3.3 总抗氧化能力测定
分别通过ABTS法和FRAP法总抗氧化能力检测试剂盒对GF和GFF的ABTS阳离子自由基清除能力和铁离子还原抗氧化能力进行测定,详细操作步骤参照试剂盒说明书进行。
1.3.4 HaCaT细胞培养
在MEM培养基中加入体积分数10%胎牛血清和体积分数1%青霉素-链霉素(1×105 U/L)培养细胞,在37 ℃、5%(体积分数)CO2的恒温培养箱中孵育2~3 d,当细胞贴壁程度达到80%~90%时,进行下一步实验。
1.3.5 GF和GFF细胞毒性测定
在96孔板中,HaCaT细胞以每孔8×103~1×104个HaCaT细胞的密度接种,并培养12 h。将细胞分为空白组(只加入PBS)、对照组(只加入培养基)、样品组(0.031 25、0.062 5、0.125、0.25、0.5 mg/mL样品)。用不同浓度的GF和GFF样品液(100 μL/孔)处理细胞24 h。GF和GFF的细胞毒性测定通过CCK-8试剂盒检测,详细操作步骤参照试剂盒说明书进行。对照组细胞存活率按公式(3)计算:
细胞存活率![]()
(3)
1.3.6 UVB损伤模型建立
将细胞分为空白组(C组:只含培养基,不照射UVB)、模型组(M组:只含培养基,照射UVB)、样品组(0.031 25、0.062 5、0.125、0.25、0.5 mg/mL样品,照射UVB)。HaCaT细胞孵育完成后,除空白孔外,其余孔均在40 mJ/cm2的剂量暴露于UVB照射40 s。暴露于UVB后分别在含有GF和GFF的培养基中再培养24 h,空白组和模型组加入等体积无血清MEM培养基替代样品溶液进行后续实验。采用CCK-8试剂盒测定细胞存活率。模型组细胞存活率按公式(4)计算:
细胞存活率![]()
(4)
1.3.7 抗氧化酶、炎症因子、屏障功能蛋白含量的测定
采用ELISA试剂盒检测HaCaT细胞中抗氧化酶、炎症因子及屏障功能蛋白的含量。抗氧化酶包括血红素加氧酶-1(heme oxygenase 1, HO-1)和NAD(P)H醌氧化还原酶-1[NAD(P)H quinone oxidoreductase 1, NQO-1];炎症因子包括IL-6、IL-1β和IL-8;屏障功能蛋白包括丝聚蛋白(including filasilin, FLG)、水通道蛋白3(aquaporin 3, AQP3)和半胱氨酸天冬氨酸蛋白酶-14(cysteine-asparate protease-14, Caspase-14)。具体方法见试剂盒说明书。
1.3.8 ROS含量的测定
将HaCaT细胞以约5×106个/孔的密度接种于6孔板中,培养细胞。建立UVB模型后,每孔加入2 mL样品液,培养24 h后倒掉培养液,并用PBS轻洗2次。在每个孔中加入2 mL事先制备好的10 μmol/L DCFH-DA,培养20 min后取出并弃去,用1 mL无血清培养基洗涤3次以完全去除 DCFH-DA。每个孔中加入1 mL PBS,用荧光显微镜拍摄荧光照片。实验全程避光。激发波长488 nm,发射波长525 nm。用荧光酶标仪测定荧光值。
1.3.9 定量逆转录聚合酶链式反应(quantitative reverse transcription polymerase chain reaction)qRT-PCR测基因表达量
在6孔板中以每孔1×106个HaCaT细胞培养24 h,每孔体积为2 mL。GF和GFF作用HaCaT细胞后,使用Trizol 从HaCaT细胞中提取总RNA,详细操作步骤参照说明书进行。根据cDNA逆转录试剂盒的说明书,将RNA逆转录为cDNA。完成逆转录后,进行qRT-PCR检测。引物序列如表1所示。
表1 聚合酶链式反应引物序列表
Table 1 RCR primer sequence list

目的基因引物对序列 (5'→3')p38正向引物-ATGTTCCCTGTCCCTGAGC 反向引物-GCCCTGAGTGTAGCCTGTGTNF-κB正向引物-CCAGGTCCTCCAGGCAATCCAAAAG反向引物-AGTGCAGGGCTGTCAAACCATCGTAGERK正向引物-CATCGCGACCTCAAACCTTC 反向引物-TCCGGATCTGCAACACGAGNQO-1正向引物-CAGCCAATCAGCGTTCGGTA反向引物-CTTCATGGCGTAGTTGAATGATGTCHO-1正向引物-CAAGCGCTATGTTCAGCGAC反向引物-GCTTGAACTTGGTGGCACTGIL-6正向引物-TTCTCCACAAGCGCCTTC反向引物-AGAGGTGAGTGGCTGTCTGTIL-8正向引物-GGAGAAGTTTTTGAAGAGGGCTG反向引物-ACAGACCCACACAATACATGAAGIL-1β正向引物-AACCTCTTCGAGGCACAAGG反向引物-GTCCTGGAAGGAGCACTTCATFLG正向引物-TGAGGCATACCCAGAGGACT反向引物-CTGTATCGCGGTGAGAGGATAQP3正向引物-CTTCTTTGACCAGGACCGGC反向引物-GGGCCAGCTTCACATTCTCTCaspase-14正向引物-ATTCCACGGTAGAGGGATACA反向引物- TCAGGGTTCGTTTTCCTTGCTβ-actin正向引物-TGGCACCCAGCACAATGAA反向引物-CTAAGTCATAGTCCGCCTAGAAGCA
1.3.10 红细胞溶血实验
新鲜兔血用PBS溶液以2∶5的体积比稀释,1 500×g离心10 min,沉淀用PBS洗涤2~3次,最后一次离心后用PBS稀释其沉淀物,混匀得到细胞悬液。将0.5 mL细胞悬液加入到4.5 mL去离子水中,以541 nm处测量吸光度为(0.5±0.025)时的红细胞悬液为适合的红细胞悬液(red blood cell suspension,RBC)。
使用PBS将GF和GFF稀释至2、1、0.5、0.25和0.125 mg/mL,并以1∶3的体积比与RBC混合。混合后,将其放在室温下振荡孵育1 h,然后通过10 000×g离心1 min终止孵育,在560 nm处测定上清液的吸光度,实验设置3个平行。阴性对照为 750 μL PBS和250 μL RBC,阳性对照为750 μL去离子水和250 μL RBC。红细胞溶血率按公式(5)计算:
红细胞溶血率![]()
(5)
1.4 数据处理与分析
用GraphPad Prism 8.0软件进行作图,数据统计及计算均使用Excel 2021处理,用t检验进行显著性分析。当P<0.05 时,差异具有统计学意义。
2 结果与分析
2.1 GF和GFF的活性物质含量测定和体外抗氧化活性研究
对GF和GFF中总糖、总蛋白和总酚含量进行测定,结果如表2所示。GFF的总糖、总蛋白和总酚含量均高于GF,表明发酵过程有效提高了生物活性物质的含量。使用DPPH自由基清除率、羟自由基清除率、总抗氧化能力评估GF和GFF的抗氧化活性,结果如图1所示。随着浓度的增加,GF和GFF的DPPH自由基清除率和羟自由基清除率均呈现上升趋势,且GFF抗氧化能力优于GF。在1 mg/mL的测定浓度下,GFF的总抗氧化能力高于GF。IC50值越低,表明抗氧化剂的自由基清除能力越强,由表3可知,GFF的IC50值低于GF,表明GFF清除DPPH自由基和羟自由基的能力优于GF。综上所述,经过裂褶菌发酵得到的GFF生物活性含量和抗氧化能力均高于GF。
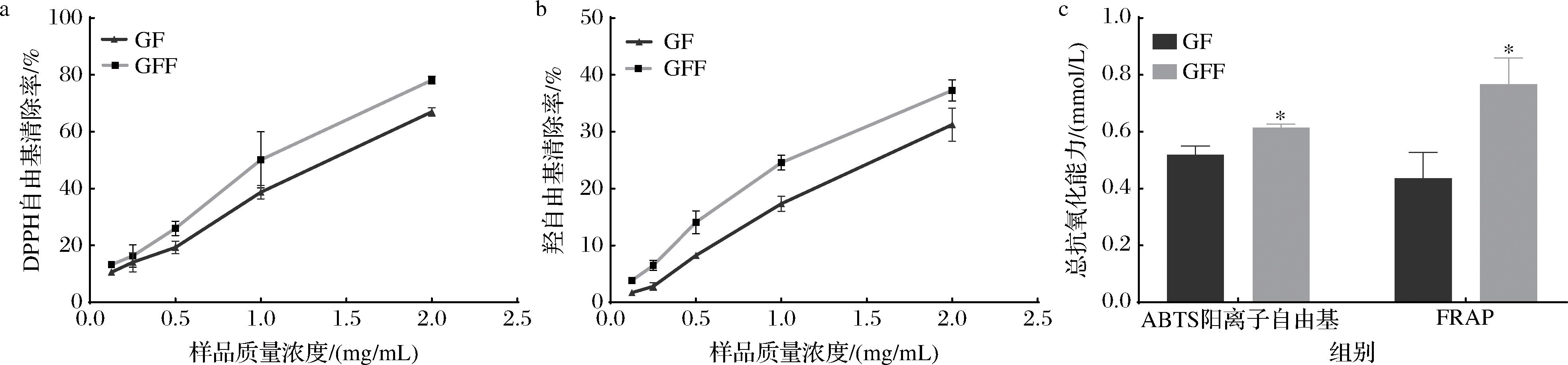
a-DPPH自由基清除能力;b-羟自由基清除能力;c-ABTS阳离子自由基清除能力以及FRAP总还原力
图1 GF和GFF体外抗氧化能力的测定
Fig.1 Determination of antioxidant capacity of GF and GFF in vitro
注:GF和GFF相比,*表示P<0.05(下同)。
表2 GF和GFF的活性物质的含量 单位:mg/mL
Table 2 Content of active substances in GF and GFF

样品总糖总蛋白总酚GF 2.34±0.003 81.72±0.0630.75±0.023GFF2.47±0.005 8***2.37±0.110.83±0.012**
注:GF和GFF相比,nsP>0.05,**P<0.01,***P<0.001。
表3 IC50值 单位:mg/mL
Table 3 IC50 value
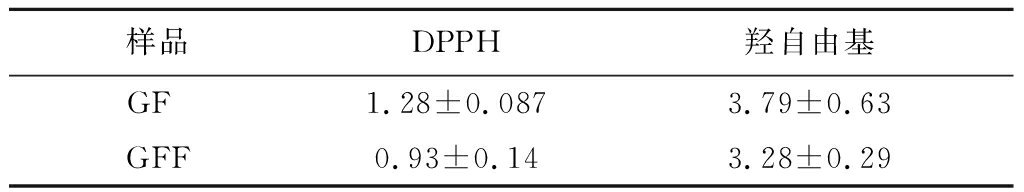
样品DPPH羟自由基GF 1.28±0.0873.79±0.63GFF0.93±0.143.28±0.29
2.2 GF和GFF对HaCaT细胞存活率的影响
CCK-8实验能够进一步反映样品对细胞存活率的影响。GF和GFF作用HaCaT细胞后,对细胞存活率的影响如图2所示。当GF和GFF低于0.5 mg/mL时,HaCaT细胞的存活率均在80%以上。此外,GFF质量浓度为0.062 5 mg/mL时的结果显示出对HaCaT细胞的增殖作用。总体来看,GFF对HaCaT细胞的毒性的修复能力更强。
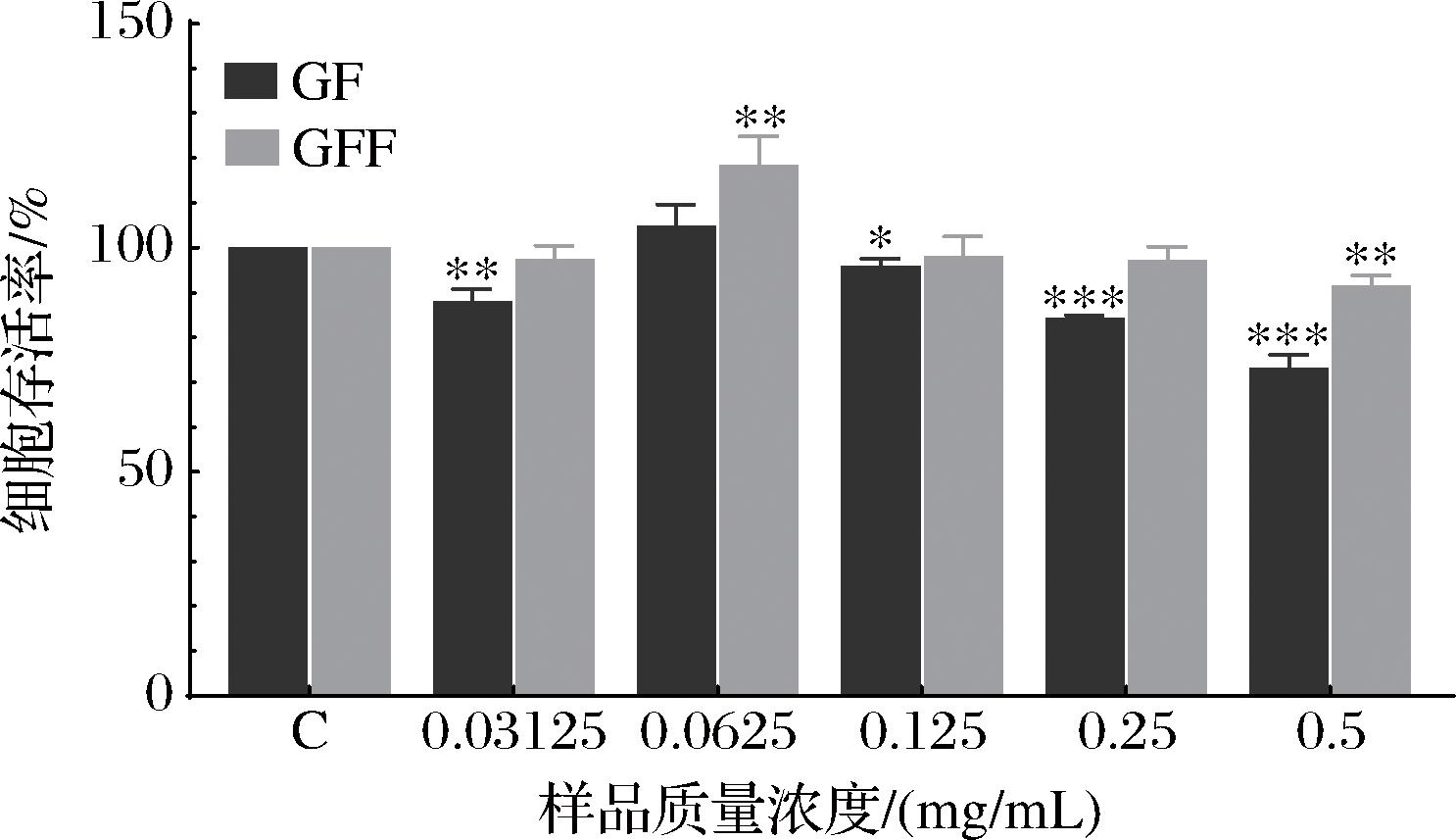
图2 不同质量浓度的GF和GFF对 HaCaT细胞存活率的影响
Fig.2 Effect of different mass concentrations of GF and GFF on the survival of HaCaT cells
注:**表示P<0.01,***表示P<0.001(下同)。
2.3 UVB损伤模型建立
过量UVB照射会增加HaCaT细胞中ROS含量,诱发氧化应激反应,进而导致蛋白质氧化、线粒体功能障碍及DNA受损[23]。为探究GF和GFF对UVB诱导损伤的修复作用,用UVB照射HaCaT细胞后,细胞存活率如图3所示。与空白组相比,UVB处理后HaCaT细胞的存活率显著下降;与模型组相比,不同浓度的GF和GFF作用细胞后,细胞活力均显著增加,对细胞损伤具有一定的修复作用。当质量浓度为0.062 5 mg/mL及以上时,GFF的存活率高于GF,且在0.062 5 mg/mL时,GF和GFF细胞存活率最高,因此均选择此质量浓度进行后续实验。
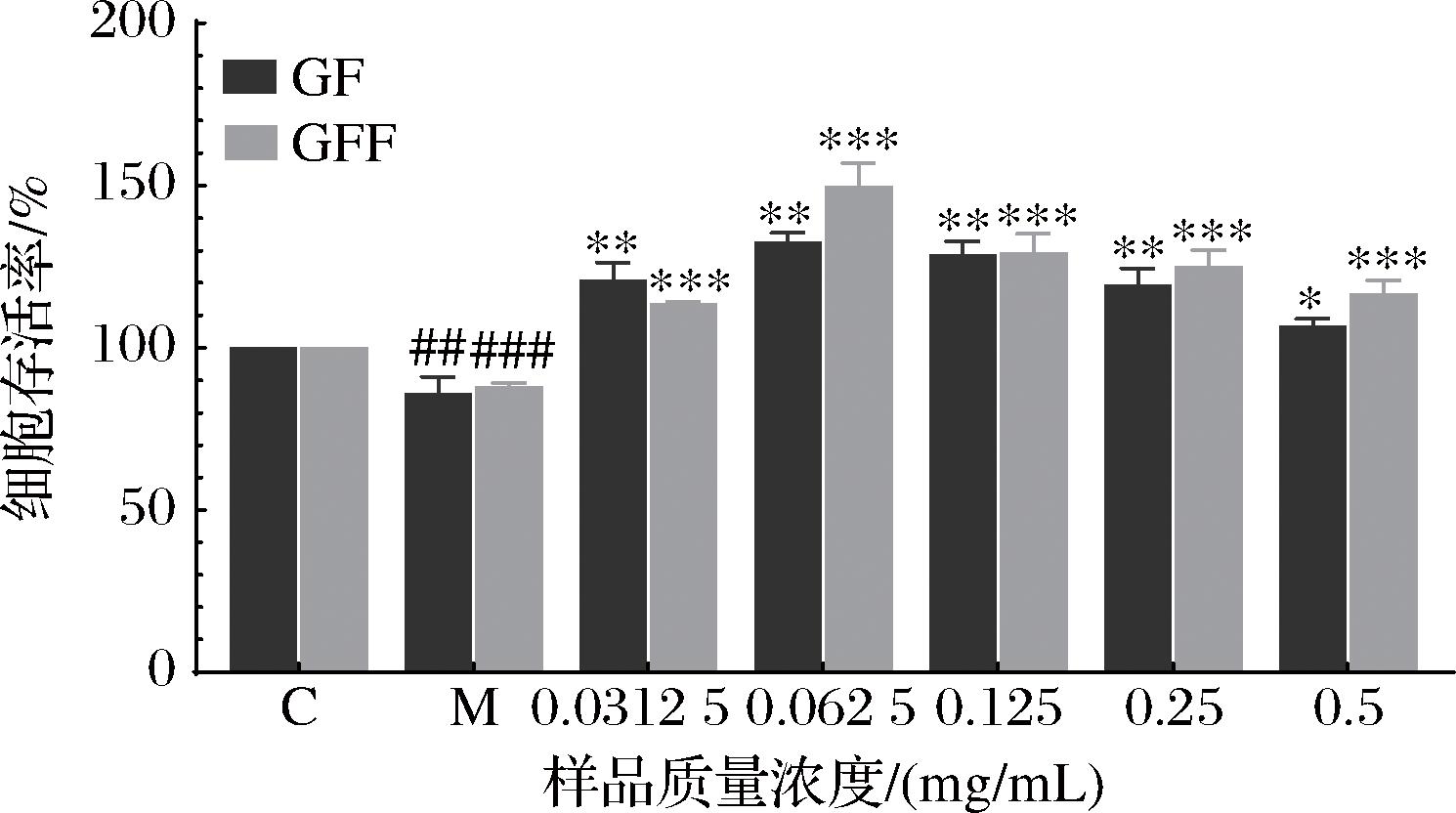
图3 不同质量浓度的GF和GFF对UVB诱导的损伤HaCaT细胞存活率的影响
Fig.3 Effect of different mass concentrations of GF and GFF on the survival of UVB-induced damaged HaCaT cells
注:与空白组相比,#表示P<0.05,##表示P<0.01,###表示P<0.001;与模型组相比, *表示P<0.05,**表示P<0.01,***表示P<0.001(下同)。
2.4 GF和GFF对抗氧化酶相对表达量以及mRNA相对表达量的影响
NQO-1和HO-1是2种具有抗氧化作用的酶,能够催化血红蛋白的分解,生成一氧化碳和胆绿素等产物,从而降低ROS含量,发挥抗氧化作用[24]。探究GF和GFF对UVB有诱导后细胞内抗氧化酶含量及其mRNA相对表达量的影响,结果如图4所示。经过UVB照射后,模型组细胞内NQO-1和HO-1的表达均显著下降;与模型组相比,GFF作用于细胞后NQO-1和HO-1含量均上升,GF和GFF作用细胞后NQO-1和HO-1 mRNA相对表达量均显著升高。结果表明,经过GFF作用细胞后,细胞内HO-1相对表达量、NQO-1和HO-1 mRNA相对表达量与GF相比大幅度提升,说明GFF具有更强的抗氧化能力。
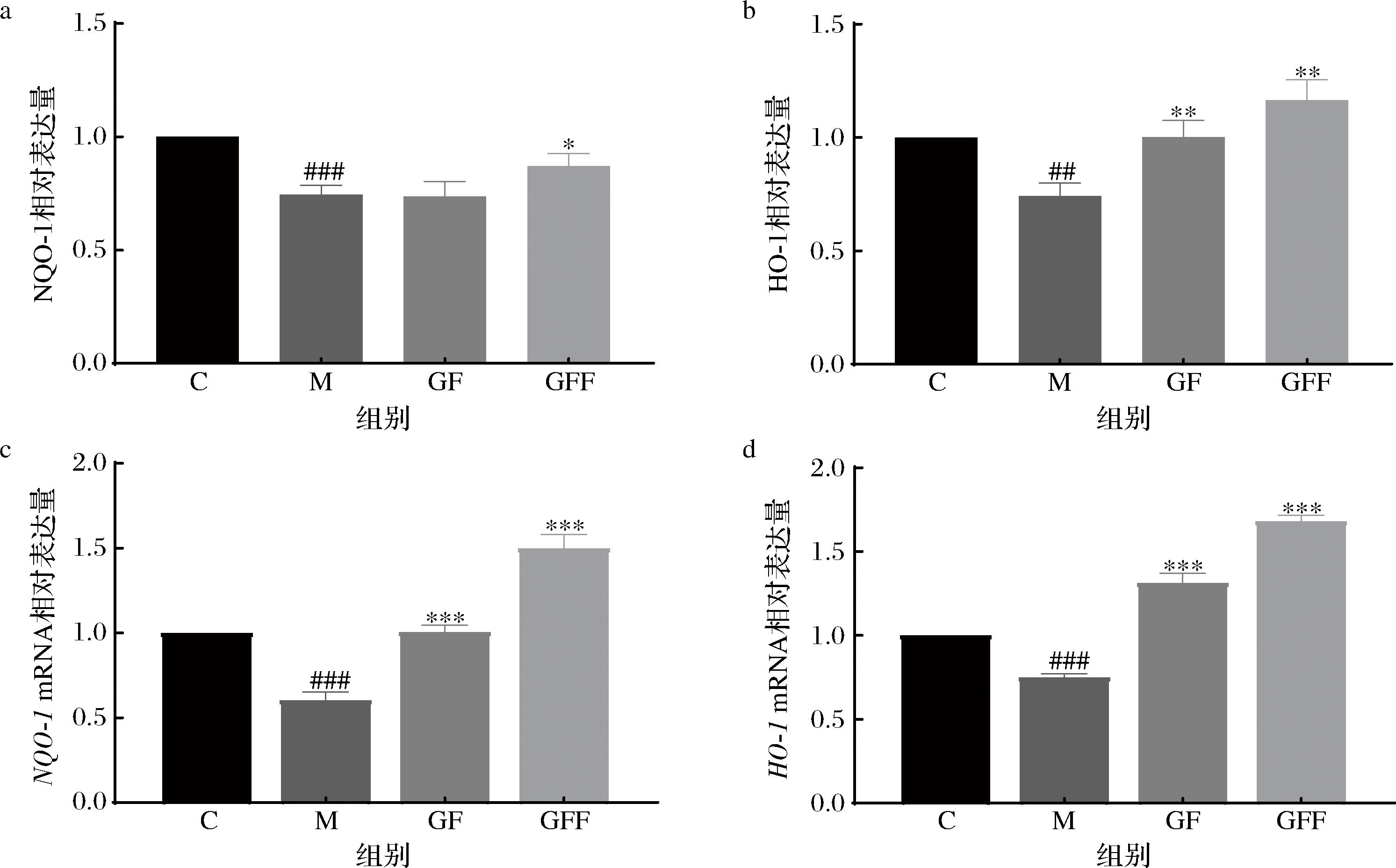
a-NQO-1相对表达量;b-HO-1相对表达量;c-NQO-1 mRNA 相对表达量;d-HO-1 mRNA 相对表达量
图4 GF和GFF对抗氧化酶的影响
Fig.4 Effect of GF and GFF on antioxidant enzymes
2.5 GF和GFF对ROS的影响
UVB照射会导致细胞内抗氧化酶含量下降,使细胞对ROS的清除能力降低,从而引起 ROS积累,诱导氧化应激反应并促进炎症因子的分泌[10]。利用DCFH-DA荧光探针进行ROS检测,通过荧光强度的变化反映ROS水平,结果如图5所示。UVB照射后,HaCaT细胞内ROS含量显著增加,细胞内绿色荧光强度明显增强;与模型组相比,GF和GFF能够减弱细胞内荧光强度,降低ROS含量。实验结果表明,GFF具有抑制细胞内过量ROS的生成,且其抑制能力强于GF,说明经过裂褶菌发酵的灰树花子实体可以明显降低UVB诱导的细胞内ROS水平。
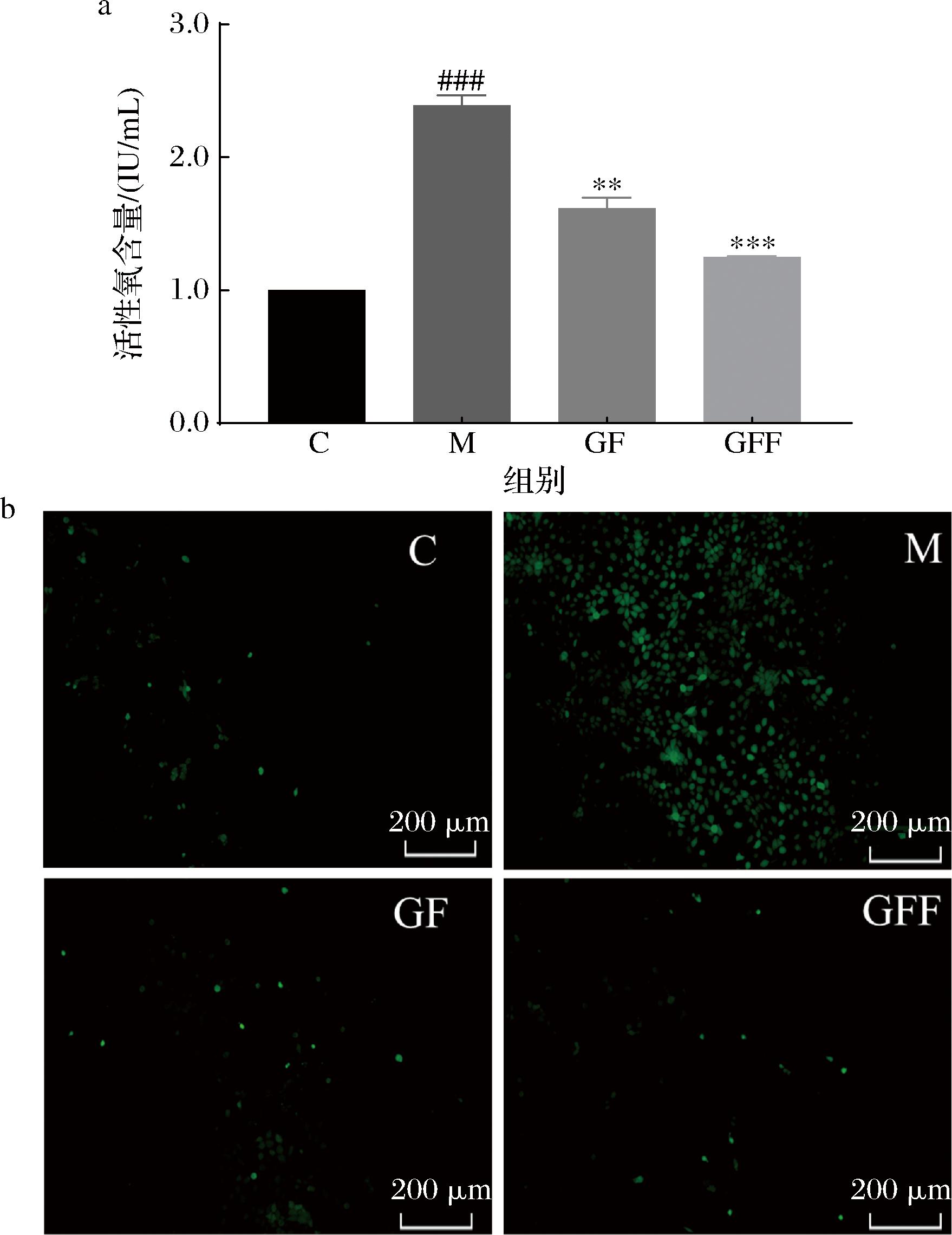
a-ROS含量;b-ROS荧光强度
图5 GF和GFF对ROS的影响
Fig.5 Effect of GF and GFF on ROS
2.6 GF和GFF对炎症因子相对表达量以及mRNA相对表达量的影响
细胞内ROS增加会刺激细胞释放过量的炎症因子,从而加剧炎症反应,最终导致皮肤屏障功能受损。为了探究GF和GFF对UVB诱导后细胞内炎症因子的影响,实验结果如图6所示。经UVB照射后,模型组细胞内IL-6、IL-8和IL-1β 这3种炎症因子的含量均显著升高,GF和GFF处理后,HaCaT细胞中这3种炎症因子的含量均显著降低。与空白组相比,UVB照射后细胞中这3种炎症因子mRNA相对表达量升高;经过GF和GFF作用后,细胞中这3种炎症因子mRNA表达受到抑制。结果表明,GFF在降低UVB诱导细胞内IL-8和IL-1β含量及抑制mRNA表达上的效果优于GF,表明经过裂褶菌发酵的灰树花子实体抑制细胞内炎症因子释放的作用更强。
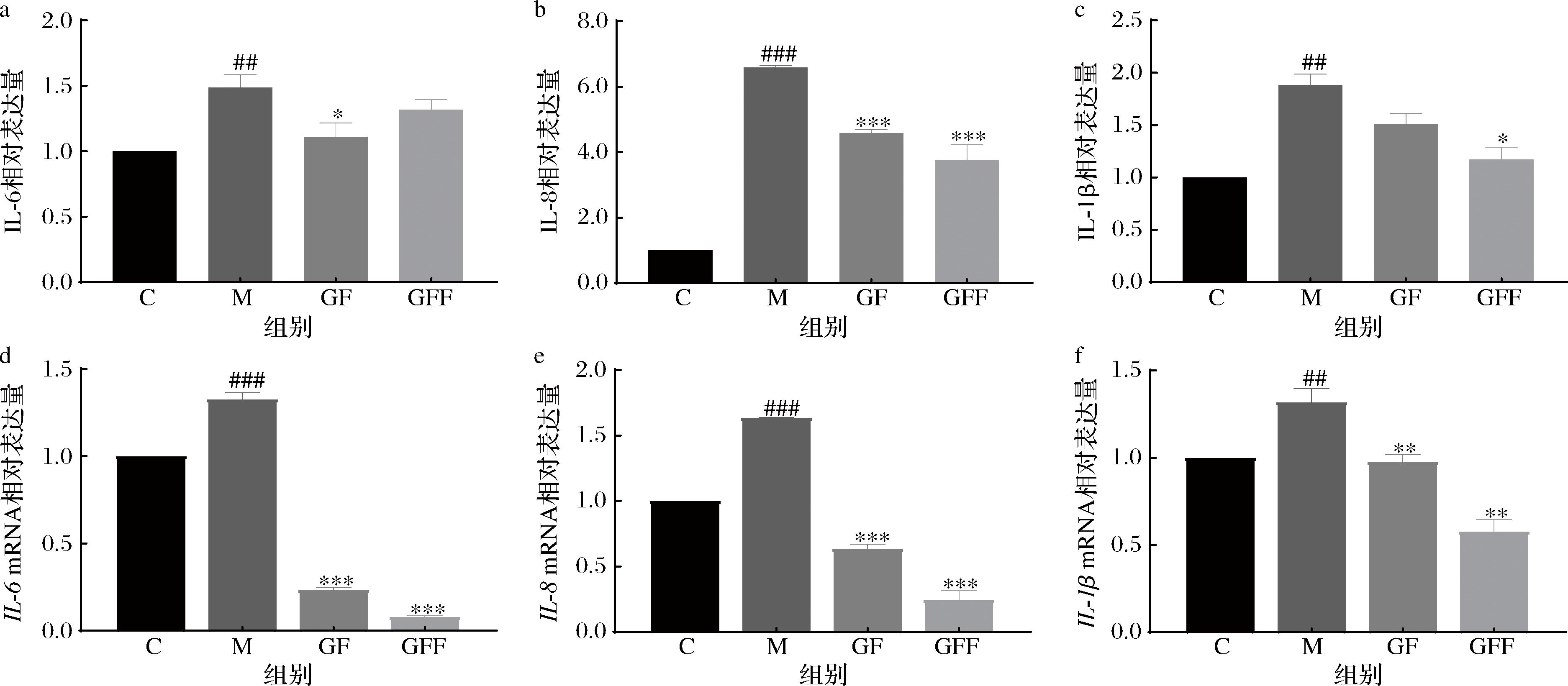
a-IL-6相对表达量;b-IL-8相对表达量;c-IL-1β 相对表达量;d-IL-6 mRNA 相对表达量;e-IL-8 mRNA 相对表达量;f-IL-1β mRNA 相对表达量
图6 GF和GFF对炎症因子的影响
Fig.6 Effect of GF and GFF on inflammatory factors
2.7 GF和GFF对屏障相关蛋白相对表达量以及mRNA相对表达量的影响
Caspase-14与FLG与紧密相关,Caspase-14能够促进丝聚蛋白原迅速去磷酸化,并成为FLG,进而加速FLG水解成天然保湿因子,维护皮肤屏障[25]。AQP3可以调节皮肤的屏障功能及其含水量[26]。GF和GFF作用于UVB诱导损伤的细胞后,对 FLG、AQP3和Caspase-14表达的影响如图7所示。与空白组相比,UVB照射后细胞中FLG、AQP3和Caspase-14含量均下降,表明UVB对皮肤屏障结构具有损伤作用。GF和GFF作用细胞后,FLG、AQP3和Caspase-14含量均显著升高,表明GF和GFF对皮肤屏障结构具有修复作用。经UVB照射后,模型组细胞内FLG、AQP3和Caspase-14的mRNA相对表达量均下降,而GF和GFF作用细胞后,FLG和AQP3和Caspase-14的mRNA相对表达量均显著上升。实验结果表明,GFF在提高UVB诱导细胞内FLG、AQP3和Caspase-14含量、及增强其mRNA表达的效果优于GF,能够有效修复UVB诱导的皮肤屏障损伤。

a-FLG相对表达量;b-AQP3相对表达量;c-Caspase-14相对表达量;d-FLG mRNA 相对表达量;e-AQP3 mRNA 相对表达量;f-Caspase-14 mRNA相对表达量
图7 GF和GFF对皮肤屏障相关因子的影响
Fig.7 Effect of GF and GFF on skin barrier-associated factors
2.8 GF和GFF对MAPK/NF-κB信号通路的影响
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在炎症介质的调控中发挥着关键作用,MAPK家族主要由3部分组成:p38、细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)和应激活化蛋白激酶(c-Jun N-terminal kinase, JNK)[27]。核因子-κB(nuclear factor kappa B,NF-κB)是诱导炎症因子释放的重要核转录因子[28]。当ERK和p38受到信号刺激后发生磷酸化,磷酸化的ERK和p38会使NF-κB二聚体解离,并从细胞质转移至细胞核,从而进一步介导炎症反应[28]。
通过qRT-PCR测定GF和GFF对MAPK/NF-κB信号通路相关基因表达的影响,结果如图8所示。与空白组相比,模型组细胞中的NF-κB mRNA相对表达量显著升高,而GF和GFF处理细胞后NF-κB mRNA相对表达量显著下降;UVB照射细胞后,模型组p38 mRNA相对表达量显著增加,GF和GFF作用细胞后p38表达被抑制;与空白组相比,模型组细胞内的ERK mRNA相对表达量上升,GF和GFF作用细胞后ERK mRNA相对表达量降低,且GFF抑制UVB诱导细胞内NF-κB、p38和ERK表达的效果优于GF。实验结果表明,经过GFF可能通过抑制MAPK/NF-κB信号通路中关键因子的mRNA表达,对UVB诱导的细胞发挥抗氧化、抗炎及修复皮肤屏障功能的作用。
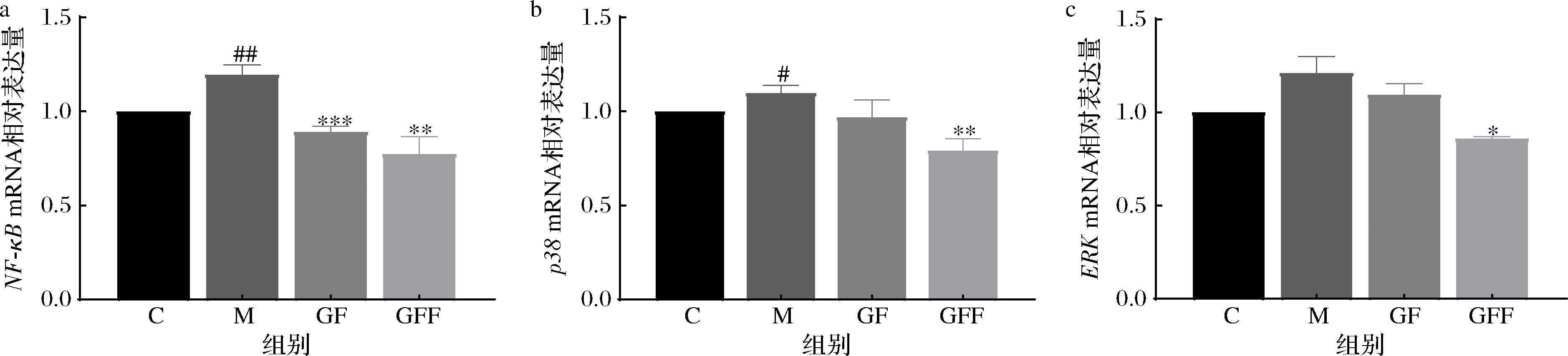
a-NF-κB mRNA 相对表达量;b-p38 mRNA 相对表达量;c-ERK mRNA 相对表达量
图8 GF和GFF对MAPK/NF-κB信号通路的影响
Fig.8 Effect of GF and GFF on the MAPK/NF-κB signaling pathway
2.9 GF和GFF在红细胞溶血实验中的安全性评价
红细胞溶血实验是通过观察红细胞在受试物质作用下的溶血反应,利用红细胞的破裂和释放血红蛋白的特性进行评估。图9为不同浓度的GF和GFF对红细胞溶血率以及相应EP管的溶血情况。在0.125~2 mg/mL时,GF和GFF溶血率均低于5%,表明GF和GFF具有低刺激性和高安全性。
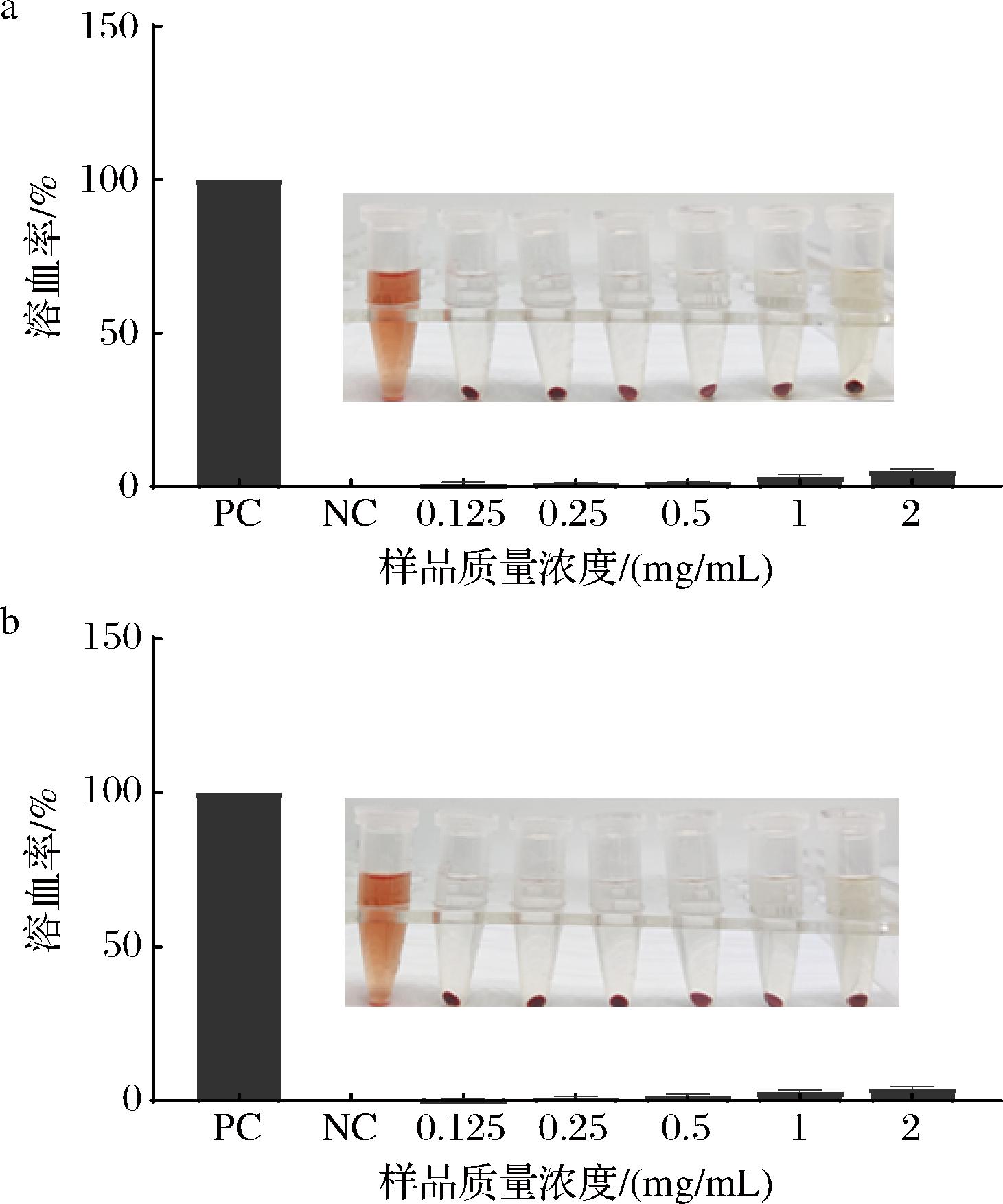
a-GF;b-GFF
图9 不同浓度GF和GFF的红细胞溶血实验结果
Fig.9 Results of erythrocyte hemolysis experiments with different concentrations of GF and GFF
注:NC:阴性对照;PC:阳性对照。
3 结论
本研究用裂褶菌对灰树花子实体进行发酵,制备灰树花发酵液,并建立UVB损伤模型,探究其抗氧化、抗炎和皮肤屏障修复能力。GFF的总糖、总酚和总蛋白含量均高于GF,这种差异可能源于发酵过程中微生物产生的酶,该酶能够破坏细胞壁,促进活性物质的释放。与GF相比,GFF具有更强的自由基清除能力,初步表明其抗氧化活性更强。虽然本实验初步表明GFF活性物质含量和体外抗氧化活性均优于GF,但未能排除裂褶菌及其代谢产物对实验结果的潜在影响,后续将进一步研究。UVB照射皮肤时,细胞内ROS含量增加,导致皮肤的氧化还原平衡被破坏。GFF通过增强抗氧化酶的含量以及mRNA表达,抑制细胞中ROS的过量生成,从而有效缓解UVB诱导的氧化应激损伤。过量UVB辐射会引发皮肤炎症反应,进而导致表皮屏障遭到破坏,而在GFF作用下,能够有效调节细胞炎症反应,并增强皮肤屏障功能。大量的ROS会引发细胞内生物大分子的氧化损伤,并异常诱导细胞外的NF-κB等信号通路。GFF可能通过抑制MAPK/NF-κB信号通路中关键因子的mRNA表达,从而发挥抗氧化和抗炎作用。红细胞溶血实验表明GFF具有良好的安全性。
综上所述,GFF对UVB引起的HaCaT细胞损伤具有一定的修复作用,其机制可能与提高细胞内抗氧化酶活性,抑制细胞内ROS生成,抑制细胞炎症因子的释放,促进屏障相关蛋白的表达有关。未来的研究将进一步探究GFF在抗氧化、抗炎以及修复皮肤屏障功能。
[1] 吴彩云. 对羟基苯甲醛等天麻成分对灰树花多糖代谢的影响及其机理研究[D].贵州:贵州大学, 2016.WU C Y.Effects of p-hydroxybenzaldehyde and other asparagus components on polysaccharide metabolism of Grifola frondosa and its mechanism[D].Guizhou:Guizhou University, 2016.
[2] 甘长飞. 灰树花及其药理作用研究进展[J].食药用菌, 2014, 22(5):264-267;281.GAN C F.Progress on immunological regulation effects and mechanisms of edible fungus polysaccharides[J].Edible and Medicinal Mushrooms, 2014, 22(5):264-267;281.
[3] 杨冰峰, 陶清泉, 常学东, 等.灰树花的生理功能和栽培技术研究进展[J].安徽农业科学, 2017, 45(26):126-128.YANG B F, TAO Q Q, CHANG X D, et al.Research advances on physiological function and cultivation techniques of Grifola frondosa [J].Journal of Anhui Agricultural Sciences, 2017, 45(26):126-128.
[4] 杨庆伟, 王芃, 全迎萍.灰树花子实体多糖硫酸酯化及抗凝血活性研究[J].北京联合大学学报, 2022, 36(2):52-56.YANG Q W, WANG P, QUAN Y P.Study on suflation and anticoagulant activity of polysaccharide from fruiting body of Grifola frondosa[J].Journal of Beijing Union University, 2022, 36(2):52-56.
[5] 郭予斌, 李洽胜, 吴昭晖, 等.灰树花化学成分和药理作用的研究进展[J].药物评价研究, 2011, 34(4):283-288.GUO Y B, LI Q S, WU Z H, et al.Research advances on chemical constituents and pharmacological effect of Grifola frondosa[J].Drug Evaluation Research, 2011, 34(4):283-288.
[6] 吕旭聪, 贾瑞博, 李燕, 等.灰树花抗氧化活性多酚的提取纯化及其鉴定[J].中国酿造, 2016, 35(3):74-79.LYU X C, JIA R B, LI Y, et al.Purification and identification of polyphenols with antioxidant activity from Grifola frondosa[J].China Brewing, 2016, 35(3):74-79.
[7] 马迪, 冯娜, 韩伟.灰树花子实体的化学成分研究[J].食用菌学报, 2015, 22(3):80-84.MA D, FENG N, HAN W.Chemical components of Grifola frondosa fruiting bodies[J].Acta Edulis Fungi, 2015, 22(3):80-84.
[8] 周戈. 灰树花系列养生食品制作工艺[J].农村百事通, 2020, (15):42-43.ZHOU G.Production process of Grifola frondosa series health food[J].Rural Hundred Things, 2020, (15):42-43.
[9] 马晓惠. 灰树花鲜面条的研制与品质评价及工厂设计[D].南京农业大学, 2020.MA X H.Development and quality evaluation of fresh noodles from Grifola frondosa and plant design [D].Nanjing Agricultural University, 2020.
[10] SONG Z X, GENG J M, WANG D D, et al.Reparative effects of Schizophyllum commune oat bran fermentation broth on UVB-induced skin inflammation via the JAK/STAT pathway[J].Bioresources and Bioprocessing,2024,11(1):73.
[11] 杨雪, 高亚男, 王加启, 等.短链脂肪酸的功能研究进展[J].食品科学, 2023, 44(13):408-417.YANG X, GAO Y N, WANG J Q, et al.Research progress on the functions of short chain fatty acid[J].Food Science, 2023, 44(13):408-417.
[12] HAN S W, DA M, QI Q, et al.Protective effect of the “food-microorganism-SCFAs” axis on colorectal cancer: From basic research to practical application[J].Journal of Cancer Research and Clinical Oncology, 2019, 145(9):2169-2197.
[13] LIN S Q, WU Y X, HUANG Q, et al.Optimization of antioxidant activity of compounds generated during ginseng extract fermentation supplemented with Lactobacillus[J].Molecules, 2024, 29(6):1265.
[14] KANG H, HWANG J W, LEE S G.Bacillus subtilis fermentation augments the anti-inflammatory and skin moisture improvement activities of Tetragonia tetragonoides through the upregulation of antioxidant components[J].Fermentation, 2023, 9(9):800.
[15] 闫雅倩, 张玉芝, 付豪, 等.黄花菜发酵液的化妆品功效评价[J].精细化工, 2023, 40(5):1073-1081.YAN Y Q, ZHANG Y Z, FU H, et al.Cosmetic efficacy evaluation of Hemerocallis citrina Baroni fermentation broth[J].Fine Chemicals, 2023, 40(5):1073-1081.
[16] 莫秋婷, 李萌, 王冬冬, 等.丹参发酵液的体外抗氧化和美白功效评价[J].日用化学工业, 2021, 51(10):981-989.MO Q T, LI M, WANG D D, et al.Evaluation of anti-oxidation and whitening efficacy of Salvia miltiorrhiza fermentation broth in vitro[J].China Surfactant Detergent &Cosmetics, 2021, 51(10):981-989.
[17] 叶琳琳, 陈志雄, 阮建成, 等.竹叶发酵液的美白、增强皮肤屏障和抗炎护肤功效研究[J].高校化学工程学报, 2023, 37(4):591-598.YE L L, CHEN Z X, RUAN J C, et al.Effects of bamboo leaf fermentation broth on the whitening, skin barrier strengthening and anti-inflammatory skincare functions[J].Journal of Chemical Engineering of Chinese Universities, 2023, 37(4):591-598.
[18] 周袁璐, 师苑, 陆跃乐, 等.传统发酵过程微生物互作研究进展[J].中国食品学报, 2021, 21(11):349-358.ZHOU Y L, SHI Y, LU Y L, et al.Research progress on microbial interaction in traditional fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):349-358.
[19] ALM SI É, SAHU N, KRIZS
SI É, SAHU N, KRIZS N K, et al.Comparative genomics reveals unique wood-decay strategies and fruiting body development in the Schizophyllaceae[J].New Phytologist, 2019, 224(2):902-915.
N K, et al.Comparative genomics reveals unique wood-decay strategies and fruiting body development in the Schizophyllaceae[J].New Phytologist, 2019, 224(2):902-915.
[20] 张传利. 白参菌研究进展[J].热带农业科技, 2009, 32(3):25-29;36.ZHANG C L.Advances in the research of Schizophyllum commune[J].Tropical Agricultural Science &Technology, 2009, 32(3):25-29;36.
[21] 刘婷, 姚凌云, 王彩霞, 等.生物发酵技术在化妆品中的应用研究进展[J].香料香精化妆品, 2021(3):114-119.LIU T, YAO L Y, WANG C X, et al.Research progress on application of biological fermentation technology in cosmetics[J].Flavour Fragrance Cosmetics, 2021(3):114-119.
[22] 鲁丽颖, 卢士欣, 申东晨, 等.裂褶菌产酶条件优化及对秸秆的降解[J].菌物学报, 2023, 42(11):2285-2293.LU L Y, LU S X, SHEN D C, et al.Optimization of enzyme production and straw degradation by Schizophyllum commune[J].Mycosystema, 2023, 42(11):2285-2293.
[23] 邓映, 钟建桥.皮肤光损伤与氧化应激研究进展[J].临床皮肤科杂志, 2017, 46(9):671-673.DENG Y, ZHONG J Q.Advances in skin photodamage and oxidative stress[J].Journal of Clinical Dermatology, 2017, 46(9):671-673.
[24] 石洪林, 余文胜.花姜酮对急性肝损伤大鼠Nrf2/HO-1/NQO-1氧化应激损伤的影响[J].浙江中西医结合杂志, 2022, 32(3):217-222.SHI H L, YU W S.Zingerone protects oxidative stress-induced acute liver injury in a rat model by the regulation of the Nrf2/HO-1/NQO-1 signaling[J].Zhejiang Journal of Integrated Traditional Chinese and Western Medicine, 2022, 32(3):217-222.
[25] 张芳芳, 车雅敏, 傅志宜.Filaggrin和Caspase-14在皮肤屏障中的作用[J].皮肤性病诊疗学杂志, 2012, 19(2):114-117.ZHANG F F, CHE Y M, FU Z Y.Role of Filaggrin and Caspase-14 in the skin barrier[J].Journal of Dermatology and Venereology, 2012, 19(2):114-117.
[26] 韩耕涛, 董卓, 姚韧辉.芝麻林素对皮肤光老化小鼠AQP3表达和Nrf2信号通路活化的影响[J].日用化学工业(中英文), 2024, 54(4):431-438.HAN G T, DONG Z, YAO R H.Effects of sesamolin on AQP3 expression and Nrf2 signaling pathway activation in skin photoaging mice[J].China Surfactant Detergent &Cosmetics, 2024, 54(4):431-438.
[27] 蔡强, 于婷, 唐海姣, 等. 人参皂苷Rh2调节TNF/MAPK和NF-κB信号通路抑制TGF-β1诱导的LX-2细胞活化[J]. 中药新药与临床药理, 2022, 33(8):1047-1054.CAI Q, YU T, TANG H J, et al. Ginsenoside Rh2 regulates TNF/MAPK and NF-κB signaling pathway to inhibit TGF-β1 induced activation of LX-2 cells[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2022, 33(8):1047-1054.
[28] LIU T, ZHANG L Y, JOO D, et al.NF-κB signaling in inflammation[J].Signal Transduction and Targeted Therapy,2017,2(1):17023.