由于生活节奏快、工作压力大、作息不规律等多种因素,越来越多的人极易出现肠道健康问题,继而可能增加罹患多种疾病的风险。肠道菌群是与宿主共存、丰度可达百万亿的复杂而多样的微生物群落,菌群种类、菌群代谢产物、菌群多样性差异都与宿主的肠道健康直接相关[1-2]。研究表明,膳食对肠道健康及菌群代谢具有重要的调节作用[3-4],而作为膳食重要组成部分的谷物对于肠道健康的影响已成为研究重点。
稻谷是禾本科稻属植物,是世界主要粮食作物之一,为近一半的世界人口提供日常所需营养和能量。糙米是稻谷经脱壳加工后的产物,主要由米糠层、胚芽和胚乳组成。与传统大米相比,糙米保留了米糠与胚芽,含有更丰富的营养成分及活性物质。食用糙米有利于预防和控制冠心病、高血压、糖尿病、代谢综合征等多种疾病[5-6]。但由于麸皮层的存在,糙米制品的蒸煮时间较长、硬度和嚼劲较大,口感较差,通常需要采用物理改良技术或生物加工技术对其进行加工,因此以采用不同方式处理后的糙米为对象开展研究更具有现实意义。
微生物发酵是一种经济、安全的生物改性方法,在谷物加工领域应用广泛,是具有应用潜力的糙米加工方法。发酵主要通过酸的激活、酶的催化以及微生物的代谢产物对谷物基质产生影响[7],可赋予谷物食品理想的质地、良好的风味、丰富的营养,同时也有益于人体肠道健康。WANG等[8]发现存在于发酵谷物中的阿拉伯木聚糖对肠道中微生物群落组成具有调节功能。TAMURA等[9]也通过研究证实了发酵谷物中的β(1, 3)/β(1, 4)-葡聚糖对于肠道微生物代谢具有重要意义。然而,目前针对糙米酵素调节肠道健康的功效评价及机制挖掘的研究相对较少。
本研究基于非靶向代谢组学研究挖掘糙米经过发酵处理后对肠道健康有益的潜在功能物质;通过硫酸铝建立便秘斑马鱼模型,通过其肠道荧光强度、肠道一氧化氮(nitric oxide,NO)清除率、一氧化氮合成酶(nitric oxide synthetase,NOS)mRNA表达水平探究糙米酵素改善肠道运动的机制机理;进一步采用体外模拟结肠厌氧发酵体系,评价糙米酵素对人体肠道微生物组成、结构特征和代谢产物短链脂肪酸的影响,有助于深入理解植物生物发酵与肠道健康的关系,为开发相关健康产品提供理论依据。
1 材料与方法
1.1 材料与试剂
吗丁啉®多潘立酮片(批号190104499),西安杨森制药有限公司;NO检测探针,翌圣生物科技(上海)股份有限公司;FastKing cDNA第一链合成试剂盒(去基因组)、TGuide S96 磁性土壤/粪便DNA试剂盒,天根生化科技(北京)有限公司(China);Universal RNA Extraction TL Kit C,佛山奥维生物科技有限公司。除另有说明外,其他化学试剂均为分析纯。
1.2 仪器与设备
SZX7解剖显微镜,日本OLYMPUS公司;VertA1CCD相机,上海土森视觉科技有限公司;AZ100电动聚焦连续变倍荧光显微镜,日本Nikon公司;CP214精密电子天平,美国OHAUS公司;T100普通PCR扩增仪、CFX Connect荧光定量PCR仪,新加坡BIO-RAD公司;Heraeus Fresco17高速冷冻离心机,德国ThermoFisher公司;Nanodrop 2000紫外-可见光分光光度计,美国Thermo公司;Auto-Pure32A全自动核酸提取仪,杭州奥盛仪器有限公司;Synergy HTX酶标仪,中国GeneCompang有限公司;Veriti 96-Well 9902梯度基因扩增仪,美国Appliedbiosystem公司;GC-2010Plus气相色谱仪,岛津企业管理(中国)有限公司。
1.3 实验方法
1.3.1 糙米和糙米酵素冻干粉制备方法
糙米用水充分浸泡后蒸熟至米粒膨胀、外硬内软、无生芯,加入干糙米0.2%(质量分数)的根霉粉28 ℃发酵36 h。将得到的糙米发酵液100 ℃蒸煮20 min 灭菌。将熟糙米和灭菌后的糙米发酵液冷冻干燥得到糙米冻干粉和糙米酵素冻干粉。
1.3.2 非靶向代谢组学
将糙米或糙米酵素冻干粉样品用蒸馏水配制成20.0 mg/mL的溶液。将100 μL样品与预冷的色谱级甲醇(1∶4,体积比)混合并离心,取上清液待用。将3 μL样品进样到ACQUITY UPLC BEH C18(100 mm×2.1 mm×1.7 μm)色谱柱中。流动相A为乙腈水(2%体积分数,含0.1%体积分数甲酸),流动相B为乙腈(含0.1%体积分数甲酸),流速为0.4 mL/min,梯度为:0.0~0.5 min,98% A;0.5~7.5 min,98%~65% A;7.5~13 min,65%~5% A;13~14.4 min,5% A;14.4~14.5 min,5%~98% A;14.5~16 min,98% A,柱温保持在40 ℃。采用正离子和负离子扫描方式采集质谱信号。扫描范围为70~1 050 m/z,鞘气流速为50 arb,辅助气流速为13 arb,加热温度450 ℃,毛细管温度320 ℃,喷雾电压(正模式)3 500 V,喷淋电压(负模式)-3 000 V,S-Lens电压40,碰撞能20、40、60 eV。每个样品3次平行检测。
1.3.3 斑马鱼便秘模型实验
斑马鱼具有体积小、喂养方便、成本低、与人类基因组相似性高的优点[10],已被用于验证发酵谷物制品对人体健康的益处。参照林超等[11]的方法并稍作修改。斑马鱼由杭州环特生物科技股份有限公司提供,试验动物使用许可证号为:SYXK(浙)2022-0004,饲养管理符合国际AAALAC认证(认证编号:001458)的要求。野生型AB品系斑马鱼,以自然成对交配繁殖方式进行。
将受精后5 d(5 dpf)斑马鱼随机分配至6孔板中,每孔30尾,以硫酸铝(1 μg/mL)处理6 h建立便秘模型,共分为2组,处理组为适量糙米酵素冻干粉,阳性对照组为50 μg/mL多潘立酮,均于28 ℃干预24 h。以有无心跳统计各试验组的斑马鱼死亡数量,测定便秘斑马鱼模型对糙米酵素的最大耐受剂量(maximum talerated concentration,MTC)。
采用水溶尼罗红方式对斑马鱼肠道染色,每组随机选取10尾斑马鱼在荧光显微镜下拍摄照片,分析斑马鱼肠道荧光强度,以评价斑马鱼的肠道运动情况。
用NO检测探针对斑马鱼肠道NO染色,每组随机选取10尾斑马鱼在荧光显微镜下拍摄照片,分析斑马鱼肠道NO荧光强度,以评价NO清除率。
提取斑马鱼总RNA,取2.00 μg反转录20.0 μL cDNA,通过q-PCR检测β-actin、nos1、nos2a和nos2b基因的表达。以β-actin作为基因表达的内参,计算nos1、nos2a和nos2b基因的相对表达量。引物序列详见表1。
表1 引物序列信息
Table 1 Primers sequence information
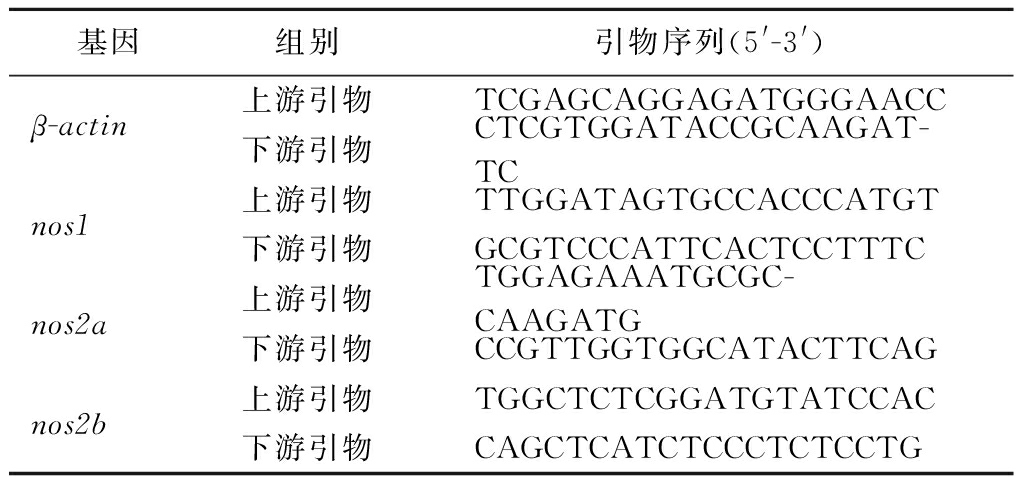
基因组别引物序列(5'-3')β-actin上游引物TCGAGCAGGAGATGGGAACC下游引物CTCGTGGATACCGCAAGAT-TCnos1上游引物TTGGATAGTGCCACCCATGT下游引物GCGTCCCATTCACTCCTTTCnos2a上游引物TGGAGAAATGCGC-CAAGATG下游引物CCGTTGGTGGCATACTTCAGnos2b上游引物TGGCTCTCGGATGTATCCAC下游引物CAGCTCATCTCCCTCTCCTG
1.3.4 体外模拟结肠厌氧发酵实验
参照CHEN等[12]的方法配制发酵培养基。参照WANG等[13]的方法进行制备粪便菌悬液,其中人类粪便采集自男性和女性健康志愿者各2名,均无肠道疾病和基础代谢病且3个月内未服用抗生素。将6 mL发酵培养基与3 mL菌悬液混匀,加入0.5%(质量分数)的糙米酵素,37 ℃厌氧发酵48 h。收集发酵样品,12 000 r/min离心10 min得到上清液和沉淀,分别用于后续实验。
1.3.5 短链脂肪酸的测定
参照ZHANG等[14]的方法并稍作修改。将0.8 mL发酵上清液与0.2 mL 50%(体积分数)硫酸溶液充分混合,加入1 mL乙醚振荡1 min(冰上操作),冰浴10 min,用无水氯化钙去除残留水,12 000 r/min离心10 min后收集上清液过0.22 μm尼龙膜。使用气相色谱结合HP-FFAP柱(30 m×0.25 mm×0.25 mm),载气为N2,流速为19.0 mL/min,分流比1∶10,检测器进样口温度均为260 ℃,进样量为1 μL。短链脂肪酸浓度采用外标法进行定量分析。升温程序为初始温度80 ℃,保持1.5 min,以10 ℃/min的速度升温至240 ℃,温度达260 ℃保持20 min,以外标法对乙酸、丙酸、正丁酸、正戊酸进行定量分析。
1.3.6 16S RNA基因高通量测序
将发酵沉淀物进行DNA提取和16S rRNA高通量测序。使用上游引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和下游引物806R(5′- GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的V3~V4可变区进行PCR扩增。使用Illumina HiSeq 2500平台进行测序。基于上海美吉生物医药科技有限公司I-sanger生信云平台(http://www.isanger.com/index.html)进行数据处理和生物信息分析。
1.4 统计分析
数据采用SPSS 25.0进行单因素方差分析。采用邓肯多重比较,在95%或99%的置信水平上比较平均值,以确定样本之间的显著差异(P<0.05或P<0.001)。所有实验均重复进行,数据以“平均值±标准差”表示。
2 结果与分析
2.1 糙米酵素调节肠道健康的潜在功能物质挖掘
为了探索糙米发酵后影响肠道健康的关键功能代谢物,本研究通过非靶向代谢组学的方法对糙米及糙米酵素中的小分子差异代谢物进行高通量测定。采用主成分分析(principal component analysis, PCA)和偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)法反映糙米经过发酵处理后的代谢差异(图1-A和图1-B),结果均显示糙米酵素组与糙米组显著分离,表明糙米经发酵后,其内源性代谢物变化显著。

A-PCA图;B-PLS-DA图;C-糙米酵素相较于糙米的显著差异代谢物火山图;D-糙米与糙米酵素之间差异代谢物的分层聚类分析;E-植物初生代谢物分类图;F-植物次生代谢物分类图;G-糙米与糙米酵素之间差异代谢物的表达谱及VIP值分析(VIP>2, P<0.05)
图1 糙米与糙米酵素的非靶向代谢组学分析结果
Fig.1 Non-targeted metabolomics analysis of brown rice and brown rice ferments
注:BR表示糙米组;FerBR表示糙米酵素组。
图1-C采用火山图的形式展示发酵前后糙米中的显著差异代谢物[差异贡献值变量重要性投影(variable important in projection,VIP)>1, P<0.05]。图1-E和图1-F的结果显示,与未糙米酵素相比,糙米酵素共有506个差异代谢物(图1-C),415个上调、91个下调(图1-D)。图1-E和图1-F的结果显示,糙米酵素的差异代谢物中脂质(76种)、碳水化合物及其衍生物(48种)、氨基酸及其衍生物(44种)等植物初生代谢产物和萜类化合物(100种)、甾体及其衍生物(33种)等植物次生代谢产物发生显著变化(P<0.05)。与未糙米酵素相比,糙米酵素中的乙酰氨基葡萄糖、羟基白藜芦醇苷、黄麻属醇苷A、N-乙酰-β-氨基葡萄糖、土霉素、新岩蛤毒素、去乙酰异戊酸酯、刀豆苷等代谢物的差异贡献度较高(图1-G)。有研究表明,羟基白藜芦醇苷作为苦艾草(Artemisia absinthium)的主要成分之一,具有抗寄生虫和抗氧化的作用[15]。因此,本研究推测上述差异代谢物可能是糙米酵素改善肠道健康的重要功能物质基础。
2.2 糙米酵素显著改善便秘斑马鱼的肠道运动
为进一步评价糙米酵素对生物体肠道健康的调节作用,本研究通过便秘斑马鱼模型探究糙米酵素对肠道运动的改善作用。便秘斑马鱼模型对糙米酵素的最大耐受剂量实验结果显示,当糙米酵素的暴露质量浓度为125~1 000 μg/mL时,斑马鱼生活正常;升高到2 000 μg/mL后会导致斑马鱼出现死亡(死亡率17%,表2),说明斑马鱼对糙米酵素的MTC为1 000 μg/mL。
表2 糙米酵素预防便秘功效最大耐受浓度的测定(n=30)
Table 2 Determination of maximum tolerance concentration of the efficacy of brown rice ferments in preventing constipation (n=30)
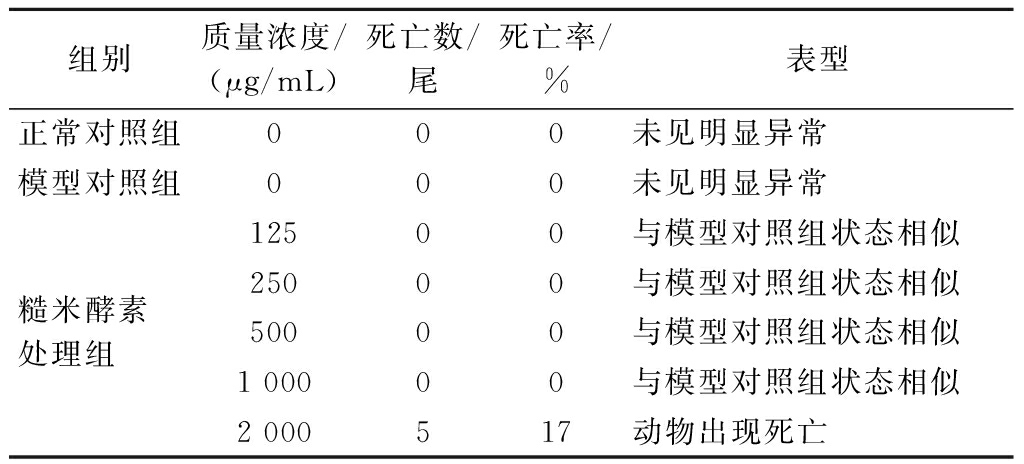
组别质量浓度/(μg/mL)死亡数/尾死亡率/%表型正常对照组000未见明显异常模型对照组000未见明显异常糙米酵素 处理组 12500与模型对照组状态相似25000与模型对照组状态相似50000与模型对照组状态相似1 00000与模型对照组状态相似2 000517动物出现死亡
图2尼罗红染色的结果显示,糙米酵素可以促进斑马鱼肠道内尼罗红染料的排出。随着糙米酵素的处理质量浓度从500 μg/mL增加至1 000 μg/mL,其肠道的荧光强度减弱(图2-A)。图2-B显示,500 μg/mL的糙米酵素处理下,处理组与模型对照组对尼罗红染料的排出无显著差异(P>0.05),但显著高于正常对照组和阳性对照组(P<0.01);当糙米酵素质量浓度提高到750 μg/mL时,与模型对照组相比,处理组的荧光强度显著降低了26.7%(P<0.01),与正常对照组达到同一水平,差异不显著(P>0.05);当处理质量浓度进一步提高到1 000 μg/mL时,与模型对照组相比,处理组的荧光强度显著降低了30.0%(P<0.01),但与正常对照组和750 μg/mL糙米酵素处理组的差异均不显著(P>0.05)。而与阳性对照组相比,阳性对照组的荧光强度显著降低了36.7%,甚至显著低于正常组(P<0.05)。上述结果表明糙米酵素能够有效促进便秘斑马鱼模型的肠道运动,且相较于多潘立酮,糙米酵素干预便秘的效果更温和,可接近于正常水平。而后本研究又将样品质量浓度降低至655 μg/mL后,对比便秘模型组,预防便秘功效得到了显著性改善(P<0.001),推测糙米酵素具有预防斑马鱼便秘模型功效最低起效质量浓度为655 μg/mL左右。
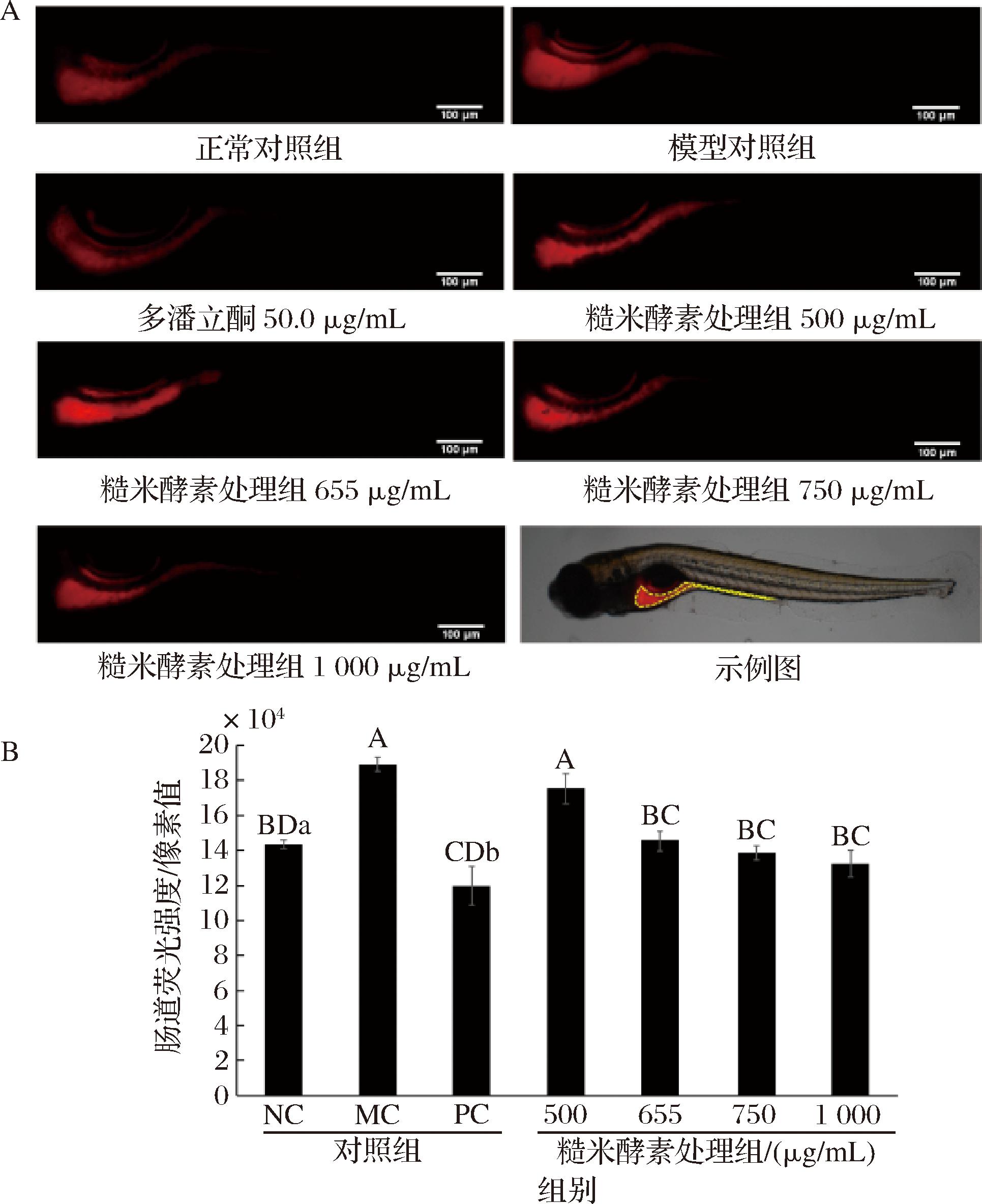
A-斑马鱼肠道尼罗红染色的荧光成像,黄色虚线框为斑马鱼肠道分析部位;B-斑马鱼的肠道荧光信号强度
图2 糙米酵素对便秘斑马鱼模型肠道蠕动的影响
Fig.2 Effect of brown rice ferments on intestinal motility of zebrafish model with constipation
注:NC,正常对照组;MC,模型对照组;PC,阳性对照组(多潘立酮);柱状图中,不同大写字母表示存在极显著性差异(P<0.01);不同小写字母表示存在显著性差异(P<0.05)(下同)。
2.3 糙米酵素显著上调便秘斑马鱼NOS基因的表达
NO是影响肠动力的一种主要抑制性神经递质,在胃肠道的功能活动中发挥重要的作用[16]。NOS是NO合成过程中唯一的酶,目前斑马鱼共鉴定出nos1、nos2a和nos2b三种类型的NOS基因[17]。为探究糙米酵素干预便秘斑马鱼肠道运动的作用机制,本研究测定便秘斑马鱼模型肠道NO的荧光强度和NOS mRNA的表达水平。图3表明,便秘斑马鱼模型肠道NO的荧光强度与肠道荧光强度表现出相同的趋势。随着糙米酵素的处理质量浓度增加,斑马鱼肠道NO的荧光强度减弱(图3-A),相比于模型对照组,500、750、1 000 μg/mL糙米酵素处理组NO的荧光强度分别显著降低了26.1%、30.6%和35.1%(P<0.01),且与正常对照组的差异均不显著(P>0.05),同样表明糙米酵素相较于多潘立酮能够更温和地促进便秘斑马鱼模型的肠道运动(图3-B)。同时,1 000 μg/mL糙米酵素处理时,便秘斑马鱼模型的nos1和nos2b基因的相对表达量极显著降低(P<0.01,图3-C和图3-E),nos2a基因的相对表达量显著降低(P<0.05,图3-D),表明糙米酵素处理可下调斑马鱼NOS基因的表达,提高便秘斑马鱼NO的清除率,从而促进斑马鱼的肠道运动。
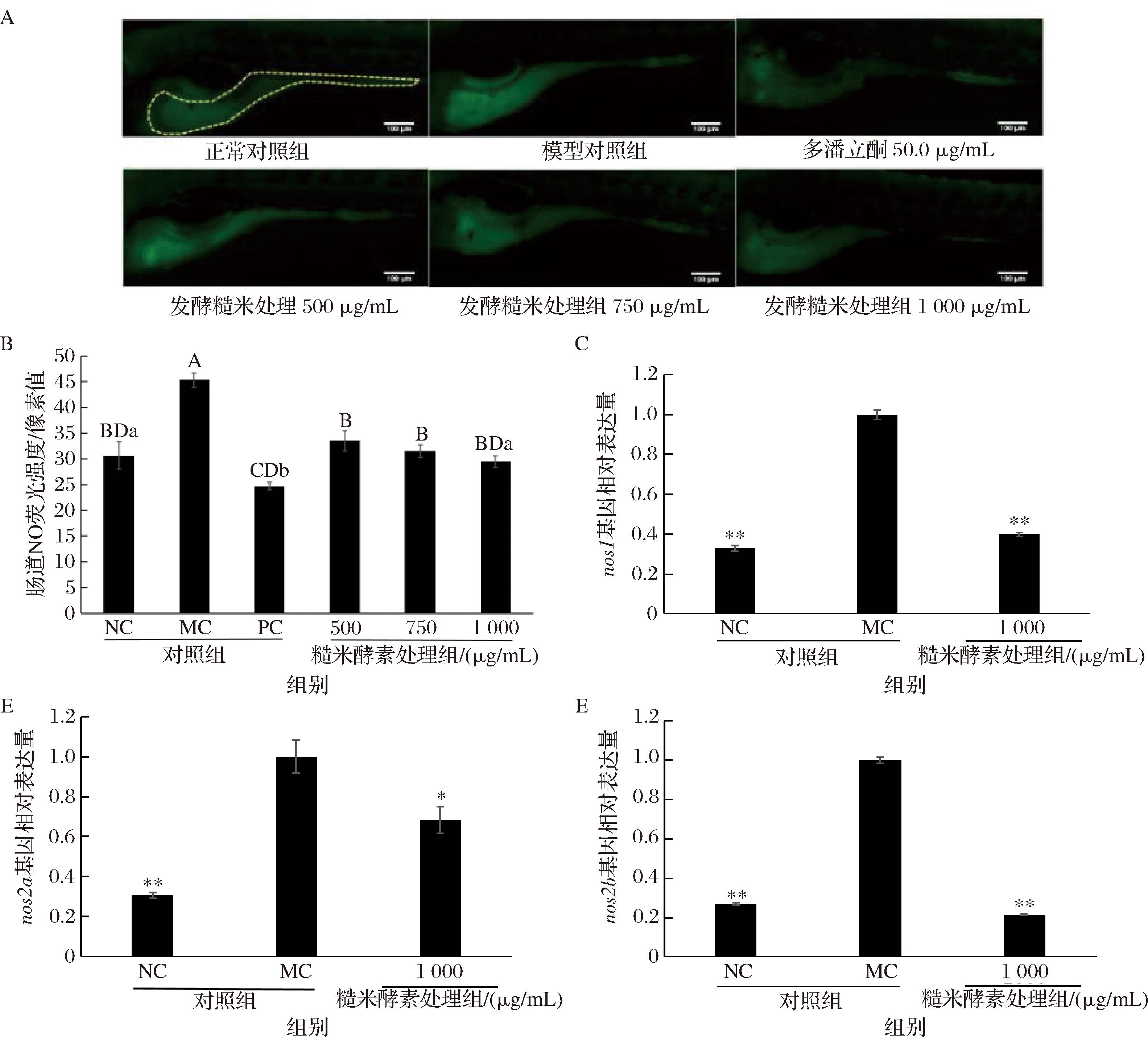
A-斑马鱼肠道NO染色的荧光成像,黄色虚线框为斑马鱼肠道分析部位;B-斑马鱼肠道的NO荧光信号强度;C-nos1基因相对表达量;D-nos2a基因相对表达量;E-nos2b基因相对表达量
图3 糙米酵素对便秘斑马鱼模型NO表达的影响
Fig.3 Effect of brown rice ferments on NO expression in zebrafish model with constipation
注:**表示与MC相比,存在极显著性差异(P<0.01);*表示与MC相比,存在显著性差异(P<0.05)。
2.4 糙米酵素显著提高人体肠道菌群代谢物短链脂肪酸水平
为进一步挖掘糙米酵素对肠道健康的改善情况,本研究采用体外模拟结肠厌氧发酵体系评估糙米酵素对发酵产物pH及短链脂肪酸水平的影响(图4)。已有研究报道肠道有益菌的活动和增殖能够产生短链脂肪酸等有益于肠道健康的酸性物质,降低肠道环境pH[18]。相较于空白对照,糙米酵素处理组的pH值整体呈现迅速下降而后逐步变缓的规律,从0 h时的6.83±0.01快速下降至12 h时的4.51±0.02,发酵48 h后pH值下降至3.82±0.00,表明糙米酵素能调节肠道菌群产生大量酸性物质,而空白对照组的pH无显著变化(图4-A)。
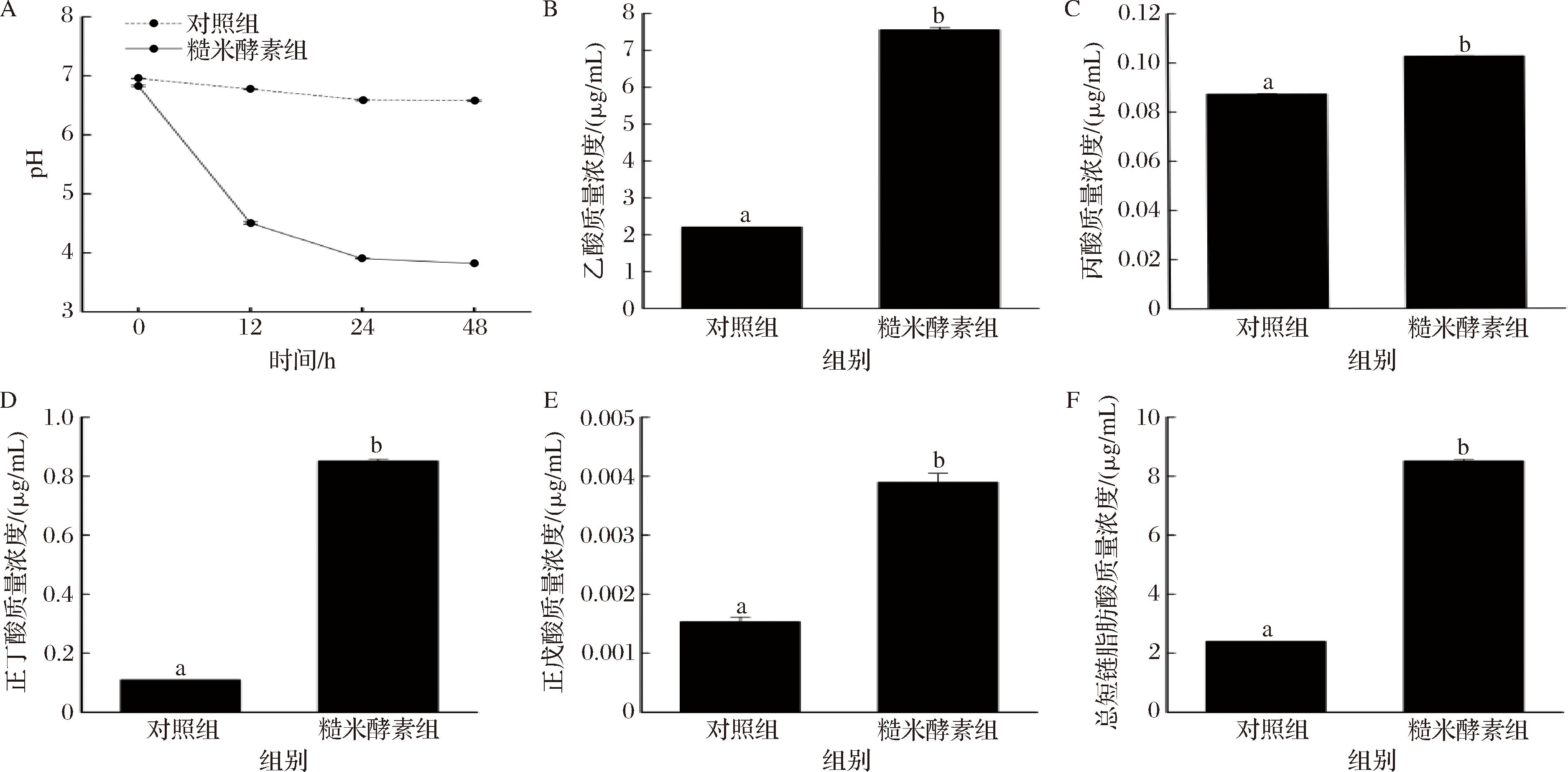
A-pH;B-乙酸质量浓度;C-丙酸质量浓度;D-正丁酸质量浓度;E-正戊酸质量浓度;F-总短链脂肪酸质量浓度
图4 发酵48 h后糙米酵素对肠道菌群代谢产生短链脂肪酸的影响
Fig.4 Effects of brown rice ferments on short-chain fatty acid production by intestinal flora metabolism after 48 h fermentation
研究证实,肠道菌群代谢产生的短链脂肪酸有助于改善宿主代谢、缓解炎症和增强肠上皮屏障,肠道微生物介导的宿主代谢也可能与短链脂肪酸信号通路有关,有助于人体健康[19]。本研究采用气相色谱法测定短链脂肪酸含量。如图4显示,糙米酵素处理组的乙酸、丙酸、正丁酸和正戊酸含量显著高于对照组(P<0.05),相对而言,糙米酵素更有利于提升肠道菌群代谢物乙酸和正丁酸水平。短链脂肪酸是肠道菌群利用膳食纤维或多糖发酵产生的代谢产物。乙酸是双歧杆菌和乳杆菌代谢的主要产物,可以改善肠道微环境、促进部分营养素吸收[20-21];丙酸能够被外周器官吸收利用,维护宿主机体健康[22];丁酸可以作为结肠上皮细胞的主要能量来源,在促进营养物质吸收和维持肠道完整性等方面发挥着重要作用[23];戊酸可以促使机体产生炎症与免疫抑制因子,抑制致病性细胞表型的增殖[24]。上述结果表明,糙米酵素促使肠道菌群产生更多的短链脂肪酸,总水平(乙酸+丙酸+丁酸+正戊酸)显著高于对照组(P<0.05)。
2.5 糙米酵素能够提高人体肠道微生物多样性
由于肠道菌群与肠道功能密切相关,基于体外模拟结肠发酵体系,本研究采用16S rRNA基因高通量测序技术分析糙米酵素对肠道菌群的影响。图5趋于平滑的稀释曲线表明此次测序深度能够包含稀有新物种以及大部分菌群的多样性,可用于进一步分析。
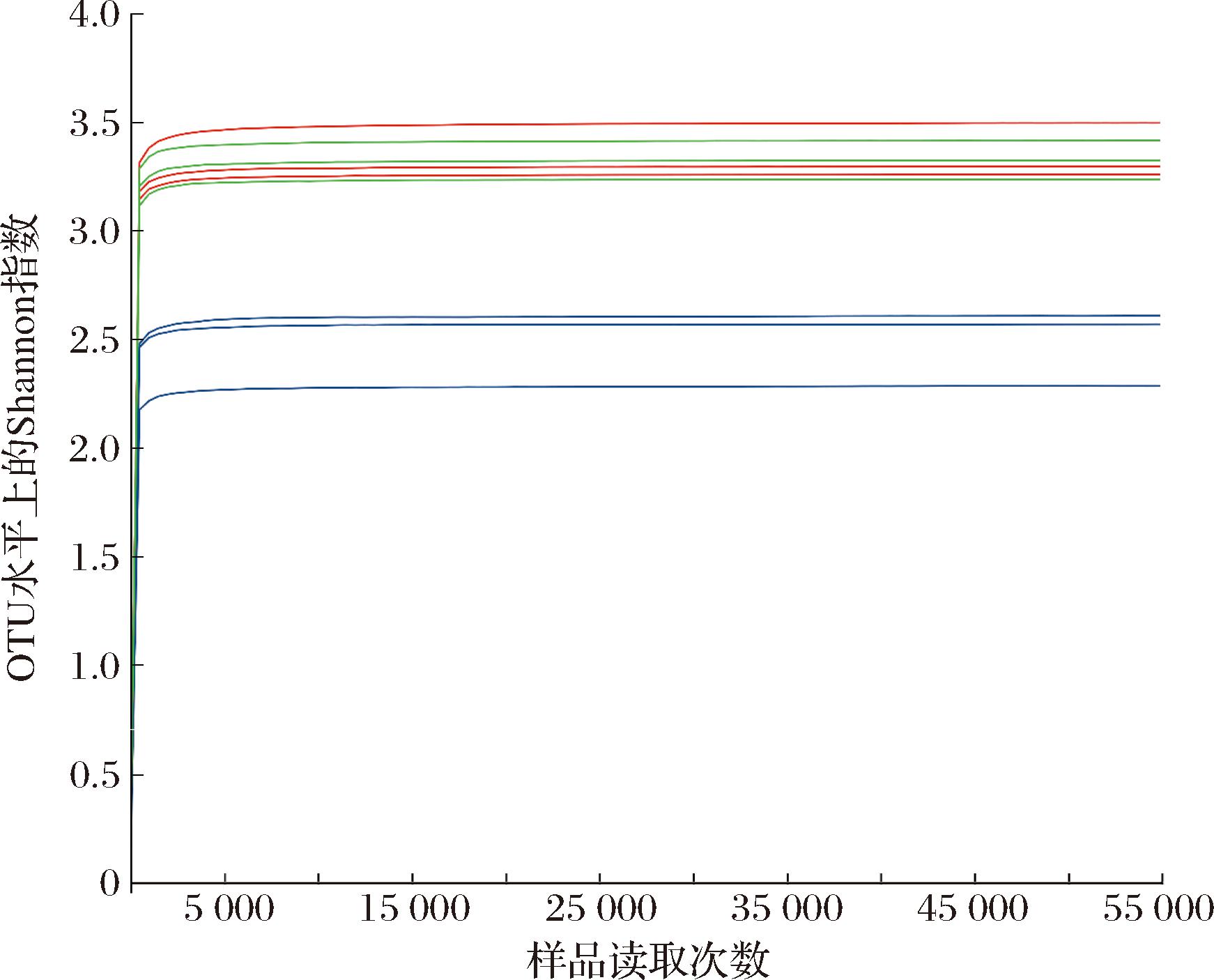
图5 Shannon指数的稀释曲线
Fig.5 Shannon curves
图6-A和图6-B中,α-多样性分析中的Shannon指数和Simpson指数分析表明糙米酵素显著改变操作分类单元(operational taxonomic unit,OTU)水平肠道菌群的丰富度和多样性。图6-C中,β多样性主坐标分析(principal co-ordinates analysis, PCoA)同样显示糙米酵素干预前后的肠道菌群组成显著不同,证明糙米酵素对肠道菌群的有效调节作用。由图6-D和图6-F可知,糙米酵素在门水平以及属水平均可调节肠道菌群组成。胃肠道功能紊乱与肠道菌群失调之间有很大联系,肠道菌群紊乱可以通过神经系统、肠道菌群代谢产物和免疫系统等多途径参与便秘的发展过程[25]。有研究表明,兼性厌氧菌变形菌门的丰度与肠道炎症、肠道上皮功能障碍、菌群失调呈正相关[26]。另有研究报道,高厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)的比例(Firmicutes/Bacteroidetes)通常被用作肠道微生态失调的替代指标[27]。由图6-E可知,糙米酵素干预显著下调变形菌门(Proteobacteria)的相对丰度(P<0.05),并显著上调拟杆菌门的相对丰度(P<0.05),导致Firmicutes/Bacteroidetes比例显著降低(P<0.05),表明糙米酵素干预能减少菌群失调及肠道功能紊乱风险,促进肠道上皮行使正常功能,稳定肠道微生态。
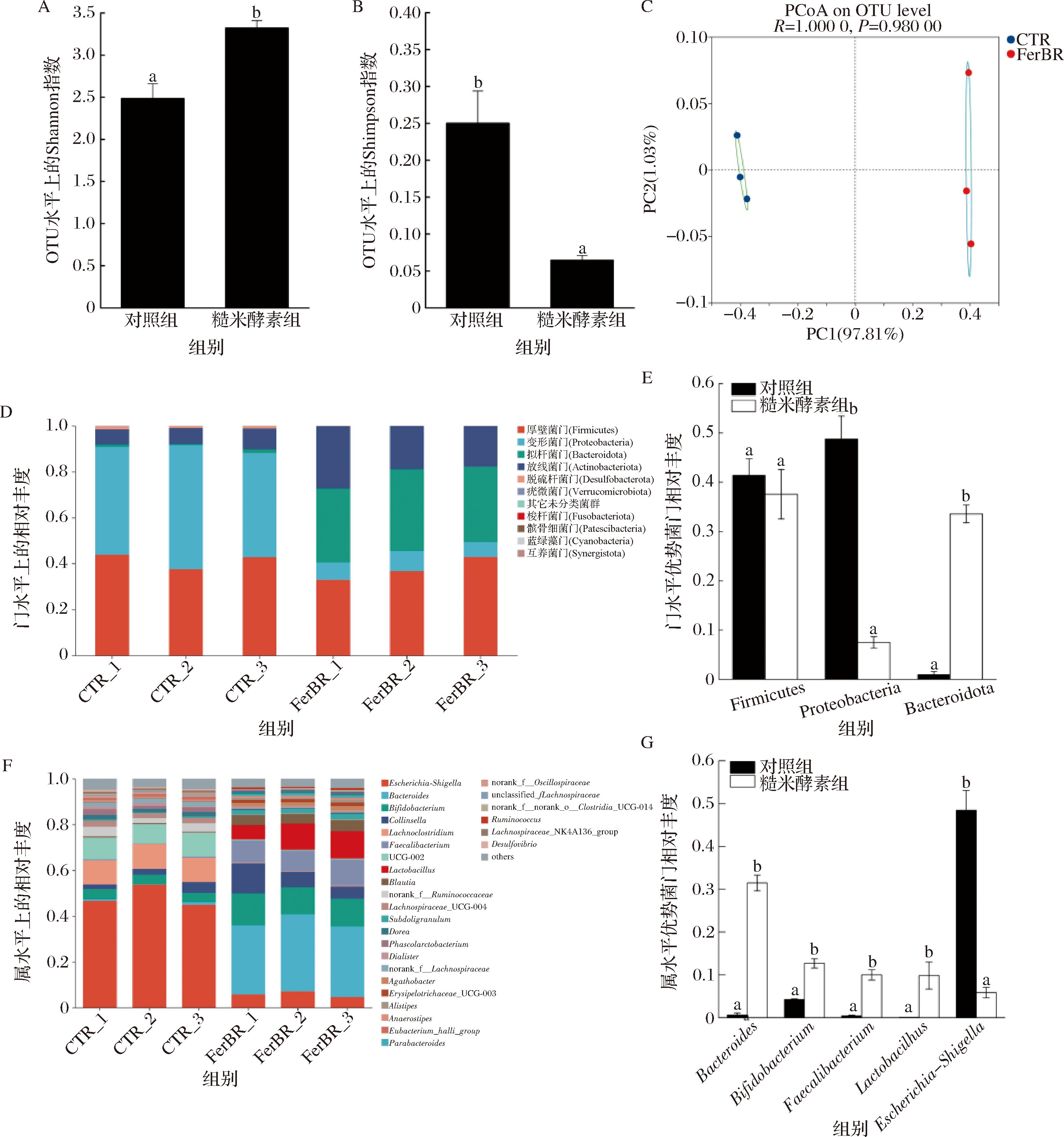
A-OTU水平上的Shannon指数图;B-OTU水平上的Simpson指数图;C-OTU水平上的PCoA图;D-门水平上的菌群相对丰度图;E-优势菌门相对丰度柱形图;F-属水平上的菌群相对丰度柱形图;G-优势菌属相对丰度柱形图
图6 糙米酵素对肠道微生物多样性的影响
Fig.6 Effect of brown rice ferments on gut microbial diversity
此外,图6-G显示,糙米酵素干预后,拟杆菌门拟杆菌属(Bacteroides)、放线菌门双歧杆菌属(Bifidobacterium)、厚壁菌门乳杆菌属(Lactobacillus)和粪杆菌属(Faecalibacterium)的相对丰度显著升高(P<0.05),研究表明,其在维持肠道正常功能、改善人体炎症性肠病等肠功能障碍发展中发挥着积极作用,可增强机体肠道消化能力和屏障功能,改善便秘,降低炎症反应及感染风险[28-31]。同时,糙米酵素干预伴随变形菌门大肠杆菌-志贺氏菌属(Escherichia-Shigella)等促炎性细菌相对丰度的显著降低(P<0.05),表明糙米酵素能够在一定程度上改善肠道菌群失调,有助于调节人体肠道菌群的组成结构,对肠道健康具有积极作用,这可能与糙米酵素中含有膳食纤维、花青素、酚类、黄酮类等功能成分有关,而发酵处理更好地保持了糙米中酚类、黄酮类以及花青素水平[32-33]。总体来说,糙米酵素是一种有前途的饮食干预策略。
3 结论
本研究探究了糙米酵素调节肠道健康的功效评价并挖掘其作用机制。结果表明,糙米经过发酵处理后代谢差异显著(P<0.05),506个差异代谢物中,415个代谢物均为上调,包括脂质、碳水化合物及其衍生物、氨基酸及其衍生物等植物初生代谢产物,以及萜类化合物、甾体及其衍生物等植物次生代谢产物,是有益于肠道健康的功能物质基础;通过便秘斑马鱼模型验证得到,糙米酵素可通过下调斑马鱼nos1、nos2a和nos2b基因的表达,提高便秘斑马鱼NO的清除率,从而促进斑马鱼的肠道运动达到正常水平,相较于多潘立酮更温和;经过人体外模拟结肠厌氧发酵分析验证,糙米酵素还可通过调节人体肠道菌群的组成结构丰富人体肠道微生物组成。因此,糙米酵素能够温和地调节肠道运动,丰富肠道微生物组成,改善有益菌结构及肠道微生态,为开发相关健康产品提供理论依据。
[1] FUJISAKA S, WATANABE Y, TOBE K. The gut microbiome: A core regulator of metabolism[J]. Journal of Endocrinology, 2023, 256(3): 21.
[2] VATANEN T, FRANZOSA E A, SCHWAGER R, et al. The human gut microbiome in early-onset type 1 diabetes from the TEDDY study[J]. Nature, 2018, 562(7728):589-594.
[3] SAKKAS H, BOZIDIS P, TOUZIOS C, et al. Nutritional status and the influence of the vegan diet on the gut microbiota and human health[J]. Medicina, 2020, 56(2):88.
[4] HILLS R, PONTEFRACT B, MISHCON H, et al. Gut microbiome: Profound implications for diet and disease[J]. Nutrients, 2019, 11(7):1613.
[5] REN C Y, LU S W, GUAN L J, et al. The metabolomics variations among rice, brown rice, wet germinated brown rice, and processed wet germinated brown rice[J]. Journal of Integrative Agriculture, 2022, 21(9):2767-2776.
[6] FUKUI M, ISLAM M Z, LAI H M, et al. Effects of roasting on storage degradability and processing suitability of brown rice powder[J]. LWT, 2022, 161:113277.
[7] KATINA K, POUTANEN K. Nutritional Aspects of Cereal Fermentation with Lactic Acid Bacteria and Yeast[M]. Handbook on Sourdough Biotechnology. New York, NY: Springer US, 2012:229-244.
[8] WANG J, BAI J Y, FAN M C, et al. Cereal-derived arabinoxylans: Structural features and structure-activity correlations[J]. Trends in Food Science &Technology, 2020, 96:157-165.
[9] TAMURA K, HEMSWORTH G R, DÉJEAN G, et al. Molecular mechanism by which prominent human gut bacteroidetes utilize mixed-linkage beta-glucans, major health-promoting cereal polysaccharides[J]. Cell Reports, 2017, 21(7):2030.
[10] SHEN F, WANG Q Q, ZHONG H, et al. Combination of galacto-oligosaccharides and wheat peptides synergistically relieved constipation via regulating water transport, gut barrier, inflammation and gut microbiota[J]. Food Bioscience, 2023, 56:103208.
[11] 林超, 张晓芹, 林炳锋, 等. 消疳健胃合剂对便秘大鼠胃肠功能的促进作用及机制研究 [J]. 中国中医药科技, 2023, 30(4): 642-645.LIN C, ZHANG X Q, LIN B F, et al. Effect and mechanism of Xiaogan Jianwei Mixture on regulating gastrointestinal function in constipated rat [J]. Chinese Journal of Traditional Medical Science and Technology, 2023, 30(4): 642-645.
[12] CHEN G J, XIE M H, WAN P, et al. Digestion under saliva, simulated gastric and small intestinal conditions and fermentation in vitro by human intestinal microbiota of polysaccharides from Fuzhuan brick tea[J]. Food Chemistry, 2018, 244:331-339.
[13] WANG W Q, LI J J, ZHOU J Y, et al. The effect of ion environment changes on retention protein behavior during whey ultrafiltration process[J]. Food Chemistry: X, 2022, 15:100393.
[14] ZHANG L, SHI M X, JI J F, et al. Gut microbiota determines the prevention effects of Luffa cylindrica(L.) Roem supplementation against obesity and associated metabolic disorders induced by high-fat diet[J]. The FASEB Journal, 2019, 33(9):10339-10352.
[15] GONZALEZ-COLOMA A, BAILEN M, DIAZ C E, et al. Major components of Spanish cultivated Artemisia absinthium populations: Antifeedant, antiparasitic, and antioxidant effects[J]. Industrial Crops and Products, 2012, 37(1):401-407.
[16] IDRIZAJ E, TRAINI C, VANNUCCHI M G, et al. Nitric oxide: From gastric motility to gastric dysmotility[J]. International Journal of Molecular Sciences, 2021, 22(18):9990.
[17] DENG Y H, WANG L, WEI T Y, et al. Inhibition of oocyte maturation by nitric oxide synthase 1 (NOS1) in zebrafish[J]. General and Comparative Endocrinology, 2022, 321-322:114012.
[18] FIGUEROA L M, RAM REZ-JIMÉNEZ A K, SENÉS-GUERRERO C, et al. Assessment of the bacterial diversity of Agave sap concentrate, resistance to in vitro gastrointestinal conditions and short-chain fatty acids production[J]. Food Research International, 2021, 140:109862.
REZ-JIMÉNEZ A K, SENÉS-GUERRERO C, et al. Assessment of the bacterial diversity of Agave sap concentrate, resistance to in vitro gastrointestinal conditions and short-chain fatty acids production[J]. Food Research International, 2021, 140:109862.
[19] ARNOLD J W, ROACH J, FABELA S, et al. The pleiotropic effects of prebiotic galacto-oligosaccharides on the aging gut[J]. Microbiome, 2021, 9(1):31.
[20] ZHANG X, AWEYA J J, HUANG Z X, et al. In vitro fermentation of Gracilaria lemaneiformis sulfated polysaccharides and its agaro-oligosaccharides by human fecal inocula and its impact on microbiota[J]. Carbohydrate Polymers, 2020, 234:115894.
[21] FERREIRA-LAZARTE A, MORENO F J, CUEVA C, et al. Behaviour of Citrus pectin during its gastrointestinal digestion and fermentation in a dynamic simulator (simgi®)[J]. Carbohydrate Polymers, 2019, 207:382-390.
[22] WANG M J, CHEN G J, CHEN D, et al. Purified fraction of polysaccharides from Fuzhuan brick tea modulates the composition and metabolism of gut microbiota in anaerobic fermentation in vitro[J]. International Journal of Biological Macromolecules, 2019, 140:858-870.
[23] 赵红艳, 张慧文, 徐琦德. 肠道菌群治疗炎症性肠病的研究进展[J]. 武警医学, 2023, 34(12): 1090-1094.
[24] LUU M, PAUTZ S, KOHL V, et al. The short-chain fatty acid pentanoate suppresses autoimmunity by modulating the metabolic-epigenetic crosstalk in lymphocytes[J]. Nature Communications, 2019, 10:760.
[25] YANG L, WANG Y, ZHANG Y, et al. Gut microbiota: A new avenue to reveal pathological mechanisms of constipation[J]. Applied Microbiology and Biotechnology, 2022, 106(21):6899-6913.
[26] LITVAK Y, BYNDLOSS M X, TSOLIS R M, et al. Dysbiotic Proteobacteria expansion: A microbial signature of epithelial dysfunction[J]. Current Opinion in Microbiology, 2017, 39:1-6.
[27] GRIGOR’EVA I N. Gallstone disease, obesity and the firmicutes/bacteroidetes ratio as a possible biomarker of gut dysbiosis[J]. Journal of Personalized Medicine, 2021, 11(1):13.
[28] WANG C, ZHAO J X, ZHANG H, et al. Roles of intestinal Bacteroides in human health and diseases[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(21):3518-3536.
[29] LI L Q, CHEN X, ZHU J, et al. Advances and challenges in interaction between heteroglycans and Bifidobacterium: Utilization strategies, intestinal health and future perspectives[J]. Trends in Food Science &Technology, 2023, 134:112-122.
[30] TEBYANIAN H, BAKHTIARI A, KARAMI A, et al. Antimicrobial activity of some Lactobacillus species against intestinal pathogenic bacteria[J]. International Letters of Natural Sciences, 2017, 65:10-15.
[31] FERREIRA-HALDER C V, DE SOUSA FARIA A V, ANDRADE S S. Action and function of Faecalibacterium prausnitzii in health and disease[J]. Best Practice &Research Clinical Gastroenterology, 2017, 31(6):643-648.
[32] 王戊腾.煮制和发酵处理对水稻酚类物质及体外消化特性的影响[D]. 天津:天津大学, 2021.WANG W T. Effects of cooking and fermentation treatments on phenolic compounds and in vitro simulated digestion of rice[D]. Tianjin: Tianjin University, 2021.
[33] 刘欣果, 綦文涛, 庞邵杰, 等. 谷物多酚与膳食纤维调控肠道菌群缓解小鼠肥胖作用研究[J]. 中国食品学报, 2024, 24(8):225-235.LIU X G, QI W T, PANG S J, et al. Effects of cereal polyphenols and dietary fibers on alleviating obesity by regulating gut microbiota in mice[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(8):225-235.