青稞酒糟(highland barley distiller’s grains,HBDG)是青稞经酿造形成青稞酒之外的主要副产物,产量较高而且易发生腐烂。如果不及时对其进行处理,会造成环境污染。因此,人们开始将酒糟用于饲料、肥料和生物质燃料等。但是酒糟的低燃烧值和高粗纤维含量等特点使酒糟的利用受到很大局限,造成了资源的极大浪费[1]。研究发现,酒糟中含有大量粗蛋白、淀粉、有机酸、小肽、可溶性糖及各种功能性物质[2]。如果能充分利用,不仅可以减少有机废物、保护环境和生物资源,还可以较低成本生产增值食品,例如生产用于食品、药品或化妆品行业等利用的生物活性物质,促进经济循环发展[3]。
近年来,酒糟多肽除了提供营养之外,还表现出多种功能特性,包括抗炎[4]、抗氧化[5]和增强免疫[6]等。且与合成抗氧化剂和免疫抑制剂相比,生物活性多肽更容易被吸收。因此,多肽作为功能食品、膳食补充剂和营养健康产品引起了广泛关注[7]。其中酒糟多肽已被证实具有抗氧化作用[8],具有抗氧化作用的物质可能会减轻酒精引起的氧化应激,且关于青稞酒糟抗氧化多肽的制备已有报道[9]。但是未见以乙醇脱氢酶(alcohol dehydrogenase,ADH)激活率为指标制备青稞酒糟多肽(HBDG peptides,HBDG-P)并探究不同分子质量多肽的ADH活性和抗氧化活性的研究。因此,本文以青稞酒糟粉为原料,在提取HBDG蛋白的基础上筛选合适的蛋白酶,优化具有激活ADH活性的HBDG-P制备工艺,探究不同区段肽分子质量组分的ADH活性和抗氧化活性,在此基础上探讨模拟胃肠消化过程对HBDG-P活性的影响。本实验旨在为进一步利用HBDG提供理论参考,使HBDG 在市场上具有更高的附加值。
1 材料与方法
1.1 材料与试剂
过80目筛青稞酒糟粉,天佑德青稞酒股份有限公司(中国青海);碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、风味蛋白酶(20 U/mg)、菠萝蛋白酶(300 U/mg)、胃蛋白酶(30 U/mg)、胰蛋白酶(250 U/mg),南京都莱生物科技有限公司;DPPH(≥97.0%),合肥博美生物科技有限责任公司。
1.2 仪器与设备
XU-10 N-60A/B真空冷冻干燥机,上海析牛莱伯仪器有限公司;J-15/15R系列高速离心机,贝克曼库尔特国际贸易(上海)有限公司;SHB-IIG型台式循环水式多用真空泵,郑州长城科工贸有限公司;DF-101S磁力搅拌器,上海鹰迪仪器设备有限公司;FlowMen-0005-PN40型高压平板膜小试设备,厦门福美科技有限公司。
1.3 实验方法
1.3.1 青稞酒糟蛋白质的提取[10-11]
1.3.1.1 醇碱法
取10 g酒糟粉,以95%(体积分数)乙醇与0.5 mol/L NaOH以体积比1∶2混合溶解酒糟粉,固液比1∶10(g∶mL),搅拌4 h(900 r/min)。离心,取上清液,使用1 mol/L盐酸调节滤液pH值至4.7,静置,4 000 r/min离心10 min得到粗蛋白沉淀,冷冻干燥24 h(-60 ℃)。
1.3.1.2 超声波辅助醇碱法
酒糟粉在加入溶剂之后,超声波进行预处理20 min(400 W),其余步骤上同。
1.3.1.3 超声波碱性蛋白酶辅助醇碱法[12]
在上述1.3.1.2节中加入碱性蛋白酶,即在超声波预处理之前,加入4 000 U/g碱性蛋白酶,酶解2 h(45 ℃),90 ℃加热10 min灭酶活,其余步骤与超声波辅助碱法相同。
1.3.2 青稞酒糟蛋白质提取率的测定
凯氏定氮法测定青稞酒糟样品中的蛋白质含量,BCA试剂盒测定青稞酒糟提取物中的蛋白质含量,计算如公式(1)所示:
蛋白提取率![]()
(1)
1.3.3 青稞酒糟蛋白多肽的制备
1.3.3.1 蛋白酶的筛选
酶解[13]:取1 g青稞酒糟蛋白,加入适量蒸馏水,用0.5 mol/L NaOH溶液调节pH,添加适量酶水解,于100 ℃(10 min)灭酶活,离心(4 000 r/min,15 min),取上清液,冻干。不同种类蛋白酶酶解条件如表1所示。
表1 不同蛋白酶最适温度、pH值及时间
Table 1 The optimum temperature, pH value, and time of different proteases

蛋白酶种类温度/℃pH值时间/h胃蛋白酶(猪胃粘膜)3724胰蛋白酶(猪胰腺)4585碱性蛋白酶45104木瓜蛋白酶456.25菠萝蛋白酶456.05风味蛋白酶457.04
1.3.3.2 单因素试验
根据杨婷婷等[11]的方法稍作修改,以ADH激活效果和多肽得率为指标进行制备青稞酒糟多肽。
固定提取温度55 ℃,时间4 h,料液比1∶30(g∶mL),加酶量(4 000 U/g),探究不同pH值(7、8、9、10、11)对HBDG多肽ADH激活效果和得率的影响。
固定提取时间4 h,料液比1∶30(g∶mL),pH 10,加酶量(4 000 U/g),探究不同温度(45、50、55、60、65 ℃)对HBDG多肽ADH激活效果和得率的影响。
固定提取温度55 ℃,时间4 h,料液比1∶30(g∶mL),pH 10,探究不同加酶量(2 000、4 000、6 000、8 000、10 000 U/g)对HBDG多肽ADH激活效果和得率的影响。
固定提取温度55 ℃,料液比1∶30 g/mL,pH 10,加酶量(4 000 U/g),探究不同提取时间(1、2、3、4、5 h)对HBDG多肽ADH激活效果和得率的影响。
固定提取温度55 ℃,时间4 h,pH值10,加酶量(4 000 U/g),探究不同提取料液比(1∶100,2∶100,3∶100,4∶100,5∶100,g∶mL)对HBDG多肽ADH激活效果和得率的影响。
1.3.3.3 响应面试验设计
在单因素试验的基础上,响应值(Y)为ADH激活率,A(自变量为pH)、B(酶解温度)和C(加酶量)3个因素,利用Design-Expret13.0软件对酶解条件进行响应面试验,得到二元多项式回归方程,进行重复试验,响应面因素水平见表2。
表2 响应面试验因素水平
Table 2 Response surface experiment factor level
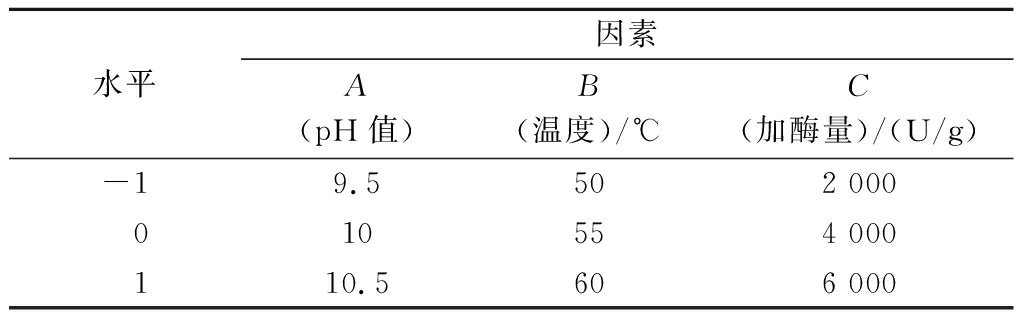
水平因素A(pH值)B(温度)/℃C(加酶量)/(U/g)-19.5502 000010554 000110.5606 000
1.3.4 青稞酒糟多肽对乙醇脱氢酶的激活效果
参考袁心田等[14]的测定方法,采用瓦勒一霍赫法经改良后测定ADH的活性。在测定ADH活性之前,将所有未经过分级分离处理的样品稀释至5 mg/mL,经过分离分级的样品稀释至1 mg/mL。在试管中加入焦磷酸钠缓冲液(1.5 mL,pH 8.8)、NAD+(1.0 mL,27 mmol/L)、乙醇溶液(0.5 mL,体积分数为11.5%)以及不同浓度的样液0.1 mL,混合均匀后在37 ℃条件下反应5 min。然后立即加入ADH溶液(0.1 mL,0.25 U/mL),用紫外-分光光度计测定其340 nm下的吸光值,每隔10 s读数一次,连续测定5 min。以0.1 mL蒸馏水代替0.1 mL样液,测定空白对照组ADH的酶活性,用蒸馏水调零。ADH活性及激活率的计算分别如公式(2)~(3)所示:
(2)
(3)
式中:ΔA为反应最初吸光值每分钟的增值;6.2为NAD+在340 nm处的摩尔消光系数;E1为样品溶液酶活性,E0为空白溶液酶活性。
1.3.5 青稞酒糟多肽得率的测定
参考王海东等[15]的方法将酶解液中上清液的多肽含量与青稞酒糟蛋白含量比值作为多肽得率。参考牟黠等[16]的双缩脲法测定多肽含量。取1 mL酶解液,加入同体积150 g/L的三氯乙酸沉淀静置10 min,4 000 r/min离心10 min;取1 mL上清液用双缩脲法测多肽含量。
1.3.6 青稞酒糟多肽的分级分离
参考ZU等[17]的方法并作修改,使用高压平板膜设备对在最佳工艺条件下获得的酒糟多肽进行超滤。使用截留分子质量为10、5和3 kDa的超滤膜对酒糟多肽进行超滤;依次获得4种馏分,即F1(分子质量>10 kDa)、F2(分子质量:5 k~10 kDa)、F3(分子质量:3 k~5 kDa)和F4(分子质量:<3 kDa),将产物真空冷冻干燥以备后用。
1.3.7 青稞酒糟多肽对DPPH自由基的清除效果
参考SONG等[18]的方法,将1 mL(0.1 mmol/L)DPPH溶液和1 mL的多肽溶液混合(吸光度记为Ai),取无水乙醇代替DPPH溶液(吸光度记为Aj),取无水乙醇代替其中的样品溶液(吸光度记为A0),上述3种混合液混匀后于室温下放置30 min,2 000 r/min离心10 min后取上清液在517 nm处测定吸光度,以抗坏血酸做阳性对照。DPPH自由基清除率(Y1,%)的计算如公式(4)所示:
(4)
1.3.8 体外消化模拟
参照李思楠等[19]的方法,配制质量浓度为1 mg/mL 的HBDG-P进行体外模拟消化。模拟胃消化:将1 mg/mL的HBDG-P与10 mL的胃液混合均匀,在37 ℃、200 r/min的条件下振荡2 h,然后用0.5 mol/L NaOH将pH值调节至7.0,以终止胃模拟消化;模拟肠消化:加入10 mL肠液,在37 ℃、200 r/min的条件下振荡2 h后于沸水浴中加热10 min灭酶活。分别在胃消化时间为0、30、60、90、120 min以及肠消化时间为30、60、90、120 min时吸取适量样品,5 000 r/min离心10 min后取上清液,测定胃肠道消化过程中HBDG-P对ADH激活率和DPPH自由基清除率的影响。
1.4 数据处理
所有试验均做3次平行,采用Origin 2019、Design-Expert 13处理和分析数据,结果以“平均值±标准差”表示。
2 结果和分析
2.1 不同提取方法对青稞酒糟蛋白提取率的影响
以牛血清蛋白为标品,得到线性方程y=0.143 3x+0.071 2,R2=0.997 8,线性关系良好,根据标曲计算酒糟蛋白含量。由图1可知,通过超声波辅助碱醇法得到的HBDG蛋白,提取率高于醇碱法和超声波碱性蛋白酶辅助碱醇法。其中超声波辅助碱醇法提取率达到28.02%,与YANG等[20]的实验结果(26.72%)相似。且相比较碱醇法,蛋白提取率显著升高,可能是由于超声波产生的机械振动加强了碱性溶液和酒糟之间的接触,使得细胞孔隙打开,从而促进了蛋白质的释放,提取率增加[21]。而加入碱性蛋白酶后,提取率显著下降,与预期不符,可能是因为强碱环境影响了蛋白酶活性,使酶活性降低,进而导致提取率降低。
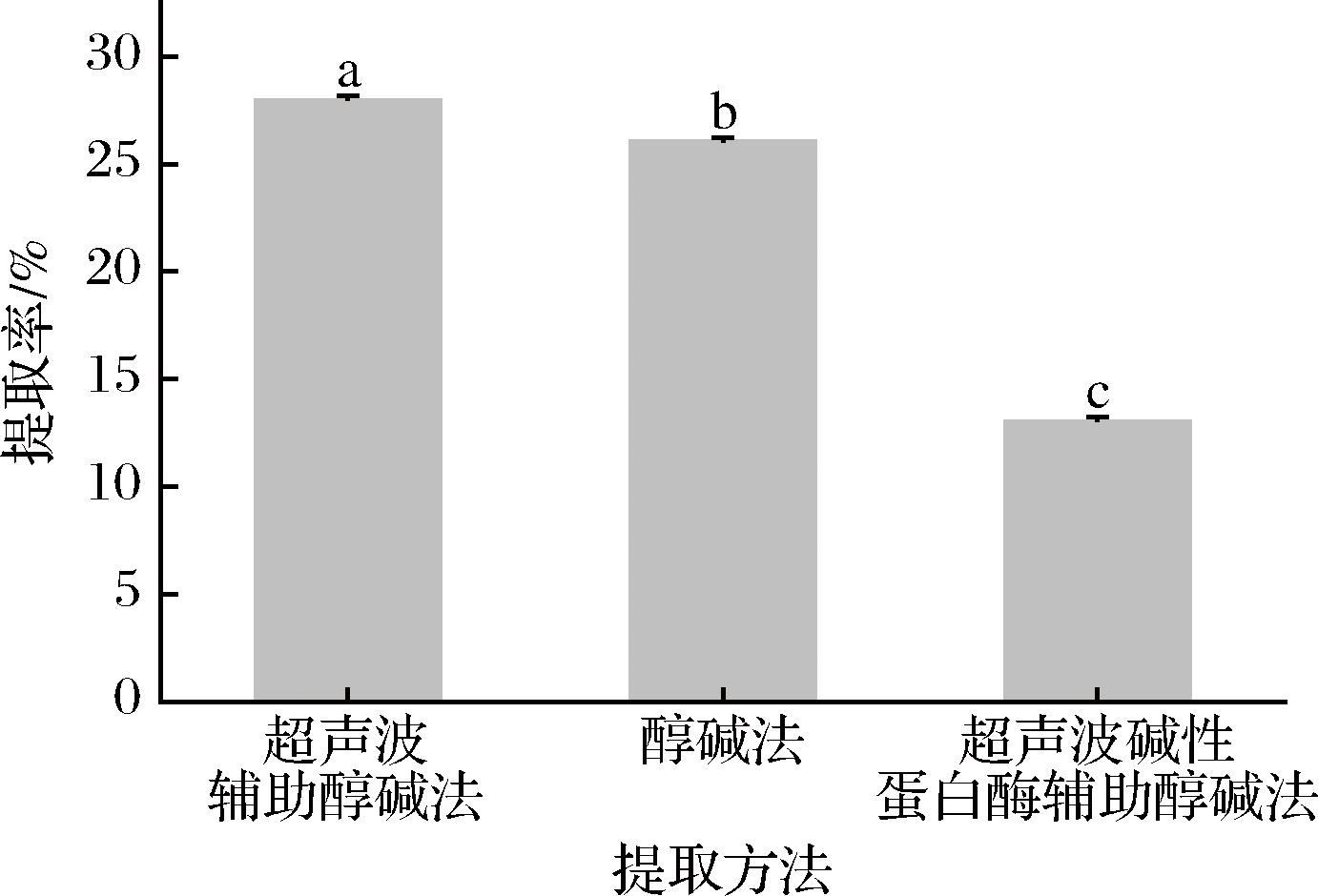
图1 不同提取方法对蛋白质提取率的影响
Fig.1 Effect on different extraction methods on protein extraction rate
注:不同小写字母表示显著性差异(P<0.05)。
2.2 不同种类蛋白酶对青稞酒糟蛋白质的酶解影响
在制备生物活性肽的方法中,酶解是最为常用的一种方法,因为它可以高效地将蛋白质分解成肽分子,并且对活性肽的破坏较小。本文选择6种不同的蛋白酶,通过比较其ADH激活率、DPPH自由基清除率以及多肽提取率评价酒糟蛋白的酶解效果。如图2所示,经胃蛋白酶水解产生的HBDG-P的DPPH自由基清除率最高[(100.53±3.31)%],其次是碱性蛋白酶[(84.92±2.27)%]和菠萝蛋白酶[(83.86±2.47)%]。ADH是影响生物体内酒精代谢的关键酶[22],因此较高的ADH激活率可以得到较好的解酒效果。在图2中,碱性蛋白酶水解物的ADH激活率最高,达到(20.69±0.24)%,且多肽提取率最高(29.9±0.32)%。综上所述,碱性蛋白酶对HBDG蛋白的酶解效果最佳。
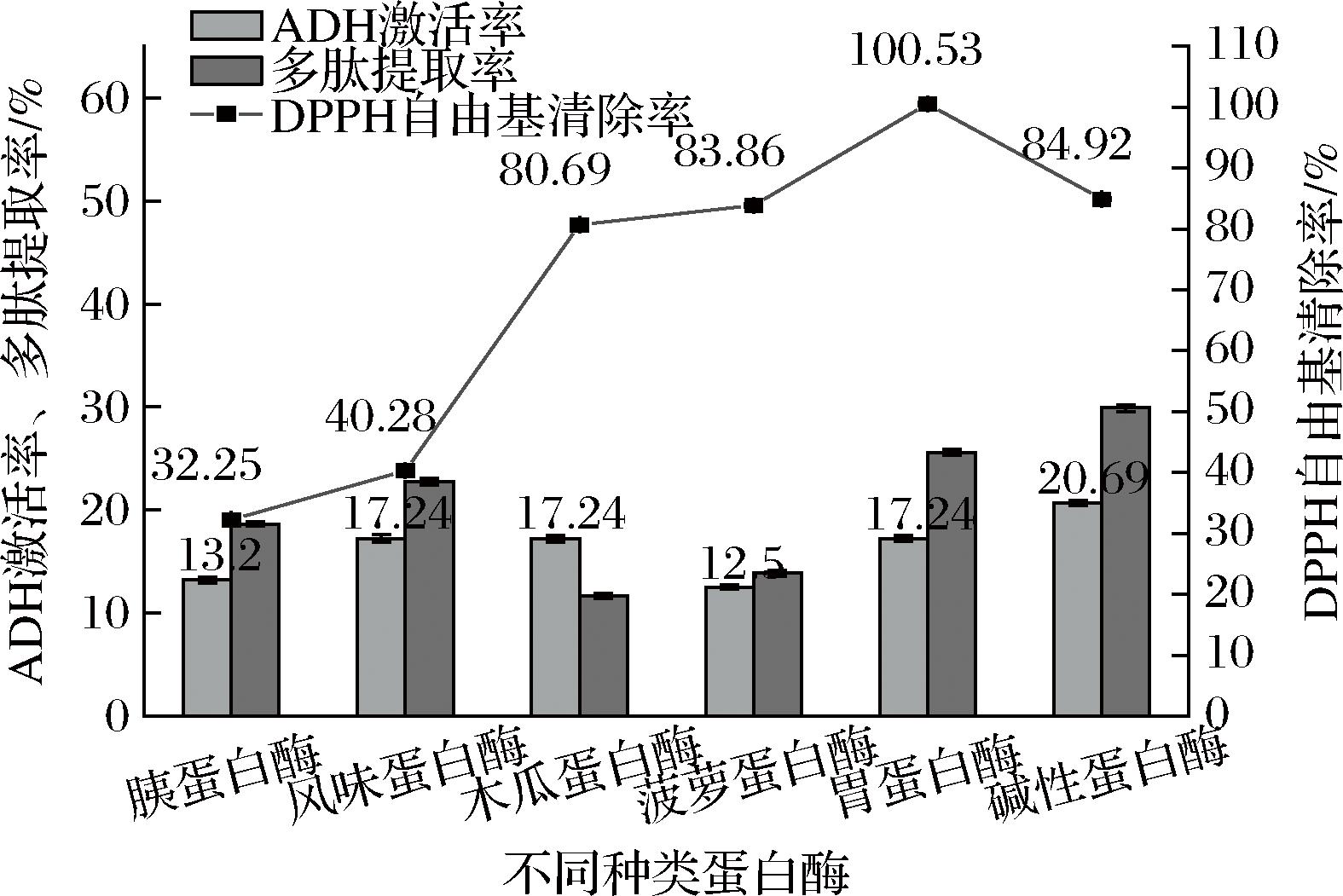
图2 不同种类酶对青稞酒糟蛋白的酶解效果
Fig.2 The enzymatic hydrolysis effect of different kinds of enzymes
2.3 单因素试验
2.3.1 酶解pH对ADH激活率和多肽得率的影响
不同pH对青稞酒糟多肽得率及其ADH激活率的影响结果如图3所示。在pH 9~10时ADH激活率和多肽得率随着pH的增大而升高,是由于pH的增加,蛋白质的负电荷增加,使其发生蛋白质-水相互作用,蛋白质溶解度增加,与BACA-BOCANEGRA等[23]的研究一致。当pH值为10时,表现出最大的ADH激活率(31.5%)和多肽得率(30.07%),主要原因可能是pH影响了酶的活性和底物的构象[24],导致青稞酒糟多肽呈现不同的ADH激活率和得率。随着pH的继续增大,过高的pH值可以改变多肽的电荷状态,导致多肽结构发生变化,如展开或聚集,这可能会破坏其自然结构,导致其生物活性降低,使ADH激活率降低。
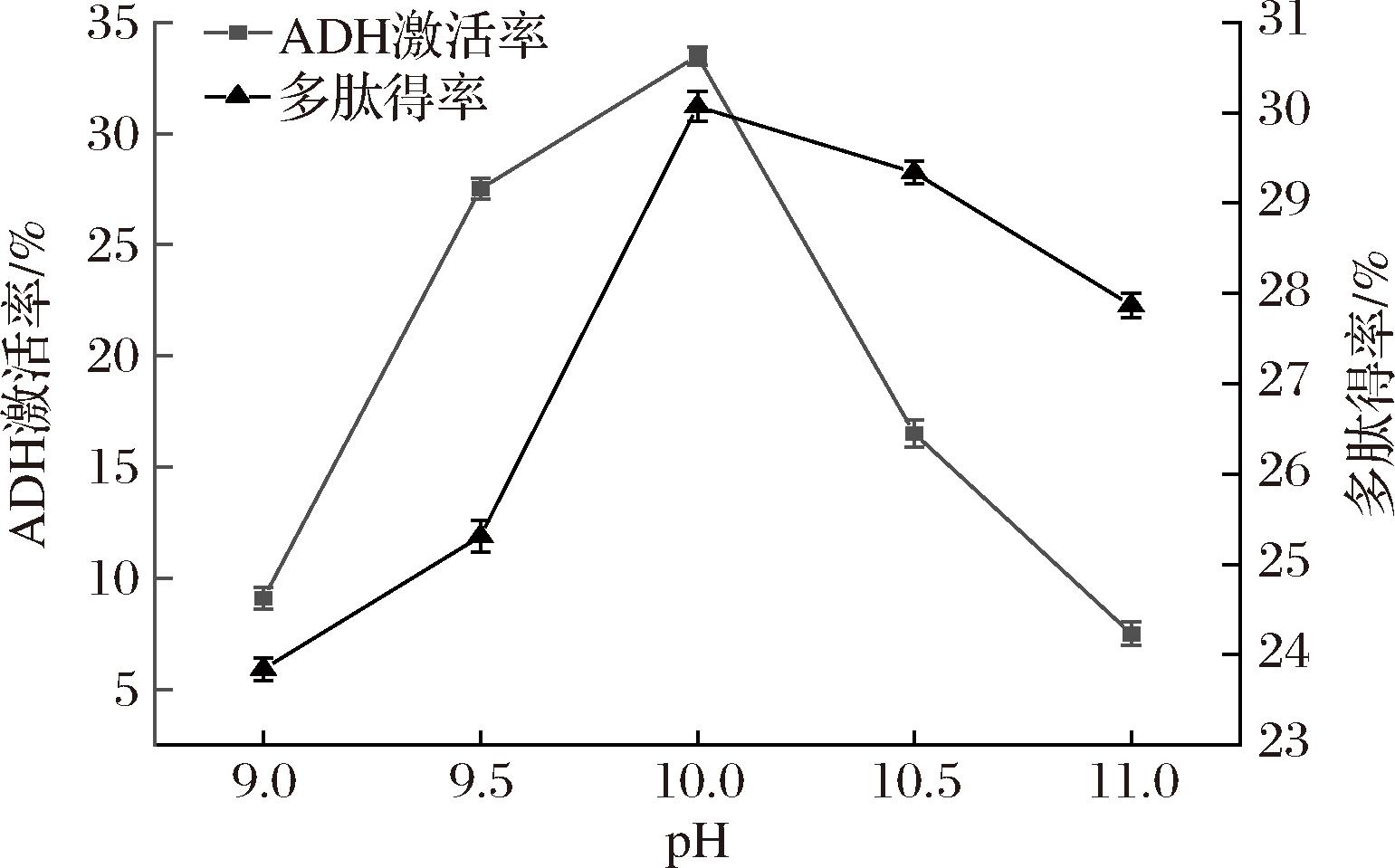
图3 pH对ADH激活率和多肽得率的影响
Fig.3 Effect of pH on ADH activation rate and peptides yield
2.3.2 温度对ADH激活率和多肽得率的影响
由图4可知,当提取温度从45 ℃升至65 ℃,青稞酒糟多肽ADH激活率和多肽得率均呈现先上升后下降的趋势。而且在温度为55 ℃时达到最大,分别是31.67%和28.97%。前期随着温度的升高,在一定的范围内能够加快酶解反应速度,提高底物与酶的结合概率,进而影响HBDG-P的ADH激活率和多肽得率,而温度过高可能破坏亚基之间的氢键、疏水作用等非共价键,使亚基之间的连接变弱甚至解离,导致蛋白质四级结构解体,蛋白质变性失活[25],使得HBDG-P的活性和得率下降。
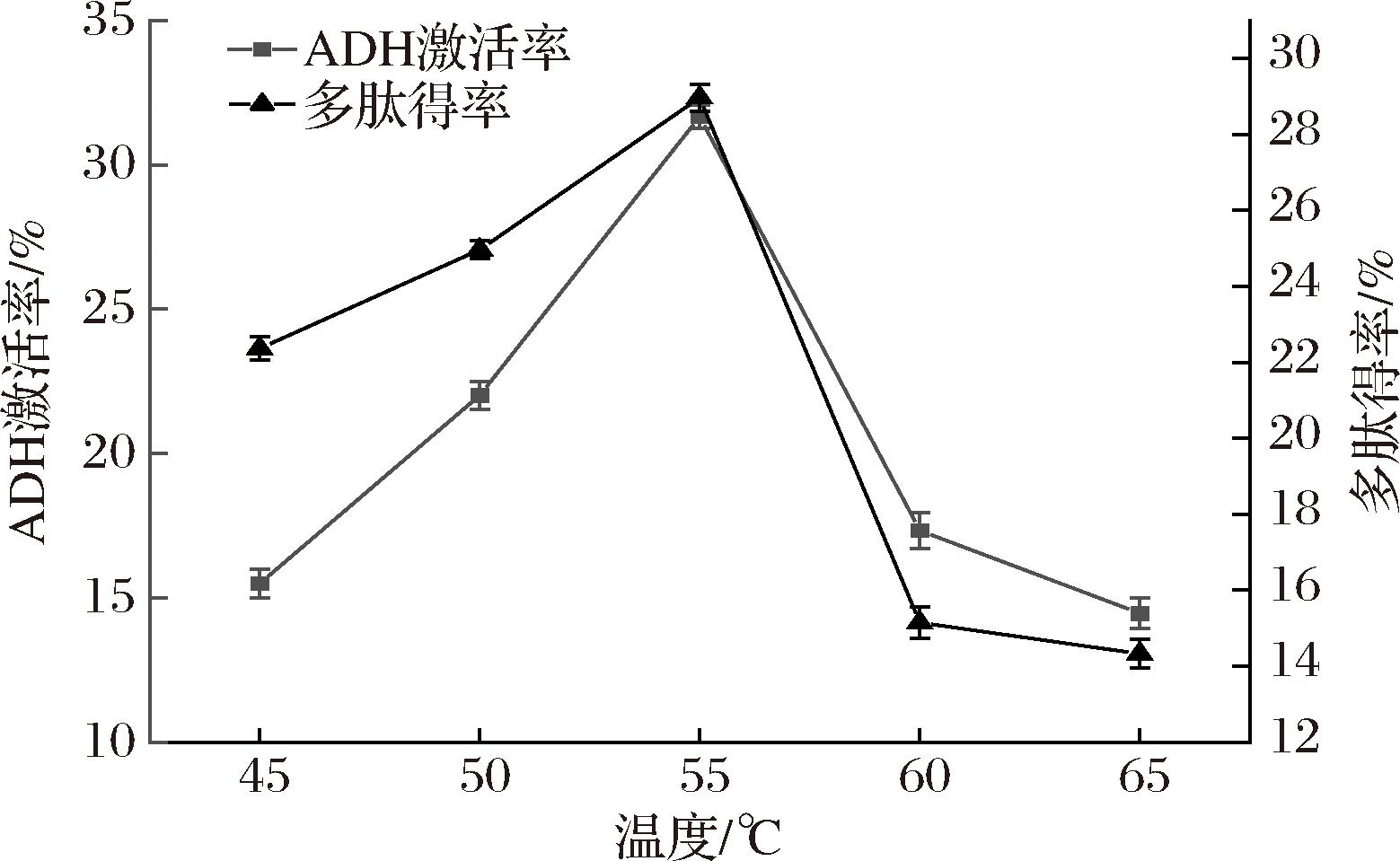
图4 温度对ADH激活率和多肽得率的影响
Fig.4 Effect of temperature on ADH activation rate and peptides yield
2.3.3 加酶量对ADH激活率和多肽得率的影响
随着加酶量的增大,HBDG-P的ADH激活率和多肽得率增加,结果如图5所示。当碱性蛋白酶添加量过少时,HBDG蛋白不能被彻底水解,当酶添加量从2 000 U/g提升至4 000 U/g,ADH激活率和多肽得率分别达到最大值21.21%和25.67%。继续增加酶用量,ADH活性和多肽得率都有下降的趋势。推测可能与酶浓度和底物之间的饱和度有关,随着酶添加量的增加,更多的肽段发生水解,然而更多肽键的断裂会导致蛋白质分子不稳定[26]。
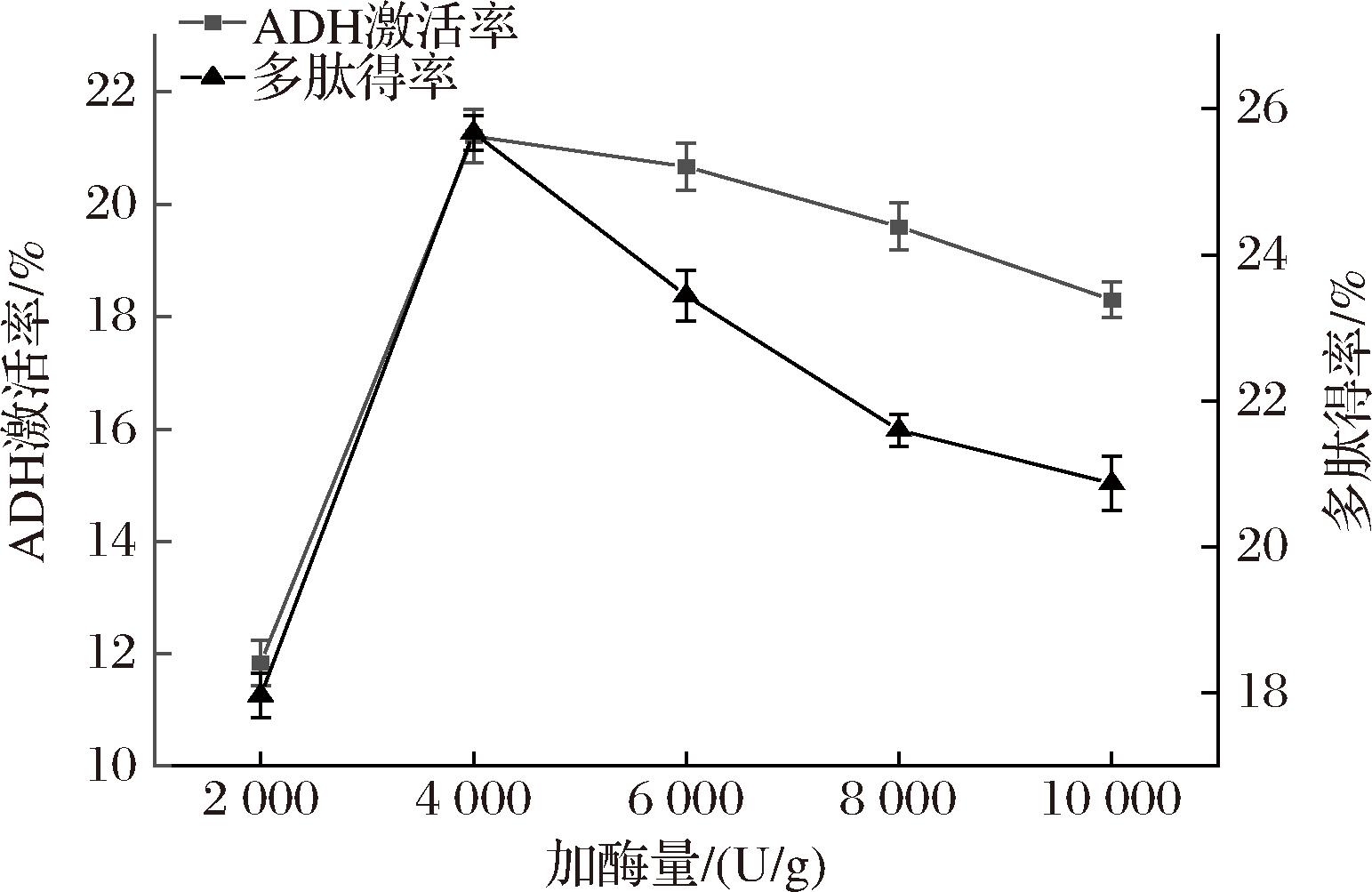
图5 加酶量对ADH激活率和多肽得率的影响
Fig.5 Effect of added enzyme amount on ADH activation rate and peptides yield
3.3.4 料液比对ADH激活率和多肽得率的影响
如图6所示,随着料液比的增加,ADH激活率和多肽得率先增加后降低,在料液比为2∶100(g∶mL)时ADH激活率达到20.61%,而多肽得率在料液比为3∶100(g∶mL)时达到最大16.81%,这与YE等[27]的结果一致。料液比增加,溶剂增多,青稞酒糟与溶剂的接触面积增大,酶与底物作用位点增多,使得多肽得率增大[28]。
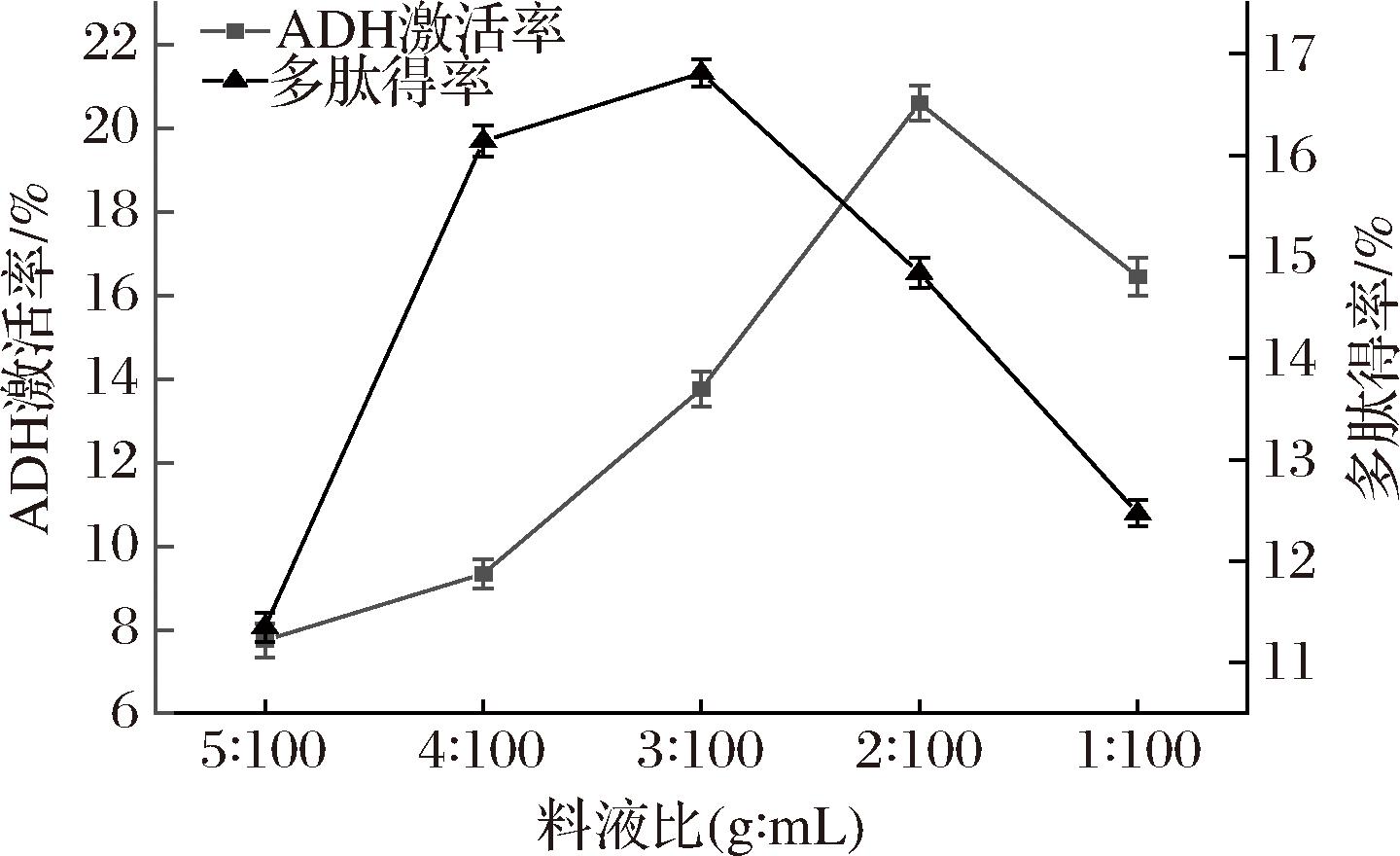
图6 料液比对ADH激活率和多肽得率的影响
Fig.6 Effect of material-liquid ratio on ADH activation rate and peptides yield
2.3.5 提取时间对ADH激活率和多肽得率的影响
青稞酒糟多肽ADH激活率和多肽得率随着提取时间的延长而迅速增加(图7)。在1~5 h内,ADH激活率最大值在3 h时达到29.17%,多肽得率最大值为4 h时的15.76%。随着提取时间的延长,ADH激活率和多肽得率都出现下降。这可能是由于长时间的水解导致多肽发生了降解或活性降低等变化。而多肽ADH激活率和多肽得率分别在不同提取时间取得最大值,说明长时间的水解不一定利于目标肽的生成,与REN等[29]的研究结果相符合。
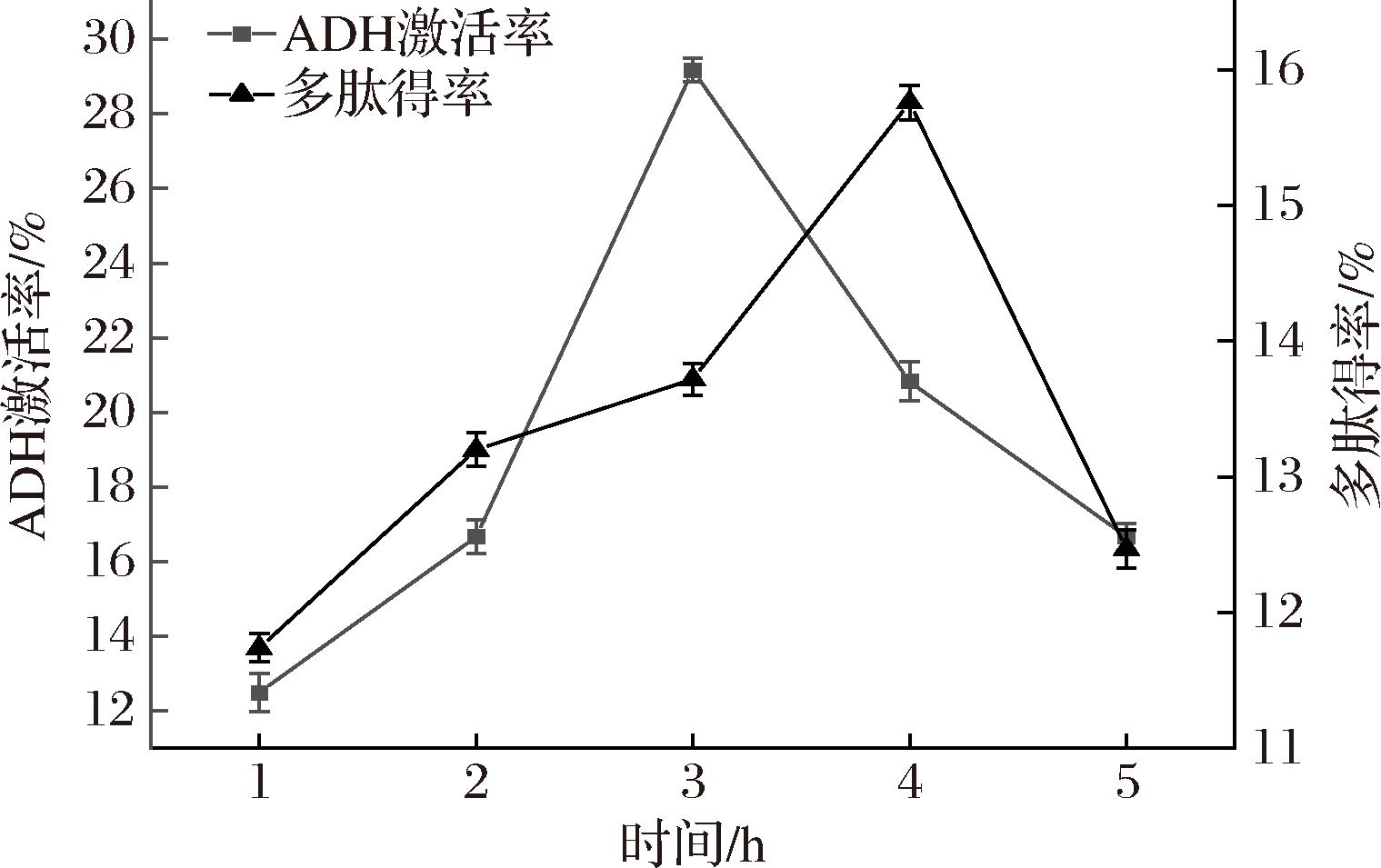
图7 时间对ADH激活率和多肽得率的影响
Fig.7 Effect of time on ADH activation rate an peptides yield
综合以上单因素结果分析,选取pH值:9.5、10、10.5,提取温度:50、55、60 ℃,碱性蛋白酶添加量:2 000、4 000、6 000 U/g进行响应面分析。
2.4 响应面试验设计结果与分析
响应面分析试验结果见表3,通过用Design-Expert13.0软件进行回归拟合,求出回归方程Y=40.82-0.44A+1.25B+0.69C+0.32AB-0.81AC+0.73BC-3.39A2-4.90B2-3.14C2。由表4可知,该模型F=91.81,P<0.000 1,该模型极显著,即对酒糟多肽的ADH激活率的影响较为显著。P失拟为0.765 9>0.05,失拟项不显著,该模型和实际试验拟合性较好。R2=0.991 6,说明模型具有高的显著性。
表3 响应面方案设计试验结果
Table 3 Test results of the response surface protocol design
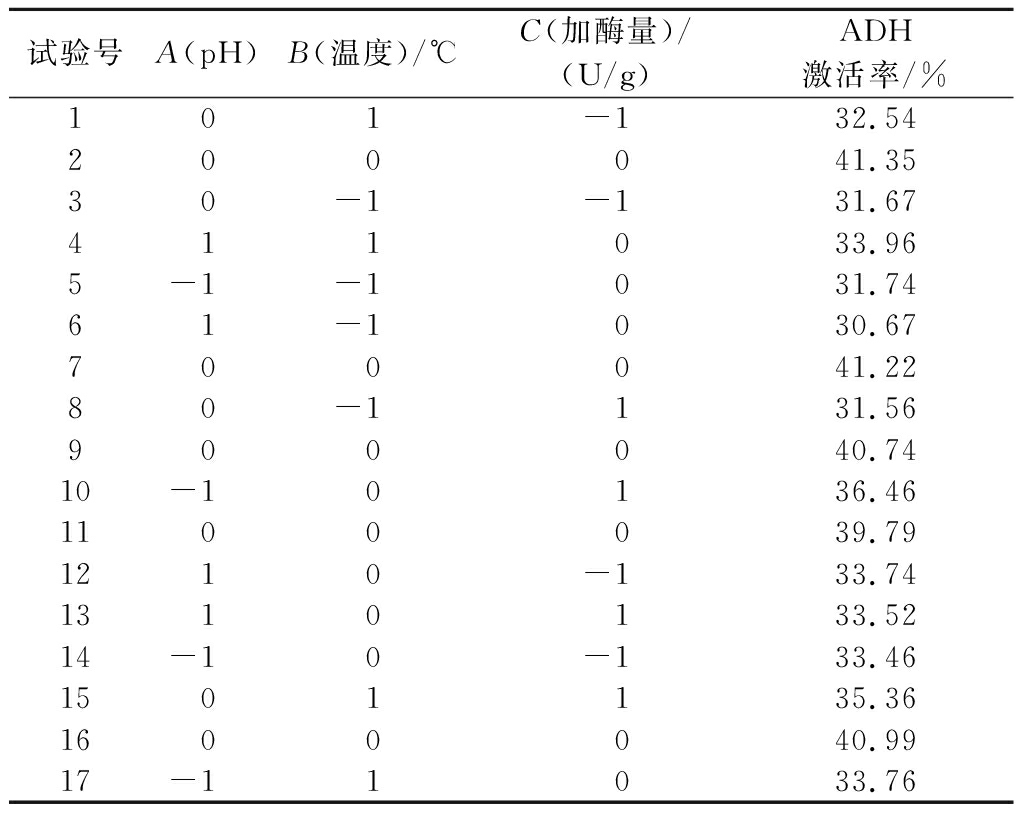
试验号A(pH)B(温度)/℃C(加酶量)/(U/g)ADH激活率/%101-132.54200041.3530-1-131.67411033.965-1-1031.7461-1030.67700041.2280-1131.56900040.7410-10136.461100039.791210-133.741310133.5214-10-133.461501135.361600040.9917-11033.76
表4 回归模型的方差分析
Table 4 Analysis of variance of the regression models
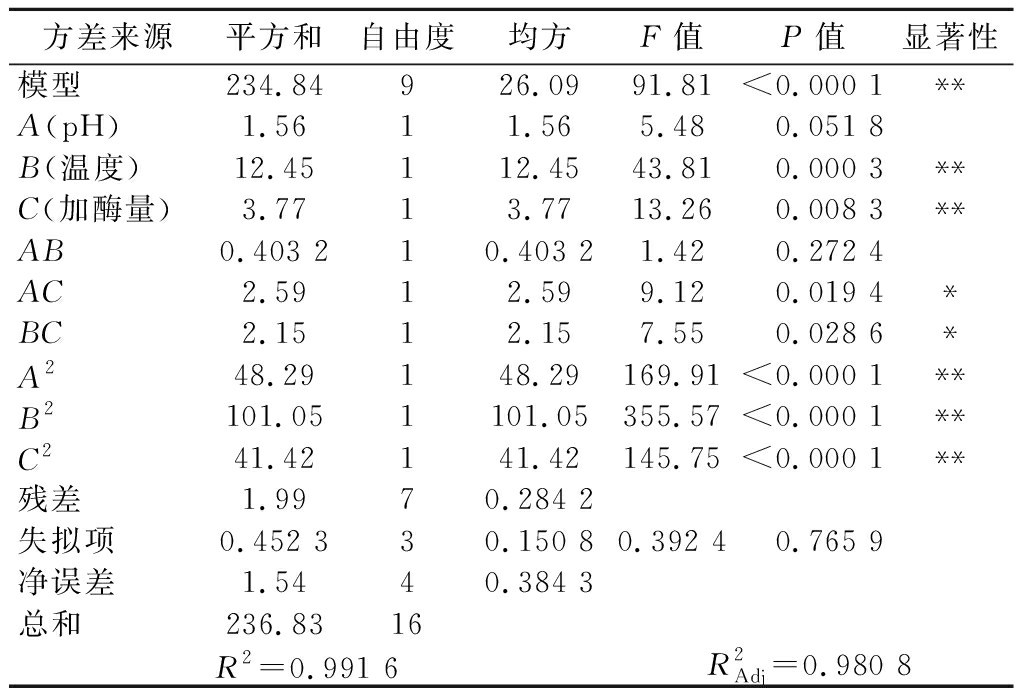
方差来源平方和自由度均方F值P值显著性模型234.84926.0991.81<0.000 1**A(pH)1.5611.565.480.051 8B(温度)12.45112.4543.810.000 3**C(加酶量)3.7713.7713.260.008 3**AB0.403 210.403 21.420.272 4AC2.5912.599.120.019 4*BC2.1512.157.550.028 6*A248.29148.29169.91<0.000 1**B2101.051101.05355.57<0.000 1**C241.42141.42145.75<0.000 1**残差1.9970.284 2失拟项0.452 330.150 80.392 40.765 9净误差1.5440.384 3总和236.8316R2=0.991 6R2Adj=0.980 8
注:**差异极显著(P<0.01);*差异显著(0.01<P<0.05)。
该回归模型中B(温度)和C(加酶量)有极显著影响(P<0.01);但是A(pH)影响相对较小(P>0.05);交互项AC(pH和加酶量)和BC(温度和加酶量)有显著影响(P<0.05),AB(pH和温度)无显著影响(P>0.05);二次项A2、B2、C2具极显著性影响(P<0.000 1);总体模型P<0.000 1,说明回归模型达到了显著水平。结果表明,各因素水平下,对ADH激活率的影响顺序依次为:B(温度)>C(加酶量)>A(pH)。
根据响应面试验设计原理,等高线可以直接反映2个变量之间的相互作用,圆代表2个因子之间的相互作用不明显,而椭圆则代表着相互影响显著。pH、温度、加酶量3个因素对响应值的三维曲面图如图8所示,响应曲面坡度反映了影响ADH激活率的各因子间的相互作用,并与ADH激活率有一定的相关性。因素A(pH)和B(温度)、A(pH)和C(加酶量)、B(温度)和C(加酶量)的交互作用等高线均呈现椭圆形,表明各因素之间交互作用对ADH激活率均显著。

a-温度与pH交互作用对ADH激活率的影响的响应面图;b-温度与pH交互作用对ADH激活率的影响的等高线图;c-加酶量与pH交互作用对ADH激活率的影响的响应面图;d-加酶量与pH交互作用对ADH激活率的影响的等高线图;e-加酶量与温度交互作用对ADH激活率的影响的响应面图;f-加酶量与温度交互作用对ADH激活率的影响的等高线图
图8 各因素交互作用对ADH激活率影响的响应面图及等高线图
Fig.8 Response surface plots and contour plots of the effect of interaction of factors on the activation rate of ethanol dehydrogenase
2.5 响应面验证试验
试验结果经Design-Expert 13.0软件优化预测,得到最优的工艺参数为:pH 9.963,温度55.677 ℃,酶添加量4 268 U/g,ADH激活率预测值为40.965%。结合试验方案,将最佳工艺参数调整为:pH 10,温度55 ℃,酶添加量4 300 U/g,在此工艺参数下,ADH激活率为(39.91±2.63)%,试验结果与理论预测结果接近。因此,试验优化工艺的参数可靠性较高。
2.6 不同区段肽分子质量组分对ADH激活率和DPPH自由基清除率的影响
使用3、5、10 kDa截留分子质量的膜,将HBDG-P分成4个不同分子质量的组分。收集4种组分,与未经分离的HBDG-P进行对比,评估4种组分激活ADH以及DPPH自由基清除能力。如图9所示,低分子质量肽(<3 kDa)的ADH激活率和DPPH自由基清除率相比未分离肽显著升高(181.92%,8.88%),表明较小分子质量肽活性较佳,与GAO等[30]的研究结果一致。原因是低分子质量肽可能具有更高的疏水性,这些疏水性氨基酸增强了其自由基清除能力和ADH激活能力[31]。
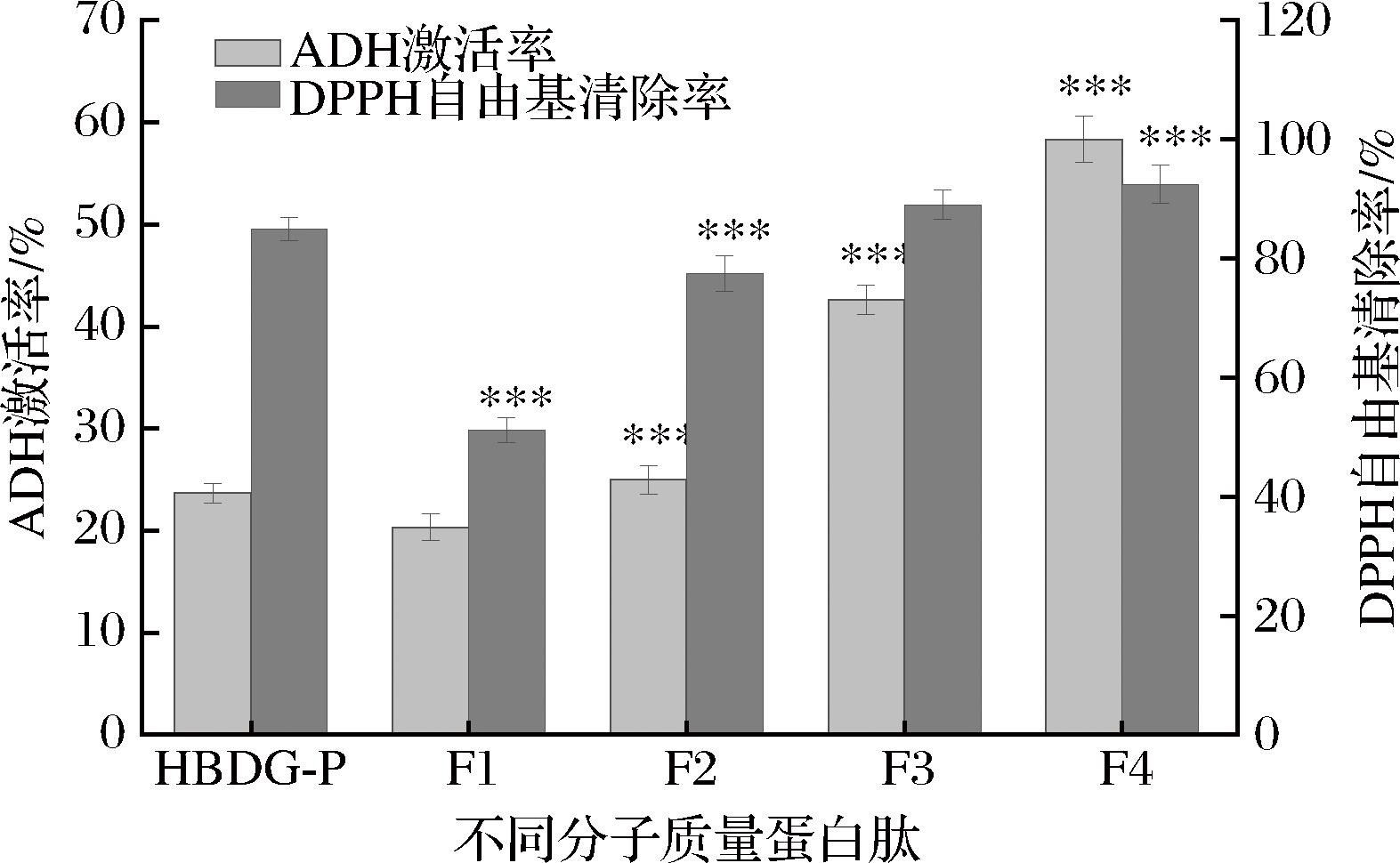
图9 不同肽的ADH激活率和DPPH自由基清除率
Fig.9 ADH activation rates and DPPH radical scavenging activity of different peptides
注:***表示与未分离的HBDG-P相比差异显著(P<0.05)。
2.7 体外模拟胃肠消化
据报道,天然产物的活性成分具有激活ADH的特性,其中生物活性肽因其低毒性和高生物相容性而被广泛研究[32]。含有抗氧化作用的蛋白水解物可以通过自由基清除能力、还原能力、抑制脂质过氧化等达到保护人体健康的目的[33]。在本项研究中,分析评估了HBDG-P经过胃肠消化后的ADH激活率以及抗氧化活性变化规律。结果如图10所示,相比较0 min 时的HBDG-P,经过胃肠消化后,ADH激活率消化时间的延长而升高,在240 min达到最大值[(37.93±2.31)%]。推测可能是由于体外胃肠消化后,HBDG-P经胃肠蛋白酶水解成小分子肽,使更多的疏水性氨基酸侧链显露出来,消化产物与酶的接触面积增加,提高酶活性[19]。而DPPH自由基清除率在90 min时最大,为(89.53±5.43)%,在90~240 min自由基清除率略有降低并趋于稳定,与张梦莹等[34]研究结果一致。原因可能是模拟胃肠消化初期,模拟胃液中的消化酶和胃酸使多肽生成新的抗氧化成分参与DPPH自由基清除反应,但是长时间的水解使形成的抗氧化肽分解成抗氧化活性低或者没有抗氧化活性的小肽或氨基酸。
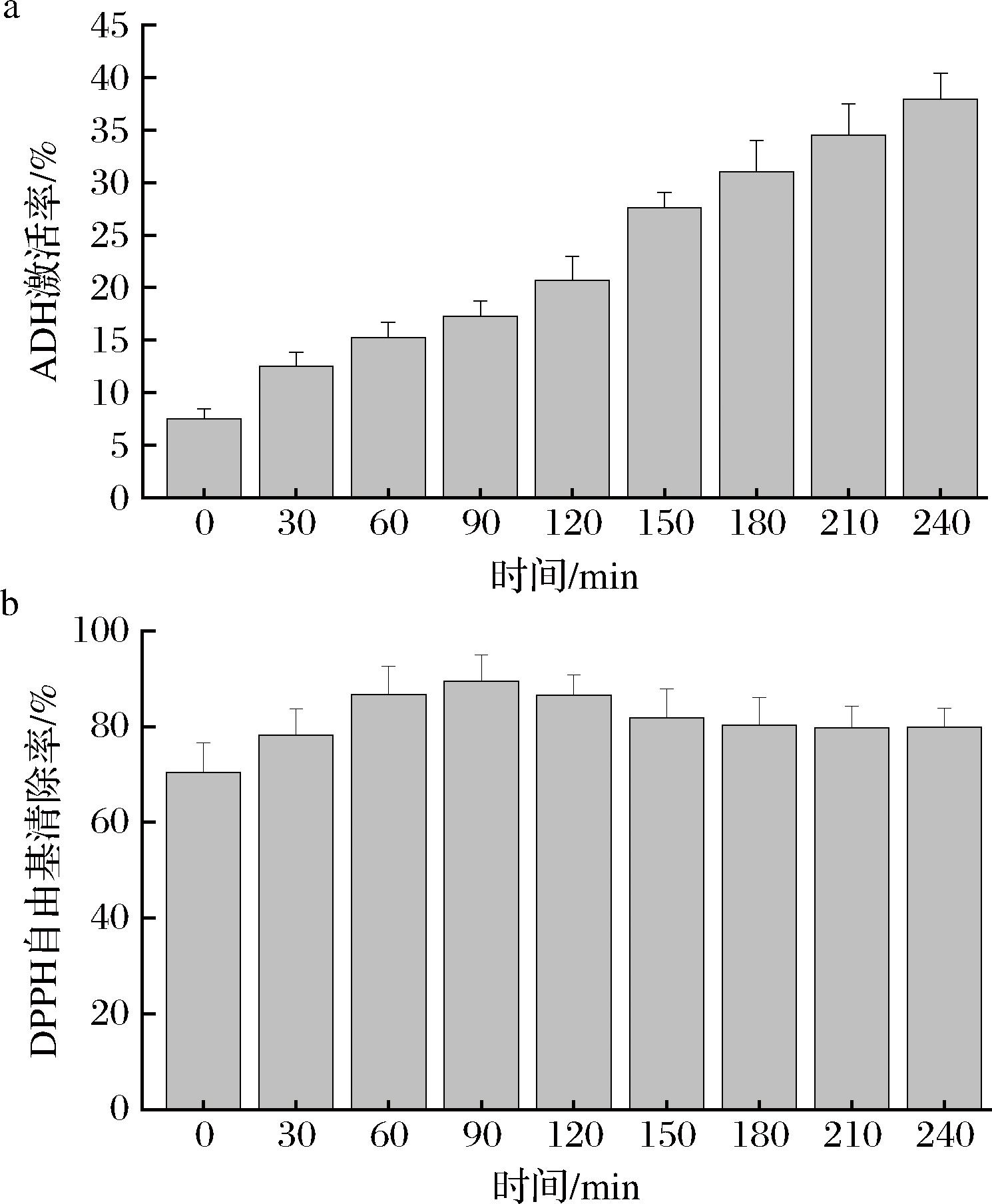
a-ADH激活率;b-DPPH自由基清除率
图10 体外模拟胃肠消化过程中HBDG-P的活性变化
Fig.10 Changes of activity of HBDG-P during gastrointestinal digestion were simulated in vitro
3 结论
相比较碱醇法、超声波碱性蛋白酶辅助碱醇法,超声波辅助碱醇法的提取率最高。进一步研究表明,经过碱性蛋白酶酶解后酶解效果最佳。基于单因素试验结果,以ADH激活率为指标,对HBDG-P的提取工艺进行响应面试验,经试验确定HBDG-P提取的最优参数为:pH 10.0、温度55 ℃、酶添加量4 300 U/g。在此条件下ADH激活率为(39.91±2.63)%。通过超滤膜对样品进行分离得到F1、F2、F3、F4四个组分,其中F4(<3 kDa)组分在ADH激活活性和DPPH自由基清除能力方面显著高于其他组分。此外,小分子肽经过体外模拟胃肠消化后,其ADH活性和DPPH自由基清除能力均优于未经胃肠消化的多肽。综合上述试验数据分析,HBDG具有成为低成本解酒材料的潜力。因此,后续将进行细胞或动物试验验证小分子HBDG-P的解酒活性和作用机制。
[1] YANG J, ZHANG Z Z, DING X Y, et al.Multiple responses optimization of antioxidative components extracted from distiller’s grains using response surface methodology and identify their chemical compositions[J].Journal of Food Processing and Preservation, 2021, 45(11):e15885.
[2] 张飞, 程润喜, 李钢平, 等.白酒糟类原料营养解析及质量影响因素[J].中国饲料, 2024(21):162-167;174.ZHANG F, CHENG R X, LI G P, et al.Nutritional analysis and quality influencing factors of Baijiu distiller’s grains[J].China Feed, 2024(21):162-167;174.
[3] AMORIELLO T, CICCORITTI R.Sustainability:Recovery and reuse of brewing-derived by-products[J].Sustainability, 2021, 13(4):2355.
[4] WEN C T, ZHANG J X, DUAN Y Q, et al.A mini-review on brewer’s spent grain protein:isolation, physicochemical properties, application of protein, and functional properties of hydrolysates[J].Journal of Food Science, 2019, 84(12):3330-3340.
[5] 侯蕊, 梁璋成, 林晓婕, 等.红曲糟源酶解蛋白肽的功能性评价[J].福建农业学报, 2024, 39(3):354-361.HOU R, LIANG Z C, LIN X J, et al.Functional evaluation of enzymatic hydrolyzed peptides from Hongqu glutinous rice wine grains protein[J].Fujian Journal of Agricultural Sciences, 2024, 39(3):354-361.
[6] NAZEER S, FORNARI D C, GALKANDA-ARACHCHIGE H S C, et al.Use of high protein distiller’s dried grain with yeast in practical diets for the channel catfish, Ictalurus punctatus[J].Aquaculture, 2022, 546:737387.
[7] WANG W, XU C, WANG Q Y, et al.Protective effect of polyphenols, protein, peptides, and polysaccharides on alcoholic liver disease:A review of research status and molecular mechanisms[J].Journal of Agricultural and Food Chemistry, 2023, 71(15):5861-5883.
[8] BAZSEFIDPAR N, AHMADI GAVLIGHI H, GHANDEHARI YAZDI A P, et al. Optimization of protein extraction from brewer’s spent grain and production of bioactive peptides[J].Biomass Conversion and Biorefinery, 2024, 14(15):17455-17465.
[9] 陈丽花, 陈少华, 荣玉芝, 等.具有抗氧化活性青稞酒糟蛋白酶解液对H2O2诱导HepG2细胞的保护作用[J].现代食品科技, 2024, 40(3):28-38.CHEN L H, CHEN S H, RONG Y Z, et al.H2O2-induced protective effects of the antioxidant protease hydrolysate of highland barley brewer’s spent grains on HEPG2 cells[J].Modern Food Science and Technology, 2024, 40(3):28-38.
[10] 陈少华. 青稞酒糟蛋白生物活性肽的制备及其功能性质研究[D].上海:上海应用技术大学, 2023.CHEN S H.Preparation and functional properties of bioactive peptides from highland barley distiller’s grains protein[D].Shanghai:Shanghai Institute of Technology, 2023.
[11] 杨婷婷, 孙万成, 罗毅皓, 等.青稞酒糟多肽的制备及其活性研究[J].食品与发酵工业, 2022, 48(20):217-224.YANG T T, SUN W C, LUO Y H, et al.Preparation and activity of highland barley fermentation spent polypeptides[J].Food and Fermentation Industries, 2022,48 (20):217-224.
[12] NAIK A S, BRUGIERE M, DUNNE K, et al.Protease hydrolysed brewers’ spent grain bioactive extracts for applications in human health[J].Systems Microbiology and Biomanufacturing, 2024, 4(3):1062-1075.
[13] KIM J M, YOON K Y.Functional properties and biological activities of perilla seed meal protein hydrolysates obtained by using different proteolytic enzymes[J].Food Science and Biotechnology, 2020, 29(11):1553-1562.
[14] 袁心田, 陈华国, 赵超, 等.基于膜技术的桑葚多糖分级分离及生物活性组分筛选[J].食品工业科技, 2022, 43(24):72-80.YUAN X T, CHEN H G, ZHAO C, et al.Separation of mori fructus polysaccharides and screening of bioactive fractions based on membrane technology[J].Science and Technology of Food Industry, 2022, 43(24):72-80.
[15] 王海东, 张涵, 周泓妍, 等.响应面法优化五味子蛋白肽的制备工艺及其体外抗氧化活性[J].食品工业科技, 2024, 45(19):166-167.WANG H D, ZHANG H, ZHOU H Y, et al.Optimization of preparation technology and antioxidant activity of Schisandrae chinensis protein peptides in vitro by response surface methodology[J].Science and Technology of Food Industry, 2024, 45(19):166-176.
[16] 牟黠, 冯庆祥, 胡杨, 等.鱼糜漂洗水回收蛋白肽的酶法制备工艺优化及体外抗氧化与降血糖活性评价[J/OL].现代食品科技, 2024.DOI:10.13982/j.mfst.1673-9078.2025.8.0659.MOU X, FENG Q X, ZHOU H Y, et al.Preparation of peptides recovered from surimi rinsing wastewater and evaluation of in vitro antioxidant and hypoglycemic activity of peptides[J/OL].Modern Food Science and Technology, 2024.DOI:10.13982/j.mfst.1673-9078.2025.8.0659.
[17] ZU X Y, LIU W B, XIONG G Q, et al.Isolation, identification, and biological activity analysis of swim bladder polypeptides from Acipenser schrencki[J].Foods, 2023, 12(10):1934.
[18] SONG X L, XU X M, CHEN W.Antioxidant and immunostimulatory activities of fermented sour soybean milk added with polypeptides from Pleurotus eryngii[J].Frontiers in Microbiology, 2022, 13:750039.
[19] 李思楠, 王萌, 余钧, 等.基于体外模拟消化探究白芸豆多肽降糖活性[J].食品与发酵工业, 2025,51(3):292-297.LI S N, WANG M, YU J, et al.The investigation of hypoglycemic activity of white kidney bean polypeptides based on simulated digestion in vitro system[J].Food and Fermentation Industries, 2025,51(3):292-297.
[20] YANG C, LIU W Y, ZHU X J, et al.Ultrasound-assisted enzymatic digestion for efficient extraction of proteins from quinoa[J].LWT, 2024, 194:115784.
[21] SERT D, ROHM H, STRUCK S.Ultrasound-assisted extraction of protein from pumpkin seed press cake:Impact on protein yield and techno-functionality[J].Foods, 2022, 11(24):4029.
[22] XIAO C Q, TOLDR F, ZHOU F B, et al.Chicken-derived tripeptide KPC (Lys-Pro-Cys) stabilizes alcohol dehydrogenase (ADH) through peptide-enzyme interaction[J].LWT, 2022, 161:113376.
F, ZHOU F B, et al.Chicken-derived tripeptide KPC (Lys-Pro-Cys) stabilizes alcohol dehydrogenase (ADH) through peptide-enzyme interaction[J].LWT, 2022, 161:113376.
[23] BACA-BOCANEGRA B, NOGALES-BUENO J, HERN NDEZ-HIERRO J M, et al.Optimization of protein extraction of oenological interest from grape seed meal using design of experiments and response surface methodology[J].Foods, 2021, 10(1):79.
NDEZ-HIERRO J M, et al.Optimization of protein extraction of oenological interest from grape seed meal using design of experiments and response surface methodology[J].Foods, 2021, 10(1):79.
[24] LE Y, LOU X W, YU C W, et al.Integrated metabolomics analysis of Lactobacillus in fermented milk with fish gelatin hydrolysate in different degrees of hydrolysis[J].Food Chemistry, 2023, 408:135232.
[25] KAUR R, GHOSHAL G, CHAUHAN S.Optimizing conditions for protein isolation from de-oiled sunflower meal using response surface methodology (RSM)[J].Journal of Food Measurement and Characterization, 2024, 18(5):3708-3719.
[26] MAHDAVI-YEKTA M, NOURI L, AZIZI M H.The effects of hydrolysis condition on antioxidant activity of protein hydrolyzate from quinoa[J].Food Science &Nutrition, 2019, 7(3):930-936.
[27] YE S Q, HUANG J M, WU W L, et al.Optimized extraction technology of glutathione from ‘Haidao 86’ germ rice by response surface methodology[J].Food Science &Nutrition, 2023, 11(11):7255-7263.
[28] 牛金鸽, 吴海玥, 马世科, 等.响应面优化藏羊皮胶原蛋白肽超声辅助提取工艺及其体内抗氧化活性分析[J].食品工业科技, 2023, 44(11):163-170.NIU J G, WU H Y, MA S K, et al.Optimization of ultrasonic assisted extraction of tibetan sheep skin collagen peptide by response surface methodology and its antioxidant activity in vivo[J].Science and Technology of Food Industry, 2023, 44(11):163-170.
[29] REN Y, LIANG K, JIN Y Q, et al.Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J].Journal of Functional Foods, 2016, 26:439-450.
[30] GAO S, SHI J, WANG K, et al.Protective effects of oyster protein hydrolysates on alcohol-induced liver disease (ALD) in mice:Based on the mechanism of anti-oxidative metabolism[J].Food &Function, 2022, 13(16):8411-8424.
[31] ZHAO R J, HUO C Y, QIAN Y, et al.Ultra-high-pressure processing improves proteolysis and release of bioactive peptides with activation activities on alcohol metabolic enzymes in vitro from mushroom foot protein[J].Food Chemistry, 2017, 231:25-32.
[32] WANG Z X, XING L J, CAI J M, et al.Identification of hepatoprotective peptides from porcine liver and its interaction with ethanol metabolizing enzymes in vitro[J].Food Bioscience, 2023, 55:103036.
[33] ASPRI M, LENI G, GALAVERNA G, et al.Bioactive properties of fermented donkey milk, before and after in vitro simulated gastrointestinal digestion[J].Food Chemistry, 2018, 268:476-484.
[34] 张梦莹, 毕凯悦, 吴予涵, 等.基于体外消化酵解模型探究芜菁多糖的抗氧化活性及对肠道菌群的影响[J].食品工业科技, 2025,46(13):106-116.ZHANG M Y, BI K Y, WU Y H, et al.Exploring the antioxidant activity and impact on gut microbiota of brassica rapa polysaccharides based on an in vitro digestion and fermentation model[J].Science and Technology of Food Industry, 2025,46(13):106-116.