高粱(Sorghum bicolor L.Moench)是一种气候智能型作物,具有独特的抵御非生物胁迫的能力[1],广泛种植于半干旱和干旱地区,作为世界第五大谷物,是南亚和非洲许多国家的主食[2-3]。高粱籽粒富含多种生物活性化合物、矿物质、膳食纤维、维生素E和类胡萝卜素[4]。食用高粱全谷物可以改善肠道健康,预防慢性疾病、缓解高血糖症[5-6],高粱的营养特性及抗逆性使其在粮食安全方面具有重要意义。近年来,高粱及其产品因潜在的健康益处而受到广泛关注。目前,高粱已被用于开发功能性食品和饮料,或作为一种成分加入到面制品、肉制品中,以提高食品质量和保健功效[7]。风味是食品的重要特征,影响消费者的喜好和接受程度。消费者对风味的感知与挥发性化合物密切相关,挥发性化合物的种类、数量和形成可为评价和改进最终产品的风味质量、分类和鉴定提供重要特征信息,并指导原料的生产、加工和利用。
气相色谱-离子迁移谱法(gas chromatography-ion mobility spectrometry, GC-IMS)结合了气相色谱的高分离能力和离子迁移谱的快速响应特性,具有灵敏、样品无需预处理等优点,广泛应用于食品风味分析[8-10]。FAN等[11]利用GC-IMS鉴定了6个澳大利亚高粱品种的挥发性化合物,共鉴定出25种挥发性化合物。LIU等[12]通过GC-IMS定性分析和人工识别,结合化学计量学建立了有机糯高粱、无糯高粱和有机非糯高粱的分类模型,实现了高粱品种的快速鉴定。但GC-IMS缺乏完整的数据库,因此在风味物质的定性方面存在局限性。GC-MS通常与固相微萃取相结合,作为一种有效的挥发性化合物定性和定量方法,但是对小分子风味物质灵敏度不够。结合多种技术研究食品中挥发性化合物已成为当前研究热点,可以快速、准确评价样品风味特征。目前,基于GC-IMS和顶空固相微萃取气相色谱-质谱联用法(headspace solid-phase microextraction gas chromatography-mass spectrometry, HS-SPME-GC-MS)对不同品种高粱挥发性化合物进行比较分析的研究很少。本研究采用GC-IMS、HS-SPME-GC-MS相结合的方法,对20种高粱的挥发性成分进行了综合研究,并构建了高粱的特征指纹图谱。通过多元统计分析,解释不同高粱品种风味品质的异同,以期为高粱的鉴定及高粱制品的深加工开发利用提供技术支撑。
1 材料与方法
1.1 材料与试剂
本研究选取20个高粱品种(表1),所有品种均在新疆奇台县种植,成熟时收获并干燥至水分含量12%左右,脱粒后粉碎,密封保存在-20 ℃,以备进一步分析。
表1 高粱样品信息
Table 1 Information of sorghum samples
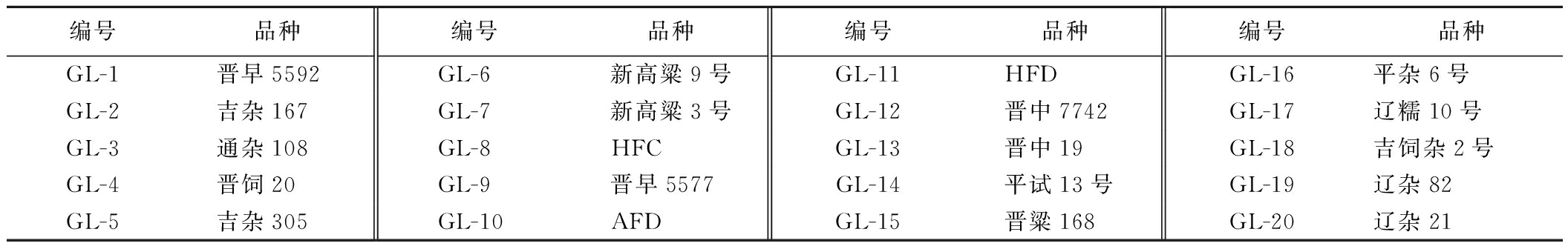
编号品种编号品种编号品种编号品种GL-1晋早5592GL-6新高粱9号GL-11HFDGL-16平杂6号GL-2吉杂167GL-7新高粱3号GL-12晋中7742GL-17辽糯10号GL-3通杂108GL-8HFCGL-13晋中19GL-18吉饲杂2号GL-4晋饲20GL-9晋早5577GL-14平试13号GL-19辽杂82GL-5吉杂305GL-10AFDGL-15晋粱168GL-20辽杂21
1.2 仪器与设备
Flavour Spec®气相色谱离子迁移谱联用仪,德国G.S.A公司;QP 2020 NX气相色谱-质谱联用仪,日本G.A.S公司;AL104分析天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 GC-IMS分析
准确称取0.50 g高粱粉末,放入20 mL顶空瓶并密封,在90 ℃和500 r/min转速下孵育20 min,用进样针吸取100 μL顶空瓶中的挥发性气体,经气相色谱柱(MXT-5,15 m×0.53 mm)预分离然后进入IMS分析,色谱柱温度为60 ℃,载气为高纯氮气(99.999%)。挥发性化合物的定性分析基于保留时间和迁移时间与GC-IMS库比对,定量分析采用峰面积归一化法。
1.3.2 HS-SPME-GC-MS分析
准确称取1.5 g高粱粉末于20 mL顶空瓶中,密封后将固相微萃取头插入顶空瓶,70 ℃条件下富集挥发性气体30 min,经PolarWAX柱(30 m×0.25 mm,膜厚0.25 μm)分离测定。气相色谱条件:进样针温度250 ℃,载气为He,流速1.0 mL/min,采用程序升温模式对挥发性化合物进行气相色谱分离。初始柱温为40 ℃,保持3 min,然后以5 ℃/min的速率升高至200 ℃,保持5 min。之后,以10 ℃/min的速率将温度升高到230 ℃,持续5 min。MS条件:离子源温度为200 ℃,质量扫描范围为35 m/z~550 m/z。基于高粱样品挥发性化合物的质谱数据与NIST数据库的匹配结果与保留指数对化合物进行定性,保留相似性大于80%的化合物。
1.3.3 相对气味活性值(relative odor activity value, ROAV)的计算
采用ROAV法[13]评价样品中挥发性化合物对风味的贡献。定义风味贡献最大的化合物为ROAVstan=100,其他化合物的ROAV的计算如公式(1)所示:
(1)
式中:Ci为某种挥发性化合物的相对含量,%;Ti为某种挥发性化合物的感觉阈值,mg/m3;Cstan、为贡献最大的挥发性成分的相对含量,%;Tstan为贡献最大的挥发性成分的感觉阈值,mg/m3。
1.4 数据分析
所有实验均重复3次,结果以“平均值±标准差”表示。采用SIMCA14.1软件进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)和变量重要投影(variable importance in projection, VIP)分析;绘图采用Origin 2022。
2 结果与分析
2.1 高粱挥发性化合物GC-IMS分析
2.1.1 高粱挥发性化合物二维图谱
采用GC-IMS分析不同品种高粱的挥发性化合物,结果如图1所示。图中横轴代表离子迁移时间,纵轴代表气相保留时间,与纵轴平行的红色线为反应离子峰,离子峰右侧的每个点代表一种化合物。点颜色深浅代表挥发性化合物的浓度,白色代表浓度低,红色代表浓度高[14]。图1-A中大多数信号出现在保留时间为100~400 s,迁移时间为1.0~1.5 ms。虽然20个高粱样品的挥发性化合物图谱相似,但不同区域的颜色存在差异,说明不同品种高粱的挥发性化合物存在区别。

A-二维图谱;B-差异图谱
图1 不同品种高粱样品中的挥发性化合物的GC-IMS图谱
Fig.1 Volatile compounds in sorghum samples of different varieties by GC-IMS
为了清晰地比较不同高粱品种间的差异,以GL-1高粱样品为参照,通过扣减参照得到其他高粱样品的扣减图谱(图1-B)。蓝色和红色分别表示样品中的挥发性化合物含量低于和高于参照[15]。GL-14和GL-20的红色点比参照高粱样品中多,说明这2个品种高粱样品中部分化合物浓度高于参照。相比之下,GL-10和GL-11有大量蓝色点,表明这些化合物浓度低于参照。根据气相色谱的保留时间和离子迁移时间对高粱中挥发性化合物进行鉴定,共鉴定出73种挥发性化合物(附表1,https://doi.org/10.13995/j.cnki.11-1802/ts.041746),其中醛类23种,酮类8种,醇类16种,酯类14种,酸类6种,其他类6种。由于数据库中的化合物有限,有23种化合物无法鉴定。
2.1.2 高粱挥发性化合物指纹图谱
为进一步分析不同高粱品种挥发性化合物的差异,利用Gallery Plot插件构建了高粱挥发性化合物指纹图谱(图2)。每一列代表一种化合物,每一行代表一个样品。此外,某些化合物具有高质子亲和性[16],可能会产生二聚体,如壬醛、2-庚烯醛、γ-丁内酯等化合物。红线左侧为不同高粱品种中共同含有且相对含量较高的化合物,以醛类和酯类为主(如丙位戊内酯、乙酸丙酯、1-辛烯-3-醇、2-甲基丁醛、壬醛、2,3-丁二酮、异戊醇、羟基丙酮、正己醇等化合物)。红线右侧的Ⅰ区域为GL-2中占比最高的挥发性化合物,分别为丁酸甲酯、3-甲基-2-丁烯醛、3-羟基丁酸乙酯、3-甲硫基丙醛、γ-丁内酯、2-甲基丙醇、巴豆酸乙酯、2,3-丁二醇、乙偶姻、丁酸,这些化合物通常会呈现果香,生青味、烘烤味、坚果味。GL-7中2-乙基呋喃(果味)、羟基丙酮(焦糖味)、乙硫醚(烂洋葱味)、3-甲基丁醇(果香味)和2-丁酮(芳香气味)占比最高(Ⅱ区域)。正丁醛、乙酸乙酯使GL-10和GL-11具有令人愉悦的麦芽味和果香味。在GL-14中,二丙酮醇、(E,E)-2,4-己二烯醛、2-辛醇、丙酸、乙酸、庚酸、乙酸异戊酯、辛醇、5-甲基-3-庚酮、3-甲硫基丙醛占比较高(Ⅳ区域),且这些化合物在GL-1中占比最低。此外,正戊酸、2-庚烯醛、戊醛、辛醛、庚醛、2-庚酮、丙酮、丙醇、正戊基呋喃和己酸在GL-20中占比较高(Ⅴ区域)。

图2 不同高粱品种的挥发性化合物指纹图谱
Fig.2 Gallery plot fingerprint spectra of volatile compounds detected in different sorghum varieties
注:GL-1-1、GL-1-2、GL-1-3代表同一个样品的3次重复(下同)。
2.1.3 高粱挥发性化合物定量分析
高粱中最主要的挥发性化合物是醛类,占总挥发性化合物的27.42%~36.51%(图3)。在高粱中,占比超过1%的醛类有壬醛、2-庚烯醛、己醛、3-甲基-2-丁烯醛、2-甲基戊醛、2-甲基丁醛、3-甲基丁醛、苯甲醛、庚醛、糠醛,其中己醛的占比最高(3.15%~7.11%)(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.041746)。已有研究表明,谷物中的己醛与不饱和脂肪酸的氧化有关[17],己醛是谷子、大麦、大米等谷物中的主要挥发性成分[18-19]。3-甲基丁醛和2-甲基丁醛,与麦芽和坚果香味有关[17],在高粱中2-甲基丁醛的占比仅次于己醛,约为2.79%~4.87%。壬醛通常表现为芳香和脂肪气味,在高粱中占总挥发性化合物的1.46%~2.60%,同时,壬醛也是小麦、小米等谷物中常见的挥发性化合物[20-21]。
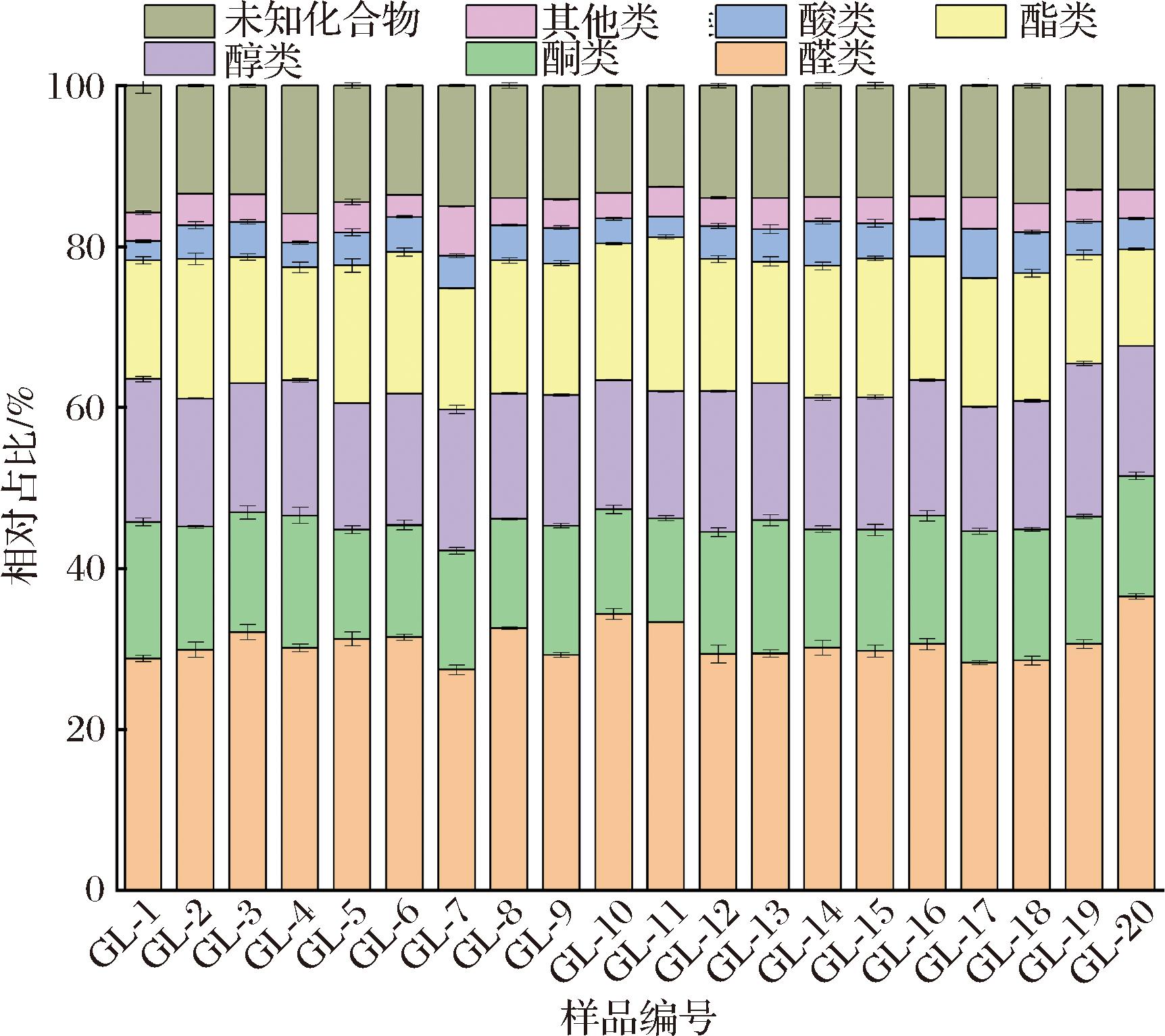
图3 GC-IMS检测的挥发性化合物相对占比
Fig.3 Volatile compounds in sorghum detected by GC-IMS
醇类是不饱和脂肪酸氧化的二次产物,高粱中醇类占比为15.45%~19.02%,由1-辛烯-3-醇、正己醇、戊醇、丙醇、异戊醇、3-甲基-3-丁烯-1-醇、2,3-丁二醇等16种醇组成。其中,正己醇是高粱中占比最高的醇类,以GL-1最高(4.41%)、GL-14最低(2.91%)。1-辛烯-3-醇是一种具有蘑菇和泥土香气的不饱和醇,对大米的特征香气有重要贡献[22]。1-辛烯-3-醇在高粱挥发性化合物中也有检出,占比为0.92%~1.59%,与谷子中占比相近(0.76%~1.44%)[18]。
酯类化合物是一类重要的低气味阈值化合物,主要通过酯化反应合成。高粱中共检出14种酯类化合物,其中2-甲基丁酸乙酯占比最高(1.72%~3.73%)。乙酸己酯、γ-丁内酯、丁酸甲酯、乙酸丙酯等酯类使高粱具有果香味。
酮类是不饱和脂肪酸氧化降解的产物,由氨基酸降解合成产生。酮类具有脂肪和烧焦的香气,以及随着碳链的增加而增强的花香[20]。6-甲基-5-庚烯-2-酮、2-庚酮、羟基丙酮、2-戊酮、2-丁酮、2,3-丁二酮、丙酮、5-甲基-3-庚酮组成了高粱中酮类化合物,占比为12.92%~16.97%。其中2,3-丁二酮占比最高(1.98%~4.39%),其次是2-庚酮(1.92%~4.33%),这一发现与之前的一项研究一致[11]。
酸类在所有高粱样品中占比都比较低,其中丁酸在GL-17样品中占比最高,为2.76%。除上述挥发性化合物外,高粱中还含有2.76%~6.15%的其他化合物,包括呋喃和醚类,共同构成了高粱复杂的风味。
2.2 高粱挥发性化合物HS-SPME-GC-MS分析
在20种高粱样品中共检测到128种挥发性化合物,包括17种醛类、18种酮类、17种醇类、20种酯类、5种酸类、20种烷烃类、21种杂环类和10种其他化合物。与GC-IMS的结果相似,不同品种高粱样品中挥发性化合物的占比和数量存在差异。附图2(https://doi.org/10.13995/j.cnki.11-1802/ts.041746)为挥发性化合物占比热图,由图可知乙醇和正己醇是20种高粱中共有且占比最高的化合物,其次是壬醛、壬酸、(E)-2-壬烯醛和亚油酸乙酯。
为了直观展示20种高粱挥发性化合物的重叠情况,做Upset图(图4-A)。20个品种高粱中共有的挥发性化合物有26种,为乙醇、2-庚酮、十二烷、2-戊基呋喃、正己醇、壬醛、反-2-辛烯醛、苯甲醇、γ-庚壬内酯等化合物。其中,在GL-5中未检出反式-3-壬烯-2-酮和2,2,4-三甲基戊二醇乙丁酯,其他品种高粱中均有检出;辛酸乙酯仅在GL-2、GL-7样品中检测到;GL-2、GL-14特有的挥发性化合物为2-丁基-2-辛烯醛;羟基香茅醇和2-吡咯甲醛为GL-8和GL-10特有的挥发性化合物。
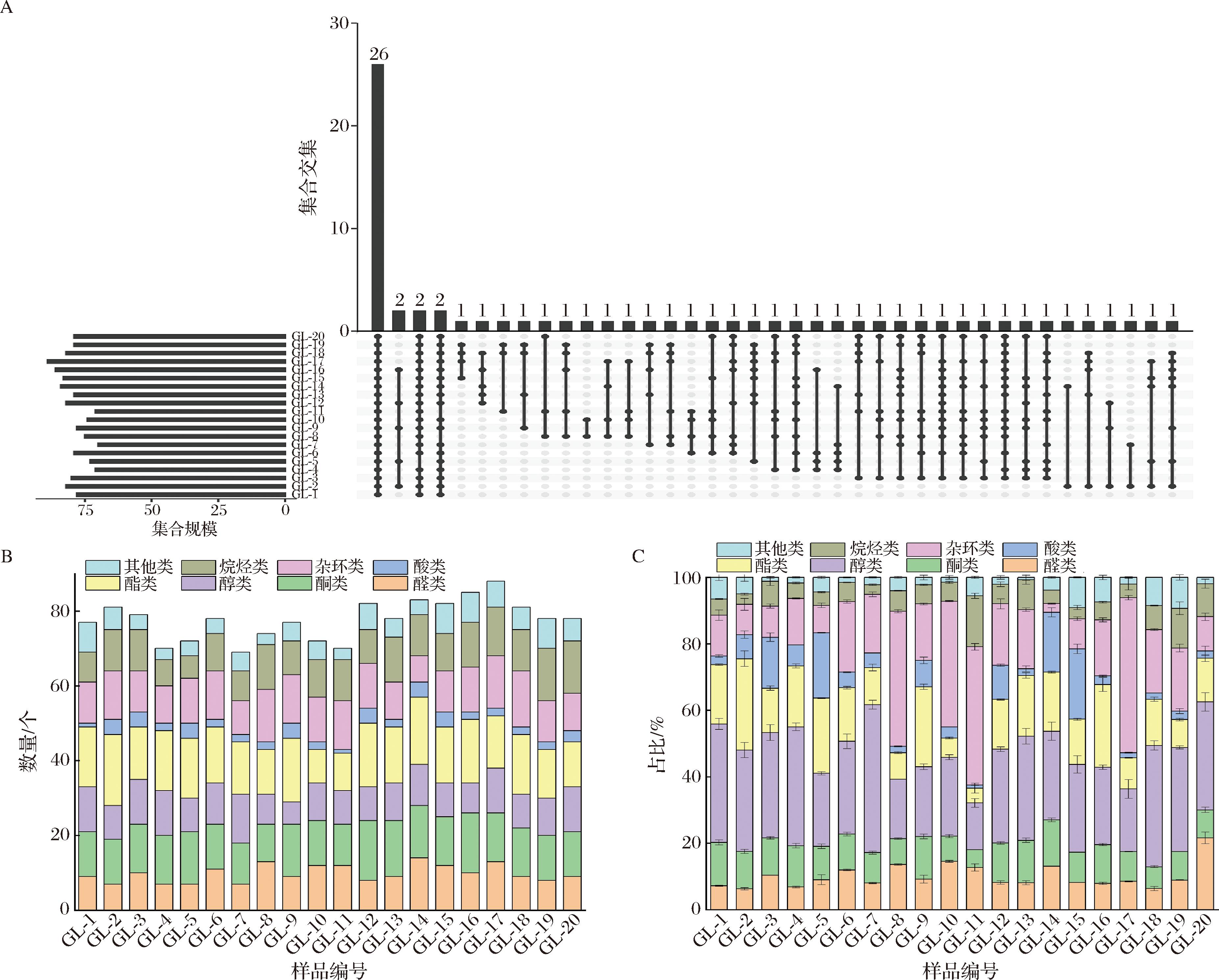
A-Upset图;B-各类化合物数量;C-化合物占比
图4 HS-SPME-GC-MS检测的挥发性化合物
Fig.4 Volatile compounds in sorghum detected by HS-SPME-GC-MS
由图4-B可知,不同品种高粱中挥发性化合物种类不同。其中,GL-7中检出的化合物种类最少(69种),GL-17中检出的化合物种类最多(89种)。在各类化合物中,酯类数量较多,其中GL-14中酯类最多,有18种。
高粱中各类挥发性组分占比如图4-C所示。高粱中挥发性化合物以醇类、酯类和杂环类为主,占总挥发性成分的42.36%~71.73%。高粱中检出醇类占总挥发性成分的12.66%~42.89%,其中具有甜味、脂肪、果香味的乙醇和正己醇占比最高,其次是具有生青、花香味的1-壬醇、戊醇和正辛醇。酯类是构成高粱风味的重要成分,主要提供果香味。在20个高粱品种中共检测到20种酯类化合物。其中γ-庚壬内酯、棕榈酸乙酯、酞酸二甲酯、邻苯二甲酸二异丁酯和邻苯二甲酸二丁酯在所有高粱品种中均检出。在孵育过程中,高粱中糖与蛋白质、氨基酸等化合物通过美拉德反应和Strecker降解产生了大量杂环化合物(如吡嗪、呋喃、吡啶、腈、噻吩类和噻唑类),主要表现出焙烤味。醛类化合物通常具有青草、脂肪味,由于阈值低,在高粱的独特风味中起着重要作用。醛类化合物占高粱挥发性成分的5.89%~20.31%。其中,己醛、(E)-2-壬烯醛和壬醛等脂肪醛的占比较高,使高粱呈现出脂肪和青草香气。高粱中酮类的占比在4.83%~13.22%。其中,GL-14的酮类占比明显较高,主要包括2-庚酮、2-辛酮、甲基庚烯酮、3-辛烯-2-酮、1-癸烯-3-酮、反式-3-壬烯-2-酮、3,5-辛二烯-2-酮等酮类。此外,在高粱中还检测到烷烃和酸类,酸类主要来源于脂肪酸的水解,其占比在不同高粱品种间的差异明显;烷烃类化合物主要由脂肪酸烷氧自由基的均裂产生,高粱中烷烃类化合物占比为2.9%~13.82%。
2.3 GC-IMS与HS-SPME-GC-MS结果比较
GC-IMS和HS-SPME-GC-MS这2种方法在高粱中分别鉴定出73种、128种挥发性化合物,有19种化合物为共同检出。HS-SPME-GC-MS比GC-IMS检测到更多的挥发性化合物,且GC-IMS检测到的化合物以小分子(C2~C10)居多,而HS-SPME-GC-MS检测到的化合物以大分子(C7~C13)居多[23]。在高粱挥发性化合物GC-IMS结果中,醛类占比最高(27.42%~36.51%)。然而,HS-SPME-GC-MS鉴定出的主要挥发性化合物是醇、酯和杂环类化合物,这可能是由于GC-IMS对醛类的识别更为敏感,这与张彦赠等[24]的研究结果一致。GC-IMS结果中没有检出烷烃类化合物,这可能是由于GC-IMS的测定依靠化合物的质子亲和力,由于烷烃的质子亲和力比水弱,因此GC-IMS无法检测出烷烃类物质[25]。总而言之,GC-IMS的结果更为直观,而HS-SPME-GC-MS的结果更为全面,2种方法的结合可以更全面地反映高梁中的挥发性化合物。
2.4 多元统计分析
2.4.1 高粱中差异挥发性成分分析
OPLS-DA是一种非常有效的样本分类和建立判别模型的方法[12],可以排除与分类无关的自变量,筛选出样本的特征变量,解释观测值并进行相应变量的预测。将高粱中挥发性化合物的GC-IMS和HS-SPME-GC-MS检测结果进行OPLS-DA分析,以便观察品种间差异。Q2用于评估模型的预测能力,![]() 和
和![]() (拟合能力)用于评估模型的拟合优度和可靠性,值越接近1,模型的可解释性越好[26]。
(拟合能力)用于评估模型的拟合优度和可靠性,值越接近1,模型的可解释性越好[26]。
将GC-IMS检测的73种挥发性化合物作为因变量,品种作为自变量,OPLS-DA分析结果如图5-A所示,其中自变量拟合指数![]() 为0.993,因变量拟合指数
为0.993,因变量拟合指数![]() 为0.857,模型预测指数(Q2)为0.829。Q2和R2均大于0.5,表明模型拟合结果可接受。同理,由HS-SPME-GC-MS的OPLS-DA分析结果可知,
为0.857,模型预测指数(Q2)为0.829。Q2和R2均大于0.5,表明模型拟合结果可接受。同理,由HS-SPME-GC-MS的OPLS-DA分析结果可知,![]() 为
为![]() 为0.949,Q2为0.865,表明模型拟合结果良好。为了评估模型的有效性,进行了200次置换检验。模型有效性的标准为:Q2的回归线与纵轴相交于零或小于零。GC-IMS和HS-SPME-GC-MS的参数分别为R2=0.363、Q2=-0.779,R2=0.383、Q2=-0.63,表明该模型可靠,没有过拟合现象(图5-C和图5-D)。
为0.949,Q2为0.865,表明模型拟合结果良好。为了评估模型的有效性,进行了200次置换检验。模型有效性的标准为:Q2的回归线与纵轴相交于零或小于零。GC-IMS和HS-SPME-GC-MS的参数分别为R2=0.363、Q2=-0.779,R2=0.383、Q2=-0.63,表明该模型可靠,没有过拟合现象(图5-C和图5-D)。
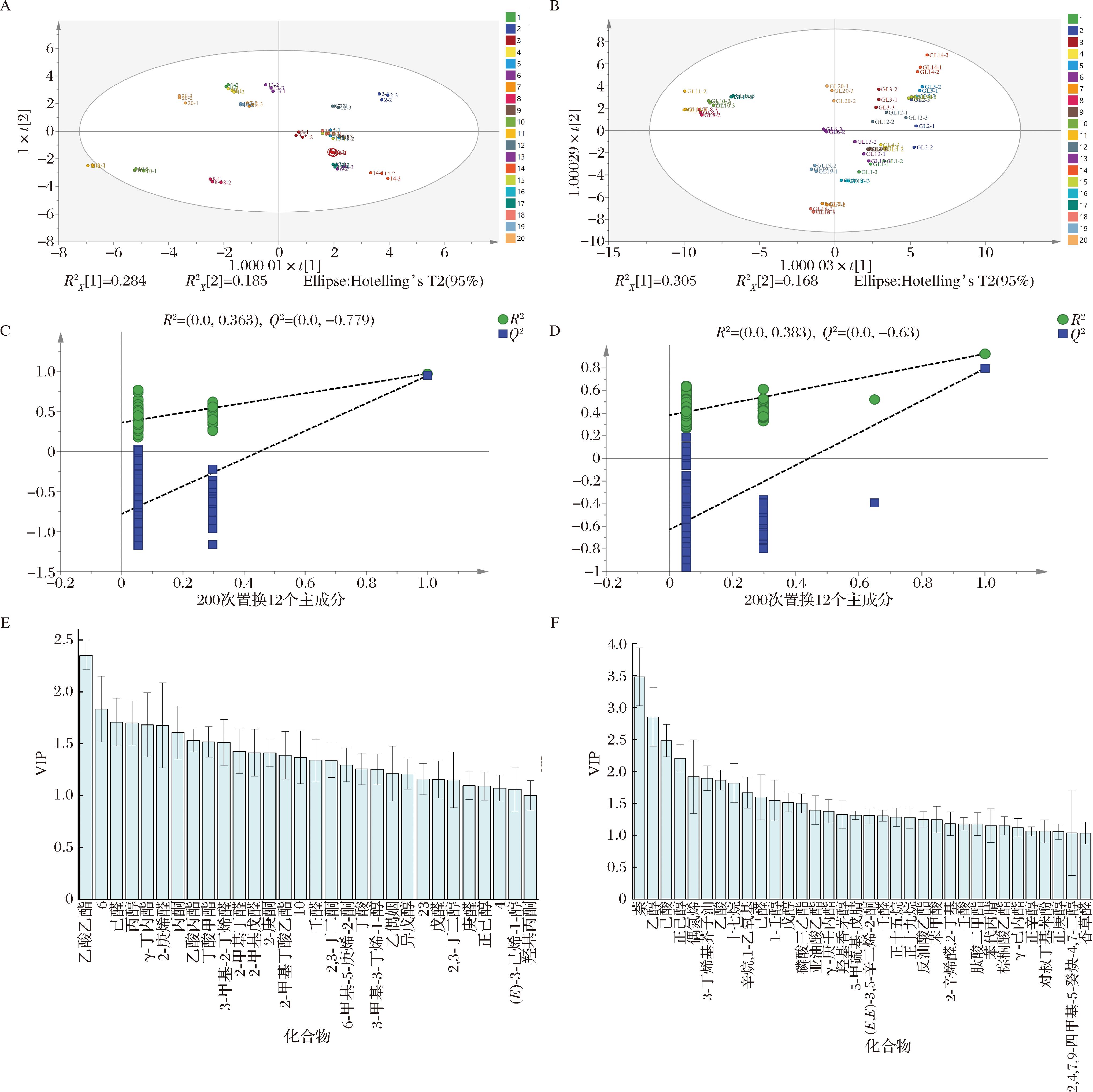
A-GC-IMS的OPLS-DA得分图;B-HS-SPME-GC-MS的OPLS-DA得分图;C-GC-IMS的交叉验证;D-HS-SPME-GC-MS的交叉验证;E-GC-IMS的VIP值图;F-HS-SPME-GC-MS的VIP值图
图5 不同高粱品种挥发性化合物的多元统计分析
Fig.5 Multivariate statistical analysis of volatile compounds in different sorghum varieties
为进一步解析不同高粱品种间的差异挥发性化合物,在OPLS-DA的基础上进行VIP分析,GC-IMS和HS-SPME-GC-MS检出的挥发性化合物中分别筛选出30种和34种VIP>1的差异挥发性成分(图5-E和图5-F)。GC-IMS的结果显示,乙酸乙酯的VIP值最大,为2.35;其次是己醛(1.71)、丙醇(1.70)、γ-丁内酯(1.68)等化合物。HS-SPME-GC-MS的结果显示,萘的VIP值最大(3.48)。
2.4.2 高粱中关键差异挥发性化合物分析
挥发性化合物对高粱特有风味的贡献不仅与化合物占比有关,而且与化合物的感官阈值有关,一些阈值和浓度较低的挥发性化合物在风味中仍然发挥着显著作用[27]。因此,为评估单个化合物对整体风味的贡献,以ROAV≥1、VIP>1为标准[28],筛选20种高粱的关键差异挥发性化合物。在GC-IMS检出化合物中筛选出7种关键差异化合物,分别为壬醛、庚醛、丁酸、己醛、2-甲基丁醛、戊醛、2,3-丁二酮(图6-A);在HS-SPME-GC-MS检出化合物中筛选出1种关键差异化合物,为己醛(图6-B)。
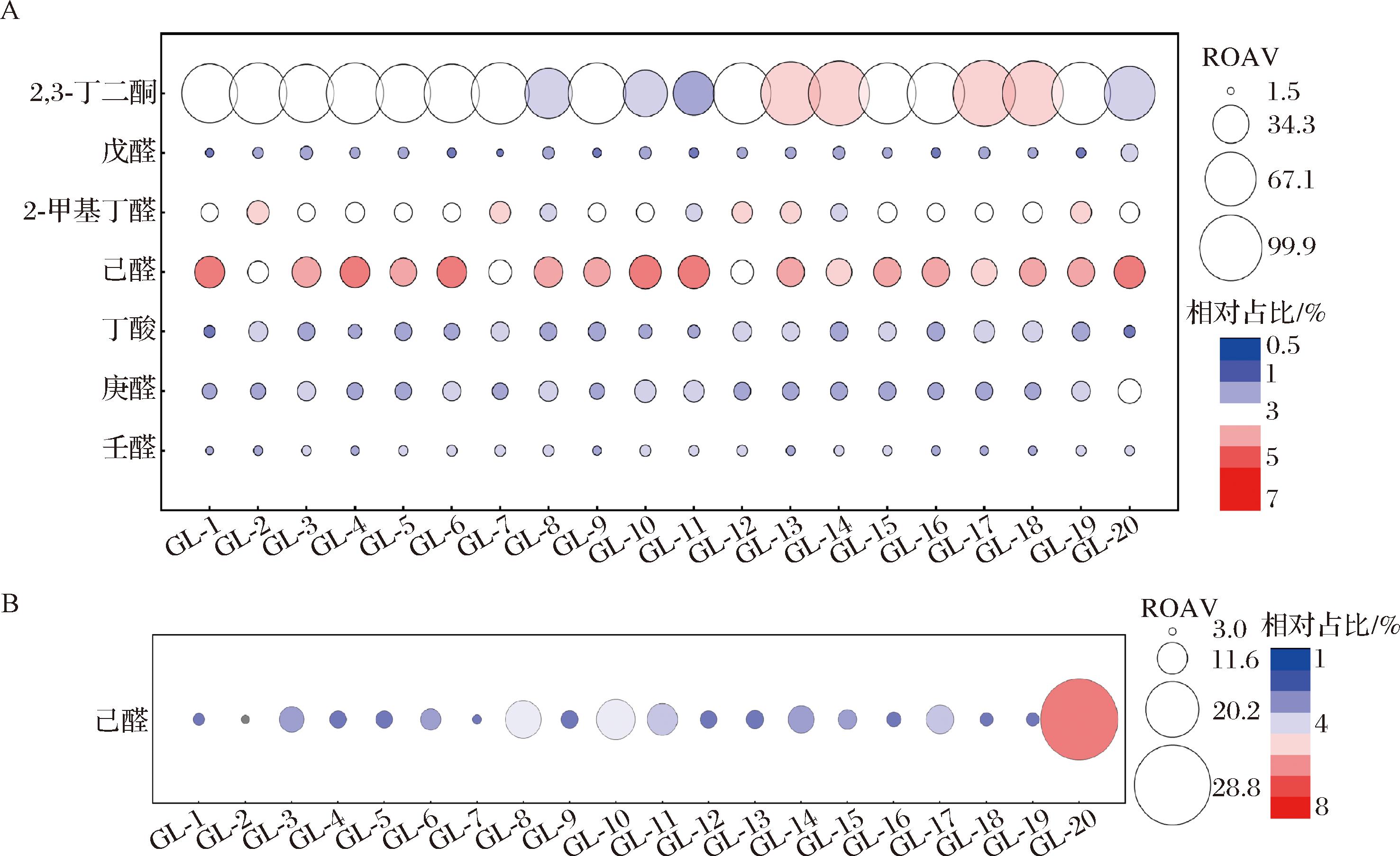
A-GC-IMS;B-HS-SPME-GC-MS
图6 不同品种高粱关键差异挥发性化合物的ROAV气泡图
Fig.6 Bubble map of relative odor activity values of key difference volatile compounds in different sorghum varieties
注:圆圈的面积与ROAV呈正比,圆圈的颜色代表挥发性化合物的占比。
3 结论
采用GC-IMS和HS-SPME-GC-MS相结合的方法,对不同品种的高粱风味特征进行综合表征。GC-IMS共鉴定出73种挥发性化合物,HS-SPME-GC-MS共鉴定出128种挥发性化合物。以VIP值为基础,建立了高粱GC-IMS分析的OPLS-DA模型,结合ROAV筛选出7种关键差异挥发性化合物,分别为壬醛、庚醛、丁酸、己醛、2-甲基丁醛、戊醛、2,3-丁二酮;采用OPLS-DA模型进行HS-SPME-GC-MS分析,确定己醛为关键差异挥发性化合物。通过GC-IMS和HS-SPME-GC-MS相结合,建立了不同品种高粱的风味化合物的可视化图谱,明确了高粱品种间主要风味物质的差异,且最大程度地保留了高粱挥发性化合物的总体信息。研究结果将有助于高粱品种的分类和鉴定。
[1] LIAQAT W, ALTAF M T, BARUTÇULAR C, et al.Sorghum:A star crop to combat abiotic stresses, food insecurity, and hunger under a changing climate:A review[J].Journal of Soil Science and Plant Nutrition, 2024, 24(1):74-101.
[2] WU G C, JOHNSON S K, BORNMAN J F, et al.Changes in whole grain polyphenols and antioxidant activity of six sorghum genotypes under different irrigation treatments[J].Food Chemistry, 2017, 214:199-207.
[3] CHADALAVADA K, RANJITHA KUMARI B D, SENTHIL KUMAR T S.Sorghum mitigates climate variability and change on crop yield and quality[J].Planta, 2021, 253(5):113.
[4] DE MORAIS CARDOSO L, PINHEIRO S S, DE CARVALHO C W P, et al.Phenolic compounds profile in sorghum processed by extrusion cooking and dry heat in a conventional oven[J].Journal of Cereal Science, 2015, 65:220-226.
[5] YANG L Y, ALLRED K F, DYKES L, et al.Enhanced action of apigenin and naringenin combination on estrogen receptor activation in non-malignant colonocytes:Implications on sorghum-derived phytoestrogens[J].Food &function, 2015, 6(3):749-755.
[6] CHEN X, SHEN J M, XU J W, et al.Sorghum phenolic compounds are associated with cell growth inhibition through cell cycle arrest and apoptosis in human hepatocarcinoma and colorectal adenocarcinoma cells[J].Foods, 2021, 10(5):993.
[7] XIONG Y, ZHANG P Z, WARNER R D, et al.Sorghum grain:From genotype, nutrition, and phenolic profile to its health benefits and food applications[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(6):2025-2046.
[8] XI B N, ZHANG J J, XU X, et al.Characterization and metabolism pathway of volatile compounds in walnut oil obtained from various ripening stages via HS-GC-IMS and HS-SPME-GC-MS[J].Food Chemistry, 2024, 435:137547.
[9] FAN X, ZHONG M H, FENG L, et al.Evaluation of flavor characteristics in tartary buckwheat (Fagopyrum tataricum) by E-nose, GC-IMS, and HS-SPME-GC-MS:Influence of different roasting temperatures[J].LWT, 2024, 191:115672.
[10] WANG D, ZHANG J, ZHU Z S, et al.Effect of ageing time on the flavour compounds in Nanjing water-boiled salted duck detected by HS-GC-IMS[J].LWT, 2022, 155:112870.
[11] FAN X J, JIAO X, LIU J G, et al.Characterizing the volatile compounds of different sorghum cultivars by both GC-MS and HS-GC-IMS[J].Food Research International, 2021, 140:109975.
[12] LIU M J, YANG Y, ZHAO X B, et al.Classification and characterization on sorghums based on HS-GC-IMS combined with OPLS-DA and GA-PLS[J].Current Research in Food Science, 2024, 8:100692.
[13] 刘登勇,周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学, 2008, 29(7):370-374.LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of rugao ham[J].Food Science, 2008, 29(7):370-374.
[14] QU D, XI L J, LI Y K, et al.Characterizing the composition of volatile compounds in different types of Chinese bacon using GC-MS, E-nose, and GC-IMS[J].Journal of Chromatography A, 2024, 1730:465056.
[15] JIANG H, DUAN W S, ZHAO Y C, et al.Development of a flavor fingerprint using HS-GC-IMS for volatile compounds from steamed potatoes of different varieties[J].Foods, 2023, 12(11):2252.
[16] RONG Y T, XIE J L, YUAN H B, et al.Characterization of volatile metabolites in Pu-erh teas with different storage years by combining GC-E-Nose, GC-MS, and GC-IMS[J].Food Chemistry:X, 2023, 18:100693.
[17] MATTIOLO E, LICCIARDELLO F, LOMBARDO G M, et al.Volatile profiling of durum wheat kernels by HS-SPME/GC-MS[J].European Food Research and Technology, 2017, 243(1):147-155.
[18] KANG M, GUO Y, REN Z Y, et al.Volatile fingerprint and differences in volatile compounds of different foxtail millet (Setaria italica Beauv.) varieties[J].Foods, 2023, 12(23):4273.
[19] CRAMER A J, SCOTT MATTINSON D S, FELLMAN J K, et al.Analysis of volatile compounds from various types of barley cultivars[J].Journal of Agricultural and Food Chemistry, 2005, 53(19):7526-7531.
[20] ZHANG K Y, ZHANG C, GAO L L, et al.Analysis of volatile flavor compounds of green wheat under different treatments by GC-MS and GC-IMS[J].Journal of Food Biochemistry, 2022, 46(6):e13875.
[21] LI S H, ZHAO W, LIU S Y, et al.Characterization of nutritional properties and aroma compounds in different colored kernel varieties of foxtail millet (Setaria italica)[J].Journal of Cereal Science, 2021, 100:103248.
[22] ZHENG X Z, LAN Y B, ZHU J M, et al.Rapid identification of rice samples using an electronic nose[J].Journal of Bionic Engineering, 2009, 6(3):290-297.
[23] ZHANG X Y, WANG A X, LI J X, et al.Volatiles and bacterial composition of pickled bamboo shoots within 10 pre-packaged Chinese Luosifen disclosed by GC-MS, GC-IMS, and high-throughput sequencing[J].Innovative Food Science &Emerging Technologies, 2024, 96:103794.
[24] 张彦赠, 汤晓娟, 林祥娜, 等.关于豆豉微生物多样性和挥发性成分检测技术及其关联分析的研究进展[J].中国调味品, 2023, 48(1):210-214;220.ZHANG Y Z, TANG X J, LIN X N, et al.Research progress on detection techniques for microbial diversity and volatile components of fermented soybeans and their correlation analysis[J].China Condiment, 2023, 48(1):210-214;220.
[25] 夏兰欣, 周贵华, 王广, 等.GC-MS和GC-IMS分析食用油对熟炕马铃薯挥发性成分的影响[J].中国粮油学报.2022, 37(12):236-245.XIA L X, ZHOU G H, WANG G, et al.Conjoint analysis of the effects of edible oil on the volatile components of cooked kang potatoes by GC-MS and GC-IMS[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(12):236-245.
[26] DU H, CHEN W L, LEI Y T, et al.Discrimination of authenticity of Fritillariae cirrhosae Bulbus based on terahertz spectroscopy and chemometric analysis[J].Microchemical Journal, 2021, 168:106440.
[27] ZHENG A R, WEI C K, WANG M S, et al.Characterization of the key flavor compounds in cream cheese by GC-MS, GC-IMS, sensory analysis and multivariable statistics[J].Current Research in Food Science, 2024, 8:100772.
[28] WANG Y J, HUANG L F, DENG G J, et al.The shaking and standing processing improve the aroma quality of summer black tea[J].Food Chemistry, 2024, 454:139772.