酸奶中富含生物活性蛋白质、碳水化合物、维生素和矿物质,对人体健康具有积极影响,因此备受消费者青睐[1]。酸奶是由唾液链球菌嗜热亚种(Streptococcus thermophilus)和德氏乳杆菌保加利亚亚种(Lactobacillus bulgaricus)复合发酵而成。在发酵过程中,发酵剂菌株利用乳糖,并将其转化为乳酸[2],促进其快速凝乳。然而,在酸奶贮藏过程中,pH值会呈现持续下降态势,易引发酸味过重、乳清分离等一系列感官品质下降的问题,即后酸化现象,严重影响酸奶品质[3]。
在酸奶的酸化过程中,乳蛋白会经历一系列的修饰如解离重组等形成凝胶,有助于酸奶质构构建和风味形成[4]。酶法修饰乳蛋白的氨基酸和多肽链,能够有效调控其发酵特性和酸奶内部形成的空间结构。蛋白质谷氨酰胺酶(protein glutaminase,PG)于2000年首次从土壤中分离而来,PG可以特异性地催化蛋白质中谷氨酰胺残基脱酰胺,产生谷氨酰胺和氨而不影响蛋白的水解或交联,从而改善蛋白质的功能性质,如溶解度、乳化特性和起泡能力,并使乳清蛋白凝胶质地柔软、增加持水力[5-7]。例如,MIWA等[8]发现经过PG处理的脱脂乳的溶解性、乳化性随脱酰胺程度的增加而显著提高,同时促进了酪蛋白胶束的解离。MIWA等[9]研究了酶法脱酰胺对不同脂肪含量凝固型酸奶结构的影响,发现随着PG脱酰胺程度的增加,脱脂和低脂酸奶表面脱水收缩减少,表面更光滑有光泽,同时,PG诱导的脱酰胺会增加酪蛋白上的羧基含量,使亲水的酪蛋白缔合能力降低,从而削弱酪蛋白胶束之间的内聚力,最终形成凝胶结构致密的酸奶。WU等[10]研究了PG酶对脱脂酸奶的质构、流变学、微观结构和感官特性的影响,发现随着PG添加量的增加,酸奶的流动性和黏度得到显著改善。经过PG处理的酸奶其顺滑度显著改善,有效地解决了脱水收缩问题,形成了更为致密的三维结构。尽管该酶在乳制品加工中的作用受到关注,但关于PG对发酵剂发酵特性及对贮藏过程中酸奶后酸化影响的研究相对匮乏。
本研究聚焦于不同浓度 PG 对乳基蛋白水解能力的作用效应,通过测定酸奶酸度、pH及活菌数,深入评估其发酵特性。在酸奶贮藏期间,通过测定有机酸含量变化,阐明不同浓度 PG 对酸奶后酸化的影响,同时全面评价酸奶的质构特性与流变特性。本研究成果旨在为高品质酸奶的生产提供坚实的科学依据,同时为 PG 在食品工业领域的广泛应用提供思路与方向。
1 材料与方法
1.1 材料与试剂
PG 500 U/g,Amano Enzyme Inc(日本天野公司);纯牛乳(脂肪含量为3.7 g/100 g;蛋白质含量为3.0 g/100 g),蒙牛乳业(集团)股份有限公司;含有唾液链球菌嗜热亚种和德氏乳杆菌保加利亚亚种的直投式发酵剂HYY,教育部-中国农业大学功能乳品北京市重点实验室;SDS,北京索莱宝科技有限公司;四硼酸钠,上海沪试实验室器材股份有限公司;无水乙醇,天津致远化学试剂有限公司;乳酸、甲醇、邻苯二甲醛、1,4-二巯基苏糖醇、丝氨酸,默克Sigma公司;MRS培养基,北京陆桥技术股份有限公司;M17培养基,英国OXOID公司。
1.2 仪器与设备
FA2104B分析天平,上海越平科学仪器(苏州)制造有限公司;DL-CJ-1 N超净工作台,北京东联哈尔仪器制造有限公司;S400-K台式pH计,瑞士METTLER TOLEDO公司;LC-20AD液相色谱仪,岛津企业管理(中国)有限公司;SPD-20AV紫外可见光检测器,岛津企业管理(中国)有限公司;AR-1500EX旋转流变仪,美国TA仪器;TDL-40B低速台式大容量离心机,上海安亭科学仪器厂;CTX质构分析仪,美国Brookfield公司;0.22 μm无菌微孔滤膜,天津津腾实验设备有限公司。
1.3 方法
1.3.1 谷氨酰胺酸奶的制备
乳基的制备参考GARC A-G
A-G MEZ等[11]的方法并稍作修改:纯牛奶在40 ℃预热5 min,加入PG使其含量达到0.03、0.06、0.09、0.12 U/g蛋白,对照组不添加PG。加入PG之后的牛奶样品在40 ℃下孵化120 min,孵化后,乳基经95 ℃加热5 min,使PG失活,之后将样品冷却至42 ℃。冷却后加入直投式发酵剂HYY(添加剂量为100 g/T),在42 ℃条件下发酵,发酵酸度达到70 °T发酵结束。达到发酵终点之后将样品放入4 ℃冰箱内贮藏,贮藏期样品测定时间为1、7、14、21 d。
MEZ等[11]的方法并稍作修改:纯牛奶在40 ℃预热5 min,加入PG使其含量达到0.03、0.06、0.09、0.12 U/g蛋白,对照组不添加PG。加入PG之后的牛奶样品在40 ℃下孵化120 min,孵化后,乳基经95 ℃加热5 min,使PG失活,之后将样品冷却至42 ℃。冷却后加入直投式发酵剂HYY(添加剂量为100 g/T),在42 ℃条件下发酵,发酵酸度达到70 °T发酵结束。达到发酵终点之后将样品放入4 ℃冰箱内贮藏,贮藏期样品测定时间为1、7、14、21 d。
1.3.2 酸奶酸度的测定
采用便携式pH计测定酸奶pH;滴定酸度的检测按照国标GB 5009.239—2016《食品安全国家标准 食品酸度的测定》进行[12]。称取发酵基料约10 g,加入20 g纯净水,滴加2滴含酚酞(2 mL,10 g/L)的乙醇溶液;用标准的0.1 mol/L NaOH滴定混合物,并记录消耗NaOH的体积(V);通过发酵基料质量m和消耗的NaOH体积计算可滴定酸度,并表示为°T。滴定酸度表示如公式(1)所示:
酸度![]()
(1)
式中:c,NaOH标准溶液的浓度,mol/L;V,滴定时消耗NaOH标准溶液体积,mL;m,发酵基料质量,g;0.1,酸度理论定义氢氧化钠的浓度,mol/L。
1.3.3 酸奶活菌数的检测
按照国标GB 4789.35—2016《食品安全国家标准 食品微生物检验 乳酸菌检验》[13]进行可培养微生物活菌数的测定:称取样品1 g,加入9 mL 8.5 g/L生理盐水,采用10倍梯度稀释至合适梯度;取1 mL稀释液添加培养皿,倾注于MRS固体培养基;在43 ℃下培养36~48 h,计算微生物数量,表示为CFU/mL;每个样品进行3次重复。
1.3.4 酸奶蛋白水解能力测定
邻苯二甲醛(o-phthalaldehyde,OPA)溶液的制备:将1.905 g四硼酸钠和50 mg SDS溶解于37.5 mL去离子水中,溶解完全,获得A1溶液;将40 mg OPA溶解于1 mL无水乙醇中,溶解完全后将OPA溶液转移至上述A1溶液中,并用去离子水冲洗,转移;将44 mg 1,4-二疏基苏糖醇加入到A1溶液中,去离子水冲洗,转移;用去离子水将A溶液定容至50 mL。标准曲线的测定:称量丝氨酸标准品分别溶解于去离子水中,获得0.237 9、0.475 8、0.951 6、1.903 2、3.806 4、5.709 6、7.612 8、9.516、11.419 2 mEq/L的Serine-NH2标准溶液。取150 μL Serine-NH2标准溶液加入到3 mL OPA试剂的测试管中(时间点0),混合均匀,静置2 min,立即读取340 nm处吸光值,进行3次重复。
称取2.50 g酸奶样品加入5 mL 7.5 g/L三氯乙酸中,使用滤纸过滤混合物,保存至-20 ℃备用。将150 μL样品溶液加入3 mL OPA试剂的测试管中(时间点0),混合均匀,静置2 min,立即读取340 nm处吸光值,进行3次重复,根据标准曲线计算游离氨基酸的浓度。
1.3.5 有机酸测定
乳酸标准溶液的配制:乳酸标准品原质量浓度为28 740 mg/L,准确吸取80 μL乳酸标准品于1 mL容量瓶中,用0.1%(体积分数)磷酸溶液溶解并定容至刻度,混匀,该标准储备溶液质量浓度为2 299.2 mg/L。准确量取适量标准储备溶液,用0.1%(体积分数)磷酸溶液稀释配制乳酸浓度分别为:35.925、71.85、143.7、287.4、574.8、1 149.6 mg/L的系列标准工作溶液。
有机酸的测定按照SHAH等[14]概述的方法进行。称取0.2 g酸奶样品与4 mL 0.01 mol/L硫酸混合;混匀后将混合物在5 000×g下离心15 min,以去除蛋白质;上清液经0.22 μm无菌微孔滤膜过滤后置于进样瓶。色谱条件:C18 column (XSelect® HSS T3 column, 2.1 mm×100 mm, 2.5 μm) 离子交换柱;柱温35 ℃;流动相A为10 mmol pH 2.0 NaH2PO,流动相B为甲醇,V(A)∶V(B)=97∶3;流速为0.8 mL/min;检测器波长210 nm;进样量为10 μL。采用外标法对样品中的有机酸进行定量分析。
1.3.6 酸奶持水力测定
参考DELIKANLI等[15]的方法并稍作修改。称量空离心管的质量记为m(g);每个离心管中称取8 g样品,并称量总质量记为m1(g);样品在4 ℃、4 000×g离心15 min,弃上清液后在滤纸上倒置10 min,称量总质量记为m2(g),持水力计算如公式(2)所示:
持水力![]()
(2)
1.3.7 酸奶流变学特性测定
使用流变仪按照LIU等[16]描述的方法测定酸奶的流变特性,并稍作修改。测试温度保持在25 ℃,选择直径为40 mm的不锈钢板。在0.1~100 s-1 的剪切速率下进行静态流变分析,以分析表观黏度随剪切速率的变化。
1.3.8 酸奶质构特性测定
酸奶质构特性的测定按照FAN等[17]描述的方法进行,并稍作调整。采用P2探头对酸奶样品进行测试,下降速度1 mm/s,测试速度3 mm/s,探头返回速度3 mm/s,应变率为35%,下压距离为30 mm。
1.4 数据分析
采用Origin 2024软件进行数据处理和绘图。所有数据均以“平均值±标准差”表示,每个实验均进行3次重复。通过单因素方差分析(analysis of variance,ANOVA)和邓肯检验来确定统计意义(P<0.05)。
2 结果与分析
2.1 不同浓度PG对乳基蛋白水解能力的影响
基于OPA的分光光度法检测不同浓度PG作用于乳基后释放的游离氨基,从而表征蛋白质的水解活力。如图1所示,随着PG浓度的增加,乳基的蛋白水解能力增加;0.03、0.06、0.09、0.12 U/mL PG处理组的蛋白水解活力分别为0.83、1.06、1.20、1.28 mEq NH3/L,其水解活力显著高于对照组(0.51 mEq NH3/L)(P<0.05),表明PG可增加乳基中的蛋白水解。PG可以催化蛋白质,在谷氨酰胺残基处脱酰胺脱氨;在乳基中通过酪蛋白酶和乳清蛋白酶等进一步将混合物水解成多肽及氨基酸等;在这个过程中,PG不引起蛋白质水解或交联[18]。WU等[10]用0.03~0.12 U/mL PG对脱脂乳进行处理,发现蛋白质灰度值随着PG添加量的增加而增加,当PG含量达到0.12 U/mL时,α-酪蛋白的绝对灰度值是对照样品的6.92倍。PG可以将乳基中的乳蛋白降解为多肽和游离氨基酸等,这可能会提高乳基中蛋白质的利用率,发酵剂菌株可以利用这些化合物促进其自身的生长和代谢,产生的有机酸等代谢物影响着酸奶的发酵特性和品质。
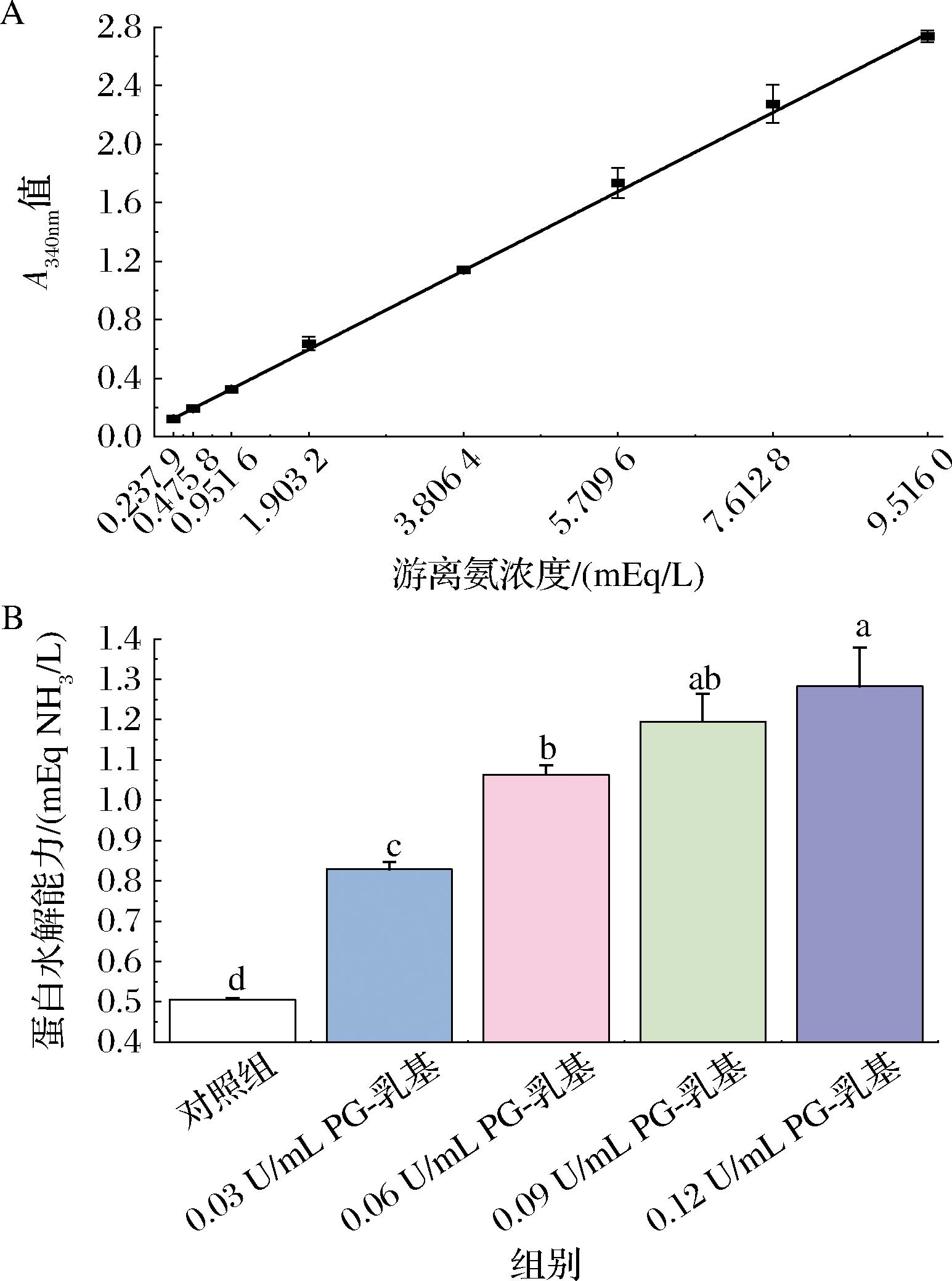
A-标准曲线;B-不同浓度乳基蛋白水解能力
图1 乳基的蛋白水解能力
Fig.1 Protein hydrolysis capacity of milk matrix
注:不同小写字母表示组间存在显著性差异(P<0.05)。
2.2 不同浓度PG对酸奶发酵特性的影响
发酵特性从根本上决定了酸奶的口感质地,是影响酸奶品质的重要因素。不同浓度PG的酸奶的酸度、pH、活菌数变化如图2所示,2 h的产酸速率无差异;2~6 h内,对照组和0.03 U/mL PG酸奶产酸速率大于其他3组;6~8 h,PG处理组和对照组的产酸速率无差异。0.03 U/mL PG处理组与对照组的酸度在7 h达到70 °T;然而,随着PG添加量从0.06 U/mL增加至0.12 U/mL后,延长了菌株的发酵时间,发酵终点延长至8 h。0.03 U/mL PG酸奶在发酵终点时其活菌数为9.15 lg CFU/mL,表明加入0.03 U/mL PG可以提高发酵剂菌株的生长(图2-C)。WU等[10]在YO-MIX 883发酵剂发酵的脱脂酸奶中添加0.03~0.12 U/mL的PG后,发酵时间均为6 h。然而,在相同的PG处理条件下,本研究结果显示大于0.03 U/mL PG 浓度下用HYY发酵剂发酵的酸奶延长了发酵时间,推迟1 h达到发酵终点。这表明PG处理对乳基发酵过程的影响可能与牛奶的营养成分和所使用的发酵剂菌株的特异性密切相关。发酵剂菌株可利用乳基中的营养物如乳蛋白质和碳水化合物等产生乳酸,引发pH的下降。有机酸是酸奶中酸度的主要来源,当pH值下降到4.6时,乳基中的酪蛋白胶束会解离重组并排列成三维网络结构,形成凝胶状即凝固酸奶。同时,酸度也是影响酸奶保质期的重要因素,持续增加的酸含量会引发贮藏期酸奶质构和感官的变化。
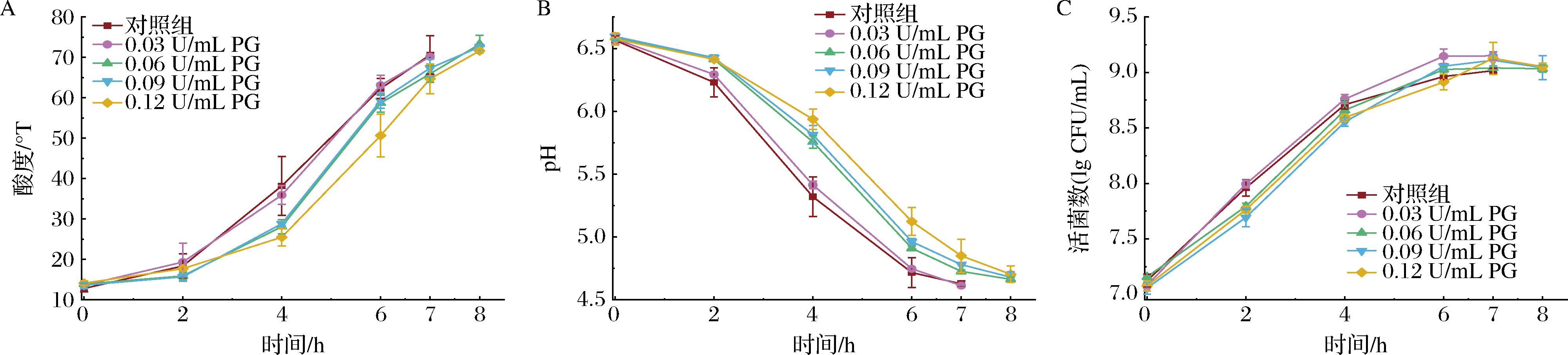
A-滴定酸度;B-pH;C-酸奶中发酵剂的活菌数
图2 酸奶的发酵特性结果
Fig.2 Results of fermentation characteristics of yogurt
2.3 不同浓度PG对酸奶贮藏特性的影响
酸奶在贮藏过程中,由于发酵剂菌株继续酸化糖产生乳酸,从而导致酸度逐渐上升,酸度的增加不仅影响了酸奶的风味和口感,还可能对其质地和营养成分产生影响[19]。不同浓度PG的酸奶在贮藏期内pH、酸度、活菌数变化如图3所示。随着贮藏时间的延长,酸奶可滴定酸度逐渐增加,pH呈相应的下降趋势;其中,0~7 d为酸度增加的主要时期,7~21 d酸度变化缓慢(图3-A、图3-B)。0.03 U/mL PG处理组在贮藏21 d时,酸度增加了6.24 °T,与对照组的酸度无显著性差异(4.1 °T)(P>0.05)(图3-A)。随着PG添加量从0.06增加至0.12 U/mL,其酸度分别增加了8.16、8.01、13.94 °T,极显著大于对照组的酸度(P<0.01)(图3-A)。PG处理组酸奶贮藏期的活菌数变化如图3-C所示,0.03 U/mL PG处理组在贮藏期21 d时,其活菌数为9.04 lg CFU/mL,显著高于对照组酸奶(P<0.05)。结果表明,适当的PG添加量不会引发酸度的显著增加,这种效应可能与 PG 处理后形成了新的缓冲对有关,有助于缓解后酸化[10]。然而当PG过量(>0.03 U/mL)添加时,会导致后酸化程度增加,保质期缩短并产生不良风味,引发消费者接受度的降低。
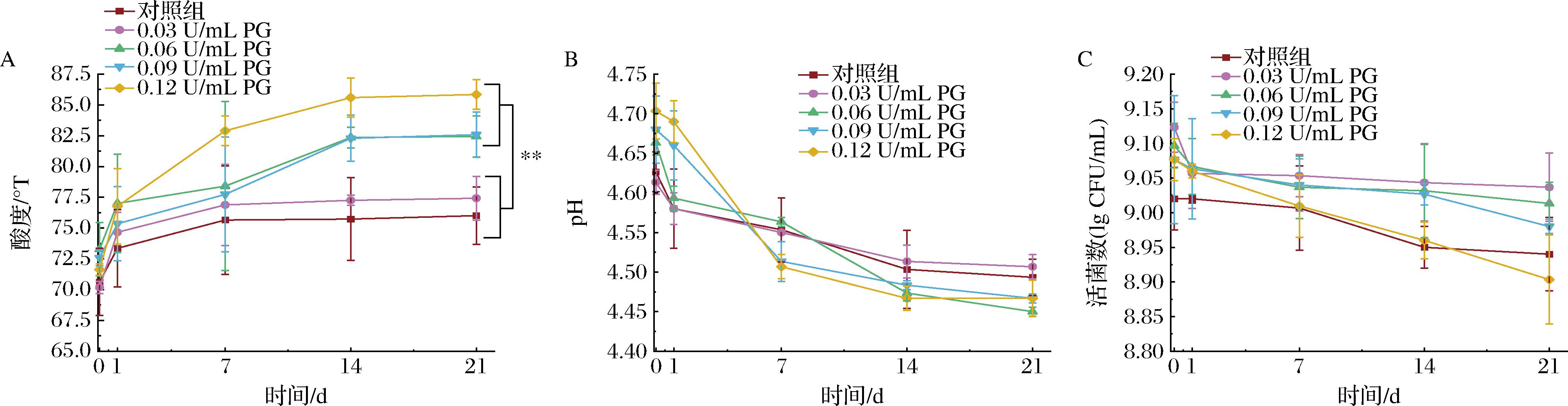
A-滴定酸度;B-pH;C-酸奶中发酵剂的活菌数
图3 酸奶贮藏期的产酸及活菌数结果
Fig.3 Results of acid production and viable bacterial counts during the shelf-life
注:**代表组间存在极显著差异(P<0.01)(下同)。
2.4 不同浓度PG对酸奶有机酸的影响
在发酵剂菌株产生的有机酸中,乳酸是影响后酸化的最直接物质。在贮藏期,菌株持续代谢乳糖并通过糖酵解途径分解为中间产物丙酮酸,在丙酮酸脱氢酶和乳酸脱氢酶等作用下分解为乳酸。乳糖的酵解和乳酸的生成是酸奶发酵的核心过程,也是酸奶具有酸味和独特口感的原因。酸奶样品中丙酮酸和乳酸含量变化如图4所示,在贮藏期间,不同浓度PG处理组的丙酮酸含量随贮藏时间的延长呈下降趋势,而乳酸含量呈上升趋势。在贮藏21 d时,对照组和PG处理组的酸奶中的丙酮酸含量分别为0.085、0.079、0.09、0.083、0.077 mg/g,5组酸奶间无显著性差异(P>0.05)(图4-A)。对照组和0.03 U/mL PG处理组乳酸含量分别为8.342、8.566 mg/g,2组间无显著性差异(P>0.05);然而,0.06~0.12 U/mL PG处理组乳酸含量分别为9.633、9.410、10.035 mg/g,其极显著高于对照组和0.03 U/mL PG处理组(P<0.000 1)(图4-B)。在酸奶中添加高浓度(>0.03 U/mL)PG水解蛋白质能力增加,生成的氨基酸及其衍生物含量或种类更丰富,这可能为发酵剂菌株(唾液链球菌嗜热亚种和德氏乳杆菌保加利亚亚种)提供大量氮源促进其生长,菌株代谢进入糖酵解途径将丙酮酸持续转化乳酸,导致乳酸不断积累[20]。
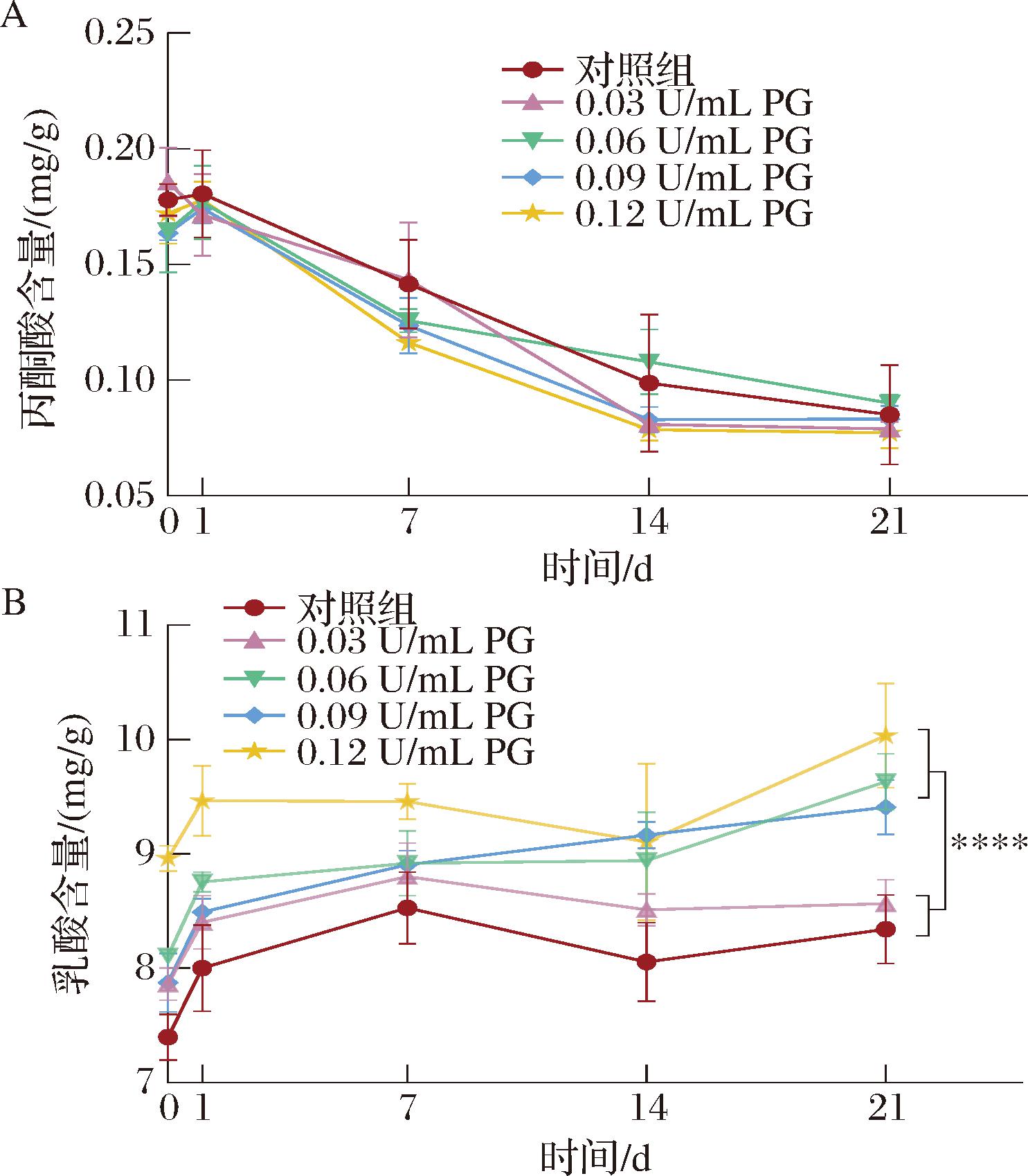
A-丙酮酸含量;B-乳酸含量
图4 贮藏期酸奶有机酸含量变化
Fig.4 Changes in the organic acid content during the shelf-life
注:****代表组间存在极显著差异(P<0.000 1)(下同)。
2.5 不同浓度PG对酸奶持水力的影响
酸奶的持水力是反映酸奶组织状态和稳定性的重要因素,主要与酸奶的凝胶结构有关[21]。不同浓度PG处理组的酸奶持水力如图5-A所示。与对照组(77.9%)相比,随着PG添加量的增加,酸奶的持水力显著增加(P<0.05);其中PG处理组酸奶的持水力分别为83.2%、84.2%、86.5%和89.5%。添加0.03 U/mL的PG可以使酸奶的持水力提高5.3%。PG的脱酰胺作用导致无序亚胶束的形成,改变蛋白质间的相互作用并导致脱水收缩的减少,酸奶内部蛋白质网络孔径减小,导致酪蛋白凝胶的渗透性受限和持水力提高,形成凝胶网络结构致密的凝固型酸奶[22]。
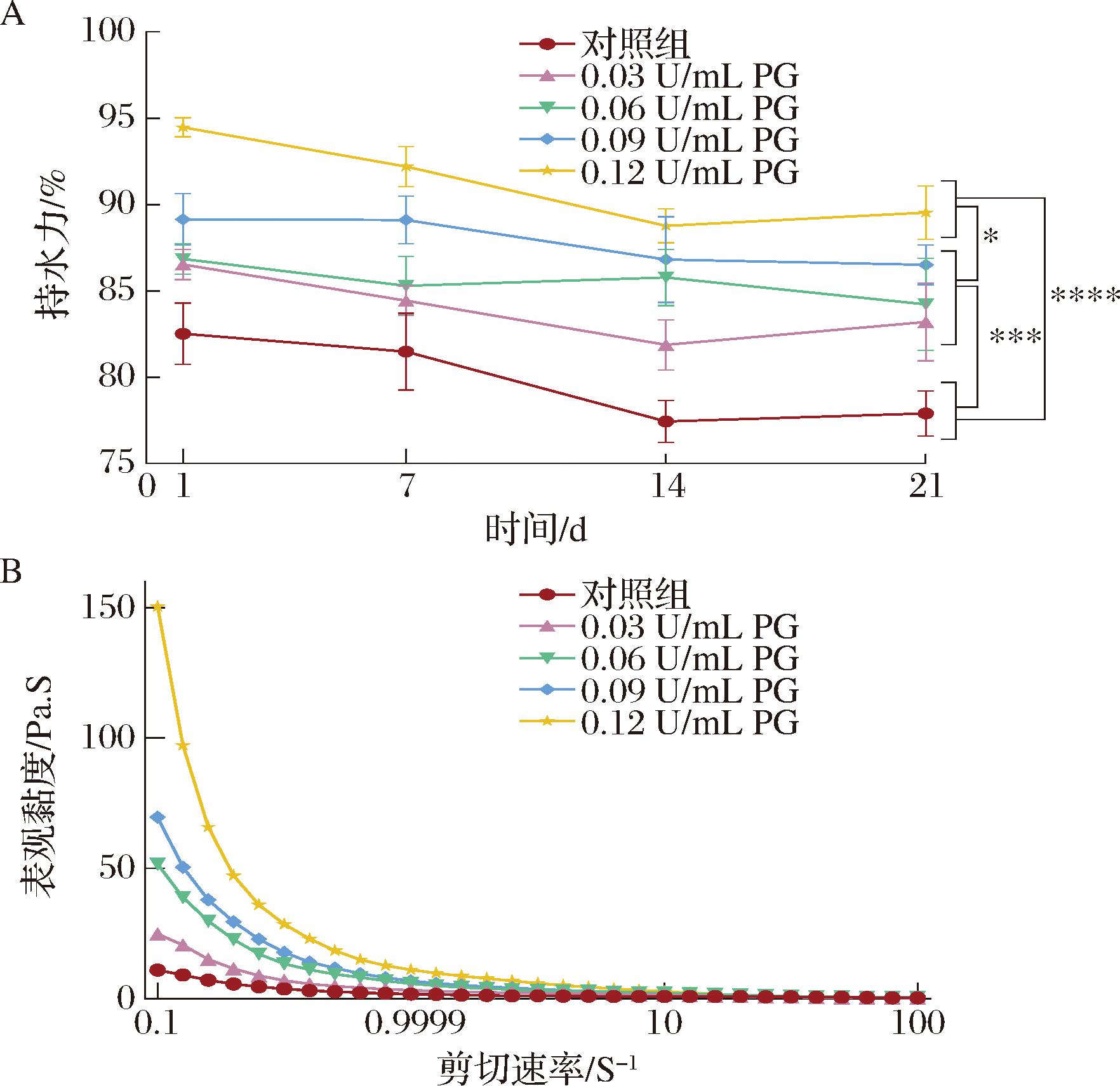
A-持水力;B-表观黏度
图5 酸奶的持水力和表观黏度
Fig.5 Water holding capacity and apparent viscosity of yogurt
注:*代表不同组间存在显著差异(P<0.05);***代表不同组间存在极显著差异(P<0.001)。
2.6 不同浓度PG对酸奶表观黏度的影响
黏度是反映酸奶的组织状态和口感的重要指标之一。不同浓度PG处理组的酸奶表观黏度如图5-B所示,在贮藏期,随着PG添加量的增加,所有酸奶样品均随着剪切速率的增加黏度呈现下降趋势;PG处理组表观黏度均高于对照组,表明经过PG处理的牛奶样品的凝胶网络在剪切作用下破坏程度变小。随着剪切速率的增加,酸奶中分子的运动逐渐朝着稳定的方向,表观黏度趋于平稳[23]。
2.7 不同浓度PG对酸奶质构特性的影响
酸奶的质构特性测定可以反映酸奶的口感和质量稳定指标,反映酸奶的凝胶强弱、内部紧实程度。不同浓度PG处理组的酸奶硬度、胶着性、黏附力、咀嚼性结果如图6所示,胶着性、咀嚼性、黏附力、硬度均随着贮藏时间的延长呈现下降趋势;PG处理组的硬度、胶着性、咀嚼性、黏附力均显著高于对照组(P<0.05)。0.03 U/mL PG处理组酸奶在0 d的硬度、胶着性和咀嚼性均高于其他PG处理组。贮藏21 d 时,0.03 U/mL PG处理组酸奶的硬度和黏附力高于其他PG处理组;0.06 U/mL PG处理组酸奶的胶着性和咀嚼性高于其他PG处理组,表明0.03~0.06 U/mL的PG添加量可在贮藏期改善酸奶质构。酸奶的硬度直接反映其凝胶状态,硬度越大,酸奶的凝固性越好[24]。0.03 U/mL PG处理组酸奶硬度较高可能是由于酪蛋白胶束和脂肪球之间的相互作用发生了改变。PG的脱酰胺过程可能会增加酪蛋白胶束的总表面积,促进脂肪球的吸收,从而使凝胶结构更加紧密,提高酸奶的硬度[8]。然而,当PG的用量超过0.03 U/mL,PG诱导的反应会导致酪蛋白大量脱氨基。这一过程导致羧酸基团数量增加,增大了静电排斥力。酪蛋白胶束的聚集能力减弱,最终导致酸奶硬度降低[25]。

A-硬度;B-胶着性;C-黏附力;D-咀嚼性
图6 贮藏期酸奶的质构特性结果
Fig.6 Results of textural properties during the shelf-life
3 结论与讨论
本研究采用0.03~0.12 U/mL PG处理乳基,发现随着PG浓度增加,乳基质蛋白水解能力增加。经过直投式发酵剂HYY获得的酸奶,其中0.03 U/mL PG处理酸奶可以促进发酵剂菌株的生长,且在贮藏21 d时,后酸化程度最低;同时,添加PG可增加酸奶持水力、表观黏度、硬度和黏附力,使酸奶表现出更高的质构特性。以上结果表明,PG可以改善酸奶的后酸化,并且可以不同程度地改善酸奶持水力、表观黏度和质构特性。综上所述,本研究不仅为生产高品质酸奶提供了科学依据,而且突显了PG作为一种功能性添加剂在食品工业中的广泛应用潜力,也为PG在食品加工和配方开发中的推广应用奠定了基础。
[1] DOS SANTOS CAMPOS D C, NEVES L T B C, FLACH A, et al. Post-acidification and evaluation of anthocyanins stability and antioxidan activity in açai fermented milk and yogurts (Euterpe oleracea Mart.)[J]. Revista Brasileira de Fruticultura, 2017, 39(5). DOI:10.1590/0100-29452017871.
[2] FREITAS M. The Microbiota in Gastrointestinal Pathophysiology[M]. New York: The Dannon Company, 2017: 209-223.
[3] 王成凤, 李柏良, 岳莹雪, 等. 弱后酸化保加利亚乳杆菌KLDS1.1011的筛选及其全基因组注释研究[J]. 食品工业科技, 2021, 42(6): 103-110.WANG C F, LI B L, YUE Y X, et al. Screening of a weakly post-acidified Lactobacillus bulgaricus KLDS1.1011 and its genome-wide annotation[J]. Science and Technology of Food Industry, 2021, 42(6): 103-110.
[4] TRIBST A A L, RIBEIRO L R, DE CASTRO LEITE B R Jr, et al. Fermentation profile and characteristics of yoghurt manufactured from frozen sheep milk[J]. International Dairy Journal, 2018, 78:36-45.
[5] MIWA N, YOKOYAMA K, NIO N, et al. Effect of enzymatic deamidation on the heat-induced conformational changes in whey protein isolate and its relation to gel properties[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9):2205-2212.
[6] YAMAGUCHI S, YOKOE M. A novel protein-deamidating enzyme from Chryseobacterium proteolyticum sp. nov., a newly isolated bacterium from soil[J]. Applied and Environmental Microbiology, 2000, 66(8):3337-3343.
[7] SAKAI K, SATO Y, OKADA M, et al. Enhanced activity and stability of protein-glutaminase by Hofmeister effects[J]. Molecular Catalysis, 2022, 517:112054.
[8] MIWA N, YOKOYAMA K, WAKABAYASHI H, et al. Effect of deamidation by protein-glutaminase on physicochemical and functional properties of skim milk[J]. International Dairy Journal, 2010, 20(6):393-399.
[9] MIWA N, NIO N, SONOMOTO K. Effect of enzymatic deamidation by protein-glutaminase on the textural and microstructural properties of set yoghurt[J]. International Dairy Journal, 2014, 36(1):1-5.
[10] WU J J, DAI T, LIN R Y, et al. Effect of protein-glutaminase on the texture, rheology, microstructure and sensory properties of skimmed set-type yoghurt[J]. Food Chemistry, 2023, 429:136831.
[11] GARC A-G
A-G MEZ B, ROMERO-RODR
MEZ B, ROMERO-RODR GUEZ
GUEZ  , V
, V ZQUEZ-ODÉRIZ L, et al. Sensory evaluation of low-fat yoghurt produced with microbial transglutaminase and comparison with physicochemical evaluation[J]. Journal of the Science of Food and Agriculture, 2019, 99(5):2088-2095.
ZQUEZ-ODÉRIZ L, et al. Sensory evaluation of low-fat yoghurt produced with microbial transglutaminase and comparison with physicochemical evaluation[J]. Journal of the Science of Food and Agriculture, 2019, 99(5):2088-2095.
[12] JIA R, CHEN H, CHEN H, et al. Effects of fermentation with Lactobacillus rhamnosus GG on product quality and fatty acids of goat milk yogurt[J]. Journal of Dairy Science, 2016, 99(1):221-227.
[13] PENG C T, YAO G Q, SUN Y R, et al. Comparative effects of the single and binary probiotics of Lacticaseibacillus casei Zhang and Bifidobacterium lactis V9 on the growth and metabolomic profiles in yogurts[J]. Food Research International, 2022, 152:110603.
[14] SHAH N, RAVULA R. Influence of water activity on fermentation, organic acids production and viability of yogurt and probiotic bacteria[J]. Australian Journal of Dairy Technology, 2000, 55(3): 127-131.
[15] DELIKANLI B, OZCAN T. Improving the textural properties of yogurt fortified with milk proteins: Textural properties of yogurt[J]. Journal of Food Processing and Preservation, 2017, 41(5): e13101.
[16] LIU W, GAO H X, MCCLEMENTS D J, et al. Stability, rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J]. Food Hydrocolloids, 2019, 88:210-217.
[17] FAN X K, DU L H, XU J, et al. Effect of single probiotics Lacticaseibacillus casei CGMCC1.5956 and Levilactobacillus brevis CGMCC1.5954 and their combination on the quality of yogurt as fermented milk[J]. LWT, 2022, 163:113530.
[18] YAMAGUCHI S, JEENES D J, ARCHER D B. Protein-glutaminase from Chryseobacterium proteolyticum, an enzyme that deamidates glutaminyl residues in proteins: Purification, characterization and gene cloning[J]. European Journal of Biochemistry, 2001, 268(5):1410-1421.
[19] SHORI A B, ALJOHANI G S, AL-ZAHRANI A J, et al. Viability of probiotics and antioxidant activity of cashew milk-based yogurt fermented with selected strains of probiotic Lactobacillus spp[J]. LWT, 2022, 153:112482.
[20] BAI M, YANG S J, ZHAO Q, et al. Fermentation characteristics of Lactobacillus delbrueckii subsp. bulgaricus T50 and Streptococcus thermophilus S10 complex starter: Enhancing fermentation performance, metabolic interaction, and storage stability[J]. LWT, 2024, 208:116716.
[21] 林楠, 李珉梦, 王新慧, 等. 玉木耳多糖发酵酸奶的研制及工艺优化[J]. 食品工业科技, 2024, 45(20): 177-186.LIN N, LI M M, WANG X H, et al. Development and process optimization of Auricularia cornea var. Li. polysaccharides yoghur[J]. Science and Technology of Food Industry, 2024, 45(20): 177-186.
[22] KHUBBER S, CHATURVEDI K, THAKUR N, et al. Low-methoxyl pectin stabilizes low-fat set yoghurt and improves their physicochemical properties, rheology, microstructure and sensory liking[J]. Food Hydrocolloids, 2021, 111:106240.
[23] 尹新雅, 李梦瑶, 李呵呵, 等. 蛋白谷氨酰胺酶与发酵剂对核桃酸奶品质的影响[J]. 食品工业科技, 2024, 45(18): 128-137. YIN X Y, LI M Y, LI H H, et al. Effect of protein-glutaminase and starter cultures on the quality of walnut-based yogurt[J]. Science and Technology of Food Industry, 2024, 45(18): 128-137.
[24] FENG C J, WANG B N, ZHAO A Q, et al. Quality characteristics and antioxidant activities of goat milk yogurt with added jujube pulp[J]. Food Chemistry, 2019, 277:238-245.
[25] DESHWAL G K, TIWARI S, KUMAR A, et al. Review on factors affecting and control of post-acidification in yoghurt and related products[J]. Trends in Food Science &Technology, 2021, 109:499-512.