近年来,随着经济快速发展和人民生活水平提高,人们生活方式和饮食习惯也发生了改变,大量高嘌呤和高蛋白食物的摄入,导致高尿酸血症呈现明显上升和年轻化趋势[1-2]。高尿酸血症是一种由于尿酸生成过多或排泄减少而导致血液中尿酸水平升高的代谢性疾病,其与多种疾病如痛风、心血管疾病、肾脏疾病等密切相关[3-5]。目前用于治疗高尿酸血症的药物大多存在毒副作用大、患者耐受性差的缺点[6-7],随着人们对健康的关注度不断提高,寻找安全有效的降尿酸方法成为研究热点和必然趋势。
乳酸菌作为一类常见的益生菌,因其对人体健康的诸多有益作用而受到广泛关注[8-9]。随着对乳酸菌益生功能研究的深入,越来越多的研究证实乳酸菌在调节尿酸代谢方面发挥重要作用,其在预防和治疗高尿酸血症及其相关疾病方面具有广阔的应用前景[10]。本文基于大量研究报道,结合尿酸在人体的形成和代谢途径,总结了乳酸菌对尿酸代谢的影响,介绍了其降尿酸的作用机制,以期为今后利用乳酸菌作为天然、安全的生物调节剂治疗高尿酸血症提供理论基础。
1 尿酸代谢机制与生理作用
1.1 尿酸在人体的形成与代谢机制
尿酸是人体内嘌呤代谢的终产物[11],嘌呤的来源分为内源性和外源性,其中内源性占80%,主要是机体内细胞死亡后细胞内的DNA和RNA分解生成,以腺嘌呤和鸟嘌呤为主;外源性主要是从食物中摄取,占20%[12]。如图1所示,内源性和外源性的核酸,在核酸酶的作用下被水解为腺苷一磷酸(adenosine monophosphate, AMP)和鸟苷一磷酸(guanosine monophosphate, GMP),AMP、GMP与肌苷一磷酸(inosine monophosphate, IMP)间可以相互转化,其中IMP是头合成途径中由5-磷酸核糖在磷酸核糖焦磷酸(phosphoribosyl pyrophosphate, PRPP)合成酶等一系列酶的作用下生成。AMP在5′核苷酸酶(5′nucleotidase, 5′NT)的作用下转化为腺苷,腺苷通过2种不同的机制转化为次黄嘌呤;首先通过腺苷脱氨酶(adenosine deaminase, ADA)去除氨基以形成肌苷,然后在嘌呤核苷磷酸化酶(purine nucleoside phosphorylase, PNP)的作用下形成次黄嘌呤;或者首先通过PNP形成腺嘌呤,再在腺嘌呤脱氨酶作用下转化为次黄嘌呤;次黄嘌呤被黄嘌呤氧化酶(xanthine oxidase, XOD)氧化形成黄嘌呤。IMP可在5′NT的作用下形成肌苷,并在PNP作用下转变为次黄嘌呤。GMP通过核苷酸酶转化为鸟苷,鸟苷进一步在PNP作用下转化为鸟嘌呤,随后鸟嘌呤通过鸟嘌呤脱氨酶(guanine deaminase, GDA)脱氨基形成黄嘌呤。形成的黄嘌呤再次被XOD氧化形成最终产物尿酸,再通过肾脏或肠道排出体外。[2,6,11]。
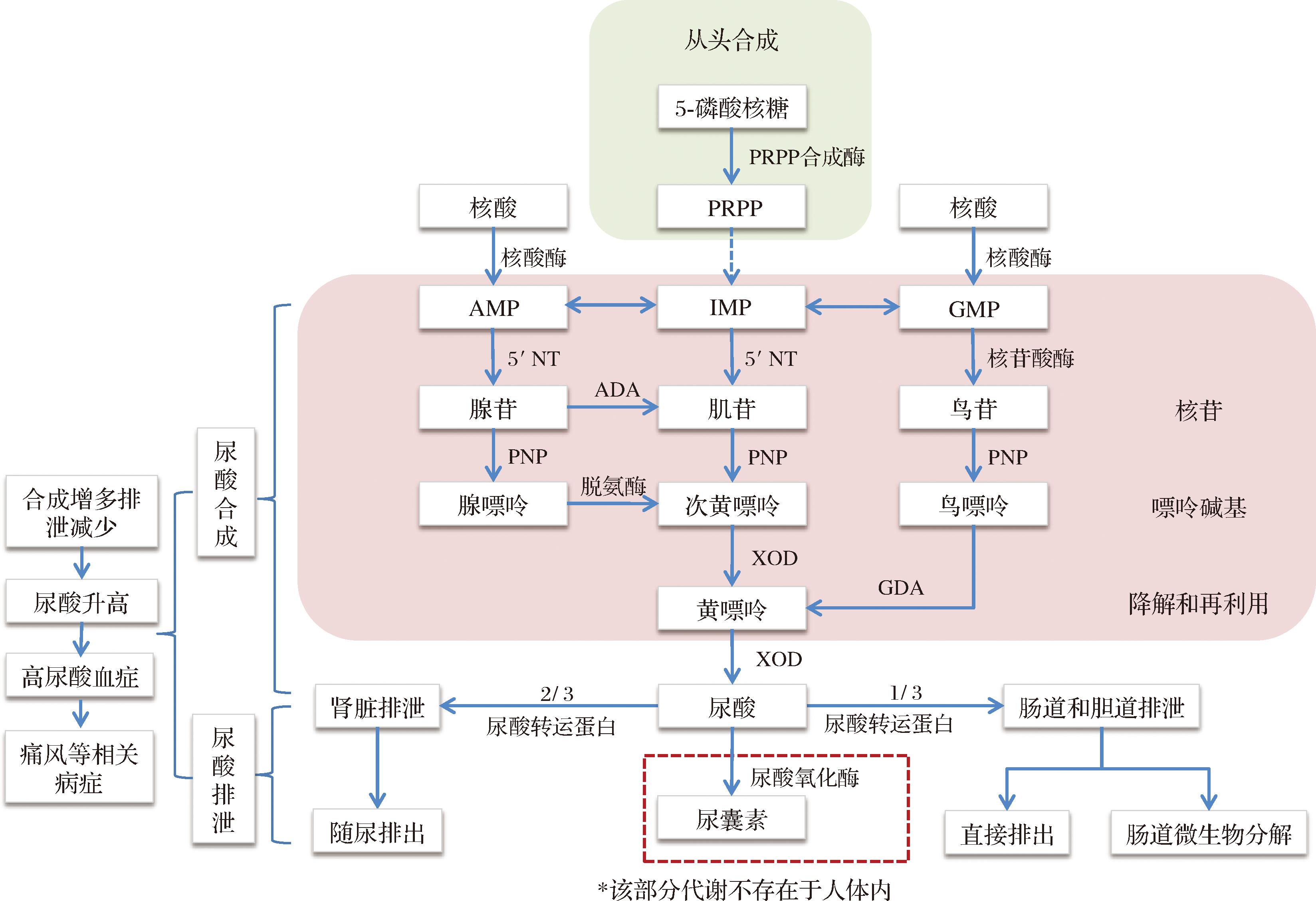
图1 尿酸的形成与代谢途径
Fig.1 Formation and metabolic pathways of uric acid
人体生成的尿酸在尿酸转运蛋白的作用下通过肾脏和肠道排泄出体外,以维持体内尿酸水平的平衡[13]。如表1所示,尿酸转运蛋白分尿酸重吸收转运蛋白和尿酸分泌蛋白,广泛分布于肝脏、肾脏、肠道等组织中,共同维持尿酸重吸收和分泌动态平衡。肾脏是维持机体循环尿酸水平的重要调节者,2/3的尿酸通过肾脏随尿排出体外[14]。1/3的尿酸通过肠道或胆道排泄,其中一部分随粪便直接排出,一部分被肠道微生物分解后排出[15];在肾功能出现问题时,该途径是尿酸代谢的主要途径[16]。在大部分生物体内,尿酸还可以在尿酸氧化酶的作用下转化为可溶性尿囊素,但人类在进化过程中尿酸酶基因突变失活,人体无法合成尿酸氧化酶,不能通过此途径代谢尿酸[17-18]。故而,肾脏或肠道功能紊乱导致尿酸排泄障碍是90%患者出现高尿酸血症的关键因素[1]。
表1 尿酸转运蛋白[14,16,19-23]
Table 1 Uric acid transporters

尿酸转运蛋白分类编码基因主要分布功能特点尿酸重吸收转运蛋白尿酸盐阴离子转运体1(urate anion transporter 1,URAT1)SLC22A12位于近端小管的上皮细胞管腔侧或腔膜侧、基底膜外侧通过介导管腔内的尿酸与近曲小管上皮细胞内阴离子交换从而将尿酸从管腔内重吸收至上皮细胞内,是尿酸盐转运与重吸收的主要载体,约占肾脏尿酸重吸收蛋白的90%葡萄糖转运体9(glucose transporter 9,GLUT9)SLC2A9主要在肾脏和肝脏表达,位于肾近端小管细胞基底膜和管腔侧膜将被吸收入肾小管上皮细胞内的尿酸转运入肾间质中,是尿酸从细胞内到细胞外的关键转运体有机阴离子转运体4(organic anion transporter 4,OAT4)SLC22A11位于在肾小管上皮细胞的顶端转运尿酸盐与α-酮戊二酸或羟基离子之间的交换完成重吸收尿酸分泌蛋白有机阴离子转运体家族蛋白(organic aniontransport-er 1/3,OAT1/3)SLC22A6/SLC22A8主要表达于肝脏、肾脏、眼及脑组织,在肾脏中的表达量最大,主要位于近端小管上皮细胞膜的基底外侧与有机阴离子结合,将管周隙的有机阴离子通过基底膜转运到近曲肾小管上皮细胞中,逆浓度梯度和电梯度而主动转运,其供能来源于Na+浓度梯度并依赖二羧酸的顺向抑制和反向刺激过程尿酸盐转运体(urate trans-porter,UAT)SLC22A12各种组织,主要表达于上皮源性细胞,在肾脏表达最丰富,在肾脏仅位于近端小管曲段和升段通过高度选择性的离子通道,将尿酸盐分泌到管腔中,再经肾脏排出体外,进入肾近端小管的尿酸盐50%由其介导分泌入管腔三磷酸腺苷结合盒转运蛋白G2(adenosine triphos-phate binding cassette transporter G member 2,ABCG2)ABCG2小肠、肝、肾等组织的上皮细胞顶膜,肾脏中主要表达于近端小管上皮细胞顶膜既在肾内参与尿酸盐的分泌,又在肾外调节尿酸水平,是同时介导肠-肾双重尿酸排泄途径的重要转运体,也是肠道介导尿酸排泄的主要转运蛋白多药耐药蛋白4(multidrug resistance protein 4,MRP4)ABCC4前列腺、睾丸、卵巢、肺、肝细胞、小肠、胰等组织,肾脏中表达位于近端小管通过正向协同机制介导ATP依赖性尿酸盐转运,其位于肾近端小管顶膜参与肾尿酸的分泌,促进尿酸从细胞排入肾小管腔;位于肝基底膜则参与尿酸从血液循环到肝的转运磷酸盐转运蛋白(Na+/phosphate transporter 1/4,NPT1/NPT4)SLC17A在肝脏、肾脏、脑组织均有表达,主要位于肾近曲小管上皮细胞顶膜能够对尿酸进行电压敏感运输,介导上皮细胞分泌尿酸盐至肾近曲小管腔
1.2 尿酸的生理功能与高尿酸血症
尿酸作为机体内重要的代谢物参与各种生理过程,生理浓度范围的尿酸能够维持机体正常的生理状态。尿酸是人体内重要的内源性抗氧化剂,通过清除氧自由基发挥抗氧化应激作用,为机体提供有益的微环境,保护神经元、防止脂质过氧化、减少炎症反应,保护细胞和组织不受损伤,同时也能起到抗衰老的作用[24-25]。在中枢神经系统炎症反应过程中,一定浓度的尿酸可以改善血脑屏障的完整性,降低通透性,阻止炎症细胞通过,减轻脑膜炎症反应、颅内压升高的症状[24]。有研究表明,一些动物在低盐饮食的情况下,其血液的高尿酸水平会产生高盐敏感性,从而诱发肾小球血管病变增加血管压力,同时体内一定的尿酸水平还可以保持血管弹性,所以有维持血压的作用[18,26]。尿酸本身还可以激活多种细胞内信号通路产生炎症因子等促进免疫应答。SHI等[27]研究发现,当机体被感染而受损时,受损细胞会释放尿酸作为主要内源性危险信号;尿酸能够刺激树突状细胞成熟,显著增强CD8+ T细胞的应答。
当人体尿酸生成过多或排泄减少时,就会导致血液中尿酸浓度升高,引发高尿酸血症。高尿酸血症已成为继糖尿病之后的第二大代谢性疾病,且与神经系统、呼吸系统、泌尿系统等多系统疾病存在明显关联,严重威胁人类健康[1]。有研究表明,痛风性关节炎与高尿酸血症密切相关,高血尿酸是其发生的重要生化基础,严重时可导致关节畸形、功能障碍[3,28]。高尿酸血症还会导致直接性或间接性的肾脏损伤,引起肾小管萎缩、间质纤维化等病理改变,逐渐影响肾脏的正常功能,严重时可导致肾功能衰竭[29]。近年来研究还发现高尿酸血症是高血压的独立危险因素,高尿酸患者中高血压的比例达到30%[30-31];当体内尿酸长期处于过高水平时表现为促氧化特性,可能发挥神经毒性作用,加速心脑血管疾病发生[24];高尿酸血症会增加人患糖尿病的风险[32],还与多种呼吸系统疾病密切相关,甚至参与疾病发病[33]。
2 乳酸菌调节尿酸代谢作用机制
2.1 抑制尿酸生成
黄嘌呤氧化酶是尿酸生成过程中的关键酶,降低其含量和活性可以有效地降低尿酸的生成量。如图2所示,乳酸菌可能通过降低黄嘌呤氧化酶的含量和活性,减少尿酸的生成[6,34]。如朱坤鹏[35]从健康雏鹅的盲肠内容物中分离出一株唾液联合乳杆菌R12,用其对高蛋白饮食进行干预测试,结果发现唾液联合乳杆菌R12可以显著降低雏鹅肝脏中因高蛋白饮食引起的XOD转录增加,使其维持在与正常蛋白饮食相近的水平,确保体内尿酸不会短时间内大量生成。研究显示,短链脂肪酸可以很好地抑制XOD活性[36],乳酸菌可能通过短链脂肪酸依赖机制来抑制XOD活性。王垚[37]从健康人群肠道、发酵食品中筛选出6株乳酸菌,其发酵液对XOD的抑制率均大于90%,且发酵液对XOD的抑制率与乳酸和乙酸的含量呈显著正相关。NI等[38]通过建立高尿酸血症小鼠模型测试发现,鼠李糖乳酪杆菌R31、鼠李糖乳酪杆菌R28-1和罗伊氏粘液乳杆菌L20M3能够有效降低小鼠血清和肝脏中XOD活性,其抑制能力与短链脂肪酸的产生具有明显相关性。
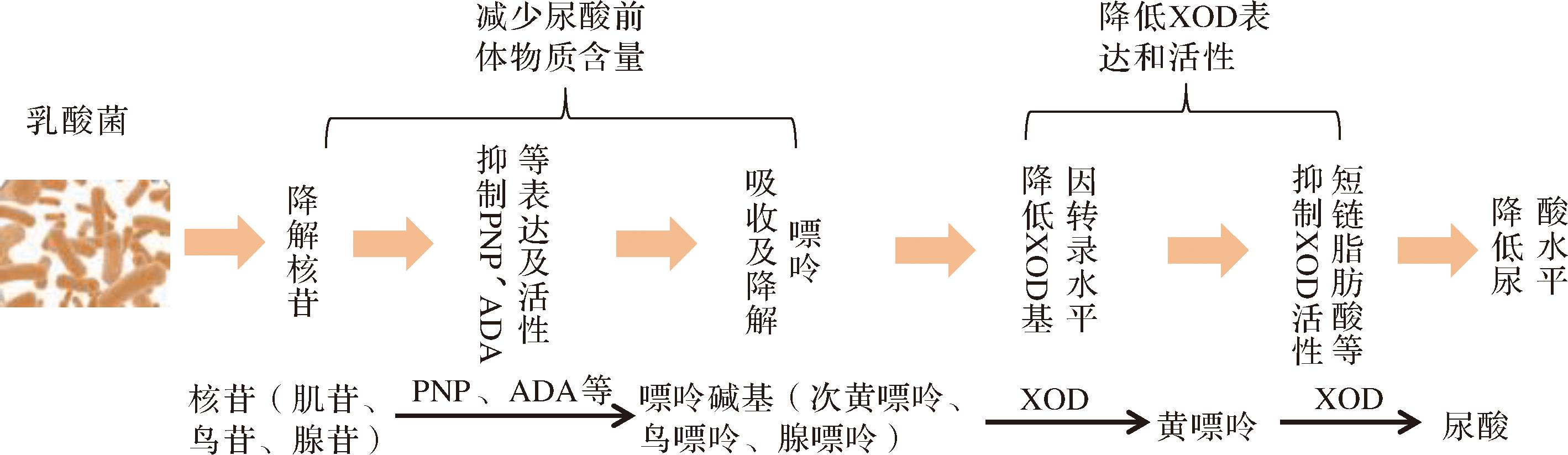
图2 乳酸菌抑制尿酸生成作用机制
Fig.2 Mechanism of lactic acid bacteria inhibiting uric acid production
有研究显示,一些乳酸菌还可以通过影响嘌呤的代谢通路,减少尿酸的前体物质含量,从而降低尿酸的水平。如李杰等[39]利用高效液相色谱法(high performance liquid chromatography, HPLC)从东北传统发酵大酱以及朝鲜族农家自制泡菜中共分离了18株对核苷的降解率达到50%以上的乳酸菌,其中植物乳植杆菌TY-S8对肌苷和鸟苷的降解率均可达99.33%。操俊[40]筛选出2株植物乳植杆菌,在体外实验中对核苷和嘌呤均有很好的降解作用,对腺苷、肌苷的转化率达到99%以上,对总嘌呤的降解率达到35%以上;进一步通过体外细胞实验,发现植物乳植杆菌LTJ1和LTJ48可以下调高尿酸模型HepG2细胞中尿酸生成关键酶PNP、ADA基因表达量并抑制ADA活性,从而减少尿酸生成。苗超等[41]对筛选出具有较高降尿酸作用的鼠李糖乳酪杆菌JY027进行全基因测序分析,发现该菌株含有多个尿酸代谢相关的基因,如次黄嘌呤核苷酸脱氢酶等,可减少黄嘌呤的含量从而抑制尿酸生成。王诗琪等[42]对2株能降低肉制品中嘌呤和尿酸含量的乳酸菌植物乳植杆菌X3-2B、戊糖片球菌37X-3研究发现,该2株菌可能是通过细胞壁表面的肽聚糖等成分吸附尿酸与嘌呤类物质,从而降低尿酸含量。
2.2 促进尿酸排泄
尿酸在人体的排泄主要依靠尿酸转运蛋白,如图2和图3所示,乳酸菌可以调节尿酸转让蛋白的表达量影响尿酸的排泄和重吸收,从而调节尿酸浓度。操俊[40]通过构建高尿酸血症小鼠模型检测植物乳植杆菌LTJ1和LTJ48对高尿酸小鼠的影响,实验结果显示,LTJ1和LTJ48能够下调高尿酸小鼠肾、肠中URAT1和GLUT9的表达量,上调肠道内ABCG2基因表达量,减少尿酸重吸收并增加尿酸排泄来降低血尿酸水平。董升辉[43]利用布氏乳杆菌ZD62、发酵粘液乳杆菌ZD103对高尿酸血症模型小鼠进行干预治疗,发现高尿酸血症模型小鼠肠道和肾脏中ABCG2基因的表达量显著上调,有效改善小鼠尿酸排泄状况。

图3 乳酸菌通过肾脏和肠道促进尿酸排泄作用机制
Fig.3 The mechanism by which lactic acid bacteria promote uric acid excretion through the kidneys and intestines
部分研究结果还显示,乳酸菌具有吸附和分解尿酸的能力,从而直接降低尿酸水平。如李婧[44]对筛选出的5株降尿酸能力较强的乳杆菌进行体外实验,通过原生质体和扫描电镜实验发现,5株乳杆菌主要是通过细胞膜对尿酸的吸附作用来达到降低尿酸的效果。WU等[45]从发酵食品中筛选出一株发酵乳酸杆菌JL-3,体外实验结果显示对尿酸具有较高的降解能力,构建小鼠模型进一步测试显示,发酵乳酸杆菌JL-3能够定植于小鼠肠道,显著降低小鼠尿液中尿酸水平。
2.3 调节肠道菌群平衡
人体中约1/3的尿酸通过肠道排泄,尿酸分泌到肠道后,可被肠道微生物群分解代谢。肠道微生物与人体互利共生,在调节人体免疫系统、稳定肠道微环境、调节代谢等方面发挥着重大作用。肠道菌群可参与嘌呤的代谢和尿酸的分解,如吸收尿酸和嘌呤类物质用于自身的生长繁殖,肠道中部分细菌还具有尿酸酶、尿囊酶等分解尿酸的相关酶,可以将尿酸代谢为高溶于水中的物质从而排出体外[46],在尿酸代谢中起着重要作用。
近年来,已经有大量研究证实肠道菌群组成和丰度与高尿酸血症存在相关性。高尿酸血症患者往往存在肠道屏障功能障碍,其肠道菌群种类及丰度发生变化甚至紊乱。乳酸菌可以通过竞争定植位点、产生抗菌物质等方式抑制有害菌的生长,从而改善肠道微生态环境,增强肠道屏障功能,维持肠道菌群的平衡,间接调节尿酸代谢[47-48]。蚁硕钊[46]通过高通量测序对高尿酸血症患者和正常志愿者的肠道菌群结构差异进行分析发现,高尿酸血症人群肠道菌群的多样性和丰度与正常人存在显著差异,其链球菌属、乳酸杆菌属等有益菌属丰度显著低于正常人群;进一步构建高尿酸大鼠模型,通过体内实验研究具有降尿酸功能的发酵粘液乳杆菌SM13-1与短乳杆菌SR52-2对肠道菌群的影响发现,菌株SM13-1和SR52-2可以改善高尿酸血症大鼠的肠道菌群失衡,使其肠道菌群更接近于正常大鼠肠道菌群,显著提高乳酸杆菌属、梭菌属、双歧杆菌属等在高尿酸血症大鼠中显著降低的有益菌属,减少丹毒荚膜菌属等在高尿酸血症大鼠中显著提高的菌属,恢复高尿酸血症大鼠肠道菌群。
还有研究显示乳酸菌可以影响肠道中短链脂肪酸产生菌的丰度,促进短链脂肪酸的产生,来降低尿酸浓度[40]。肠道微生物对糖类等物质进行酶解后产生的短链脂肪酸,不仅能抑制XOD活性,还能为肠道内尿酸的排泄提供能量[49],从而起到降低尿酸的效果。倪彩新[36]分析高尿酸血症小鼠的肠道菌群和短链脂肪酸浓度的变化发现,具有缓解高尿酸血症功能的乳杆菌能够显著提高高尿酸血症小鼠盲肠内容物中乳杆菌属、产短链脂肪酸菌群的丰度和短链脂肪酸的浓度,小鼠血尿酸水平、XOD活性与产短链脂肪酸菌群丰度、短链脂肪酸浓度具有强相关性,推测乳杆菌通过影响肠道内产短链脂肪酸相关菌群的丰度水平,促进大肠中短链脂肪酸水平的提高,从而抑制XOD活性,进而缓解高尿酸血症。徐进[47]通过16S高通量测序及生信分析和短链脂肪酸的测定结果,探究具有降尿酸功能的植物乳植杆菌NCUF201.1干预前后高尿酸模型小鼠肠道菌群及环境的变化发现,乳酸菌干预后小鼠肠道菌群的丰富度、多样性和均匀度得以恢复,肠道菌群更加稳定;小鼠肠道中胃瘤胃球菌属(Ruminococcus)等短链脂肪酸产生菌的丰度在乳酸菌干预组小鼠中明显增多,乙酸、丙酸、丁酸、异丁酸等短链脂肪酸的含量明显增多,与健康小鼠更相似。
2.4 调节机体免疫
当血尿酸浓度超过其溶解度后,形成的尿酸盐结晶沉积在关节、肾脏等组织中引发炎症反应,伴随大量的炎症因子释放,造成组织细胞损伤加重。尿酸代谢过程还参与了多种疾病的慢性炎症反应,免疫细胞识别尿酸钠晶体或血液中的其他致炎因子,如内毒素等后,会通过丝裂原活化蛋白激酶(mitogen-activated protein kinase, AMPK)、核因子-κB(nuclear factor kappa-B, NF-κB)、核苷酸结合寡聚化域样受体3(NOD-like receptor protein 3, NLRP3)、Toll样受体(toll-like receptor, TLRs)等多种信号通路转导途径,诱发细胞释放如IL-1β、IL-6等多种炎性细胞因子,促进炎性因子释放,最终介导炎症级联放大反应[28]。
乳酸菌通过调节机体的免疫反应,减轻炎症状态,缓解肾脏、肝脏、肠道损伤,修复组织屏障,改善其通透性,恢复尿酸代谢能力,从而有助于降低尿酸水平。牛春华等[50]通过筛选获得一株具有降尿酸功能的植物乳植杆菌UA149,通过动物体内实验测试显示,植物乳植杆菌UA149可显著降低高尿酸血症模型大鼠白三烯、血栓素和炎症因子水平,并可以显著上调AMPK、SIRT1蛋白表达,降低NF-κB、IκB-α、NLRP3和ASC表达,通过调节AMPK/NF-κB/NLRP3信号通路来减缓高尿酸血症引起的肾脏炎症反应。崔鹏月[51]通过建立炎症细胞模型进行体外实验,结果也显示,筛选出的具有降尿酸功能的罗伊氏粘液乳杆菌、植物乳植杆菌具有可以降低炎性细胞因子IL-1β、IL-6分泌的能力,但不同细菌作用的炎性细胞因子的类型存在差异。此外,有研究发现乳酸菌可以分泌可溶性蛋白(p40和p75),通过AMPK途径修复由过氧化氢导致的人克隆结肠腺癌细胞Caco-2功能损伤,恢复其屏障功能和紧密连接功能,降低尿酸的通透性,减轻炎症反应[52]。
综上所述,如表2所示,乳酸菌可以通过多种途径降低血液中尿酸水平,主要包括:减少尿酸生成前体物质含量,降低尿酸生成关键酶XOD表达与活性,从而减少尿酸的生成;调节尿酸转运蛋白的表达水平,通过自身代谢酶降解尿酸,促进尿酸排泄;改善肠道微生态环境,增强肠道屏障功能,通过调节肠道菌群的组成;调节机体免疫,降低炎性细胞因子分泌的能力,减缓高尿酸血症引起的炎症反应,缓解肾脏损伤。
表2 乳酸菌调节尿酸代谢作用机制
Table 2 Mechanism of lactic acid bacteria regulating uric acid metabolism

作用机制作用原理代表菌株抑制尿酸生成降低关键酶XOD表达和活性减少尿酸前体物质含量降低XOD基因转录水平唾液联合乳杆菌抑制XOD活性植物乳植杆菌、鼠李糖乳酪杆菌、罗伊氏粘液乳杆菌、戊糖片球菌产生短链脂肪酸抑制XOD活性植物乳植杆菌、鼠李糖乳酪杆菌、发酵乳酸杆菌、罗伊氏粘液乳杆菌、布氏乳杆菌降低嘌呤生成量:降解核苷(肌苷、鸟苷、腺苷)或下调PNP、ADA基因表达量并抑制ADA活性植物乳植杆菌、鼠李糖乳酪杆菌、发酵乳酸杆菌、罗伊氏粘液乳杆菌、短乳杆菌、干酪乳酪杆菌降解嘌呤,用于自身生长繁殖植物乳植杆菌、发酵乳酸杆菌、布氏乳杆菌通过细胞壁表面的肽聚糖吸附嘌呤类物质植物乳植杆菌、戊糖片球菌促进尿酸排泄调节尿酸转让蛋白的表达量吸附尿酸降解尿酸下调尿酸重吸收转运蛋白表达水平,减少尿酸重吸收植物乳植杆菌、短乳杆菌上调尿酸分泌蛋白表达水平,促进尿酸排出植物乳植杆菌、发酵乳酸杆菌、布氏乳杆菌、唾液联合乳杆菌、短乳杆菌通过细胞膜吸附尿酸植物乳植杆菌通过自身的尿酸代谢酶分解尿酸,排出体外发酵乳酸杆菌调节肠道菌群平衡改善肠道微生态环境,增强肠道屏障功能显著提高双歧杆菌属、乳酸杆菌属等有益菌属丰度植物乳植杆菌、发酵乳杆菌短乳杆菌影响肠道中短链脂肪酸产生菌的丰度通过调节肠道菌群的组成,促进大肠中短链脂肪酸水平的提高,从而抑制XOD活性植物乳植杆菌、鼠李糖乳酪杆菌、罗伊氏粘液乳杆菌调节机体免疫减轻炎症状态通过调节AMPK/NF-κB/NLRP3信号通路来减缓高尿酸血症引起的肾脏炎症反应植物乳植杆菌、短乳杆菌降低炎性细胞因子分泌的能力植物乳植杆菌、罗伊氏粘液乳杆菌
3 总结与展望
随着全球患者数量的持续增长,高尿酸血症已成为威胁人类健康和生活的高发疾病之一。乳酸菌作为一种天然、安全的生物调节剂,在调节尿酸代谢方面具有重要作用,其通过抑制尿酸生成、促进尿酸排泄、调节肠道菌群平衡等多种途径发挥降尿酸功能,有望为高尿酸血症患者提供新的治疗选择。但是,目前对乳酸菌降尿酸机制的研究多局限于动物实验,缺乏有力的临床实验证据,多种机制间的协同作用也还需要进一步分析和探索。未来,需要进一步开展大规模、多中心的临床研究,深入探讨其作用机制,优化产品开发,为高尿酸血症患者带来更多的健康福祉。
[1] 张超, 常岭迪, 冯伟, 等.高尿酸血症发病机制与治疗策略的研究进展[J].空军军医大学学报, 2024, 45(10):1184-1190.ZHANG C, CHANG L D, FENG W, et al.Research progress on the pathogenesis and treatment strategies of hyperuricemia[J].Journal of Air Force Medical University, 2024, 45(10):1184-1190.
[2] 黄佳豪, 李先平, 赵军英, 等.益生菌缓解高尿酸血症作用机制研究进展[J].食品科学, 2023, 44(23):282-292.HUANG J H, LI X P, ZHAO J Y, et al.Progress in understanding the mechanism by which probiotics alletivate hyperuricemia[J].Food Science, 2023, 44(23):282-292.
[3] 王雨, 林志健, 张冰.尿酸代谢紊乱相关疾病的现代认知及中医药防治进展[J].中国中药杂志, 2024, 49(12):3160-3167.WANG Y, LIN Z J, ZHANG B.Modern understanding of uric acid metabolism disorders and progress in traditional Chinese medicine prevention and treatment[J].China Journal of Chinese Materia Medica, 2024, 49(12):3160-3167.
[4] GAMALA M, JACOBS J W G.Gout and hyperuricaemia:A worldwide health issue of joints and beyond[J].Rheumatology, 2019, 58(12):2083-2085.
[5] VENKATACHALAM R, KUMAR R, KALIAPERUMAL R, et al.Association of serum uric acid and lipid profile in type 2 diabetic patients with and without diabetic retinopathy[J].Asian Journal of Pharmaceutical and Clinical Research, 2017, 10(6):112.
[6] 杨新如, 唐甲越, 曾小群, 等.益生菌缓解高尿酸血症:研究现状、作用机制及面临的挑战[J].食品工业科技, 2024, 45(20):415-425.YANG X R, TANG J Y, ZENG X Q, et al.Probiotics in alleviating hyperuricemia:Research status, mechanism of action and challenges[J].Science and Technology of Food Industry, 2024, 45(20):415-425.
[7] ISHIKAWA T, MAEDA T, HASHIMOTO T, et al.Long-term safety and effectiveness of the xanthine oxidoreductase inhibitor, topiroxostat in Japanese hyperuricemic patients with or without gout:A 54-week open-label, multicenter, post-marketing observational study[J].Clinical Drug Investigation, 2020, 40(9):847-859.
[8] 徐婷, 鲍丁宇, 朱雨蒙, 等.降解体内有害成分的乳酸菌研究进展[J].粮食与食品工业, 2024, 31(3):31-33.XU T, BAO D Y, ZHU Y M, et al.Research progress of lactic acid bacteria degrading harmful components in vivo[J].Cereal and Food Industry, 2024, 31(3):31-33.
[9] YAMANAKA H, TANIGUCHI A, TSUBOI H, et al.Hypouricaemic effects of yoghurt containing Lactobacillus gasseri PA-3 in patients with hyperuricaemia and/ or gout:A randomised, double-blind, placebo-controlled study[J].Modern Rheumatology, 2019, 29(1):146-150.
[10] 吴世芳, 李义恒, 石承瑞, 等.乳酸菌对藏区高尿酸血症防治的研究进展[J].食品与发酵工业, 2022, 48(18):286-291.WU S F, LI Y H, SHI C R, et al.Research progress of lactic acid bacteria on the prevention and treatment of hyperuricemia in Tibetan region[J].Food and Fermentation Industries, 2022, 48(18):286-291.
[11] MAIUOLO J, OPPEDISANO F, GRATTERI S, et al.Regulation of uric acid metabolism and excretion[J].International Journal of Cardiology, 2016, 213:8-14.
[12] PAN L B, HAN P, MA S R, et al.Abnormal metabolism of gut microbiota reveals the possible molecular mechanism of nephropathy induced by hyperuricemia[J].Acta Pharmaceutica Sinica B, 2020, 10(2):249-261.
[13] NAKAYAMA A, NAKAOKA H, YAMAMOTO K, et al.GWAS of clinically de ned gout and subtypes identi
ned gout and subtypes identi es multiple susceptibility loci that include urate transporter genes[J].Annals of the Rheumatic Diseases, 2017, 76(5):869-877.
es multiple susceptibility loci that include urate transporter genes[J].Annals of the Rheumatic Diseases, 2017, 76(5):869-877.
[14] 胡小华, 张黎明.尿酸代谢途径的研究进展[J].临床肾脏病杂志, 2019, 19(12):935-937.HU X H, ZHANG L M.Progress in research on uric acid metabolism pathway[J].Journal of Clinical Nephrology, 2019, 19(12):935-937.
[15] WANG J, CHEN Y, ZHONG H, et al.The gut microbiota as a target to control hyperuricemia pathogenesis:Potential mechanisms and therapeutic strategies[J].Critical Reviews in Food Science and Nutrition, 2022, 62(14):3979-3989.
[16]李秋睿, 李玲, 林华.肠道尿酸排泄及相关转运体的研究进展[J].国际药学研究杂志, 2019, 46(4):261-265.LI Q R, LI L, LIN H.The intestinal uric acid excretion and related transporters:research advances[J].International Journal of Pharmaceutical Research, 2019, 46(4):261-265.
[17] 任思齐, 李青青, 么春艳, 等.微生物参与人体尿酸的合成、分解和转运[J].中国微生态学杂志, 2023, 35(10):1223-1227.REN S Q, LI Q Q, YAO C Y, et al.Microbes participate in the synthesis, decomposition and transport of human uric acid [J].Chinese Journal of Microecology, 2023, 35(10):1223-1227.
[18] WATANABE S, KANG D H, FENG L L, et al.Uric acid, hominoid evolution, and the pathogenesis of salt-sensitivity[J].Hypertension, 2002, 40(3):355-360.
[19] 辛家东, 周嘉宝, 吴志远, 等.尿酸排泄及其相关转运蛋白在高尿酸血症中的研究进展[J].中国全科医学, 2023, 26(15):1916-1922.XIN J D, ZHOU J B, WU Z Y, et al.Advances in urate excretion and urate transporters in hyperuricemia[J].Chinese General Practice, 2023, 26(15):1916-1922.
[20] 丁宁, 古恩鹏, 刘加宝, 等.尿酸转运蛋白和相关调控基因的研究现状[J].医疗装备, 2022, 35(11):192-194.DING N, GU E P, LIU J B, et al.Research status of uric acid transporter and related regulatory genes[J].Medical Equipment, 2022, 35(11):192-194.
[21] 朱立然, 陈光亮.尿酸转运蛋白研究进展[J].中国临床药理学与治疗学, 2012, 17(11):1289-1294.ZHU L R, CHEN G L.Progress in uric acid transporters[J].Chinese Journal of Clinical Pharmacology and Therapeutics, 2012, 17(11):1289-1294.
[22] 韩宇, 黄锦坚, 林志健, 等.三磷酸腺苷结合盒转运蛋白G2与痛风病关联的病理机制研究进展[J].世界中医药, 2024, 19(3):437-443.HAN Y, HUANG J J, LIN Z J, et al.Research progress of association between ABCG2 and gout disease in pathogenesis[J].World Chinese Medicine, 2024, 19(3):437-443.
[23] 刘润, 谢晨栖, 陈晓芳, 等.以尿酸转运蛋白1为靶点治疗高尿酸血症药物研究进展[J].江苏大学学报(医学版), 2024, 34(3):203-210.LIU R, XIE C (Q/X), CHEN X F, et al. Research progress of drugs targeting uric acid transporter 1 in the treatment of hyperuricemia[J]. Journal of Jiangsu University (Medicine Edition), 2024, 34(3):203-210.
[24] 李均超, 苏红军. 尿酸与神经系统疾病的关联性研究进展[J]. 淮海医药, 2024, 42(2):211-214.LI J C, SU H J. Research progress on the correlation between uric acid and nervous system diseases[J]. Journal of Huaihai Medicine, 2024, 42(2):211-214.
[25] 陈秋霞, 刘磊. 尿酸的生理功能及其与认知功能障碍关系的研究进展[J]. 武警医学, 2020, 31(3):251-254.CHEN Q X, LIU L. Research progress on physiological function of uric acid and its relationship with cognitive dysfunction[J]. Medical Journal of the Chinese People’s Armed Police Force, 2020, 31(3):251-254.
[26] 汪洋, 陈晨, 褚超, 等. 慢性盐负荷对成年人血尿酸及尿尿酸水平的影响[J]. 中国医刊, 2019, 54(4):368-371.WANG Y, CHEN C, CHU C, et al. Effect of salt intake on plasma and urinary uric acid levels in Chinese adults[J]. Chinese Journal of Medicine, 2019, 54(4):368-371.
[27] SHI Y, EVANS J E, ROCK K L. Molecular identification of a danger signal that alerts the immune system to dying cells[J]. Nature, 2003, 425(6957):516-521.
[28] 贾昱晗, 高天舒, 裴乃琪, 等. 痛风性关节炎发病机制的研究进展[J]. 药学研究, 2024, 43(7):684-688.JIA Y H, GAO T S, PEI N Q, et al. Research process in pathogenesis of gouty arthritis[J]. Journal of Pharmaceutical Research, 2024, 43(7):684-688.
[29] 徐卫锋. 高尿酸血症通过调控肾上皮钠通道(ENaC)介导高血压发生的机制研究[D].南京:南京医科大学, 2015.XU W F.Hyperuricemia induces hypertension through activation of renal epithelial sodium channel (ENaC)[D].Nanjin:Nanjing Medical University, 2015.
[30] NISHIDA Y, TAKAHASHI Y, SUSA N,et al.Comparative effect of angiotensin II type I receptor blockers on serum uric acid in hypertensive patients with type 2 diabetes mellitus:A retrospective observational study[J].Cardiovascular Diabetology, 2013, 12:159.
[31] AGARWAL V, HANS N, MESSERLI F H.Effect of allopurinol on blood pressure:A systematic review and meta-analysis[J].The Journal of Clinical Hypertension, 2013, 15(6):435-442.
[32] 金方, 杨虹.降血尿酸益生菌株的筛选和降血尿酸机理的探索[J].微生物学通报, 2018, 45(8):1757-1769.JIN F, YANG H.Isolation of hypouricemic probiotics and exploration their effects on hyperuricemic rats[J].Microbiology China, 2018, 45(8):1757-1769.
[33] 吴小燕, 钱仁怡, 吕玲春, 等.尿酸与呼吸系统疾病相关性的研究进展[J].浙江实用医学, 2024, 29(1):86-90.WU X Y, QIAN R Y, LYU L C, et al.Research progress on the correlation between uric acid and respiratory diseases[J].Zhejiang Practical Medicine, 2024, 29(1):86-90.
[34] ZHAO X T, PENG F, LIU Z G, et al.Lactic acid bacteria with anti-hyperuricemia ability:Screening in vitro and evaluating in mice[J].Food Bioscience, 2023, 52:102411.
[35] 朱坤鹏. 一株鹅源唾液乳杆菌的分离及其对雏鹅高尿酸血症的影响[D].长春:吉林大学, 2023.ZHU K P.Isolation of a Goose-derived Lactobacillus salivary and its effect on hyperuricemia in goslings[D].Changchun:Jilin University, 2023.
[36] 倪彩新. 乳杆菌对高尿酸血症的影响及作用途径探究[D].无锡:江南大学, 2021.NI C X.Study of the effects and approaches of Lactobacillus on hyperuricaemia alleviation[D].Wuxi:Jiangnan University, 2021.
[37] 王垚. 具有潜在降尿酸能力乳酸菌的筛选及应用研究[D].扬州:扬州大学, 2021.WANG Y.Screening and application research of lactic acid bacteria with potential uric acid lowering ability[D].Yangzhou:Yangzhou University, 2021.
[38] NI C X, LI X, WANG L L, et al.Lactic acid bacteria strains relieve hyperuricaemia by suppressing xanthine oxidase activity via a short-chain fatty acid-dependent mechanism[J].Food &Function, 2021, 12(15):7054-7067.
[39] 李杰, 李霜, 张鹏霞, 等.发酵食品中具有潜在降尿酸功能乳酸菌的筛选及特性分析[J].食品研究与开发, 2024, 45(7):174-180.LI J, LI S, ZHANG P X, et al. Screening and characteristics analysis of lactic acid bacteria with potential function of reducing uric acid from fermented foods[J]. Food Research and Development, 2024, 45(7):174-180.
[40] 操俊. 降尿酸功能乳酸菌的筛选及其机制研究[D].天津:天津科技大学, 2023.CAO J.Identification and mechanistic investigation of uric acid-degradation Lactobacillus[D].Tianjin:Tianjin University of Science and Technology, 2023.
[41] 苗超, 张宇, 杨鑫焱, 等.降尿酸乳酸菌菌株的筛选及其全基因组分析[J].中国食品学报, 2024, 24(7):88-99.MIAO C, ZHANG Y, YANG X Y, et al.Screening and whole genome sequencing analysis of lactic acid bacteria with lowering uric acid[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(7):88-99.
[42] 王诗琪, 张美枝, 郝世奇, 等.菌株X3-2B和37X-3体外抑制黄嘌呤氧化酶能力及其对小鼠高尿酸血症缓解作用的研究[J].食品与发酵工业, 2024, 50(20):145-152.WANG S Q, ZHANG M Z, HAO S Q, et al.Ability of strains X3-2B and 37X-3 to inhibit xanthine oxidase in vitro and their mitigating effect on hyperuricemia in mice[J] Food and Fermentation Industries, 2024, 50(20):145-152.
[43] 董升辉. 降嘌呤核苷乳酸菌的筛选及特性研究[D].济南:齐鲁工业大学, 2024.DONG S H.Screening and characterization of purine nucleoside reducing lactic acid bacteria[D].Jinan:Qilu University of Technology, 2024.
[44] 李婧. 降尿酸乳酸菌的筛选及其潜在机制研究[D].呼和浩特:内蒙古农业大学, 2023.LI J.Screening of lactic acid bacteria for decreasing uric acid and its potential mechanism[D].Hohhot:Inner Mongolia Agricultural University, 2023.
[45] WU Y, YE Z, FENG P Y, et al.Limosilactobacillus fermentum JL-3 isolated from "Jiangshui" ameliorates hyperuricemia by degrading uric acid[J].Gut Microbes, 2021, 13(1):1897211.
[46] 蚁硕钊. 高尿酸血症患者肠道菌群的分析与乳酸菌对高尿酸血症大鼠的影响[D].湛江:广东海洋大学, 2022.YI S Z.Gut flora analysis of hyperuricemic patients and the effect of lactic acid bacteria on hyperuricemic rats[D].Zhanjiang:Guangdong Ocean University, 2022.
[47] 徐进. 具有高嘌呤清除能力乳酸菌对嘌呤诱导高尿酸血症模型的影响及其微胶囊制备工艺研究[D].南昌:南昌大学, 2023.XU J.Effect of lactic acid bacteria with high purine scavenging ability on purine-induced hyperuricemia model and preparation of microcapsules[D].Nanchang:Nanchang University, 2023.
[48] LIN J X, XIONG T, PENG Z, et al.Novel lactic acid bacteria with anti-hyperuricemia ability:Screening and in vitro probiotic characteristics[J].Food Bioscience, 2022, 49:101840.
[49] NIEUWDORP M, GILIJAMSE P W, PAI N, et al.Role of the microbiome in energy regulation and metabolism[J].Gastroenterology, 2014, 146(6):1525-1533.
[50] 牛春华, 肖茹雪, 赵子健, 等.植物乳杆菌UA149的降尿酸作用[J].现代食品科技, 2020, 36(2):1-6;217.NIU C H, XIAO R X, ZHAO Z J, et al.Serum uric acid lowering effect of Lactobacillus plantarum UA149 on hyperuricemic rats[J].Modern Food Science and Technology, 2020, 36(2):1-6;217.
[51] 崔鹏月. 降尿酸乳酸菌的筛选及其功能评价[D].呼和浩特:内蒙古农业大学,2020.CUI P Y.The screening and functional evaluation of uric acid lowering lactic acid bacteria[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[52] SETH A, YAN F, POLK D B, et al.Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC- and MAP kinase-dependent mechanism[J].American Journal of Physiology Gastrointestinal and Liver Physiology, 2008, 294(4):G1060-G1069.