近年来,无糖、零卡食品备受推崇,这些食物主要由人工甜味剂代替了传统蔗糖。常用的非营养型人工甜味剂(non-nutritive artificial sweeteners,NNAS)主要有三氯蔗糖、糖精、安赛蜜、阿斯巴甜等,由于具有甜度高、热量低、成本低等特点,这些甜味剂被广泛添加到常见的饮料和食品中[1],甚至被推荐给肥胖、糖尿病等代谢异常人群食用,尤其是中老年人。然而,人工甜味剂的安全性仍有争议。多项大规模队列研究报告了人工甜味剂与糖尿病、心血管疾病、肿瘤、炎性肠炎等多种疾病风险增加有关[2-5]。同时,近期一些研究聚焦于人工甜味剂对肠道微生物的影响,而菌群紊乱是某些疾病发生和发展的潜在媒介。本文重点介绍人工甜味剂在体内外对肠道微生物的影响研究,并简要阐述其与相关疾病的风险。
1 人工甜味剂概述
甜味剂分为营养型和非营养型,营养型甜味剂可提供热量,如葡萄糖、麦芽糖、蔗糖等。非营养型甜味剂不含或只含少量热量,根据来源分为天然甜味剂和人工甜味剂。非营养型人工甜味剂因其较高的甜度,广泛添加于多种食品中。在我国常用的NNAS包括三氯蔗糖、糖精、阿斯巴甜、安赛蜜、纽甜等[6],这些甜味剂在人体吸收和代谢的途径各不相同,其中三氯蔗糖很少被人体吸收和代谢,可与人体肠道菌群直接作用并由粪便直接排出[7];85%~95%糖精作为完整分子被人体吸收,仅小部分会到达结肠并随粪便排出[8];阿斯巴甜进入人体后则被胃肠道酶水解,几乎不会以完整分子与结肠微生物相互作用[7-8];而安赛蜜则直接以分子形式完全被小肠吸收,并通过血液分布到不同的组织,在动物和人类中只有不到1%的安赛蜜通过粪便排出[7]。此外,隶属于联合国粮农组织和世界卫生组织的食品添加剂联合专家委员会规定了每种人工甜味剂的每日允许摄入量(acceptable daily intake,ADI)[9],大部分体内研究中甜味剂剂量限制在该范围内(表1)。
表1 主要非营养型人工甜味剂ADI及代谢
Table 1 ADI and metabolism of the main non-nutritive artificial sweeteners
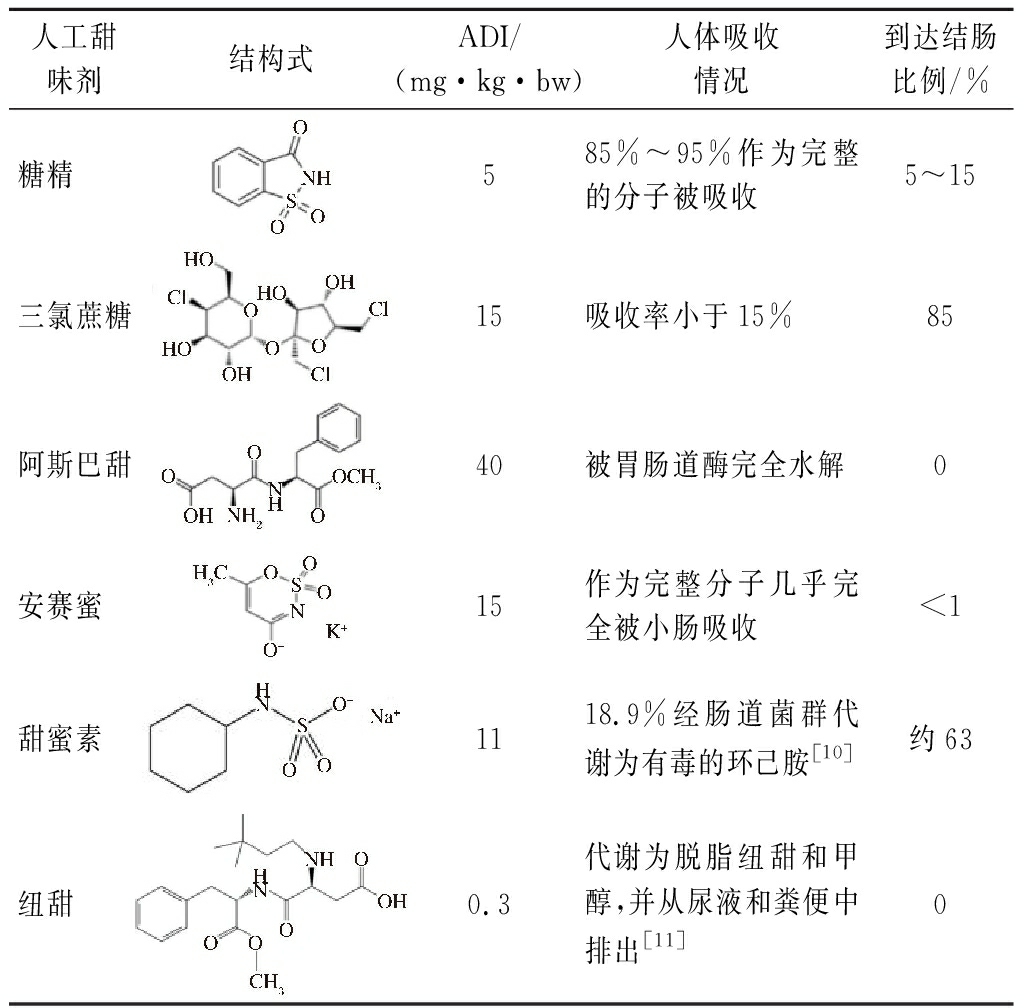
人工甜味剂结构式ADI/(mg·kg·bw)人体吸收情况到达结肠比例/%糖精 585%~95%作为完整的分子被吸收5~15三氯蔗糖15吸收率小于15%85阿斯巴甜40被胃肠道酶完全水解0安赛蜜 15作为完整分子几乎完全被小肠吸收<1甜蜜素 1118.9%经肠道菌群代谢为有毒的环己胺[10]约63纽甜 0.3代谢为脱脂纽甜和甲醇,并从尿液和粪便中排出[11]0
2 人工甜味剂的健康风险
早年一些研究报道了NNAS不会对机体健康(如体重、食量、血糖等)产生负面影响[12-15]。然而,近年来多项大规模队列研究显示了NNAS对健康的不良影响。2022年,法国国家卫生和医学研究所的一项大规模前瞻性队列研究表明,较高的人工甜味剂摄入量(特别是阿斯巴甜、安赛蜜和三氯蔗糖)与心血管疾病风险增加之间存在潜在的直接联系[16],并且大量摄入含有人工甜味剂的软饮料会增加心血管疾病的发病率和死亡率[17]。一项中位随访时间7.8年、纳入102 865名成年人的队列研究表明,人工甜味剂(尤其是阿斯巴甜和安赛蜜)与癌症风险增加相关[2]。另一项包含105 588名参与者、中位随访时间9.1年的大规模前瞻性队列研究中,食用人工甜味剂较多的人(男性高于16.4 mg/d,女性高于18.5 mg/d)患2型糖尿病的风险较高[风险比(hazard ratio,HR) 1.69(1.45~1.97),P<0.001],其中阿斯巴甜、安赛蜜和三氯蔗糖的摄入均与2型糖尿病风险增加相关[3]。此外,人工甜味剂还与肝脏疾病、炎性肠病、免疫抑制、遗传性焦虑等疾病风险相关[4-5,18-19]。这些研究使人工甜味剂的安全性备受争议,其对机体的影响及机制有待重新评估。
人工甜味剂导致人体不良效应的机制尚不完全清楚,目前认为主要有以下几个方面(图1):a)NNAS与消化系统的甜味受体T1R结合,激活偶联的G蛋白α-gustducin和下游信号通路,促进神经递质释放,在葡萄糖吸收和触发胰岛素分泌中起关键作用;NNAS通过干扰该通路,促进代谢综合征和胰岛素抵抗[20-22]。b)NNAS干扰肠道微生物群的组成,诱导葡萄糖耐受不良和肠道屏障损伤、代谢疾病等[20-22]。c)长期食用NNAS破坏了控制葡萄糖和能量稳态的甜味学习行为和反应,导致体重和血糖升高[21]。d)一些NNAS会产生有害代谢物,如阿斯巴甜在体内代谢产生甲醇和二酮哌嗪,三氯蔗糖产生三氯蔗糖-6-乙酸酯,甜蜜素经肠道菌群代谢产生有毒的环己胺等[10,23],可对机体造成损伤。
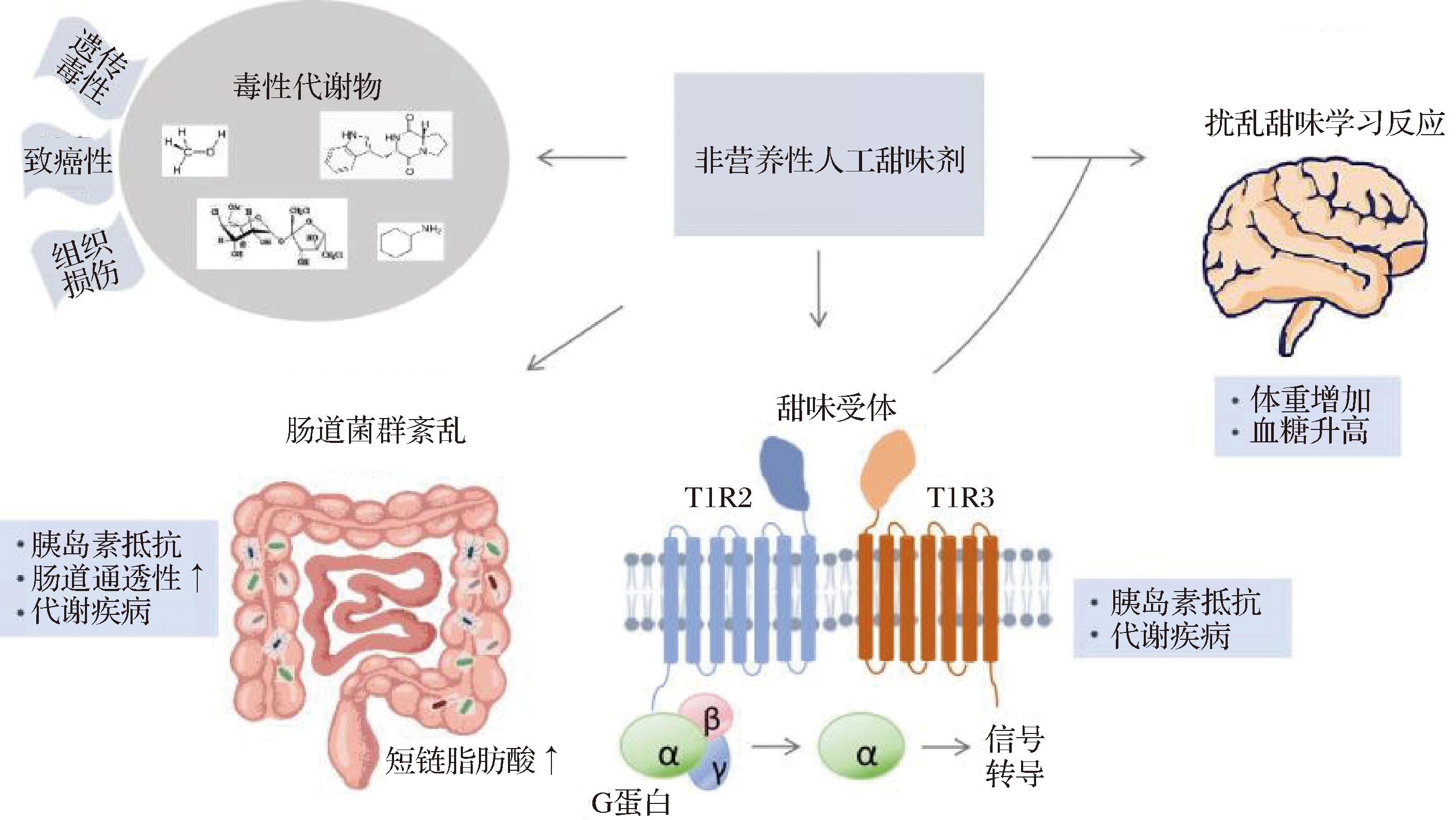
图1 人工甜味剂导致不良健康效应的潜在机制[20]
Fig.1 The underlying mechanisms of the adverse health effects of artificial sweeteners[20]
3 肠道菌群与人体健康
人体肠道中寄居着大量微生物群,构成了复杂、动态的生态系统,其中90%肠道细菌属于拟杆菌门(Bacteroideta)和厚壁菌门(Bacillota),其次是变形菌门(Pseudomonadota)、梭菌门(Fusobacteriota)、微孢子菌门(Mycoplasmatota)和放线菌门(Actinobacteria)[24]。肠道菌群在整个生命过程中参与了宿主生理和病理的多个方面[25],菌群紊乱与多种疾病密切相关,如糖尿病、心血管疾病、神经系统性疾病等[26-29]。健康成年人的微生物群相对稳定,但饮食等外部因素会对其组成和功能产生影响。研究表明,短期和长期饮食都会改变肠道微生物群的组成和功能,饮食、微生物群和免疫系统之间复杂的相互作用是维持体内平衡和抵御外部病原体的重要调节机制,由此可见饮食对人类健康的影响[30-33]。人工甜味剂作为常见的膳食补充剂,可能与微生物组发生直接或间接相互作用,进而对宿主健康产生影响。
4 人工甜味剂对肠道菌群的影响
部分糖精、三氯蔗糖、甜蜜素等甜味剂不被宿主消化而通过肠道,可直接与肠道菌群相互作用,影响肠道菌群的组成和功能。其他甜味剂被人体完全吸收,如阿斯巴甜,可能通过其他途径间接影响肠道菌群。
4.1 人工甜味剂对肠道细菌的生理和耐药性的影响
人工甜味剂可对肠道细菌产生直接影响,包括细菌生长代谢、耐药基因的转移和群体感应等。
多项研究表明人工甜味剂可促进细菌耐药基因的转移。YU等[34]首次通过体外实验证实糖精、三氯蔗糖、阿斯巴甜和安赛蜜可以促进含抗生素抗性基因的质粒在细菌间接合转移(菌株:E.coli K-12 和P.alloputida),包括细菌属内和属间转移增加,该现象在临床样本中的多重耐药质粒中也观察到,并且细菌通过接合转移获得的质粒仍可转移到其他潜在受体菌中。同时,暴露于人工甜味剂使细菌的活性氧(reactive oxygen species,ROS)产生,细菌DNA损伤诱导反应(SOS response,SOS反应)、基因转移、细胞膜通透性均增加;细菌参与ROS解毒、SOS反应和细胞膜通透性的基因表达显著上调[34]。此外,在巴氏不动杆菌ADP1(Acinetobacter baylyi ADP1)、枯草芽孢杆菌(Bacillus subtilis)和小鼠粪便微生物中均观察到糖精、三氯蔗糖、阿斯巴甜和安赛蜜还可通过自然转化促进抗性基因的转移;同时,细菌的膜通透性增加,DNA摄取和易位机制相关基因上调[35]。一项体外研究以携带耐药基因质粒的大肠杆菌为供体,以小鼠粪便细菌为受体,建立体外偶联模型[36]。该研究也发现糖精、三氯蔗糖、阿斯巴甜和安赛蜜可促进携带耐药基因的质粒在肠道微生物群间转移,包括肠道病原菌,同时肠道细菌ROS产生增加[36]。此外,4种NNAS可使细菌外排泵基因表达上调,促进枯草芽孢杆菌对青霉素耐受进化,这种耐受在无甜味剂作用下依然能稳定保持[37]。肠道微生物群是抗生素耐药基因的集合,NNAS的摄入可能通过促进耐药基因转移导致菌群紊乱,增加疾病风险。目前鉴于人工甜味剂的使用量及肠道细菌耐药不断增加,对人工甜味剂相关的抗生素耐药性进行全面风险评估是十分必要的。
WANG等[38]在体外实验中观察到三氯蔗糖(25/50 mg/mL)、安赛蜜(25 mg/mL)和糖精(25 mg/mL)能明显抑制E.coli HB101、K12菌株的生长。糖精、三氯蔗糖、阿斯巴甜和安赛蜜还对革兰阴性[大肠杆菌和肺炎克雷伯菌(Klebsiella pneumoniae)]和阳性(枯草芽孢杆菌)菌株具有抗菌作用,其机制是增加ROS和细胞膜损伤[37]。此外,5 mmol/L糖精对金黄色葡萄球菌(Staphylococcus aureus)、肺炎克雷伯菌和铜绿假单胞菌(Pseudomonas aeruginosa)(均为变形杆菌)具有抑菌而非杀菌作用[39]。3种人工甜味剂(26.6 mg/mL糖精/甜蜜素/安赛蜜)对重点病原体[鲍曼不动杆菌(Acinetobacter baumannii)、铜绿假单胞菌]也有生长抑制作用,其中安赛蜜的抑制作用呈剂量依赖,其生长抑制机制是影响细菌膜稳定性,增加膜渗透性,导致细菌裂解[40]。然而,在另一项研究中,大肠杆菌NCTC10418和粪肠球菌(Enterococcus faecalis)ATCC19433暴露于不同浓度(0~1 mmol/L)的人工甜味剂(糖精、三氯蔗糖和阿斯巴甜)后,仅观察到1 mmol/L糖精可显著降低大肠杆菌的生长(48~84 h)[41]。这种不一致可能与细菌种类或人工甜味剂暴露的浓度不同有关。NNAS对部分肠道细菌的生长抑制作用,可能发挥类似抗生素的功能,长期食用可能导致菌群紊乱。
此外,NNAS还会影响细菌的代谢。当把市售阿斯巴甜和安赛蜜加入对数生长的E.coli培养液中,2种人工甜味剂可调节大肠杆菌的生长,并诱导细菌的葡萄糖、核苷酸和脂肪酸等代谢相关的关键基因表达,其中一些基因对肠道中微生物的定植很重要[42]。
细菌通过复杂的细胞-细胞通讯网络进行集体行动称为群体感应,可使细菌能够根据种群密度相互作用并调整自身基因表达,如生物膜形成、蛋白酶和毒素产生以及运动机制。MARKUS等[43]发现阿斯巴甜、三氯蔗糖和糖精对革兰氏阴性菌N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHL)通讯系统有显著抑制作用;以LasR作为AHL的典型受体,用计算机模拟预测时发现人工甜味剂可结合到蛋白质的配体结合口袋,可能会影响天然配体,从而干扰AHL下游群体感应信号的激活;同时,3种人工甜味剂均能抑制细菌的运动。因此,人工甜味剂可能通过影响肠道微生物群体感应,改变基因表达水平,甚至影响宿主代谢。
由此可见,部分人工甜味剂可能通过以上机制对肠道细菌产生影响,进而诱导肠道菌群紊乱和微生态改变,增加相关疾病风险。然而,这些研究具有局限性,体外简化的实验条件不能完全反映体内复杂的生理情况,需在体内实验中进一步验证。
4.2 人工甜味剂不良健康效应中肠道菌群的变化
4.2.1 葡萄糖耐量受损
2014年,SUEZ等[44]首次报道了人工甜味剂通过肠道菌群诱导血糖耐受不良。该研究对381名非糖尿病患者进行临床营养研究,通过问卷调查量化食用人工甜味剂的量,发现其摄入量与空腹血糖、糖化血红蛋白和糖耐量呈显著正相关,并在随机选择的172名个体中观察到肠道细菌中肠杆菌科(Enterobacteriaceae)、δ变形菌纲(Deltaproteobacteria)、放线菌门丰度与人工甜味剂的消耗量呈正相关[44]。随后,7名健康志愿者连续6 d食用商业糖精(5 mg/kg,含质量分数为95%葡萄糖)并监测血糖,其中4人在摄入糖精5~7 d后血糖反应明显较1~4 d差,即为对NNAS有反应者;通过16S rRNA分析评估,NNAS反应者的微生物组结构在NNAS摄入前后与无反应者均不同,且观察到明显的组成变化[44]。为了研究NNAS诱导的肠道生态失调是否在葡萄糖耐受不良中起因果作用,研究者将NNAS暴露前后的粪便从2个应答者和2个无应答者中移植到无菌小鼠中,移植了NNAS应答者暴露后粪便的无菌小鼠出现明显的葡萄糖耐受不良,同时小鼠与供体具有相似的菌群特征,如脆弱拟杆菌(Bacteroides fragilis)和魏斯菌属(Weissella cibaria)(乳酸杆菌目)的相对丰度增加20倍,而Candidatus Arthromitus(梭菌目)减少10倍[44]。但是,该部分研究有一定局限,如后期临床研究和粪菌移植实验中纳入的研究对象过少,人群摄入的甜味剂为商业糖精,含有葡萄糖等。此外,该研究还在动物实验中进行验证。C57BL/6小鼠食用商业配方的糖精(5 mg/mL糖精和95 mg/mL葡萄糖)和低剂量纯糖精(0.1 mg/mL)11周后,均出现了明显的葡萄糖耐受不良;食用商业糖精的小鼠与对照组(葡萄糖对照组、空白对照组)相比,肠道菌群结构和功能明显改变,超过40个操作分类单元(operational taxonomic unit,OTU)丰度显著改变,其中拟杆菌属(Bacteroides)和梭菌目(Clostridiales)相对丰度增加,细菌多糖降解途径增强,粪便短链脂肪酸(short-chain fatty acid,SCFA)水平升高[44]。当分别使用靶向革兰阴性(环丙沙星和甲硝唑)和革兰阳性(万古霉素)广谱抗生素处理4周后,食用糖精的小鼠与对照组间的葡萄糖耐受差异被消除[44]。为检测肠道菌群与血糖耐受不良的因果关系,作者将食用商业糖精或葡萄糖(对照)的小鼠粪便微生物群移植到无菌小鼠,在移植6 d后,接受商业糖精小鼠粪便微生物的无菌小鼠表现出葡萄糖耐受受损[44]。由此可见,糖精引起的血糖代谢紊乱是由肠道微生物群介导的。同时,将幼年小鼠粪便与糖精在严格厌氧条件下孵育9 d,其培养物中拟杆菌门增加、厚壁菌门减少,与糖尿病患者肠道菌群特征一致,当把培养物灌胃给无菌小鼠显著增加了小鼠的葡萄糖不耐受[44]。
然而,其他一些临床研究并未得出一致的结果。SERRANO等[45]设计了随机双盲、安慰剂对照试验以探索纯糖精对健康人肠道微生物群和葡萄糖耐量的影响,其中糖精组(13人)持续2周摄入纯糖精(400 mg/d),其肠道微生物组成和多样性、血糖耐受与对照组(11人)相比均无显著变化。另一项34名受试者的随机双盲试验中,健康受试者连续7 d摄入高剂量三氯蔗糖(780 mg/d)并不会导致血糖、胰岛素抵抗和肠道微生物群改变[46]。
为了系统验证人工甜味剂对人体肠道菌群和血糖的影响,SUEZ等[47]再次设计了样本量更大、更为严谨的随机对照实验。首先,研究者严格筛选6个月内未摄入人工甜味剂的健康人群为研究对象,并在干预前检测了参与者的基线肠道微生物组、血糖、代谢组等指标水平,排除干扰因素。该研究最终纳入120名健康成人,并随机分为6组:4组干预组分别给予低于ADI剂量的糖精(180 mg/d)、三氯蔗糖(102 mg/d)、阿斯巴甜(240 mg/d)和甜菊糖(180 mg/d)(均含葡萄糖);对照组共2组,分别给予葡萄糖和无任何添加的水;持续时间均为2周[47]。通过宏基因组检测,干预后全部非营养型甜味剂组粪便微生物的组成和功能明显改变,其中三氯蔗糖对粪便微生物组的影响最为显著,而对照组均无显著变化[47]。同样,人工甜味剂组口腔微生物组和血浆代谢组也发生明显改变,其中糖精和三氯蔗糖显著损害了血糖反应[47]。重要的是,当把每组人工甜味剂干预组中血糖反应最强和反应最弱的3~4人的粪便微生物分别接种到无菌小鼠,小鼠表现出与捐赠者一致的血糖反应[47]。由此可见,NNAS诱导的微生物组改变与无菌小鼠血糖耐受间存在因果关系。
在另一项临床研究中,健康志愿者持续摄入三氯蔗糖(48 mg/d)10周后,肠道细菌厚壁菌门丰度发生改变,其中Blautia coccoides增加了3倍,Lactobacillus acidophilus减少了0.66倍[48],受试者血清胰岛素水平和葡萄糖AUC均增加。此外,正常饮食和高脂高糖喂养的雄性SD大鼠食用低剂量阿斯巴甜[5~7 mg/(kg·d)]8周后,消耗的能量和体重增加减少,血糖升高、胰岛素耐受损害;粪便细菌组成分析显示,阿斯巴甜增加了肠道细菌总数、肠杆菌科和柔嫩梭菌(Clostridium leptum)的丰度,减弱了因高脂高糖饮食引起的厚壁菌门/拟杆菌门比例的增加[49]。
以上不同的研究结果可能由于人群和实验动物对人工甜味剂的反应存在差异[45],如饮食习惯、生活或饲养环境等均会影响肠道菌群。此外,各研究中所用人工甜味剂的纯度不同,例如,有的采用市售人工甜味剂,含有一定比例葡萄糖,有的则用纯的甜味剂,但一些采用市售人工甜味剂的研究中设置了等量的葡萄糖对照组以排除影响[40]。
4.2.2 肝脏损伤和非酒精性脂肪性肝病
当小鼠连续8周摄入三氯蔗糖[1.5 mg/(kg·d)],粪便中梭菌群ⅪⅤa(Clostridium cluster ⅪⅤa)(厚壁菌门)的相对数量减少,肝脏胆固醇和胆酸的浓度升高,肠道代谢产物中丁酸盐的相对浓度和次级/初级胆汁酸的比例随三氯蔗糖的消耗呈剂量依赖性增加[50]。摄入糖精或三氯蔗糖(0.1 mg/mL)11周可诱导小鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD),同时肠道微生物群落结构改变,盲肠变形菌门和放线菌门丰度增加,链球菌属(Streptococcus)、普氏菌属(Prevotella)、梭菌属(Fusibacter)等的丰度显著升高,Akkermansia属和Verrucomicrobia门丰度显著下调,宏基因组分析显示A.muciniphila的丰度显著减少;微生物源性AHR配体和结肠AHR表达降低,而补充二甲双胍或低聚果糖可显著恢复三氯蔗糖诱导的嗜粘单胞杆菌和AHR配体降低,从而改善NAFLD[51]。此外,在摄入三氯蔗糖3个月和6个月的小鼠中观察到肠道微生物呈动态发育,其中14个属呈现出不同的变化模式,同时细菌促炎基因富集、粪便代谢物改变,肝脏促炎基因表达升高[52]。食用三氯蔗糖(0.1 mg/mL)6个月后,小鼠与胆汁酸代谢相关的几种细菌在属水平丰度降低,包括乳杆菌属(Lactobacillus)和瘤胃球菌属(Ruminococcu);肠道细菌胆汁酸次生生物合成和胆盐水解酶基因的丰度降低;此外,三氯蔗糖诱导小鼠肝脏中关键脂肪生成、胆固醇外排基因表达上调,胆固醇逆向转运基因下调,肝脏磷脂酰胆碱与磷脂酰乙醇胺比率(PC/PE)降低,脂质轻度积累、胆固醇水平升高等[53]。由此可见,长期食用三氯蔗糖和糖精对肝脏功能有一定影响且与肠道菌群相关。然而,这些发现尚未在人群中验证。
4.2.3 子代健康
母亲孕期摄入人工甜味剂会影响子代健康和肠道菌群。一项前瞻性儿童队列研究发现,母亲怀孕期间摄入人工加糖饮料与婴儿出生后第一年的肠道细菌分类结构及婴儿1岁时的体重指数(body mass index,BMI)相关,而肠道菌群结构也与婴儿BMI相关[54]。此外,在动物中也观察到人工甜味剂对子代肠道菌群的影响。SD大鼠在妊娠和哺乳期摄入高脂饮食和甜味剂(蔗糖/阿斯巴甜/甜菊糖),其中阿斯巴甜[5~7 mg/(kg·d)]和甜菊糖[2~3 mg/(kg·d)]都会改变母鼠和后代的粪便微生物群,与高脂喂养母鼠相比,摄入阿斯巴甜使高脂喂养的母鼠的肠球菌科(Enterococcaceae)、肠球菌(Enterococcus)、Parasutterella的丰度降低,梭菌簇Ⅳ(Clostridium cluster Ⅳ)的丰度增加,而子代中紫单胞菌科(Porphyromonadaceae)丰度增加,同时子代断奶时的体脂增加;母鼠摄入阿斯巴甜时,其雄性后代(8周龄)的葡萄糖耐量受到损害。当把摄入阿斯巴甜的母亲的粪便移植到无菌小鼠后,小鼠的体重、体脂、糖耐量受损增加[55]。
4.2.4 肠道屏障损伤和微生态失衡
长期摄入糖精和三氯蔗糖(0.1 mg/mL)可诱导小鼠肠道通透性和血清脂多糖水平升高,肠道菌群改变[51]。此外,进行性回肠炎易感的SAMP小鼠食用三氯蔗糖麦芽糊精6周后,粪便中变形菌门丰度增加、大肠杆菌过度生长,回肠固有层的细菌浸润增加[56]。在氧化偶氮甲烷(azoxymethane,AOM)和葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠癌小鼠模型中,三氯蔗糖(1.5 mg/mL)导致肠道细菌丰度降低,厚壁菌门、放线菌门丰度显著增加,变形菌门丰度降低;属水平Peptostreptococcus stomatis、Clostridium symbiosum、Peptostreptococcus anaerobius升高,双歧杆菌属(Bifidobacterium)降低;同时,三氯蔗糖加重了模型小鼠的肠道损伤和炎症,小鼠结直肠肿瘤数量和大小增加,β-葡萄糖醛酸酶和消化蛋白酶、肿瘤相关信号通路分子等参数发生变化[57]。然而,在另一项DSS诱导的急性或慢性结肠炎小鼠模型中,糖精(0.1 mg/mL)使模型小鼠粪便细菌载量显著降低、微生物组成改变,但对肠道屏障无明显影响,显著改善了小鼠结肠炎[39],可能与糖精抑制细菌生长相关。
在体外研究中,糖精、三氯蔗糖和阿斯巴甜(0~1 mmol/L)不同程度地增加模式肠道细菌大肠杆菌和粪肠球菌生物膜的形成[41]。值得注意的是,细菌生物膜可通过其机械力作用及细菌因子的释放,破坏肠上皮的完整性[58]。当2种细菌分别与肠上皮细胞系Caco-2细胞共同培养时,3种甜味剂增加了细菌对肠上皮细胞的黏附和侵袭能力,细菌释放的可溶性因子降低了Caco-2细胞活力[41]。此外,暴露于纽甜(100 μmol/L)也显著增加大肠杆菌和粪肠杆菌的生物膜形成,增强2种肠菌对Caco-2细胞的黏附能力和大肠杆菌的侵袭能力,并以锌依赖的方式增加大肠杆菌的细胞毒性[59]。这些研究为NNAS诱导肠道屏障功能损伤提供依据。
此外,NNAS还可影响肠道代谢和pH。小鼠摄入安赛蜜[37.5 mg/(kg·d)]4周后,肠道细菌群落组成、粪便代谢组学均发生变化且具有高度性别特异性,细菌与能量代谢相关的功能性基因富集,脂多糖合成相关基因丰度增加[60]。小鼠连续4周食用纽甜[0.75 mg/(kg·d)]可使肠道菌群α多样性降低,β多样性发生改变,厚壁菌门显著减少,拟杆菌门增加;粪便代谢物谱发生改变,多种脂肪酸、脂质和胆固醇升高,其他代谢物减少,如苹果酸和甘油酸[61]。然而,当大鼠给予安赛蜜[20/100 mg/(kg·d)]或糖精[40/120 mg/(kg·d)]4周后,粪便代谢组和微生物群变化都很小,细菌β多样性无变化,大鼠血浆代谢组中氨基酸、脂质、能量代谢显著改变,特别是胆汁酸[62],可能因为人工甜味剂作用时间较短,尚未对肠道菌群产生明显作用。此外,VAMANU等[63]采用静态GIS1模拟器在体外模拟人体结肠(升结肠、横结肠、降结肠),并把健康个体的粪便样本接种于该体系,在该模拟器中微生物群的调节反应与体内相似[64];该研究显示三氯蔗糖和糖精显著增加了结肠中氨的含量,甜菊醇和低聚果糖降低了氨含量,而氨是影响菌群调节的关键因素;甜蜜素和糖精则导致微生物数量减少,短链脂肪酸降低,尤其是双歧杆菌(Bifidobacteria)的数量大量减少;此外,除甜菊醇外,甜味剂对结肠的发酵均产生负面影响,包括发酵降低,结肠的pH升高[63]。肠道代谢物、pH的改变会影响肠道微生态,可能进一步加重菌群失衡和肠道黏膜损伤。
4.2.5 其他
如表2所示,ZANI等[18]给予小鼠三氯蔗糖(0.17或0.72 mg/mL)和葡萄糖12周后,发现高剂量三氯蔗糖通过限制T细胞增殖和T细胞分化产生免疫调节作用;同时3组小鼠粪便中Romboutsia和Phoenicibacter(属水平)丰度均降低,其中低剂量三氯蔗糖中1个属丰度升高、3个属降低,高剂量三氯蔗糖组3个属丰度升高、4个属降低;然而,并未发现肠道细菌种类变化一致,且葡萄糖组肠道细菌较三氯蔗糖组发生更大变化[18]。
表2 非营养型人工甜味剂对肠道菌群影响的研究
Table 2 Studies on effect of non-nutritive artificial sweeteners on gut microbiota
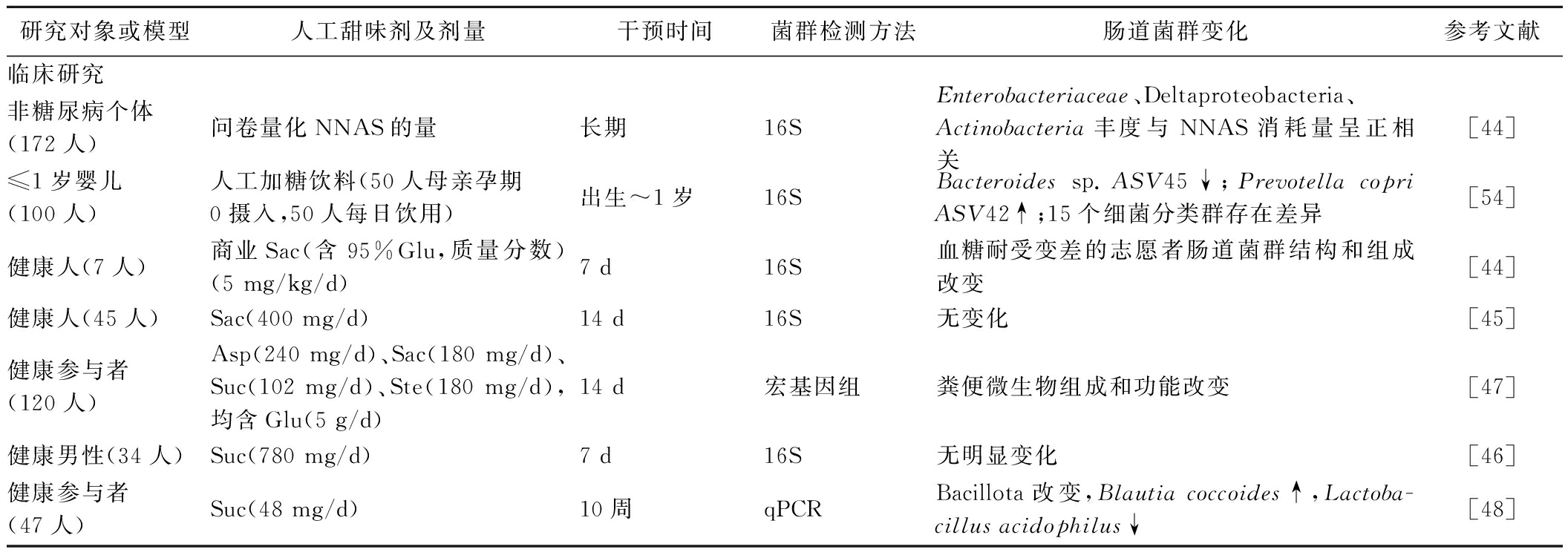
研究对象或模型人工甜味剂及剂量干预时间菌群检测方法肠道菌群变化参考文献临床研究非糖尿病个体(172人)问卷量化NNAS的量长期16S Enterobacteriaceae、Deltaproteobacteria、Actinobacteria丰度与NNAS消耗量呈正相关[44]≤1岁婴儿(100人)人工加糖饮料(50人母亲孕期0摄入,50人每日饮用)出生~1岁16S Bacteroides sp.ASV45↓;Prevotella copri ASV42↑;15个细菌分类群存在差异[54]健康人(7人)商业Sac(含95%Glu,质量分数)(5 mg/kg/d)7 d16S 血糖耐受变差的志愿者肠道菌群结构和组成改变[44]健康人(45人)Sac(400 mg/d)14 d16S 无变化[45]健康参与者(120人)Asp(240 mg/d)、Sac(180 mg/d)、Suc(102 mg/d)、Ste(180 mg/d),均含Glu(5 g/d)14 d宏基因组粪便微生物组成和功能改变[47]健康男性(34人)Suc(780 mg/d)7 d16S 无明显变化[46]健康参与者(47人)Suc(48 mg/d)10周qPCRBacillota改变,Blautia coccoides↑,Lactoba-cillus acidophilus↓[48]
续表2
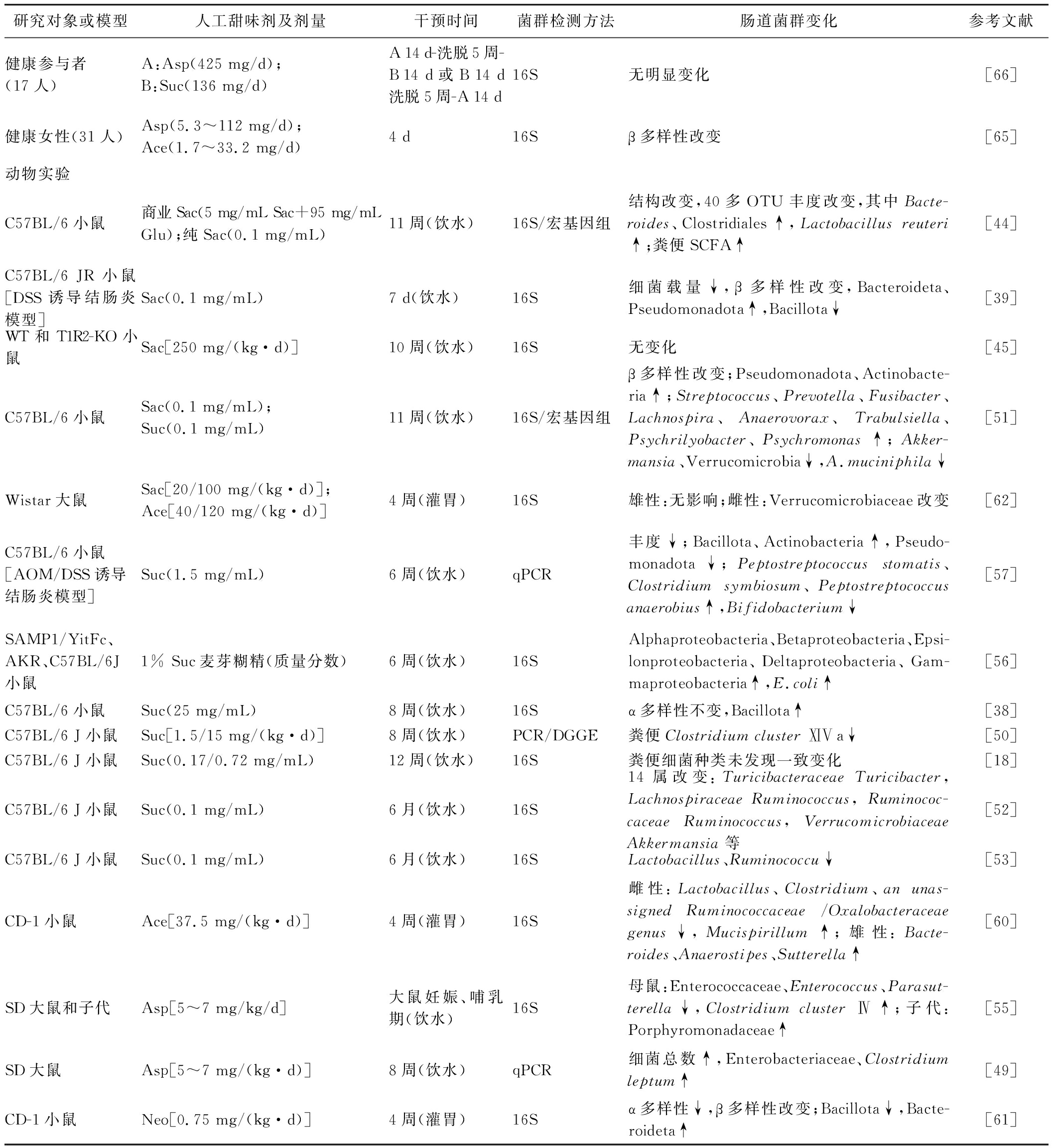
研究对象或模型人工甜味剂及剂量干预时间菌群检测方法肠道菌群变化参考文献健康参与者(17人)A:Asp(425 mg/d);B:Suc(136 mg/d) A 14 d-洗脱5周-B 14 d或B 14 d洗脱5周-A 14 d16S 无明显变化[66]健康女性(31人)Asp(5.3~112 mg/d);Ace(1.7~33.2 mg/d)4 d16S β多样性改变[65]动物实验C57BL/6小鼠商业Sac(5 mg/mL Sac+95 mg/mL Glu);纯Sac(0.1 mg/mL)11周(饮水)16S/宏基因组结构改变,40多OTU丰度改变,其中Bacte-roides、Clostridiales↑,Lactobacillus reuteri↑;粪便SCFA↑[44]C57BL/6 JR小鼠[DSS诱导结肠炎模型]Sac(0.1 mg/mL)7 d(饮水)16S细菌载量↓,β多样性改变,Bacteroideta、Pseudomonadota↑,Bacillota↓[39]WT和T1R2-KO小鼠Sac[250 mg/(kg·d)]10周(饮水)16S 无变化[45]C57BL/6小鼠Sac(0.1 mg/mL);Suc(0.1 mg/mL)11周(饮水)16S/宏基因组β多样性改变;Pseudomonadota、Actinobacte-ria↑;Streptococcus、Prevotella、Fusibacter、Lachnospira、Anaerovorax、Trabulsiella、Psychrilyobacter、Psychromonas↑;Akker-mansia、Verrucomicrobia↓,A.muciniphila↓[51]Wistar大鼠Sac[20/100 mg/(kg·d)];Ace[40/120 mg/(kg·d)]4周(灌胃)16S雄性:无影响;雌性:Verrucomicrobiaceae改变[62]C57BL/6小鼠[AOM/DSS诱导结肠炎模型]Suc(1.5 mg/mL)6周(饮水)qPCR丰度↓;Bacillota、Actinobacteria↑,Pseudo-monadota↓;Peptostreptococcus stomatis、Clostridium symbiosum、Peptostreptococcus anaerobius↑,Bifidobacterium↓[57]SAMP1/YitFc、AKR、C57BL/6J小鼠1% Suc麦芽糊精(质量分数)6周(饮水)16SAlphaproteobacteria、Betaproteobacteria、Epsi-lonproteobacteria、Deltaproteobacteria、Gam-maproteobacteria↑,E.coli↑[56]C57BL/6小鼠Suc(25 mg/mL)8周(饮水)16Sα多样性不变,Bacillota↑[38]C57BL/6 J小鼠Suc[1.5/15 mg/(kg·d)]8周(饮水)PCR/DGGE粪便Clostridium cluster ⅪⅤa↓[50]C57BL/6 J小鼠Suc(0.17/0.72 mg/mL)12周(饮水)16S 粪便细菌种类未发现一致变化[18]C57BL/6 J小鼠Suc(0.1 mg/mL)6月(饮水)16S14属改变:Turicibacteraceae Turicibacter, Lachnospiraceae Ruminococcus, Ruminococ-caceae Ruminococcus, Verrucomicrobiaceae Akkermansia等[52]C57BL/6 J小鼠Suc(0.1 mg/mL)6月(饮水)16S Lactobacillus、Ruminococcu↓[53]CD-1小鼠Ace[37.5 mg/(kg·d)]4周(灌胃)16S雌性:Lactobacillus、Clostridium、an unas-signed Ruminococcaceae /Oxalobacteraceae genus↓,Mucispirillum↑;雄性:Bacte-roides、Anaerostipes、Sutterella↑[60]SD大鼠和子代Asp[5~7 mg/kg/d]大鼠妊娠、哺乳期(饮水)16S 母鼠:Enterococcaceae、Enterococcus、Parasut-terella↓,Clostridium cluster Ⅳ↑;子代:Porphyromonadaceae↑[55]SD大鼠Asp[5~7 mg/(kg·d)]8周(饮水)qPCR 细菌总数↑,Enterobacteriaceae、Clostridium leptum↑[49]CD-1小鼠Neo[0.75 mg/(kg·d)]4周(灌胃)16S α多样性↓,β多样性改变;Bacillota↓,Bacte-roideta↑[61]
注:16S:16S rRNA 测序;宏基因组:宏基因组测序;阿斯巴甜:Asp;三氯蔗糖:Suc;安赛蜜:Ace;纽甜:Neo;糖精:Sac;葡萄糖:Glu;甜菊糖:Ste。
一些临床研究并未检测人工甜味剂对人体的不良效应。FRANKENFELD等[65]在21名年轻志愿者中观察人工甜味剂对肠道微生物群的影响:与对照组相比,短期(4 d)食用高强度阿斯巴甜(5.3~112 mg/d)和安赛蜜(1.7~33.2 mg/d)的志愿者肠道菌群丰度无明显变化,但细菌多样性不同。此外,在一项纳入17名健康受试者的随机双盲交叉临床实验中,一部分受试者先摄入阿斯巴甜(425 mg/d)14 d,间隔5周洗脱,再次摄入三氯蔗糖(136 mg/d)14 d,另一部分受试者采用相同方法但更换2种甜味剂的先后顺序;与干预前相比,受试者肠道菌群在科和属水平无明显变化,SCFAs也无差异[66]。这些研究中,健康人单次摄入人工甜味剂的持续时间限制在14 d内,可能不足以使健康人群肠道菌群发生改变,因此不能排除长期或大量使用人工甜味剂导致的缓慢的菌群紊乱和疾病风险[45]。
5 结语
总的来说,人工甜味剂对不同研究对象肠道微生物的影响并不明确,特别是并未发现与人工甜味剂相关的特定肠道微生物(表2)。人工甜味剂影响肠道菌群与疾病的关联在各研究中存在差异,同时缺乏有力证据,今后还需设计严谨、长期的大规模人群研究和动物实验加以验证。此外,肠道微生物组结构在人群和不同供应商或饲养环境的实验动物间均存在异质性[67],应尽可能排除这些因素的影响,并探索人工甜味剂导致肠道菌群变化和疾病发生的潜在机制。
[1] GARDNER C, WYLIE-ROSETT J, GIDDING S S, et al.Nonnutritive sweeteners:Current use and health perspectives:A scientific statement from the American Heart Association and the American Diabetes Association[J].Circulation, 2012, 126(4):509-519.
[2] DEBRAS C, CHAZELAS E, SROUR B, et al.Artificial sweeteners and cancer risk:Results from the NutriNet-santé population-based cohort study[J].PLoS Medicine, 2022, 19(3):e1003950.
[3] DEBRAS C, DESCHASAUX-TANGUY M, CHAZELAS E, et al.Artificial sweeteners and risk of type 2 diabetes in the prospective NutriNet-santé cohort[J].Diabetes Care, 2023, 46(9):1681-1690.
[4] FU T, CHEN H, CHEN X J, et al.Sugar-sweetened beverages, artificially sweetened beverages and natural juices and risk of inflammatory bowel disease:A cohort study of 121,490 participants[J].Alimentary Pharmacology &Therapeutics, 2022, 56(6):1018-1029.
[5] JONES S K, MCCARTHY D M, VIED C, et al.Transgenerational transmission of aspartame-induced anxiety and changes in glutamate-GABA signaling and gene expression in the amygdala[J].Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(49):e2213120119.
[6] 王思睿, 仝涛.甜味剂与人体健康的研究进展[J].食品与发酵工业, 2024, 50(17):371-379.WANG S R, TONG T.Progress of research on sweeteners and human health[J].Food and Fermentation Industries, 2024, 50(17):371-379.
[7] CONZ A, SALMONA M, DIOMEDE L.Effect of non-nutritive sweeteners on the gut microbiota[J].Nutrients, 2023, 15(8):1869.
[8] MAGNUSON B A, CARAKOSTAS M C, MOORE N H, et al.Biological fate of low-calorie sweeteners[J].Nutrition Reviews, 2016, 74(11):670-689.
[9] WHO, JECFA. List of chemicals from the 9th JECFA meeting (June 2024)[EB/OL].(2024-06-01)[2025-07-22].https://apps.who.int/food-additives-contaminants-jecfa-database/.
[10] RENWICK A G, THOMPSON J P, O′SHAUGHNESSY M, et al.The metabolism of cyclamate to cyclohexylamine in humans during long-term administration[J].Toxicology and Applied Pharmacology, 2004, 196(3):367-380.
[11] WHITEHOUSE C R, BOULLATA J, MCCAULEY L A.The potential toxicity of artificial sweeteners[J].AAOHN Journal, 2008, 56(6):251-261.
[12] BLACKBURN G L, KANDERS B S, LAVIN P T, et al.The effect of aspartame as part of a multidisciplinary weight-control program on short- and long-term control of body weight[J].The American Journal of Clinical Nutrition, 1997, 65(2):409-418.
[13] TATE D F, TURNER-MCGRIEVY G, LYONS E, et al.Replacing caloric beverages with water or diet beverages for weight loss in adults:Main results of the Choose Healthy Options Consciously Everyday (CHOICE) randomized clinical trial[J].The American Journal of Clinical Nutrition, 2012, 95(3):555-563.
[14] GOLDSMITH L A.Acute and subchronic toxicity of sucralose[J].Food and Chemical Toxicology, 2000, 38(Suppl 2):S53-S69.
[15] MA J, BELLON M, WISHART J M, et al.Effect of the artificial sweetener, sucralose, on gastric emptying and incretin hormone release in healthy subjects[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2009, 296(4):G735-G739.
[16] BUERGE I J, KELLER M, BUSER H R, et al.Saccharin and other artificial sweeteners in soils:Estimated inputs from agriculture and households, degradation, and leaching to groundwater[J].Environmental Science &Technology, 2011, 45(2):615-621.
[17] LI Z Q, GAO J F, GUO Y, et al.Enhancement of antibiotic resistance dissemination by artificial sweetener acesulfame potassium:Insights from cell membrane, enzyme, energy supply and transcriptomics[J].Journal of Hazardous Materials, 2022, 422:126942.
[18] ZANI F, BLAGIH J, GRUBER T, et al.The dietary sweetener sucralose is a negative modulator of T cell-mediated responses[J].Nature, 2023, 615(7953):705-711.
[19] EMAMAT H, GHALANDARI H, TANGESTANI H, et al.Artificial sweeteners are related to non-alcoholic fatty liver disease:Microbiota dysbiosis as a novel potential mechanism[J].EXCLI Journal, 2020, 19:620-626.
[20] LIAUCHONAK I, QORRI B, DAWOUD F, et al.Non-nutritive sweeteners and their implications on the development of metabolic syndrome[J].Nutrients, 2019, 11(3):644.
[21] YANINA PEPINO M.Metabolic effects of non-nutritive sweeteners[J].Physiology &Behavior, 2015, 152:450-455.
[22] AGUAYO-GUERRERO J A, MÉNDEZ-GARC A L A, SOLLEIRO-VILLAVICENCIO H, et al.Sucralose:From sweet success to metabolic controversies-Unraveling the global health implications of a pervasive non-caloric artificial sweetener[J].Life, 2024, 14(3):323.
A L A, SOLLEIRO-VILLAVICENCIO H, et al.Sucralose:From sweet success to metabolic controversies-Unraveling the global health implications of a pervasive non-caloric artificial sweetener[J].Life, 2024, 14(3):323.
[23] 孙威, 鲁晶晶, 闾盟, 等.人工合成甜味剂对机体健康影响的研究进展[J].职业与健康, 2024, 40(16):2299-2304.SUN W, LU J, LYU M, et al.Research progress on the effects of artificial sweeteners on human health[J].Occupation and health, 2024, 40(16):2299-2304.
[24] GOMAA E Z.Human gut microbiota/microbiome in health and diseases:A review[J].Antonie Van Leeuwenhoek, 2020, 113(12):2019-2040.
[25] FAN Y, PEDERSEN O.Gut microbiota in human metabolic health and disease[J].Nature Reviews Microbiology, 2021, 19(1):55-71.
[26] CHAKAROUN R M, OLSSON L M, B CKHED F.The potential of tailoring the gut microbiome to prevent and treat cardiometabolic disease[J].Nature Reviews Cardiology, 2023, 20(4):217-235.
CKHED F.The potential of tailoring the gut microbiome to prevent and treat cardiometabolic disease[J].Nature Reviews Cardiology, 2023, 20(4):217-235.
[27] IATCU C O, STEEN A, COVASA M.Gut microbiota and complications of type-2 diabetes[J].Nutrients, 2022, 14(1):166.
[28] ![]() A, SZMAJDA-KRYGIER D, KOZ
A, SZMAJDA-KRYGIER D, KOZ OWSKA E.The microbiota-gut-brain axis in psychiatric disorders[J].International Journal of Molecular Sciences, 2022, 23(19):11245.
OWSKA E.The microbiota-gut-brain axis in psychiatric disorders[J].International Journal of Molecular Sciences, 2022, 23(19):11245.
[29] HSU C L, SCHNABL B.The gut-liver axis and gut microbiota in health and liver disease[J].Nature Reviews Microbiology, 2023, 21(11):719-733.
[30] SINGH R K, CHANG H W, YAN D, et al.Influence of diet on the gut microbiome and implications for human health[J].Journal of Translational Medicine, 2017, 15(1):73.
[31] DAVID L A, MAURICE C F, CARMODY R N, et al.Diet rapidly and reproducibly alters the human gut microbiome[J].Nature, 2014, 505(7484):559-563.
[32] GHOSH T S, RAMPELLI S, JEFFERY I B, et al.Mediterranean diet intervention alters the gut microbiome in older people reducing frailty and improving health status:The NU-AGE 1-year dietary intervention across five European countries[J].Gut, 2020, 69(7):1218-1228..
[33] BOURDEAU-JULIEN I, CASTONGUAY-PARADIS S, ROCHEFORT G, et al.The diet rapidly and differentially affects the gut microbiota and host lipid mediators in a healthy population[J].Microbiome, 2023, 11(1):26.
[34] YU Z G, WANG Y, LU J, et al.Nonnutritive sweeteners can promote the dissemination of antibiotic resistance through conjugative gene transfer[J].The ISME Journal, 2021, 15(7):2117-2130.
[35] YU Z G, WANG Y, HENDERSON I R, et al.Artificial sweeteners stimulate horizontal transfer of extracellular antibiotic resistance genes through natural transformation[J].The ISME Journal, 2022, 16(2):543-554.
[36] YU Z G, HENDERSON I R, GUO J H.Non-caloric artificial sweeteners modulate conjugative transfer of multi-drug resistance plasmid in the gut microbiota[J].Gut Microbes, 2023,15(1):2157698.
[37] YU Z G, GUO J H.Non-caloric artificial sweeteners exhibit antimicrobial activity against bacteria and promote bacterial evolution of antibiotic tolerance[J].Journal of Hazardous Materials, 2022, 433:128840.
[38] WANG Q-P, BROWMAN D, HERZOG H, et al.Non-nutritive sweeteners possess a bacteriostatic effect and alter gut microbiota in mice[J].PLoS One, 2018, 13(7):e0199080.
[39] SÜNDERHAUF A, PAGEL R, KÜNSTNER A, et al.Saccharin supplementation inhibits bacterial growth and reduces experimental colitis in mice[J].Nutrients, 2020, 12(4):1122.
[40] DE DIOS R, PROCTOR C R, MASLOVA E, et al.Artificial sweeteners inhibit multidrug-resistant pathogen growth and potentiate antibiotic activity[J].EMBO Molecular Medicine, 2023, 15(1):e16397.
[41] SHIL A, CHICHGER H.Artificial sweeteners negatively regulate pathogenic characteristics of two model gut bacteria, E.coli and E.faecalis[J].International Journal of Molecular Sciences, 2021, 22(10):5228.
[42] MAHMUD R, SHEHREEN S, SHAHRIAR S, et al.Non-caloric artificial sweeteners modulate the expression of key metabolic genes in the omnipresent gut microbe Escherichia coli[J].Microbial Physiology, 2020, 29(1-6):43-56.
[43] MARKUS V, SHARE O, SHAGAN M, et al.Inhibitory effects of artificial sweeteners on bacterial quorum sensing[J].International Journal of Molecular Sciences, 2021,22(18):9863.
[44] SUEZ J, KOREM T, ZEEVI D, et al.Artificial sweeteners induce glucose intolerance by altering the gut microbiota[J].Nature, 2014, 514(7521):181-186.
[45] SERRANO J, SMITH K R, CROUCH A L, et al.High-dose saccharin supplementation does not induce gut microbiota changes or glucose intolerance in healthy humans and mice[J].Microbiome, 2021, 9(1):11.
[46] THOMSON P, SANTIBA EZ R, AGUIRRE C, et al.Short-term impact of sucralose consumption on the metabolic response and gut microbiome of healthy adults[J].British Journal of Nutrition, 2019, 122(8):856-862.
EZ R, AGUIRRE C, et al.Short-term impact of sucralose consumption on the metabolic response and gut microbiome of healthy adults[J].British Journal of Nutrition, 2019, 122(8):856-862.
[47] SUEZ J, COHEN Y, VALDÉS-MAS R, et al.Personalized microbiome-driven effects of non-nutritive sweeteners on human glucose tolerance[J].Cell, 2022,185(18):3307-3328.
[48] MÉNDEZ-GARC A L A, BUENO-HERN
A L A, BUENO-HERN NDEZ N, CID-SOTO M A, et al.Ten-week sucralose consumption induces gut dysbiosis and altered glucose and insulin levels in healthy young adults[J].Microorganisms, 2022, 10(2):434.
NDEZ N, CID-SOTO M A, et al.Ten-week sucralose consumption induces gut dysbiosis and altered glucose and insulin levels in healthy young adults[J].Microorganisms, 2022, 10(2):434.
[49] PALMN S M S A, COWAN T E, BOMHOF M R, et al.Low-dose aspartame consumption differentially affects gut microbiota-host metabolic interactions in the diet-induced obese rat[J].PLoS One, 2014, 9(10):e109841.
S M S A, COWAN T E, BOMHOF M R, et al.Low-dose aspartame consumption differentially affects gut microbiota-host metabolic interactions in the diet-induced obese rat[J].PLoS One, 2014, 9(10):e109841.
[50] UEBANSO T, OHNISHI A, KITAYAMA R, et al.Effects of low-dose non-caloric sweetener consumption on gut microbiota in mice[J].Nutrients, 2017, 9(6):662.
[51] SHI Z J, LEI H H, CHEN G, et al.Impaired intestinal Akkermansia muciniphila and aryl hydrocarbon receptor ligands contribute to nonalcoholic fatty liver disease in mice[J].mSystems, 2021, 6(1):e00985-20.
[52] BIAN X M, CHI L, GAO B, et al.Gut microbiome response to sucralose and its potential role in inducing liver inflammation in mice[J].Frontiers in Physiology, 2017, 8:487.
[53] CHI L, YANG Y F, BIAN X M, et al.Chronic sucralose consumption inhibits farnesoid X receptor signaling and perturbs lipid and cholesterol homeostasis in the mouse livers, potentially by altering gut microbiota functions[J].Science of the Total Environment, 2024, 919:169603.
[54] LAFOREST-LAPOINTE I, DE SHERBROORE U, et al.Maternal consumption of artificially sweetened beverages during pregnancy is associated with infant gut microbiota and metabolic modifications and increased infant body mass index[J].Gut Microbes, 2021, 13(1):1-15.
[55] NETTLETON J E, CHO N A, KLANCIC T, et al.Maternal low-dose aspartame and Stevia consumption with an obesogenic diet alters metabolism, gut microbiota and mesolimbic reward system in rat dams and their offspring[J].Gut, 2020, 69(10):1807-1817.
[56] RODRIGUEZ-PALACIOS A, HARDING A, MENGHINI P, et al.The artificial sweetener splenda promotes gut proteobacteria, dysbiosis, and myeloperoxidase reactivity in Crohn’s disease-like ileitis[J].Inflammatory Bowel Diseases, 2018, 24(5):1005-1020.
[57] LI X T, LIU Y L, WANG Y, et al.Sucralose promotes colitis-associated colorectal cancer risk in a murine model along with changes in microbiota[J].Frontiers in Oncology, 2020, 10:710.
[58] BISCHOFF S C, BARBARA G, BUURMAN W, et al.Intestinal permeability-a new target for disease prevention and therapy[J].BMC Gastroenterol, 2014, 14(1):189.
[59] SHIL A, LADEIRA FARIA L M, WALKER C A, et al.The artificial sweetener neotame negatively regulates the intestinal epithelium directly through T1R3-signaling and indirectly through pathogenic changes to model gut bacteria[J].Frontiers in Nutrition, 2024, 11:1366409.
[60] BIAN X M, CHI L, GAO B, et al.The artificial sweetener acesulfame potassium affects the gut microbiome and body weight gain in CD-1 mice[J].PLoS One, 2017, 12(6):e0178426.
[61] CHI L, BIAN X M, GAO B, et al.Effects of the artificial sweetener neotame on the gut microbiome and fecal metabolites in mice[J].Molecules, 2018, 23(2):367.
[62] MURALI A, GIRI V, CAMERON H J, et al.Investigating the gut microbiome and metabolome following treatment with artificial sweeteners acesulfame potassium and saccharin in young adult Wistar rats[J].Food and Chemical Toxicology, 2022, 165:113123.
[63] VAMANU E, PELINESCU D, GATEA F, et al.Altered in vitro metabolomic response of the human microbiota to sweeteners[J].Genes, 2019, 10(7):535.
[64] UMU Ö C O, RUDI K, DIEP D B.Modulation of the gut microbiota by prebiotic fibres and bacteriocins[J].Microbial Ecology in Health and Disease, 2017, 28(1):1348886.
[65] FRANKENFELD C L, SIKAROODI M, LAMB E, et al.High-intensity sweetener consumption and gut microbiome content and predicted gene function in a cross-sectional study of adults in the United States[J].Annals of Epidemiology, 2015, 25(10):736-742.e4.
[66] AHMAD S Y, FRIEL J, MACKAY D.The effects of non-nutritive artificial sweeteners, aspartame and sucralose, on the gut microbiome in healthy adults:Secondary outcomes of a randomized double-blinded crossover clinical trial[J].Nutrients, 2020, 12(11):3408.
[67] HARRINGTON V, LAU L, CRITS-CHRISTOPH A, et al.Interactions of non-nutritive artificial sweeteners with the microbiome in metabolic syndrome[J].Immunometabolism, 2022, 4(2):e220012.