活性包装即为在普通包装基质中添加活性物质,添加物可以与被包装食品或者周围环境相互作用,从而达到减轻食品氧化以及微生物污染风险的目的,且不会对食品品质造成影响。在VILELA等[1]的研究中,食品包装中加入的活性剂包括抗氧化剂[多酚、α-生育酚、丁基羟基茴香醚(butylated hydroxyanisole,BHA)、丁基羟基甲苯(butylated hydroxytobuene,BHT)、木质素、精油、植物提取物]、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、二氧化碳排放剂(碳酸氢钠、柠檬酸、碳酸亚铁)、除氧剂(铁、钯、抗坏血酸、邻苯三酚、没食子酸、葡萄糖氧化酶、漆酶)、乙烯清除剂(高锰酸钾、活性炭、金属氧化物、二氧化钛)和抗菌剂(金属离子、乳酸链球菌素、精油、溶菌酶、壳聚糖、乳铁蛋白、噬菌体)。其中噬菌体作为天然抗菌剂,具有宿主特异性、自限性以及治疗效率高等特点[2],涉及生物医学、食品工业、传感器和纳米材料等多方面的应用。近年来大量学者聚焦于噬菌体在食品中的应用,商业化噬菌体被美国食品和药物管理局(Food and Drug Administration,FDA)批准为公认安全(Generally Recognized as Safe,GRAS)[3]。噬菌体针对性杀灭宿主细菌,不会对食品中的有益微生物造成影响。与其他化学添加剂相比,在活性包装中噬菌体具有多项抗菌优势,因为它们专门针对细菌污染并降低食品中化学残留的风险。
本文详细介绍噬菌体、活性包装的概念以及应用前景,总结了噬菌体作为抗菌剂的复合材料种类以及噬菌体的封装固定载体和方式,同时梳理活性包装中噬菌体的释放机制,增强消费者对于活性包装的了解,进而打消其对于天然包装的偏好,提高活性包装的可接受度,同时为活性包装的进一步创新研究提供理论基础。
1 噬菌体概述
噬菌体是一种专性杀菌病毒。在1896年和1898年,科学家分别在对霍乱弧菌和枯草芽孢杆菌的实验中检测到很强的抗菌活性物质[4]。在1915年,英国医学细菌学家FREDERICK TWORT在观察微球菌时出现类似的现象,提出是因为病毒的存在导致其强抗菌性。1917年,法裔加拿大微生物学家D’HERELLE在痢疾患者粪便样本的无细菌滤液中观察到一种“看不见的微生物”,这些“看不见的微生物”促使液体悬浮液的裂解,并使细菌平板上出现清晰的透明区域。D’HERELLE第一次解释到,这些病毒通过牺牲细菌实现自我复制,导致细菌死亡和裂解。
噬菌体的数量是细菌的10倍,据估计,噬菌体种群由大约1031个噬菌体颗粒组成,是地球上最丰富的实体[5-6]。噬菌体是一个异质性很强的类群,不仅可以根据其核酸组成(dsDNA、ssDNA、dsRNA和ssRNA)进行分类,还可以根据其形态结构进行分类(如图1所示)[7]。大多数噬菌体是尾状(约96%),属于尾状目。尾状噬菌体被进一步划分为短尾(podoviridae)、长尾不收缩(siphoviridae)和收缩尾(myoviridae)3个家族[8]。但是,由于遗传多样性高,收缩尾科的一些噬菌体已被重新分类为2个新的家族——阿克曼病毒科(Ackermannviridae)和赫勒利病毒科(Herelleviridae)。
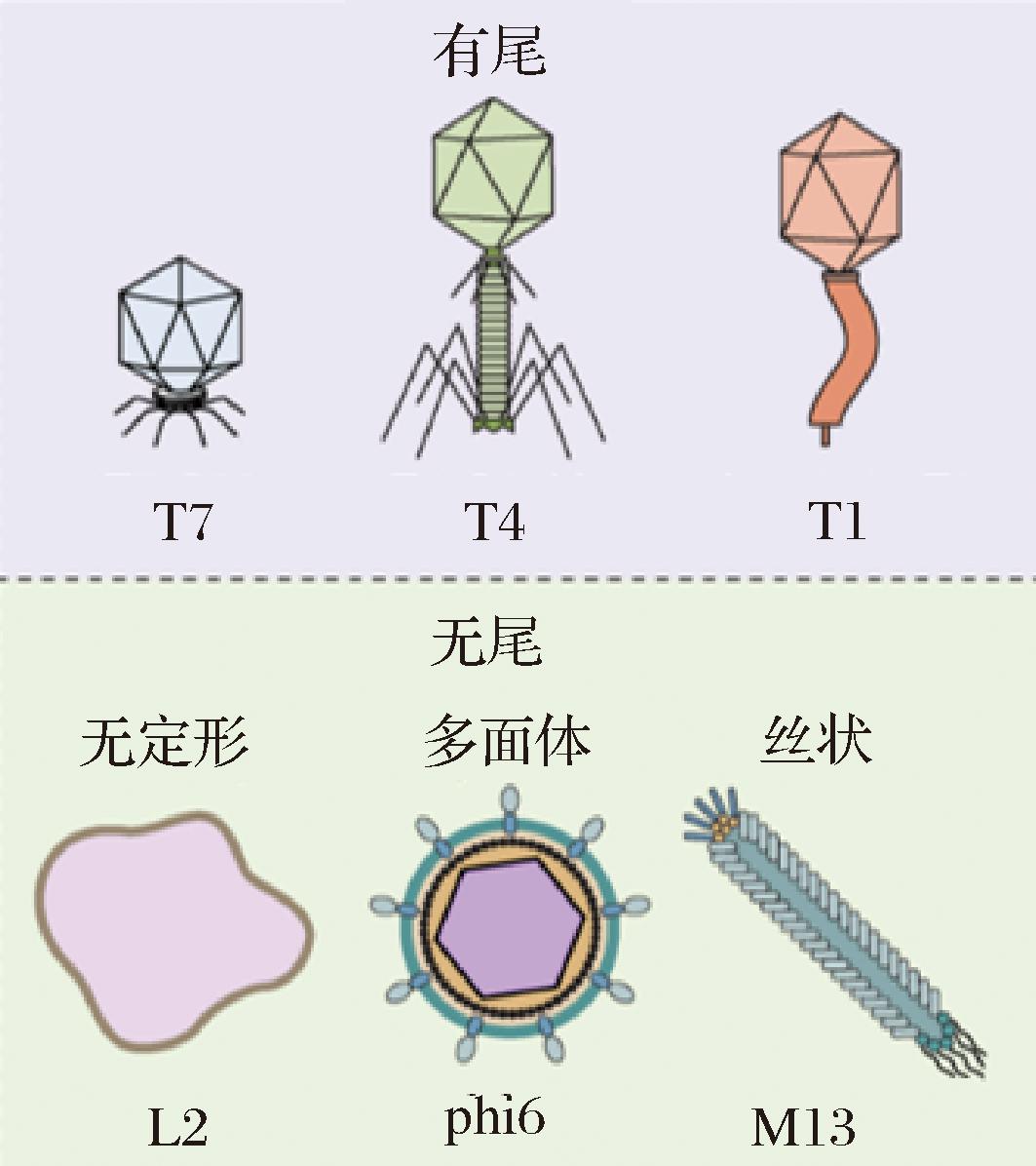
图1 噬菌体形态示意图[9]
Fig.1 Schematic diagram of phage morphology[9]
噬菌体只能依附于其特定宿主生活,因为噬菌体需要有活力的细菌细胞来进行复制和增殖。噬菌体的复制周期为吸附、侵入、核酸复制,最后形成病毒粒子[10]。这个过程会导致细胞裂解,进而使得噬菌体从细胞中释放。噬菌体通常对细菌种属具有特异性,甚至是菌株亚种特异性。但是仍有部分噬菌体能够感染不同的物种,称之为宽谱噬菌体。这种特异性由位于细菌细胞表面的受体(如脂多糖片段或外膜蛋白)所决定[11]。依据噬菌体感染细菌时侵入的生命周期,将其分为两类:温和型和裂解型(如图2所示)。裂解型噬菌体感染时总会使宿主裂解并释放子代[12]。正是因为裂解型噬菌体不会在宿主内部残留,所以裂解型噬菌体是抗菌应用的首选。而温和型噬菌体会进入溶原周期,这意味着它们的基因组会以稳定的方式(称为前噬菌体)整合并与宿主基因组共存,且在宿主细胞复制时一同复制[13]。若有外部因素(通常会给细胞造成某种压力),温和型噬菌体便会进入裂解周期。在以往的研究中,从溶原状态到裂解状态的转换一直是噬菌体研究的重要课题。ENGELBERG-KULKA等[14]研究发现λcI阻遏蛋白决定了噬菌体从溶原型转换为裂解型。λcI阻遏蛋白在DNA损伤条件下被裂解,裂解的λcI阻遏蛋白不充当阻遏物,使噬菌体λ从溶原循环转变为裂解循环,这归因于应激反应(SOS反应)。在原噬菌体λ的溶原菌株中,λRexB的存在可能导致SOS反应。在之前的研究中发现λRexB可以抑制抗毒素MazE的降解,从而防止MazF的毒性作用。因此,噬菌体λRexB基因不仅通过阻止其大肠杆菌宿主死亡来保护原噬菌体状态,而且还间接参与溶原-裂解的转换。
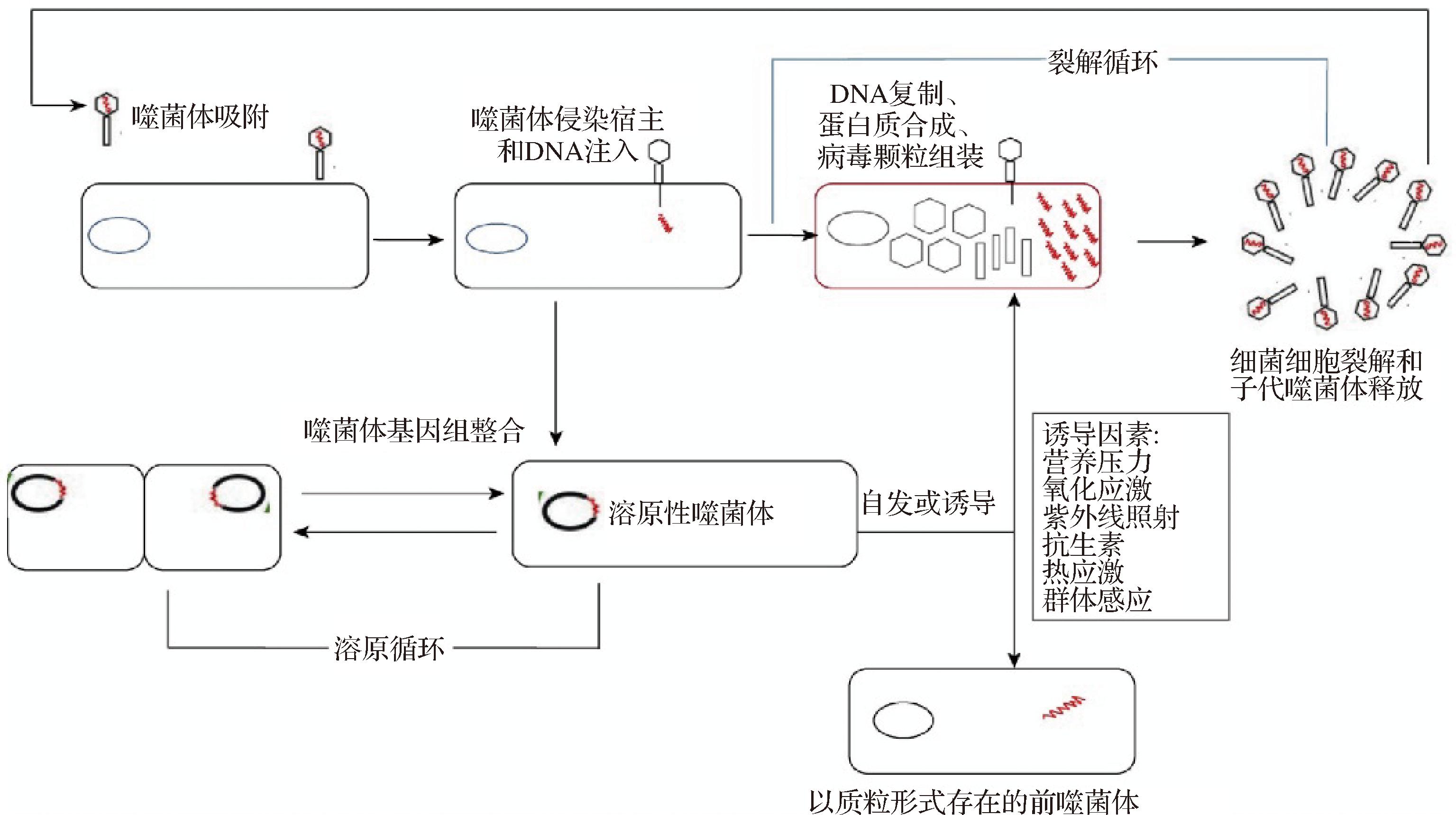
图2 噬菌体裂解和溶原过程[15]
Fig.2 Phage lysis and lysogenic process[15]
如何确保噬菌体长期有效的抑菌活性以及逆境中的活性稳定性是当前研究热点。由于噬菌体直接接触食物时活性会丧失,因此大量研究致力于将噬菌体包封于薄膜或者胶囊中再加以利用,以提高噬菌体的抗菌活性以及稳定性。ZHANG等[16]采用黄原胶/海藻酸钠/氯化钙/壳聚糖的方法对沙门氏菌噬菌体进行微囊化,以提高其胃肠道稳定性。CUI等[17]设计了一种含有脂质体的壳聚糖可食用薄膜来包裹噬菌体,以有效避免噬菌体在食品中因酸性化合物、酶和蒸发物的存在而失去生物活性。
2 活性包装
活性包装是一种先进的技术,它将包装、产品和环境之间的相互作用整合在一起,以提高目标产品的保质期,通常会改变包装食品的自然环境,从而提高产品的可持续性、安全性、质量和保质期[18]。活性包装是一种通过主动改变包装内部环境或与食品/产品相互作用,以延长保质期、改善安全性或维持品质的先进包装技术,可分为释放型和吸收型两大类[19]。活性包装系统的驱动变量可以导向4个不同的方向,即去除任何不需要的成分,加入特定的所需成分,增强包装的表面抗菌活性,改变包装的物理特性[20]。因此,活性包装是一个一步的战略干预,以提供可以提高产品寿命的方式。
将具有抗氧化、抗菌和抗紫外线特性的活性物质掺入聚合物基质、涂层、标签、垫子或小袋中是活性包装使用的一种技术。藻类植物,包括像大麻、草药、香料、水果或蔬菜这样的经济作物,都可以提供活性元素(酚类化合物)[21]。使用活性包装基本上可以减少抗氧化剂和抗菌剂等活性化合物的数量,而不是直接将它们添加到膳食中。最近的研究证明,大多数新鲜和加工食品、食品降解或微生物增殖仅在表面发生和启动。因此,为了解决这个问题,大多数食品包装系统中通常都包含活性化合物。当活性化合物直接放入食品中时,由于与食物成分的相互作用或在食品制备过程中,它们的活性可能会受到限制或减弱。因此,近期研究大多集中于将活性化学品放在活性包装中而不是食品的主体中。许多活性食品包装正在研发中,如风味和气味吸收包装、湿气管理包装、氧气清除剂、二氧化碳排放框架、抗菌活性包装和乙烯清除剂[22]。
3 基于噬菌体的复合材料在食品保鲜包装中的应用
在活性包装中添加噬菌体需要解决加工和贮存过程中诱导物理和化学应力的因素,避免噬菌体稳定性降低以及失活的问题。需要保证噬菌体的形态完整以及单一颗粒的分散性,防止噬菌体颗粒与周围环境中的包装材料自聚或融合,从而影响噬菌体的抑菌活性。因此需要复合材料加以辅助进行噬菌体的封装或固定。
3.1 材料种类
大量研究聚焦于封装/固定噬菌体的复合材料,包括天然材料和合成材料(表1)。封装材料的选择对于噬菌体的成功应用至关重要。考虑到噬菌体在活性包装中的应用目的和途径,用于制造封装载体的材料应该是安全、无毒、生物相容性、可生物降解且对食品无刺激性、无损伤性的。同时,考虑到活性包装的应用场景,温度、湿度以及外界恶劣环境都可能对噬菌体活性造成影响,因此封装材料应具有良好的耐各种恶劣环境能力,以保障噬菌体在食品贮存过程中可以持续抗菌。壳聚糖是最为常见的包封材料,其具有亲水性外层和疏水性腔,同时具有一定的抗菌和抗氧化能力,优异的成膜能力和机械性能,可与噬菌体组成复合物,增强基于噬菌体的活性包装的包封结构[23]。低甲氧基果胶的半乳糖醛酸单元可以与多价阳离子(Ca2+)形成凝胶并包封噬菌体,避免被外界强酸环境影响[24]。
表1 活性食品包装中用于噬菌体封装/固定的复合材料
Table 1 Composites for phage encapsulation/immobilization in active food packaging

噬菌体宿主菌包装材料应用文献T3大肠杆菌海藻酸盐食品工业杀菌[25]philPLA-RODI金黄色葡萄球菌明胶奶酪保鲜[26]T7大肠杆菌乳清分离蛋白即食蔬菜和水果保鲜[27]vB_EcoMH2 W大肠杆菌壳聚糖西红柿保鲜[28]K (ATCC-19685B1)金黄色葡萄球菌胍基功能化聚(氧氮基降冰片烯)亚胺聚合物生物膜消除[29]WA大肠杆菌海藻酸钠和聚醋酸乙烯酯混合材料有机长叶莴苣保鲜[30]T4大肠杆菌麦芽糖糊精和海藻糖混合材料牛奶和肉类保鲜[31]大肠杆菌噬菌体大肠杆菌O157∶H7海藻酸钠/聚环氧乙烷纳米纤维牛肉和蔬菜保鲜[32]FGS011沙门氏菌甲基丙烯酸和甲基丙烯酸甲酯的共聚物鸡体内杀菌[33]SPT 015沙门氏菌乳清分离蛋白和海藻糖复合材料体外杀菌[34]
3.2 封装/固定载体
目前已经从各种结构材料中开发了各种载体来封装噬菌体并提高噬菌体在贮存过程中的稳定性,包括纤维、乳液、脂质体、水凝胶和颗粒(表2),总结了各种载体封装材料以及研究进展和取得的结果。纤维是指用静电纺丝技术制造的静电纺丝纤维,具有易于控制、连续生产、非热加工等优点[35]。乳液是一种合适的载体,具有高包埋效率,为噬菌体提供了良好的包封环境。根据物相组成,常规乳液可分为两类型,即水包油(oil in water,O/W)和油包水(water in oil,W/O)乳液[36]。通过将初始乳液作为分散相掺入另一个连续相中,可以制备多种乳液。脂质体是具有细胞膜样结构的球形囊泡,由磷脂(卵磷脂、头孢素、大豆磷脂)、胆固醇和其他成分组成。脂质体的核心包含一个水相,其中可以掺入封装噬菌体。脂质体的磷脂双层膜可以为噬菌体提供物理保护。脂质体作为一种有效的包埋系统,具有易于制备(溶剂注入、薄膜水合和反向蒸发法)、生物相容性、生物降解性和成本效益等众多优点[37]。水凝胶由通过物理或化学模式交联的三维亲水性聚合物网络组成,由液相(水)和固相(聚合物)2部分组成。水凝胶具备优异的机械强度和吸水能力。在水性环境中,多孔网络可以通过水合作用和毛细管力吸收大量水,然后膨胀并缓慢释放嵌入的物质。由于水凝胶具有高孔隙率和大比表面积,因此具有很高的包埋效率。除此之外,水凝胶还具有保湿性、生物降解性以及与生物活性化合物功能化的特性。噬菌体封装成颗粒的生产方法主要有冷冻干燥、电喷雾和喷雾干燥。其中喷雾干燥由于具有较低的比能耗和可以大规模生产的优点,已被广泛用于将噬菌体封装成干燥的粉末颗粒。
表2 活性食品包装中用于噬菌体封装/固定的载体
Table 2 Carriers for phage encapsulation/immobilization in active food packaging
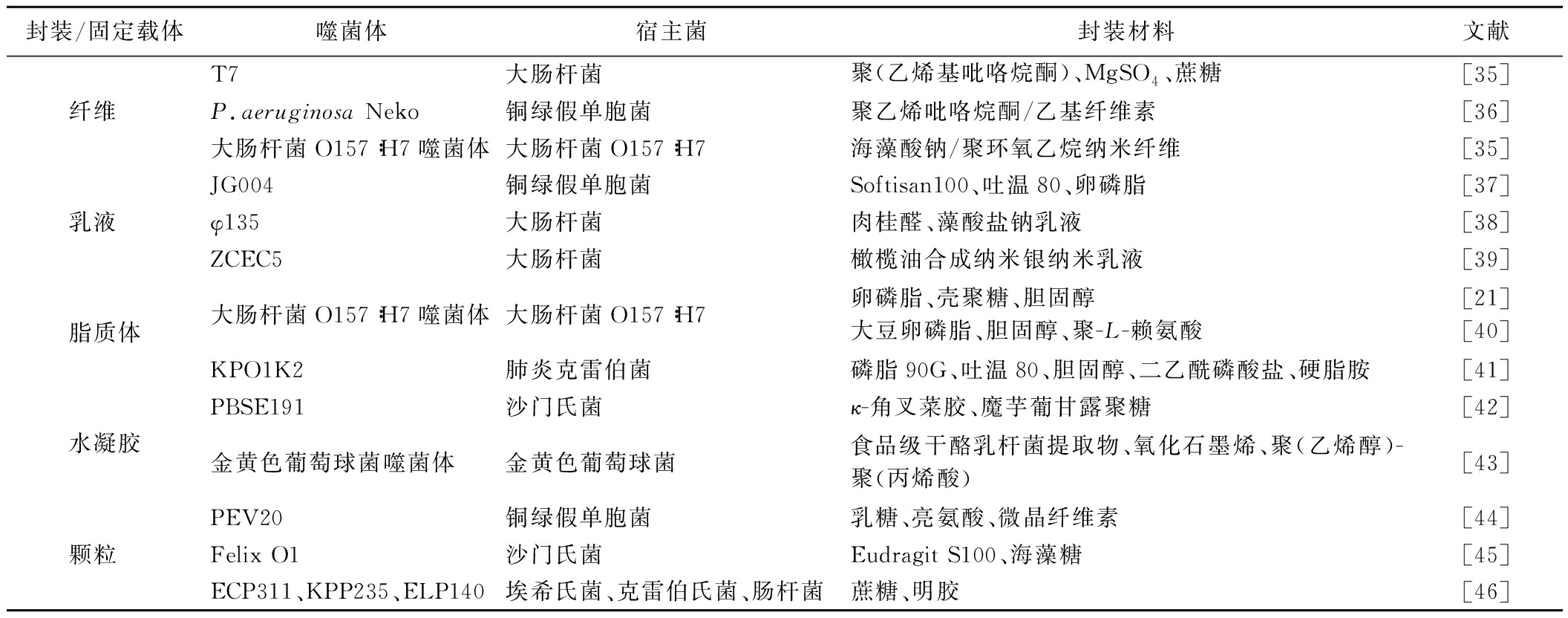
封装/固定载体噬菌体宿主菌封装材料文献纤维 T7大肠杆菌聚(乙烯基吡咯烷酮)、MgSO4、蔗糖[35]P.aeruginosa Neko铜绿假单胞菌聚乙烯吡咯烷酮/乙基纤维素[36]大肠杆菌O157∶H7噬菌体大肠杆菌O157∶H7海藻酸钠/聚环氧乙烷纳米纤维[35]乳液 JG004铜绿假单胞菌Softisan100、吐温80、卵磷脂[37]φ135大肠杆菌肉桂醛、藻酸盐钠乳液[38]ZCEC5大肠杆菌橄榄油合成纳米银纳米乳液[39]脂质体大肠杆菌O157∶H7噬菌体大肠杆菌O157∶H7卵磷脂、壳聚糖、胆固醇大豆卵磷脂、胆固醇、聚-L-赖氨酸[21][40]KPO1K2肺炎克雷伯菌磷脂90G、吐温80、胆固醇、二乙酰磷酸盐、硬脂胺[41]水凝胶PBSE191沙门氏菌κ-角叉菜胶、魔芋葡甘露聚糖[42]金黄色葡萄球菌噬菌体金黄色葡萄球菌食品级干酪乳杆菌提取物、氧化石墨烯、聚(乙烯醇)-聚(丙烯酸)[43]颗粒 PEV20铜绿假单胞菌乳糖、亮氨酸、微晶纤维素[44]Felix O1沙门氏菌Eudragit S100、海藻糖[45]ECP311、KPP235、ELP140埃希氏菌、克雷伯氏菌、肠杆菌蔗糖、明胶[46]
3.3 噬菌体封装/固定方法
3.3.1 物理包埋
噬菌体的物理包埋是指将噬菌体包埋在另一种材料中而不形成化学键。常用方法包括乳化、喷雾干燥、电喷涂、静电纺丝、溶剂蒸发、凝聚和离子凝胶化,这些都是重要的包埋技术。3.2节中所提及的纤维、乳液、脂质体、水凝胶和颗粒封装/固定载体均为物理包埋的方式。
3.3.2 物理吸附
物理吸附通过范德华力、氢键和其他非共价相互作用发生在噬菌体和表面之间。在某些情况下,由于噬菌体和基质之间的电荷吸引,静电相互作用参与噬菌体与基质的黏附。噬菌体广泛用于食品安全和其他领域,遇到酸性和碱性pH等压力源,导致其灭活。可以通过纸或消费品包装中常用的改性聚合物薄膜表面等材料来实现对这些应力的稳定。MEYER等[47]通过将噬菌体固定于用羧酸(羧甲基纤维素)或胺(壳聚糖)官能化的滤纸上,可增强噬菌体的杀菌性。将噬菌体吸收于食品级吸水垫中,直接放在冰鲜肉托盘的食物上,延长冷藏食品保质期。除此之外,由于传统抗生素和其他化学处理方法会产生不可逆的抗性。在食品包装应用中,抗菌聚合物薄膜在抗菌剂耗尽后功效降低,导致微生物产生耐药性。在食品包装材料中使用噬菌体的主要挑战在于使用乳化、喷雾干燥和聚合等技术将它们封装固定在聚合物中,但是这些方法通常会使噬菌体结构受损,从而导致其活性降低。鉴于此,研究人员正在探索通过使用逐层(layer by layer,LbL)技术制造多层薄膜来提高噬菌体抗菌功效。LbL技术的突出之处在于它能够从各种各样的材料中选择性地构建并精确地控制多层膜的纳米级组成。此外,LbL涂层通过非共价相互作用实现承载功能分子的多功能平台,保障噬菌体在活性包装中的稳定性和高效递送。因此,LbL薄膜可以作为食品包装应用中封装固定噬菌体的媒介,含有噬菌体的LbL膜具有抗菌涂层的潜力。FRANCIUS等[48]使用LbL沉积方法制备了一系列具有不同聚阳离子-聚阴离子组合的聚电解质多层(polyelectrolyte multilayer,PEM)薄膜,测量了PEM薄膜对于噬菌体的吸附能力以及抗菌性。
3.3.3 共价固定
由于噬菌体物理固定的局限性,如受pH、离子强度或温度等环境因素影响,从而导致噬菌体吸附具有不牢固和可逆性的不足,因此大量学者进一步研究了共价固定的应用。共价固定是指噬菌体通过形成共价键与活性包装基质进行化学附着,使得噬菌体活性增强。噬菌体共价固定化具有以下4个优点:稳定性增强、浸出率低、效率高和活性持续时间长。通过在各种聚合物表面或基质上的共价附着来定向固定噬菌体,可以增强噬菌体外部响应刺激。多种聚合物常用于与噬菌体进行结合或者共聚合。PEARSON等[49]利用微波等离子体在聚乙烯(polyethylene,PE)和聚四氟乙烯(polytetrafluoroethylene,PTFE)表面形成酸(—COOH)基团,然后通过酸胺反应使T1和Φ11噬菌体共价附着,有效地保证了噬菌体对大肠杆菌和金黄色葡萄球菌的持续感染性。原始聚合聚醚砜(polyethersulfone,PES)膜、经氧等离子体处理的羧基功能化聚醚砜(PES-O2)以及经EDC/NHS交联剂和乙二胺(EDA)处理的胺功能化聚醚砜膜(PES-O2-EDA)也被用于固定T4噬菌体。经过氧等离子体处理的表面改性增加了噬菌体的结合力,主要依靠PES-O2和PES-O2-EDA的羧基和胺官能团。
3.3.4 主客体相互作用
主客体相互作用是指宿主分子之间的非共价相互作用,它提供了一个腔体或结合位点来容纳客体分子,形成稳定的主客体复合物。这些相互作用涉及氢键、范德华力、疏水相互作用力和静电相互作用力等。链霉亲和素和生物素的相互作用属于宿主-客体系统或蛋白质-配体系统,具有高亲和力、稳定性、特异性和定向的分子固定。虽然噬菌体可以通过被动吸附固定在各种聚合物表面,但却难以满足有效识别和感染特定食源性病原体的需求。尾状和丝状噬菌体理想的方向应该是头朝下、尾朝上或侧边,以提高其功效。丝状噬菌体容易聚集,需要技术来实现丝状噬菌体在底物上的平行排列。需要对噬菌体的衣壳以及头部进行化学生物素化,使噬菌体能够以特定方向固定在链霉亲和素标记的磁珠上,从而通过释放噬菌体尾部来实现噬菌体的裂解活性。
4 活性包装中噬菌体的释放机制
第1种机制将水作为释放过程中的主要调节器。在这种情况下,水分子从液体溶液扩散到聚合物基质中,通过产生新的键并中断原始相互作用(聚合物-聚合物、聚合物-增塑剂、聚合物-噬菌体),导致分子间空间的增加[50]。这种现象可能产生2种结果:a)噬菌体有更多的自由空间可以向食品表面扩散;b)水分滞留会促进聚合物被侵蚀,从而导致活性包装结构发生变化。随着时间的推移,活性包装逐渐变得松散,基质将被破坏,从而导致噬菌体迅速释放。这种机制可能与活性包装基质的溶胀性、溶解度、食品模拟剂的极性以及亲水性有关[51]。
第2种机制是噬菌体向食品表面自然扩散。在这种情况下,挥发性化合物、噬菌体浓度,甚至聚合物基质与食物之间的亲和力都可能发挥重要作用。孔径较大的食物可能会增强噬菌体的扩散速率。这种机制与活性包装是否和食品表面之间的直接接触无关。例如,用挥发性化合物制备的活性包装不需要直接接触,但包装必须与食品形成顶部空间。这种机制适用于各种食品,包括含水量较低的食品。这种机制的主要限制是抗菌剂的快速释放导致其浓度快速降低以及活性包装效果的降低。同时,如果噬菌体浓度增加,则必须注意确保在贮存过程中是否会产生抗性菌,从而影响噬菌体的抗菌效果[51]。
5 结论
综上所述,本文首先介绍了噬菌体以及活性包装的概念,进一步阐述基于噬菌体的活性包装所使用的材料种类、包封固定载体以及方法,最后总结了噬菌体在活性包装的释放机制。尽管目前食品包装已经取得了一定的研究进展,但是由食源性致病菌引起的食品感染问题仍存在极大的危险和挑战。活性包装材料中加入生物抗菌剂既可以避免化学抗生素可能带来的耐药性,又响应绿色环保安全的要求,不会对环境以及食品本身造成影响,被认为是大幅降低甚至根除食源性致病菌的有效方法。噬菌体作为天然抗菌剂,被广泛用于新鲜果蔬、肉制品以及即食产品的品质保障中。同时,噬菌体具有可调控性,未来可以通过进化实验进化出耐高温、耐强酸强碱、多宿主活性的噬菌体,或者通过工程噬菌体增强其靶向性和功效,满足各种食品包装条件的应用。基于噬菌体的活性包装材料除了用于食品包装外,还有可能成为生物医学应用的绝佳候选者,例如植入物或组织工程和再生医学的涂层。目前,不同新兴技术已经彻底改变了食品包装行业,例如纳米封装、可持续聚合物材料和先进的封装策略。因此,材料科学、食品科学和包装行业之间的跨学科合作是非常必要的,重点是控释机制的研究、工艺优化以实现商业化水平的可扩展性,以及确切的监管标准,最终保障各行业的蓬勃发展。
[1] VILELA C, KUREK M, HAYOUKA Z, et al.A concise guide to active agents for active food packaging[J].Trends in Food Science &Technology, 2018, 80:212-222.
[2] WANG J H, ZHENG Y Q, HUANG H K, et al.An overview of signal amplification strategies and construction methods on phage-based biosensors[J].Food Research International, 2024, 191:114727.
[3] JAHANDAR-LASHAKI S, FARAJNIA S, FARAJI-BARHAGH A, et al.Phage display as a medium for target therapy based drug discovery, review and update[J].Molecular Biotechnology, 2025,67(6):2161-2184.
[4] KIRCHHELLE C, LIPTON M F, NOLAN T M, et al.Reuse, repurpose, and recycle:Bacteriophages and microbial surveillance (1921-2023)[J].Phage, 2024, 5(1):14-21.
[5] OLUWARINDE B O, AJOSE D J, ABOLARINWA T O, et al.Safety properties of Escherichia coli O157:H7 specific bacteriophages:Recent advances for food safety[J].Foods, 2023, 12(21):3989.
[6] HUANG Z H, ZHANG Z H, TONG J R, et al.Phages and their lysins:Toolkits in the battle against foodborne pathogens in the postantibiotic era[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4):3319-3343.
[7] HOU Y T, WU Z H, REN L, et al.Characterization and application of a lytic jumbo phage ZPAH34 against multidrug-resistant Aeromonas hydrophila[J].Frontiers in Microbiology, 2023, 14:1178876.
[8] COSTA M J, PASTRANA L M, TEIXEIRA J A, et al.Bacteriophage delivery systems for food applications:Opportunities and perspectives[J].Viruses, 2023, 15(6):1271.
[9] VALENCIA-TOXQUI G, RAMSEY J.How to introduce a new bacteriophage on the block:A short guide to phage classification[J].Journal of Virology, 2024, 98(10):e0182123.
[10] ZHANG Y T, MIAO J J, ZHANG N, et al.The analysis of the function, diversity, and evolution of the Bacillus phage genome[J].BMC Microbiology, 2023, 23(1):170.
[11] NING Y, TENG T S, WU X H, et al.Development of an enzyme-linked phage receptor-binding protein assay (ELPRA) based on a novel biorecognition molecule- receptor-binding protein Gp130 of Pseudomonas aeruginosa bacteriophage Henu5[J].Enzyme and Microbial Technology, 2024, 177:110442.
[12] CHOO K W, MAO L, MUSTAPHA A.CAM-21, a novel lytic phage with high specificity towards Escherichia coli O157:H7 in food products[J].International Journal of Food Microbiology, 2023, 386:110026.
[13] LEE H J, KIM H J, LEE S J.Control of λ lysogenic Escherichia coli cells by synthetic λ phage carrying cIantisense[J].ACS Synthetic Biology, 2022, 11(11):3829-3835.
[14] ENGELBERG-KULKA H, KUMAR S.Yet another way that phage λ manipulates its Escherichia coli host:λ is involved in the lysogenic—lytic switch[J].Molecular Microbiology, 2015, 96(4):689-693.
[15] 陈学梅, 魏云林, 季秀玲.前噬菌体研究进展[J].遗传, 2021, 43(3):240-248.CHEN X M, WEI Y L, JI X L.Research progress of prophages[J].Hereditas, 2021, 43(3):240-248.
[16] ZHANG B, WANG Y X, WANG F F, et al.Microencapsulated phage composites with increased gastrointestinal stability for the oral treatment of Salmonella colonization in chicken[J].Frontiers in Veterinary Science, 2023, 9:1101872.
[17] CUI H Y, YUAN L, LIN L.Novel chitosan film embedded with liposome-encapsulated phage for biocontrol of Escherichia coli O157:H7 in beef[J].Carbohydrate Polymers, 2017, 177:156-164.
[18] TYAGI P, SALEM K S, HUBBE M A, et al.Advances in barrier coatings and film technologies for achieving sustainable packaging of food products-a review[J].Trends in Food Science &Technology, 2021, 115:461-485.
[19] 孙彦梅, 吴世芳, 尚天翠, 等.壳聚糖-明胶-恰玛古提取物活性包装膜的制备及其对新疆褐牛肉保鲜效果的研究[J/OL].食品与发酵工业, 2025.https://doi.org/10.13995/j.cnki.11-1802/ts.041159.SUN Y M, WU S F, SHANG T C, et al.Preparation of active packaging film of chitosan-gelatin-chamagu extract and its effect on fresh-keeping of Xinjiang brown beef[J/OL].Food and Fermentation Industries, 2025.https://doi.org/10.13995/j.cnki.11-1802/ts.041159.
[20] MOEINI A, GERMANN N, MALINCONICO M, et al.Formulation of secondary compounds as additives of biopolymer-based food packaging:A review[J].Trends in Food Science &Technology, 2021, 114:342-354.
[21] UPADHYAY A, AGBESI P, ARAFAT K M Y, et al.Bio-based smart packaging:Fundamentals and functions in sustainable food systems[J].Trends in Food Science &Technology, 2024, 145:104369.
[22] PERERA K Y, SHARMA S, PRADHAN D, et al.Seaweed polysaccharide in food contact materials (active packaging, intelligent packaging, edible films, and coatings)[J].Foods, 2021, 10(9):2088.
[23] WANG H X, HU L D, PENG L, et al.Dual encapsulation of β-carotene by β-cyclodextrin and chitosan for 3D printing application[J].Food Chemistry, 2022, 378:132088.
[24] ![]() M, GRASSINO A N, ZHU Z Z, et al.An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products:Ultrasound-, microwaves-, and enzyme-assisted extraction[J].Trends in Food Science &Technology, 2018, 76:28-37.
M, GRASSINO A N, ZHU Z Z, et al.An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products:Ultrasound-, microwaves-, and enzyme-assisted extraction[J].Trends in Food Science &Technology, 2018, 76:28-37.
[25] RICHARDS K, MALIK D J.Microencapsulation of bacteriophages using membrane emulsification in different pH-triggered controlled release formulations for oral administration[J].Pharmaceuticals, 2021, 14(5):424.
[26] WENG S H, L PEZ A, S
PEZ A, S EZ-ORVIZ S, et al.Effectiveness of bacteriophages incorporated in gelatine films against Staphylococcus aureus[J].Food Control, 2021, 121:107666.
EZ-ORVIZ S, et al.Effectiveness of bacteriophages incorporated in gelatine films against Staphylococcus aureus[J].Food Control, 2021, 121:107666.
[27] VONASEK E L, CHOI A H, SANCHEZ J Jr, et al.Incorporating phage therapy into WPI dip coatings for applications on fresh whole and cut fruit and vegetable surfaces[J].Journal of Food Science, 2018, 83(7):1871-1879.
[28] AMARILLAS L, LIGHTBOURN-ROJAS L, ANGULO-GAXIOLA A K, et al.The antibacterial effect of chitosan-based edible coating incorporated with a lytic bacteriophage against Escherichia coli O157:H7 on the surface of tomatoes[J].Journal of Food Safety, 2018, 38(6):e12571.
[29] PARK J, HASSAN M A, NABAWY A, et al.Engineered bacteriophage-polymer nanoassemblies for treatment of wound biofilm infections[J].ACS Nano, 2024, 18(39):26928-26936.
[30] PACIOS-MICHELENA S, RODR GUEZ-HERRERA R, RINC
GUEZ-HERRERA R, RINC N-ENR
N-ENR QUEZ G, et al.Effect of encapsulation and natural polyphenolic compounds on bacteriophage stability and activity on Escherichia coli in Lactuca sativa L.var.longifolia[J].Journal of Food Safety, 2023, 43(2):e13000.
QUEZ G, et al.Effect of encapsulation and natural polyphenolic compounds on bacteriophage stability and activity on Escherichia coli in Lactuca sativa L.var.longifolia[J].Journal of Food Safety, 2023, 43(2):e13000.
[31] CHOI I, LEE J S, HAN J.Maltodextrin-trehalose miscible system-based bacteriophage encapsulation:Studies of plasticizing effect on encapsulated phage activity and food application as an antimicrobial agent[J].Food Control, 2023, 146:109550.
[32] CUI H Y, YANG X J, LI C Z, et al.Enhancing anti-E.coli O157:H7 activity of composite phage nanofiber film by D-phenylalanine for food packaging[J].International Journal of Food Microbiology, 2022, 376:109762.
[33] LORENZO-REBENAQUE L, MALIK D J, CATAL -GREGORI P, et al.Microencapsulated bacteriophages incorporated in feed for Salmonella control in broilers[J].Veterinary Microbiology, 2022, 274:109579.
-GREGORI P, et al.Microencapsulated bacteriophages incorporated in feed for Salmonella control in broilers[J].Veterinary Microbiology, 2022, 274:109579.
[34] PETSONG K, BENJAKUL S, VONGKAMJAN K.Optimization of wall material for phage encapsulation via freeze-drying and antimicrobial efficacy of microencapsulated phage against Salmonella[J].Journal of Food Science and Technology, 2021, 58(5):1937-1946.
[35] KOO C K W, SENECAL K, SENECAL A, et al.Dehydration of bacteriophages in electrospun nanofibers:Effect of excipients in polymeric solutions[J].Nanotechnology, 2016, 27(48):485102.
[36] JU T, LI J X, WESTON A, et al.Anti-Pseudomonas aeruginosa bacteriophage loaded electrospun fibers for antibacterial wound dressings[J].Macromolecular Rapid Communications, 2025,46(13).
[37] RIOS A C, VILA M M D C, LIMA R, et al.Structural and functional stabilization of bacteriophage particles within the aqueous core of a W/O/W multiple emulsion:A potential biotherapeutic system for the inhalational treatment of bacterial pneumonia[J].Process Biochemistry, 2018, 64:177-192.
[38] ALVES D, CERQUEIRA M A, PASTRANA L M, et al.Entrapment of a phage cocktail and cinnamaldehyde on sodium alginate emulsion-based films to fight food contamination by Escherichia coli and Salmonella enteritidis[J].Food Research International, 2020, 128:108791.
[39] ELSAYED A, SAFWAT A, ABDELSATTAR A S, et al.The antibacterial and biofilm inhibition activity of encapsulated silver nanoparticles in emulsions and its synergistic effect with E.coli bacteriophage[J].Inorganic and Nano-Metal Chemistry, 2023, 53(6):549-559.
[40] LIN L, ZHU Y L, CUI H Y.Inactivation of Escherichia coli O157:H7 treated by poly-L-lysine-coated bacteriophages liposomes in pork[J].Journal of Food Safety, 2018, 38(6):e12535.
[41] SINGLA S, HARJAI K, RAZA K, et al.Phospholipid vesicles encapsulated bacteriophage:A novel approach to enhance phage biodistribution[J].Journal of Virological Methods, 2016, 236:68-76.
[42] KIM S, KIM B S, BAI J, et al.Antibacterial κ-carrageenan/konjac glucomannan-based edible hydrogel film containing Salmonella phage PBSE191 and its application in chicken meat[J].LWT, 2023, 180:114707.
[43] GONG C X, GUAN W, LIU X M, et al.Biomimetic bacteriophage-like particles formed from probiotic extracts and NO donors for eradicating multidrug-resistant staphylococcus aureus[J].Advanced Materials, 2022, 34(45):e2206134.
[44] KHANAL D, CHANG R Y K, HICK C, et al.Enteric-coated bacteriophage tablets for oral administration against gastrointestinal infections[J].International Journal of Pharmaceutics, 2021, 609:121206.
[45] VINNER G K, REZAIE-YAZDI Z, LEPPANEN M, et al.Microencapsulation of Salmonella-specific bacteriophage felix O1 using spray-drying in a pH-responsive formulation and direct compression tableting of powders into a solid oral dosage form[J].Pharmaceuticals, 2019, 12(1):43.
[46] YANG Y F, DU H, ZOU G, et al.Encapsulation and delivery of phage as a novel method for gut flora manipulation in situ:A review[J].Journal of Controlled Release, 2023, 353:634-649.
[47] MEYER A, GREENE M, KIMMELSHUE C, et al.Stabilization of T4 bacteriophage at acidic and basic pH by adsorption on paper[J].Colloids and Surfaces, B:Biointerfaces, 2017, 160:169-176.
[48] FRANCIUS G, CERVULLE M, CLÉMENT E, et al.Impacts of mechanical stiffness of bacteriophage-loaded hydrogels on their antibacterial activity[J].ACS Applied Bio Materials, 2021, 4(3):2614-2627.
[49] PEARSON H A, SAHUKHAL G S, ELASRI M O, et al.Phage-bacterium war on polymeric surfaces:Can surface-anchored bacteriophages eliminate microbial infections?[J].Biomacromolecules, 2013, 14(5):1257-1261.
[50] ZHAO Y, LI B, ZHANG W P, et al.Recent advances in sustainable antimicrobial food packaging:Insights into release mechanisms, design strategies, and applications in the food industry[J].Journal of Agricultural and Food Chemistry, 2023, 71(31):11806-11833.
[51] MALEKJANI N, KARIMI R, ASSADPOUR E, et al.Control of release in active packaging/coating for food products;approaches, mechanisms, profiles, and modeling[J].Critical Reviews in Food Science and Nutrition, 2024, 64(29):10789-10811.