茶黄素是红茶加工过程中由多酚类物质氧化生成的色素之一,是红茶滋味和汤色形成的主要成分,主要包括茶黄素(theaflavin,TF1)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF2A)、茶黄素-3′-没食子酸酯(theaflavin-3′-gallate,TF2B)和茶黄素-3,3′-双没食子酸酯(theaflavin-3,3′-digallate,TFDG)4种[1],其中TFDG活性最强,具有预防癌症[2]、抑菌[3]及抗炎[4]等健康功效,研究最为广泛,但TFDG存在易氧化降解[5]、生物可及性低[6]等缺点,在医药、保健及食品等行业的运用被极大限制。据相关研究可知,β-乳球蛋白(beta-lactoglobulin,β-Lg)可作为多种两亲性和疏水性配体的高效纳米载体[7],保护没食子儿茶素没食子酸酯等多酚类物质的生物活性,防止其氧化降解[8-9]。另外肠道是人体消化吸收的主要器官,而β-Lg作为肠溶载体,能够提高如多酚[10]、花青素[11]等活性成分的生物可及性及稳定性。研究表明,在中性pH下经预热后的β-乳球蛋白具有更多表面暴露的疏水簇,与多酚的结合亲和力加强,可进一步提高多酚的稳定性[12]。
本课题组前期研究表明,TFDG与经85 ℃预热处理后的β-Lg结合可形成稳定澄清的分散体,减少游离TFDG含量,有效降低红茶茶汤中冷后浑的产生。且85 ℃预热后的β-Lg活性位点关键环区域呈展开趋势,此时TFDG被包裹在其活性腔内部与β-Lg结合[13],因此推测β-Lg(85 ℃)与TFDG结合后可有效保护TFDG在贮藏中不被氧化分解,并提升TFDG的生物可及性。
故本研究以β-Lg、TFDG制备复合分散体(β-Lg-TFDG)探究经85 ℃预热处理后的β-Lg在贮藏期中对TFDG的保护作用,同时通过体外消化模拟试验探究β-Lg(85 ℃)在提升TFDG生物可及性上的可行性。本研究为利用β-Lg提升TFDG的贮藏稳定性、生物可及性提供了理论基础,有利于扩宽TFDG及β-Lg的应用。
1 材料与方法
1.1 材料与试剂
β-Lg(纯度≥90%),美国Sigma-Aldrich仪器有限公司;α-淀粉酶(200 U/mg),上海泰坦科技股份公司;TFDG(纯度≥98%),成都普菲德生物技术有限公司;胰酶(130.03 U/mg)、胃蛋白酶(3 256 U/mg)、胆酸钠,上海阿拉丁生化科技股份有限公司;其他化学品均为分析级。
1.2 仪器与设备
HWS-26电热恒温水浴锅,上海一恒科学仪器有限公司;HWCL-1集热式恒温磁力搅拌浴,郑州长城科工贸有限公司;FA2004A电子天平,上海舜宇恒平科学仪器有限公司;ULUP-Ⅱ-10T优普超纯水机,四川优普超纯科技有限公司;Nano ZS90 Zeta粒度分析仪,英国马尔文仪器有限公司;UV-2450紫外-可见分光光度计,日本岛津公司;MV-100涡旋混合器,武汉赛维尔生物科技有限公司;H1850R型台式高速冷冻离心机,长沙湘仪离心机有限公司;SN-MS-H2800磁力搅拌器,上海尚普仪器设备有限公司;YS2580分光测色仪,广东三恩时科技有限公司;1200高效液相色谱,安捷伦科技有限公司。
1.3 实验方法
1.3.1 β-Lg-TFDG复合物的制备
参考ZHONG等[13]的方法,稍作修改。配制0.405 mmol/L的β-Lg母液溶于pH 7.0磷酸盐缓冲液,以400 r/min使用磁力搅拌器室温搅拌2 h,静置过夜使充分溶解;配制1.62 mmol/L的TFDG母液溶于pH 2.5磷酸盐缓冲液。β-Lg母液和TFDG母液须现配现用,以避免β-Lg污染和TFDG氧化,且在溶液中添加β-Lg和TFDG不会明显改变pH值。吸取适量的β-Lg母液以及pH 7.0磷酸盐缓冲液分别在85 ℃与25 ℃下热处理20 min,然后吸取3 mL β-Lg母液、pH 7.0磷酸盐缓冲液分别与1.5 mL TFDG母液于10 mL离心管中,趁热涡旋20 s,迅速冷却至室温,静置3 h。
1.3.2 贮藏时间对β-Lg-TFDG稳定性的影响
分别取相同体积的β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)及TFDG样品置于25 ℃下避光保存28 d,每隔7 d取样并分别检测透光率、色泽、粒径、ζ-电位、TFDG保留率。测量前将样品摇匀。
1.3.3 透光率测定
参考ZENG等[14]的方法,稍作修改。使用UV-2450紫外-可见分光光度计测量样品的透光率,吸取3 mL样品于1 cm比色皿,在640 nm处测定。测量前将样品摇匀,并用超纯水将UV-2450紫外-可见分光光度计的透射率校准为100%。
1.3.4 色泽测定
参考LEE等[15]的方法,稍作修改。采用分光测色仪测定样品L*、a*、b*值的变化。其中L*值代表亮度;a*值代表红绿色度,正值表示红色程度,负值表示绿色程度;b*值代表黄蓝色度,正值表示黄色程度,负值表示蓝色程度。测量前利用黑白陶瓷板校正仪器,并将样品摇匀。样品的色差(ΔE)和色度角(h°)的计算分别如公式(1)和公式(2)所示:
ΔE=(L2+a2+b2)1/2
(1)
(2)
1.3.5 粒径及ζ-电位测定
利用纳米粒径电位分析仪测定样品粒径及ζ-电位。为避免多重光散射效应,测定前用5 mmol/L磷酸盐缓冲液对样品进行稀释。水的黏度和折射率分别为0.887 2 cP、1.330。
1.3.6 TFDG保留率及生物可及性测定
参考FENG等[16]的方法,稍作修改。吸取1.3.2节中适量样品于离心管中离心(4 ℃,10 000 r/min,10 min)。取适量上清液和等量乙酸乙酯萃取,重复3次后用无水甲醇定容至5 mL,用0.22 μm有机微孔滤膜过滤后作为待测样品。样品采用高效液相色谱检测,TFDG保留率的计算如公式(3)所示:
(3)
式中:A为样品中TFDG保留率;B为被测组分峰面积;Bi为标准物峰面积;C为标准物质量浓度,mg/L;Ci为样品未经处理时的TFDG质量浓度,mg/L;D为稀释倍数。
色谱柱:Hypersil BDS C18柱(250 mm×4.6 mm,5 μm);流速:1 mL/min;检测波长:278 nm;柱温:30 ℃;进样量:20 μL;流动相:A:2%(体积分数)冰乙酸,B:乙腈。TFDG采用梯度洗脱,具体梯度如下表1所示。
表1 TFDG检测梯度洗脱表
Table 1 Linear gradient elution of concentration of TFDG
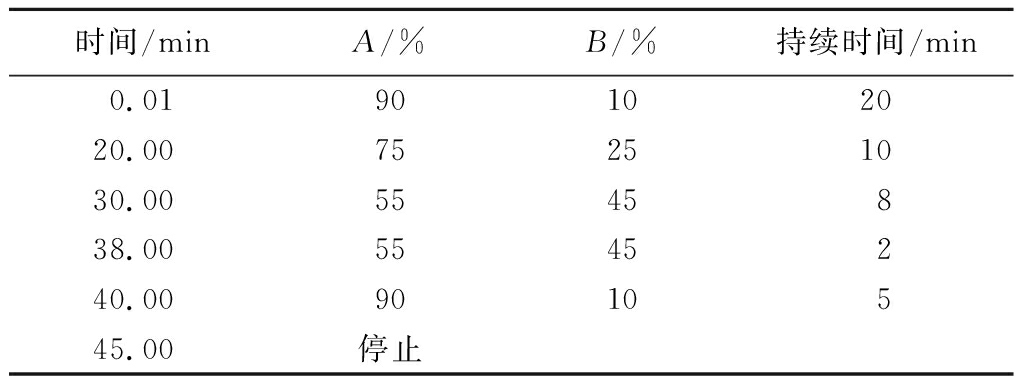
时间/minA/%B/%持续时间/min0.0190102020.0075251030.005545838.005545240.009010545.00停止
TFDG的体外生物可及性定义为肠道消化结束后TFDG的残留量[17-18]。TFDG体外生物可及性的计算如公式(4)所示:
生物可及性![]()
(4)
式中:Qinitial为样品消化前的TFDG含量;Qdigestion为样品消化后的TFDG的剩余量。
1.3.7 体外模拟消化
参考BRODKORB等[19]的方法,稍作修改。根据表2制备口腔模拟唾液(simulated saliva fluid,SSF)、胃模拟消化液(simulated gastric fluid,SGF)及肠模拟消化液(simulated intestinal fluid,SIF),分别模拟人体口腔、胃、肠道的消化阶段。分别吸取5 mL β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG于50 mL离心管中,加入4.0 mL SSF、25 μL CaCl2(0.3 mol/L)、0.5 mL α-淀粉酶溶液及475 μL超纯水混合均匀,于37 ℃磁力搅拌消化2 min后,向离心管中加入8.0 mL SGF、0.5 mL胃蛋白酶溶液、5 μL CaCl2(0.3 mol/L)、0.4 mL HCl(1 mol/L)(调节pH值至3.0)及1.095 mL超纯水,并于37 ℃磁力搅拌消化2 h后,向离心管中加入8.5 mL SIF、5.0 mL胰酶溶液、2.5 mL胆汁盐溶液(160 mmol/L)、40 μL CaCl2(0.3 mol/L)、0.05 mL NaOH(1 mol/L)(调节pH值至7.0)及3.91 mL超纯水,并再次于37 ℃磁力搅拌消化2 h后,迅速将样品置于冰浴中冷却10 min,结束体外模拟消化过程。
表2 体外模拟消化液的制备
Table 2 Preparation of in vitro simulated digestion solutions
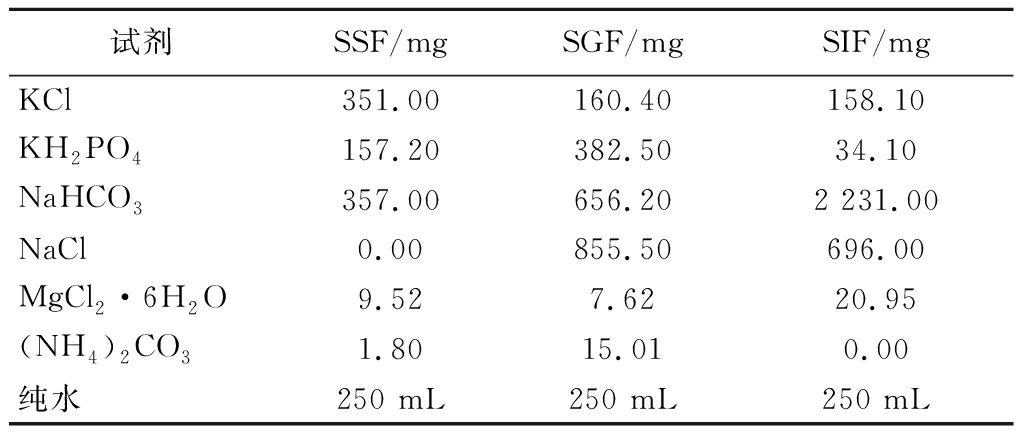
试剂SSF/mgSGF/mgSIF/mgKCl351.00160.40158.10KH2PO4157.20382.5034.10NaHCO3357.00656.202 231.00NaCl0.00855.50696.00MgCl2·6H2O9.527.6220.95(NH4)2CO31.8015.010.00纯水250 mL250 mL250 mL
在口腔-胃-肠的消化过程中,分别在口腔、胃、肠道阶段结束后取适量消化液,并根据1.3.5节、1.3.8节和1.3.6节的方法测定其在体外消化过程中的粒径、ζ-电位、抗氧化性和生物可及性。
1.3.8 抗氧化性测定
抗氧化活性检测根据LI等[12]、LI等[20]的方法,稍作修改。使用无水乙醇制备DPPH的储备溶液(0.05 mg/mL)。然后,向2.9 mL的DPPH储备溶液中加入0.1 mL样品。将得到的混合物在室温避光条件下培养30 min。摇匀后,在517 nm处测定分散体的吸光度。以维生素C浓度为横坐标,清除率为纵坐标,得到的回归方程为y=2.720 3x+0.092 9,R2=0.997。DPPH自由基清除能力(维生素C g/L)的计算如公式(5)所示:
DPPH自由基清除能力/(维生素C g/L)
(5)
式中:Acontrol为DPPH储备溶液的吸光度;Asample是样品和DPPH储备溶液的复合溶液吸光度;而Ablank是样品和无水乙醇的复合溶液吸光度。
使用超纯水制备2-苯基-4,4,5,5-四甲基咪唑啉-3-氧代-1-氧(2-phenyl-4,4,5, 5-tetramethylimidazolin-3-oxo-1-oxygen,PTIO)的储备溶液(0.05 mg/mL)。将0.1 mL的样品溶液加入0.9 mL的PTIO储备溶液中。混合后的反应溶液在37 ℃暗箱中孵育120 min。摇匀后,测定分散体在557 nm处的吸光度。以维生素C浓度为横坐标,清除率为纵坐标,得到的回归方程为y=3.543 9x+0.373 4,R2=0.999。PTIO自由基清除能力(维生素C g/L)的计算如公式(6)所示:
PTIO自由基清除能力/(维生素C g/L)
(6)
式中:Bcontrol是PTIO储备溶液的吸光度;Bsample是样品和PTIO储备溶液形成的复合物溶液吸光度;Bblank是样品和无水乙醇形成的复合物溶液吸光度。
1.4 数据分析
所有试验均进行3次重复,结果以“平均值±标准差”表示。数据使用SPSS 27进行单因素ANOVA分析,取显著性差异水平为P<0.05。利用Origin软件进行绘图。
2 结果与分析
2.1 贮藏期稳定性分析
2.1.1 透光率与色泽分析
透光率和色泽是反映样品在贮藏期内澄清度和颜色变化的重要参数。如图1所示,贮藏期间,β-Lg-TFDG(85 ℃)的透光率均显著(P<0.05)高于β-Lg-TFDG(25 ℃),是因为相较于TFDG结合在β-Lg(25 ℃)的外围,与β-Lg(85 ℃)的结合则是在其活性腔中[13],β-Lg-TFDG(85 ℃)可在贮藏中保持较好的澄清度。β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)及TFDG的透光率随贮藏时间延长分别降低了22.91%、17.01%及13.21%,β-Lg-TFDG(85 ℃)透光率受贮藏时间的影响高于β-Lg-TFDG(25 ℃)和TFDG,是因为随着贮藏时间延长,β-Lg(85 ℃)聚集形成多聚体及絮状物,且TFDG氧化形成沉淀,故透光率下降[21]。
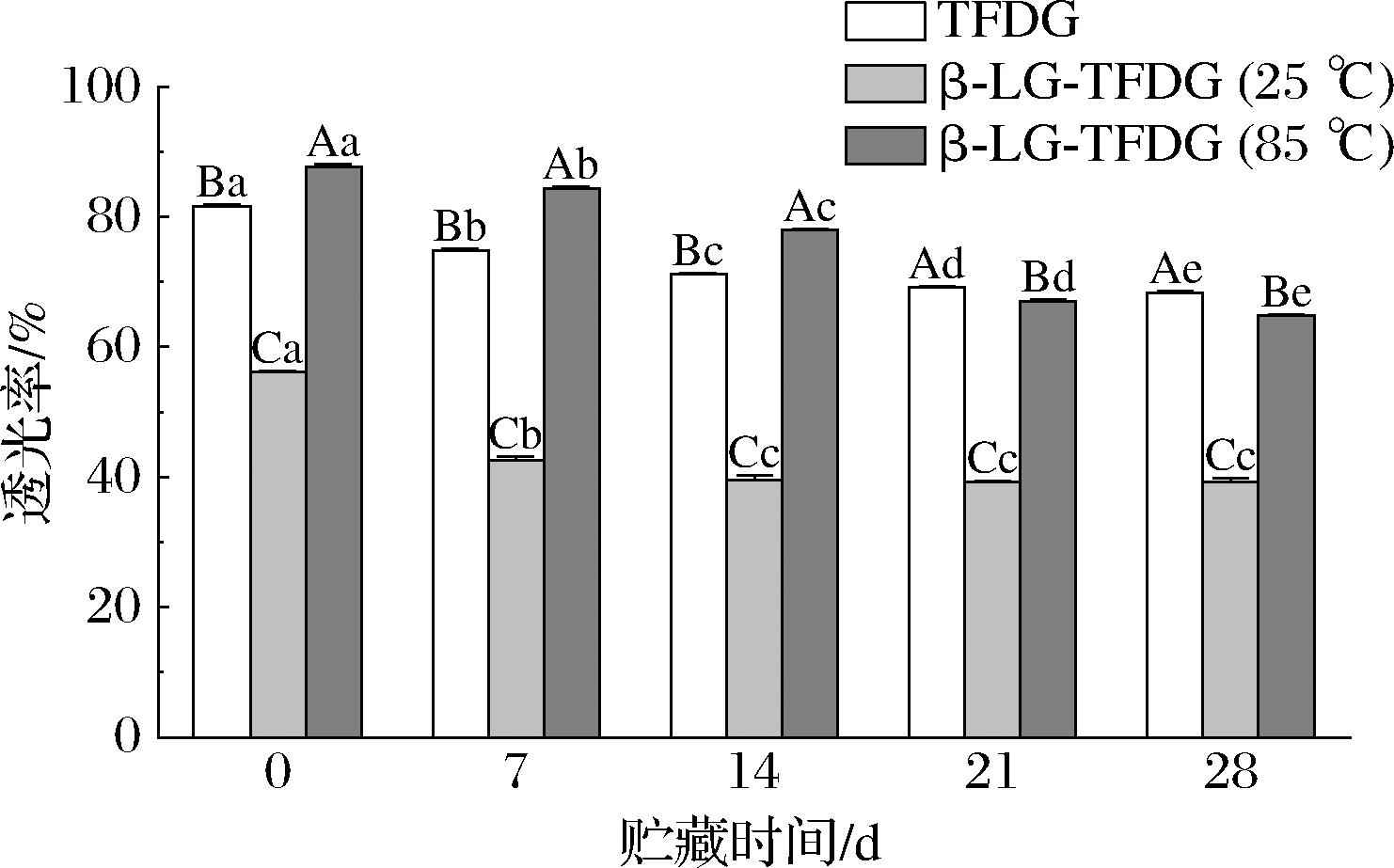
图1 β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG在贮藏期间的透光率变化
Fig.1 Changes in light transmittance of β-Lg-TFDG (85 ℃),β-Lg-TFDG (25 ℃), and TFDG during storage
注:图中不同小写字母表示组内样品差异显著(P<0.05),不同大写字母表示组间样品差异显著(P<0.05)(下同)。
β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)以及TFDG在贮藏期间的颜色变化用亮度值(L*),红度值(a*),黄度值(b*),总颜色变化(ΔE)和色度角(h°)进行表征[22]。如表3所示,在贮藏期间, β-Lg-TFDG(25 ℃)以及TFDG的L*、a*、β*、ΔE和h°值均显著(P<0.05)下降,而β-Lg-TFDG(85 ℃)除L*,h°值显著(P<0.05)下降外,a*、b*、ΔE值均无明显变化,表明相较于β-Lg-TFDG(25 ℃)及TFDG,β-Lg-TFDG(85 ℃)在贮藏期间色泽更稳定,β-Lg(85 ℃)可在贮藏期间较好地保护TFDG色泽。
表3 β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG在贮藏期的L*、a*、b*、h°和ΔE
Table 3 The L*, a*, b*, h°, and ΔE of β-Lg-TFDG (85 ℃), β-Lg-TFDG (25 ℃), and TFDG during storage

组别贮藏时间/dL*a*b*h°ΔETFDG023.80±0.05a1.23±0.01a1.58±0.08a52.07±1.17a23.88±0.05a723.39±0.07b1.01±0.04b1.22±0.03b50.29±0.48a23.44±0.07b1423.23±0.06c0.88±0.04c0.61±0.05c34.73±2.71c23.25±0.05c2122.91±0.01d0.84±0.03cd0.66±0.02c37.91±1.01b22.93±0.01d2822.80±0.03e0.83±0.02d0.64±0.02c37.67±1.14b22.82±0.03eβ-Lg-TFDG(25 ℃)026.24±0.30a1.32±0.01b2.68±0.03a63.83±0.13a26.41±0.30a725.13±0.02b1.22±0.03c1.82±0.03c56.12±0.77b25.22±0.02b1424.62±0.07c1.24±0.01c1.90±0.06b56.98±0.61b24.73±0.07c2123.86±0.03d1.31±0.01b1.69±0.04d52.14±0.83c23.96±0.03d2823.43±0.02e1.36±0.03a1.46±0.00e46.97±0.67d23.52±0.02eβ-Lg-TFDG(85 ℃)023.91±0.03a1.69±0.04a1.30±0.03ab37.58±0.39a24.01±0.03a723.59±0.05b1.72±0.04a1.31±0.03a37.35±0.28a23.69±0.04b1423.56±0.06bc1.67±0.04ab1.25±0.01bc36.89±0.58a23.66±0.06bc2123.51±0.03c1.60±0.03b1.24±0.04c37.77±0.62a23.60±0.03c2823.37±0.02d1.70±0.04a1.29±0.02abc37.25±0.72a23.47±0.02d
注:所测数据均以“平均值±标准差”表示;列表数据上标不同小写字母表示组内样品差异显著(P<0.05)。
2.1.2 粒径和电位分析
如图2-a所示,β-Lg-TFDG(85 ℃)的粒径在贮藏期间显著(P<0.05)升高,从34.29 nm增加至139.57 nm,与图1中β-Lg-TFDG(85 ℃)溶液透光率下降的结果一致,表明β-Lg-TFDG(85 ℃)在贮藏中不断聚集并形成多聚体。另β-Lg-TFDG(25 ℃)在贮藏期间粒径呈先减小再增大的趋势,是因为前期结合在β-Lg外围的部分TFDG降解[13],粒径变小,后期β-Lg-TFDG(25 ℃)随着贮藏时间延长逐渐形成多聚体进而形成大量絮状物。β-Lg-TFDG(85 ℃)的粒径在贮藏中均显著(P<0.05)小于β-Lg-TFDG(25 ℃),与图1中2组的透光率结果一致,说明贮藏期间β-Lg-TFDG(85 ℃)比β-Lg-TFDG(25 ℃)更稳定。
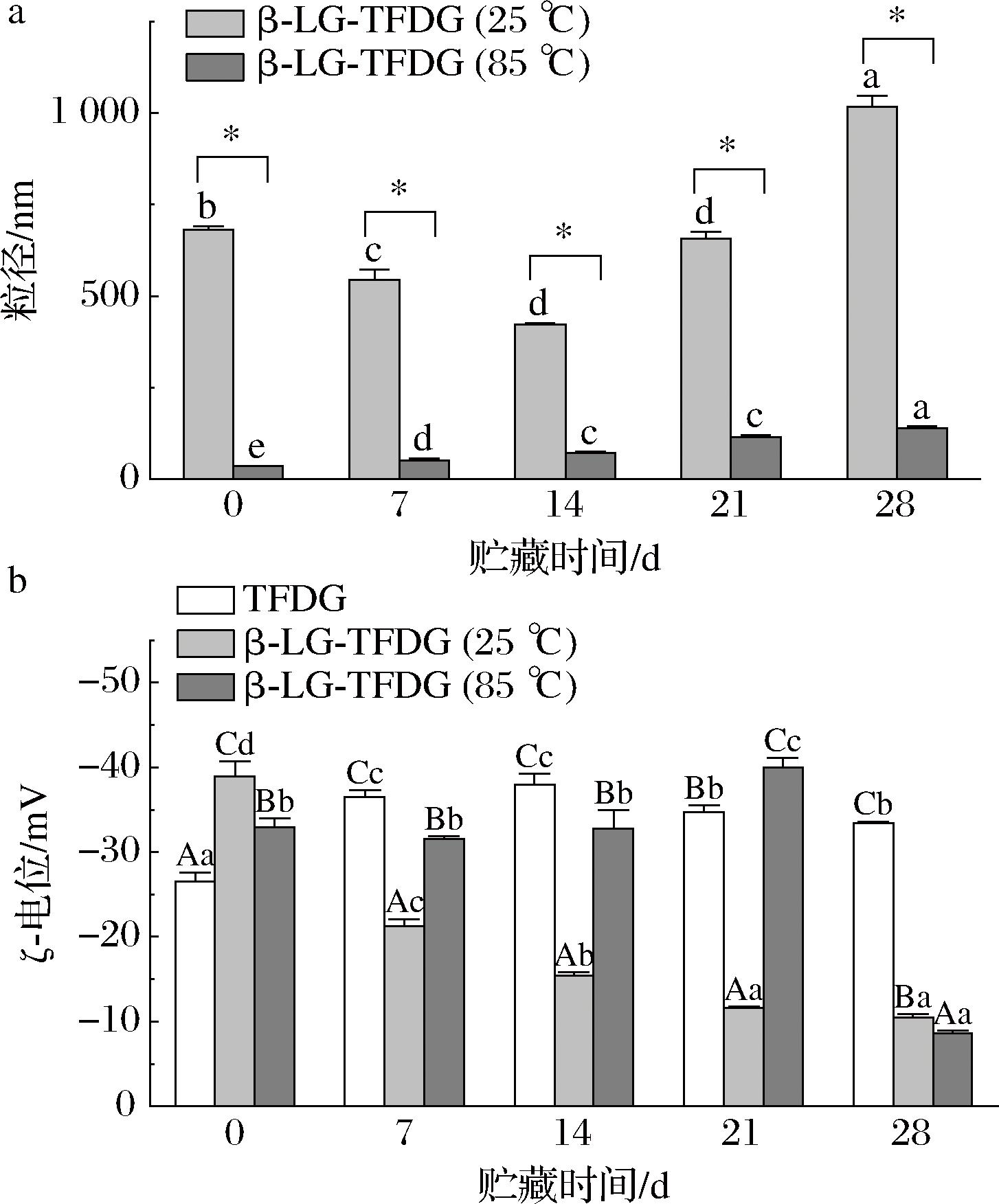
a-粒径;b-ζ-电位
图2 β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG在贮藏期间的粒径和ζ-电位变化
Fig.2 Changes in particle size and ζ-potential of β-Lg-TFDG(85 ℃), β-Lg-TFDG (25 ℃), and TFDG during storage
注:*号表示2组样品差异显著(P<0.05)(下同)。
据报道,溶液的ζ-电位绝对值大于30 mV有助于防止颗粒聚集和沉淀物形成[12]。如图2-b所示,0 d 时,3组样品的ζ-电位绝对值高低顺序依次为β-Lg-TFDG(25 ℃)、β-Lg-TFDG(85 ℃)、TFDG,前两者的ζ-电位绝对值均高于30 mV,是因为带负电荷的TFDG加入会使体系的电荷增加[23],且热处理能影响β-Lg A链和B链的空间结构,暴露蛋白活性空腔中的活性位点与TFDG结合,使样品中游离TFDG的量降低[13],故β-Lg-TFDG(25 ℃)ζ-电位绝对值最高。另外贮藏14 d后,β-Lg-TFDG(85 ℃)的ζ-电位绝对值无显著变化(P<0.05)且大于30 mV,说明β-Lg-TFDG(85 ℃)比另2组样品稳定。而在21 d后包裹在蛋白内部的TFDG逐渐暴露后分解,因此ζ-电位绝对值升高后又降低[24]。β-Lg-TFDG(25 ℃)ζ-电位绝对值在贮藏期间显著(P<0.05)降低,且第7天后的ζ-电位绝对值均小于30 mV,说明β-Lg-TFDG(25 ℃)溶液在贮藏期间不稳定,与粒径结果一致。
2.1.3 TFDG稳定性分析
TFDG在中性和碱性的水溶液中极易氧化降解[5,14]。由图3可知,在常温避光贮藏28 d后,β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)及TFDG样品中的TFDG含量分别显著(P<0.05)降低了95.39%,82.13%、51.61%,表明β-Lg与TFDG的结合可抑制TFDG在贮藏中的氧化分解。且贮藏至28 d时,β-Lg-TFDG (85 ℃)中TFDG保留率分别是β-Lg-TFDG(25 ℃)、TFDG样品中TFDG保留率的3.77倍、15.18倍,表明经85 ℃处理后的β-Lg在贮藏中保护TFDG不被氧化分解的效果更强。
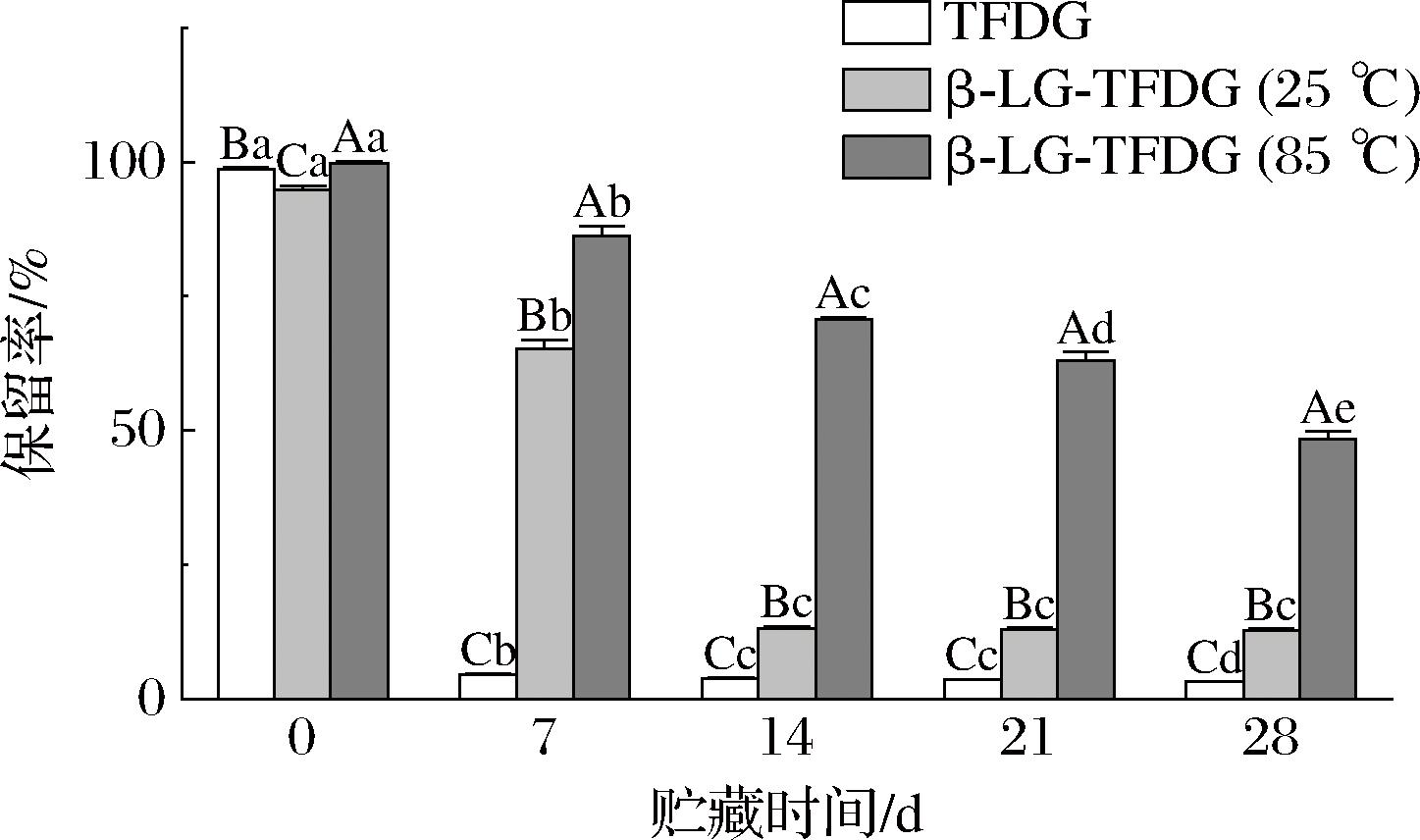
图3 β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG在贮藏期内TFDG保留率的变化
Fig.3 Changes in TFDG retention of β-Lg-TFDG (85 ℃),β-Lg-TFDG (25 ℃), and TFDG during storage
2.2 体外模拟消化特性分析
2.2.1 粒径和ζ-电位分析
粒径和ζ-电位是反映样品体外消化过程稳定性的重要参数。由图4-a可知,在肠道消化前的各个阶段,β-Lg-TFDG(85 ℃)的粒径变化幅度及粒径大小显著(P<0.05)小于β-Lg-TFDG(25 ℃),说明相较于β-Lg-TFDG(25 ℃),β-Lg-TFDG(85 ℃)在体外模拟消化中更稳定。而肠道阶段消化结束后,β-Lg-TFDG(85 ℃)及β-Lg-TFDG(25 ℃)的粒径变化均较大,这是由于肠液中存在大量消化后形成的沉淀物,而沉淀物形成是因为胆汁盐和消化酶的存在及pH和离子强度的变化引起的聚集或絮凝[25]。
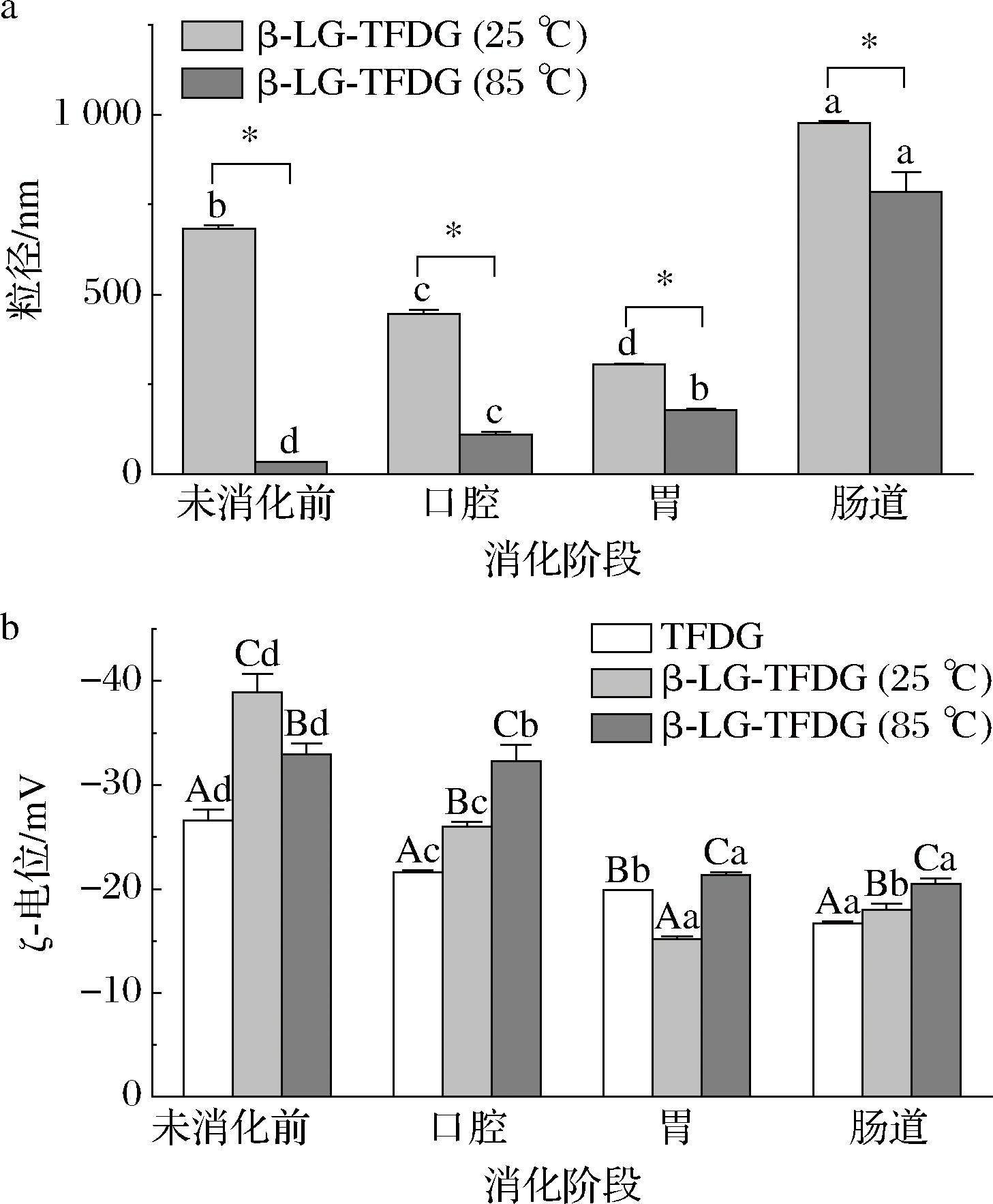
a-粒径;b-ζ-电位
图4 体外模拟消化过程中的β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG的粒径和ζ-电位变化
Fig.4 Changes in particle size and ζ-potential of β-Lg-TFDG(85 ℃), β-Lg-TFDG (25 ℃), and TFDG during in vitro digestion
由图4-b可知,各消化阶段的β-Lg-TFDG(85 ℃)ζ-电位绝对值均显著(P<0.05)高于β-Lg-TFDG(25 ℃)及TFDG。且各阶段消化后,β-Lg-TFDG(25 ℃)的ζ-电位绝对值显著(P<0.05)降低了20.93 mV,而β-Lg-TFDG(85 ℃)除了因酸性胃液中电荷间中和效应的发生[26],导致胃阶段ζ-电位绝对值显著下降(P<0.05)外,其余阶段均无显著(P<0.05)变化。综上,说明β-Lg-TFDG(85 ℃)在体外消化中能保持更好的稳定性,与上述粒径结果一致。
2.2.2 抗氧化性分析
DPPH法和PTIO法是评价植物多酚抗氧化活性的常用方法[20,27]。由图5可知,在消化中,β-Lg-TFDG(85 ℃)的DPPH自由基清除能力显著(P<0.05)高于β-Lg-TFDG(25 ℃)及TFDG,在肠消化阶段,β-Lg-TFDG(85 ℃)的PTIO自由基清除能力显著(P<0.05)高于β-Lg-TFDG(25 ℃)及TFDG,表明β-Lg-TFDG(85 ℃)在消化中可呈现出更好的稳定性和自由基清除能力。然而,在口腔及胃消化阶段3组样品的PTIO自由基清除能力与DPPH自由基清除能力不同,是因为它们清除自由基的机制不同,DPPH自由基清除基于氢原子转移和电子转移的混合机制,而PTIO自由基清除基于质子转移和电子转移的混合机制[20,27]。
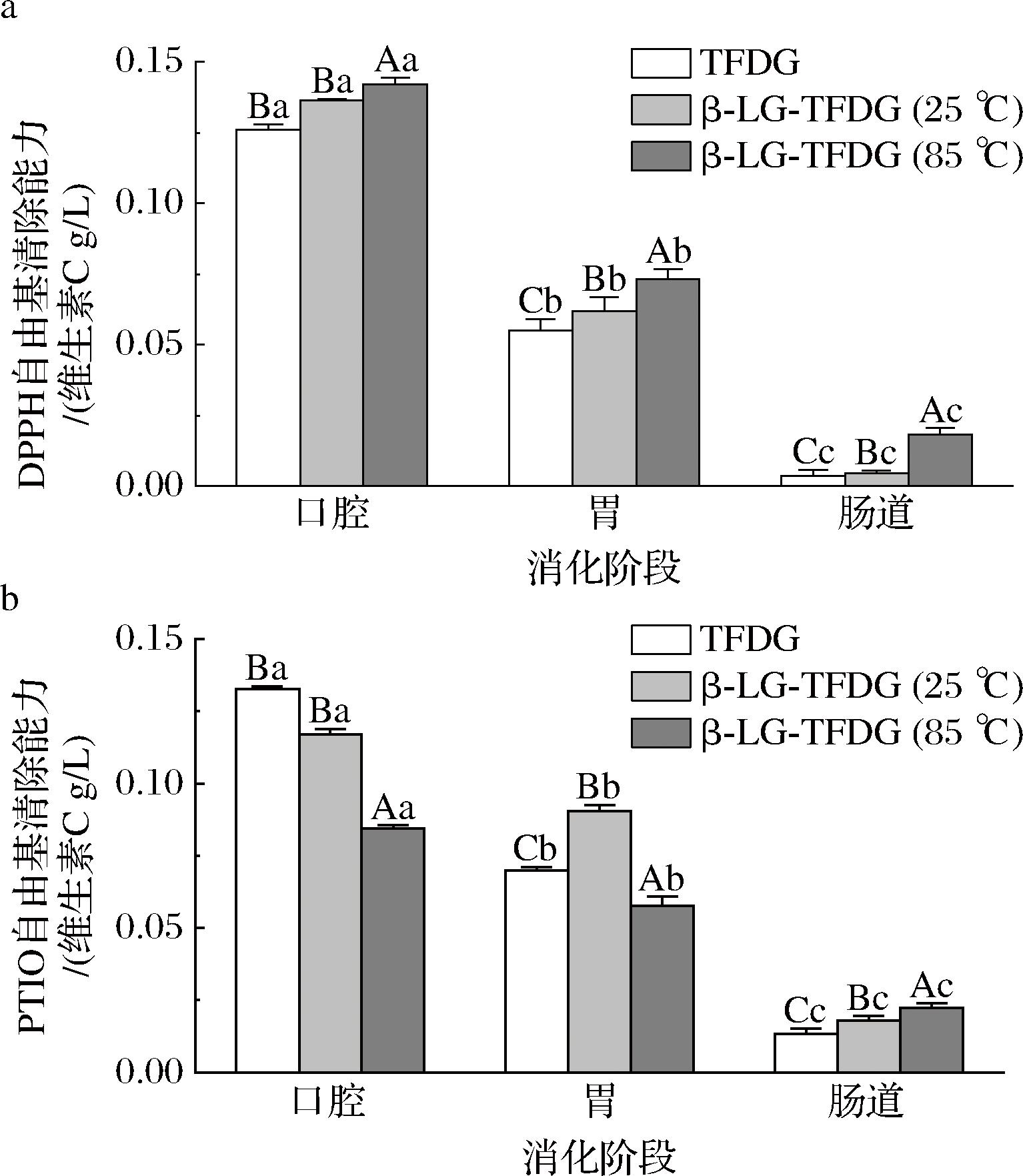
a-DPPH自由基清除能力;b-PTIO自由基清除能力
图5 体外模拟消化过程中β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG的抗氧化活性
Fig.5 Changes in antioxidant activities of β-Lg-TFDG (85 ℃),β-Lg-TFDG (25 ℃), and TFDG during in vitro digestion
2.2.3 生物可及性分析
TFDG可被人体吸收利用的程度通常用生物可及性表示[1]。如图6所示,经体外模拟消化后,3组样品中TFDG保留率均显著降低(P<0.05),其中,TFDG样品的生物可及性最低仅为11.83%,显著(P<0.05)低于另外2组样品,表明与β-Lg结合可提高TFDG的生物可及性。另外 β-Lg-TFDG(85 ℃)的TFDG生物可及性最高为22.03%,是β-Lg-TFDG(25 ℃)的1.38倍,TFDG的1.86倍,且各消化阶段中,β-Lg-TFDG(85 ℃)的TFDG保留率均显著(P<0.05)高于另外2组,表明β-Lg-TFDG(85 ℃)可在消化中更好保护TFDG不被降解, 显著提升TFDG的生物利用度,与上述粒径、ζ-电位结果一致。
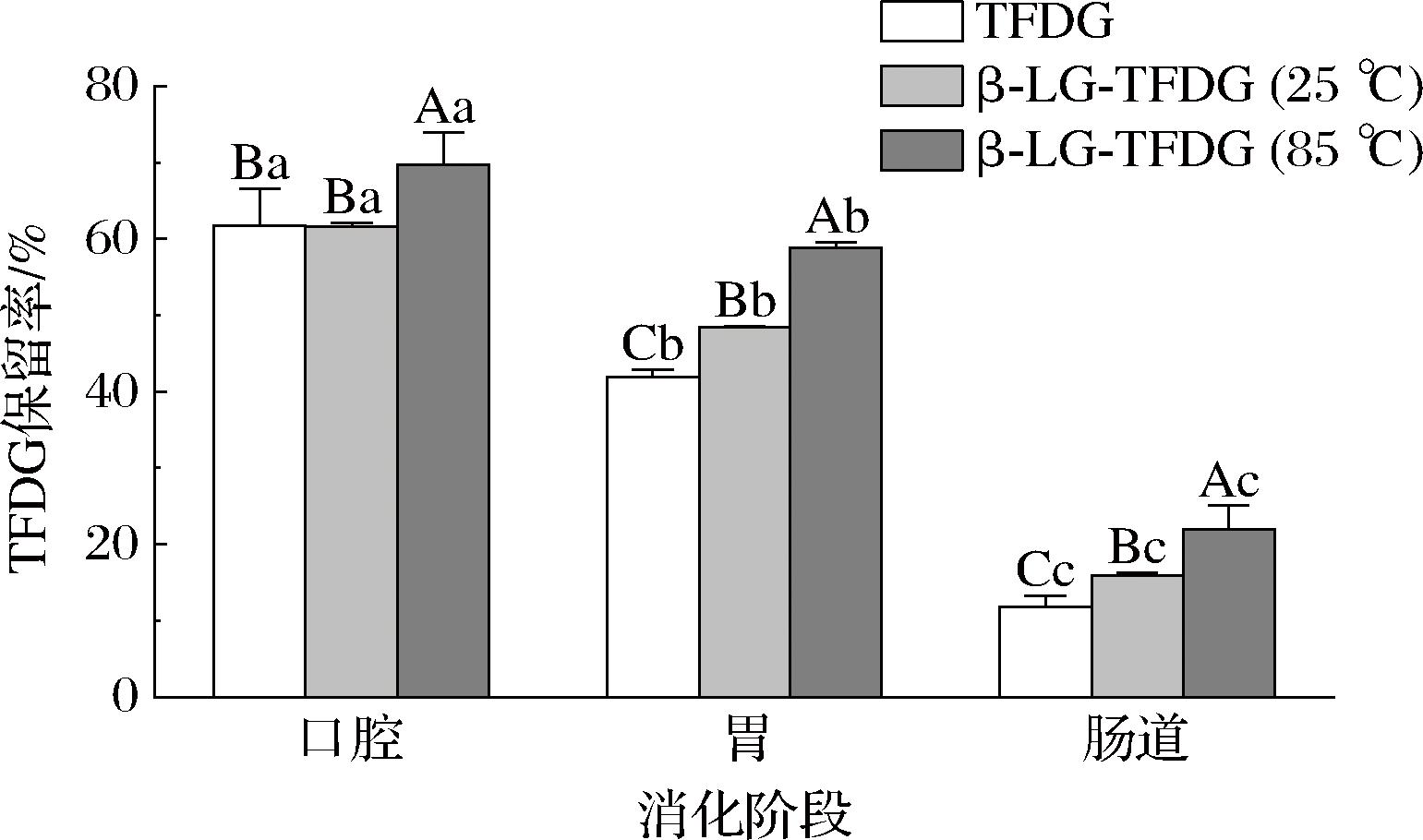
图6 体外模拟消化过程中β-Lg-TFDG(85 ℃)、β-Lg-TFDG(25 ℃)和TFDG的生物可及性变化
Fig.6 Changes in bioavailability of β-Lg-TFDG (85 ℃),β-Lg-TFDG (25 ℃), and TFDG during in vitro digestion
3 结论
本文以β-Lg、TFDG制备复合分散体(β-Lg-TFDG),探究了β-Lg(85 ℃)提升TFDG贮藏稳定性及生物可及性的可行性。结果表明,贮藏28 d后,相较于β-Lg-TFDG(25 ℃)及TFDG,β-Lg-TFDG(85 ℃)在色泽上无显著(P<0.05)变化,并能较好地保持澄清,且TFDG保留率为48.27%,分别是β-Lg-TFDG(25 ℃)、TFDG样品的3.77倍、15.18倍,另粒径、ζ-电位结果表明,β-Lg-TFDG(85 ℃)在贮藏期间更稳定。体外消化结果显示,β-Lg-TFDG(85 ℃)中TFDG的生物可及性为22.03%,分别是β-Lg-TFDG(25 ℃)、TFDG样品的1.38倍、1.86倍,且β-Lg-TFDG(85 ℃)在消化期间可呈现出更好的胶体分散稳定性和抗氧化能力。综上所述,相比于β-Lg(25 ℃),经85 ℃预热处理后的β-Lg与TFDG结合能更有效地保护TFDG在贮藏期中不被氧化分解,并提升其生物可及性。
目前已有相关研究表明,W/O型Pickering乳液[28]可提升TFDG的稳定性和生物可及性。相较于此,本研究所用的β-Lg不仅易得,且经预热处理后的β-Lg可包埋TFDG形成稳定澄清的分散体,在不减少茶饮料中生物活性成分的前提下降低冷后浑的产生,同时提升TFDG的贮藏稳定性和生物可及性。这对茶饮料行业具有重要意义,能改善茶饮料的外观和口感并增强其健康效益和市场竞争力,同时为TFDG的利用提供了更多可能。
[1] 刘昌伟, 张梓莹, 王俊懿, 等.茶黄素生物学活性研究进展[J].食品科学, 2022, 43(19):318-329.LIU C W, ZHANG Z Y, WANG J Y, et al.Progress in research on the bioactivity of theaflavins[J].Food Science, 2022, 43(19):318-329.
[2] SUN L L, WEN S, LI Q H, et al.Theaflavin-3,3′-di-gallate represses prostate cancer by activating the PKCδ/aSMase signaling pathway through a 67 kDa laminin receptor[J].Food &Function, 2022, 13(8):4421-4431.
[3] WANG S, DENG S, WANG Y.Theaflavin-3,3′-digallate effectively attenuates biofilm formation by Enterococcus faecalis via the targeting of specific quorum sensing pathways[J].Microbial Pathogenesis, 2024, 193:106739.
[4] LIU C W, LIU A L, ZHOU J H, et al.Role and mechanism of theaflavins in regulating skeletal muscle inflammation[J].Journal of Agricultural and Food Chemistry, 2022, 70(41):13233-13250.
[5] JHOO J W, LO C Y, LI S M, et al.Stability of black tea polyphenol, theaflavin, and identification of theanaphthoquinone as its major radical reaction product[J].Journal of Agricultural and Food Chemistry, 2005, 53(15):6146-6150.
[6] PEREIRA-CARO G, MORENO-ROJAS J M, BRINDANI N, et al.Bioavailability of black tea theaflavins:Absorption, metabolism, and colonic catabolism[J].Journal of Agricultural and Food Chemistry, 2017, 65(26):5365-5374.
[7] SHAFAEI Z, GHALANDARI B, VASEGHI A, et al.β-Lactoglobulin:An efficient nanocarrier for advanced delivery systems[J].Nanomedicine:Nanotechnology, Biology and Medicine, 2017, 13(5):1685-1692.
[8] 包小妹, 钟俊桢, 周若楠, 等.β-乳球蛋白、叶酸和视黄醇三元复合物的形成机制及功能性质[J].食品科学, 2020, 41(16):86-93.BAO X M, ZHONG J Z, ZHOU R N, et al.Formation mechanism and functional properties of β-lactoglobulin-folic acid-retinol ternary complexes[J].Food Science, 2020, 41(16):86-93.
[9] YIN J, XU Y, YUAN H, et al.Cream formation and main chemical components of green tea infusions processed from different parts of new shoots[J].Food Chemistry, 2009, 114(2):665-670.
[10] 曲涛, 程勇, 王璐潇, 等.热处理条件下乳清蛋白对可可饮料体系多酚生物可及性的影响及其蛋白-多酚相互作用[J].食品与发酵工业, 2023, 49(21):123-130.QU T, CHENG Y, WANG L X, et al.Effect of whey protein on bioaccessibility of polyphenols in cocoa beverage systems under heat treatment conditions and their protein-polyphenol interactions[J].Food and Fermentation Industries, 2023, 49(21):123-130.
[11] CHEN C P, LI Z C, WANG C, et al.Stability and antioxidant activity of chitosan/β-Lactoglobulin on anthocyanins from Aronia melanocarpa[J].LWT, 2023, 173:114335.
[12] LI B, DU W K, JIN J C, et al.Preservation of (-)-epigallocatechin-3-gallate antioxidant properties loaded in heat treated b-lactoglobulin nanoparticles[J].Journal of Agricultural and Food Chemistry, 2012, 60(13):3477-3484.
[13] ZHONG S P, LUO L Y, PITTIA P, et al.Studies on the effects of preheated β-lactoglobulin on the physicochemical properties of theaflavin-3,3′-digallate and the interaction mechanism[J].Food Hydrocolloids, 2024, 154:110087.
[14] ZENG L, MA M J, LI C, et al.Stability of tea polyphenols solution with different pH at different temperatures[J].International Journal of Food Properties, 2017, 20(1):1-18.
[15] LEE B, SEO J D, RHEE J K, et al.Heated apple juice supplemented with onion has greatly improved nutritional quality and browning index[J].Food Chemistry, 2016, 201:315-319.
[16] FENG J, WU S S, WANG H, et al.Improved bioavailability of curcumin in ovalbumin-dextran nanogels prepared by Maillard reaction[J].Journal of Functional Foods, 2016, 27:55-68.
[17] WANG L, JIA W Q, YANG Q L, et al.Casein nanoparticles as oral delivery carriers for improved bioavailability and hypoglycemic activity of apigenin[J].Food Hydrocolloids, 2024, 146:109194.
[18] LI N, CUI Y F, LIU Y A, et al.Mechanism of interaction between astaxanthin and soy protein fibrils:Effects on complexes structure, rheological properties and bioaccessibility[J].Food Hydrocolloids, 2024, 146:109227.
[19] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[20] LI X C.2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl 3-oxide (PTIO·) radical scavenging:A new and simple antioxidant assay in vitro[J].Journal of Agricultural and Food Chemistry, 2017, 65(30):6288-6297.
[21] MAHMOUDI N, MEHALEBI S, NICOLAI T, et al.Light-scattering study of the structure of aggregates and gels formed by heat-denatured whey protein isolate and β-lactoglobulin at neutral pH[J].Journal of Agricultural and Food Chemistry, 2007, 55(8):3104-3111.
[22] MABUSELA B P, BELAY Z A, GODONGWANA B, et al.Impact of vacuum ultraviolet (VUV) photolysis on ethylene degradation kinetics and removal in mixed-fruit storage, and direct exposure to ‘Fuji’ apples during storage[J].Journal of Food Science and Technology, 2023, 60(10):2557-2567.
[23] TIAN L, YANG K J, ZHANG S L, et al.Impact of tea polyphenols on the stability of oil-in-water emulsions coated by whey proteins[J].Food Chemistry, 2021, 343:128448.
[24] LIAO Y, KANG M X, KOU T Z, et al.Effects of three polyphenols with different numbers of phenolic hydroxyls on the structural and interfacial properties and lipid-protein co-oxidation of oil body emulsions[J].Food Hydrocolloids, 2024, 154:110077.
[25] PINHEIRO A C, LAD M, SILVA H D, et al.Unravelling the behaviour of curcumin nanoemulsions during in vitro digestion:Effect of the surface charge[J].Soft Matter, 2013, 9(11):3147-3154.
[26] ZHOU H L, DAI T T, LIU J N, et al.Chitin nanocrystals reduce lipid digestion and β-carotene bioaccessibility:An in-vitro INFOGEST gastrointestinal study[J].Food Hydrocolloids, 2021, 113:106494.
[27] PRZYBYLSKI P, KONOPKO A, ![]() P, et al.Concentration-dependent HAT/ET mechanism of the reaction of phenols with 2,2-diphenyl-1-picrylhydrazyl (dpph·) in methanol[J].RSC Advances, 2022, 12(13):8131-8136.
P, et al.Concentration-dependent HAT/ET mechanism of the reaction of phenols with 2,2-diphenyl-1-picrylhydrazyl (dpph·) in methanol[J].RSC Advances, 2022, 12(13):8131-8136.
[28] LU Y T, WU Y J, LIU Y J, et al.Stability and gastrointestinal digestion behaviour of theaflavins encapsulated in W/O Pickering emulsions[J].LWT, 2024, 207:116664.
[29] JIANG Y K, GE Z Z, HUANG Q R.Chitosan-polypeptide nanocomplexes crosslinked by a natural crosslinker enhanced the intestinal permeability of black tea polyphenol[J].Food Hydrocolloids for Health, 2023, 4:100148.