海洋脂质因其富含人体必需的脂质营养成分而广受瞩目,特别是omega-3脂肪酸、脂溶性维生素A和维生素D。这些鱼油营养组分在保持心血管健康、促进大脑功能和支持免疫系统等方面发挥着至关重要的作用。多不饱和脂肪酸二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)被认为对心血管[1]、神经功能健康[2]及生理炎症减轻[3]等方面皆具有益处。小型的金枪鱼大多被加工为鱼肉罐头,生产副产物以蒸煮过的鱼肝为主。为了提升远洋鱼类资源的综合利用,增加可持续生产能力,行业不断寻找着经济、高效、绿色、高品质的鱼肝油萃取分离技术。
目前鱼肝油常见的提取方法包括蒸煮法、酶解法、溶剂萃取法、超临界流体和亚临界萃取等方法。传统方法存在提取率低、氧化程度高、有溶剂残留等弊端[4]。其中亚临界萃取基于低沸点溶剂可在低压条件下呈现同时具备气态与液态的溶剂特性,强化的流体效应与溶解能力显著提升自原料中萃取脂质的效率。近十年来该技术报道应用于金枪鱼油、磷虾油等高值海洋脂质的分离研究[5]。WANG等[6]使用了亚临界二甲醚对微波处理后的鱼肝进行了脂质提取,发现最优亚临界条件下提取效率达93.21%,显著高于传统常压溶剂萃取法。FANG等[7]发现通过亚临界萃取的金枪鱼油中维生素和脂肪酸的破坏最少,其氧化稳定性与超临界法差异不大。与传统溶剂萃取法相比,亚临界萃取脂质的氧化稳定性较好与分离加工过程体系的无氧环境、更低的萃取温度与更短萃取时间有关。部分研究验证了亚临界分离的鱼油具有更高氧化稳定性[8]。SUN等[9]对比南极磷虾的亚临界和传统溶剂提油法,发现前者具备较高提油率,且制备磷虾油具有较好氧化稳定性。然而,目前大多数论文集中在亚临界萃取油脂的营养品质与贮藏稳定性评价,针对亚临界萃取过程中油脂氧化品质的变化规律缺少监测与数理模型的表征。
油脂氧化通常随温度升高而加剧,学者为了解释不同脂质在加工、贮藏过程中的氧化规律,通常使用数理建模方式。KASEKE等[10]对微波处理的石榴籽油贮藏中的氧化规律进行研究,在Arrhenius模型的基础上通过对活化能和吉布斯自由能参数的分析总结了相关的规律;刘姗姗等[11]基于酸价、过氧化值和硫代巴比妥酸值使用了零级氧化和一级氧化进行模型对猪油氧化的规律进行了表征。龙婷等[12]基于酸价和过氧化值对不同贮藏温度下油茶籽油的氧化过程变化规律进行了建模拟合,其中酸价的预测值和实际值的平均误差更低(仅6%)。
鲣鱼是一种用于罐头加工的小体型金枪鱼[13],本研究以鲣鱼鱼肝为原料,通过研究30、40、50 ℃ 3个温度下亚临界萃取鱼肝油氧化指标(过氧化值、酸价和茴香胺值)的时间变化,分析了其相关性并建立基于酸价的一级氧化动力学模型;并就不饱和脂肪酸、脂溶维生素等营养含量变化进行品质评价。拟合模型可为行业预测新技术应用下海洋油脂的高质萃取提供理论指导,推进亚临界技术在水产品加工行业的使用。
1 材料与方法
1.1 材料与试剂
新鲜采集的蒸煮鲣鱼肝脏由中国浙江宁波今日食品有限公司提供,来自完全同批次的鱼罐头加工生产线,分装为小袋后于-40 ℃快速冷冻并低温运输,在1 d内到达实验室。所有到达样品立即贮存在-30 ℃冷库。亚临界萃取操作前,鱼肝样品于4 ℃冰箱中过夜解冻,以便后续试验和分析。
二甲醚气体(纯度>99.9%),杭州艾尔柯制冷剂科技有限公司;乙醇、氯化钠、三氯甲烷、异丙醇、异辛烷、乙醚、无水硫酸钠、石油醚(沸程30~60 ℃)、三氟化硼-甲醇溶液、氢氧化钠标准溶液(均为分析纯)和维生素标品,国药集团化学试剂有限公司;氢氧化钠、冰乙酸、百里香酚酞、硫代硫酸钠标准溶液、无水硫酸钠(均为分析纯),杭州邦易化工有限公司;碘化钾、正己烷(色谱纯),杭州吉工生物科技有限公司;对茴香胺,上海泰坦科技股份有限公司。
1.2 仪器与设备
CDB-5 L亚临界流体提取设备,河南亚临界生物技术有限公司;TU-19双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Trace 1300-ISQ气相色谱质谱联用仪,美国赛默飞世尔科技公司;waterse 2695高效液相色谱仪, 赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 亚临界萃取鱼肝油
本研究实验使用的亚临界设备结构可见先前研究论文[6]。准确称取预处理后的鱼肝样品200 g置于CDB-5 L亚临界流体提取设备的萃取罐中,关闭萃取罐。打开设备调节萃取压力,调控3 L亚临界二甲醚泵入萃取罐,于设定温度下(30、40、50 ℃)恒温搅拌实现亚临界萃取(20~120 min)。完成每一次的萃取操作后,打开真空泵与压缩机,释压至常压促使亚临界溶剂气化,40 min回收确保所有溶剂回归储液罐,再打开萃取罐下方出油口。收集的鱼肝油倒入分液漏斗进行分层静置,取上层清油液,用无水硫酸钠脱水,并氮吹确保溶剂脱除,获得最终的鱼肝油样品。每2次亚临界萃取操作间使用亚临界二甲醚于同温度下冲洗萃取罐2 h后停止,以减少2次平行操作间的差异。
1.3.2 鱼肝油氧化稳定性测定、时间变化规律与相关性分析
分别按照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》、GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》、GB/T 24304—2009《动植物油脂 茴香胺值的测定》依次测定不同温度下亚临界萃取过程中鱼肝油的酸价(acid value, AV)、过氧化值(peroxide value, POV)和茴香胺值(p-anisidine value, p-AV)变化。
根据实验设定,分别基于AV、POV与p-AV指标,绘制不同亚临界温度下萃取鱼肝油过程中的时间变化曲线,分析氧化稳定性指标随温度、时间的变化规律;并使用Pearson相关性分析,表征亚临界萃取过程中鱼肝油氧化品质变化与时间及温度的相关方向和密切程度
1.3.3 氧化动力学预测模型与数值模拟
1.3.3.1 零级和一级动力学方程
依据反应动力学原理,参考周爽等[14]研究,分别用零级反应动力学方程和一级反应动力学方程不同温度的亚临界萃取过程中鱼肝油的酸价、过氧化值和茴香胺值数据进行模型拟合,建立鱼肝油在不同温度下酸价变化的回归方程,得到模型决定系数R2,根据R2越高的方程可确定相应的动力学反应级数。即亚临界萃取中鱼肝油的氧化动力学模型如公式(1)所示:
(1)
将n=0代入公式(1), 可得零级动力学方程如公式(2)所示:
F=F0+kt
(2)
将n=1代入公式(1), 可得到一级动力学方程如公式(3)所示:
lnF=kt+lnF0
(3)
计算可得公式(4):
F=e(lnF0+kt)
(4)
式中:F为亚临界萃取过程中鱼肝油样品的酸价,mg KOH/g;k为速率常数;t为时间,min;n为反应动力学级数;F0为亚临界萃取前鱼肝油原料的初始酸价值,mg KOH/g。
1.3.3.2 Arrhenius方程
Arrhenius方程可以反映不同氧化速率与温度间的函数关系方程如公式(5)所示:
(5)
式中:k为温度为T时的速率,mol/(L·s);A为指前因子;Ea为活化能,kJ /mol;R为通用气体常数, 即8.314 J/(mol·K);T为亚临界萃取绝对温度,K。
结合动力学方程和Arrhenius方程,分别将公式(5)代入公式(2)和公式(4),得到萃取温度效应下,鱼肝油亚临界萃取过程中酸价的零级动力学和一级动力学模型可换算为公式(6)和公式(7):
(6)
(7)
1.3.4 脂肪酸组成测定
参照XU等[15]的方法对不同温度下亚临界萃取过程中鱼肝油的脂肪酸组成进行测定。称取0.1 g 鱼肝油溶于2 mL NaOH-CH3OH溶液中,加入BF3-CH3OH溶液甲酯化鱼油中的脂肪酸,脂肪酸甲酯再通过毛细管色谱柱(60 m×0.32 mm×0.25 μm),使用Trace 1300-ISQ气相色谱质谱联用仪进行GC-MS分析。氦气(99%)作为载气,恒流模式不分流,流速为 2 mL/min,进样量1 μL。色谱柱初温设定为90 ℃并保持5 min,随后以15 ℃/min 的速度升至200 ℃,以1 ℃/min 的速度升至240 ℃,最后保持在240 ℃ 下10 min。MS处于 EI模式(70 eV),离子源温度为250 ℃,每 0.2 秒扫描1次,间隔为35~450 m/z。
1.3.5 脂溶性维生素测定
分别参照GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》对不同温度下亚临界萃取过程中鱼肝油脂溶性维生素含量进行测定。称取2 g鱼肝油,加入20 mL去离子水、1 g抗坏血酸、0.1 g 2,6-二叔丁基-4-甲基苯酚、30 mL无水乙醇和20 mL KOH溶液并混匀,在80 ℃振荡反应30 min,取出后快速冷却至室温。将冷却后液体用30 mL水转入分液漏斗中,加入石油醚振荡后静置分层,取上层醚层,用去离子水洗涤至中性,再经无水硫酸钠脱水,过滤、旋转蒸发后使用氮气吹干后过膜待测。使用waterse 2695高效液相色谱仪进行HPLC定量分析。设定20 ℃柱温,96%(体积分数)甲醇水溶液为流动相,0.8 mL/min流速自C18色谱柱(100 mm×2.1 mm×1.8 μm)洗脱维生素成分,并通过内标法进行定量。
1.4 统计分析
所有理化检测都进行3次平行重复测定, 并以“平均值±标准差”来表示数据结果并以Origin 2024进行制图。统计分析使用SPSS 26进行,特定理化指标在萃取过程中的变化差异由ANOVA 方差分析进行(P<0.05)理化指标间相关性使用Pearson分析(P<0.05)。
2 结果与分析
2.1 亚临界萃取过程中鱼肝油氧化稳定性的变化规律
3个亚临界萃取温度下AV随时间的变化规律如图1-a所示。随着时间延长,3个亚临界萃取温度制备的鱼肝油酸价均呈现上升趋势,该变化趋势与刘姗姗等[11]研究中显示的规律相同。总体AV来看,亚临界低温萃取下AV小于高温萃取组,可见30 ℃亚临界萃取过程总体稳定性更佳。此外,从AV变化规律来看,30 ℃较其他萃取温度,在制备鱼肝油过程中AV增加程度更缓。3个温度组前60 min亚临界萃取时间内酸价变化几乎忽略不计,80 min后高萃取温度组AV增长显著,斜率更大,低温组萃取至100 min时才出现酸价的显著增加。3个亚临界萃取温度下POV随时间的变化规律如图1-b所示。随着时间延长,不同萃取温度制备鱼肝油POV的上升趋势也各不相同。类似AV变化趋势,低萃取温度30 ℃时,鱼肝油的POV时间变化程度不如其他温度显著;40 ℃和50 ℃亚临界萃取20 min和40 min时的差异不大,但当萃取时间到60 min时POV的增长程度开始明显,每增加20 min萃取时间,鱼肝油的POV值都有明显升高。这一发现与XU等[16]研究发现相似,可见随着亚临界萃取时间的延长,鱼肝油逐步发生氧化,升高的亚临界萃取温度一定程度加速了氧化过程。p-AV可反映次级氧化产物如醛、酮、酸等物质的含量,其数值越大显示油脂酸败程度更严重。3个亚临界萃取温度下鱼肝油p-AV随时间的变化曲线如1-c图所示,p-AV在不同在亚临界萃取温度下的时间变化趋势基本一致,均随时间延长不断上升;较低温度下增长比率更低,60 min时有明显的增加。这一发现与AL-KHAROUSI等[17]研究枣核油在不同贮藏温度下p-AV随时间的变化趋势相同。综合来看,3个萃取温度下皆在萃取80 min后呈现更明显的线性增加,且温度越高,p-AV值越大。
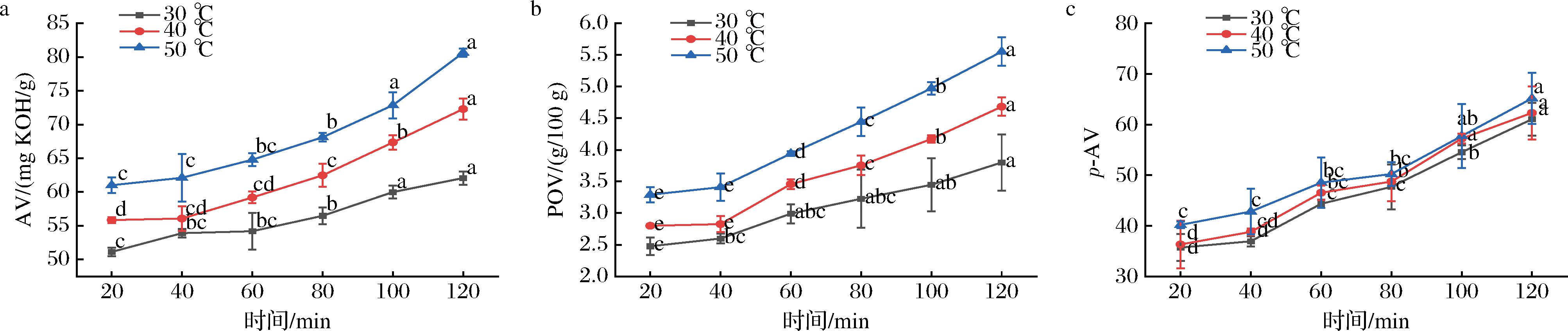
图1 不同亚临界萃取温度下鱼肝油的氧化稳定性的时间变化规律
Fig.1 Oxidative stability changes of tuna liver oil along times under different subcritical extraction temperatures
注:图中同一温度下亚临界萃取过程间的不同字母表示显著性差异(P<0.05)。
2.2 亚临界萃取过程中鱼肝油氧化稳定性指标间的相关性
亚临界过程中不同萃取时间下各氧化指标与温度的相关性见表1。由表1可知,6个亚临界萃取时间段间,温度和POV皆呈现P<0.01水平的极强显著正相关性。AV除了亚临界萃取40 min时与温度无相关性,其余5个亚临界萃取间断都与温度呈现P<0.01水平的极强显著正相关。其中,在20 min时,AV和POV与萃取温度的相关性更好,相关系数分别为0.942**和0.939**;同时AV和POV的最高相关性也在20 min(0.916**)。p-AV与温度在任何萃取时间的相关性都不大。同样,研究还对各理化指标在不同亚临界萃取温度下有时间的相关性进行了分析(表2),整体来说,氧化稳定性指标与萃取时间均呈显著正相关性,最强相关性显示出现于40 ℃亚临界温度下,该条件下亚临界萃取时间与AV、POV和p-AV的相关系数分别为0.917**、0.971**、0.916**。萃取温度为30 ℃时,时间和AV的相关性更好,而40 ℃和50 ℃ 2组,时间和POV的相关性更强。
表1 亚临界萃取过程中不同时间下各氧化指标与温度的相关性
Table 1 Correlation between oxidative indicators and temperature at different times during subcritical extraction
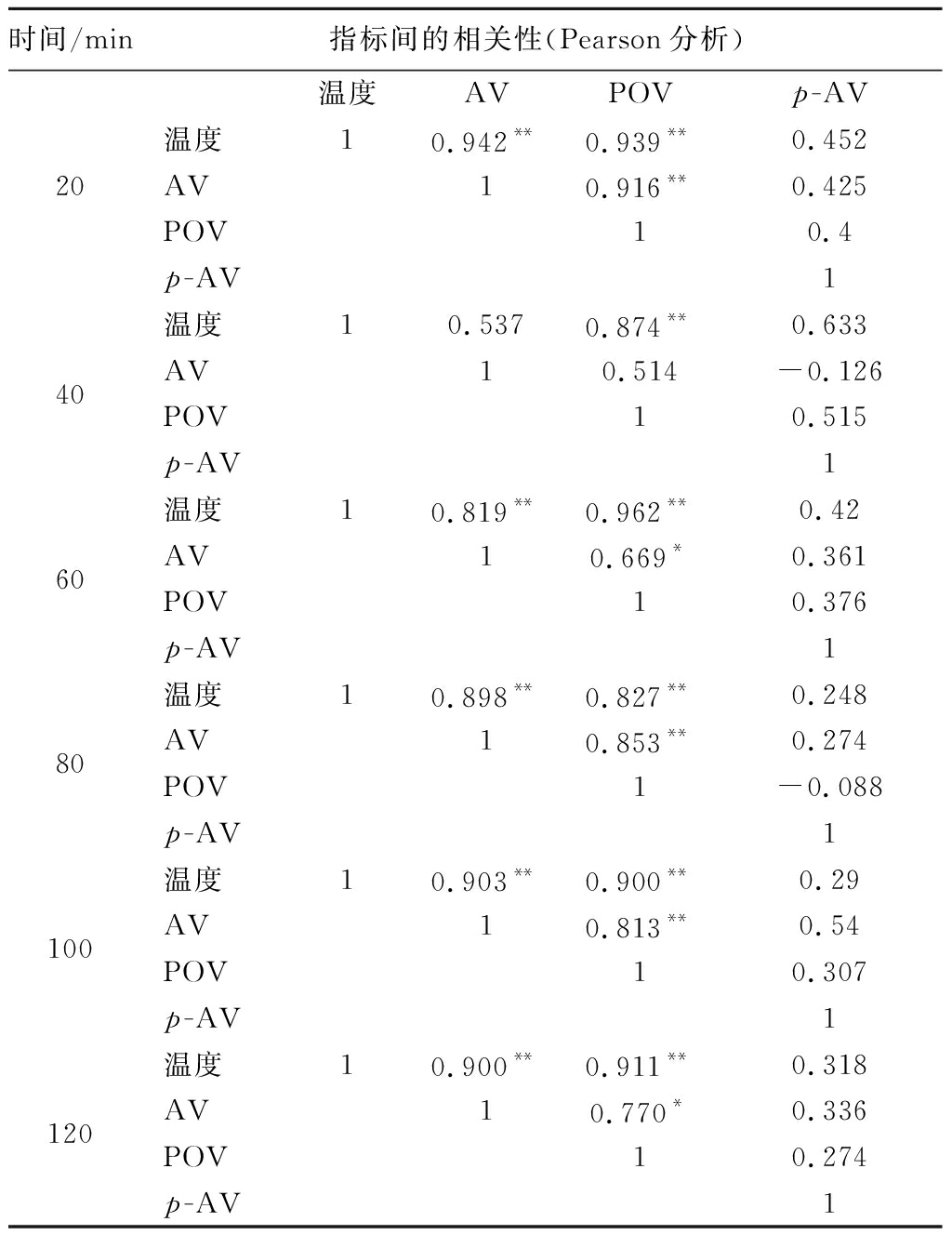
时间/min指标间的相关性(Pearson分析)20温度AVPOVp-AV温度10.942**0.939**0.452AV10.916**0.425POV10.4p-AV140温度10.5370.874**0.633AV10.514-0.126POV10.515p-AV160温度10.819**0.962**0.42AV10.669*0.361POV10.376p-AV180温度10.898**0.827**0.248AV10.853**0.274POV1-0.088p-AV1100温度10.903**0.900**0.29AV10.813**0.54POV10.307p-AV1120温度10.900**0.911**0.318AV10.770*0.336POV10.274p-AV1
注:**表示在0.01水平上显著相关,*表示在0.05水平上显著相关。
表2 亚临界萃取过程中不同温度下各氧化指标与时间的相关性
Table 2 Correlation between oxidative indicators and times at different temperatures during subcritical extraction
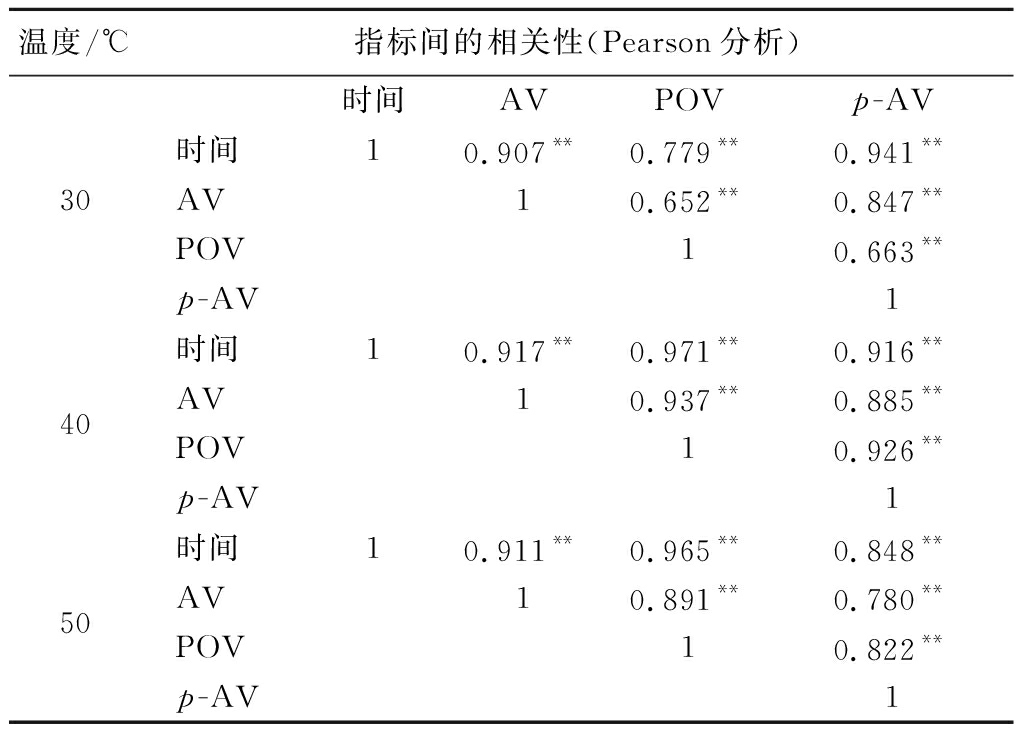
温度/℃指标间的相关性(Pearson分析)30时间AVPOVp-AV时间10.907**0.779**0.941**AV10.652**0.847**POV10.663**p-AV140时间10.917**0.971**0.916**AV10.937**0.885**POV10.926**p-AV150时间10.911**0.965**0.848**AV10.891**0.780**POV10.822**p-AV1
注:**表示在0.01水平上显著相关,*表示在0.05水平上显著相关。
2.3 亚临界萃取过程中鱼肝油氧化动力学模型拟合
根据2.2节结果可知, AV和POV更能反映鱼肝油在萃取过程中的氧化程度,因此,基于这2个氧化稳定性指标,根据公式(2)和公式(3)分别建立了零级与一级动力学方程,见表3和表4。结果显示,虽然拟合方程后的回归系数R2皆高于0.90,但除了30 ℃下萃取鱼肝油AV时间变化数值进行的模型拟合结果,其他基于POV与AV的氧化动力学方程拟合结果皆显示一级反应方程优于零级反应方程。可见亚临界萃取鱼肝油的过程中氧化变化规律建议使用一级氧化动力学方程表征。同时AV和POV的零级和一级的动力学方程的反应速率常数k随着温度的增加而变大,表明萃取鱼肝油过程中,氧化速率与温度紧密相关,温度越高,萃取时氧化速率就越快。
表3 基于酸价的氧化动力学方程参数及相关拟合系数
Table 3 Oxidation kinetic equation parameters and related fitting coefficients based on acid value
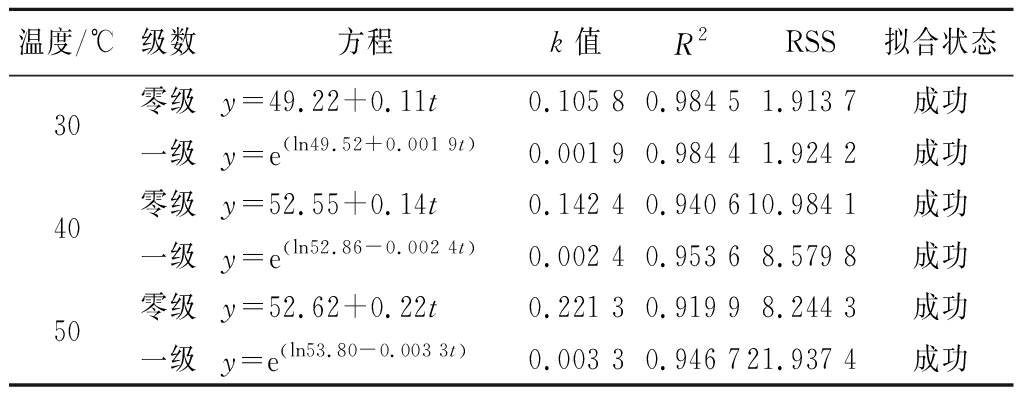
温度/℃级数方程k值R2RSS拟合状态30零级y=49.22+0.11t0.105 80.984 51.913 7成功一级y=e(ln49.52+0.001 9t)0.001 90.984 41.924 2成功40零级y=52.55+0.14t0.142 40.940 610.984 1成功一级y=e(ln52.86-0.002 4t)0.002 40.953 68.579 8成功50零级y=52.62+0.22t0.221 30.919 98.244 3成功一级y=e(ln53.80-0.003 3t)0.003 30.946 721.937 4成功
表4 基于过氧化值的氧化动力学方程参数及相关拟合系数
Table 4 Oxidation kinetic equation parameters and related fitting coefficients based on peroxide value
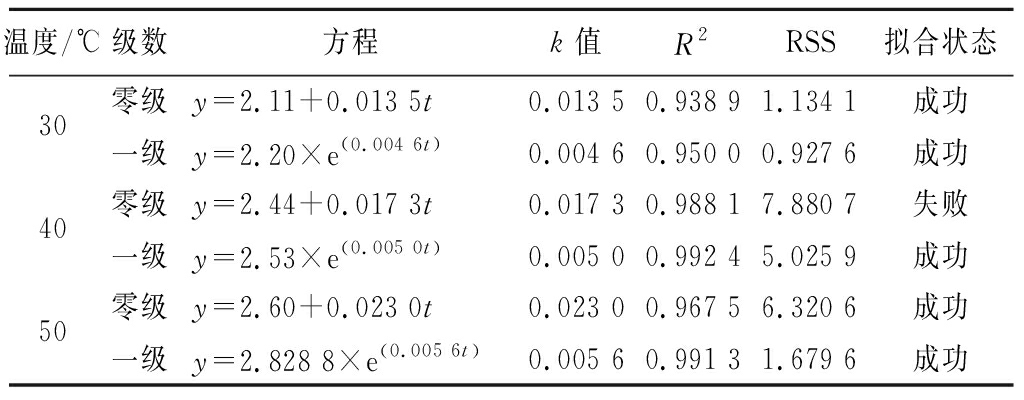
温度/℃级数方程k值R2RSS拟合状态30零级y=2.11+0.013 5t0.013 50.938 91.134 1成功一级y=2.20×e(0.004 6t)0.004 60.950 00.927 6成功40零级y=2.44+0.017 3t0.017 30.988 17.880 7失败一级y=2.53×e(0.005 0t)0.005 00.992 45.025 9成功50零级y=2.60+0.023 0t0.023 00.967 56.320 6成功一级y=2.828 8×e(0.005 6t)0.005 60.991 31.679 6成功
根据表3和表4的结果,基于POV数值拟合中存在过失败的情况,因此本研究最终确定选取AV作为重要氧化指标,以表征亚临界萃取过程中鱼肝油的氧化变化。Arrhenius模型可表征亚临界萃取温度对萃取过程中鱼肝油AV的动力学速率影响规律,以1/T为横坐标,反应速率常数k的对数值 lnk为纵坐标,可建立Arrhenius曲线。如图2所示,根据斜率计算可发现,亚临界萃取过程中鱼肝油在氧化动力学零级和一级反应模型下所需自由能Ea分别为29.951、22.416 kJ/mol,R2分别为0.983 1和0.988 6。结合表3和表4可总结,一级氧化模型更适合表征鱼肝油在亚临界萃取过程中的氧化变化,通过公式(7)计算得到最终氧化预测模型,如公式(8)所示:
(8)
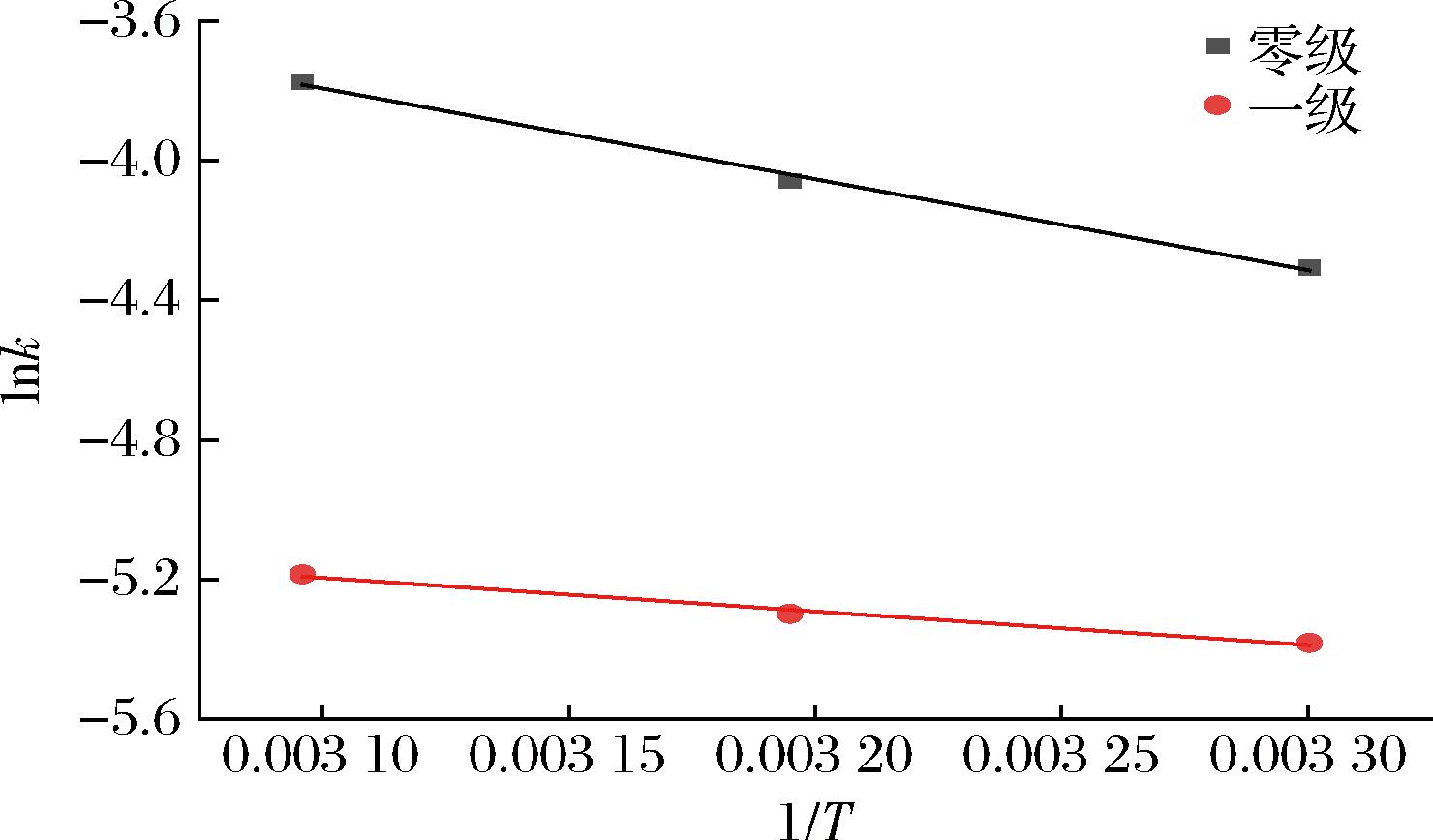
图2 基于酸价的动力学Arrhenius曲线
Fig.2 Kinetic reaction Arrhenius plot based on acid value
此外,研究还就亚临界萃取鱼肝油AV随萃取时间、温度变化的实测值与上述氧化预测模型计算所得的预测值进行了相关性分析。如图3所示,30、40、50 ℃亚临界萃取温度下AV的实际值与预测值间相关系数分别达0.969 7、0.956 1、0.936 5,模型拟合度较高。
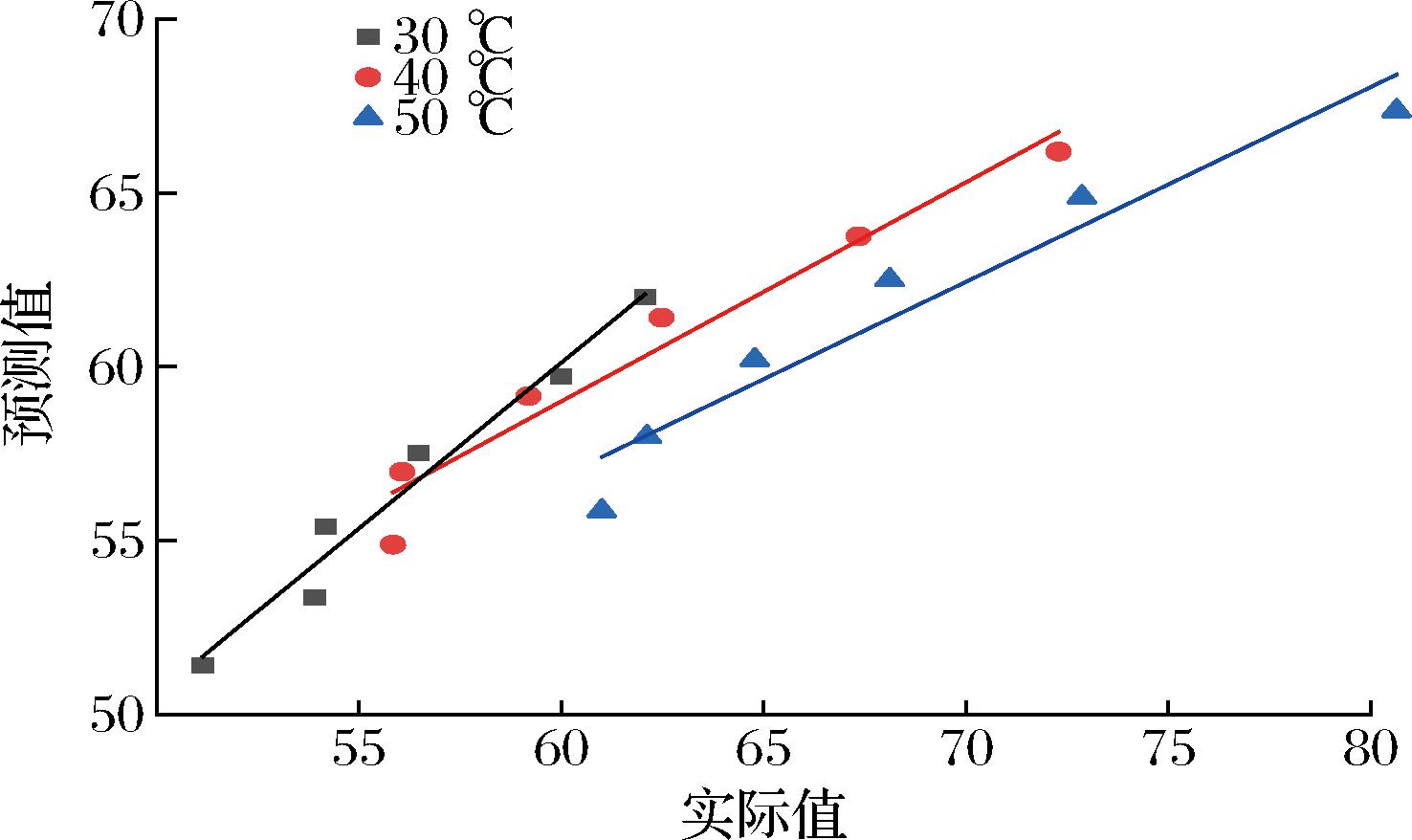
图3 不同亚临界萃取温度下酸价的实际值与预测值相关性
Fig.3 Correlation between the actual and predicted values of acid value at different subcritical extraction temperatures
2.4 亚临界萃取过程中鱼肝油脂肪酸组成变化
亚临界萃取过程中鱼肝油的脂肪酸组分变化见表5,饱和脂肪酸(saturate fatty acids, SFA)含量在各温度下都随时间的延长逐渐升高,这一发现与崔晨茜等[18]研究发现一致。80 min开始,SFA增加的量相较与短时间内有显著的变化;油酸作为单不饱和脂肪酸,其相对含量在30 ℃时,随着时间的变化,含量减少的变化较为明显,当温度为40 ℃和50 ℃时,并无显著的变化。鱼肝油中其他单不饱和脂肪酸多呈现减少的趋势,与李佳灵等[19]研究成果一致,在油脂受热后,不饱和脂肪酸含量都在下降,但是整体的变化都不是很显著。多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)中亚油酸、亚麻酸变化与油酸的变化规律基本一致,都在较低温度、萃取80 min时开始变化较明显。另一种PUFA花生四烯酸的含量受时间影响并不显著,但在不同温度下,含量变化较大。鱼肝油中特有的EPA和DHA的含量,随着温度的变化都有明显的下降,其中EPA的含量在40 min时就有了明显的降低,40 min之后的变化差异不大;DHA的含量在80 min时的变化明显,120 min时较80 min时,含量再一次明显下降。这些结果表明亚临界萃取鱼肝油的氧化以不饱和脂肪酸的氧化降解为主,尤其是PUFA的氧化分解,是影响亚临界萃取过程中油脂氧化的重要因素。REBOLLEDA等[20]使用超临界萃取的玉米油氧化中的脂肪酸组成变化也呈现了相对一致的趋势。
表5 鱼肝油在亚临界萃取过程中脂肪酸组分变化
Table 5 Changes in fatty acid composition of tuna liver oil during subcritical extraction

脂肪酸分子式温度/℃相对含量/%20 min40 min60 min80 min100 min120 min肉豆蔻酸C14:0301.57±0.02b1.58±0.04b1.62±0.02b1.71±0.02a1.73±0.02a1.73±0.02a401.59±0.04b1.64±0.01ab1.68±0.03ab1.72±0.01a1.70±0.04a1.74±0.03a501.60±0.06b1.69±0.08ab1.73±0.05ab1.73±0.01ab1.83±0.01a1.84±0.06a十五烷酸C15:0300.71±0.02b0.70±0.02b 0.78±0.02ab0.80±0.04a 0.77±0.02ab0.83±0.03a400.69±0.01b0.79±0.01a0.82±0.03a0.82±0.03a0.83±0.02a0.83±0.05a500.84±0.01a0.83±0.10a0.87±0.02a0.92±0.10a0.86±0.07a0.88±0.06a棕榈酸C16:03021.41±0.15b 24.28±1.13a 24.83±0.28a 25.62±0.08a 24.09±0.19a 25.10±0.52a 4021.34±0.15b22.19±0.90b21.85±1.37b23.39±1.12ab26.29±0.30a25.79±0.32a5021.36±0.20b21.62±0.62b22.38±1.09ab24.85±0.50a24.56±1.17a25.24±0.90a棕榈油酸C16:1303.70±0.04a3.80±0.06a3.70±0.03a3.47±0.04b3.33±0.06b3.11±0.03c403.78±0.06a3.71±0.05a3.51±0.28a3.50±0.38a3.26±0.04a3.18±0.46a503.83±0.03a3.64±0.03ab3.38±0.15abc3.42±0.24abc3.18±0.14bc3.11±0.17c十七碳酸C17:0300.93±0.02b0.96±0.02b 1.04±0.06ab0.97±0.02b0.98±0.02b1.12±0.02a400.94±0.03b0.94±0.08b1.06±0.02ab1.02±0.07b1.19±0.04ab1.22±0.07a500.94±0.01b0.98±0.03b0.96±0.01b1.22±0.08a1.26±0.02a1.30±0.06a十七碳烯酸C17:1301.59±0.02a 1.50±0.04ab1.41±0.02b 1.48±0.08ab1.37±0.04bc1.27±0.02c401.56±0.06a1.48±0.08ab1.38±0.03bc1.37±0.02bc1.31±0.02c1.24±0.03c501.51±0.01a1.38±0.05ab1.31±0.04b1.29±0.04b1.23±0.01b1.24±0.08b硬脂酸C18:0307.15±0.06c7.22±0.20c 7.49±0.29bc 8.05±0.11ab8.16±0.20a 8.35±0.09a407.29±0.47b7.42±0.09b8.11±0.50b9.74±0.48a9.81±0.01a9.71±0.30a507.08±0.16b7.39±1.23b7.36±0.10b8.49±1.53ab9.42±0.19ab10.51±0.45a油酸C18:1n9c3016.65±0.23a 16.39±0.14ab 16.10±0.32abc 15.69±0.03bcd15.63±0.28cd 15.21±0.03d 4016.61±2.75a16.37±0.31a16.14±0.64a16.35±0.19a16.04±0.13a15.54±0.19a5015.56±0.20a14.98±0.15a14.87±0.46a14.18±0.80a14.16±0.48a14.15±0.11a亚油酸C18:2n6c300.89±0.03a0.85±0.01a0.83±0.01a0.77±0.03b0.74±0.01b0.73±0.01b400.81±0.05a0.78±0.12a0.79±0.05a0.74±0.03a0.72±0.02a0.79±0.01a500.76±0.01a0.73±0.01a0.70±0.01a0.70±0.04a0.71±0.01a0.71±0.02a亚麻酸C18:3n3300.26±0.02a 0.24±0.02ab 0.22±0.01abc 0.21±0.02bc0.21±0.01c0.19±0.01c400.24±0.03ab0.27±0.02a0.18±0.01bc0.18±0.02bc0.24±0.01bc0.17±0.01c500.25±0.03a0.24±0.02ab0.21±0.03abc0.15±0.03bc0.17±0.03c0.16±0.02abc花生酸C20:0300.20±0.04a0.22±0.03a0.23±0.02a0.24±0.01a0.23±0.02a0.24±0.01a400.18±0.06a0.24±0.03a0.23±0.04a0.25±0.01a0.25±0.06a0.21±0.01a500.21±0.01a0.24±0.01a0.23±0.03a0.22±0.02a0.21±0.05a0.22±0.02a花生烯酸C20:1300.42±0.03a0.40±0.02a0.39±0.07a0.37±0.01a0.35±0.01a0.33±0.02a400.40±0.07a0.45±0.10a0.36±0.02a0.34±0.03a0.34±0.03a0.32±0.03a500.39±0.01a0.38±0.01ab0.38±0.01ab0.35±0.01ab0.37±0.01ab0.34±0.03b花生四烯酸C20:4n6303.54±0.08a3.32±0.07a3.35±0.41a3.23±0.07a3.09±0.06a2.93±0.05a403.38±0.06a3.26±0.36a3.41±0.26a3.13±0.19a3.02±0.06a3.06±0.05a503.13±0.02a3.07±0.02a3.05±0.10a2.89±0.13a2.82±0.19a2.79±0.16aEPAC20:5n3305.94±0.08a5.61±0.15ab 5.45±0.02abc 5.28±0.32bc 5.07±0.05bc5.01±0.01c405.98±0.25a5.41±0.40ab5.37±0.16ab5.22±0.23ab4.97±0.12b4.71±0.02b505.52±0.22a5.20±0.02a4.81±0.06ab4.43±0.22b4.25±0.29b4.28±0.26bDHAC22:6n33021.80±0.15a 20.67±0.59a 20.77±1.74a 20.25±0.21a 18.97±0.09ab 16.93±0.71b 4020.60±0.31a19.70±0.05a19.71±0.10a18.23±0.06b17.76±0.55bc17.15±0.07c5019.25±0.18a18.93±0.05ab18.25±0.11abc17.55±0.44bc17.18±0.83c16.98±0.04c
注:同一萃取温度下,脂肪酸含量结果后的不同字母表示在该时间段脂肪酸含量的差异显著(P<0.05)。
2.5 亚临界萃取过程中鱼肝油维生素含量变化
亚临界萃取过程中鱼肝油中脂溶性维生素含量的变化如图4所示。几种维生素含量随温度呈现不同程度的下降趋势,但萃取时间与维生素含量的减少并无线性趋势。维生素A含量随亚临界温度增长其下降趋势更加明显,这一发现与SILALAHI等[21]对热处理植物油进行的维生素A变化分析结果相同。维生素D作为一种较为脆弱的脂溶性维生素,受光照、加热可发生分解[22],但本研究结果显示,亚临界萃取温度的影响相对不明显;亚临界萃取时间对维生素D2、维生素D3含量的影响明显,在80 min 出现显著上升趋势。维生素E作为一种天然抗氧化剂,随加工温度的增加和时间的延长,其化学结构可会发生改变[23],因不同程度的氧化降解影响最终的活性[24]。本结果显示超过40 ℃亚临界萃取温度时,3种结构的维生素E都明显下降了,α-维生素E下降率最低,γ-维生素E含量下降程度最大。

a-维生素A随温度变化;b-维生素A随时间变化;c-维生素D2和维生素D3随温度变化;d-维生素D2和维生素D3随时间变化;e-α-维生素E和ξ-维生素E、γ-维生素E随温度变化;f-α-维生素E、γ-维生素E和ξ-维生素E随时间变化
图4 鱼肝油在亚临界萃取过程中维生素含量的变化
Fig.4 Changes of vitamin content in tuna liver oil during subcritical extraction
注:图中同一曲线不同萃取时间段的不同字母表示差异显著(P<0.05)。
3 结论
本研究通过在30、40、50 ℃ 3个温度下亚临界萃取的鱼肝油氧化稳定性的时间变化规律,确认了鱼肝油在时间或温度变化下酸价、过氧化值和茴香胺值的相关性,最终总结了亚临界鱼肝油萃取过程中越高温度、越长亚临界萃取时间会降低鱼肝油的氧化稳定性的规律;通过模型拟合成功建立了基于酸价预测亚临界萃取油脂氧化的动力学模型lnF=lnF0+13.74te-22.42/RT。鱼肝油中的营养物质含量也呈现了动态变化,DHA和EPA随萃取时间的延长与温度的增加而减少,受温度的影响更为明显;脂溶性维生素也随亚临界萃取时间与温度有所下降,维生素E被破坏的速率更明显。本研究以动力学模型阐述了海洋脂质在亚临界萃取过程存在的氧化变化规律,虽然亚临界技术在理论与应用研究中呈现了一定性能优势,但考虑到原料自身的氧化无法避免,建议行业操作降低亚临界萃取温度与时间,以实现高值海洋油脂的高质量生产。
[1] MA T Q, HE L F, LUO Y, et al.Use of fish oil and mortality of patients with cardiometabolic multimorbidity:A prospective study of UK biobank[J].Nutrition, Metabolism and Cardiovascular Diseases, 2022, 32(12):2751-2759.
[2] LIU S H, CHEN Y C, TZENG H P, et al. Fish oil enriched ω-3 fatty acids ameliorates protein synthesis/degradation imbalance, inflammation, and wasting in muscles of diet-induced obese rats[J]. Journal of Functional Foods, 2021, 87:104755.
[3] CARPINTER B A, RENHE D C, BELLEI J C B, et al. DHA-rich fish oil plays a protective role against experimental cerebral malaria by controlling inflammatory and mechanical events from infection[J]. The Journal of Nutritional Biochemistry, 2024, 123:109492.
[4] 干淼钰, 田方, 曹爱玲, 等.超临界流体技术在鱼油加工中的应用研究进展[J].中国油脂, 2024, 49(9):16-22.GAN M Y, TIAN F, CAO A L, et al.Research progress on the application of supercritical fluid technology in fish oil processing[J].China Oils and Fats, 2024, 49(9):16-22.
[5] 王文洁, 陈修彪, 陈云云, 等.亚临界萃取技术在水产品营养组分提取领域研究进展[J].食品与机械, 2023, 39(2):1-8;24.WANG W J, CHEN X B, CHEN Y Y, et al.Research progress of subcritical extraction technology in the field of nutrient component extraction from aquatic products[J].Food &Machinery, 2023, 39 (2):1-8;24.
[6] WANG W J, XIAO Y L, DING Y C, et al.Effect of microwave (MW)-subcritical extraction on oil recovery, oxidative stability, and lipid types from Katsuwonus pelamis livers[J].Food Chemistry:X, 2024, 22:101351.
[7] FANG Y Z, LIU S L, HU W, et al.Extraction of oil from high‐moisture tuna livers by subcritical dimethyl ether:A comparison with different extraction methods[J].European Journal of Lipid Science and Technology, 2019, 121(2):1800087.
[8] 毛丽芳, 朱新亮, 桑卫国.亚临界流体萃取马鲛鱼加工下脚料中鱼油的研究[J].宁波大学学报(理工版), 2012, 25(4):10-15.MAO L F, ZHU X L, SANG W G.Fish oil extraction from by-products of Cybium niphonium using subcritical fluid extraction method[J].Journal of Ningbo University (NSEE), 2012, 25(4):10-15.
[9] SUN D W, CAO C, LI B, et al.Antarctic krill lipid extracted by subcritical n-butane and comparison with supercritical CO2 and conventional solvent extraction[J].LWT, 2018, 94:1-7.
[10] KASEKE T, OPARA U T, FAWOLE O A.Oxidative stability of pomegranate seed oil from blanched and microwave pretreated seeds:Kinetic and thermodynamic studies under accelerated conditions[J].Journal of Food Processing and Preservation, 2021, 45:e15798.
[11] 刘姗姗, 沈玥, 黄现青, 等.不同贮藏温度下猪油品质变化及氧化动力学模型构建[J].食品与机械, 2021, 37(12):113-120.LIU S S, SHEN Y, HUANG X Q, et al.Construction of quality change and oxidation kinetics model of lard during storage[J].Food and Machinery, 2021, 37 (12):113-120.
[12] 龙婷, 林树真, 林树红, 等. 基于不同贮藏温度下油茶籽油氧化模型的建立[J]. 中国粮油学报, 2020, 35(5):105-109.LONG T, LIN S Z, LIN S H, et al. Establishment of oxidation model of Camellia oleifera seed oil based on different storage temperatures[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(5):105-109.
[13] 周猛, 李东萍. 远洋的馈赠: 金枪鱼[J]. 中国水产, 2022(12):104-106.ZHOU M, LI D P. A gift from the ocean-tuna[J]. China Fisheries, 2022(12):104-106.
[14] 周爽, 刘玫初, 姜虹宇, 等.榛子油在煎炸薯条过程中品质变化的研究[J].中国粮油学报, 2024,39(12):148-156.ZHOU S, LIU M C, JIANG H Y, et al.Study on the quality changes of hazelnut oil during frying and frying of French fries[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(12):148-156.
[15] XU L R, ZHU C F, LIU T R, et al.Effect of microwave heating on lipid composition, chemical properties and antioxidant activity of oils from Trichosanthes kirilowii seed[J].Food Research International, 2022, 159:111643.
[16] XU W, YAO J, YI F, et al.Effects of storage condition on the physicochemical characteristics of sunflower seed oil[J].Rsc Advances, 2019, 9:42262-42271.
[17] AL-KHAROUSI N, AL-KHUSAIBI M, AL-BULUSHI I, et al.Physico-chemical characteristics and oxidative stability of date-pits oil during storage at different temperatures[J].International Journal of Food Engineering, 2016, 12:385-393.
[18] 崔晨茜, 张红燕, 袁贝, 等.金枪鱼油加热后脂肪酸的动态变化[J].食品工业科技, 2017, 38(9):271-276.CUI C X, ZHANG H Y, YUAN B, et al.Dynamic changes of fatty acids in heated tuna oil[J].Science and Technology of Food Industry, 2017, 38(9):271-276.
[19] 李佳灵, 杨舒曼, 牛阳雨, 等.微波预处理对山苍子油脂肪酸组成、活性成分及挥发性风味的影响[J].中国油脂, 2024, 49(10):7-13;19.LI J L, YANG S M, NIU Y Y, et al.Effect of microwave pretreatment on fatty acid composition, active components and volatile flavor of Litsea cubeba oil[J].China Oils and Fats, 2024, 49(10):7-13;19.
[20] REBOLLEDA S, RUBIO N, BELTR N S, et al. Supercritical fluid extraction of corn germ oil: Study of the influence of process parameters on the extraction yield and oil quality[J]. The Journal of Supercritical Fluids, 2012, 72:270-277.
N S, et al. Supercritical fluid extraction of corn germ oil: Study of the influence of process parameters on the extraction yield and oil quality[J]. The Journal of Supercritical Fluids, 2012, 72:270-277.
[21] SILALAHI D K N, YULIYANTI D, DA SILVA M, et al. The stability of vitamin A in fortified palm olein during extended storage and thermal treatment[J]. International Journal of Food Science &Technology, 2017, 52(8):1869-1877.
[22] ZAREIE M, ABBASI A, FAGHIH S.Influence of storage conditions on the stability of vitamin D3 and kinetic study of the vitamin degradation in fortified canola oil during the storage[J].Journal of Food Quality, 2021:5599140.
[23] PARK J S, KIM S Y, LEE S C, et al.Edible oil extracted from anchovies using supercritical CO2:Availability of fat-soluble vitamins and comparison with commercial oils[J].Journal of Food Processing and Preservation, 2021, 45(5):e15441.
[24] 徐月华, 蒋将, 孟宗, 等.烘烤条件对核桃油品质的影响[J].中国油脂, 2014,39(7):9-12.XU Y H, JIANG J, MENG Z, et al.Effect of roasting conditions on the quality of walnut oil[J].China Oils and Fats, 2014,39(7):9-12.