黄酒起源于中国,是以稻米、糯米、小米等为主要原料,经加曲和/或部分酶制剂、酵母等糖化发酵剂酿造而成的发酵酒。黄酒独特的边糖化、边液化双边发酵工艺产生了丰富的营养物质,如氨基酸、低聚糖、酚酸、黄酮、单宁等[1-2]。其中,酚类化合物主要来源于谷物的麸皮层和胚芽。在原料带皮发酵过程中,经过微生物复杂的生化作用,酚类化合物溶入酒中,赋予了黄酒独特的风味和营养价值。大量研究显示,黄酒中酚类化合物在清除体内自由基[3]、减轻氧化应激[4]、预防阿霉素诱导的心脏毒性[5]、降低炎症反应[2]、改善动脉粥样硬化斑块[6]等方面具有积极作用,同时还可以与蛋白质和多糖相互作用提升黄酒的感官品质 [7]。然而,黄酒中酚类化合物成分复杂,目前关于其具体组成和含量的研究仍然有限,这在很大程度上制约了对其作用机制的进一步深入探究。
酚类化合物由一系列次生代谢产物构成,是黄酒的重要功能成分。黄酒中总酚含量为137~582 mg/L[8-9],低于红葡萄酒(1 527~3 936 mg/L)[10-11],与白葡萄酒(178~524 mg/L)相当[10-12],其含量主要受原料的品种和质量、酿造工艺(如发酵时间、温度、酒曲的种类和用量)、贮存条件等影响[13]。酚类化合物是构成黄酒非酒精组分最丰富的化合物类群之一,结构复杂、种类多样,可以分为两大类:黄酮类化合物(如花青素、黄烷醇、黄酮醇等)和非黄酮类化合物(如酚酸、芪类化合物等)[14-15]。前期研究显示,黄酒中酚类化合物主要以酚酸类和黄酮类为主,包括阿魏酸、儿茶素、没食子酸、肉桂酸等20种常见酚类化合物,总量为1.3~115.7 mg/L[16-18]。目前,采用广泛靶向代谢组学方法,在黄酒样品中识别到了222种酚类化合物和180种黄酮类化合物[19],这拓展了对黄酒中酚类化合物的认知。然而,受限于酚类化合物定性的覆盖率和定量的准确性,以及糖、蛋白等组分缔合的干扰,黄酒中复杂酚类化合物的分离提取以及准确定量仍然面对挑战。
酒精饮料中酚类化合物的检测主要有分光光度法(Folin-ciocalteu法、紫外-可见分光光度法等)、光谱法(红外光谱、荧光光谱、拉曼光谱等)、色谱法(液相色谱、液相色谱质谱联用等)和电化学法(差分脉冲伏安法等)[12]。液相色谱串联质谱联用技术由于可靠性和准确性而被许多研究人员使用。其中超高效液相色谱-四极杆飞行时间串联质谱(ultrahigh-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS/MS)和超高效液相色谱-三重四级杆串联质谱(ultrahigh-performance liquid chromatography coupled with triple quadrupole tandem mass spectrometry,UPLC-QQQ-MS/MS)是黄酒酚类化合物研究中最强大的分析工具之一。前者分辨能力强、检测灵敏度高、质量范围宽,未知化合物识别能力突出,适合复杂样品的定性分析;后者特异性高、选择性好,在定量分析中表现出色。二者结合可以为黄酒酚类化合物的分析提供一种有效且可靠的途径。此外,由于黄酒样品基质复杂,因此往往需要采用液液萃取(liquid-liquid extraction,LLE)、固相萃取(solid-phase extraction,SPE)、固相微萃取(solid-phase microextraction,SPME)等单一方法或多方法组合技术进行样品制备,以达到除杂纯化、适应仪器检测条件等目的。整体来讲,仪器科学的快速发展为黄酒中酚类化合物的高效识别和准确量化提供了可能。
本研究以4种不同甜型的绍兴黄酒作为研究对象,采用LLE、SPE以及LLE结合SPE的前处理手段,基于UPLC-Q-TOF-MS/MS对黄酒中酚类化合物进行定性及半定量分析,进一步建立了多反应监测(multiple reaction monitoring,MRM)模式下UPLC-QQQ-MS/MS分析策略,针对高丰度酚类化合物进行外标法准确定量,最后从DPPH自由基清除能力、ABTS阳离子自由基清除能力和总还原能力(铁还原能力)对黄酒酚类化合物进行抗氧化能力评估。这项工作是黄酒中酚类化合物高效鉴定和准确定量的有效探索,为其质量控制和评价提供了有用信息。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
黄酒,浙江古越龙山绍兴酒股份有限公司;无水乙醇、氢氧化钠、色谱级甲醇、色谱级乙腈、乙酸、盐酸,国药集团化学试剂有限公司;乙酸乙酯、福林酚,上海泰坦科技股份有限公司;L-2-氯苯丙氨酸、DPPH、ABTS、维生素C、没食子酸、芦丁,纯度>98%,上海源叶生物科技有限公司;阿魏酸、鼠尾草酚、秦皮乙素、高香草酸、牛蒡子苷元、6-姜酚、姜酮酚、柚皮素、姜酮、双去甲氧基姜黄素、桑色素、玉米烯酮,纯度>98%,四川省维克奇生物科技有限公司;邻香豆酸,纯度>98%,上海麦克林生化科技有限公司;2,2′-亚甲基双(6-叔丁基对甲酚)、2-(4-羟基苯甲酰氨基)乙酸、补骨脂二氢黄酮甲醚、对香豆酸乙酯,纯度>98%,四川精萃天成药物科技有限公司;过硫酸钾,阿拉丁试剂(上海)有限公司。
1.1.2 仪器与设备
Varioskan Flash型全自动酶标仪,赛默飞世尔科技(中国)有限公司;SHB-B95循环水式多用真空泵、DLSB低温冷却液循环泵、R-1020旋转蒸发仪,杭州庚雨仪器有限公司;CR21 N落地式低温高速离心机,日本工机控股株式会社;Oasis MAX阴离子固相萃取小柱、超高效液相色谱串联四极杆飞行时间质谱联用、UNIFI软件分析平台,美国Waters公司;Waters ACQUITY TQD串联四极杆液质联用仪,上海沃特世科技有限公司;FE20 pH计,梅特勒-托利多仪器有限公司;ZXGP-B2080电热恒温水浴锅,上海智城分析仪器制造有限公司;Vortex-Genie2 G560E漩涡混合器,美国科学工业公司。
1.2 样品前处理
参考PENG等[2]的方法并进行适当修改。取1 L不同甜型黄酒旋转蒸发浓缩至原体积1/9,然后向浓缩液中按1∶4体积比加入无水乙醇,在4 ℃环境沉淀12 h以上,4 ℃下离心(10 000 r/min,20 min)收集上清液并进行浓缩至100 mL,浓盐酸调节pH值至2.0[20],得到黄酒酚类化合物浓缩液,4 ℃保存备用。
1.2.1 LLE处理
取黄酒酚类化合物浓缩液10 mL,加入10 mL乙酸乙酯振荡萃取30 min,8 000 r/min离心5 min,收集上清液,重复3次,合并上层萃取液,于35 ℃旋转蒸发仪浓缩至干,使用10 mL甲醇溶解,收集溶解液过0.22 μm有机系滤膜,备用。
1.2.2 SPE处理[21]
取6 mL黄酒酚类化合物浓缩液加载到Oasis MAX阴离子固相萃取柱(6 mL甲醇和6 mL超纯水预活化),使用12 mL 5%(体积分数)NH4OH冲洗小柱,弃去废液,采用6 mL纯甲醇进行第1次洗脱,6 mL 2%(体积分数)甲酸-甲醇溶液进行第2次洗脱,2次洗脱液合并后,经N2吹干,然后以6 mL 2%(体积分数)乙酸-甲醇溶液定容,过0.22 μm有机系滤膜,备用。
1.2.3 LLE结合SPE处理
黄酒酚类化合物浓缩液经过1.2.1节LLE处理,然后按照1.2.2节SPE处理,收集洗脱液过0.22 μm有机系滤膜,备用。
1.3 总酚含量测定
参考WU等[22]的方法并作适当修改。精确称取10 mg没食子酸标准品,蒸馏水定容至100 mL,得到质量浓度为0.1 mg/mL的没食子酸标准溶液。分别准确吸取0、20、40、60、80、100、120、140 μL没食子酸标准溶液和50 μL样品溶液,加入250 μL 0.1 mol/L福林酚试剂,室温(25 ℃)反应5 min后,加入200 μL质量浓度为75 g/L Na2CO3溶液,混匀后用蒸馏水定容至1 mL,避光反应2 h。使用酶标仪在765 nm处测定吸光值,根据标准曲线计算总多酚含量。
1.4 总黄酮含量测定
参考HE等[23]的方法并作适当修改。准确称取10 mg芦丁标准品,用体积分数为60%乙醇定容至100 mL,得到质量浓度为0.1 mg/mL芦丁标准溶液;分别吸取0、50、100、150、200、250、300、350、400 μL芦丁标准溶液和150 μL样品溶液,加入30 μL 50 g/L亚硝酸钠溶液,静置6 min;加入30 μL 100 g/L硝酸铝溶液,静置6 min,加入400 μL体积分数为10% NaOH溶液,用体积分数为60%乙醇溶液定容至1 mL,静置20 min。在510 nm处测定吸光度,根据标准曲线计算总黄酮含量。
1.5 UPLC-Q-TOF-MS/MS定性分析
1.5.1 色谱条件
色谱柱:Waters HSS T3(100 mm×2.1 mm,1.8 μm);柱温35 ℃;进样量2 μL;流速0.3 mL/min;流动相A:体积分数为1%乙酸-水溶液;流动相B:乙腈;梯度洗脱程序:0 min 2% B,0.5 min 2% B,10 min 20% B,18 min 100% B,21 min 100% B,21.5 min 2% B。
1.5.2 质谱条件
ESI离子源;正负离子模式下扫描;毛细管电压3 kV;锥孔电压40 V;提取锥孔电压3 V;脱溶剂气(N2)流速800 L/h;锥孔气(He)流速50 L/h;脱溶剂气温度300 ℃;离子源温度150 ℃;扫描范围50~1 200 m/z;扫描时间0.5 s;间隔时间0.02 s。
1.5.3 UNIFI数据处理
分别采用556.276 6(负离子模式)和554.262 0(正离子模式)进行LockSpray实时校正,低能通道强度阈值1 200 counts,高能通道强度阈值20.0 counts。质荷比匹配质量精度± 5 mDa,并开展高能通道中碎片离子匹配。二元对比参数:时间误差0.2 min,质荷比质量精度± 5 mDa,相对强度阈值50%。
1.5.4 定性及半定量方法
黄酒酚类化合物通过获得母离子及碎片离子的高分辨、高质量精确数据功能及结合UNIFI在线数据库进行定性,采用内标法(L-2-氯苯丙氨酸)进行半定量。具体地,L-2-氯苯丙氨酸用甲醇配制成100 mg/L内标溶液,与提取的黄酒酚类化合物待测物混匀,使得样品溶液中的内标质量浓度为1 mg/L。
1.6 UPLC-QQQ-MS/MS定量分析
1.6.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温35 ℃;进样量5 μL;流速0.3 mL/min;流动相A:乙腈;流动相B:体积分数为1%的甲酸-水溶液;梯度洗脱程序:0 min 5% A,2 min 5% A,15 min 55% A,25 min 100% A,26 min 100% A,26.5 min 5% A。
1.6.2 质谱条件
采用ESI离子源;正、负离子模式下扫描;扫描模式:MRM;碰撞池能量:15~35 eV;离子源温度120 ℃;毛细管电压3.0 kV;锥孔气流量50 L/h;脱溶剂气温度400 ℃;脱溶剂气流量600 L/h,碰撞气流量0.3 mL/min。
1.6.3 质谱参数优化
通过UPLC-MS/MS结合Masslynx软件对25种酚类化合物质谱参数进行优化。首先确定酚类化合物的正、负离子模式,选择响应最强的母离子-子离子对;并在最优母离子-子离子对的基础下,优化锥孔电压(10~40 V)、碰撞能量(5~40 eV)等质谱参数。
1.6.4 方法验证
通过测定已知25种酚类化合物浓度混合标液,得到浓度-峰面积标准曲线,每个浓度重复测定6次,方法可靠性主要从相关性系数R2、线性范围、检测限、定量限、精密度等方面评价。回收率实验使用半干黄酒进行评估,将标准品以约100%内源酚类化合物加入黄酒样品中,与未添加标准品的黄酒样品进行相同前处理,以加标样品和未加标样品中测得酚类化合物浓度的差值,除以加标量即为加标回收率。
1.6.5 外标法准确定量
将选择25种酚类化合物溶于色谱级甲醇,制备成500 mg/L单标工作液,以甲醇作为稀释溶剂配制质量浓度为50 mg/L混合工作液,将混合工作液用甲醇稀释成8个0.001~25.000 mg/L不同质量浓度梯度,于-20 ℃下保存。得到的梯度标准溶液按照UPLC-QQQ-MS/MS条件进行操作,以标准品质量浓度(mg/L)为横坐标(x),以提取离子色谱图峰面积为纵坐标(y)建立标准曲线,采用外标法对不同甜型黄酒中25种酚类化合物实现准确定量。
1.7 体外抗氧化活性测定
1.7.1 DPPH自由基清除能力的测定
参考YEN等[24]的方法并作适当修改。用无水乙醇将DPPH配制成0.1 mmol/L,将不同浓度的受试样品加入到试管中混匀,室温避光放置30 min,测定517 nm处吸光值,以相同浓度的抗坏血酸溶液作为阳性对照。按公式(1)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(1)
式中:A0,DPPH溶液+无水乙醇的吸光度值;A1,受试样品+DPPH溶液的吸光度值;A2,受试样品+无水乙醇的吸光度值。
1.7.2 ABTS阳离子自由基清除能力的测定
参考RE等[25]的方法并作适当修改。将7.4 mmol/L ABTS溶液与2.6 mmol/L过硫酸钾溶液等体积混合,室温避光放置12 h后,用无水乙醇稀释,使溶液在734 nm处吸光值为0.7±0.02,得到ABTS溶液;将受试样品与ABTS溶液振荡混匀,室温反应6 min后,测定734 nm处吸光值,以相同浓度的抗坏血酸作为阳性对照。按公式(2)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(2)
式中:A1,受试样品+ABTS溶液的吸光度值;A2,无水乙醇+ABTS溶液的吸光度值。
1.7.3 总还原能力的测定
使用总还原能力试剂盒测定总还原能力,总还原能力由Fe2+的浓度表示。制备铁离子还原能力(ferric ion reducing antioxidant power,FRAP)工作液:FRAP缓冲液、2,4,6-三 (2-吡啶)-1,3,5-三嗪和氯化铁溶液分别按10∶1∶1的比例混合;制备Fe2+标准梯度溶液:用蒸馏水将Fe2+标准溶液(558.45 mg/L)稀释至0、2.79、5.58、16.75、27.92、39.09、50.26、67.01和83.77 mg/L。将不同浓度Fe2+标准溶液与FRAP工作液依次加入96孔板中混合。37 ℃孵育30 min,用酶标仪记录反应溶液在593 nm处吸光度值。结果以Fe2+的质量浓度(mg/L)表示。
1.8 数据分析
所有分析重复3次以上,结果表示为“平均值±标准差”。使用Masslyxn V 4.2软件对总离子流图进行分析,使用Origin 2021软件进行数据可视化。使用SPSS 26.0软件对数据进行统计学分析,多重比较采用单因素方差分析,事后多重检验采用Duncan检验(方差齐)和Tamhane检验(方差不齐),P<0.05被认为在统计学上差异显著。
2 结果与分析
2.1 不同甜型黄酒总酚和总黄酮含量
采用福林酚法和亚硝酸钠-硝酸铝法测定不同甜型黄酒酒样中总酚和总黄酮含量,结果如表1所示。
表1 不同甜型黄酒总酚和总黄酮含量
Table 1 Total phenol and total flavonoid contents in Huangjiu with different sugar contenes

酒样总酚含量/(mg/L)总黄酮含量/(mg/L)干黄酒 201.03±3.82a120.63±0.61c半干黄酒217.45±1.96a141.08±1.22b半甜黄酒212.84±1.23a145.10±0.68b甜黄酒 224.62±7.33a158.27±0.61a
注:同列中不同字母表示差异显著(P<0.05)(表5同)。
由表1可知,4种不同甜型黄酒的总酚含量为201.03~224.62 mg/L,且无显著差异(P>0.05),整体含量略低于文献[8]报道水平(总酚含量为376~582 mg/L)。在4种不同甜型黄酒中,总黄酮含量在总酚含量中的占比均超过60%,特别地,半干黄酒与半甜黄酒在黄酮含量上无显著差异(P>0.05),与干黄酒和甜黄酒差异显著(P<0.05),这种差异与黄酒原料及产地、发酵工艺和酿造技术等多种因素有关[26]。
2.2 不同前处理方法对总酚和总黄酮提取率的影响
采用LLE、SPE和LLE+SPE 3种前处理方法对4种不同甜型黄酒中酚类化合物进行萃取,然后测定其总酚和总黄酮提取率,结果如表2所示。
表2 不同前处理方法对总酚和总黄酮提取率的影响
Table 2 Effect of different pretreatment methods on extraction rate of total phenols and total flavonoids

酒样总酚提取率/%总黄酮提取率/%LLESPELLE+SPELLESPELLE+SPE干黄酒 12.31±0.54aA3.05±0.17bB1.36±1.18bA5.96±0.18aA2.53±0.14bB1.54±1.34bA半干黄酒12.45±0.26aA3.95±0.10bA2.12±0.61cA5.77±0.14aA3.33±0.22bA2.68±0.08cA半甜黄酒12.14±0.26aA3.41±0.17bB1.13±0.09cA5.61±0.19aA3.23±0.03bA2.70±0.18cA甜黄酒 12.61±0.19aA/0.75±0.65bA5.69±0.19aA/1.41±1.23bA
注:不同小写字母表示相同甜型黄酒在不同前处理方法之间差异显著(P<0.05),不同大写字母表示相同前处理方法在不同甜型黄酒之间差异显著(P<0.05)。
结果表明,不同前处理技术对黄酒中总酚和总黄酮的提取率有显著影响。具体地,黄酒总酚LLE的提取率均高于12%,而SPE和LLE+SPE的提取率均低于5%,与文献报道一致(提取率3.92%~12.78%)[27-29]。LLE利用2种互不相溶的溶剂中分配系数差异来分离和提取酚类化合物,由于多酚结构的复杂性和多样性,乙酸乙酯能够适应不同多酚的极性需求,从而保持较高的提取效率[30]。然而,由于黄酒本身的复杂性,SPE处理时,酚类化合物可能未能有效从填料上洗脱,导致酚类化合物的损失[31]。特别是对于含糖量高的甜黄酒,其浓缩液过于黏稠,流动性差,难以通过SPE小柱进行有效分离,因此SPE不适合本研究甜黄酒的前处理。值得注意的是,不同酒样在相同前处理方法下的总酚提取率没有显著差异(P>0.05),这可能是因为不同甜型黄酒中总酚含量本身没有显著差异,经过相同前处理后,提取率也表现出相似性。总黄酮的提取率低于总酚,LLE的总黄酮提取率大约只有总酚的一半,而SPE和LLE+SPE虽能保持总酚和总黄酮的提取率相近,但与LLE相比,其提取率偏低,无法有效提取更多的酚类化合物。这是由于黄酮类化合物在乙酸乙酯中的分配系数较低[32],导致提取效率相对较低。与LLE相比,SPE的提取效率减半,表明SPE不适合本实验中总酚和总黄酮的分离。综上所述,选择LLE进行后续分析。
2.3 不同甜型黄酒酚类化合物定性分析
采用LLE结合UPLC-Q-TOF-MS/MS对不同甜型黄酒中酚类化合物组成进行系统分析,质谱扫描在正/负离子2种模式下进行,以确保能够全面捕捉到各种酚类化合物的特征。在正离子模式下,大部分酚类化合物的分子离子峰通过捕获质子(H+)形成,少数化合物表现为在捕获H+后失去1个水分子(H2O),干黄酒、半干黄酒、半甜黄酒和甜黄酒分别鉴定出66、89、72、127个酚类化合物;在负离子模式下,大部分酚类化合物的分子离子峰表现为失去1个质子(H+),而少数化合物则通过捕获+HCOO形成分子离子峰,干黄酒、半干黄酒、半甜黄酒和甜黄酒分别鉴定出82、101、90、57个酚类化合物。这些发现揭示了不同甜型黄酒中酚类化合物的多样性和复杂性。不同甜型黄酒酚类化合物定性分析结果如图1所示。
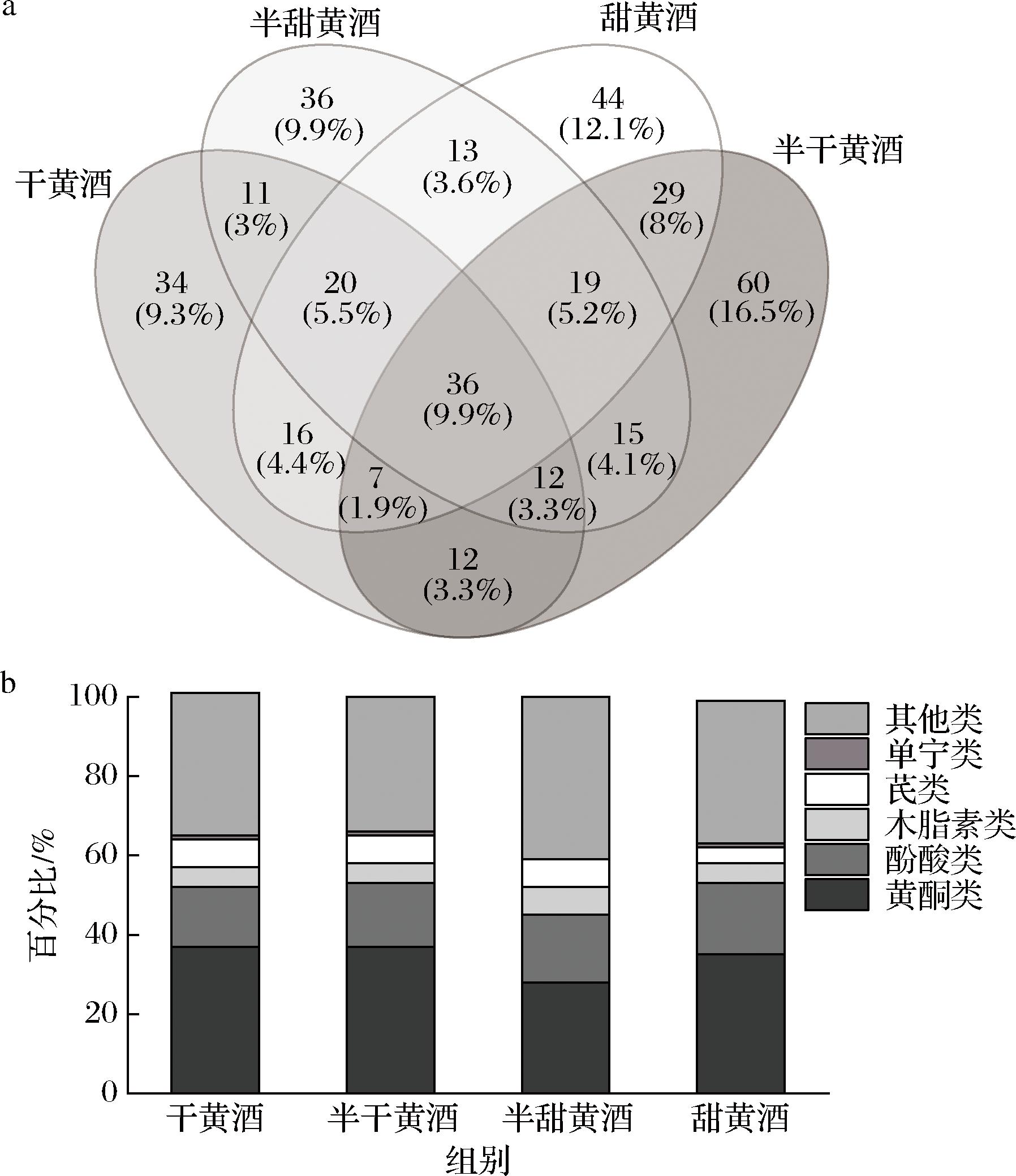
a-韦恩图分析;b-类型分布
图1 不同甜型黄酒中酚类化合物个数的韦恩图分析及类型分布
Fig.1 Venn diagram analysis and type distribution of phenolic compounds in Huangjiu with different sugar contents
4种不同甜型黄酒中共鉴定出364个酚类化合物,包括152个黄酮类、57个酚酸类、24个芪类、16个木脂素类、3个单宁类以及112个其他类型的化合物。干黄酒、半干黄酒、半甜黄酒和甜黄酒中分别鉴定到148、190、162、184个酚类化合物。其中,超过133个酚类化合物是首次在黄酒中被发现[2,16-19]。对比不同甜型黄酒中鉴定到的酚类化合物组成发现,36个酚类化合物是4种黄酒中共有的(图1-a),包括6-姜酚、高香草酸、姜黄素、邻香豆酸、香草酸、柚皮素、阿魏酸、姜酮等,说明不同甜型黄酒在酚类化合物组成上存在一定共性。此外,每种黄酒也有其独特的酚类化合物组成:甜黄酒、半甜黄酒、半干黄酒和干黄酒则分别含有44、36、60、34个特有的酚类化合物,这些差异反映了不同甜型黄酒在酚类化合物种类上的特异性。不同甜型黄酒中酚类化合物基于基本化学结构和碳骨架不同归纳为六大类:黄酮类、酚酸类、木脂素类、芪类、单宁类和其他类(图1-b)。黄酮类和酚酸类均是4种黄酒中种类最丰富的酚类化合物,二者合计占总数量的一半,木质素类、芪类和单宁类化合物数量在4种黄酒中所占比例相对较小。此外,黄酒还含有其他酚类化合物,占比大约30%,主要包括简单酚类(如苯酚)、香豆素类等。这些发现揭示了UPLC-Q-TOF-MS/MS技术不仅能够鉴定出已知的酚类化合物,还能够发现新的化合物,极大地扩展了人们对黄酒中酚类化合物多样性的认识。
2.4 不同甜型黄酒酚类化合物定量分析
在UPLC-Q-TOF-MS/MS定性和半定量的基础上,针对高丰度且常见的25个酚类化合物,进一步开发UPLC-QQQ-MS/MS定量方法,并对方法的定量限、检测限、加标回收率等进行系统评估,确保方法学的准确性和可靠性后采用外标法进行准确定量。
2.4.1 方法的性能指标
优化25种目标酚类化合物的锥孔电压、碰撞能量等参数,使目标酚类化合物的母离子和子离子的信号强度达到最佳,建立优化后的MRM参数(表3)。每个目标酚类化合物均设置2对母离子-子离子对进行监测,选用响应强度较高、稳定性较强的母离子-子离子对离子色谱图峰面积用于目标酚类化合物定量分析,另一对母离子-子离子对用于辅助定性。
表3 目标化合物的最佳MRM参数
Table 3 Optimal MRM parameters for the target compounds
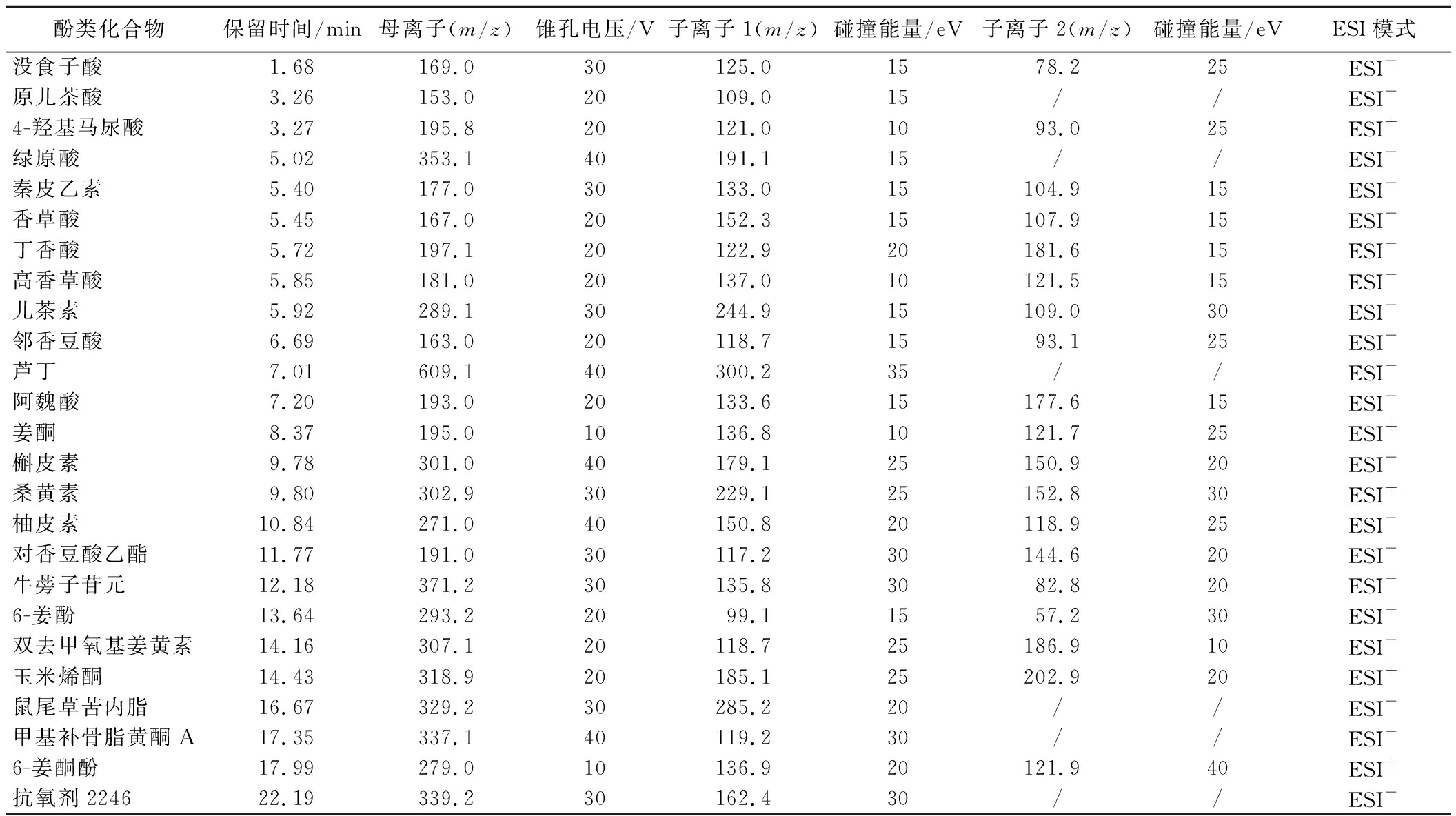
酚类化合物保留时间/min母离子(m/z)锥孔电压/V子离子1(m/z)碰撞能量/eV子离子2(m/z)碰撞能量/eVESI模式没食子酸1.68169.030125.01578.225ESI-原儿茶酸3.26153.020109.015//ESI-4-羟基马尿酸3.27195.820121.01093.025ESI+绿原酸5.02353.140191.115//ESI-秦皮乙素5.40177.030133.015104.915ESI-香草酸5.45167.020152.315107.915ESI-丁香酸5.72197.120122.920181.615ESI-高香草酸5.85181.020137.010121.515ESI-儿茶素5.92289.130244.915109.030ESI-邻香豆酸6.69163.020118.71593.125ESI-芦丁7.01609.140300.235//ESI-阿魏酸7.20193.020133.615177.615ESI-姜酮8.37195.010136.810121.725ESI+槲皮素9.78301.040179.125150.920ESI-桑黄素9.80302.930229.125152.830ESI+柚皮素10.84271.040150.820118.925ESI-对香豆酸乙酯11.77191.030117.230144.620ESI-牛蒡子苷元12.18371.230135.83082.820ESI-6-姜酚13.64293.22099.11557.230ESI-双去甲氧基姜黄素14.16307.120118.725186.910ESI-玉米烯酮14.43318.920185.125202.920ESI+鼠尾草苦内脂16.67329.230285.220//ESI-甲基补骨脂黄酮A17.35337.140119.230//ESI-6-姜酮酚17.99279.010136.920121.940ESI+抗氧剂224622.19339.230162.430//ESI-
注:母离子-子离子1为定量离子对,母离子-子离子2为辅助定性离子对。
25种酚类化合物分别在正、负离子模式下的总离子色谱图如图2所示。结果表明根据上述质谱条件,25种酚类化合物均可在25 min内出峰,峰型尖锐,且分离效果较好。
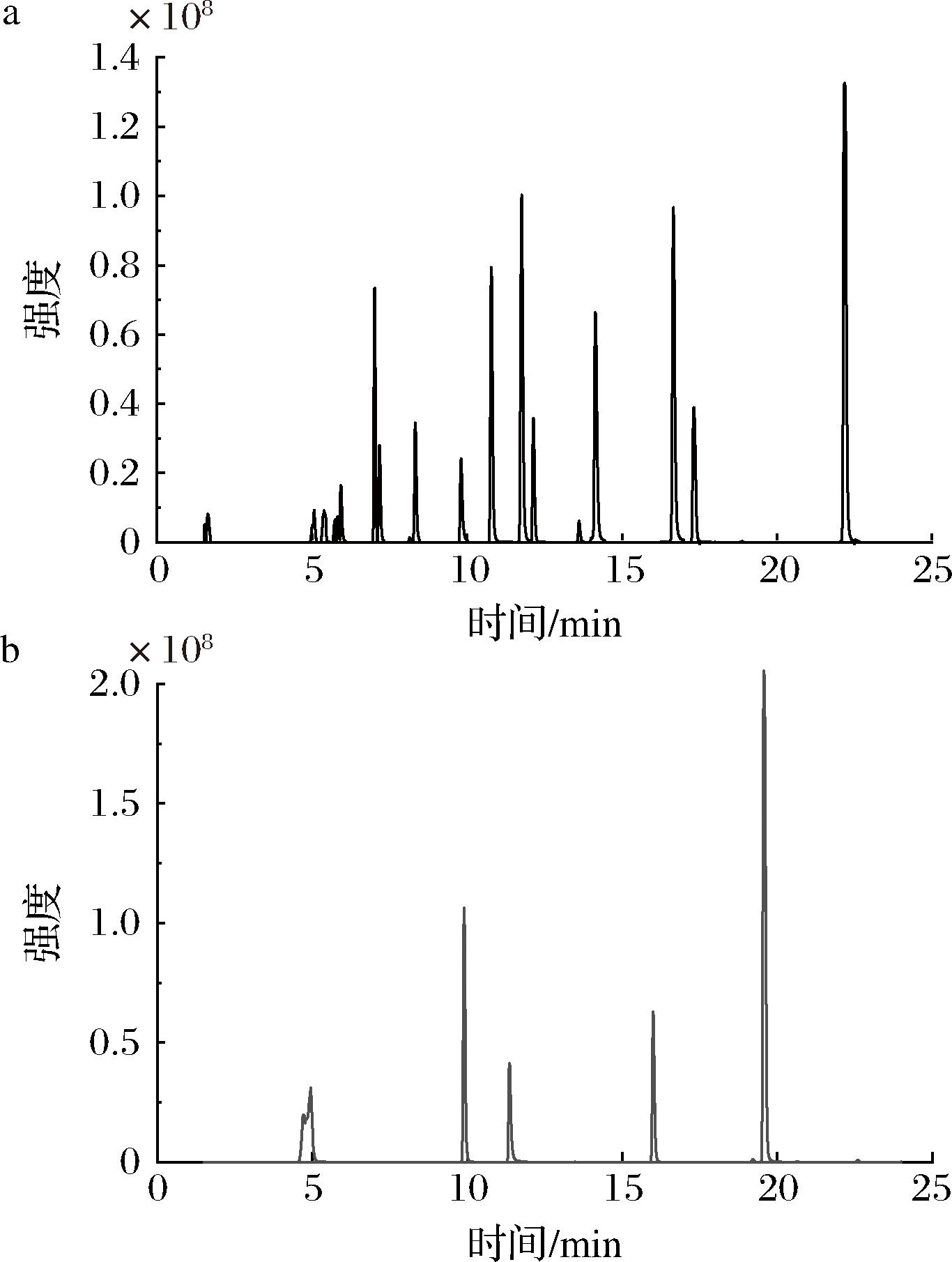
a-ESI-(20种);b-ESI+(5种)
图2 25种酚类化合物标准品的总离子流图
Fig.2 Total ion chromatograms of 25 phenolic compound standards
采用优化后的MRM条件(表3),通过线性范围、检测限、定量限、精密度、回收率进行方法学验证,结果如表4所示。
表4 UPLC-QQQ-MS/MS方法学验证
Table 4 Methodology validation of UPLC-QQQ-MS/MS

酚类化合物相关系数(R2)线性范围/(μg/mL)检测限/(μg/L)定量限/(μg/L)回收率/%精密度/%柚皮素0.999 50.010~1.0000.1200.23075.8%1.5%牛蒡子苷元0.999 00.010~1.0000.1100.36088.3%0.5%6-姜酚0.999 40.100~10.0016.0023.0072.2%1.2%甲基补骨脂黄酮A0.999 50.010~1.0000.0250.08398.4%1.8%阿魏酸0.999 10.100~2.5000.2300.77070.3%1.1%对香豆酸乙酯0.999 20.010~5.0000.0370.15090.1%3.5%双去甲氧基姜黄素0.999 70.010~1.0000.0770.26089.1%2.6%鼠尾草苦内脂0.999 50.010~0.5000.0300.12094.0%5.5%秦皮乙素0.999 10.025~0.50015.0026.0078.6%0.7%高香草酸0.999 50.100~1.00013.0039.0084.7%4.2%邻香豆酸0.998 90.100~10.003.7007.70073.5%1.1%抗氧剂22460.999 50.001~0.0500.0090.01871.6%1.7%没食子酸0.998 90.100~2.5002.6008.00070.8%4.3%香草酸0.999 60.100~25.000.9304.80075.2%1.6%儿茶素0.999 50.100~10.000.5202.80070.8%3.6%原儿茶酸0.999 50.100~10.000.7002.30076.9%1.5%丁香酸0.999 00.100~5.0006.90016.0074.0%1.3%芦丁0.999 30.005~1.0000.1000.34080.6%2.1%槲皮素0.999 50.005~2.5000.3302.700104.9%1.7%绿原酸0.999 10.100~5.00012.0020.0088.0%5.1%4-羟基马尿酸0.999 40.005~2.5008.50026.0089.1%2.1%姜酮0.999 80.005~1.0000.3703.10070.6%0.4%桑黄素0.999 10.005~0.2503.2005.200100.2%3.4%玉米烯酮0.999 80.005~0.5000.5204.40097.6%0.6%6-姜酮酚0.999 80.005~0.5000.2300.78076.7%4.6%
由表4可知,25种酚类化合物的相关系数均不低于0.999 0,表明在相应的线性范围内线性关系良好。检测限为0.009~16.000 μg/L,定量限为0.018~39.000 μg/L,可满足黄酒中低丰度酚类化合物的检测需求。通过相对标准偏差(relative standard deviation,RSD)评价方法的重复性,结果为0.4%~5.5%,表明该方法具有良好的重复性。加标回收率为70.3%~104.9%,相对标准偏差小于5.5%,该定量分析方法具有良好的精密度和准确度。对比之前文献[16-17],此方法灵敏度更强,线性范围更广,并降低了酚类化合物的检测限和定量限,能够精准地定量黄酒中的酚类化合物,为黄酒的品质控制研究提供可靠的数据支持。
2.4.2 酚类化合物定量检测
采用优化后的UPLC-QQQ-MS/MS结合外标法建立标准曲线对4种不同甜型黄酒中酚类化合物进行准确定量,结果如表5所示。
表5 四种不同甜型黄酒酚类化合物含量 单位:mg/L
Table 5 Content of phenolic compounds in four Huangjiu with different sugar contents

酚类化合物干黄酒半干黄酒半甜黄酒甜黄酒柚皮素1.23±0.02a1.05±0.03b1.02±0.00c0.47±0.03d牛蒡子苷元0.53±0.00c1.17±0.02a0.86±0.00b0.11±0.00d6-姜酚1.49±0.00b1.08±0.03c1.49±0.01b2.13±0.19a甲基补骨脂黄酮A0.54±0.00b0.57±0.01a0.05±0.00c0.04±0.00c阿魏酸0.68±0.26d18.14±3.79a14.65±0.76b9.66±0.78c对香豆酸乙酯1.88±0.35b2.60±1.46ab1.83±0.05b3.41±0.25a双去甲氧基姜黄素0.11±0.00b0.63±0.00a0.11±0.00b0.11±0.00b鼠尾草内脂0.04±0.00c0.54±0.00b0.90±0.00a0.04±0.00c秦皮乙素0.55±0.03b0.52±0.11b1.26±0.07a0.33±0.04c高香草酸1.98±0.36a0.96±0.40b0.92±0.13b0.38±0.09c邻香豆酸1.64±0.34b4.52±2.39a2.63±0.11b5.87±0.46a抗氧剂0.88±0.03a0.90±0.04a0.88±0.02a0.87±0.03a没食子酸0.53±0.02a0.51±0.02a0.55±0.02a0.49±0.04a香草酸18.61±2.28b22.37±2.50a14.77±1.31c15.95±0.98c儿茶素6.70±0.88c3.00±0.33d15.73±0.92a8.10±1.15b原儿茶酸0.78±0.25c2.47±1.92ab1.59±0.33bc3.22±0.37a丁香酸1.39±0.11d4.15±1.16b1.67±0.14c12.65±1.24a芦丁0.08±0.02a0.08±0.06a0.07±0.01a0.05±0.01a槲皮素1.13±0.10a0.09±0.01c0.03±0.02d0.85±0.11b绿原酸0.04±0.01c0.77±0.07a0.81±1.34a0.49±0.07b4-羟基马尿酸0.30±0.07c1.22±0.06a0.38±0.04b0.28±0.02c姜酮0.14±0.00c1.20±0.03b1.28±0.01a0.10±0.01d桑黄素1.05±0.14b3.21±0.08a0.18±0.01c0.93±0.18b玉米烯酮0.07±0.02b0.86±0.04a0.07±0.01b0.08±0.01b6-姜酮酚0.10±0.01d0.90±0.01b2.57±0.00a0.81±0.00c总计42.47±4.47c73.53±3.56a66.30±3.26b67.43±3.66b
4种不同甜型黄酒中25种酚类化合物总含量为42.47~73.53 mg/L,占总酚(表1)含量的21.1%~33.8%。香草酸在4种酒样中含量均超过14 mg/L,它不仅提升了黄酒的香气和口感[33],还在提供抗氧化活性和健康功效方面发挥重要作用。阿魏酸在半干、半甜和甜黄酒中的含量显著高于干黄酒(P<0.05),而儿茶素在干、半甜和甜黄酒中的含量显著高于半干黄酒(P<0.05)。阿魏酸源自谷物,通过发酵过程释放到黄酒中,不仅增加了黄酒的苦味,还可能与其他香气成分相互作用,形成更加复杂的风味轮廓,并具有抗氧化、抗炎、降低血压和血管强化等多种活性[34]。儿茶素在黄酒中的作用不仅限于其含量,还通过发酵过程中的化学反应生成其他风味化合物,如表儿茶素和没食子酸儿茶素等,这些化合物丰富了黄酒的风味层次,并改善了其口感和色泽[35]。高香草酸在干黄酒中含量最高,它是一种具有神经保护潜力的化合物,对增强黄酒的香气和口感起到关键作用[36]。桑黄素在半干黄酒中含量丰富,具有抗菌、抗病毒和抗肿瘤活性[37]。6-姜酮酚在半甜黄酒中含量最高,具有抗炎症作用[38]。丁香酸是甜黄酒中含量最高的酚类化合物,能够中和体内自由基,减缓细胞老化,降低慢性病风险,并在防治与代谢综合征相关的疾病方面被广泛关注[39]。此外,柚皮素、牛蒡子苷元、槲皮素和姜酮化合物在4种不同甜型黄酒中的含量差异显著(P<0.05)。甲基补骨脂黄酮A、鼠尾草苦内脂、绿原酸、抗氧剂、没食子酸和芦丁在4种不同甜型黄酒中的含量较低,这些化合物的存在和含量差异共同塑造了黄酒独特的风味和健康益处。
2.5 体外抗氧化活性分析
采用LLE对不同甜型黄酒酚类化合物提取液浓度归一化[均基于其总酚含量(mg/L)],通过测定自由基清除率和总还原能力评估不同甜型黄酒酚类化合物的体外抗氧化能力,结果如图3所示。
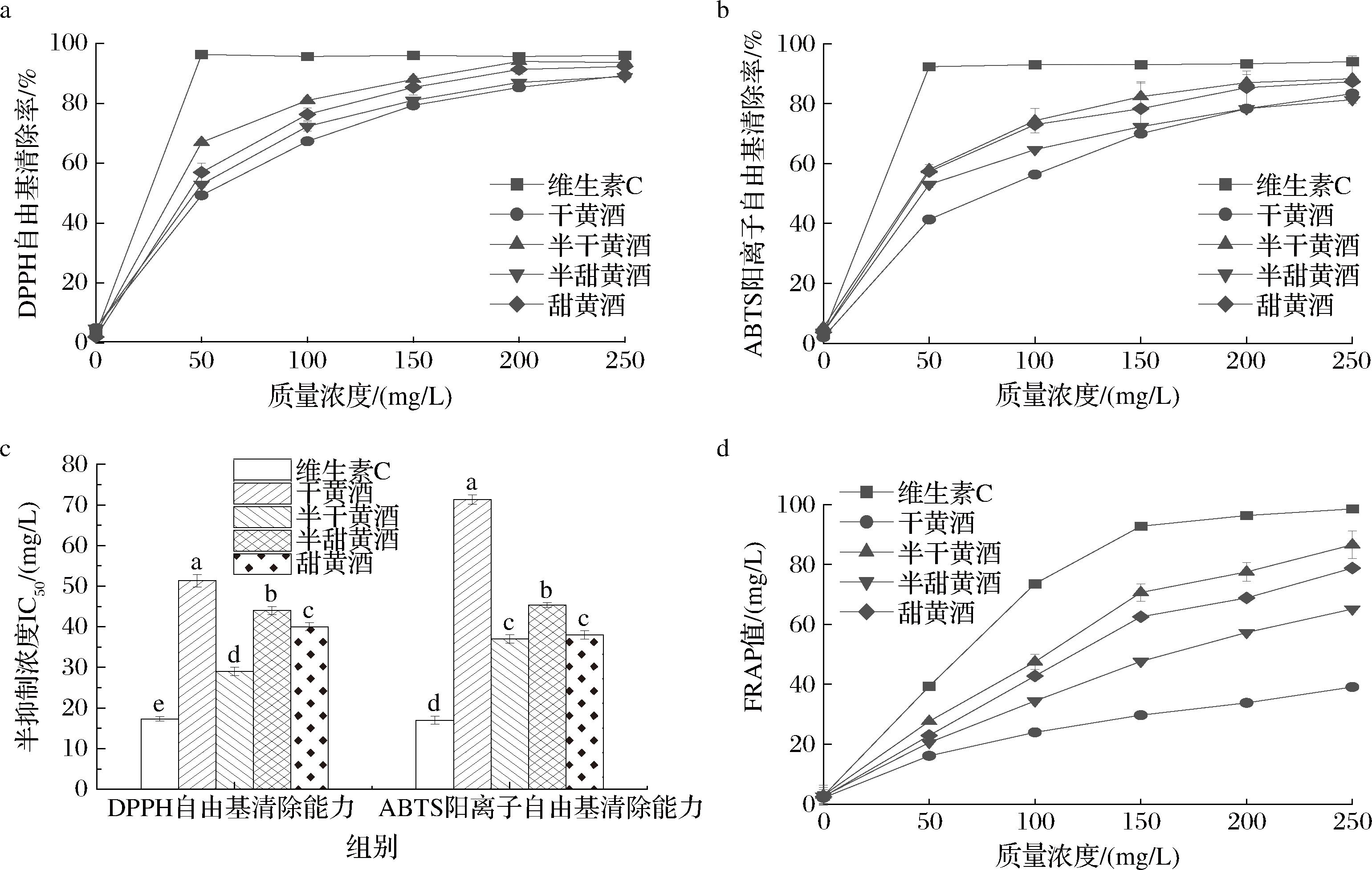
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-IC50;d-总还原能力
图3 不同甜型黄酒酚类化合物体外抗氧化活性
Fig.3 In vitro antioxidant activity of phenolic compounds in Huangjiu with different sugar contents
4种黄酒酚类化合物的DPPH自由基、ABTS阳离子自由基清除能力以及总还原能力均随浓度的增加而显著增强(P<0.05),说明4种不同甜型黄酒中的酚类化合物均具有抗氧化作用且有剂量依赖性,与LIN等[40]研究结果相吻合。
如图3-a和图3-c所示,不同甜型黄酒均显示出对DPPH自由基的清除能力,其IC50为29.00~51.33 mg/L。IC50越低,表示抗氧化能力越强。具体来说,半干黄酒中的酚类化合物在清除DPPH自由基方面表现最为出色,而干黄酒则相对较弱。此外,半甜黄酒和甜黄酒在清除DPPH自由基的能力上没有显著差异(P>0.05)。图3中ABTS与DPPH法抗氧化清除率结果相一致,均表现为半干黄酒在清除自由基方面最佳,而干黄酒的表现则相对较低,半甜黄酒和甜黄酒则处于中等水平。图3-d进一步揭示了总还原能力随酚类化合物浓度增加而变化的趋势。当酚类化合物质量浓度达到250 mg/L时,维生素C的FRAP值最高,为98.55 mg/L。在4种黄酒中,半干黄酒的FRAP值最高,为85.83 mg/L,其次是甜黄酒(78.90 mg/L)、半甜黄酒(65.10 mg/L),而干黄酒的FRAP值最低,为39.01 mg/L。综合分析,除阳性对照维生素C外,半干黄酒在抗氧化活性上的表现最为突出,而干黄酒的抗氧化活性相对较弱,半甜黄酒和甜黄酒则处于中等水平。这些发现说明不同甜型黄酒在总酚含量几乎一致的情况下,是酚类化合物不同的组成导致了不同的抗氧化能力。
3 结论
本研究旨在探究4种不同甜型黄酒中酚类化合物的组成、含量及其抗氧化能力。研究发现,LLE技术为最佳的预处理方法,能够有效地从黄酒中分离出酚类化合物,其中半干黄酒中的酚类物质和黄酮的提取率较高。鉴于黄酒中酚类化合物的多样性,采用UPLC-Q-TOF-MS/MS结合正、负离子2种扫描模式,识别出更多的化合物。最终,从4种黄酒中共鉴定出364个化合物,其中超过133个化合物在黄酒中首次被发现,4种黄酒中共检测到36个共有的酚类化合物。此外,建立了一种高效、精确的UPLC-QQQ-MS/MS分析方法,准确定量了4种黄酒中25个高丰度且常见的酚类化合物。在不同甜型黄酒的总酚含量几乎一致的情况下,酚类化合物不同的组成表现出不同的抗氧化能力,其中半干黄酒表现出较强的抗氧化能力。这些新发现为深入探究酚类化合物如何影响黄酒独特的风味、色泽及其抗氧化等品质属性提供了数据支撑,后续可进一步拓展研究范围,以更全面地理解黄酒中的酚类化合物及其对黄酒品质和健康功效的影响。
[1] WANG X Y, TIAN R G, YANG H Y, et al.Effect of baking technique for rice wine production and the characteristics of baked rice wine [J].Journal of the Science of Food and Agriculture, 2022, 102(4):1498-1507.
[2] PENG L, AI-LATI A, JI Z W, et al.Polyphenols extracted from Huangjiu have anti-inflammatory activity in lipopolysaccharide stimulated RAW264.7 cells[J].RSC Advances, 2019, 9(10):5295-5301.
[3] 刘晓艳, 曹甜, 傅筱鸥, 等.广东客家黄酒体外抗氧化能力的初步评价 [J].中国酿造, 2019, 38(1):154-157.LIU X Y, CAO T, FU X O, et al.Preliminary evaluation of in vitro antioxidant capacity of Guangdong Hakka Huangjiu[J].China Brewing, 2019, 38(1):154-157.
[4] 李爽, 陈林玉, 王东浩, 等.红小米黄酒心肌保护作用及活性成分研究[J].中草药, 2022, 53(22):7010-7018.LI S, CHEN L Y, WANG D H, et al.Cardioprotective effects and active components of red millet Huangjiu[J].Chinese Traditional and Herbal Drugs, 2022, 53(22):7010-7018.
[5] LIN H, MENG L P, SUN Z Z, et al.Yellow wine polyphenolic compound protects against doxorubicin-induced cardiotoxicity by modulating the composition and metabolic function of the gut microbiota [J].Circulation:Heart Failure, 2021, 14(10):e008220.
[6] ZHAI X Y, CHI J F, TANG W L, et al.Yellow wine polyphenolic compounds inhibit matrix metalloproteinase-2, -9 expression and improve atherosclerotic plaque in LDL-receptor-knockout mice [J].Journal of Pharmacological Sciences, 2014, 125(2):132-141.
[7] 曲敏, 陈强, 孙冰玉, 等.多酚的功能性质及与蛋白质、多糖相互作用研究进展 [J].食品工业科技, 2021, 42(11):405-413.QU M, CHEN Q, SUN B Y, et al.Advances in studies on the functional properties of polyphenols and their interactions with proteins and polysaccharides [J].Science and Technology of Food Industry, 2021, 42(11):405-413.
[8] 叶杰, 倪莉.Folin-ciocalteu法测定黄酒中总多酚含量 [J].福建轻纺, 2006, (11):66-69.YE J, NI L.Determination of total polyphenols in yellow rice wine by folin-ciocalteu method[J].The Light &Textile Industries of Fujian, 2006, (11):66-69.
[9] 杨柳青, 谷晓东, 蒋昊, 等.6款市售红谷黄酒的营养及安全性评价 [J].食品安全质量检测学报, 2023, 14(18):312-320.YANG L Q, GU X D, JIANG H, et al.Nutrition and safety evaluation of 6 kinds of commercial red millet Huangjiu[J].Journal of Food Safety and Quality Inspection, 2023, 14(18):312-320.
[10] RADEKA S, ROSSI S, ![]() E, et al.Bioactive compounds and antioxidant activity of red and white wines produced from autochthonous Croatian varieties:Effect of moderate consumption on human health [J].Foods, 2022, 11(12): 1804.
E, et al.Bioactive compounds and antioxidant activity of red and white wines produced from autochthonous Croatian varieties:Effect of moderate consumption on human health [J].Foods, 2022, 11(12): 1804.
[11] YOO Y J, SALIBA A J, PRENZLER P D, et al.Total phenolic content, antioxidant activity, and cross-cultural consumer rejection threshold in white and red wines functionally enhanced with catechin-rich extracts [J].Journal of Agricultural and Food Chemistry, 2012, 60(1):388-393.
[12] CLARKE S, BOSMAN G, DU TOIT W, et al.White wine phenolics:Current methods of analysis [J].Journal of the Science of Food and Agriculture, 2023, 103(1):7-25.
[13] VISIOLI F, PANAITE S A, TOMÉ-CARNEIRO J.Wine’s phenolic compounds and health:A pythagorean view [J].Molecules, 2020, 25(18): 4105.
[14] ![]() V, LONGO E, WINDISCH G, et al.Phenolic compounds as markers of wine quality and authenticity [J].Foods, 2020, 9(12):1785.
V, LONGO E, WINDISCH G, et al.Phenolic compounds as markers of wine quality and authenticity [J].Foods, 2020, 9(12):1785.
[15] NOLLET L M L, GUTIERREZ-URIBE J A.Phenolic Compounds in Food:Characterization and Analysis[M].Boca Raton:CRC Press, Taylor &Francis Group, 2018:430.
[16] 胡建刚, 刘镇, 周建弟, 等.液相色谱-串联质谱法同时测定黄酒中20种多酚含量 [J].食品安全质量检测学报, 2023, 14(2):217-225.HU J G, LIU Z, ZHOU J D, et al.Simultaneous determination of 20 kinds of polyphenols in Chinese rice wine by liquid chromatography-tandem mass spectrometry [J].Journal of Food Safety and Quality Inspection, 2023, 14(2):217-225.
[17] 徐秋月, 周志磊, 毛健, 等.固相萃取-高效液相法测定黄酒中多酚[J].食品与生物技术学报, 2018, 37(10):1021-1027.XU Q Y, ZHOU Z L, MAO J, et al.Application of SPE-HPLC for determination of phenolic compounds in Chinese rice wines[J].Journal of Food Science and Biotechnology, 2018, 37(10):1021-1027.
[18] WANG Y T, LIU Y Y, XIAO C X, et al.Simultaneous determination of 15 phenolic constituents of Chinese black rice wine by HPLC-MS/MS with SPE [J].Journal of Food Science, 2014, 79(6):C1100-C1105.
[19] WANG J, WANG D Q, HUANG M Q, et al.Identification of nonvolatile chemical constituents in Chinese Huangjiu using widely targeted metabolomics [J].Food Research International, 2023, 172:113226.
[20] 宓捷波, 毕玉国, 赵孔祥, 等.葡萄酒中10种多酚类物质的高效液相色谱-四极杆/静电场轨道高分辨质谱测定方法研究[J].分析测试学报, 2015, 34(11):1227-1232.MI J B, BI Y G, ZHAO K X, et al.Studies on determination of 10 polyphenols in wine by HPLC- quadrupole/electrostatic field orbitrap HRMS[J].Journal of Instrumental Analysis, 2015, 34(11):1227-1232.
[21] LIU J, WANG J, SHEN G Y, et al.Extraction methods and compositions of polyphenols in Shanxi aged vinegar[J].Journal of Chromatography A, 2023, 1705:464169.
[22] WU L F, WU W H, CAI Y Z, et al.HPLC fingerprinting-based multivariate analysis of phenolic compounds in mango leaves varieties:Correlation to their antioxidant activity and in silico α-glucoidase inhibitory ability[J].Journal of Pharmaceutical and Biomedical Analysis, 2020, 191:113616.
[23] HE J M, YIN T P, CHEN Y, et al.Phenolic compounds and antioxidant activities of edible flowers of Pyrus pashia[J].Journal of Functional Foods, 2015, 17:371-379.
[24] YEN G C, CHEN H-Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].Journal of Agricultural and Food Chemistry, 1995, 43(1):27-32.
[25] RE R, PELLEGRINI N, PROTEGGENTE A, et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine, 1999, 26(9-10):1231-1237.
[26] 郑显义, 郑傲雪.不同原料对米酒的酚类成分及抗氧化活性的影响[J].食品科技, 2020, 45(5):47-51.ZHENG X Y, ZHENG A X.Effects of different raw materials on phenolic composition and antioxidant activity of rice wine[J].Food Science and Technology, 2020, 45(5):47-51.
[27] ![]() G,
G, ![]() A, et al.The extraction process, separation, and identification of curcuminoids from turmeric Curcuma longa[J].Foods, 2023, 12(21): 4000.
A, et al.The extraction process, separation, and identification of curcuminoids from turmeric Curcuma longa[J].Foods, 2023, 12(21): 4000.
[28] LIU J, LI C C, DING G J, et al.Artificial intelligence assisted ultrasonic extraction of total flavonoids from Rosa sterilis[J].Molecules, 2021, 26(13):3835.
[29] SAHNE F, MOHAMMADI M, NAJAFPOUR G D, et al.Extraction of bioactive compound curcumin from turmeric (Curcuma longa L.) via different routes:A comparative study[J].Pakistan Journal of Biotechnology, 2016, 13(3):173-180.
[30] SILVA M, GARC A J C, OTTENS M.Polyphenol liquid-liquid extraction process development using NRTL-SAC[J].Industrial &Engineering Chemistry Research, 2018, 57(28):9210-9221.
A J C, OTTENS M.Polyphenol liquid-liquid extraction process development using NRTL-SAC[J].Industrial &Engineering Chemistry Research, 2018, 57(28):9210-9221.
[31] DOU Y N, MEI M L, KETTUNEN T, et al.Chemical fingerprinting of phenolic compounds in Finnish berry wines using Fourier transform ion cyclotron resonance mass spectrometry[J].Food Chemistry, 2022, 383:132303.
[32] HAMINIUK C W I, PLATA-OVIEDO M S V, DE MATTOS G, et al.Extraction and quantification of phenolic acids and flavonols from Eugenia pyriformis using different solvents[J].Journal of Food Science and Technology, 2014, 51(10):2862-2866.
[33] ITO T, KONNO M, SHIMURA Y, et al.Formation of guaiacol by spoilage bacteria from vanillic acid, a product of rice koji cultivation, in Japanese sake brewing[J].Journal of Agricultural and Food Chemistry, 2016, 64(22):4599-4605.
[34] HOU S W, LIANG Z H, WU Q, et al.Metagenomics reveals the differences in flavor quality of rice wines with Hongqu and Maiqu as the fermentation starters[J].Food Microbiology, 2025, 125:104647.
[35] GADKARI P V, BALARAMAN M.Catechins:Sources, extraction and encapsulation:A review[J].Food and Bioproducts Processing, 2015, 93:122-138.
[36] SELKA A, NDONGOU MOUTOMBI F J, CORMIER M, et al.Phenethyl esters and amide of ferulic acid, hydroferulic acid, homovanillic acid, and vanillic acid:Synthesis, free radicals scavenging activity, and molecular modeling as potential cholinesterases inhibitors[J].Molbank, 2020, 2020(3):M1151.
[37] 崔诗遥. 桑黄多酚类化合物的成分鉴定及其抗肿瘤作用机制研究[D].杭州:浙江大学, 2022.CUI S Y.Identification of polyphenols from Phellinus igniarius and study on its anti-tumor mechanism[D].Hangzhou:Zhejiang University, 2022.
[38] 田文妮, 宋明月, 吕慕雯, 等.6-姜酚健康效应机制及其口服增效递送体系开发的研究进展[J].食品科学, 2023, 44(3):314-322.TIAN W N, SONG M Y, LYU M W, et al.Progress in research on the health effects and mechanisms of 6-gingerol and in development of oral delivery systems for it[J].Food Science, 2023, 44(3):314-322.
[39] CHIM C, DIZON E I, HURTADA W A, et al.Total phenolic content and antioxidant activity of rice wine from waxy pigmented and non-pigmented rice varieties produced by traditional and multi-parallel fermentation[J].Food Research, 2019, 4(1):199-206.
[40] LIN Y D, YANG H X, JIANG L, et al.Analysis of the flavour components, total phenolic content and antioxidant capacity between rice wine from two raw rice and starters[J].International Journal of Food Science &Technology, 2024, 59(1):129-141.