薄荷醇是一种由薄荷的叶和茎中所提取的萜类有机化合物,具有清凉体感和薄荷香味,常被应用于日化、食品、医药以及个人卫生品的产品中[1]。研究表明,薄荷醇具有抗氧化、抗炎和抗凋亡特性,以及有效治疗糖尿病和保护心脏等功能[2]。然而,薄荷醇挥发性强,导致贮藏过程中容易风味损失,极大的限制了薄荷醇在食品工业中的应用。
基于乳液的包埋技术是抑制薄荷醇挥发的有效手段[3]。具有两亲性的乳化剂在油水界面形成物理屏障,将薄荷醇包埋在内相,限制其向外界迁移,可有效减少薄荷醇加工和贮藏过程中的挥发损失。然而,由于薄荷醇能在油中溶解,因此目前薄荷醇乳液的研究多为水包油剂型,这限制了薄荷醇在涂抹脂质、人造奶油、巧克力等油基食品中的应用。采用水相凝胶网络限制疏水活性成分向油相转移,从而制备负载活性成分的油包水乳液是实现负载疏水活性成分乳液在油基食品中应用的有效手段。贺超等[4]通过K+诱导豆腐柴果胶凝胶化增强凝胶硬度及流变特性从而提高其凝胶强度。赵霞等[5]通过制备油包水乳液对睡莲花色苷进行包埋,构建了食品体系并改善了花色苷的包封稳定性及包封效果。WU等[6]将辣椒碱负载在油包水乳液中,通过乙醇诱导内水相多糖形成凝胶,有效掩蔽了辣椒碱的刺激性,同时改善了辣椒素的胃肠递送能力。然而,目前尚未见到油包水乳液内相凝胶化包封薄荷醇的研究,该方法对抑制薄荷醇挥发的有效性也尚未被讨论。
基于此,本研究以不同添加量的果胶(0%、0.4%、0.8%、1.6%,质量分数)作为内水相凝胶剂,构建负载薄荷醇的内相凝胶油包水乳液。评价不同浓度果胶制备的乳液间宏微观结构、薄荷醇包封能力和乳液界面与流变学性质差异,进一步评价负载薄荷醇乳液的离心稳定性、热稳定性和贮藏稳定性,阐明内相凝胶油包水乳液对薄荷醇负载性能的改善作用,为薄荷醇在油基食品中的应用提供理论技术和数据支撑。
1 材料与方法
1.1 材料
薄荷醇(≥99%),安徽爱迪香料有限公司;果胶(半乳糖醛酸含量≥74.0%)、聚甘油聚蓖麻油酸酯(polyglycerol polyricinoleate,PGPR),上海麦克莱恩生化科技有限公司;葵花籽油,长寿花食品股份有限公司;尼罗红、异硫氰酸荧光素酯(fluorescein isothiocyanate, FITC),西格玛奥德里奇(上海)贸易有限公司;2-苯乙基乙酸酯、无水乙醇等试剂均为分析级,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Olympus FV10i激光扫描共聚焦显微镜、Leica Microsystems CMS GmbH Emst-Leitz-Str光学显微镜,日本Olympus公司;MCR302流变仪,德国Anton Paar公司;LUMiSizer稳定分析仪,德国LUM GmbH有限公司;高速剪切分散机,德国IKA公司;界面扩张流变测量仪,德国德飞仪器有限公司;5977B GC/MSD气质联用仪器,美国安捷伦科技有限公司;高速冷冻离心机、漩涡振荡混合仪、电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 乳液的制备
将占总质量3%的PGPR加入葵花籽油中,搅拌均匀制得油相。将2 g薄荷醇溶于8 mL无水乙醇后,加入到30 g果胶溶液中搅拌均匀,制得水相。最后,按水油质量比4∶6将水相加入到油相中,在分散机12 000 r/min的条件下分散2 min,制得乳液。考虑到过高浓度果胶溶液的高黏度和难溶解因素,因此选定果胶的添加量为总质量的0%~1.6%。
1.3.2 乳液微观
使用高清相机记录乳液的外观形态。
1.3.3 微观结构观察与粒径分析
使用光学显微镜观察乳液的微观结构。基于显微图像,随机选择图片上的300个液滴,利用ImageJ软件计算样品的液滴大小。
使用共聚焦激光扫描显微镜观察薄荷醇乳液的微观结构,使用分别制备0.01 g/mL的尼罗红丙醇溶液和0.01 g/mL FITC水溶液(发射波长分别为488 nm、633 nm),使用尼罗红丙醇溶液按照1∶50的比例对油相染色,使用FITC水溶液按照1∶50的比例对水相进行染色,按照1.3.1节中的方法制备乳液。共聚焦显微镜激发波长为561 nm,发射波长为569~691 nm对图像进行搜集。
1.3.4 包封率的测定
取40 mL薄荷醇乳液,加入10 mL无水乙醇搅拌10 min使其均匀混合,将混合液超声处理30 min,通过冷冻离心机以7 000 r/min的转速离心10 min取上清液,即提取乳液中的全部薄荷醇。取40 mL薄荷醇乳液,通过超高速离心机以7 000 r/min的转速离心10 min取上清液,即提取乳液中未包封的薄荷醇。
参考胡梓曼[7]的方法略作修改,以2-苯乙基乙酸酯作为内标物,通过GC对薄荷醇定量。气相色谱的系统配置火焰电离检测器和熔融石英毛细管柱。气相色谱设置的参数如下:1 μL上清液或标准品,氮气作为载气,流速设定为1 mL/min,分流比为15∶1,进样口温度设置为220 ℃,检测器温度为150 ℃,升温程序为80 ℃恒温1 min后,以30 ℃/min的速度上升到250 ℃,最后恒温2 min。结合标准曲线计算薄荷醇含量。乳液中的薄荷醇包封率(encapsulation efficiency, EE)计算如公式(1)所示:
(1)
式中:W1,乳液中添加的薄荷醇含量, mg;W2,乳液中提取到的全部薄荷醇含量, mg;W3,乳液中未包封薄荷醇含量, mg。
1.3.5 流变特性的测定
使用旋转流变仪测量乳液从剪切速率0.1 s-1增加到100 s-1时的表观黏度变化[8]。将样品均匀添加至流变仪上,等待5 min以达到设定温度。线性黏弹性区通过动态应变扫描得到确认。在0.1~100 rad/s的角频率范围内以 0.1% 的固定剪切应变进行频率扫描测试乳液的弹性模量(G′)和损耗模量(G″)。
1.3.6 界面张力的测试
界面张力测试方法参考FENG等[9]的方法略作修改,用25 mL油相计算校正补偿,然后向样品池中加入不同质量分数(0%、0.4%、0.8%、1.6%)的25 mL 果胶乙醇溶液。此外,设置降速20 mm/min、加速20 mm/min、润湿深度12 mm、测量时间30 min、样品间隔1 s、稳定4 s、积分4 s、检测范围2 mN/m、起始位置5 mm、复位速度40 mm/min、温度25 ℃。
1.3.7 离心稳定性
参考ZHU等[10]的方法采用稳定分析仪测量薄荷醇乳液在4 000 r/min离心60 min的透光率变化曲线,评价薄荷醇乳液的离心稳定性。
1.3.8 热稳定性
参考ZHU等[11]的方法将薄荷醇乳液样品在60 ℃下加热20 min,通过外观、微观结构和粒径变化以及1.3.4中的方法确定薄荷醇含量变化研究其热稳定性。
1.3.9 贮藏稳定性
参考YUE等[12]将不同果胶浓度的薄荷醇乳液在25 ℃下贮存,分别在0、7、14、21、28 d等时刻测定贮存后样品中的薄荷醇含量。乳液的薄荷醇保留率计算如公式(2)所示。
保留率![]()
(2)
式中:W贮存,测试时刻乳液的薄荷醇含量,mg;W初始,第0天乳液的薄荷醇含量,mg。
1.4 数据分析
所有实验在25 ℃下至少独立进行一式三份。获得的数据以“平均值±标准差”表示。使用SPSS软件(版本25.0)和Origin 2022进行单因素方差分析(ANOVA,P<0.05)和Duncan多范围检验。P<0.05 的值被认为具有统计学意义。
2 结果与分析
2.1 乳液形态与结构表征
不同添加量(0%、0.4%、0.8%、1.6%)的果胶溶液对乳液外观与微观形态的影响如图1-a所示,所制备乳液外观均一且无明显差别,共聚焦图像中绿色代表油相,红色代表水相,水滴分散在连续的油相中,表明所制备的乳液为油包水乳液。未添加果胶的空白对照组乳液形成的液滴较大且不均匀,随着果胶添加量的增加,乳液大液滴数量逐渐减小,呈现出更加均匀的趋势。
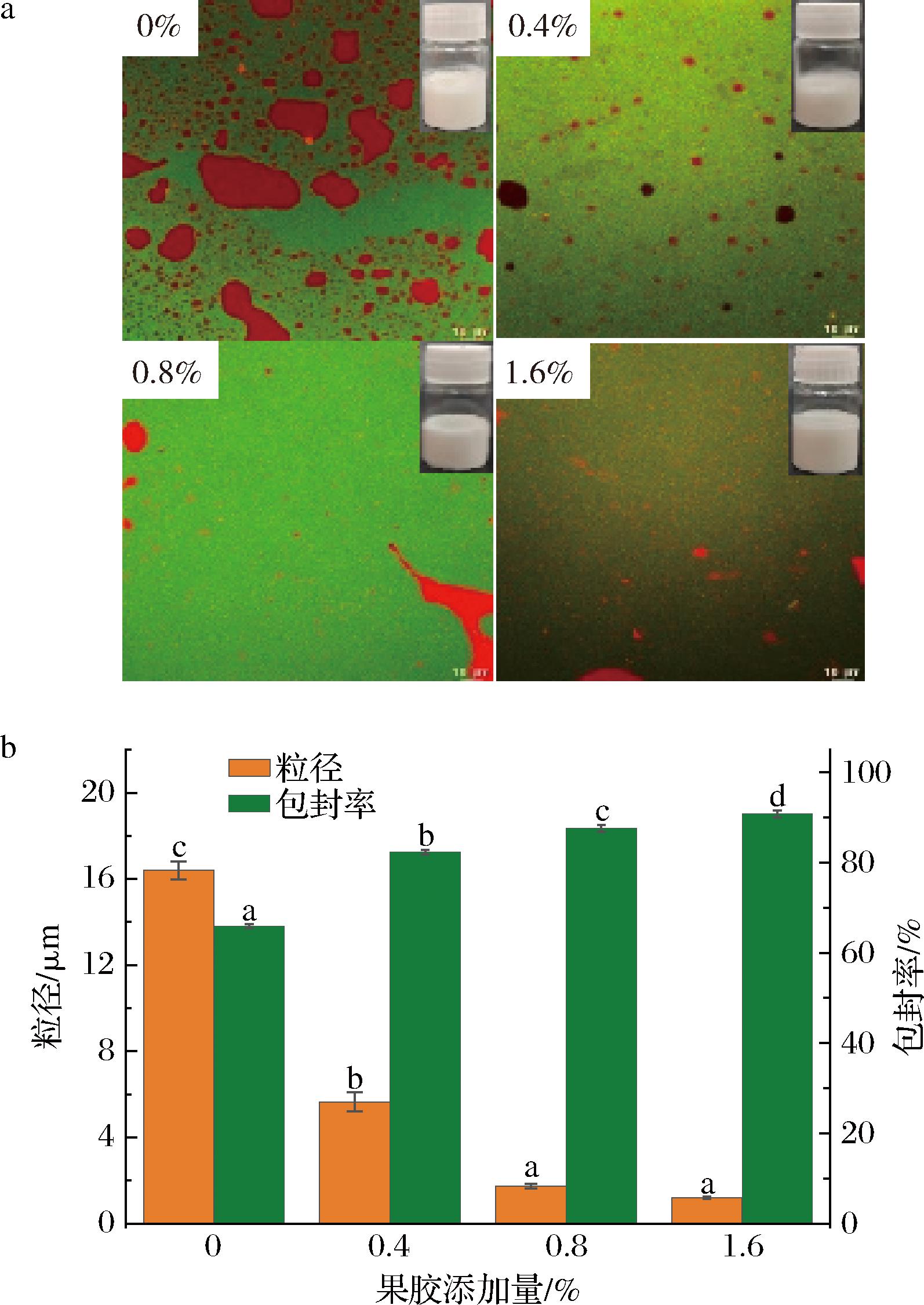
a-外观与微观形态;b-粒径与包封率
图1 不同果胶添加量薄荷醇乳液的外观与微观形态、粒径与包封率
Fig.1 Appearance and microscopic morphology, particle size and encapsulation efficiency of menthol emulsion with different pectin concentrations
注:不同小写字母代表显著性差异水平(P<0.05)(下同)。
乳液粒径与包封率结果如图1-b所示,随着果胶添加量的增加,粒径从16.4 μm递减至1.19 μm,与激光共聚焦图像结果一致。YANG等[13]监测果胶与陈皮素制备的乳液粒径也得到了类似结论。薄荷醇包封率数据显示,随着果胶添加量的增加,乳液对薄荷醇的包封率从65.93%递增至90.84%。HE等[14]推测乳液中的乙醇与果胶形成乙醇-果胶凝胶网络改变了乳液的流变特性,提高了乳液黏度导致乳液的包封效率提高。
2.2 界面张力分析
果胶添加浓度对油水界面张力的影响如图2所示。在所测试时间范围内,所有样品的界面张力逐渐降低直至达到平衡值,这代表PGPR逐渐吸附在油水界面,从而促进了W/O乳液的产生[15]。随着果胶浓度的增加,薄荷醇乳液的界面张力持续下降。LEROUX等[16]通过实验证明柑橘果胶和甜菜果胶能够降低油相和水相之间的界面张力,并且可以有效地制备乳液。在乳液中添加PGPR对于界面张力的降低有所帮助,从而提高乳液的稳定性。当与PGPR同时添加时,果胶被证明会进一步降低界面张力;由于PGPR的存在,会导致果胶形成弱弹性界面膜[17]。同时,界面张力的降低使得PGPR在水滴表面的吸附能力增强,加速液滴之间的聚集,促进了凝胶网络的形成并进一步提高了W/O乳液的稳定性。
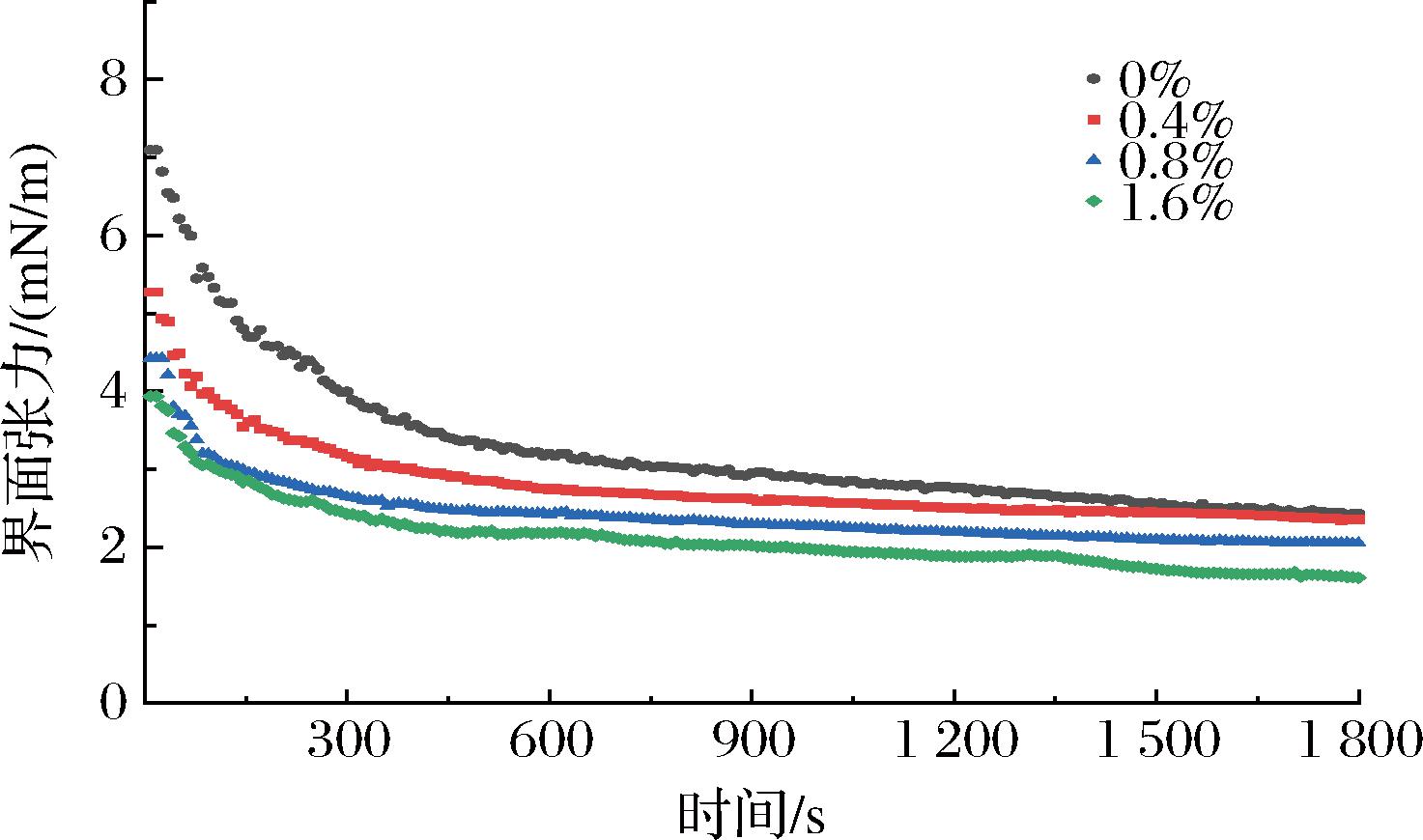
图2 不同果胶添加量的薄荷醇乳液界面张力
Fig.2 Interfacial tension of menthol emulsion with different pectin concentrations
2.3 果胶添加量对乳液流变特性的影响
不同添加量(0%、0.4%、0.8%、1.6%)的果胶溶液对薄荷醇乳液黏度的影响如图3-a所示。所有样品乳液的表观黏度均随着剪切速率的升高而降低(0.1~100 s-1),乳液表现出了剪切稀化特性,表明薄荷醇制备的W/O乳液属于假塑性流体。随着乳液中果胶添加量的增加(0%~1.6%),样品乳液的黏度在任何剪切频率下均呈现增加的趋势。当果胶添加量达到1.6%时,乳液表观黏度最大。乳液黏度的增大可能是由于果胶能够增加内水相的黏度,从而抑制了发生聚结的趋势。DUANGKAEW等[18]认为随着果胶添加量的增加,内层聚合物网络变得更紧密,液滴变形的可能性更小,系统的流动性变差,因此黏度升高。同时,果胶与乙醇的凝胶化在一定程度上促进了乳液形成紧密结构,从而提高薄荷醇乳液的表观黏度。
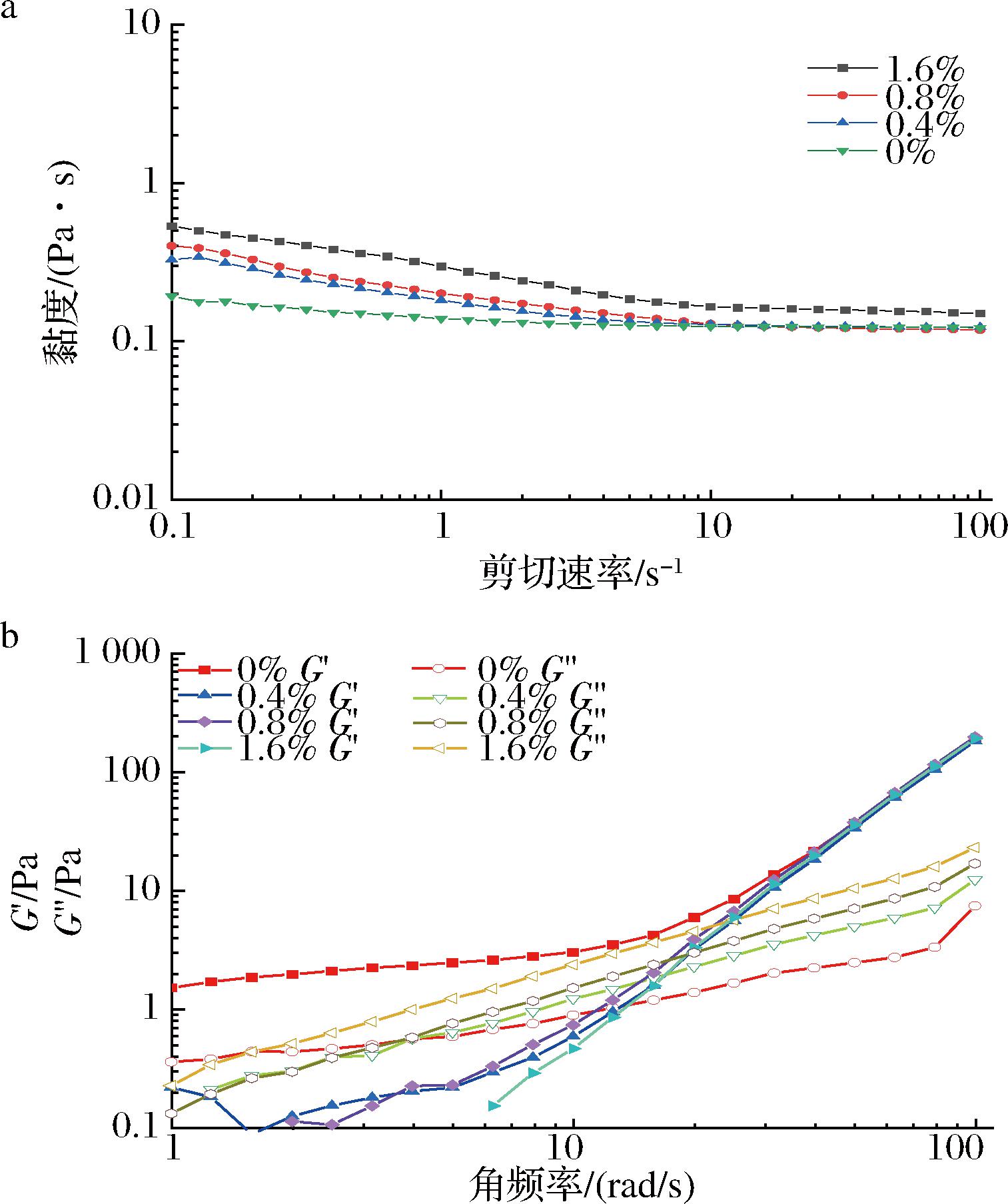
a-剪切黏度曲线;b-频率扫描曲线
图3 不同果胶质量分数薄荷醇乳液的流变特性
Fig.3 Rheological properties of menthol emulsion with different pectin concentrations
振荡频率扫描测量结果如图3-b所示,G′反映了材料抵抗弹性变形时贮存的能量,代表了样品的弹性性质;G″是指材料抵抗黏性变形时耗散的能量,反映了样品的黏性特性。当加入果胶后,乳液在较低频率下的G″值大于G′值;随着扫描频率增大,乳液在高频率下的G′值大于G″值。观察到有交叉行为,这种行为是非絮凝或弱絮凝乳液的典型行为,表明乳液表现出弹性的液体行为趋势更为明显[19]。出现这种现象的原因可能是在高频率下乳液结构重排,水相中存在的果胶与乙醇形成凝胶网络结构使得乳液弹性占据主导地位[14]。随着角频率的增加,样品乳液的G′值和G″值均呈现上升趋势,表明样品的黏弹性主要是由交联所导致[20]。
2.4 乳液的离心稳定性
如图4所示,随着离心过程的进行,未添加果胶的空白组乳液油滴呈现出向液体表面迁移的趋势,导致离心结束后有部分油相漂浮在乳液表面,溶液顶部的透射率逐渐增加。随着溶液中果胶添加量的增加,乳液表面漂浮的油相体积呈现下降的趋势;当果胶添加量上升到1.6%时,乳液离心后表面未分层。由于果胶具有良好的持水性和黏性,使得油滴在水相中的运动阻力增加从而导致速度进一步减慢[21]。果胶凝胶网络和黏度的升高限制了乳液结构被破坏;同时,果胶对乳液稳定性的作用可以通过果胶对黏度、假塑性行为和带负电的电位的积极作用来解释[22]。
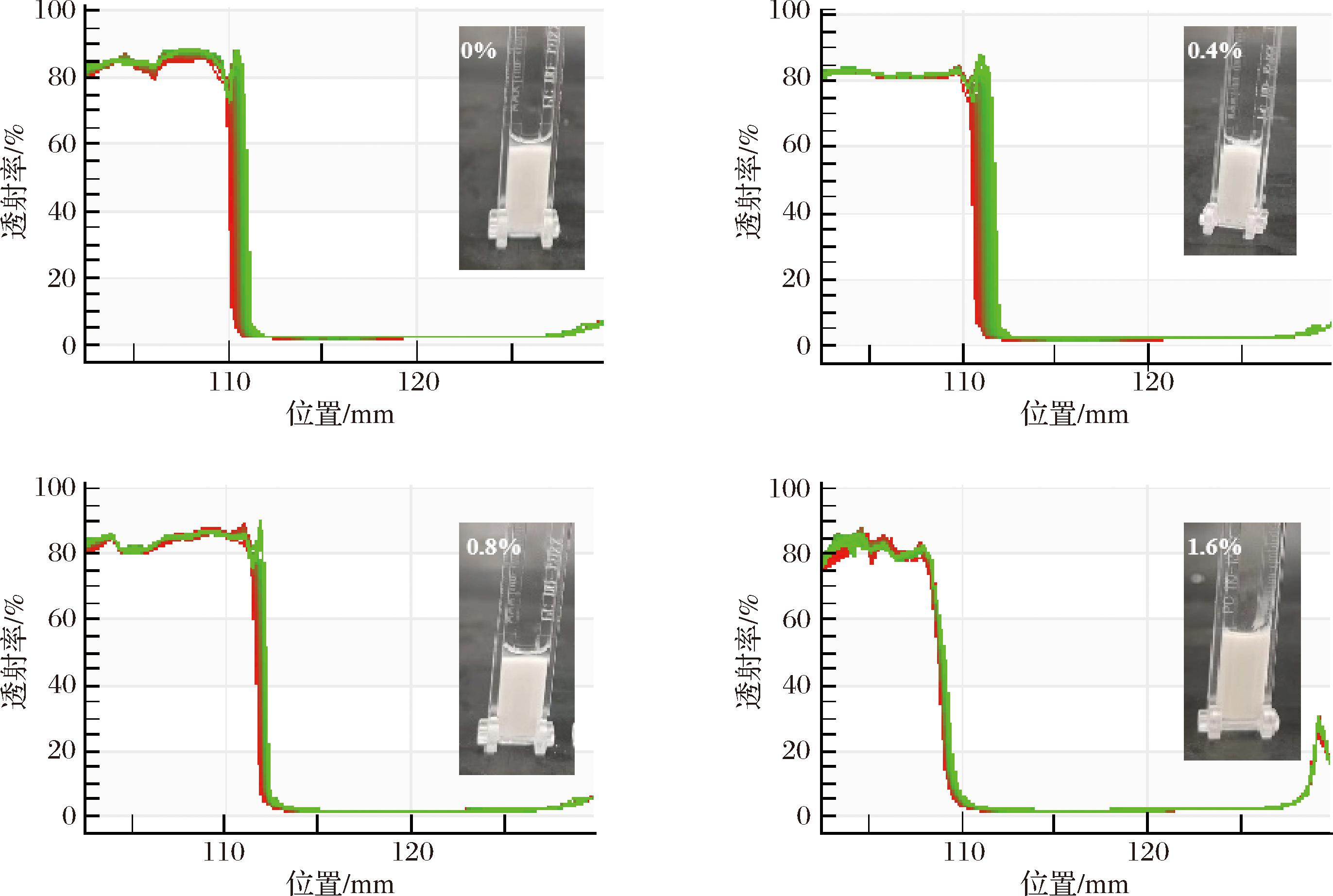
图4 不同果胶浓度的薄荷醇乳液离心稳定性
Fig.4 Centrifugation stability of menthol emulsion with different pectin concentrations
2.5 乳液的热稳定性
为评价乳液在油基食品中应用的杀菌与应用潜力,研究了乳液的热稳定性。图5-a显示了乳液热处理前后的外观与微观结构变化,未添加果胶乳液分层明显,热稳定性较差。添加了果胶后,乳液分层有所改善。当果胶添加量达到1.6%时,乳液未见明显分层。微观结构显示,热处理后的乳液形成了较大的液滴,均匀度明显下降。图5-b显示了热处理后乳液的平均粒径,添加果胶的乳液加热后平均粒径提高情况有所改善,这与微观图像相对应。对薄荷醇保留率(图5-c)分析显示,乳液的薄荷醇保留率与果胶添加量成正比,果胶网络的存在改善了薄荷醇在热处理过程中的挥发损失,一定程度上提高了薄荷醇乳液的热稳定性。FENG等[23]在研究甜菜果胶对乳液填充凝胶的热稳定性的影响时发现,随着甜菜果胶含量的增加,凝胶的热稳定性增强,与本实验结果一致。

a-微观结构与外观;b-粒径;c-保留率
图5 不同果胶质量分数对薄荷醇乳液热稳定性的影响
Fig.5 Effect of different pectin concentrations on the thermal stability of menthol emulsion
2.6 乳液的贮存稳定性
不同浓度的果胶溶液对薄荷醇乳液贮存稳定性的影响如图6-a所示。由图6-a可以看出,25 ℃下贮存28 d后空白对照组乳液分层明显;通过对微观结构的观察,空白组乳液的液滴发生聚集,产生了大而不均匀的液滴,粒径明显增大(图6-b),乳液稳定性较差。随着果胶添加量的增加,样品乳液的分层趋势下降,液滴尺寸逐渐减小,并呈现出更均匀的状态。当果胶添加量增加到1.6%时,样品贮存28 d后几乎不分层。同时,随着果胶添加量的增加,乳液的值得注意的是,与空白对照组相比,添加了果胶的实验组乳液粒径上升趋势较小。这种情况可以解释为带负电荷的多糖(果胶)的存在可以增强乳液液滴间的静电排斥力,由于相互带负电荷的乳液液滴相互排斥,延缓了乳液的聚集和絮凝[24]。果胶化学结构中乙酰基含量高可以增强果胶的疏水性,进而提高果胶乳液的乳液稳定性。另一方面,果胶中含有的羟脯氨酸的蛋白质的存在也可能是果胶诱导的乳液稳定性较好的原因。同时,随着果胶添加量的增加,乳液的薄荷醇保留率同步增加。

a-微观结构与外观;b-粒径;c-保留率
图6 不同果胶添加量对薄荷醇乳液贮存稳定性的影响
Fig.6 Effect of different pectin concentrations on the storage stability of menthol emulsion
3 结论与讨论
本研究利用乙醇诱导果胶凝胶提高油包水乳液负载薄荷醇的性能,并研究不同添加量果胶对乳液流变特性、稳定性和包封率的影响。结果表明,添加了果胶的薄荷醇乳液在较高频率下表现出以弹性为主的液体行为,并且液滴分布相对均匀、粒径较小。随着果胶浓度的增加,有利于水相凝胶化的诱导,使乳液进一步形成紧密的网络结构。网络结构的增强使得添加了果胶负载薄荷醇的乳液相较于未添加的乳液具有更好的物理稳定性、热稳定性,并且添加了果胶的薄荷醇乳液贮存后的薄荷醇保留率维持在80%以上。研究结果表明,构建以油包水类型的乳液负载薄荷醇并通过添加果胶的方式来提高乳液薄荷醇负载性能的体系,可以为薄荷醇乳液在食品中的应用提供基础理论和实验依据。
[1] 张其忠, 毛海舫, 张贵, 等.L-薄荷醇工业化生产的现状与进展[J].香料香精化妆品, 2023(3):115-120.ZHANG Q Z, MAO H F, ZHANG G, et al.Status quo and research progress for the industrial production of L-menthol[J].Flavour Fragrance Cosmetics, 2023(3):115-120.
[2] KABOUTARI M, ASLE-ROUSTA M, MAHMAZI S.Protective effect of menthol against thioacetamide-induced hepatic encephalopathy by suppressing oxidative stress and inflammation, augmenting expression of BDNF and α7-nACh receptor, and improving spatial memory[J].European Journal of Pharmacology, 2024, 981:176916.
[3] BHATTACHARYYA T, PALLA C S, DETHE D H, et al.Rheological investigation of the network structure in mixed gels of Kappa and Iota Carrageenan[J].Food Hydrocolloids, 2024, 146:109298.
[4] 贺超, 尹乐斌, 何攀, 等.K+诱导豆腐柴果胶凝胶化[J].食品与发酵工业, 2023, 49(21):153-160.HE C, YIN L B, HE P, et al.K+ induced Premna microphylla Turcz pectin gelation[J].Food and Fermentation Industries, 2023, 49(21):153-160.
[5] 赵霞, 陈彦甫, 周卫娟, 等. ‘蓝鸟’睡莲花色苷W/O皮克林乳液的制备及稳定性分析[J]. 现代食品科技, 2024, 40(6):206-213. ZHAO X, CHEN Y F, ZHOU W J, et al. Preparation and stability of anthocyanin W/O Pickering emulsion from ‘blue bird’ tropical water lily[J]. Modern Food Science and Technology, 2024, 40(6):206-213.
[6] WU X L, XU N, CHENG C, et al.Encapsulation of hydrophobic capsaicin within the aqueous phase of water-in-oil high internal phase emulsions:Controlled release, reduced irritation, and enhanced bioaccessibility[J].Food Hydrocolloids, 2022, 123:107184.
[7] 胡梓曼. 环糊精基金属有机框架封装薄荷醇及其控释特性研究[D].广州:华南理工大学, 2021.HU Z M.Preparation of cyclodextrin based metal-organic frameworks and its encapsulation of menthol and controlled release[D].Guangzhou:South China University of Technology, 2021.
[8] LIU W, GAO H X, MCCLEMENTS D J, et al.Stability, rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J].Food Hydrocolloids, 2019, 88:210-217.
[9] FENG X, DAI H J, YU Y, et al.Adjusting the interfacial property and emulsifying property of cellulose nanofibrils by ultrasonic treatment combined with gelatin addition[J].Food Hydrocolloids, 2022, 133:107905.
[10] ZHU B, YANG J J, DOU J J, et al.Comparison of the physical stability, microstructure and protein-lipid co-oxidation of O/W emulsions stabilized by l-arginine/l-lysine-modified soy protein hydrolysate[J].Food Chemistry, 2024, 447:138901.
[11] ZHU C H, ZHANG M X, YANG A J, et al.Thermal stability and in vitro digestive behavior of Pickering emulsion stabilized by high-amylose starch nanocrystals[J].International Journal of Biological Macromolecules, 2024, 280:136110.
[12] YUE M, HUANG M Y, ZHU Z S, et al.Effect of ultrasound assisted emulsification in the production of Pickering emulsion formulated with chitosan self-assembled particles:Stability, macro, and micro rheological properties[J].LWT, 2022, 154:112595.
[13] YANG X H, LIU X H, ZHAO S J, et al.Pectin from steam explosion-treated citrus peel exhibits good emulsion properties and bioavailability-promoting effect in vitro of nobiletin[J].International Journal of Biological Macromolecules, 2024, 278:134758.
[14] HE J X, WU X L, XIE Y F, et al.Capsaicin encapsulated in W/O/W double emulsions fabricated via ethanol-induced pectin gelling:Improvement of bioaccessibility and reduction of irritation[J].International Journal of Biological Macromolecules, 2023, 235:123899.
[15] ZHANG M, FAN L P, LIU Y F, et al.Effects of alkali treatment on structural and functional properties of chickpea protein isolate and its interaction with gallic acid:To improve the physicochemical stability of water-in-oil emulsions[J].Food Hydrocolloids, 2023, 140:108601.
[16] LEROUX J, LANGENDORFF V, SCHICK G, et al.Emulsion stabilizing properties of pectin[J].Food Hydrocolloids, 2003, 17(4):455-462.
[17] GÜLSEREN I, CORREDIG M.Interactions between polyglycerol polyricinoleate (PGPR) and pectins at the oil-water interface and their influence on the stability of water-in-oil emulsions[J].Food Hydrocolloids, 2014, 34:154-160.
[18] DUANGKAEW S, MAHISANUNT B, PRICHAPAN N, et al.Ethanol-in-oil emulsion (E/O) stabilized by polyglycerol polyricinoleate:A potential delivery system for ethanolic extract[J].Journal of Dispersion Science and Technology, 2018,39(2):234-240.
[19] TORRES L G, ITURBE R, SNOWDEN M J, et al.Preparation of o/w emulsions stabilized by solid particles and their characterization by oscillatory rheology[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 302(1-3):439-448.
[20] LIU C H, ZHENG Z J, SHI Y F, et al.Development of low-oil emulsion gel by solidifying oil droplets:Roles of internal beeswax concentration[J].Food Chemistry, 2021, 345:128811.
[21] JIANG Y, ZHU Y Z, LI F, et al.Antioxidative pectin from hawthorn wine pomace stabilizes and protects Pickering emulsions via forming zein-pectin gel-like shell structure[J].International Journal of Biological Macromolecules, 2020, 151:193-203.
[22] MIRHOSSEINI H, TAN C P, AGHLARA A, et al.Influence of pectin and CMC on physical stability, turbidity loss rate, cloudiness and flavor release of orange beverage emulsion during storage[J].Carbohydrate Polymers, 2008, 73(1):83-91.
[23] FENG L P, JIA X, YAN J X, et al.Mechanical, thermal stability and microstructural properties of emulsion-filled gels:Effect of sugar beet pectin/soy protein isolate ratio[J].LWT, 2021, 141:110917.
[24] GAO Y J, MAO J X, MENG Z.Tracing distribution and interface behavior of water droplets in W/O emulsions with fat crystals[J].Food Research International, 2023, 163:112215.