小麦是全球最重要的粮食作物之一,小麦及其加工制品是人类饮食中碳水化合物和蛋白质的主要来源,也是联合国粮农组织(Food and Agriculture Organization of the United Nations, FAO)认定的八大食物过敏原中占比较高的一类[1]。研究表明,小麦过敏的发病率已接近全球人口的1%,并呈上升趋势[2]。小麦过敏原包括麦醇溶蛋白(gliadin, GLI)、低分子质量麦谷蛋白和高分子质量麦谷蛋白,其中GLI不仅是占小麦蛋白40%~50%的主要贮藏蛋白质[3],也是引起小麦过敏的主要过敏原[4]。如何降低GLI的致敏性成为人们重点关注的食品安全问题。
目前降低GLI致敏性的方法有热处理、非热处理、糖基化蛋白法、酶解改性[5]和发酵作用等,其中发酵作用作为一种传统的加工方式,不仅能改变食物质地,还具有提高食物营养价值作用,利用发酵微生物降低食物中的致敏原性成为当下的研究热点[6]。老酵头是一种中西方传统的天然发酵剂,主要用于制作馒头和面包等发酵食品[7]。它通过丰富的微生物菌群(如酵母菌、乳酸菌等)赋予食品独特的风味和质地[8]。老酵头中乳酸菌被证明能够通过水解蛋白质、改变蛋白质结构构象、破坏蛋白质线性表位等机制有效降低GLI致敏性,可能是其所产生的代谢产物所致,其中乳酸菌所产的胞内酶和胞外酶起到至关重要的作用[9]。KIELISZEK等[10]发现乳酸菌代谢酶能够切断麦醇溶蛋白致敏肽段肽键,破坏其空间结构和抗原表位,使得GLI更易被人体胃肠道消化吸收,从而减少过敏风险。LESZCZY SKA等[11]研究报道,干酪乳酪杆菌 LC130、副干酪乳酪杆菌 LPC100和唾液链球菌嗜热亚种ST250菌株代谢酶产物能够显著降低GLI(包括33聚体)的免疫原性。WALTER等[12]发现,黑曲霉脯氨酰内肽酶可以降解发酵面制品中的面筋浓度,达到降低其致敏性的作用。然而,菌株的来源和所属亚种不同表现出来的蛋白水解活性也不尽相同;同时酶制剂又受温度、pH、底物和酶浓度等因素的影响,与蛋白反应产生的酶解作用程度也会不同[2]。甚至酶解反应条件不适,还会使蛋白质产生更多致敏表位,反而提高GLI的致敏性。因此,探索不同乳酸菌的胞内酶和胞外酶对GLI致敏性影响,并对其酶解工艺优化进一步探究。
SKA等[11]研究报道,干酪乳酪杆菌 LC130、副干酪乳酪杆菌 LPC100和唾液链球菌嗜热亚种ST250菌株代谢酶产物能够显著降低GLI(包括33聚体)的免疫原性。WALTER等[12]发现,黑曲霉脯氨酰内肽酶可以降解发酵面制品中的面筋浓度,达到降低其致敏性的作用。然而,菌株的来源和所属亚种不同表现出来的蛋白水解活性也不尽相同;同时酶制剂又受温度、pH、底物和酶浓度等因素的影响,与蛋白反应产生的酶解作用程度也会不同[2]。甚至酶解反应条件不适,还会使蛋白质产生更多致敏表位,反而提高GLI的致敏性。因此,探索不同乳酸菌的胞内酶和胞外酶对GLI致敏性影响,并对其酶解工艺优化进一步探究。
本研究选用前期实验室从中国不同地区老酵头中分离鉴定出有降敏作用的4株乳酸菌(发酵粘液乳杆菌:Limosilactobacillus fermentum ACX0484;短乳杆菌:Lactobacillus brevis ACX0303;弯曲广布乳杆菌:Latilactobacillus curvatus ACX0476;植物乳植杆菌:Lactiplantibacillus plantarum ACX0410),以OD450致敏性特征值和AGA-IGE抗体含量为评价指标,评价不同乳酸菌代谢的胞内酶和胞外酶对GLI致敏性的影响;结合单因素试验与响应面试验,探究降低GLI过敏效果最佳的酶解作用条件;并通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、内源荧光光谱(endogenous fluorescence spectrum,EFS)和紫外吸收光谱(ultraviolet absorption spectrum,UAS)对麦醇溶蛋白结构进行表征。以期明确乳酸菌降低GLI致敏原性的可能作用机制,为解决小麦过敏提供理论依据。
1 材料与方法
1.1 原料与试剂
发酵粘液乳杆菌(L.fermentum ACX0484),分离自河南新乡老酵头;短乳杆菌(L.brevis ACX0303), 分离自河南南阳老酵头;弯曲广布乳杆菌(L.curvatons ACX0476),分离自河南新乡老酵头;植物乳植杆菌(L.plantarum ACX0410),分离自河南洛阳老酵头。已通过16S rRNA 测序鉴定。
GLI分离提取自郑麦7698小麦粉,经HPLC分析鉴定,与标准麦醇溶蛋白高度一致。
郑麦7698小麦种子,产地河南黄淮南;麦醇溶蛋白标准品、溶菌酶、蔗糖、Tris,上海麦克林生化科技有限公司;麦醇溶蛋白致敏原性试剂盒、麦醇溶蛋白AGA-IGE抗体测定试剂盒、辣根过氧化物酶、显色剂过氧化物酶和3,3′,5,5′-四甲基联苯胺,江苏酶免实业有限公司;MRS肉汤,北京奥博星生物技术有限公司;PBS,北京索莱宝科技有限公司;NaCl,国药集团化学试剂有限公司;无水乙醇,天津富宇化学试剂有限公司;三氟乙酸、乙腈,天津四友精细化学品有限公司。
1.2 仪器与设备
MDDY/MDDZ型磨粉机,瑞士布勒集团;BioTek多功能酶标仪,美国安捷伦科技公司;JY92-IIN型超声细胞破碎机,中国宁波鑫致生物科技有限公司;TEN-SOR Ⅱ型FTIR,德国布鲁克科技有限公司;F-7000型荧光分光光度计,日本Tokyo公司;UV-1800型紫外分光光度计,尤尼柯仪器公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;FD-1B-50型真空冷冻干燥机,北京博医实验仪器有限公司;5810R型离心机,德国汉堡埃彭多夫公司;SN-MS-1型磁力搅拌器,上海尚普仪器设备有限公司;LHP-250型培养箱,中国上海洪都电子科技有限公司。
1.3 实验方法
1.3.1 GLI提取
GLI的提取参考RANI等[13]的方法并加以修改。郑麦7698是中国黄淮地区的小麦品种[14],称取清理后的郑麦7698籽粒15 kg,加入适量蒸馏水润洗至水分质量分数为15%,利用瑞士布勒磨粉机磨粉,准确称取小麦粉50 g置于烧杯中,加入磁珠和10倍体积的蒸馏水,磁力搅拌器搅拌提取30 min,9 000 r/min离心10 min,弃上清液,重复3次以除去清蛋白;然后加入10倍体积的质量分数2% NaCl溶液,振荡提取30 min,9 000 r/min离心10 min,弃上清液,重复3次以除去球蛋白;最后加入10倍体积的体积分数为70%乙醇溶液,振荡提取30 min,9 000 r/min离心15 min,收集上清液,即为GLI提取液;将其过0.45 μm滤膜,随后旋蒸、冻干备用。
1.3.2 乳酸菌胞外酶、胞内酶制备和酶活性测定
乳酸菌胞外、胞内酶制备:将4株乳酸菌以1%接种量在1 mL MRS培养基上接种,37 ℃培养20 h后,扩增至10 mL MRS中,再以2%的接种量转至500 mL MRS培养基中,37 ℃培养20 h。
再将500 mL培养基中培养20 h的细胞,在4 ℃下(9 000 r/min)离心10 min取上清液,菌泥在PBS中洗涤2次。将上清液冻干,获得乳酸菌胞外酶产物;菌泥内加入含有1 g/L溶菌酶和240 g/L蔗糖的50 mmol/L Tris-HCl缓冲液(pH 7.5),置于冰水浴中,400 W超声波处理30 min,在4 ℃下,9 000 r/min离心10 min取沉淀以收集细胞内提取物,冷冻干燥获得胞内酶产物[15]。胞外和胞内酶产物均保存于-80 ℃冰箱备用。
酶活性测定:采用福林酚法,用酪蛋白作为底物,测定蛋白酶活性[16]。将冻干后的样品以1∶40(g∶L)溶解于1 mL 0.05 mol/L Tris-HCl缓冲液(pH 7.5)中,与含有1 mL酪蛋白底物的Tris-HCl缓冲液混合均匀,在40 ℃下孵育10 min;然后加入2 mL 0.4 mol/L的三氯乙酸终止反应;4 ℃下9 000 r/min离心10 min后,离心取上清液;向 1.0 mL上清液中加入 5.0 mL 0.4 mol/L Na2CO3,溶液然后加入1.0 mL Folin试剂;将溶液在40 ℃下孵育20 min以显色,680 nm处测量吸光值。蛋白酶活性以U/g单位表示,1个单位是在测定条件下释放1.0 μg酪氨酸当量所需的酶量。
1.3.3 GLI抗原性及AGA-IGE抗体含量测定
准确称取0.05 g GLI加入1 mL pH 7.5的磷酸盐缓冲液中,涡旋混匀制得悬浮液,再分别加入0.05 g乳酸菌胞外、胞内酶,35 ℃酶解反应24 h,酶解结束后,于95 ℃水浴灭酶10 min。用GLI致敏原性试剂盒和麦醇溶蛋白AGA-IGE抗体测定试剂盒对GLI的抗原性以及与GLI过敏原结合的AGA-IGE抗体含量水平进行测定。在样品孔中加入10 μL样品液(乳酸菌胞外、胞内酶产物处理后的GLI提取液),然后在样品孔中加入40 μL的稀释液A,轻轻晃动混合均匀,空白孔不添加任何物质,用封板膜封板后置于37 ℃温育30 min,弃掉孔内的液体,用洗板液清洗板5次后拍干,然后每孔加入50 μL的辣根过氧化物酶(horseradish peroxidase, HRP),用封板膜封板,于37 ℃孵育30 min。弃掉孔内的液体,用洗板液清洗板5次。每孔加显色剂过氧化物酶和3,3′,5,5′-四甲基联苯胺各50 μL,37 ℃避光显色10 min,加终止液50 μL终止反应(此时蓝色立转黄色),15 min内用酶标仪BioTek于450 nm波长下,测量各孔的吸光度(OD值)。
1.3.4 酶解单因素试验
配制底物质量浓度为0.05 g/mL GLI,以GLI的致敏性特征值OD450和AGA-IGE抗体含量为评价指标,主要考察各单因素酶解温度(25、30、35、40、45 ℃)、酶解 pH(6.5、7.0、7.5、8.0、8.5)、时间(3、6、9、12、24 h)、酶添加量(200、400、600、800、1 000 U/g)对酶解GLI致敏性的影响。
1.3.5 酶解工艺优化试验
在单因素试验的基础上,以GLI的致敏性特征值OD450为评价指标,用 Design-Expert.13软件设计响应面优化试验进一步优化酶解温度(A)、酶解pH(B)、酶解时间(C)、酶添加量(D)四个因素对酶解GLI致敏性的影响,从而得出最佳酶解工艺。试验设计见表1,以-1、0、1 分别代表变量的三水平,见表1。
表1 响应面优化麦醇溶蛋白酶解条件的因素水平设计
Table 1 Factors and levels of response surface method to optimize the enzymolysis conditions of gliadin
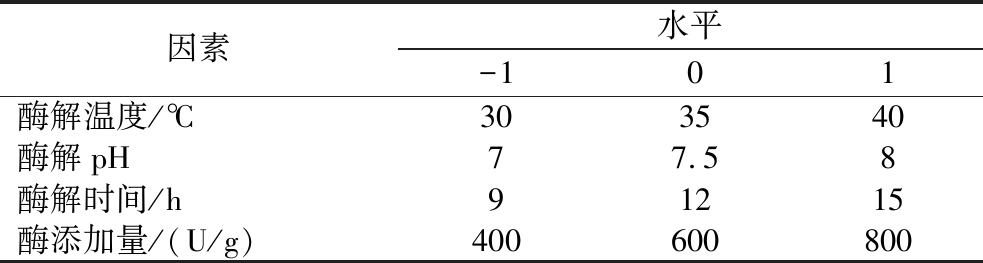
因素水平-101酶解温度/℃303540酶解pH77.58酶解时间/h91215酶添加量/(U/g)400600800
1.3.6 验证试验
通过双抗体夹心ELISA法评价最佳酶解条件作用下GLI提取液的抗原性及AGA-IGE抗体含量。方法同1.3.3节。
1.3.7 FTIR测定
扫描波数为400~4 000 cm-1,扫描次数32次和分辨率4 cm-1。准确称取250 g KBr进行压片,吸取样品(乳酸菌胞内酶处理的GLI提取溶液)和未处理的GLI提取溶液10 μL滴在KBr晶体片上,每个样品重复测定3次。蛋白二级结构含量采用Peak Fit 4.12软件进行分析。
1.3.8 EFS测定
吸取样品(乳酸菌胞内酶处理的GLI提取溶液)和未处理的GLI提取溶液20 μL加入比色皿中。设定分光光度计参数:激发波长280 nm,发射波长300~600 nm,激发和发射狭缝均为5 nm。每个样品重复测定3次。
1.3.9 UAS扫描测定
吸取样品(乳酸菌胞内酶处理的GLI提取溶液)和未处理的GLI提取溶液20 μL加入比色皿中,在200~400 nm范围内扫描紫外吸收光谱,光程为1 cm,响应时间0.1 s。每个样品重复测定3次。
1.4 数据处理
实验数据均为3次重复试验所得,结果均以“平均值±标准差”表示。运用SPSS 23进行单因素方差和独立样本t检验分析,P<0.05表示具有差异显著性,具有统计学意义。运用Design-Expert.13对酶解单因素试验结果进行响应面优化设计试验并进行分析,利用Origin 2021软件进行图片制作。
2 结果与分析
2.1 不同乳酸菌胞外、胞内酶对GLI抗原性和AGA-IGE抗体含量的影响
由图1-a可知,与对照组相比,4株乳酸菌胞外酶对降低GLI抗原性没有显著变化,而4株乳酸菌的胞内酶制剂显著降低了GLI的致敏性(P<0.05),特别是ACX0410将OD450值由0.842降至0.640。结果表明,这4株乳酸菌降低GLI致敏性主要是胞内酶起作用,ACX0410菌株表现出较好的应用潜力。SCHERF等[17]研究发现,乳酸菌外肽酶可打破多肽链的末端,而内肽酶主要负责GLI降解;LI等[18]采用双抗体夹心ELISA法发现木瓜蛋白酶和碱性蛋白酶可降低小麦粉中GLI过敏原;MASKE等[19]发现,不同乳酸菌发酵能够显著降低GLI过敏原性,与乳酸菌代谢酶产物密切相关;LIANG等[20]研究发现,Alcalase酶解作用能够显著降低牛乳中牛酪蛋白的抗原性和IgE结合能力;CAMINERO等[21]发现,乳酸杆菌所产酶可以降解淀粉酶-胰蛋白酶抑制剂,从而减轻小鼠由麸质引起的过敏反应。这些研究结果揭示4株乳酸菌的降敏作用与其胞内酶作用紧密相关,也可能与其降解淀粉酶胰蛋白酶抑制剂有关。
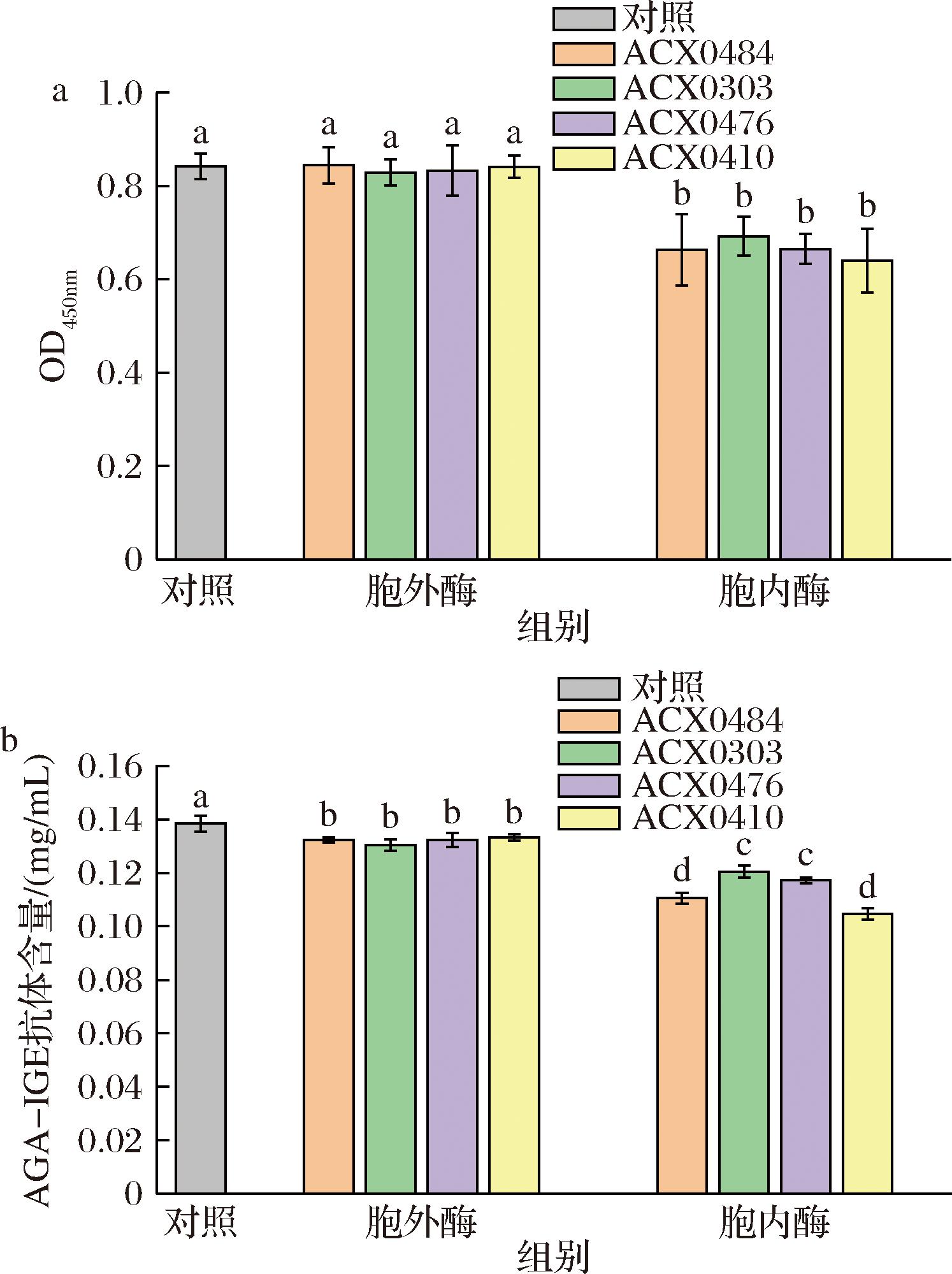
a-GLI抗原性;b-AGA-IGE抗体含量
图1 不同乳酸菌胞外、胞内酶对GLI抗原性及AGA-IGE抗体含量的影响
Fig.1 Effects of extracellular and intracellular enzymes of different lactic acid bacteria on the antigenicity of gliadin and the content of AGA-IGE antibody
注:不同小写字母表示差异显著(P<0.05)(下同)。
抗原性的降低常常伴随抗体含量的降低,4株乳酸菌胞外、胞内酶对麦醇溶蛋白AGA-IGE抗体含量影响结果如图1-b所示。与对照组相比,4株乳酸菌胞内、胞外酶处理均显著降低了麦醇溶蛋白AGA-IGE抗体含量(P<0.05),且胞内酶处理对降低麦醇溶蛋白AGA-IGE抗体含量作用效果更显著。4株乳酸菌胞外酶处理组之间差异不显著,而4株乳酸菌胞内酶处理中ACX0410和ACX0484两组表现出较强降低AGA-IGE抗体含量的能力(P<0.05),这与图1-a的结果也相互印证,表明ACX0410菌株胞内酶降低GLI致敏原性的作用较好。因此,后续选用ACX0410菌株胞内酶进行酶解工艺优化试验。
2.2 单因素试验结果
由图2-a、图2-b可知,随着酶解温度、pH增大,OD450 和AGA-IGE抗体含量的值均呈现先下降后上升的趋势,且在酶解温度为35 ℃、酶解pH值为7.5时二者值均达到最低值,此时降敏效果最佳。由图2-c可知,随着酶解时间的延长,OD450和AGA-IGE抗体含量的值逐渐降低,在酶解12 h之后趋于平缓,酶解24 h时有略微的回升但差异不显著,表明在酶解12 h时达到一个最优点,是最佳酶解麦醇溶蛋白的时间点。由图2-d可知,随着酶添加量的增加,OD450和AGA-IGE抗体含量的值呈逐渐降低趋势,在酶添加量为600 U/g达到最佳降敏效果。蛋白酶是一种具有生物催化功能的蛋白质,温度、pH、时间、底物浓度是影响酶解的重要因素[22]。当温度过低时,酶与蛋白底物反应速率较慢,进而影响酶解效果;当温度过高时,会导致酶的结构构象发生改变使酶失活,导致反应速率减慢[23];pH值的变化影响了酶的活性及底物的解离状态,进而影响酶与麦醇溶蛋白底物的结合和反应速率;酶解时间对酶解效果具有显著影响,它不仅影响酶解反应速率,还影响蛋白质的结构变化,适宜的酶解时间对提高酶解速率至关重要,当达到适宜的酶解时间时酶解效果已达到最佳状态,再延长酶解时间酶解效果也不会再增加[24];底物浓度一定时,尽管提高了酶添加量,但酶切位点是有限的[25]。因此,再增加酶添加量也不会改变酶解程度。

a-酶解温度;b-酶解pH值;c-酶解时间;d-酶添加量
图2 酶解温度、酶解pH值、酶解时间和酶添加量对麦醇溶蛋白抗原性和AGA-IGE抗体含量的影响
Fig.2 Effects of enzymolysis temperature, enzymolysis pH, enzymolysis time, and enzymolysis amount on the antigenicity of gliadin and AGA-IGE antibody content
综上,本研究选用最佳酶解温度为35 ℃、最佳酶解pH值为7.5、最佳酶解时间为12 h和最佳酶添加量600 U/g作为单因素,为响应面优化设计提供依据。
2.3 响应面优化试验结果
在单因素试验结果基础上,运用Design-Expert.13中Box-Behnken设计进行试验优化,设计四因素三水平试验。试验设计方案及结果如表2所示。
表2 响应面试验设计方案及结果
Table 2 Schemes and results of response surface design
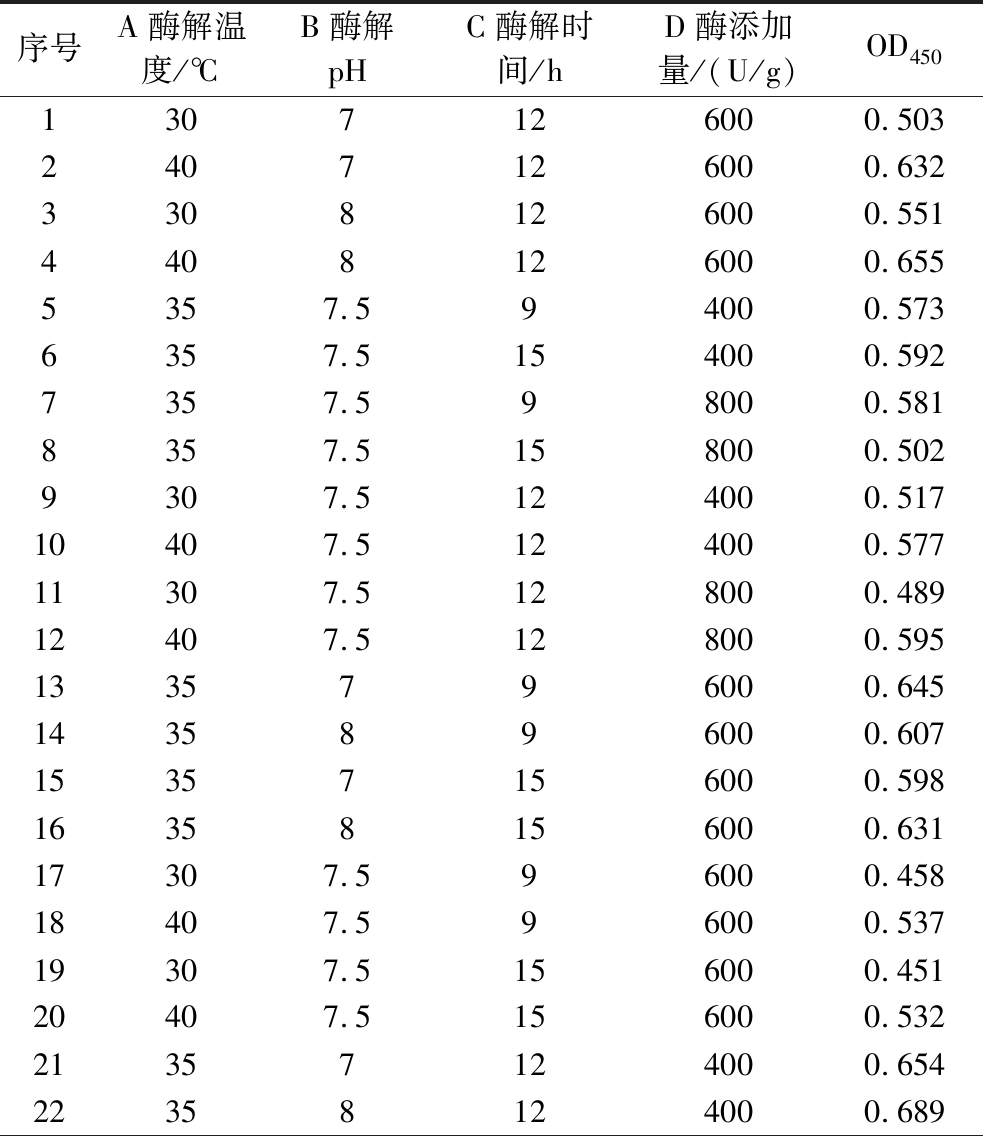
序号A酶解温度/℃B酶解pHC酶解时间/hD酶添加量/(U/g)OD4501307126000.5032407126000.6323308126000.5514408126000.6555357.594000.5736357.5154000.5927357.598000.5818357.5158000.5029307.5124000.51710407.5124000.57711307.5128000.48912407.5128000.5951335796000.6451435896000.60715357156000.59816358156000.63117307.596000.45818407.596000.53719307.5156000.45120407.5156000.53221357124000.65422358124000.689
续表2
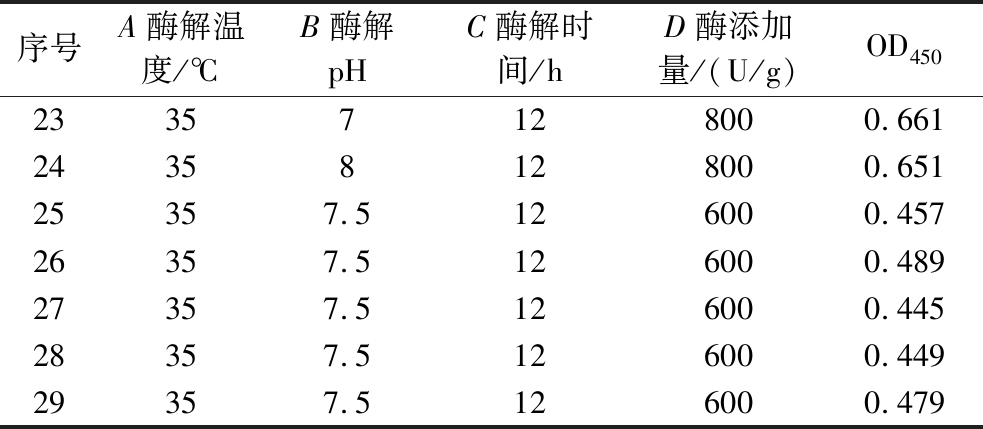
序号A酶解温度/℃B酶解pHC酶解时间/hD酶添加量/(U/g)OD45023357128000.66124358128000.65125357.5126000.45726357.5126000.48927357.5126000.44528357.5126000.44929357.5126000.479
使用Design-Expert.13响应面分析软件对29组OD450试验结果进行回归拟合,得到 OD450的回归方程:
OD450=29.143 03+0.015 587×A-7.432 83×B-0.142 989×C-0.001 365×D-0.002 5×AB+0.000 033×AC+0.000 012×AD+0.011 833×BC-0.000 112×BD-0.000 041×CD+0.000 074×A2+0.497 4×B2+0.003 122×C2+1.871 25E-06×D2
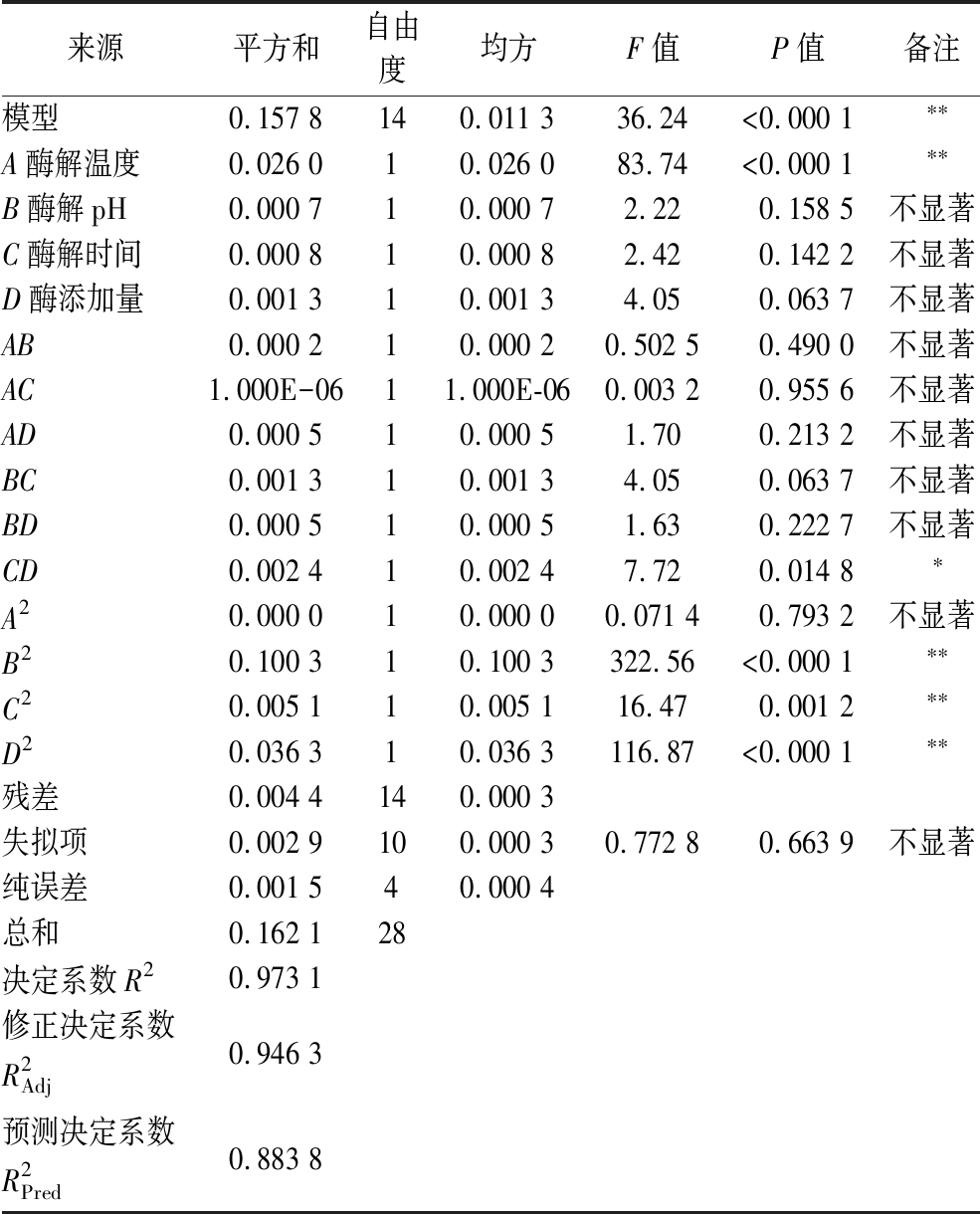
对回归方程进一步进行方差分析(表3),由表3可知,本试验的响应面回归模型中P<0.000 1,失拟项P=0.663 9>0.05,方程的决定系数R2=0.973 1,修正决定系数![]() 预测决定系数
预测决定系数![]() 表明回归模型与实际试验拟合较好,试验设计可靠,误差小,可用此模型来分析和预测试验因素对麦醇溶蛋白致敏特征值OD450的影响。以GLI致敏性特征值OD450为响应值的回归模型中,一次项A和二次项B2、C2、D2对OD450的影响极显著(P<0.01),交互项CD对OD450的影响显著(P<0.05),其他因素影响不显著。通过F值的大小判断可得各个因素对麦醇溶蛋白致敏性特征值OD450影响力大小为A>D>C>B,即酶解温度>酶添加量>酶解时间>酶解pH。
表明回归模型与实际试验拟合较好,试验设计可靠,误差小,可用此模型来分析和预测试验因素对麦醇溶蛋白致敏特征值OD450的影响。以GLI致敏性特征值OD450为响应值的回归模型中,一次项A和二次项B2、C2、D2对OD450的影响极显著(P<0.01),交互项CD对OD450的影响显著(P<0.05),其他因素影响不显著。通过F值的大小判断可得各个因素对麦醇溶蛋白致敏性特征值OD450影响力大小为A>D>C>B,即酶解温度>酶添加量>酶解时间>酶解pH。
表3 回归模型方差分析
Table 3 Regression model variance analysis
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
来源平方和自由度均方F值P值备注模型0.157 8140.011 336.24<0.000 1∗∗A酶解温度0.026 010.026 083.74<0.000 1∗∗B酶解pH0.000 710.000 72.220.158 5不显著C酶解时间0.000 810.000 82.420.142 2不显著D酶添加量0.001 310.001 34.050.063 7不显著AB0.000 210.000 20.502 50.490 0不显著AC1.000E-0611.000E-060.003 20.955 6不显著AD0.000 510.000 51.700.213 2不显著BC0.001 310.001 34.050.063 7不显著BD0.000 510.000 51.630.222 7不显著CD0.002 410.002 47.720.014 8∗A20.000 010.000 00.071 40.793 2不显著B20.100 310.100 3322.56<0.000 1∗∗C20.005 110.005 116.470.001 2∗∗D20.036 310.036 3116.87<0.000 1∗∗残差0.004 4140.000 3失拟项0.002 9100.000 30.772 80.663 9不显著纯误差0.001 540.000 4总和0.162 128决定系数R20.973 1修正决定系数R2Adj0.946 3预测决定系数R2Pred0.883 8
运用Design-Expert.13响应面分析软件处理数据,得出降低GLI致敏性特征值OD450的最佳酶解工艺条件:酶解温度为35 ℃,酶解pH值为7.524,酶解时间为12.715 h,酶添加量为647.06 U/g。
为研究酶解温度、酶解pH、酶解时间、酶添加量各因素之间相互作用对麦醇溶蛋白致敏特征值OD450的影响,使用Design-Expert.13响应面分析软件由二次回归模型绘制得到3D响应面图如图3所示,通过曲线坡度可以看出各因素相互作用之间的影响大小[2]。由图3可知,三维图整体呈向下凹陷趋势,说明该回归模型具有最小值;酶添加量与酶解时间的交互作用(图3-f)对GLI致敏特征值OD450影响显著(P<0.05),酶解pH与酶解温度的交互作用(图3-a)、酶解时间与酶解温度的交互作用(图3-b)、酶添加量与酶解温度的交互作用(图3-c)、酶解时间与酶解pH的交互作用(图3-d)、酶添加量与酶解pH的交互作用(图3-e)对GLI致敏特征值OD450影响不显著,这与表3结果一致。

a-酶解温度和酶解pH交互作用;b-酶解温度和酶解时间交互作用;c-酶解温度和酶解添加量交互作用;d-酶解pH和酶解时间交互作用;e-酶解pH和酶解添加量交互作用;f-酶解时间和酶解添 加量交互作用
图3 酶解温度、酶解pH、酶解时间、酶解添加量交互作用的响应面分析
Fig.3 Response surface analysis of the interaction of enzymolysis temperature, enzymolysis pH, enzymolysis time, and enzymolysis amount
2.4 验证试验
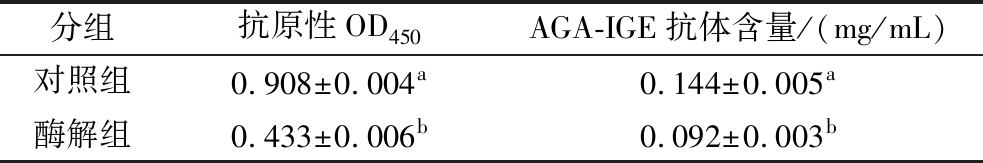
为了验证响应面法可行性及实际操作过程中可操作性,在实验条件酶解温度为35 ℃,酶解pH为7.5,酶解时间为12.5 h,酶添加量为647 U/g下,进行3次平行验证试验。在此条件下酶解对GLI致敏原性的影响结果如表4所示。由表4可知,与对照组相比,酶解组抗原性OD450值显著降低(P<0.05),由0.908降低至0.433,降低了52.3%;与理论值0.423比相对误差为2.36%,说明优化后的参数符合预测模型;AGA-IGE抗体含量也显著降低(P<0.05),降低了36.1%。JAGLAN等[26]研究报道了枯草芽孢杆菌AJG10处理对麦醇溶蛋白降解程度较高,降解率达到48.8%。FU等[27]发现接种乳酸葡萄球菌XZ31、酿酒酵母JM1和德氏葡萄球菌JM4共培养物的面团发酵24 h后,IgE结合过敏原含量降低了49%。这些研究结果提示,植物乳植杆菌L.plantarum ACX0410胞内酶具有作为低敏发酵面制品发酵剂的应用潜力。
表4 最佳酶解条件下麦醇溶蛋白抗原性OD450及AGA-IGE抗体含量
Table 4 Antigenic OD450 and contents of AGA-IGE antibody of gliadin under optimal enzymolysis conditions
注:不同小写字母表示差异显著(P<0.05)(下同)。
分组抗原性OD450AGA-IGE抗体含量/(mg/mL)对照组0.908±0.004a0.144±0.005a酶解组0.433±0.006b0.092±0.003b
2.5 ACX0410胞内酶对GLI二级结构的影响
FTIR可用于探究乳酸菌胞内酶对GLI二级结构的影响,蛋白质二级结构变化主要反映在酰胺Ⅰ带(1 600~1 700 cm-1)。蛋白二级结构主要包括:α-螺旋(1 650~1 660 cm-1)、β-折叠(1 610~1 640 cm-1)和(1 686~1 692 cm-1)、β-转角(1 660~1 686 cm-1)和无规则卷曲(1 640~1 650 cm-1)[28]。ACX0410胞内酶处理对GLI的二级结构含量变化如图4所示,与对照组相比,酶解麦醇溶蛋白的α-螺旋含量显著降低(P<0.05),β-转角和无规则卷曲含量显著增加(P<0.05)。酶解后麦醇溶蛋白的α-螺旋结构大量减少,由有序α-螺旋转变为无序β-转角,导致麦醇溶蛋白的二级结构展开变得无序,影响了麦醇溶蛋白结构稳定性。RAJENDHRAN等[29]研究也发现,枯草芽孢杆菌MTCC2423蛋白酶可以改变麦醇溶蛋白二级结构,进而影响小麦面筋蛋白水解活性。
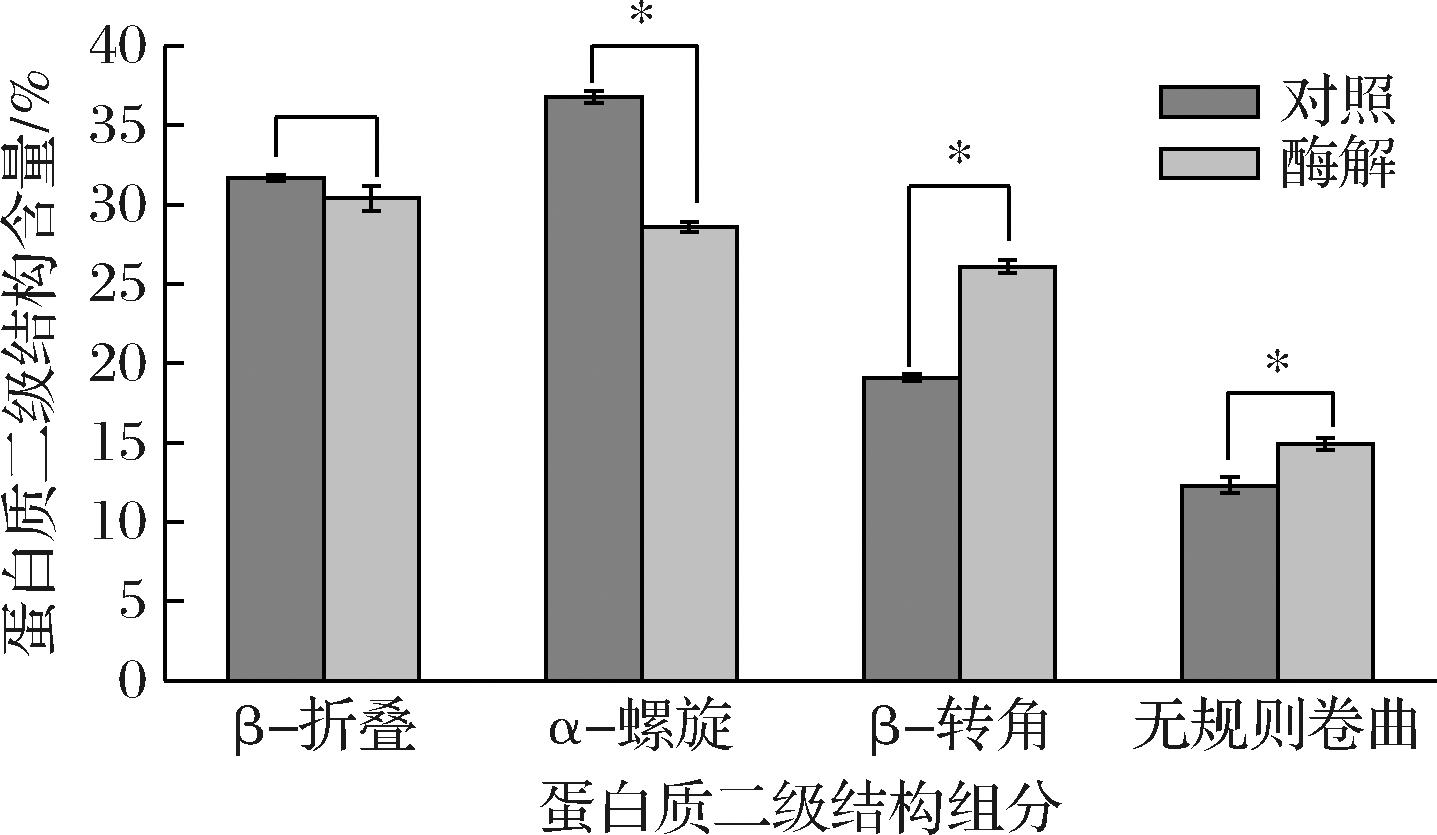
图4 ACX0410胞内酶处理对麦醇溶蛋白二级结构构象的影响
Fig.4 Effect of intracellular enzyme treatment by ACX0410 on conformation of secondary structure of gliadin
注:*表示差异显著(P<0.05)。
2.6 ACX0410胞内酶对GLI三级结构的影响
内源荧光光谱和紫外吸收光谱常用于表征蛋白质的三级结构变化[14]。如图5-a所示,与对照组相比,酶解后GLI荧光光谱峰最大荧光强度出现向更长的波长偏移(红移,从338 nm到350 nm),且酶解后GLI荧光光谱峰最大荧光强度明显低于对照组(P<0.05)。GLI中酪氨酸(Try)、色氨酸(Trp)和苯丙氨酸(Phe)残基与其过敏性相关,这些残基在特定波长激发下会发射荧光,其发射光谱对周围微环境高度敏感[30];酶解作用可破坏这些残基,影响蛋白的结构稳定性,促进其分子内疏水性基团的暴露,从而达到降低致敏作用的效果[31]。如图5-b所示,GLI的最大紫外吸收峰出现在277 nm处,与对照组相比,酶解后GLI紫外吸收光谱峰强度明显下降。这是由于Try、Trp和Phe残基的疏水性基团从蛋白质内部的疏水性环境暴露到亲水性环境中,从而使蛋白质构象表位被破坏或降解,降低了麦醇溶蛋白的致敏性[32]。LIU等[33]研究发现,葡萄糖氧化酶、木聚糖酶和漆酶处理可以降低小麦过敏原(谷蛋白)的内源荧光强度,改变其蛋白质结构构象。XUE等[34]研究发现,碱性蛋白酶和木瓜蛋白酶水解GLI致敏性结果也发现了类似现象。这表明ACX0410胞内酶对GLI的降敏作用可能与其对Try、Trp和Phe残基的破坏,促进疏水性基团的暴露相关。
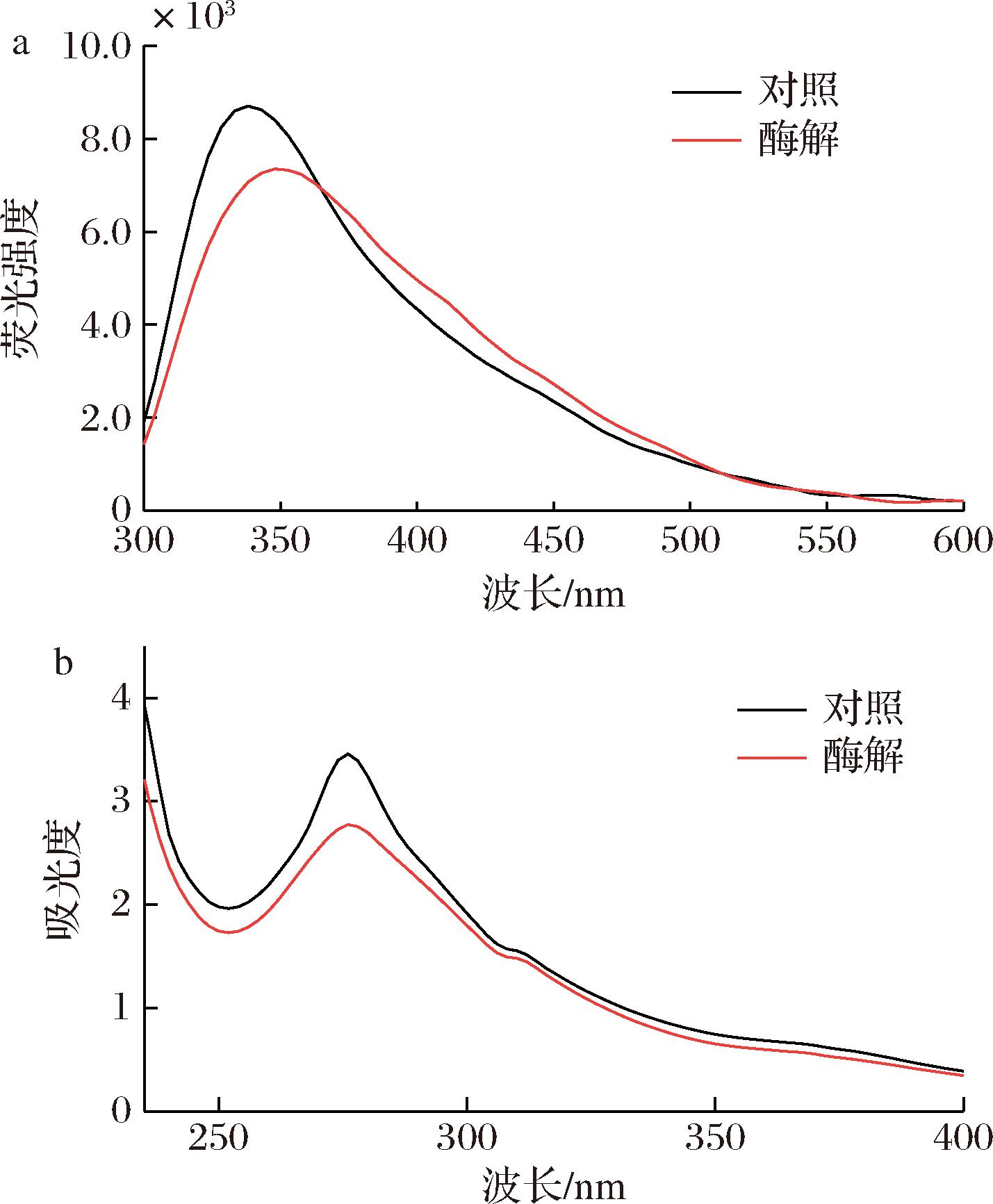
a-内源荧光光谱图;b-紫外扫描吸收光谱图
图5 ACX0410胞内酶处理对麦醇溶蛋白的三级结构构象的影响
Fig.5 Effect of intracellular enzyme treatment by ACX0410 on the tertiary structural conformation of gliadin
3 结论
本研究利用国内不同地区老酵头中4株乳酸菌(L.fermentum ACX0484、L.brevis ACX0303、L.curvatons ACX0476和L.plantarum ACX0410),探究不同乳酸菌胞内酶和胞外酶对GLI的致敏性影响及其最佳酶解工艺。结果发现,不同乳酸菌胞内酶对降低GLI致敏性具有较好效果,ACX0410胞内酶对降低GLI致敏性效果最好;通过单因素及响应面优化试验得出ACX0410胞内酶对GLI的最佳酶解工艺为:GLI质量浓度为0.05 g/mL时,酶解温度为35 ℃,酶解pH 7.5,酶解时间为12.5 h,酶添加量为647 U/g。ACX0410胞内酶对GLI的降敏作用与其能够降低GLI的α-螺旋含量、增加β-转角含量及促进疏水性基团的暴露相关。由此可见,植物乳植杆菌L.plantarum ACX0410胞内酶具有很好的降敏功效,可以为后续低敏发酵面制食品的研究提供理论依据,为开发小麦致敏患者新型食物提供参考。
[1] LIU M, HUANG J H, MA S, et al.Allergenicity of wheat protein in diet:Mechanisms, modifications and challenges[J].Food Research International, 2023, 169:112913.
[2] 孟智鹏, 温青玉, 张雨, 等.酶解改性对小麦醇溶蛋白致敏性的影响与工艺优化[J].河南农业科学, 2022, 51(7):163-172.MENG Z P, WEN Q Y, ZHANG Y, et al.Effect of enzymatic hydrolysis modification on the allergenicity of wheat gliadin and process optimization[J].Journal of Henan Agricultural Sciences, 2022, 51(7):163-172.
[3] 王晓辉, 朱婷伟, 孟凡聪, 等.大豆蛋白对面团中醇溶蛋白组成和结构的影响研究[J].食品与发酵工业, 2025, 51(1):223-230.WANG X H, ZHU T W, MENG F C, et al.Study on influence of soybean protein on composition and structure of gliadin in dough[J].Food and Fermentation Industries, 2025, 51(1):223-230.
[4] STØRDAL K, KURPPA K.Celiac disease, non-celiac wheat sensitivity, wheat allergy-clinical and diagnostic aspects[J].Seminars in Immunology, 2025, 77:101930.
[5] 胡庆玲, 尹文颖, 赵谋明, 等.小麦面筋蛋白盐酸脱酰胺工艺优化及其酶解敏感性[J].食品与发酵工业, 2013, 39(4):7-11.HU Q L, YIN W Y, ZHAO M M, et al.The optimization of HCl-deamidation to wheat gluten and research on its susceptibility to enzymatic hydrolysis[J].Food and Fermentation Industries, 2013, 39(4):7-11.
[6] PI X W, YANG Y L, SUN Y X, et al.Recent advances in alleviating food allergenicity through fermentation[J].Critical Reviews in Food Science and Nutrition, 2022, 62(26):7255-7268.
[7] DE VUYST L, VAN KERREBROECK S, LEROY F.Chapter Two-Microbial Ecology and Process Technology of Sourdough Fermentation [M].Advances in Applied Microbiology.Academic Press,2017:49-160.
[8] CAO Y F, ZHANG H J, YANG Z, et al.Influence of the fermentation time and potato pulp addition on the technological properties and volatile compounds of wheat dough and steamed bread[J].LWT, 2020, 128:109377.
[9] 李玺, 田阳, 唐杰, 等.酵母菌和植物乳杆菌发酵对小麦过敏原性的影响[J].食品工业科技, 2017, 38(2):235-239;312.LI X, TIAN Y, TANG J, et al.The influence of fermentation on wheat allergy by yeast and Lactobacillus[J].Science and Technology of Food Industry, 2017, 38(2):235-239;312.
[10] KIELISZEK M, POBIEGA K, PIWOWAREK K, et al.Characteristics of the proteolytic enzymes produced by lactic acid bacteria[J].Molecules, 2021, 26(7):1858.
[11] LESZCZY SKA J, SZCZEPANKOWSKA A K, MAJAK I, et al.Reducing immunoreactivity of gluten peptides by probiotic lactic acid bacteria for dietary management of gluten-related diseases[J].Nutrients, 2024, 16(7):976.
SKA J, SZCZEPANKOWSKA A K, MAJAK I, et al.Reducing immunoreactivity of gluten peptides by probiotic lactic acid bacteria for dietary management of gluten-related diseases[J].Nutrients, 2024, 16(7):976.
[12] WALTER T, WIESER H, KOEHLER P.Degradation of gluten in rye sourdough products by means of a proline-specific peptidase[J].European Food Research and Technology, 2015, 240(3):517-524.
[13] RANI M, AHMAD SIDDIQI R, SHARMA R, et al.Functional and structural properties of gliadin as influenced by pH, extraction protocols, and wheat cultivars[J].International Journal of Biological Macromolecules, 2023, 234:123484.
[14] 郑玉茹. 市售酵母对馒头醇溶蛋白抗原性影响的研究[D].郑州:河南农业大学, 2023.ZHENG Y R.Study on the effect of commercially available yeast on the antigenicity of alcohol-soluble protein in steamed buns[D].Zhengzhou:Henan Agricultural University, 2023.
[15] FU W H, XUE W T, LIU C L, et al.Screening of lactic acid bacteria and yeasts from sourdough as starter cultures for reduced allergenicity wheat products[J].Foods, 2020, 9(6):751.
[16] LU J, ZHAO Y, HU R, et al.Screening and characteristics of marine Bacillus velezensis Z-1 protease and its application of enzymatic hydrolysis of mussels to prepare antioxidant active substances[J].Molecules, 2022, 27(19):6570.
[17] SCHERF K A, WIESER H, KOEHLER P.Novel approaches for enzymatic gluten degradation to create high-quality gluten-free products[J].Food Research International, 2018, 110:62-72.
[18] LI Y, YU J M, GOKTEPE I, et al.The potential of papain and alcalase enzymes and process optimizations to reduce allergenic gliadins in wheat flour[J].Food Chemistry, 2016, 196:1338-1345.
[19] MASKE B L, DE MELO PEREIRA G V, DA S VALE A, et al.A review on enzyme-producing lactobacilli associated with the human digestive process:From metabolism to application[J].Enzyme and Microbial Technology, 2021, 149:109836.
[20] LIANG X N, QU Y Z, ZHOU W N, et al.Changes in allergenicity characteristics of bovine casein by enzymatic hydrolysis treatment[J].Journal of Food Measurement and Characterization, 2024, 18(8):7213-7223.
[21] CAMINERO A, MCCARVILLE J L, ZEVALLOS V F, et al.Lactobacilli degrade wheat amylase trypsin inhibitors to reduce intestinal dysfunction induced by immunogenic wheat proteins[J].Gastroenterology, 2019, 156(8):2266-2280.
[22] LIANG X N, HUI Y, JING S, et al.Effects of enzymatic treatments on the hydrolysis and antigenicity reduction of natural cow milk[J].Food Science &Nutrition, 2021, 9(2):985-993.
[23] 王仁佳, 曹文红, 章超桦, 等.华贵栉孔扇贝富硒蛋白粉的酶法制备工艺优化及其营养评价[J].食品与发酵工业, 2022, 48(10):84-92.WANG R J, CAO W H, ZHANG C H, et al.Optimization of enzymatic processing and nutritional evaluation of selenium-enriched protein powder of Chlamys nobilis[J].Food and Fermentation Industries, 2022, 48(10):84-92.
[24] 刘英丽, 张慧娟, 王静, 等.酶解花生粕制备抗氧化肽工艺研究[J].中国食品学报, 2014, 14(8):62-68.LIU Y L, ZHANG H J, WANG J, et al.Studies on peanut meal hydrolysis by protease to prepare peanut antioxidative peptides[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(8):62-68.
[25] ZHENG Y, YANG F F, YUAN X W, et al.Enzymatic hydrolysis of whey proteins by the combination of Alcalase and Neutrase:Kinetic model and hydrolysis control[J].International Dairy Journal, 2024, 151:105867.
[26] JAGLAN A, SADERA G, GOEL G.Proteolytic efficiency and degradation of gliadin and toxic immunopeptide in laboratory media by indigenous potential probiotic Bacillus strains[J].Food and Humanity, 2025, 4:100567.
[27] FU W H, LIU C L, MENG X, et al.Co-culture fermentation of Pediococcus acidilactici XZ31 and yeast for enhanced degradation of wheat allergens[J].International Journal of Food Microbiology, 2021, 347:109190.
[28] 麻嵩淼, 王旭, 金浏丽, 等.戊糖片球菌PE5与酵母联合发酵对玉米馒头面团中醇溶蛋白结构的影响[J].食品工业科技,2025,46(18):136-143.MA S M, WANG X, JIN L L, et al.The effect of co-fermentation of Pediococcus pentosaceus PE5 and yeast on the structure of prolamins in corn-wheat dough[J].Science and Technology of Food Industry, 2025,46(18):136-143.
[29] RAJENDHRAN H P, VAIDYANATHAN V K, VENKATRAMAN S, et al.Optimization of enzymatic hydrolysis by protease produced from Bacillus subtilis MTCC 2423 to improve the functional properties of wheat gluten hydrolysates[J].International Journal of Food Science, 2024, 2024:5053510.
[30] 张玉静, 黄凌立, 郭峻.糖基化对小米醇溶蛋白结构和消化性影响[J].食品研究与开发, 2023, 44(2):13-20.ZHANG Y J, HUANG L L, GUO J.Effect of glycosylation on the structure and digestibility of millet gliadin[J].Food Research and Development, 2023, 44(2):13-20.
[31] CHIZOBA EKEZIE F G, CHENG J H, SUN D W.Effects of nonthermal food processing technologies on food allergens:A review of recent research advances[J].Trends in Food Science &Technology, 2018, 74:12-25.
[32] TAN L, HONG P Z, YANG P, et al.Correlation between the water solubility and secondary structure of tilapia-soybean protein co-precipitates[J].Molecules, 2019, 24(23):4337.
[33] LIU M N, FAN M C, QIAN H F, et al.Effect of different enzymes on thermal and structural properties of gluten, gliadin, and glutenin in Triticale whole-wheat dough[J].International Journal of Biological Macromolecules, 2023, 253:127384.
[34] XUE L M, LI Y, LI T T, et al.Phosphorylation and enzymatic hydrolysis with alcalase and papain effectively reduce allergic reactions to gliadins in normal mice[J].Journal of Agricultural and Food Chemistry, 2019, 67(22):6313-6323.