酱香型白酒由于其独特的风味而受到大众的喜爱,四甲基吡嗪(tetramethylpyrazine,TTMP)是酱香型白酒的主要风味物质,不仅能协调白酒的味道和口感,更是有预防心脑血管疾病、糖尿病和癌症等疾病的功效[1]。TTMP是一种从中药川芎中提取的生物碱[2],又名川芎嗪,具有焙烤、可可和榛子等香气[3]。TTMP已被研究用于治疗各种疾病,其具有抗动脉粥样硬化,降低血浆中炎性细胞因子与细胞黏附因子的水平[4]和保护脑血管预防脑卒中的作用[5]。此外,TTMP还可通过激活p53依赖的线粒体凋亡和阻滞细胞周期,有效抑制癌细胞生长[6]。因此,TTMP是白酒中具有药用价值的健康因子。
细菌是酱香型白酒中酱香风味形成的主要微生物群[7],芽孢杆菌属通过代谢合成吡嗪类化合物,能够与酱香型白酒中的其他风味组分形成协同增效作用,从而显著提升酒体的香气复杂度、口感层次及整体品质。王晓丹等[8]从酱香大曲中筛选出1株具有高产蛋白酶特性的地衣芽孢杆菌,并且在挥发性成分中TTMP的含量高达44.11%。史洪丽等[9]从高温大曲中分离出的产TTMP菌株为贝莱斯芽孢杆菌,接种至堆积酒醅中,TTMP的含量为11.38 μg/g,是对照组的71.13倍。葛向阳等[10]将接种了高产TTMP的地衣芽孢杆菌的强化大曲应用到浓香型白酒的酿酒工艺中,原酒中TTMP提升了5~20倍。已报道的高产菌株虽能提升TTMP含量,但并不能满足实际生产需求,其仍有提升空间。此外,在白酒固态发酵中还存在以下问题:高产菌株对高温、高酸及复杂微生物群落环境耐受性不足,导致发酵过程中TTMP产量下降;过量接种会削弱酒体风味的丰富性。因此,筛选获得耐白酒固态发酵环境的TTMP高产菌株,并探究其接种量对菌群结构及风味物质的影响,对协同提升TTMP产量与维持白酒风味的丰富性及层次感具有重要意义。
TTMP的合成有2条途径:葡萄糖和氨基酸通过美拉德反应可以产生吡嗪类物质[11];乙偶姻通过与氨基酸转化而来的NH4+发生非酶促反应生成TTMP[12]。高活力的淀粉酶和蛋白酶可高效分解淀粉和蛋白质生成葡萄糖和氨基酸,为合成四甲基吡嗪提供丰富的前体物质。本研究从大曲和酒醅中分离筛选高产TTMP芽孢杆菌,对菌株产酶特性进行初筛,对液态和固态发酵产TTMP复筛,得到产酶特性优良且高产TTMP芽孢杆菌,通过形态观察及分子生物学技术对其进行鉴定,并利用该菌株模拟酱香型白酒发酵实验,结合高通量测序技术及顶空固相微萃取和气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS),探究其不同接种比例对菌群结构和风味物质的影响,旨在提升酱酒生产中TTMP含量,为酱香型白酒的酿造工艺改良提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
高温大曲、酒醅,贵州某酱香型酒厂提供;稻壳、高粱,购于当地市场;2-辛醇(色谱纯)、四甲基吡嗪标准品(纯度≥98%),上海阿拉丁生化科技股份有限公司。
1.1.2 培养基
LB培养基(g/L):酵母浸粉5,NaCl 10,蛋白胨10,琼脂15,115 ℃高温灭菌20 min。
高梁水解液发酵培养基:参考阮玉磊[13]的方法制作。
纯粮固态发酵培养基:高粱和温水按照料液比1∶1(g∶mL)混合后,润粮20 h,电磁炉蒸2 h。加入适量糖化酶,60 ℃恒温糖化2 h。加入质量分数为4%的稻壳混合均匀,分装至500 mL锥形瓶,每瓶分装160 g,121 ℃高压灭菌20 min。
酱酒模拟发酵培养基:高粱和温水按照料液比1∶1混合后,润粮20 h,电磁炉蒸2 h。摊凉后加入质量分数为8%的曲粉混匀,分装置于500 mL锥形瓶中,每瓶160 g。
1.2 仪器与设备
7890A气相色谱仪、1100系列高效液相色谱仪、Agilent 7890A-5975C气相色谱质谱联用仪,美国安捷伦科技有限公司;PCT-200型PCR基因扩增仪,美国BIO-RAD公司。
1.3 实验方法
1.3.1 芽孢杆菌的分离与纯化
称取10 g样品,加入90 mL液体LB培养基制备成均匀的菌悬液,在85 ℃水浴中灭活20 min后,在37 ℃条件下培养24 h,使芽孢萌发成营养细胞。取菌悬液进行梯度稀释(10-2、10-3、10-4、10-5),稀释液涂布于LB琼脂培养基上,37 ℃培养24 h。挑选不同形态的菌株,划线平板,得到单菌落后液体扩培再划线纯化,纯化后的菌株于4 ℃下保藏备用。
1.3.2 高产四甲基吡嗪芽孢杆菌的初筛
1.3.2.1 高产蛋白酶、淀粉酶及脂肪酶的菌株筛选
参考李晨瑶[14]的方法通过透明圈实验初步筛选出产酶较多的菌株。
1.3.2.2 液态发酵中高酶活力菌株筛选
按5%的接种量将种子液接种于装有100 mL液态培养基三角瓶中,以200 r/min转速在37 ℃下摇瓶培养48 h,培养结束后,7 000 r/min离心10 min后收集得酶浸出液,分别采用福林酚试剂法[15]、3,5-二硝基水杨酸法[16]和指示剂滴定法[15]测定各液态培养液中蛋白酶、淀粉酶以及脂肪酶活力。
1.3.2.3 麸曲中蛋白酶、淀粉酶及脂肪酶活力高菌株筛选
麸曲的培育方法:将麸皮和水按照料液比5∶4混匀。每500 mL三角瓶内分装混合麸皮80 g,湿热灭菌后用麸皮培养基接种种子液,将其平放在37 ℃的培养箱内恒温培养6 d,其间隔8 h摇瓶1次,6 d后用牛皮纸37 ℃干燥保存。
麸曲中酶活力测定:参考李晨瑶[14]的方法制备蛋白酶、淀粉酶及脂肪酶的浸出液,蛋白酶和淀粉酶活力测定与液态发酵中方法一致,酯化酶活力测定参考刑爽等[16]的方法进行测定。
1.3.3 高产四甲基吡嗪芽孢杆菌的复筛
液态发酵产TTMP实验:在装有150 mL液态发酵培养基的250 mL三角瓶中,按3%、5%、7%接种量加入种子液,恒温37 ℃下200 r/min振荡培养3 d。发酵结束后,取发酵液2 mL,12 000 r/min离心2 min后,用ddH2O稀释上清液10倍,用0.22 μm滤膜过滤上清液,采用HPLC技术对发酵液中的四甲基吡嗪的含量进行测定。
纯粮固态发酵产TTMP实验:挑选液态发酵中产TTMP含量最高的3株菌种进行纯粮固态发酵培养。将5%的种子液添加到装有160 g的纯粮固态培养基中,恒温40 ℃静置发酵7 d。发酵结束后,取100 g酒醅加200 mL水蒸馏,取100 mL馏出液,气相色谱法测其含量。
1.3.4 四甲基吡嗪含量检测
液态发酵TTMP含量的检测:采用HPLC测定四甲基吡嗪含量[17],以溶液浓度为横坐标,峰面积为纵坐标,制作标准曲线,获得标准曲线回归方程为y=557.46x+0.584,相关系数R2=0.999 9。
色谱检测条件:流动相为乙腈和甲酸水溶液,流速0.5 mL/min,梯度洗脱,0~25 min为97%甲酸水和3%乙腈,25~31 min为88%甲酸水和12%乙腈,31~35 min为80%甲酸水和20%乙腈,35~35.5 min 为30%甲酸水和70%乙腈,35.5~40 min 为97%甲酸水和3%乙腈(以上均为体积分数),柱温为40 ℃,采用色谱柱Eclipse PlusC18(4.6×250 mm),紫外检测器,检测波长为280 nm,进样量10 μL。
固态发酵TTMP含量的检测:参考刑爽等[16]的方法检测,获得标准曲线回归方程为y=2.296 3x-13.343,相关系数R2=0.999 2。
1.3.5 菌株的鉴定
形态观察:参照《伯杰士手册》对纯化后的菌株进行菌落形态观察并进行革兰氏染色处理。
分子生物学鉴定:采用Axygen Miniprep试剂盒对分离得到的菌株进行基因组提取,并利用细菌通用引物(27F/1492R)进行PCR扩增,将得到PCR产物琼脂糖凝胶电泳检测,然后送至北京金唯智生物科技有限公司进行测序。
1.3.6 酱酒模拟发酵实验
将菌株分别按5%、10%、15%的比例(菌液体积与模拟发酵培养基质量的比值)接种在拌有质量分数为8%大曲的模拟发酵培养基中,搅拌均匀后分装至500 mL锥形瓶中,8层纱布封口。梯度升温,30 ℃堆积3 d,在无菌条件下换成发酵栓封口以隔绝空气37 ℃堆积4 d,40 ℃堆积7 d,42 ℃堆积7 d,45 ℃堆积7 d,同时做平行实验。发酵结束后测定酒醅中TTMP、其他挥发性风味物质含量和菌群结构。
微生物群落结构分析:发酵结束后,取30 g发酵后酒醅溶于100 mL灭菌后的0.1 mol/L PBS溶液中充分振荡混匀,用滤纸过滤去除高粱、麸皮等大颗粒谷物杂质,保留滤液,7 400 r/min,4 ℃下离心10 min,收集菌泥,将菌泥在液氮中迅速冷冻后于-80 ℃保存。寄送样品到上海美吉生物测序公司做16S和ITS测序,把空白对照和不同接种量实验酒醅中菌群结构进行对比。
1.3.7 挥发性风味物质的顶空固相微萃取气质联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析样品前处理:取100 g酒醅与100 mL水蒸馏,接取100 mL馏出液。准确吸取8 mL馏出液,加入3 g NaCl和10 μL 0.5 mg/L的2-辛醇溶液混匀,使用HS-SPME-GC-MS仪分析。
顶空固相微萃取方法与色谱柱温度程序设定:参照WANG等[18]的方法设定。
1.3.8 数据处理
所有分析都进行3次独立重复,用“平均值±标准差”表示,使用GraphPad Prism 9软件绘图,使用SPSS 27软件进行单因素方差分析(ANOVA),P<0.05为显著差异。
2 结果与分析
2.1 芽孢杆菌分离与初筛
如图1所示,利用热处理产芽孢的方法从大曲和酒醅共分离纯化得364株芽孢杆菌。对以上菌株进行透明圈实验,通过透明圈直径大小,初步筛选出产蛋白酶、淀粉酶和脂肪酶各排名前20的菌株共60株菌进行液态酶活力测定。根据各酶活力情况挑选出酶活力高的14株菌制成麸曲,进一步对酶活力进行考察,最终挑选出DQ-B6、XS-B25、XS-B89、DQ-B102、DQ-B103、DQ-B106共6株高产TTMP候选菌进行后续发酵实验。
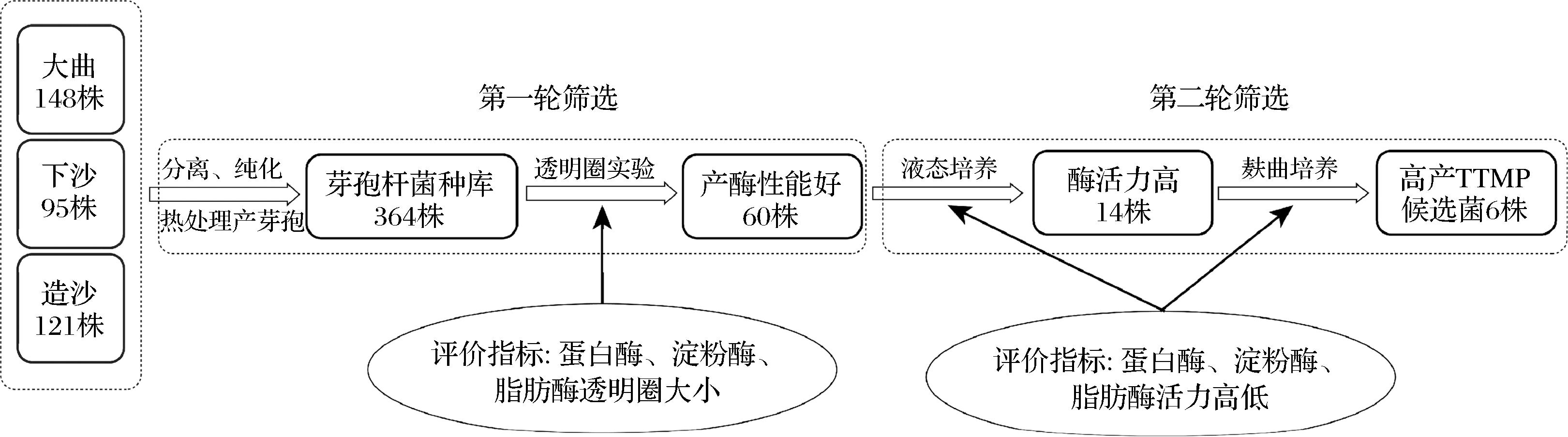
图1 芽孢杆菌分离与初筛流程
Fig.1 Isolation and primary screening process of Bacillus
2.2 高产四甲基吡嗪芽孢杆菌的复筛
2.2.1 液态发酵产TTMP
6株高产TTMP候选菌的液态发酵液中乙偶姻与TTMP的含量见表1。各菌株在接种比例为7%时TTMP含量最高,且乙偶姻的转化也在正常进行。TTMP产量最高的菌株为DQ-B102,TTMP含量达0.128 mg/L;其次为XS-B25,TTMP产量0.127 mg/L;DQ-B103的TTMP产量为0.126 mg/L。综合TTMP的产量以及乙偶姻转化能力挑选出XS-B25、DQ-B102、DQ-B103共3株菌进行后续实验。
表1 液态发酵液中乙偶姻与TTMP的含量
Table 1 Content of acetoin and TTMP in fermented broth
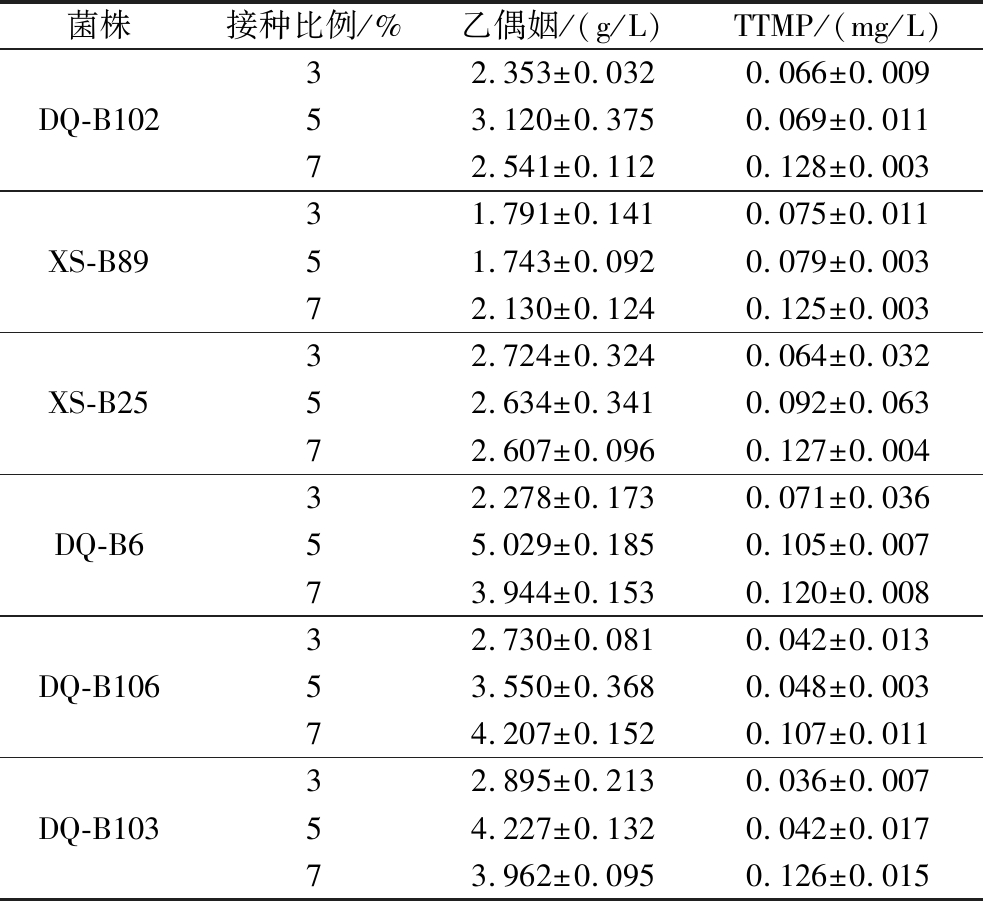
菌株接种比例/%乙偶姻/(g/L)TTMP/(mg/L)DQ-B10232.353±0.0320.066±0.00953.120±0.3750.069±0.01172.541±0.1120.128±0.003XS-B8931.791±0.1410.075±0.01151.743±0.0920.079±0.00372.130±0.1240.125±0.003XS-B2532.724±0.3240.064±0.03252.634±0.3410.092±0.06372.607±0.0960.127±0.004DQ-B632.278±0.1730.071±0.03655.029±0.1850.105±0.00773.944±0.1530.120±0.008DQ-B10632.730±0.0810.042±0.01353.550±0.3680.048±0.00374.207±0.1520.107±0.011DQ-B10332.895±0.2130.036±0.00754.227±0.1320.042±0.01773.962±0.0950.126±0.015
2.2.2 纯粮固态发酵产TTMP
对已筛选出的XS-B25、DQ-B102、DQ-B103共3株菌进行纯粮固态发酵产乙偶姻和TTMP实验。结果如图2所示,XS-B25、DQ-B102、DQ-B103的乙偶姻产量分别为13.21、3.46、4.89 g/L。DQ-B102的TTMP含量最高,达到61.42 mg/L,其次是DQ-B103,TTMP含量为34.25 mg/L,而XS-B25的TTMP含量显著低于前2株菌,为4.81 mg/L。实验结果表明,DQ-B102将乙偶姻转化TTMP效率最高,产TTMP能力最强。综上,选择DQ-B102进行后续探究。
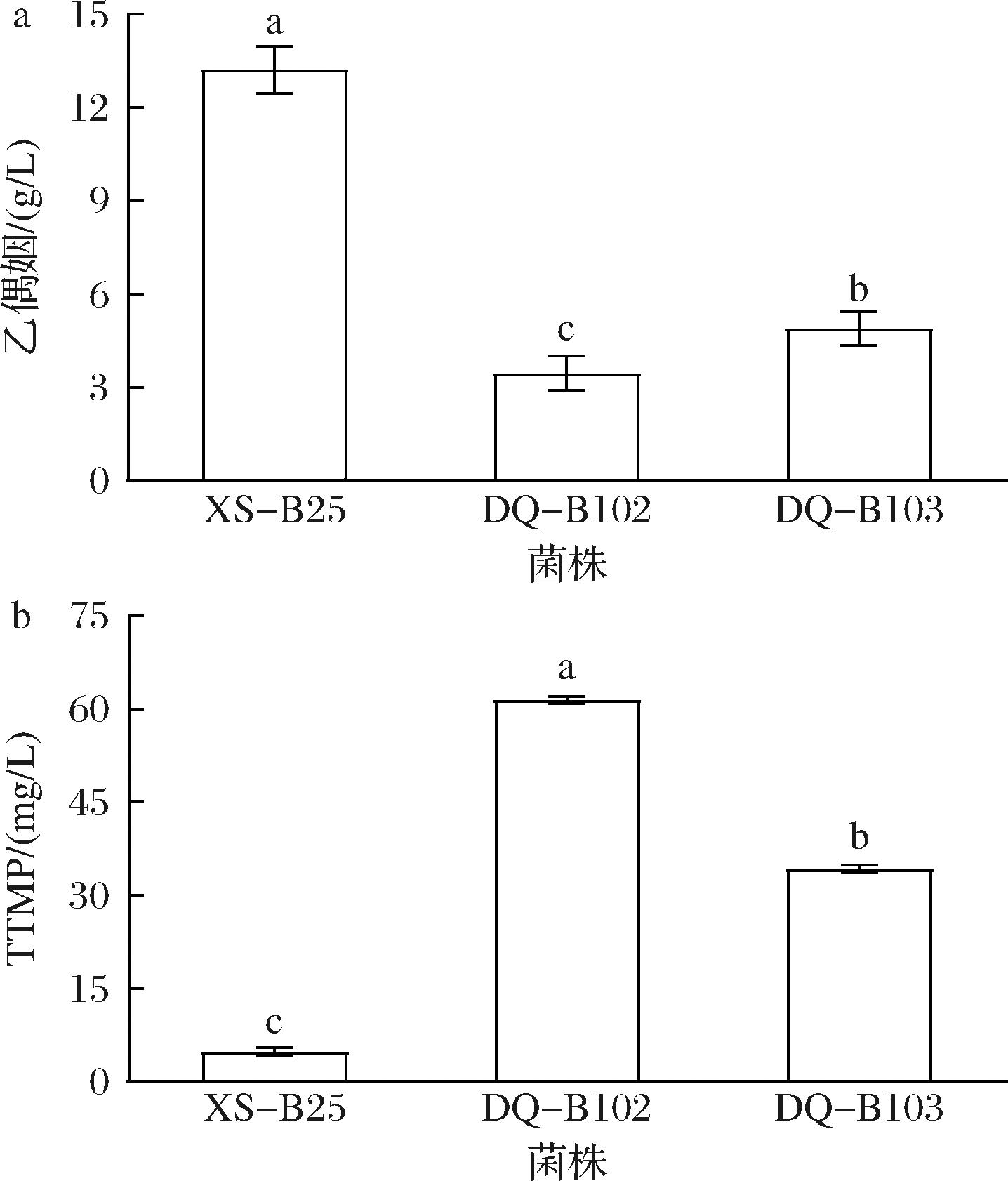
a-乙偶姻;b-TTMP
图2 纯粮固态发酵产TTMP含量
Fig.2 Production of TTMP content via solid-state fermentation
注:不同小写字母表示差异显著(P<0.05)(下同)。
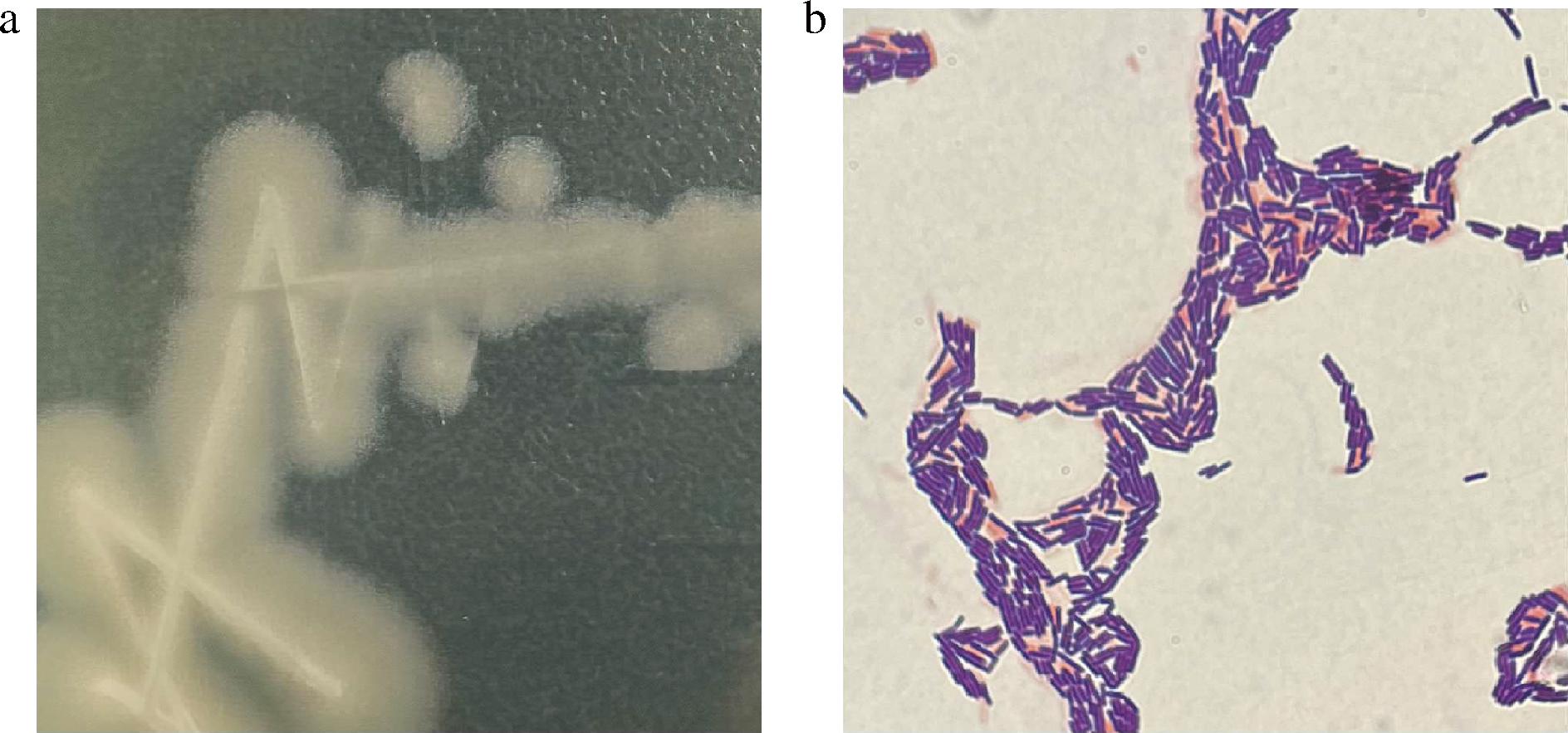
a-菌落形态;b-革兰氏染色结果
图3 菌株DQ-B102的菌落形态及革兰氏染色结果
Fig.3 Colonial morphology and gram staining results of strain DQ-B102
2.3 高产四甲基吡嗪芽孢杆菌的鉴定
2.3.1 菌株形态学鉴定
如图3-a所示,菌株DQ-B102的菌落呈圆形或近圆形,直径约2~5 mm,边缘整齐至轻微波浪状,颜色为乳白色或灰白色,表面略带褶皱;革兰氏染色(图3-b)显示为革兰氏阳性杆菌,菌体直或略弯曲,单个或短链状排列,末端钝圆。参照《伯杰氏细菌鉴定手册》初步鉴定该菌株为芽孢杆菌(Bacillus)。
2.3.2 分子生物学鉴定
对高产四甲基吡嗪菌株DQ-B102进行16S rDNA测序鉴定,选择同源性高的序列,通过MEGA11.0构建系统发育树。结果如图4所示,菌株DQ-B102与贝莱斯芽孢杆菌(Bacillus velezensis)TPS3N聚于一支,亲缘关系最近,结合形态学鉴定结果,鉴定菌株DQ-B102为贝莱斯芽孢杆菌(Bacillus velezensis)。
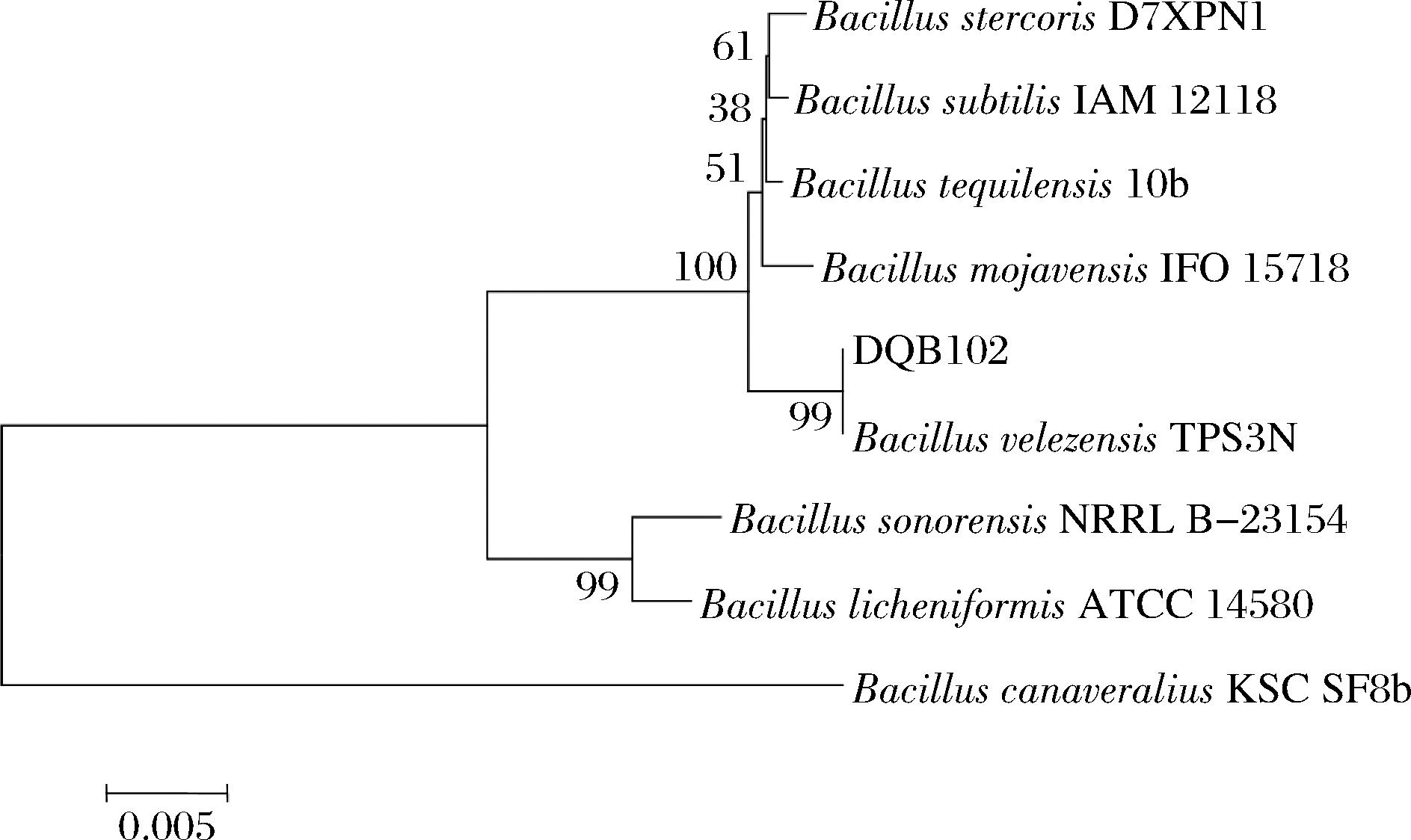
图4 基于16S rDNA基因序列构建菌株DQ-B102的系统发育树
Fig.4 Phylogenetic tree of strain DQ-B102 based on 16S rDNA gene sequence
2.4 酱酒模拟发酵实验
2.4.1 酒醅中TTMP的测定
将DQ-B102以不同接种比例与曲混合进行酱酒模拟发酵,以只加大曲发酵作为对照。如图5所示,添加DQ-B102强化菌剂后在各发酵组中TTMP含量均显著提高。在5%、10%和15%接种量时,DQ-B102的TTMP产量分别为103.46、117.30、144.18 mg/L,相比于对照组分别提升0.82倍、1.06倍、1.54倍。对比目前已报道研究中筛选获得菌株产TTMP的水平,DQ-B102的TTMP产量处于较高水平[9-10,19]。结果表明,TTMP产量与DQ-B102接种量成正相关,将DQ-B102制成强化菌剂干预发酵,可显著提升TTMP产量,改善白酒风味。
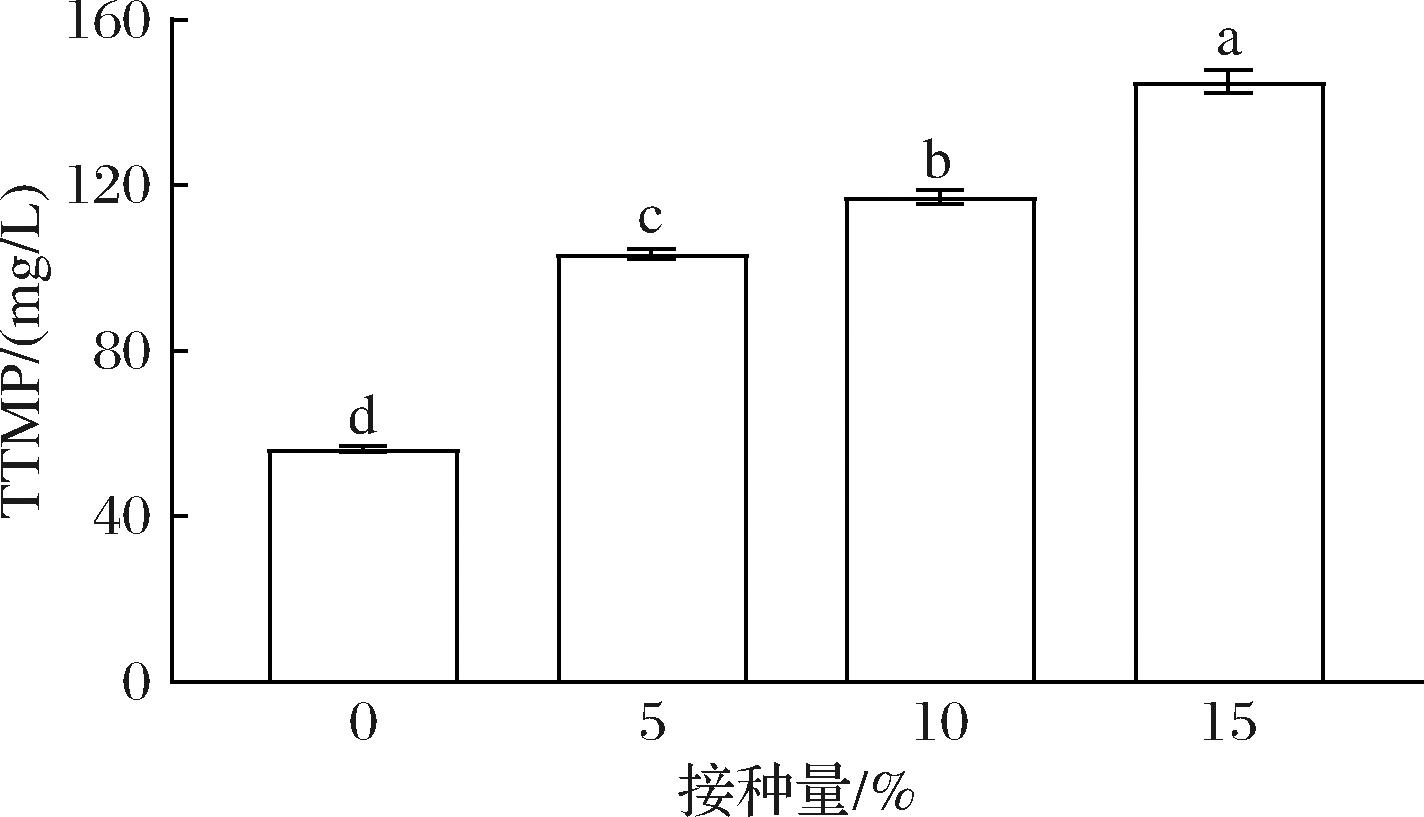
图5 酒醅中TTMP含量
Fig.5 Content of TTMP in fermented grains
2.4.2 DQ-B102对细菌群结构的影响
各酒醅样本细菌群落Alpha多样性数据如表2所示,各酒醅样本的Chao指数为105.625~138.714,Ace指数为113.416~140.907,接种量为5%时Chao指数与Ace指数最高;Shannon指数为1.986~2.176,Simpson指数为0.153~0.190,2个指数综合表明接种量为0%时物种丰富度最高。所有样本的覆盖率为0.999 4~0.999 7。综上,测序分析结果可完整反映出酒醅中细菌微生物组成与结构,表明DQ-B102的接种可对酱酒模拟发酵过程中细菌的菌群结构与丰富度产生影响。
表2 酒醅中细菌群落测序Alpha多样性指数
Table 2 Alpha diversity indices of bacterial community sequencing in fermented grains
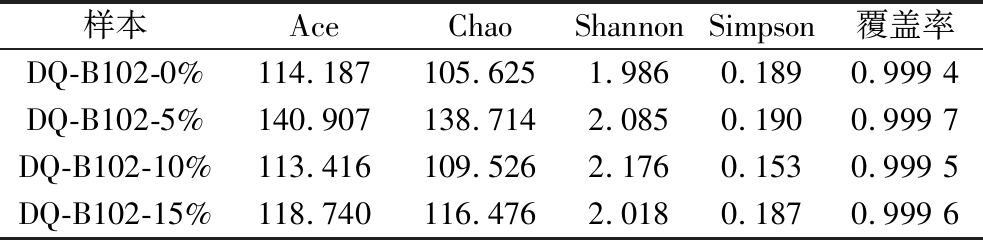
样本AceChaoShannonSimpson覆盖率DQ-B102-0%114.187105.6251.9860.1890.999 4DQ-B102-5%140.907138.7142.0850.190 0.999 7DQ-B102-10%113.416109.5262.1760.1530.999 5DQ-B102-15%118.740116.4762.0180.1870.999 6
通过比较DQ-B102不同接种比例酒醅样本中细菌群落的属水平组成结构,各样本中相对丰度排名前10的细菌属分布如图6所示,主要包括克罗彭斯特菌属(Kroppenstedtia)、枝芽孢杆菌属(Virgibacillus)、高温放线菌属(Thermoatinomyces)、芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、海洋芽孢杆菌属(Oceanobacillus)、火山渣芽孢杆菌属(Scopulibacillus)、葡萄球菌属(Staphylococcus)、直丝菌属(Planifilum)等。
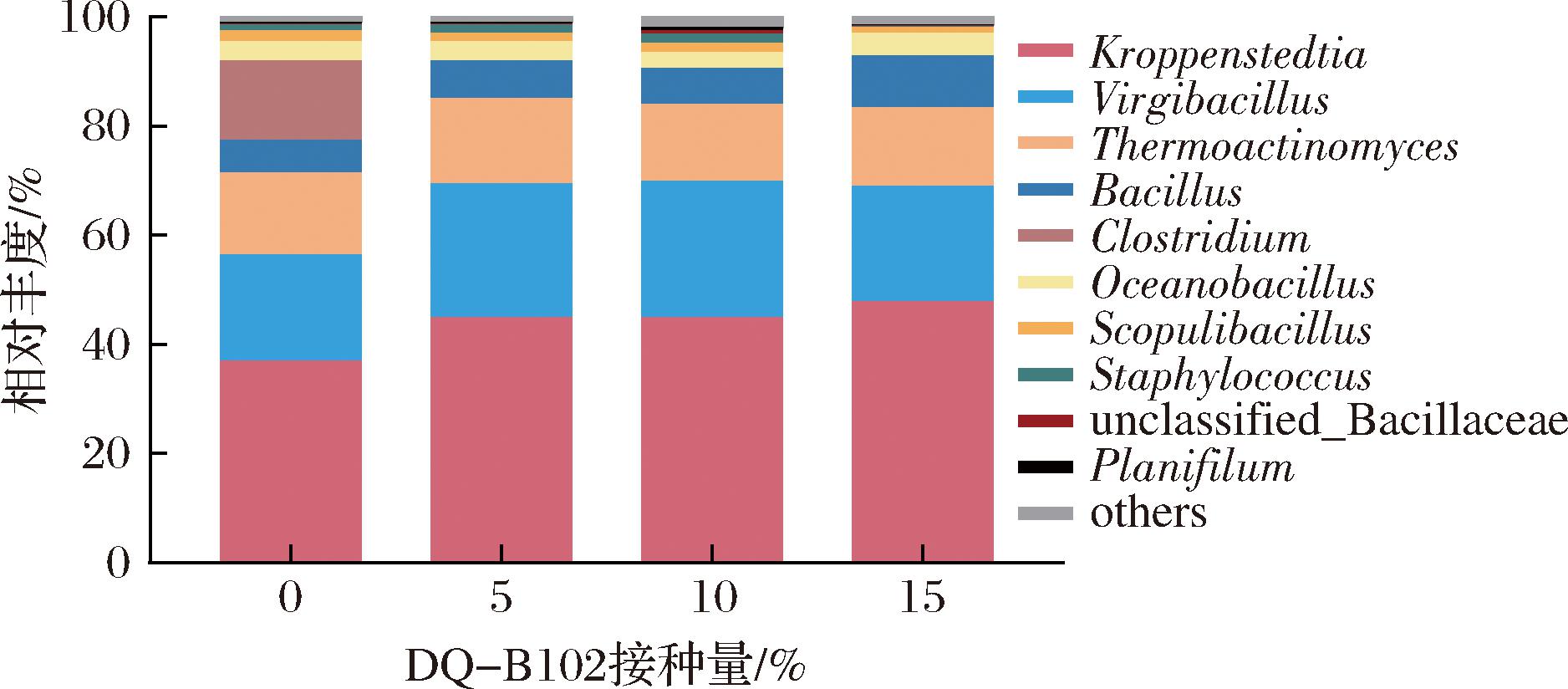
图6 属水平下细菌群落结构
Fig.6 Bacterial community structure at genus level
克罗彭斯特菌属、枝芽孢杆菌属、高温放线菌属、芽孢杆菌属相对丰度占比较高,是酱酒模拟发酵过程中的优势细菌属。克罗彭斯特菌属在对照组中相对丰度为37.01%,随着DQ-B102接种量增加,其相对丰度逐渐增加至47.87%。研究表明,克罗彭斯特菌属为高温大曲中的第2优势菌属[20]。枝芽孢杆菌属在无DQ-B102强化菌剂影响时相对丰度为19.54%,在不同接种量DQ-B102强化菌剂影响下呈现先增后降的趋势。枝芽孢杆菌属具有较强分泌蛋白酶及其他酶的能力,可产酸、增香、增加酒体的棉柔感,从而提升白酒的风味[21]。高温放线菌属在各发酵组中相对丰度均接近15%,DQ-B102的添加对其没有显著影响。高温放线菌是α-高温淀粉酶的主要来源之一,有助于淀粉的液化与糖化,提高原料的利用率[22]。芽孢杆菌属在对照组中相对丰度为6.40%,随着DQ-B102接种量增加,其相对丰度逐渐增加至9.67%。芽孢杆菌属是酱香型白酒中生产风味物质的主要细菌属,对于产TTMP具有重要作用。值得注意的是,在对照组中梭菌属相对丰度较高达14.50%,而在加入DQ-B102强化菌剂后其相对丰度迅速下降,推测贝莱斯芽孢杆菌对梭菌属有强抑制作用。实验结果表明,贝莱斯芽孢杆菌DQ-B102强化菌剂显著改变了酒醅细菌菌群结构,其群落组成因菌株环境适应性及种间互作发生动态重构。
2.4.3 DQ-B102对真菌群结构的影响
如表3所示,各酒醅样本的Chao指数为67.000~90.000,Ace指数为67.388~90.643,接种量为0%的时候Chao指数与Ace指数最高;各酒醅样本的Shannon指数为2.043~2.451,Simpson指数为0.155~0.245,2个指数综合表明接种量为15%时物种丰富度最高;所有样本的覆盖率为0.999 970~1.000 000。综上,测序分析结果可完整反映出酒醅中真菌微生物组成与结构,表明DQ-B102的接种可对酱酒模拟发酵过程中真菌的菌群结构与丰富度产生影响。
表3 酒醅真菌群落测序Alpha多样性指数
Table 3 Alpha diversity indices of fungal community sequencing in fermented grains
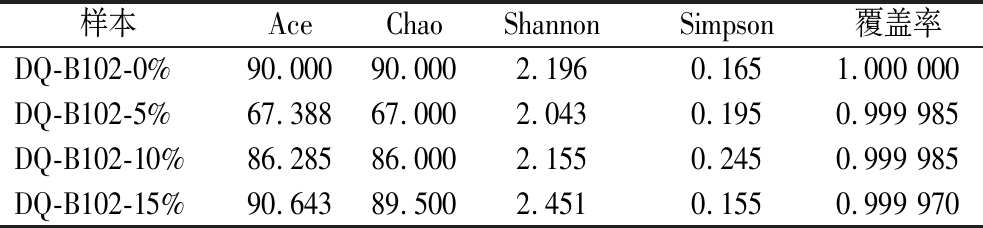
样本AceChaoShannonSimpson覆盖率DQ-B102-0%90.00090.0002.1960.1651.000 000DQ-B102-5%67.38867.0002.0430.1950.999 985DQ-B102-10%86.28586.0002.1550.2450.999 985DQ-B102-15%90.64389.5002.4510.1550.999 970
通过比较DQ-B102不同接种比例酒醅样本中真菌群落的属水平组成结构,各样本中相对丰度排名前10的真菌属分布如图7所示,主要包括酵母属(Saccharomyces)、曲霉属(Aspergillus)、拉氏霉属(Rasamsonia)、伊萨酵母属(Issatchenkia)、青霉属(Penicillium)、红曲霉属(Monascus)、马拉色菌属(Malassezia)、枝孢菌属(Cladosporium)、威克汉姆酵母属(Wickerhamomyces)、赤酿母属(Rhodotorula)等。
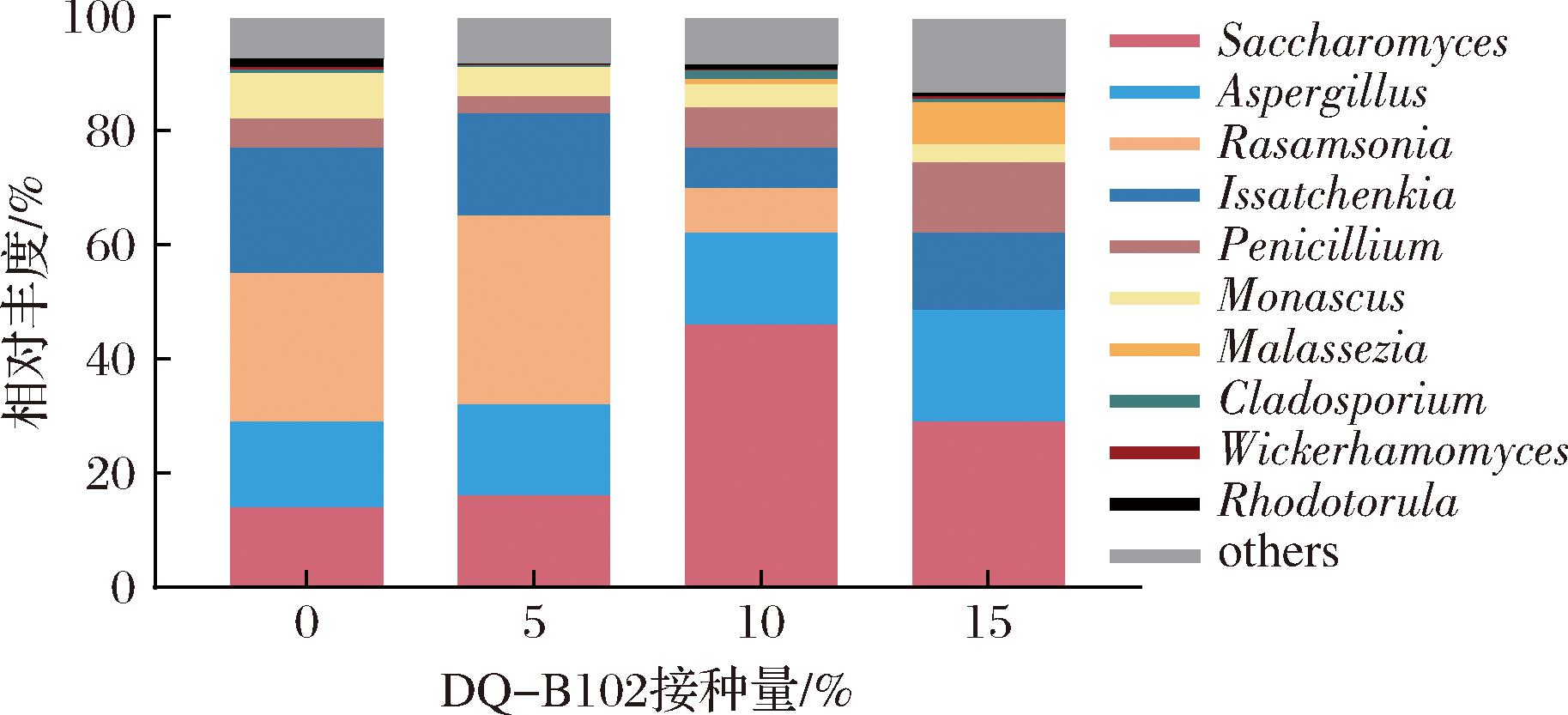
图7 属水平下真菌群落结构组成分析
Fig.7 Fungal community structure at genus level
酵母属、曲霉属、拉氏霉属、伊萨酵母属的相对丰度占比较高,是酱酒模拟发酵过程中的优势真菌属。酵母属在对照组中相对丰度为13.72%,DQ-B102强化菌剂接种量为5%~10%时,酵母属并未受到抑制作用,然而当接种量提升至15%时酵母属相对丰度开始降低。此结果与研究者在清香型小曲中接种贝莱斯芽孢杆菌后会对酵母菌的生长产生抑制作用结果相一致[23]。曲霉属在对照组中相对丰度为15.50%,随着DQ-B102接种量增加,其相对丰度逐渐增加至19.50%。曲霉属和芽孢杆菌混合发酵会促进氨基酸转化率提高[24]。拉氏霉属的相对丰度在接种比例5%时达峰值,相对丰度为32.70%,而在接种比例为15%时几乎被完全抑制,相对丰度仅为0.002%。跨界网络分析表明,芽孢杆菌科等与拉氏霉属等真菌之间存在显著互斥性[25]。伊萨酵母属的相对丰度在对照组中最高为21.84%,在DQ-B102强化菌剂接入后生长受到抑制。结果表明,酵母属凭借高效的糖酵解代谢网络及环境胁迫响应机制,在发酵中普遍能占据优势地位,外源菌剂虽能短暂重塑菌群结构,但单一菌剂易引发群落单一化。
2.4.4 挥发性物质的检测与分析
不同接种比例的DQ-B102强化菌剂显著影响酱酒模拟发酵酒醅的风味物质组成及香气活度值(oder activity ralue,OAV)变化,结果如表4所示。所有实验组共检测到34种挥发性风味物质,包括醇类8种、酯类9种、醛类7种、酚类4种及其他类6种酱香型白酒典型风味组分。其中,5%接种量组风味物质种类最丰富为32种,显著高于其他实验组。根据参考文献[26-27]计算风味成分的OAV,OAV越大表示该成分对白酒的风格和口味的贡献越大。各类物质中OAV>1的是正辛醇(果香)、己酸乙酯(甜香)、辛酸乙酯(菠萝香)、苯乙酸乙酯(花香)、十六酸乙酯(乳酯香)、愈创木酚(焦酱香)和4-乙基愈创木酚(酱油香)。随着接种量增加,其中正辛醇、苯乙酸乙酯和己酸乙酯的OAV呈下降趋势,而辛酸乙酯、十六酸乙酯、4-乙基愈创木酚和愈创木酚的OAV呈整体上升的趋势,为酒体贡献更多的焦酱香。结果表明,DQ-B102强化菌剂添加量为5%时可以提高挥发性风味物质种类和含量,但是当DQ-B102接种量提高至10%和15%时会导致挥发性风味物质种类减少。过多添加芽孢杆菌会抑制酵母等真菌属菌群生长[28],这可能是导致风味物质种类减少的原因之一。同时,随着接种量增加,焦酱香贡献度整体呈上升趋势,酒体的酱香风味更为浓郁。
表4 酱酒模拟发酵酒醅中挥发性物质的含量及OAV
Table 4 Content of volatile compounds and OAV in simulated Jiangxiangxing Baijiu fermented grains
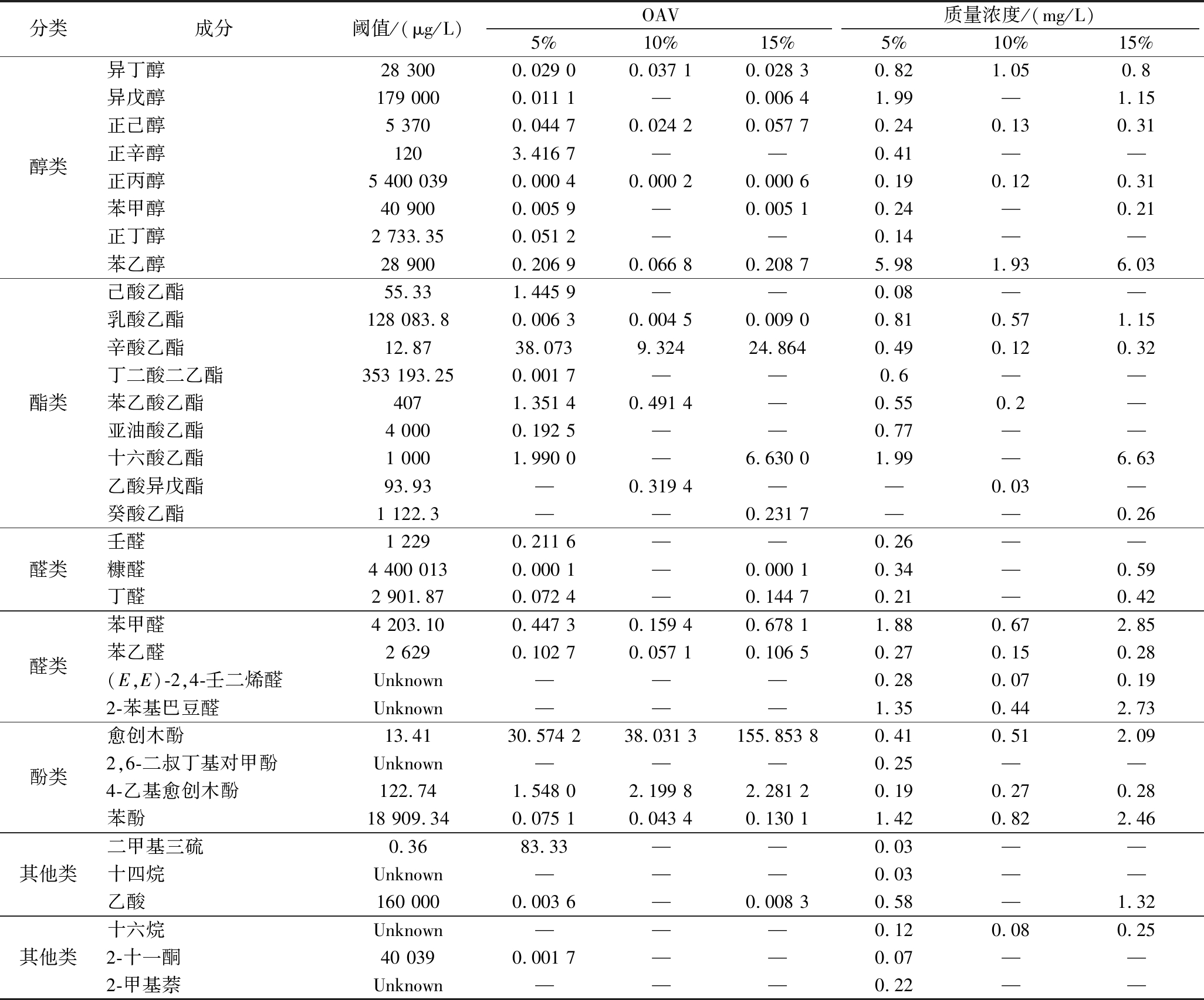
注:—表示未检出;Unknown表示气味阈值未能获得。
分类成分阈值/(μg/L)OAV质量浓度/(mg/L)5%10%15%5%10%15%醇类异丁醇28 3000.029 00.037 10.028 30.821.050.8异戊醇179 0000.011 1—0.006 41.99—1.15正己醇5 3700.044 70.024 20.057 70.240.130.31正辛醇1203.416 7——0.41——正丙醇5 400 0390.000 40.000 20.000 60.190.120.31苯甲醇40 9000.005 9—0.005 1 0.24—0.21正丁醇2 733.350.051 2——0.14——苯乙醇28 9000.206 90.066 80.208 7 5.981.936.03酯类己酸乙酯55.331.445 9——0.08——乳酸乙酯128 083.80.006 30.004 50.009 0 0.810.571.15辛酸乙酯12.8738.0739.32424.8640.490.120.32丁二酸二乙酯353 193.250.001 7——0.6——苯乙酸乙酯4071.351 40.491 4 —0.550.2—亚油酸乙酯4 0000.192 5——0.77——十六酸乙酯1 0001.990 0—6.630 01.99—6.63乙酸异戊酯93.93—0.319 4 ——0.03—癸酸乙酯1 122.3——0.231 7 ——0.26醛类壬醛1 2290.211 6——0.26——糠醛4 400 0130.000 1— 0.000 1 0.34—0.59丁醛2 901.870.072 4—0.144 7 0.21—0.42醛类苯甲醛4 203.100.447 30.159 4 0.678 1 1.880.672.85苯乙醛2 6290.102 70.057 1 0.106 5 0.270.150.28(E,E)-2,4-壬二烯醛Unknown———0.280.070.192-苯基巴豆醛Unknown———1.350.442.73酚类愈创木酚13.4130.574 238.031 3 155.853 8 0.410.512.092,6-二叔丁基对甲酚Unknown———0.25——4-乙基愈创木酚122.741.548 0 2.199 8 2.281 2 0.190.270.28苯酚18 909.340.075 1 0.043 4 0.130 1 1.420.822.46其他类二甲基三硫0.3683.33 ——0.03——十四烷Unknown———0.03——乙酸160 0000.003 6—0.008 3 0.58—1.32其他类十六烷Unknown———0.120.080.252-十一酮40 0390.001 7——0.07——2-甲基萘Unknown———0.22——
3 结论
本研究成功从大曲和酒醅中分离筛选出高产TTMP的贝莱斯芽孢杆菌DQ-B102,并系统评价了其发酵特性及对酒醅微生物群落与风味物质的影响。通过透明圈初筛及液态发酵复筛,DQ-B102表现出最优的乙偶姻转化能力,其TTMP产量在液态发酵中达0.128 mg/L,固态发酵中提升至61.42 mg/L,显著优于其他候选菌株。分子鉴定结合形态学分析确认DQ-B102为贝莱斯芽孢杆菌(Bacillus velezensis)。在酱酒模拟发酵中,DQ-B102的接种显著提升TTMP产量,15%接种量时达144.18 mg/L,较对照组提高1.54倍,且通过抑制梭菌属等竞争菌群,优化了细菌群落结构,同时促进芽孢杆菌属、克罗彭斯特菌属等优势菌的富集。真菌群落中,当接种量提高至15%时,虽抑制酵母属与拉氏霉属,但曲霉属丰度提升至19.50%,可能协同增强酶活力与风味转化。挥发性物质分析表明,共检出34种挥发性风味物质,5%接种量组风味物质种类最丰富为32种,随着接种量提高,焦酱香贡献度上升。综上,DQ-B102通过高效产TTMP及调控菌群互作,为提升酱香白酒风味品质提供了优良菌种资源,其最佳应用策略需结合接种量对微生物平衡与风味多样性的综合调控。本研究为功能菌剂在传统发酵食品中的定向应用提供了理论依据。
[1] LI J, LU J, MA Z L, et al.A green route for high-yield production of tetramethylpyrazine from non-food raw materials[J].Frontiers in Bioengineering and Biotechnology, 2022, 9:792023.
[2] LIN J G, WANG Q Q, ZHOU S M, et al.Tetramethylpyrazine:A review on its mechanisms and functions[J].Biomedicine &Pharmacotherapy, 2022, 150:113005.
[3] MÜLLER R, RAPPERT S.Pyrazines:Occurrence, formation and biodegradation[J].Applied Microbiology and Biotechnology, 2010, 85(5):1315-1320.
[4] WANG G F, SHI C G, SUN M Z, et al.Tetramethylpyrazine attenuates atherosclerosis development and protects endothelial cells from ox-LDL[J].Cardiovascular Drugs and Therapy, 2013, 27(3):199-210.
[5] ZHANG M S, GAO F, TENG F M, et al.Tetramethylpyrazine promotes the proliferation and migration of brain endothelial cells[J].Molecular Medicine Reports, 2014, 10(1):29-32.
[6] BIAN Y Y, YANG L L, SHENG W, et al.Ligustrazine induces the colorectal cancer cells apoptosis via p53-dependent mitochondrial pathway and cell cycle arrest at the G0/G1 phase[J].Annals of Palliative Medicine, 2021, 10(2):1578-1588.
[7] XIONG X M, HU Y L, YAN N F, et al.PCR-DGGE analysis of the microbial communities in three different Chinese “Baiyunbian” liquor fermentation starters[J].Journal of Microbiology and Biotechnology, 2014, 24(8):1088-1095.
[8] 王晓丹, 王婧, 朱国军, 等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造, 2017, 36(1):55-60.WANG X D, WANG J, ZHU G J, et al.Isolation and identification of functional bacteria with high yield of tetramethyl pyrazine from Moutai-flavor high-temperature Daqu[J].China Brewing, 2017, 36(1):55-60.
[9] 史洪丽, 余梦婷, 王世昕, 等.高温大曲中高产四甲基吡嗪芽孢杆菌的筛选及其在酒醅堆积中的应用[J].中国酿造, 2025, 44(3):59-65.SHI H L, YU M T, WANG S X, et al.Screening of high yield tetramethylpyrazine Bacillus from high temperature Daqu and its application in the stacking of fermented grains[J].China Brewing, 2025, 44(3):59-65.
[10] 葛向阳, 李晓欢, 周庆伍, 等.浓香型白酒中高含四甲基吡嗪酿造工艺的研究[J].酿酒, 2018, 45(3):26-29.GE X Y, LI X H, ZHOU Q W, et al.Study on brewing process of high-containing tetramethylpyrazine in Luzhou-flavor liquor[J].Liquor Making, 2018, 45(3):26-29.
[11] 吴建峰, 徐岩.白酒细菌酒曲固态培养条件下B.subtilis S12产四甲基吡嗪的合成机制[J].食品与生物技术学报, 2014, 33(1):8-15.WU J F, XU Y.Formation mechanism of tetramethylpyrazine produced with B.subtilis S12 under the fermentation condition simulated bacterial Qu preparation used for Chinese liquor brewing[J].Journal of Food Science and Biotechnology, 2014, 33(1):8-15.
[12] 陈媛媛, 陈德茗, 李子健, 等.产乙偶姻菌株的分离鉴定及其对固态混菌发酵产物的影响[J].中国酿造, 2024, 43(3):84-89.CHEN Y Y, CHEN D M, LI Z J, et al.Isolation and identification of acetoin-producing strain and its effect on solid-state multi-microbial fermentation products[J].China Brewing, 2024, 43(3):84-89.
[13] 阮玉磊. 小曲清香型白酒合成微生物群落的构建[D].天津:天津科技大学, 2023.RUAN Y L.Construction of synthetic microbial community of xiaoqu qingxiang baijiu[D].Tianjin:Tianjin University of Science and Technology, 2023.
[14] 李晨瑶. 贝莱斯芽孢杆菌在酱香型白酒生产中的作用[D].天津:天津科技大学, 2023.LI C Y.The role of Bacillus velezensis in the production of jiangxiangxing baijiu[D].Tianjin:Tianjin University of Science and Technology, 2023.
[15] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 2015.SHEN Y F.Comprehensive Textbook on Baijiu Production Technology[M].Beijing:China Light Industry Press, 2015.
[16] 邢爽, 王亚平, 郭学武, 等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造, 2018, 37(2):24-28.XING S, WANG Y P, GUO X W, et al.Effects of fermentation conditions on ethanol fermentation and ester production of five ester-producing yeasts[J].China Brewing, 2018, 37(2):24-28.
[17] 陈梦圆, 李志军, 罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技, 2018(8):24-29.CHEN M Y, LI Z J, LUO A M.Screening and identification of strains with high yield of tetramethylpyrazine from high-temperature daqu[J].Liquor-Making Science &Technology, 2018(8):24-29.
[18] WANG C L, LI C Y, BIN Z Q, et al.Workshop environment heterogeneity shaped the microbiome and metabolome profiles during Xiasha round of Jiangxiangxing Baijiu[J].Food Chemistry:X, 2024, 22:101264.
[19] 王婧. 酱香大曲中产吡嗪类物质芽孢杆菌的筛选及其应用研究[D].贵阳:贵州大学, 2016.WANG J.Screening and application of pyrazine-producing Bacillus strains in Jiangxiang Daqu[D].Guiyang:Guizhou University, 2016.
[20] 姚粟, 葛媛媛, 李辉, 等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业, 2012, 38(6):1-6.YAO S, GE Y Y, LI H, et al.Analysis on bacterial communities in high temperature Daqu of sesame flavor liquor through culture-free approach[J].Food and Fermentation Industries, 2012, 38(6):1-6.
[21] 王光路, 张帆, 杨旭, 等.贾湖原香型白酒高温堆积过程原核微生物的消长规律研究[J].中国酿造, 2020, 39(11):30-35.WANG G L, ZHANG F, YANG X, et al.Growth and decline of prokaryotic microorganisms during high temperature stacking fermentation of the Jiahu original flavor Baijiu[J].China Brewing, 2020, 39(11):30-35.
[22] 梁晨, 杜海, 徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报, 2017, 44(2):384-393.LIANG C, DU H, XU Y.The succession of procaryotic microbial community and the flavor components in the storage process of Daqu[J].Microbiology China, 2017, 44(2):384-393.
[23] 蒲领平, 邓杰, 卫春会, 等.贝莱斯芽孢杆菌对小曲酒酿造过程中酵母菌生长及风味物质代谢的影响[J].中国酿造, 2023, 42(2):53-57.PU L P, DENG J, WEI C H, et al.Effects of Bacillus velesiensis on the growth and flavor metabolism of yeast during Xiaoqu Baijiu brewing[J].China Brewing, 2023, 42(2):53-57.
[24] 赵龙, 周池虹伶, 赵谋明, 等.解淀粉芽孢杆菌SWJS22和米曲霉混合制曲在酱油发酵中的应用[J].食品科学, 2017, 38(22):125-130.ZHAO L, ZHOU C H L, ZHAO M M, et al.Application of mixed cultures of Bacillus amyloliquefaciens SWJS22 and Aspergillus oryzae in soy sauce fermentation[J].Food Science, 2017, 38(22):125-130.
[25] ZHAO M, SU X Q, NIAN B, et al.Integrated meta-omics approaches to understand the microbiome of spontaneous fermentation of traditional Chinese Pu-erh tea[J].mSystems, 2019, 4(6):e00680-19.
[26] 马宁. 酱香型习酒特征香气成分鉴定及香气协同作用研究[D].上海:上海应用技术大学, 2021.MA N.Study on key aroma compounds and perceptual interaction among odorants in soy sauce aroma type Xi Baijiu[D].Shanghai:Shanghai Institute of Technology,2021.
[27] 刘发洋, 李璐, 游奇, 等.基于OAV分析多粮浓香型调味酒陈酿过程中风味物质的变化[J].中国酿造, 2023, 42(5):237-242.LIU F Y, LI L, YOU Q, et al.Changes of flavor substances of multi-grain strong-flavor flavouring liquor during the aging process based on OAV[J].China Brewing, 2023, 42(5):237-242.
[28] 聂士昊, 张志伟, 汪俊卿, 等.芽孢杆菌加强菌对酱香型白酒酒醅微生物群落及蛋白酶活力的影响[J].中国酿造, 2022, 41(8):137-142.NIE S H, ZHANG Z W, WANG J Q, et al.Effect of addition of Bacillus on microbial communities and protease activity of fermented grains of sauce-flavor Baijiu[J].China Brewing, 2022, 41(8):137-142.