白酒文化源远流长,共被细分为12种香型,其中浓香型白酒以其窖香浓郁,入口绵甜爽净、回味悠长等特点,而深受消费者欢迎。浓香型白酒的浓郁窖香主要源自窖泥中相关功能微生物的活动,在发酵过程中窖泥与接触位置的糟醅进行微生物和代谢物质的交流,直接或间接影响白酒的品质[1]。窖泥微生物能够产生酸类、酯类等挥发性物质,影响浓香型白酒的协调性和复杂性。己酸乙酯、乙酸乙酯、丁酸乙酯和乳酸乙酯为浓香型白酒中的四大酯,是浓香型白酒典型风格的重要香气化合物。窖泥所产四大酸(己酸、乙酸、丁酸和乳酸)则作为白酒四大酯的前体物质被重点关注。
细菌为窖泥中的主要功能菌,具有产酸增香的作用[1]。窖泥中功能细菌经过多轮发酵不断富集,进而形成复杂、稳定的群落结构。据研究,乳杆菌属(Lactobacillus)在新窖泥中占有优势地位,这会导致窖泥pH降低,进而使得菌群失衡和酒体中的乳酸乙酯与己酸乙酯的比例失调[2]。随着发酵进行,乳杆菌属丰度随窖龄增加下降,有助于维持发酵体系的稳定。老窖泥中产甲烷菌属(Methanogenus)、梭菌属(Clostridium)、己酸菌属(Caproiciproducens)、互营单胞菌属(Syntrophomonas)等细菌菌属含量较高[3]。其中梭菌属、己酸菌属能够合成己酸,有助于白酒中的窖香呈味物质己酸乙酯的生成[4];产甲烷菌能够利用产酸功能细菌产生的H2解除氢抑制,促进酸类和酯类物质生成[5]。因而相较于新窖泥,经驯化的老窖泥具有较好的发酵功能。作为窖泥微生物群落变化的重要动态驱动力,每一轮次的发酵过程均改变窖泥微生物的组成与丰度,这些变化持续累积,共同完成了窖泥的驯化进程。发酵后窖泥细菌中乳杆菌属相对丰度下降,产酸微生物(己酸菌属和梭菌属等)得到富集,在连续批次间酿造活动的影响下,窖泥的微生物群落转向有规律、有方向的进化模式[6]。因此深入剖析发酵过程中微生物的动态变化规律,对精准解析窖泥的驯化机制至关重要。模拟实验表明窖泥在单轮次发酵中群落结构同样存在演替,梭菌属和己酸菌属相对丰度在发酵初期含量剧烈增加,乳杆菌属先增加后减少[3]。
目前研究在一定程度上揭示了发酵过程中窖泥微生物群落的演替方向,但仍缺少在实际发酵中对窖泥细菌群落动态规律的阐述。发酵中需要密封窖池,因此难以在不干扰发酵进程的前提下取样。对此本研究应用埋入式窖泥取样器,对发酵中的窖泥进行实时取样,解析窖泥细菌群落结构和挥发性物质的动态变化规律,从发酵过程中找寻细菌与挥发性物质的作用关系。以期为实际生产过程中开展窖泥配制工作提供理论支持。
1 材料与方法
1.1 材料与试剂
窖泥样品采集自白酒厂浓香型窖池,选取发酵0、5、15、25、45、60 d为取样时间点。采用长12 cm,直径2 cm,连1.5 m铁丝的多孔圆柱取样器进行取样,多孔结构保证取样器内外的物质交流,通过铁丝取出,对窖池破坏小、取样便捷。如图1所示,发酵前将取样器埋入深度为1 m处的30 cm×20 cm的池壁居中位置,取出样品于无菌密封袋密封、混匀,于-20 ℃保存。
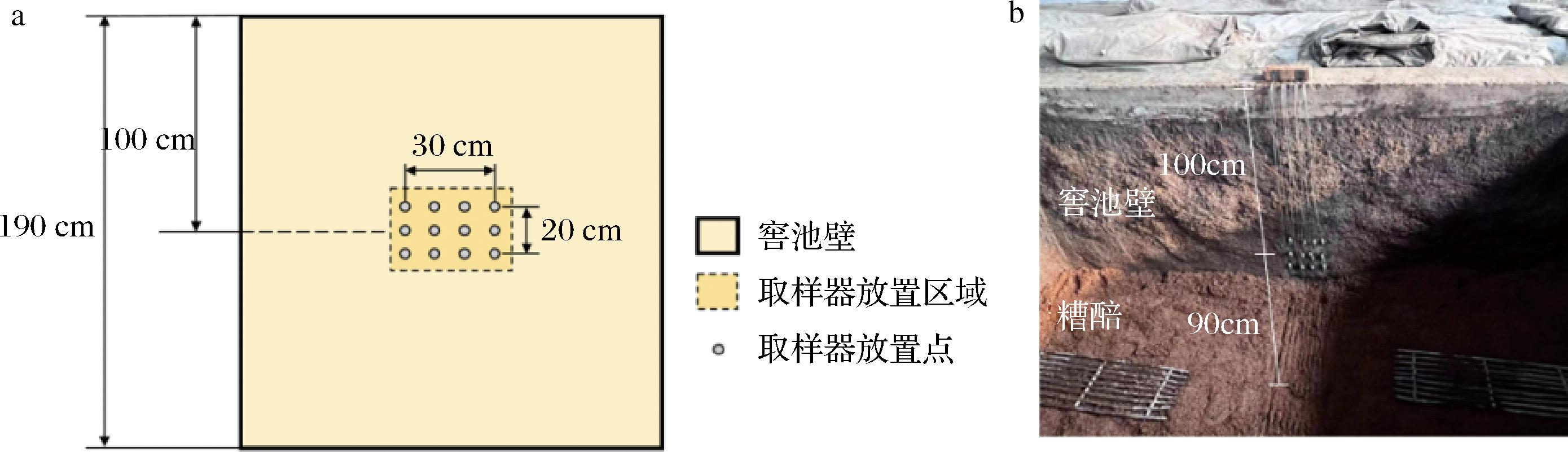
a-取样示意图;b-实际取样器埋入图
图1 埋入取样器使用详解图
Fig.1 Detailed diagram of embedded sampler usage
甲醇、异丙醇、K2HPO4,上海麦克林生化科技股份有限公司;乙酸戊酯,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Illumina MiSeq测序平台,上海美吉生物医药科技有限公司;DH-20008高速台式冷冻离心机,上海德洋意邦仪器有限公司;AL204型精密电子天平,梅特勒-托利多仪器公司;固相微萃取三相萃取头(DVB/C-WRPDMS)、GC色谱柱:TR-WAXMS毛细管色谱柱(60 m×0.25 mm×0.25 μm),美国赛默飞公司;多功能自动进样器,广州智达公司;Clarus 690/Clarus 5Q 8T气相色谱-质谱联用仪(GC-MS)、Clarus 690气相色谱仪(GC)、LC 300液相色谱仪(HPLC),美国PerkinElmer公司;GC-MS色谱柱:DB-WAX(60 m×0.25 mm×0.25 μm)毛细管色谱柱,美国Agilent公司;HPLC色谱柱:JadeCore AC C18(5 μm×4.6 mm×250 mm),北京谱奥达科技有限公司。
1.3 实验方法
1.3.1 高通量测序及数据处理
样品采集后低温保存,用土壤DNA提取试剂盒提取基因组DNA,验证合格后,委托上海美吉生物医药科技有限公司采用通用引物338F/806R(5′-ACTCCTACGGGAGGCAGCA-3′和5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rDNA V3V4可变区,构建高通量测序文库及进行Illumina MiSeq双端测序。
1.3.2 挥发性物质测定及分析
参考的徐相辉等[7]的方法并稍作修改,GC内标法定量丁酸、己酸和乙酸;HPLC法测定乳酸。准确称取1 g窖泥用9 mL溶剂涡旋混匀,气相溶剂为50%(体积分数)甲醇溶液,液相溶剂为15%(体积分数)甲醇溶液。将混匀溶液进行超声波处理、离心,上清液通过0.22 μm过滤。气相法:进样量1 μL,载气He,分流比10∶1,流速1 mL/min,进样口温度250 ℃。升温条件:初始温度35 ℃保持2 min,2 ℃/min升温至60 ℃,保持4 min,6 ℃/min升温至195 ℃,保持20 min。液相法:采用光电二极管阵列(photodiode array,PDA)检测器,波长210 nm,进样量15 μL。流动相:KH2PO4溶液(0.01 mol/L)∶甲醇=95∶5(体积比),流速0.6 mL/min。
参考LI等[8]的方法并稍做修改,用顶空-固相微萃取-气相色谱-质谱(headspace-solid phase microextraction,HS-SPME-GC-MS)测定挥发性物质。HS-SPME条件:称取1.0 g窖泥于顶空瓶中,加入0.5 g NaCl、0.9 mL 5%(体积分数)乙醇和100 μL内标(乙酸戊酯,207.64 mg/L),在50 ℃振荡孵育30 min。萃取吸附30 min,240 ℃解析5 min。GC条件:初始35 ℃保持2 min,3 ℃/min升温至150 ℃,4 ℃/min升温至200 ℃,8 ℃/min升温至240 ℃,保持10 min;进样口温度250 ℃,离子源温度230 ℃;载气为He,流速1 mL/min,分流比5∶1。MS条件:EI电离方式,电子能量70 eV,离子源温度250 ℃,传输线温度230 ℃。采用全离子扫描方式,扫描范围35~450 amu。根据NIST 20标准谱库定性,筛选相似指数>800的挥发性化合物。根据内标含量及峰面积进行半定量分析,按照刘登勇等[9]的方法计算挥发性物质的相对气味活度值(relative odor activity value,ROAV)。
1.3.3 统计分析
细菌群落结构分析基于上海美吉生信云平台(https://cloud.majorbio.com/)进行,通过R语言进行微生物相关性网络构建和进行冗余分析(redundancy analysis,RDA),采用Gephi 0.10.1进行可视化表达。采用Excel 2016、SPSS26.0进行数据分析,通过单因素方差分析(one-way analysis of variance,ANOVA)确定数据间差异显著性(P<0.05)。使用Origin 2022 Pro绘制折线图、Tbtools绘制热图、SIMCA 14.1进行主成分分析(principal component analysis,PCA)和正交偏最小二乘回归分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)。
2 结果与分析
2.1 发酵过程中窖泥挥发性物质和理化变化规律
2.1.1 发酵过程中窖泥挥发性物质组成及变化规律
白酒的质量与风味直接受酸类和酯类的含量及二者量比关系的影响。靠近窖泥糟醅的挥发性物质受到窖泥微生物的代谢影响,既直接贡献于白酒酒体又间接作为风味前体进一步生成呈香物质。因此测定窖泥挥发性物质能够一定程度反映窖泥的功能。窖泥中共检出47种挥发性物质,其中:酯类(31种)>醇类(8种)>酸类(4种)>醛(2种)=酚(1种)=吲哚(1种)。相较于发酵开始时,发酵结束后,除辛酸乙酯、乳酸乙酯、壬酸乙酯、乙酸乙酯外,所有酯和酸类物质含量显著上升,除对甲基苯酚、吲哚和3-甲基吲哚外所有醛、醇、酚和吲哚含量显著下降(P<0.05)。对发酵过程中挥发性物质进行聚类分析(图2),挥发性物质根据聚类被分为5类,其中A类包含所有醇类,D聚类包含所有酸类,其余分类簇则主要包含酯类。除吲哚外的醇、醛、酚和吲哚类物质都集中于A聚类,在5 d达到最大值,发酵结束后含量提高153%~302%不等。B、E、F聚类中除吲哚外都为中链脂肪酸酯,含量先上升后下降,主要在5~25 d累积。C、D聚类中的物质则基本在25~60 d累积,其中D聚类中除酯类外包含4种酸类物质。对不同发酵时期的聚类分析表明,挥发性物质在发酵过程中可以被分为发酵前期(0~5 d)和发酵后期(15~60 d)2个时期。ZHUANSUN等[10]研究发现,根据酒醅挥发性物质也可以将发酵分为发酵前期(0~10 d)和发酵后期(12~79 d)2个时期。糟醅中也有类似的规律,醇类化合物在发酵20 d时达到最高含量,己酸乙酯和乳酸乙酯等酯类化合物的含量在发酵50~70 d达到最大值[11],这是因为在发酵前期糟醅中的微生物代谢生成前体物质,进而在发酵后期发生酯化反应。糟醅和窖泥的挥发性物质在发酵中的演变规律相似,在发酵过程中二者存在动态交流。综上所述,发酵过程中窖泥挥发性物质中,醇类物质主要于发酵前期增加,酯类物质主要于发酵后期增加。
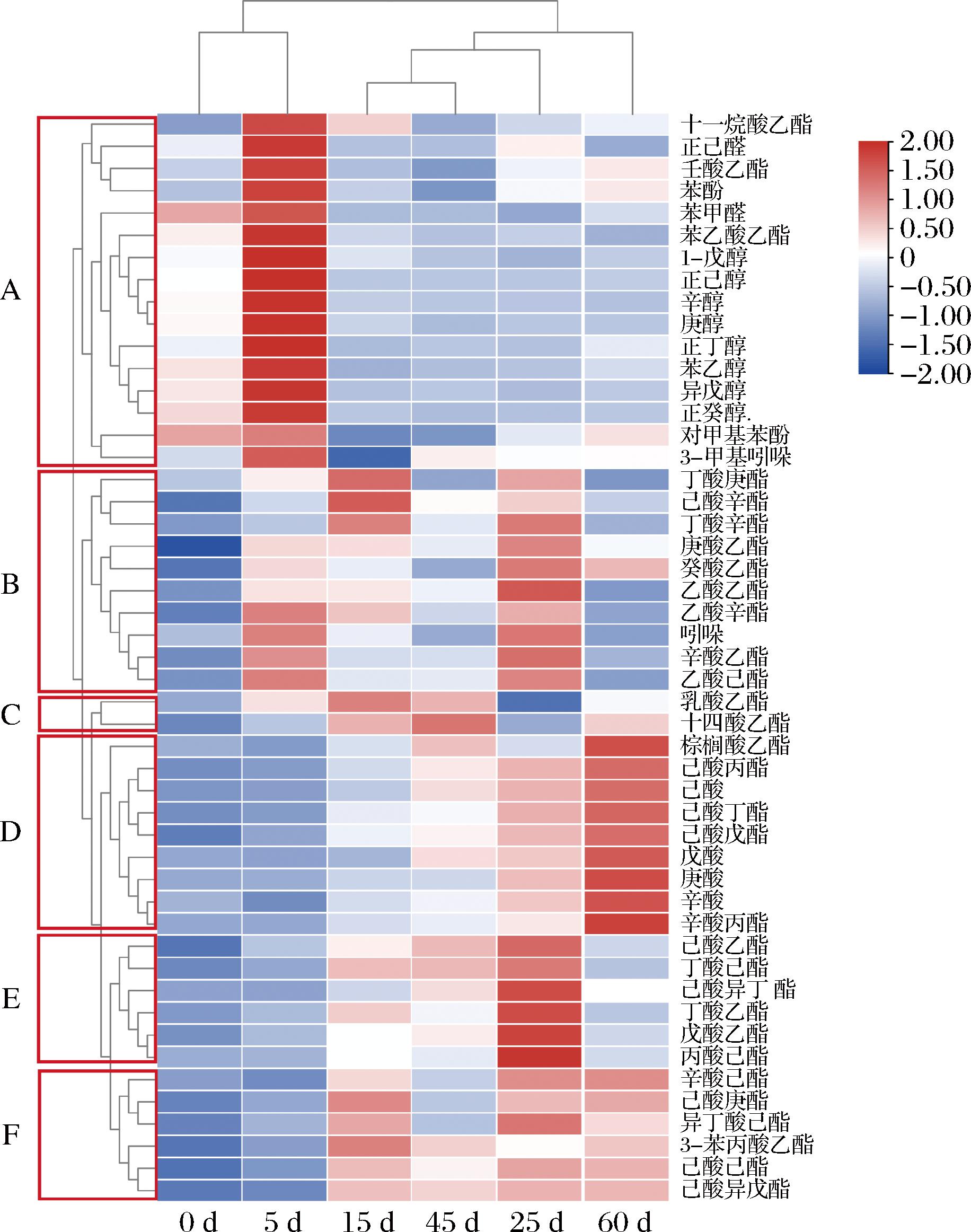
图2 发酵过程中窖泥挥发性物质聚类热图
Fig.2 Cluster heat map of volatile compounds in pit mud during fermentation
注:A~F表示窖泥挥发性物质聚类簇。
为探究风味物质随发酵时间增加的演替规律,对样品数据进行PCA。如图3-a所示,PC1和PC2共解释了72.5%的变化,随发酵时间增加,样本点呈现顺时针演替,发酵前期样本点分散于负半轴,发酵后期样本点紧密分布于正半轴。这表明挥发性物质在发酵前期和发酵后期各自挥发性物质更相似,而2个发酵时期之间存在较大差异。
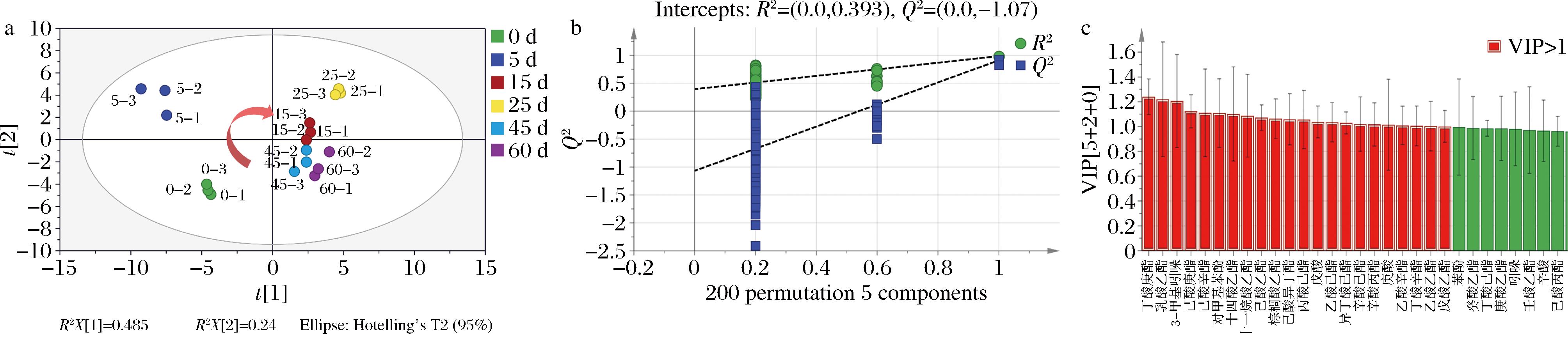
a-PCA得分图(椭圆表示95%置信区间);b-OPLS-DA 200次置换检验结果;c-OPLS-DA VIP值
图3 挥发性物质的PCA和OPLS-DA结果
Fig.3 PCA and OPLS-DA results of volatile compounds
通过构建OPLS-DA模型并计算模型的变量重要性投影(variable importance in projection,VIP),筛选发酵中出现差异的挥发性物质。一般认为VIP>1的物质可以作为组间潜在的差异物质。模型中R2X=0.981、R2Y=0.984、Q2=0.927,表明模型具有较好解释率;通过200次置换检验,证明模型不存在过拟合现象(图3-b)。以VIP>1,P<0.05为条件,筛选得到关键挥发性物质包括18种酯类、2种酸类、1种吲哚和1种酚类物质,主要为酯类,并未筛选到醇类物质(图3-c)。其中,十一烷酸乙酯、对甲基苯酚、3-甲基吲哚的主要于发酵前期生成;丁酸庚酯、己酸辛酯、丁酸辛酯、乙酸乙酯、乙酸辛酯、己酸乙酯、己酸异丁酯、戊酸乙酯、丙酸己酯、乙酸己酯、乳酸乙酯、十四酸乙酯、棕榈酸乙酯、戊酸、庚酸、辛酸丙酯、辛酸己酯、己酸庚酯、异丁酸己酯的主要于发酵后期生成。
在发酵前期的关键挥发性物质中对甲基苯酚和3-甲基吲哚具有粪臭和皮革臭味,发酵后期的关键挥发物质主要为呈香的酯类。DONG等[12]通过缺失重组试验发现对甲基苯酚、3-甲基吲哚和丁酸等化合物是白酒中“泥臭味”的主要来源,这些物质会对白酒的感官品质产生显著的负面影响,破坏其风味的协调性和复杂性。酸、酯的合成与窖泥中的微生物代谢相关,对糟醅中挥发性物质与窖泥来源微生物进行相关性分析表明,窖泥来源微生物主要与酸类和酯类物质呈正相关。醇类物质是窖泥主要挥发性成分之一,在糟醅中醇类物质主要在发酵0~42 d快速增长[13]。高江婧[14]的模拟实验发现,无窖泥发酵组的乙醇、异丁醇、异戊醇等醇类物质含量显著高于窖泥发酵组,这是因为窖泥中的菌群产酸抑制了酵母的生长。因此窖泥具有部分醇类代谢功能,但窖泥中的醇类物质主要来源是糟醅而非自身微生物的代谢。综上,窖泥关键挥发性物质的变化以发酵后期生成的酯类为主,与醇类物质的生成关系较小。
2.1.2 发酵过程中窖泥四大有机酸变化规律
乙酸、丁酸、己酸和乳酸既作为白酒四大酯(乙酸乙酯、丁酸乙酯、己酸乙酯和乳酸乙酯)的前体物质,也能直接影响白酒风味。产酸为研究中普遍认为的窖泥主要功能,因而对窖泥四大酸的动态变化规律研究尤为重要。采用GC法绝对定量窖泥中四大酸含量如图4所示,四大酸总量在发酵中整体呈现增加趋势,在发酵前期显著增加,发酵后期维持稳定,由最初的8 873 mg/kg升至18 142 mg/kg。在发酵前期丁酸和乳酸含量维持稳定,乙酸和己酸含量持续增加;在发酵后期乙酸和乳酸含量显著增高后降低,丁酸和己酸含量显著升高后维持稳定至发酵结束。同时观察到丁酸、乳酸、己酸和乙酸含量在发酵后均显著升高(P<0.05)。在糟醅中,乙酸、丁酸和己酸在发酵过程中先增加后减少,丁酸在发酵过程中变化不大[11]。综上,窖泥挥发性物质具有“先醇后酸、酯”变化规律,醇类物质主要于发酵前期增加,酯类和酸类物质主要于发酵后期增加。
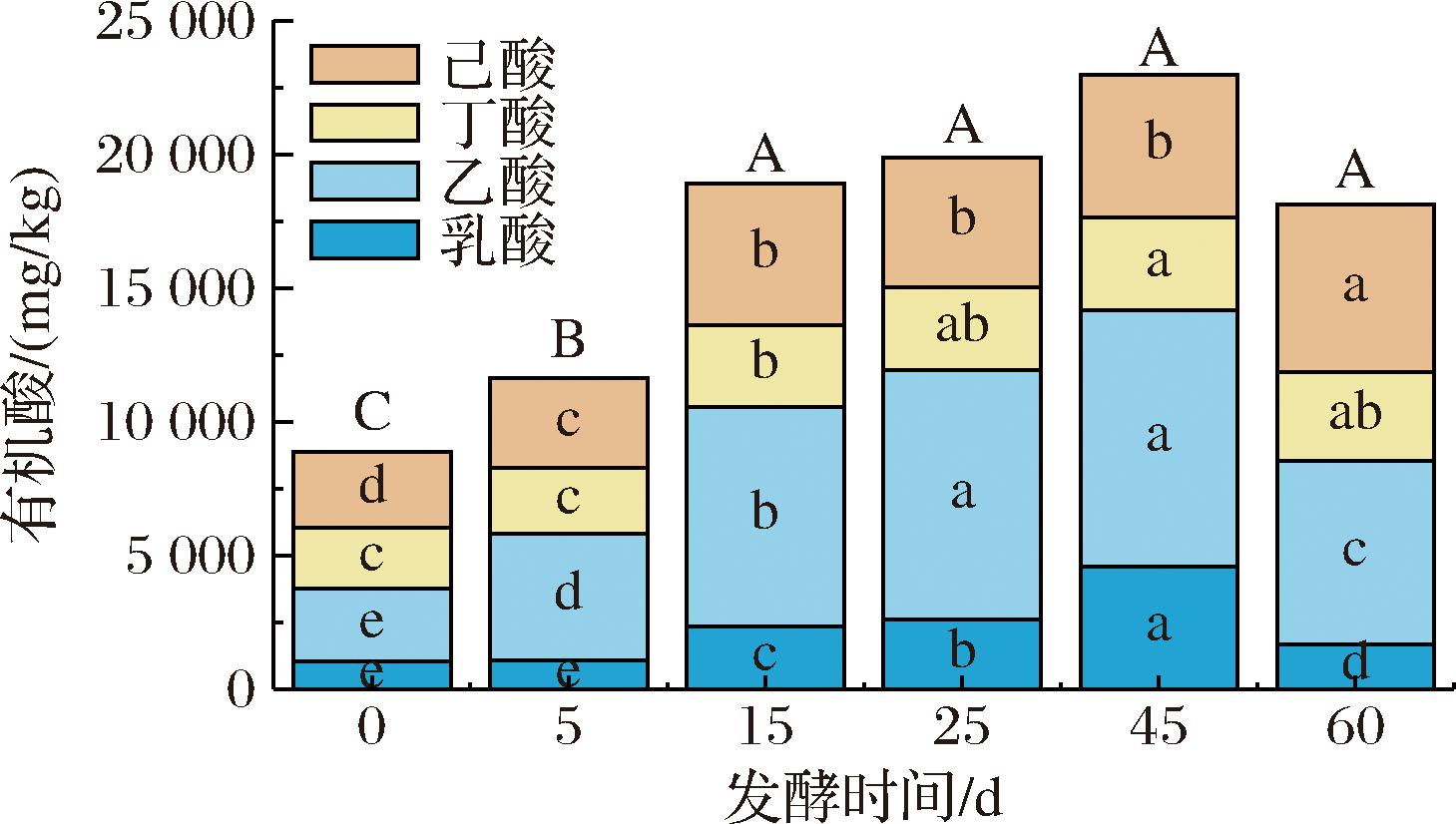
图4 窖泥发酵过程中有机酸变化
Fig.4 Changes of organic acids in pit mud during fermentation
注:不同颜色区域小写字母表示相应有机酸含量存在显著差异(P<0.05);不同大写字母表示四大酸总量存在显著差异(P<0.05)。
2.2 发酵过程中窖泥细菌群落变化规律
2.2.1 发酵过程中窖泥细菌群落多样性分析
窖泥中的挥发性物质由微生物代谢产生,其细菌群落的多样性和结构对白酒酿造功能具有显著影响。6个样本经16S rRNA测序共获得1 264 630条细菌有效序列,由表1可知,所有样本覆盖率均达到99%以上,由此认为测序结果可以反映窖泥细菌群落全部信息。细菌丰富度指数(Ace和Chao1)在发酵中0~5 d变化较大,在15~60 d变化较小,具体表现为发酵过程中在5 d显著下降(P<0.05)后再15 d上升,随后在15~60 d持续下降。细菌多样性(Shannon和Simpson指数)在发酵前后无显著变化(P>0.05)。
表1 窖泥发酵过程中窖泥细菌群落α多样性
Table 1 α diversity of bacterial community in pit mud during fermentation
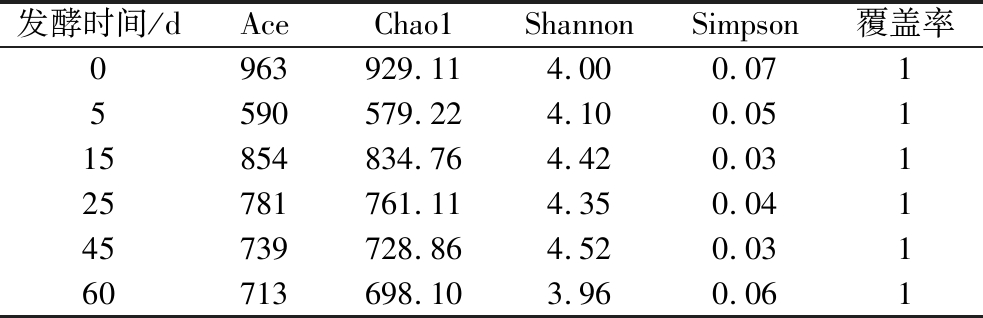
发酵时间/dAceChao1ShannonSimpson覆盖率0963929.114.000.0715590579.224.100.05115854834.764.420.03125781761.114.350.04145739728.864.520.03160713698.103.960.061
采用基于Bray-Curtis距离的主坐标分析(principal coordinates analysis,PCoA)和样本层级聚类分析对于细菌群落β多样性进行分析(图5),以展现细菌群落组成差异。在PCoA中(图5-a)可观察到随着发酵的进行窖泥细菌群落出现显著变化(P=0.001),样本点随时间进行在坐标中呈逆时针方向变化,说明细菌群落具有明显的时间演替规律。进一步样本层级聚类结果显示(图5-b)发酵过程细菌群落可聚为2个类,由此可将细菌群落变化过程初步分为发酵前期(0~5 d)和发酵后期(15~60 d),相同发酵时期内细菌群落组成具有相似性,这与风味物质的演替阶段一致。
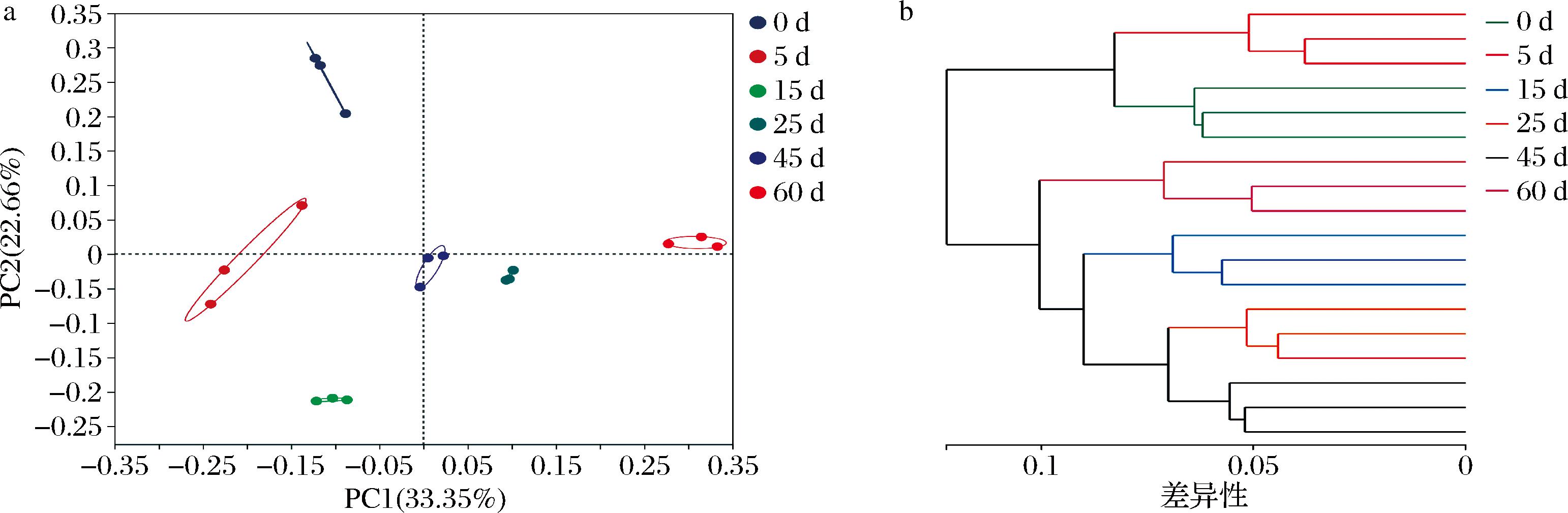
a-发酵过程中窖泥细菌群落PCoA;b-发酵过程中窖泥样本层级聚类分析
图5 发酵过程中窖泥细菌群落β多样性分析
Fig.5 β Diversity of bacterial community in pit mud during fermentation
本研究发现,窖泥细菌群落在发酵前期丰富度显著下降同时群落多样性增加,细菌群落变化剧烈,发酵后期则变化较小,这与浓香型白酒发酵过程中糟醅和黄水的细菌群落变化规律一致。胡晓龙等[15]将糟醅发酵过程分为发酵前期、中期和后期3个过程,前期细菌群落具有较高丰富度和多样性,乳酸菌属则是发酵中后期的绝对优势菌属。MU等[16]对发酵过程中酒醅微生物群落的研究表明,发酵0~15 d微生物群落演变剧烈,15~80 d微生物群落结构趋于稳定。曾波等[17]通过研究黄水细菌群落变化同样发现,发酵前期群落多样性和丰富度显著变化,发酵后期则较为稳定。综上,无论从挥发性物质还是细菌群落结构变化浓香型白酒窖内发酵过程均可以分为2个时期,在发酵前期窖内发酵状态剧烈变化,发酵后期趋于稳定。
2.2.2 发酵过程中窖泥细菌群落演替规律
接下来进一步阐述发酵过程中细菌群落组成变化。相对丰度>1%的细菌门有6个(图6-a),其中厚壁菌门(Firmicutes,64.29%)>拟杆菌门(Bacteroidota,24.63%)>变形菌门(Proteobacteria,4.35%),相对丰度之和占每个样品90%以上,是发酵过程中的主要优势菌门,这与已报道的窖泥细菌结构相似[2]。发酵前期厚壁菌门含量由50.35%上升至69.7%、变形菌门含量由19.65%下降至极低水平(0.009%)、拟杆菌门相对丰度维持稳定。而到了发酵后期,厚壁菌门、变形菌门和拟杆菌门的相对含量均保持相对稳定。
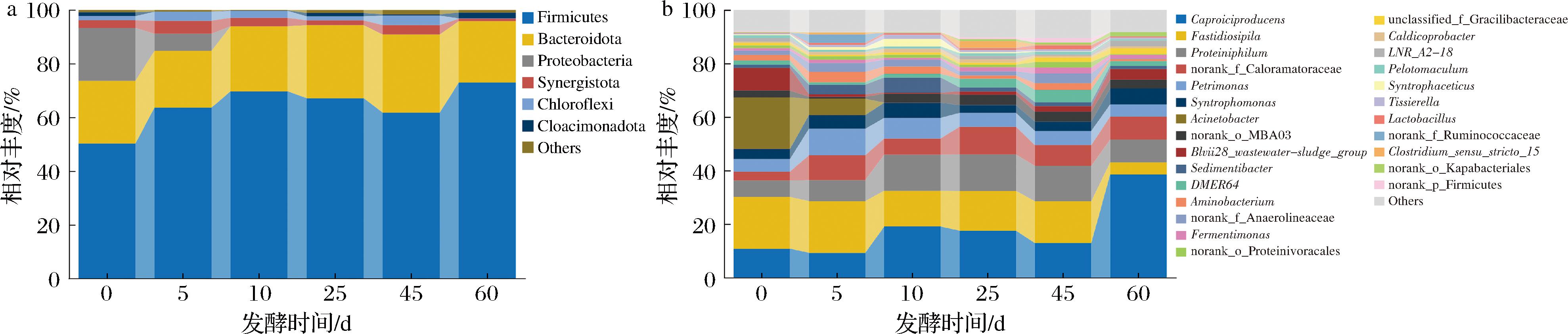
a-门水平;b-属水平
图6 发酵过程中窖泥细菌群落门水平和属水平物种组成
Fig.6 Species composition of pit mud bacterial community at phylum and genus levels during fermentation
如图6-b所示,整个发酵阶段属水平共检出26个优势细菌菌属(平均相对丰度≥1%),包括己酸菌属(Proteiniphilum,18.02%)、Fastidiosipila(14.51%)、嗜蛋白质菌属(Proteiniphilum,10.46%)、理研菌属(Petrimonas,6.22%)、共养单胞菌属(Syntrophomonas,4.49%)、不动杆菌属(Acinetobacter,4.22%)、Blvii28_wastewater-sludge_group(2.86%)等。发酵前期的主要优势菌属为己酸菌属、Fastidiosipila和不动杆菌属(>10%),平均相对丰度分别为10.04%、19.31%和12.64%。在发酵后期不动杆菌消失,Fastidiosipila和己酸菌仍保持优势地位,同时嗜蛋白质菌属含量上升成为主要优势菌属(>10%),平均相对丰度分别为20.98%、12.73%和11.75%。
除主要菌属外,优势菌属中存在具有发酵功能的细菌。乳杆菌属通常在新窖泥中含量较高,其代谢产生的乳酸和乙酸也是乳酸乙酯的代谢前体物质。己酸菌属被认为是窖泥的主要功能菌属,能够产生己酸,促进衍生物己酸乙酯的生成代谢。理研菌属、共养单胞菌属和嗜蛋白质菌属具有产乙酸、丁酸的能力,一定程度上白酒风味成分的形成相关[3]。Blvii28_wastewater-sludge_group可能具有生成CO2、H2和乙酸的能力[18],但在白酒中的作用尚不明晰。对梭菌属的分离和模拟发酵发现,其能代谢产生乙酸、丁酸和己酸[19]。这些功能菌属在发酵过程中变化趋势如下。在发酵前期,共养单胞菌属、理研菌属和乳杆菌属相对丰度上升,分别由3.82%上升至5.67%、4.69%上升至7.82%和由0.12%上升至0.58%。Blvii28_wastewater-sludge_group由8.12%下降至0.36%。在发酵后期,共养单胞菌属先下降后上升至5.92%,理研菌属维持稳定发酵结束(4.53%),乳杆菌属先上升后下降至0.39%,Blvii28_wastewater-sludge_group稳定上升至4.06%。Clostridium_sensu_stricto_15先上升后下降,在发酵25 d达到最大值。
基于窖泥挥发性物质和细菌群落的动态变化,发酵过程可分为发酵前期和发酵后期2个阶段。基于对群落结构的分析,可以发现发酵前期群落结构呈现显著变化,发酵后期群落结构趋于稳定,变形菌门的下降和厚壁菌门的升高是造成2个发酵时期差异的主要差异。
变形菌门在退化窖泥和未经驯化的新窖泥中常具有较高丰度,其含量下降可能表征窖泥细菌群落结构正向的演替趋势。变形菌门在发酵过程中的变化主要是不动杆菌在发酵初期相对丰度的显著下降导致的。相关研究表明,发酵初期酒醅中不动杆菌属相对丰度也出现明显下降[20]。有研究证明,浓香型白酒窖池内O2浓度在5 d达到最低[21],且不动杆菌属为兼性厌氧的革兰氏阴性杆菌,推测是封窖造成的无氧环境抑制了不动杆菌属等兼性厌氧菌和其他好氧细菌的生长。TAO等[2]发现,厚壁菌门为窖泥驯化一年后的主要菌门(95.7%),是窖泥环境筛选的最适微生物,发酵过程中厚壁菌门相对丰度的增加可能为窖泥带来更强的产香能力。厌氧条件有利于己酸菌属、梭菌属、乳杆菌属等具有产酸功能的厚壁菌门厌氧菌属的生存。新窖泥经过四轮次发酵驯化后则富集了梭菌属、芽孢杆菌属和产己酸菌属等产酸功能细菌,有机酸代谢更活跃[22]。本研究中己酸菌属丰度在发酵后显著升高,拟杆菌门中的共养单胞菌属和嗜蛋白质菌属等产酸功能细菌相对丰度波动增加,因此发酵对窖泥中的产酸功能细菌具有一定富集作用。总的来说,可能是封窖造成的无氧环境抑制了兼性厌氧菌不动杆菌属和其他好氧细菌的生长,同时功能厌氧菌属丰度增加,推动了发酵前期细菌结构的演化。
接下来通过网络模型,解析窖泥细菌群落中的关键微生物、探究细菌结构演替的原因。基于窖泥发酵过程细菌菌属间相关性,构建微生物相关性网络以明析细菌群落结构及核心微生物。如图7所示,微生物相关性网络共获得58个结点和231条边,细菌间主要为协同作用,细菌菌属之间正相关关系占69.7%,仍存在30.3%的负相关关系。在负相关关系中发现,变形菌门与其他菌门均存在负相关性,且为发酵前期的主要优势菌属。因此认为拮抗作用是推动2个时期细菌群落结构演变的原因之一,细菌的相互作用能够在窖泥演化中起到稳定细菌群落结构的作用。窖泥长期驯化中同样存在厚壁菌门增多、变形菌门减少的菌群结构演变趋势,这表明微生物之间的相互作用是推动窖泥微生物群落演化的原因之一。

图7 发酵过程中微生物网络分析
Fig.7 Microbial network analysis during fermentation
进一步通过筛选关键物种探究影响窖泥细菌群落稳定结构的物种,筛选条件为:度(degree,≥8)、接近中心性(closeness centrality,≥0.5)和中介中心性(betweenness centrality,≤25)[23]。结果表明高丰度的优势菌属(氨基杆菌属、己酸菌属、理研菌属、嗜蛋白质菌属和互营乙酸菌属(Syntrophaceticus)的移除会对细菌群落结构产生较大不良影响。相对丰度<1%的细菌菌属中,氢孢菌属、中温厌氧杆菌属、鞘氨醇单胞菌属(Sphingomonas)和盐原体属(Haloplasma),同样对维持细菌群落结构稳定性起到关键作用。
综上,在发酵过程中,变形菌门与其他菌门的拮抗作用不仅推动了细菌群落的演替,还可能通过竞争资源影响窖泥中酸类和酯类物质的生成。例如,变形菌门的减少可能为厚壁菌门中的产酸菌属(如己酸菌属)提供了更多的生态位,从而促进了酸类物质的积累。同时,己酸菌属和嗜蛋白质菌属作为窖泥中的关键物种,不仅在产酸过程中发挥关键作用,还通过协同作用维持了细菌群落的稳定性,这对窖泥的长期驯化和白酒风味的形成具有重要作用。
2.3 窖泥发酵过程中挥发性成分与细菌相关性分析
为确定窖泥细菌对挥发性物质影响关系,将相对丰度≥1%的优势细菌菌属与四大酸以及关键挥发性物质进行相关性分析(图8)。代谢合成有机酸是窖泥的主要发酵功能,主要通过窖泥细菌菌属的代谢功能实现。己酸菌属与己酸和丁酸有着显著正相关性。嗜蛋白质菌属、DMER64、乳杆菌属和Fermentimonas与乳酸、乙酸和丁酸有显著正相关性。Clostridium_sensu_stricto_15与乳酸和乙酸有显著正相关性。Fastidiosipila与丁酸和己酸,不动杆菌属与己酸、乙酸、丁酸和乳酸有显著的负相关性。在差异挥发性物质的相关性分析中,己酸菌属与戊酸和庚酸呈正相关,不动杆菌属、氨基杆菌属和Fastidiosipila与戊酸和庚酸呈负相关。酸类物质是酯类物质生成的前体物质,窖泥细菌的有机酸代谢有助于酯类物质的积累:Clostridium_sensu_stricto_15、Caldicoprobacter、Tissierella、嗜蛋白质菌属、乳杆菌属和己酸菌属与酯类差异挥发性成分有较多正相关关系;互营乙酸菌属、Christensenellaceae_R-7_group、DMER64、LNR-A2-18和理研菌属与沉积杆菌属(Sedimentibacter)与少量酯类物质呈正相关性。Blvii28_wastewater-sludge_group、不动杆菌属、氨基杆菌属和Fastidiosipila对酯类关键挥发性物质则有较多负相关关系。乳酸乙酯与细菌之间未发现显著相关性。3-甲基吲哚与Fermentimonas有正相关性;对甲基苯酚与不动杆菌属和Fastidiosipila存在显著正相关,与嗜蛋白质菌属、乳杆菌属存在显著负相关性。

a-有机酸相关性分析;b-关键挥发性物质相关性分析
图8 发酵过程中挥发性物质与细菌相关性分析
Fig.8 Correlation analysis between volatile compounds and microorganisms in fermentation process
注:*表示0.01<P<0.05;**表示0.001<P<0.01;***表示P<0.001。
窖泥中的细菌结构随发酵进行而动态调整,而具有产酸等发酵功能的细菌活动是窖泥功能实现的基础。结果表明,己酸菌属、嗜蛋白质菌属、DMER64、乳杆菌属和Clostridium_sensu_stricto_15与有机酸和较多酯类物质存在正相关关系,是发酵过程中的主要功能菌属。同时己酸菌属和嗜蛋白菌属作为核心细菌,在窖泥产酸功能的实现和细菌群落结构的稳定性维持方面均具有关键作用。Caldicoprobacter、Tissierella、互营乙酸菌属、Christensenellaceae_R-7_group、LNR-A2-18有助于酯类物质的生成。不动杆菌属、氨基杆菌属、Fastidiosipila和Blvii28_wastewater-sludge_group可能不利于酯类物质的生成。
窖泥的质量下降常伴随窖“泥臭味”的出现,吲哚、3-甲基吲哚、芴和4-甲基苯酚是窖泥“泥臭味”形成的关键化合物。刘燕[24]研究发现梭菌属为对甲基苯酚的主要微生物来源,并且认为对甲基苯酚产生前体物质为酪氨酸。本研究发现,不动杆菌属和Fastidiosipila与对甲基苯酚呈正相关性。徐相辉等[7]发现在窖泥细菌与挥发性物质的相关性研究中,Fastidiosipila与酸类物质呈负相关。因此在发酵中不动杆菌属和Fastidiosipila的活动可能对窖泥挥发性物质的产生有负面影响。不动杆菌属主要于发酵前期活动,异味物主要于发酵前期产生,因此发酵前期不动杆菌属等菌属的活动可能导致窖泥异味的生成。嗜蛋白质菌属和乳杆菌属与对甲基苯酚生成呈负相关关系,可能受微生物网络中二者与不动杆菌属有较强的负相关性影响。Fermentimonas与能降解碳水化合物和复杂蛋白质[25],蛋白质的降解产物色氨酸是3-甲基吲哚的前体物质。本研究中Fermentimonas与3-甲基吲哚呈正相关关系,可能不利于窖泥的气味质量。因此,发酵前期窖泥“泥臭味”相关的挥发性物质的产生可能与不动杆菌属等细菌群落活动相关。己酸菌属、嗜蛋白菌属、乳杆菌属、不动杆菌属、Fastidiosipila和Fermentimonas可以作为判断窖泥潜在功能的生物指标。
3 结论
本研究深入探究浓香型白酒窖泥发酵过程,揭示了挥发性物质和细菌群落结构的动态变化规律及其内在联系,同时提出了判断窖泥潜在功能的微生物指标。通过样本聚类和变化规律,挥发性物质在发酵过程中的变化可以分为发酵前期(0~5 d)和发酵后期(15~60 d)2个时期,呈“先醇后酸、酯”规律,醇类在发酵前期增加,酸类和酯类在发酵后期增加,2个时期间的挥发性物质差异明显。细菌多样性在发酵中先升后降,变化过程同样可分为发酵前后2个时期,发酵前期群落结构变化显著,发酵后期趋于稳定。通过微生物共现网络的分析发现,变形菌门与其他菌门的拮抗作用则是推动2个发酵时期转变的因素之一。优势菌属和相对丰度<1%的菌属,都能在维持细菌群落结构稳定性方面发挥关键作用。同时发酵对窖泥中的产酸功能细菌具有一定富集作用。己酸菌属、嗜蛋白质菌属、DMER64、乳杆菌属、Fermentimonas和Clostridium_sensu_stricto_15有助于有机酸和酯类物质的生成,而Blvii28_wastewater-sludge_group等可能不利于酯类生成。此外,Fermentimonas、不动杆菌属和Fastidiosipila与窖泥异味物质生成相关,不利于窖泥质量。
[1] 张会敏, 孟雅静, 王艳丽, 等.浓香型白酒窖泥菌群结构、菌种功能及其改良研究进展[J].现代食品科技, 2020, 36(10):331-340.ZHANG H M, MENG Y J, WANG Y L, et al.Research advances in the pit mud microbial community structure, function and artificial improvement for strong-flavor Baijiu fermentation[J].Modern Food Science and Technology, 2020, 36(10):331-340.
[2] TAO Y, LI J B, RUI J P, et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Applied and Environmental Microbiology, 2014, 80(7):2254-2260.
[3] CHAI L J, QIAN W, ZHONG X Z, et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Applied and Environmental Microbiology, 2021, 87(17):e0088521.
[4] WANG H L, GU Y, ZHOU W C, et al.Adaptability of a caproate-producing bacterium contributes to its dominance in an anaerobic fermentation system[J].Applied and Environmental Microbiology, 2021, 87(20):e0120321.
[5] REA S, BOWMAN J P, POPOVSKI S, et al.Methanobrevibacter millerae sp.nov.and Methanobrevibacter olleyae sp.nov., methanogens from the ovine and bovine rumen that can utilize formate for growth[J].International Journal of Systematic and Evolutionary Microbiology, 2007, 57(Pt 3):450-456.
[6] 王乐, 王耀, 韩怀斌, 等.不同窖龄窖泥产酒发酵前后的理化指标、风味物质含量和细菌菌群结构差异分析[J].酿酒科技, 2023(7):22-33;43.WANG L, WANG Y, HAN H B, et al.Differences in physicochemical indexes, flavor substances and bacterial community structure of pit mud of different ages before and after fermentation[J].Liquor-Making Science &Technology, 2023(7):22-33;43.
[7] 徐相辉, 常强, 孙伟, 等.文王浓香型白酒不同深度新老窖泥理化性质与微生物演替分析[J].食品工业科技, 2022, 43(21):129-136.XU X H, CHANG Q, SUN W, et al.Analysis of physicochemical properties and microbial succession of Wenwang Chinese strong-flavor Baijiu at different depths in old and new pit muds[J].Science and Technology of Food Industry, 2022, 43(21):129-136.
[8] LI J Y, DING Z, DONG W Q, et al.Analysis of differences in microorganisms and aroma profiles between normal and off-flavor pit mud in Chinese strong-flavor Baijiu[J].Journal of Bioscience and Bioengineering, 2024, 137(5):360-371.
[9] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV” 法[J].食品科学, 2008, 29(7):370-374.LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[10] ZHUANSUN W W, XU J, LI Z Q, et al.Dynamic changes in the microbial community, flavour components in Jiupei of a novel Maotai-Luzhou-flavoured liquor under various daqu blending modes and their correlation analysis[J].LWT, 2022, 172:114167.
[11] HUANG Z G, ZENG B, DENG J, et al.Succession of microbial community structure in fermented grains during the fermentation of strong-flavor Baijiu and its impact on the metabolism of acids, alcohols, and esters[J].Food Science and Biotechnology, 2024, 33(15):3501-3513.
[12] DONG W, GUO R N, LIU M, et al.Characterization of key odorants causing the roasted and mud-like aromas in strong-aroma types of base Baijiu[J].Food Research International, 2019, 125:108546.
[13] 贾勇磊, 张宿义, 许德富, 等.泸型酒糟醅中微生物组学和挥发性代谢物关联性分析[J].食品与发酵工业, 2024, 50(13):72-81.JIA Y L, ZHANG S Y, XU D F, et al.Correlation analysis of microbiomics and volatile metabolites in fermented grains from Luzhou-flavor liquor[J].Food and Fermentation Industries, 2024, 50(13):72-81.
[14] 高江婧. 浓香型白酒窖泥微生物菌群的风味贡献及稳态机制研究[D].无锡:江南大学, 2022.GAO J J.The flavour contribution and stability-maintaining mechanism of pit mud microbiota for the production of strong aroma-type Baijiu[D].Wuxi:Jiangnan University, 2022.
[15] 胡晓龙, 王康丽, 余苗, 等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业, 2020, 46(10):66-73.HU X L, WANG K L, YU M, et al.Microbial community succession pattern and spatial heterogeneity in fermented grains of strong-flavor Baijiu[J].Food and Fermentation Industries, 2020, 46(10):66-73.
[16] MU Y, HUANG J, ZHOU R Q, et al.Bioaugmented Daqu-induced variation in community succession rate strengthens the interaction and metabolic function of microbiota during strong-flavor Baijiu fermentation[J].LWT, 2023, 182:114806.
[17] 曾波, 郑佳, 冯政, 等.浓香型白酒发酵过程中黄水细菌群落结构的演替规律[J].中国食品学报, 2024, 24(11):300-309.ZENG B, ZHENG J, FENG Z, et al.Succession of bacterial community structure in Huangshui during fermentation process of strong aromatic Chinese spirit[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(11):300-309.
[18] HE Y P, TIAN Z, YI Q Z, et al.Impact of oxytetracycline on anaerobic wastewater treatment and mitigation using enhanced hydrolysis pretreatment[J].Water Research, 2020, 187:116408.
[19] LI W, LIU J M, ZHEN Y M, et al.Simultaneous removal of nitrite and organics in a biofilm-enhanced high-salt wastewater treatment system via mixotrophic denitrification coupled with sulfate reduction[J].Journal of Water Process Engineering, 2021, 40:101976.
[20] WANG M Y, ZHAO Q S, CHANG S, et al.Analysis of the microbial community structure during brewing of Sichuan Xiaoqu Baijiu[J].Journal of the American Society of Brewing Chemists, 2019, 77(3):210-219.
[21] 陶洪驰, 李星, 赵荣寿, 等.浓香型白酒发酵过程中窖池内不同时空物质变化规律的研究[J].酿酒科技, 2023(8):24-27.TAO H C, LI X, ZHAO R S, et al.Change rules of substances at different time and positions of the pits during the fermentation of Nongxiang Baijiu[J].Liquor-Making Science &Technology, 2023(8):24-27.
[22] LIU M K, TANG Y M, GUO X J, et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].mSystems, 2020, 5(2)
[23] BERRY D, WIDDER S.Deciphering microbial interactions and detecting keystone species with co-occurrence networks[J].Frontiers in Microbiology, 2014, 5:219.
[24] 刘燕. 梭菌产对甲基苯酚的生物法消减策略探究[D].无锡:江南大学, 2023.LIU Y.Study on the biological reduction strategy of p-cresol produced by Clostridium fermenticellae[D].Wuxi:Jiangnan University, 2023.
[25] TANG H, LI P, CHEN L, et al.The formation mechanisms of key flavor substances in stinky tofu brine based on metabolism of aromatic amino acids[J].Food Chemistry, 2022, 392:133253.