我国大部分葡萄酒产区受季风性气候影响[1],以陕西地区为典型代表,葡萄成熟期多雨,葡萄原料提前采收,常导致葡萄原料酸度较高且香气前体物质积累不足,酿造的葡萄酒口感酸涩且品种香气不足等问题,严重制约了葡萄酒高质量发展。葡萄酒的品种香气来自于葡萄浆果成熟过程中产生的次级代谢物[2],品种香气物质主要包括:萜烯、甲氧基吡嗪、挥发性酚、降异戊二烯类化合物等[3],其中,萜烯类化合物是葡萄酒品种香气的重要组成部分。萜烯类物质主要以不挥发的香气糖苷形式存在,通过β-葡萄糖苷酶的水解,能够产生游离态、具有挥发性的香气化合物,赋予葡萄酒独特的品种香气特征[4]。
苹果酸-乳酸发酵(malolactic fermentation,MLF)具有降低酒体酸度、提高微生物稳定性及改善香气质量的作用[5]。传统的发酵方式是酒精发酵结束后,接种乳酸菌进行MLF,但酒体环境会抑制乳酸菌的生长活性,影响发酵顺利进行。研究发现同时接种酵母与乳酸菌可有效提升MLF活性,缩短发酵周期[6-7],所获得酒体葡萄酒颜色更好、感官质量更高[8]。植物乳植杆菌Lactiplantibacillus plantarum和酒酒球菌Oenococcus oeni是启动MLF的主要乳酸菌,其中L.plantarum因其具有风味的酶系而在近年来受到广泛关注[8-9],主要包括β-葡萄糖苷酶、酯酶和脱羧酶等。
葡萄酒的独特地域风味在很大程度上受益于当地自然存在的微生物群落。因此,深入发掘并利用本土野生葡萄酒微生物,可以解决使用商业乳酸菌面临的葡萄酒风味同质化问题,加强葡萄酒的风土特征。另外,本土乳酸菌也更能适应当地的葡萄酒原料特性,例如曹颖等[10]从“公酿一号”葡萄酒中筛选到2株兼具耐受性、降酸能力和糖苷酶活性的优良乳酸菌株,其酿酒特性优于对照菌株;LERM等[11]通过对南非葡萄酒中分离的乳酸杆菌的调查,发现几种L.plantarum菌株可以产生一些独特的酶类物质,对促进葡萄酒芳香物质的释放产生了独特作用。因此,筛选抗逆性强、风味酶活性高的本土乳酸菌,综合探究不同的接种方式下本土乳酸菌的发酵能力和发酵特性,对MLF的顺利进行及风味塑造具有重要作用。
基于此,本研究通过筛选陕西本土乳酸菌,对酸、乙醇、SO2胁迫时的抗逆性和β-葡萄糖苷酶活性进行评价,获得一株抗逆性强且高产β-葡萄糖苷酶的优选乳酸菌。以陕西合阳示范站美乐葡萄为原料,将该优选乳酸菌与酿酒酵母(Saccharomyces cerevisiae)进行同时接种和顺序接种两种发酵模式的MLF,以O.oeni SD-2a作为对照,分析其共发酵特性、评价其调控葡萄酒风味特征的潜力。研究结果将为开发优良增香乳酸菌提供技术参考,为国产葡萄酒的风味塑造提供理论依据。
1 材料与试剂
1.1 原料与菌株
美乐(Merlot)葡萄作为原料,于2022年9月采收自陕西省合阳县西北农林科技大学葡萄试验示范站,还原糖190.5 g/L,总酸6.5 g/L(以酒石酸计)。人工粒选、除梗破碎入罐后于4 ℃冷浸渍48 h后分离出葡萄汁,在8 000×g、4 ℃下离心30 min,并使用0.25 μm和0.45 μm过滤器除菌,无菌葡萄汁(Brix 20.2,pH 3.36),于4 ℃下储存备用[6]。
酿酒酵母(Saccharomyces cerevisiae Actiflore F5,F5),法国Laffort公司;6株乳酸菌(10、11、26、3、5a、6a)从本实验使用的自发启动MLF的美乐葡萄酒中分离得到;O.oeni SD-2a从山东省烟台市的葡萄酒分离得到,保藏于中国普通微生物菌种保藏管理中心(保藏编号CGMCC 0715)[12]。
1.2 培养基
WL培养基:按WL营养琼脂粉使用方法配制。121 ℃,灭菌20 min。
ATB培养基(g/L):蛋白胨1、酵母浸粉0.5、葡萄糖1、MgSO4·7H2O 0.02、MnSO4·4H2O 0.005、盐酸半胱氨酸0.05,番茄汁25。115 ℃,灭菌20 min。固体培养基则加入2 g/L琼脂,100 mg/L放线菌酮抑制酵母菌生长。
YPD培养基(g/L):蛋白胨2、酵母浸粉1、葡萄糖2。121 ℃,灭菌20 min。
1.3 试剂与仪器
UV-2450紫外分光光度计、QP2020 GC-MS,日本岛津公司;DH-420型电热恒温培养箱,北京科伟永兴仪器有限公司;ET18全自动滴定仪,美国Mettler Toledo公司;Y15自动酶标分析仪,西班牙Biosystems公司;FTIR Lyza 5000 Wine全自动葡萄酒分析仪,奥地利Anton Paar公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;BIO-RAD C1000基因扩增仪,美国BIO-RAD公司;MIKRO-200R台式高速离心机,德国Hettich科学仪器公司;SX-500高压蒸汽灭菌锅,日本TOMY公司;BX63显微镜,日本奥林巴斯。
放线菌酮,北京索莱宝科技有限公司;L-苹果酸测定试剂盒,阿拉丁试剂(上海)有限公司;蛋白胨、酵母浸粉等其他试剂,西陇科学股份有限公司;色谱纯L-苹果酸、L-乳酸、乙醇,美国Sigma公司。
1.4 实验方法
1.4.1 菌株的耐受能力测定
以O.oeni SD-2a为对照,将6株乳酸菌(10、11、26、3、5a、6a)与O.oeni SD-2a分别接入不同pH、乙醇、SO2质量浓度梯度的ATB液体培养基中,pH梯度包括:2.9、3.2、3.5;乙醇浓度梯度包括:10%、12%、14%;SO2质量浓度梯度包括:40、60、80 mg/L。各菌株在各胁迫培养基中分别培养72 h后,测定其在波长为600 nm处的吸光度,初步筛选出3株耐受性强的乳酸菌。
1.4.2 β-葡萄糖苷酶活性测定
以对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)为底物,β-葡萄糖苷酶将其分解形成对硝基苯酚(p-nitrophenol,pNP)的比色法测定β-葡萄糖苷酶活性[13-14]。绘制pNP溶液浓度与OD400nm值的线性关系曲线,即为pNP标准曲线。绘制牛血清蛋白溶液浓度与OD280nm值的标准曲线。将初步筛选出的3株耐受性强的乳酸菌和O.oeni于ATB液体培养基中培养至对数生长末期,用150 mmol/L NaCl溶液洗涤菌体并离心(4 ℃,5 000×g,10 min),收集菌体后用PBS重悬,进行超声波破碎,破碎后离心(4 ℃,12 000×g,10 min),上清液即为粗酶液。取0.5 mL粗酶液加入0.5 mL底物(含有5 mmol/L pNPG,pH 5.0),于30 ℃恒温水浴1 h,反应结束后立即加入2 mL 1 mol/L Na2CO3溶液终止反应,测定OD400nm值[15],对照pNP标准曲线,得到pNP浓度(μmol/L)。测定粗酶液的OD280nm值,对照蛋白浓度标准曲线,得到粗酶液蛋白质量浓度(g/L)。β-葡萄糖苷酶活性定义:30 ℃时,每分钟每克β-葡萄糖苷酶生成pNP的量(μmol)为1个酶活力单位,即μmol/(min·g)。
1.4.3 菌株的分子生物学鉴定
菌株取样后,于杨凌天润奥科生物科技有限公司测序部测序鉴定。使用16S rRNA基因序列分析技术,引物为27F、1492R。
1.4.4 无菌葡萄汁混菌发酵
将葡萄原料,人工粒选、除梗破碎入罐后于4 ℃冷库冷浸渍48 h后压榨。将葡萄汁在8 000×g、4 ℃下离心30 min,并使用0.25 μm和0.45 μm过滤器除菌,制成发酵所需的无菌葡萄汁(Brix 20.2,pH 3.36),于4 ℃下储存备用[6]。
使用装入200 mL无菌葡萄汁的250 mL玻璃丝口瓶进行发酵,用含有体积分数40%甘油的发酵栓进行密封。S.cerevisiae F5于28 ℃下,在YPD液体培养基中培养至对数末期,血细胞计数板计数后,接种量为细胞浓度2×106 CFU/mL;优选乳酸菌与O.oeni SD-2a于28 ℃下,在ATB液体培养基中培养至OD600nm=1.0,接种量为细胞浓度2×107 CFU/mL。发酵方式包括:S.cerevisiae F5单菌接种(S);S.cerevisiae F5与优选乳酸菌同时接种(SL);S.cerevisiae F5与O.oeni SD-2a同时接种(SO);S.cerevisiae F5单菌接种完成酒精发酵(alcohol fermentation,AF)后,再接种优选乳酸菌(Se-SL);S.cerevisiae F5单菌接种完成AF后,再接种O.oeni SD-2a(Se-SO)。各发酵方式设置3个生物学平行,23 ℃下发酵,至总糖与苹果酸含量分别降至2 g/L和0.2 g/L以下。
1.4.5 发酵动力学监测
乳酸菌菌落总数的测定参考GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》;酵母菌菌落总数的测定参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》。S.cerevisiae使用WL固体培养基,在28 ℃下培育3 d后计算菌落总数。乳酸菌使用ATB固体培养基,在28 ℃下培育3 d后计算菌落总数。
发酵过程中还原糖和L-苹果酸含量的测定使用自动酶标分析仪及相应的检测试剂盒进行测定,测定方法遵照试剂盒说明书进行。
1.4.6 酒样的最终理化指标测定
使用全自动葡萄酒分析仪测定成品酒样的乙醇含量、总酸含量、pH值以及乳酸含量。
1.4.7 挥发性风味化合物含量检测
参考HU等[7]的方法,使用HS-SPME-GC-MS进行挥发性风味化合物的分析。将2 mL酒样、6 mL超纯水、2.0 g NaCl和20 μL 2-辛醇内标液(16 mg/L)置于20 mL顶空样品瓶中。顶空瓶置于自动进样器中,40 ℃平衡15 min后使用SARR11-DVB/CWR120/20萃取头(20 mm×1.1 mm,120 μm)萃取30 min,并通过GC-MS进行分析,在进样口于230 ℃解吸5 min。GC条件:色谱柱为DB-Wax(60 m×0.25 mm,0.25 μm)。以氦气(纯度99.999%)为载体,流速1.5 mL/min。GC程序:40 ℃下保持3 min,然后以4 ℃/min升至160 ℃,再以7 ℃/min升至220 ℃,并保持8 min。MS条件:扫描间隔0.2 s,扫描范围m/z 35~350 amu,MS transfer line 220 ℃,离子源温度200 ℃。色谱图通过GC-MS solution软件进行分析。通过标准品的保留时间和NIST 17谱库对比进行定性分析,使用内标法(2-辛醇)进行定量分析,使用5点法绘制标准曲线,无标准品的香气化合物采用化学结构和官能团相似、碳原子数相近的标准物质进行半定量。
1.5 数据处理与分析
使用Excel进行数据整理与处理;使用SPSS 26.0分析软件,通过邓肯单因素方差分析对实验结果进行比较;图片采用GraphPad Prism 8进行绘制。
2 结果与分析
2.1 乳酸菌酿酒适应性分析
乳酸菌启动MLF的能力受到多种因素的制约[16],其中pH、乙醇和SO2是乳酸菌在MLF过程中受到的最主要的胁迫因素。该实验以O.oeni SD-2a作为对照菌株,对乳酸菌10、11、26、3、5a、6a在不同pH梯度、乙醇浓度和SO2质量浓度下分别进行了葡萄酒酿造适应性的综合评估,结果如图1所示。在应对不同梯度pH值胁迫的实验中,在pH值3.5的低胁迫条件下,除乳酸菌3外所有乳酸菌都生长良好,在pH值3.2下乳酸菌10、11、26生长情况良好,特别是乳酸菌11,可以适应pH值2.9的高酸度培养环境,相较于对照菌株SD-2a,其对低pH环境的适应性更强。当面临10%乙醇浓度的胁迫时,除乳酸菌3外,其余菌株均生长良好,其中乳酸菌10、5a对高浓度乙醇的耐受能力尤为突出,在14%的乙醇浓度下依旧生长良好。在SO2耐受性测试中,乳酸菌11在质量浓度80 mg/L下生长最佳,乳酸菌3则在质量浓度40 mg/L下表现最优,而乳酸菌6a的SO2耐受性相对最低,其他乳酸菌的耐受性则相对均衡。综合以上分析,乳酸菌10、11、26在耐受性和酿酒适应性方面表现更为优异。
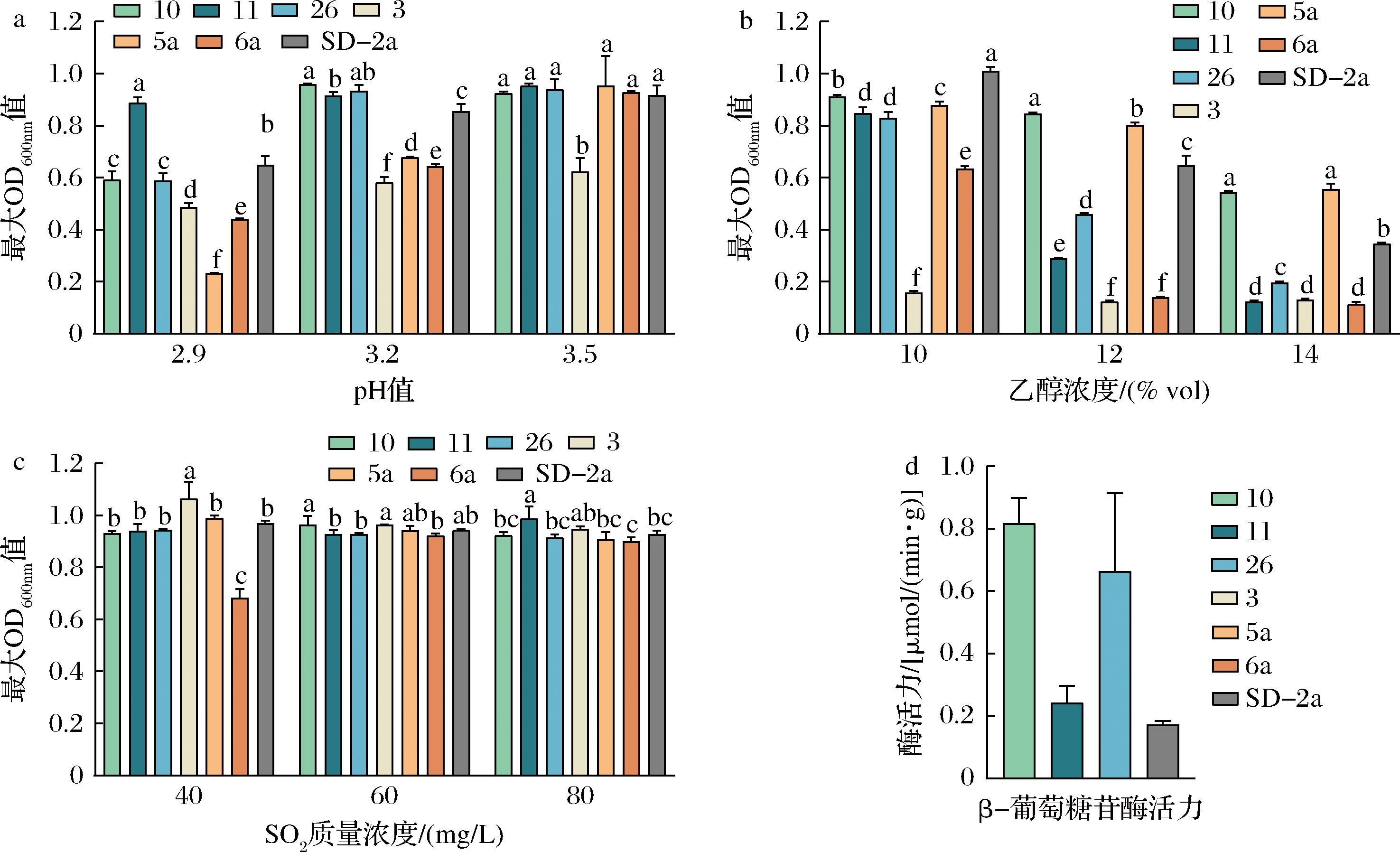
a-pH耐受性;b-乙醇耐受性;c-SO2耐受性;d-β-葡萄糖苷酶活性
图1 乳酸菌酿酒适应性评价结果
Fig.1 Evaluation of brewing adaptability of lactic acid bacteria
注:同行不同小写字母表示差异显著(P<0.05)。
β-葡萄糖苷酶通过催化β-葡萄糖苷键的水解,释放出香气化合物和风味前体,从而增强葡萄酒的复杂性和香气。对优选抗逆性良好的乳酸菌10、11、26进行β-葡萄糖苷酶活性分析(图1-d)。结果表明,乳酸菌10和乳酸菌26的β-葡萄糖苷酶活力之间并无显著性差异,并显著高于乳酸菌11和O.oeni SD-2a。结合乳酸菌酿酒适应性分析,乳酸菌10在高乙醇浓度、高SO2质量浓度环境中耐受性强于乳酸菌26。因此,最终选择乳酸菌10作为优选乳酸菌进行下一步发酵,经16S rRNA基因序列分析,结合显微镜镜检,鉴定该乳酸菌为植物乳植杆菌(序列号KP716629.1)。
2.2 优良菌株在不同接种策略下的酿酒特性分析
2.2.1 不同接种策略下的微生物生长动态
不同接种方式下,乳酸菌生长都会面临酒体环境胁迫。结果表明,同种乳酸菌在不同接种策略下的生物量水平相似,2种乳酸菌在共接种下的前2 d以及顺序接种下前4 d的生物量水平相似(图2-a)。随着MLF的进行,发酵中后期对照菌株O.oeni SD-2a参与的发酵中乳酸菌生物量显著高于L.plantarum 10。WANG等[17]在黑树莓酒的发酵中也观察到L.plantarum和O.oeni菌株的生长趋势类似,这可能是由于L.plantarum对逐渐增加的酒精浓度或低pH环境的适应性与O.oeni相比较差,导致在发酵后期L.plantarum的生物量低于O.oeni[18]。由于酒精发酵初期乙醇胁迫较低,并且营养物质丰富,在同时接种的情况下还观察到了乳酸菌在发酵初期生物量的增加。同时,无论是顺序接种还是同时接种体系,S.cerevisiae F5生长情况都大致相当(图2-b),L.plantarum 10的接种不会对S.cerevisiae生长活性产生影响。
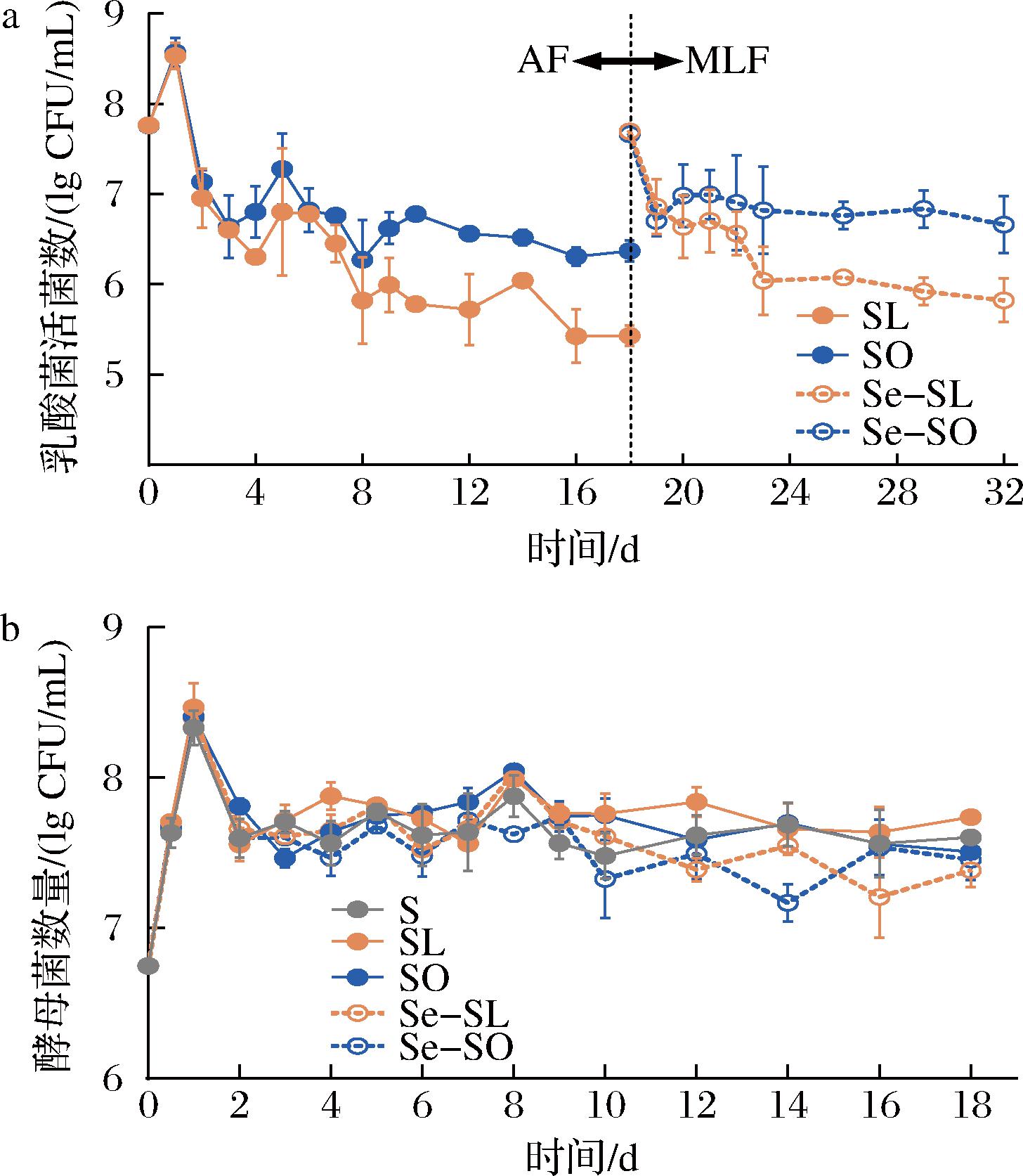
a-乳酸菌;b-酵母菌
图2 不同接种方式下葡萄酒中的微生物生长动态
Fig.2 Microbial growth dynamics in wine under different inoculation methods
2.2.2 不同接种策略下的MLF及AF发酵活性
将筛选得到的优良L.plantarum 10与S.cerevisiae F5共接种到无菌葡萄汁中进行发酵,对不同接种方式中菌株代谢L-苹果酸的能力和糖消耗能力进行监测。BRIZUELA等[19]的研究发现,一些L.plantarum菌株的发酵性能不亚于O.oeni,也是一种优秀的MLF启动菌。由图3-b可知,接种了L.plantarum 10的处理中,AF和MLF均能成功完成,糖含量消耗至2 g/L以下,苹果酸含量消耗至0.2 g/L以下。L.plantarum 10与对照菌株O.oeni SD-2a相比,两者MLF发酵周期和速率相似。同时接种处理组SL、SO的苹果酸的消耗速率要快于顺序接种处理组,尤其是在MLF开始的前24 h,苹果酸已经由2.22 g降至0.44 g左右。而在顺序接种情况下完成MLF(<0.2 g/L)则需要更长的时间,酵母菌发酵过程中产生的乙醇对乳酸菌的胁迫作用以及酒精发酵结束后酒体中营养物质的匮乏可能是导致这一情况的原因[20]。在相同的接种策略下,无论是顺序发酵还是同时发酵,两种乳酸菌的MLF速率几乎相同(图3-a),说明在单位菌体密度下L.plantarum 10的MLF活性比O.oeni SD-2a更高。此外,接种L.plantarum 10对AF周期影响不大,所有处理都是在第18天完成了AF,并且在同时接种的AF过程中,还有观察到糖的消耗受到了促进,可能的原因是同时接种情况下乳酸菌消耗了一部分糖从而导致AF过程中糖降解速率的增加。
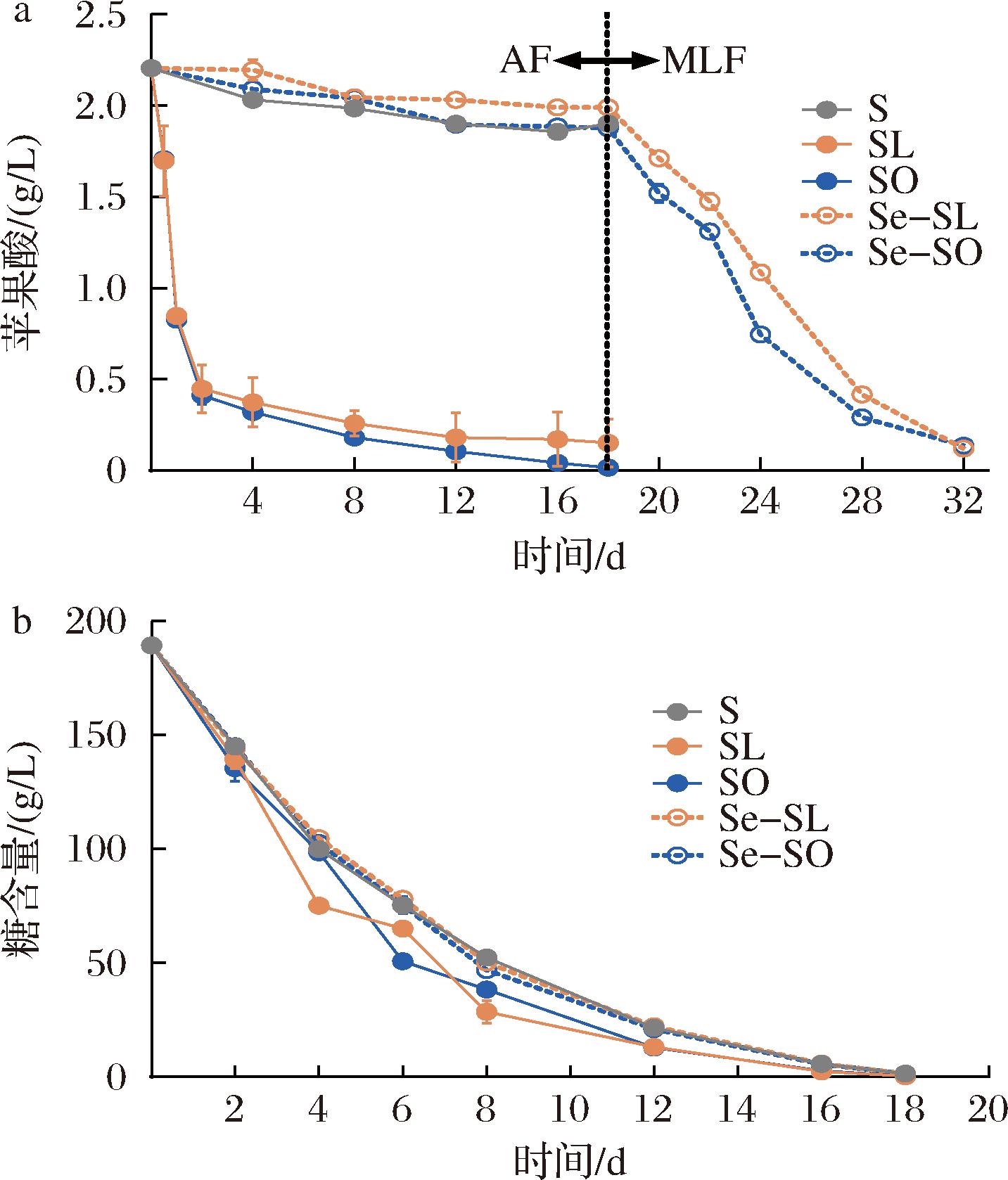
a-MLF过程中L-苹果酸的变化;b-酒精发酵过程中的还原糖的变化
图3 不同接种方式下葡萄酒的发酵曲线
Fig.3 Fermentation curve of wine with different inoculations
2.2.3 不同接种策略下葡萄酒理化特性
如表1所示,与只进行AF的对照组S相比,顺序接种显著提高了发酵结束时酒样的乙醇浓度。使用乳酸菌进行MLF后,pH值显著升高,显著降低了酒样总酸含量。其中L.plantarum 10和O.oeni SD-2a的降酸效果无显著性差异,不同接种方式对发酵结束后葡萄酒总酸含量没有影响;L.plantarum 10的接种还大幅降低了葡萄酒中苹果酸的含量,将对口感及风味不利的苹果酸转化为乳酸,使乳酸含量显著增高。整体而言,L.plantarum 10的降酸效果与目前所使用的优良O.oeni SD-2a类似。
表1 不同接种策略下发酵结束后葡萄酒的理化指标
Table 1 Physical and chemical indexes of wine after fermentation under different inoculation strategies

注:同列不同小写字母表示差异显著(P<0.05)(下同)。
接种策略总酸(酒石酸计)/(g/L)苹果酸/(g/L)乙醇/(%vol)乳酸/(g/L)pHS4.79±0.019b1.90±0.024b10.89±0.043a0.50±0.020a3.43±0.012aSL4.23±0.132a0.15±0.106a11.21±0.235ab1.96±0.146b3.50±0.004bSO4.22±0.037a0.02±0.004a11.08±0.283ab2.20±0.146c3.51±0.008bSe-SL4.18±0.100a0.12±0.008a11.69±0.019c2.06±0.005bc3.56±0.004cSe-SO4.21±0.149a0.14±0.029a11.46±0.114bc2.15±0.025bc3.56±0.008c
2.3 接种时序对美乐葡萄酒香气的影响
挥发性香气化合物直接决定葡萄酒的风格。对不同接种方式下的发酵组合进行挥发性香气化合物的检测,以S组为对照,评估L.plantarum 10和O.oeni SD-2a在不同接种方式下香气物质的差异,结果如表2所示。共检出24种挥发性香气化合物,其中包括9种酯类、5种高级醇类、3种脂肪酸类、1种醛类、2种苯衍生物和4种萜烯类。
表2 不同发酵方式下葡萄酒挥发性香气成分测定结果
Table 2 Determination of volatile aroma components in wine by different fermentation methods

注:nd表示未检出(低于方法检测限)。
香气化合物阈值[7,22,24]SSLSOS-SLS-SO气味描述[21]OAV萜烯类香茅醇1007.7±0.3a9.1±0.4b8.2±0.2ab8.2±0.7ab8.5±0.3ab柑橘、香茅、玫瑰<0.1里哪醇253.2±0.2a4.4±0.5ab4.2±0.4ab4.6±0.8b4.1±0.1ab柑橘、薰衣草、玫瑰0.1~1橙花叔醇10022.2±2.0a34.6±3.5b18.7±1.0a22.2±4.7a20.1±0.4a草本植物0.1~1β-大马士酮0.052.1±0.2b2.0±0.1b1.9±0.1ab1.6±0.1a1.7±0.2a甜香、蜂蜜、花香>1.0高级醇异丁醇40 00020 013.2±1 680.7a19 780.4±1 492.7a20 278.0±1 851.3a21 417.1±2 809.4a18 164.3±909.0a化学试剂味0.1~1异戊醇30 000212 667.1±18 050.2a212 860.7±13 323.0a218 055.8±21 369.5a236 793.5±43 889.7a204 545.4±13 440.6a奶酪、焦糖>11-庚醇64 00034.5±0.6a34.6±0.2a31.3±2.5a32.6±3.2a31.7±2.8a青苹果味<0.11-辛醇405.5±0.6a6.4±0.4ab5.8±0.4a7.6±0.8c7.5±0.3bc花香0.1~1正己醇1 100135.6±19.8a158.3±26.5ab158.9±28.9ab246.6±74.4b180.8±14.3ab青草、吐司味0.1~1脂肪酸类己酸30 000nd577.3±92.0a676.0±46.1a679.6±111.6a604.4±36.4a奶酪、脂肪<0.1辛酸500752.8±76.5b746.4±65.9b746.0±44.9b494.9±16.5a476.1±78.2a奶酪、脂肪、腐臭>1.0癸酸1 000147.3±14.2c147.3±5.7c141.1±5.7bc101.3±0.2a119.9±17.1ab脂肪、腐臭>0.1酯类乙酸乙酯7 50017 168.6±2 222.4a19 698.8±1 411.0a17 528.5±3 120.3a21 463.2±6 295.8a19 698.3±390.2a菠萝、果香>1.0乙酸异戊酯301 014.9±107.8b838.0±50.4ab882.8±135.1ab767.4±118.1a672.3±72.2a果香>1.0乙酸己酯67026.1±1.1a24.9±0.1a25.1±0.6a25.1±0.3a26.3±0.5a苹果、草莓<0.1丁酸乙酯20141.7±22.2a160.0±16.1a118.2±12.4a150.5±29.5a141.9±13.7a草莓、菠萝、香蕉>1.0己酸乙酯5241.2±69.1a229.4±33.1a240.9±43.5a233.5±26.4a198.5±45.4a苹果、草莓>1.0辛酸乙酯580128.3±31.5a131.3±14.4a136.8±22.9a110.1±9.0a107.5±16.3a花香、果香0.1~1癸酸乙酯20061.2±1.8a60.8±0.6a61.1±1.2a59.6±0.3a60.6±1.3a果味、脂质味0.1~1其他酯类乳酸乙酯14 000nd26 801.6±3 736.5b37 650.4±7 731.0c18 129.0±405.0ab16 771.1±2 597.7a奶香、果香>1丁二酸二乙酯100 000~200 000169.3±30.5a390.4±17.0c326.6±34.6c289.6±124.1bc176.4±49.6b果香、奶油味<0.1醛酮2-辛酮500.4±0.2a1.3±0.5b1.4±0.2b2.1±0.3c1.5±0.0b苹果、果香<0.1芳香族化合物2-苯乙醇14 00021 758.4±2 451.8a25 015.7±2 137.8a23 182.6±2 702.6 a24 307.9±4 854.1 a22 037.5±2 169.2a玫瑰、蜂蜜>1乙酸苯乙酯25091.6±11.2c75.8±5.6bc71.6±9.7b50.2±6.2a46.1±6.9a栀子花,玫瑰花香>0.1
萜烯属于品种香气,葡萄酒中的结合态的萜烯类香气糖苷在酿造过程中可以被β-糖苷酶水解产生游离态萜烯,对葡萄酒的香气具有明显的促进作用[22]。本试验中测得的萜烯类化合物有香茅醇、里哪醇、橙花叔醇、β-大马士酮,与S组相比接种L.plantarum 10和O.oeni SD-2a后酒样中萜烯类物质含量显著上升,最终酒样中,L.plantarum 10在同时接种时香茅醇的含量为9.1 μg/L,橙花叔醇34.6 μg/L,顺序接种时里哪醇的含量为4.6 μg/L。橙花叔醇是萜烯类物质的主体,占比60%~72%,且同时接种方式下L.plantarum 10较高的β-葡萄糖苷酶活性有效促进了该物质的释放,其含量为O.oeni SD-2a对应处理组SO的1.8倍,同时接种显著提高了β-大马士酮含量。为葡萄酒增加了柠檬、柑橘、玫瑰等特殊风味,使品种香气更为丰富。
酯类物质是葡萄酒中最主要的挥发性香气成分之一,可以为葡萄酒贡献花香和果香[23]。在葡萄酒样品中检测到的OAV>1的酯类物质为乙酸乙酯、乙酸异戊酯、丁酸乙酯、己酸乙酯,对葡萄酒的花香有显著贡献。其中乙酸异戊酯的含量在接种乳酸菌后显著下降,尤其是在顺序接种处理中。另外,乳酸乙酯的OAV>0.1,增加了葡萄酒的果香和奶油气息,除S组中未检测到,在接种L.plantarum 10和O.oeni SD-2a后均检测到该香气物质,其中SL组的乳酸乙酯含量最高。
高级醇是酵母代谢产生的次级代谢产物,也是葡萄酒中其他香气组分的载体,可增加葡萄酒香气的复杂度[24]。除顺序接种会导致1-辛醇含量增加外所有处理组的高级醇含量没有显著差异(P<0.05)。脂肪酸和醛酮类物质主要存在于葡萄果实和酒精发酵过程中产生,能赋予葡萄酒柑橘类香气[25]。与S组相比,乳酸菌会产生己酸,但在不同接种方式下,L.plantarum 10和菌O.oeni SD-2a中所产生的己酸无显著性差异(P<0.05)。顺序接种产生的辛酸和癸酸更少,其中辛酸的OAV>1,是葡萄酒的主要酸类香气物质,会给葡萄酒带来酸败的味道,顺序接种降低了辛酸的含量,对葡萄酒风味具有积极的作用。另外,接种乳酸菌后酒体产生了更多的2-辛酮,其中Se-SL组显著高于其他处理组。
结果表明,L.plantarum 10与S.cerevisiae共接种更好的促进了酒体中萜烯类物质的释放,并且显著增加了葡萄酒中橙花叔醇的含量,为葡萄酒贡献了品种香气。并且接种策略的选择也会造成葡萄酒香气成分的改变,与顺序接种相比,共接种对葡萄酒萜烯类香气和脂肪酸类香气的增加有积极的影响。并且,L.plantarum 10在不同接种策略下对酒体香气的贡献都较为突出,表现出了不弱于O.oeni SD-2a的产香特性。
3 结论
通过该研究筛选得到的L.plantarum 10具有优良的抗胁迫能力,其具有不弱于对照菌株O.oeni SD-2a的耐酸和耐SO2能力,耐高浓度乙醇能力优于对照菌株,β-葡萄糖苷酶活性是对照菌株的4倍。将L.plantarum 10与S.cerevisiae F5进行共发酵和顺序发酵,综合评价其在不同接种时序下的发酵性能。结果表明,在两种接种方式下L.plantarum 10与对照菌株O.oeni SD-2a具有相似发酵能力,所有处理均能顺利完成AF和MLF,且相同接种策略下两组处理酒样的理化指标相似。研究发现,共发酵是更适合本土乳酸菌L.plantarum 10的接种策略,显著缩短了葡萄酒的发酵周期(14 d),与顺序接种相比,共发酵结束后的葡萄酒的酒精度更低,接种L.plantarum 10进行MLF后产生的品种香气物质中,3种主要的萜烯类化合物香茅醇、里哪醇、橙花叔醇生成量显著上升,其中橙花叔醇是萜烯类物质的主体,占比60%~72%,在共发酵的情况下L.plantarum 10产生的橙花叔醇含量显著高于对照菌株。因此,选择L.plantarum 10与S.cerevisiae F5进行共发酵,能够充分发挥本土菌株优势,改善季风性气候产区高酸葡萄酒糖苷积累不足、品种香气不够丰富的问题,为本土葡萄酒风味调控提供技术基础及理论依据。
[1] 张国军, 王晓玥, 孙磊, 等.典型大陆季风气候葡萄设施栽培理念与策略分析[J].中外葡萄与葡萄酒, 2016(2):37-41.ZHANG G J, WANG X Y, SUN L, et al.Concept and strategy analysis of grape protected cultivation in typical continental monsoon climate[J].Sino-Overseas Grapevine &Wine, 2016(2):37-41.
[2] VILLAMOR R R, ROSS C F.Wine matrix compounds affect perception of wine aromas[J].Annual Review of Food Science and Technology, 2013, 4:1-20.
[3] HE Y, WANG X Y, LI P H, et al.Research progress of wine aroma components:A critical review[J].Food Chemistry, 2023, 402:134491.
[4] HJELMELAND A K, EBELER S E.Glycosidically bound volatile aroma compounds in grapes and wine:A review[J].American Journal of Enology and Viticulture, 2015, 66(1):1-11.
[5] SUMBY K M, BARTLE L, GRBIN P R, et al.Measures to improve wine malolactic fermentation[J].Applied Microbiology and Biotechnology, 2019, 103(5):2033-2051.
[6] ZHAO H Y, LI Y Q, LIU L X, et al.Effects of inoculation timing and mixed fermentation with Pichia fermentans on Oenococcus oeni viability, fermentation duration and aroma production during wine malolactic fermentation[J].Food Research International, 2022, 159:111604.
[7] HU K, ZHAO H Y, KANG X T, et al.Fruity aroma modifications in Merlot wines during simultaneous alcoholic and malolactic fermentations through mixed culture of S.cerevisiae, P.fermentans, and L.brevis[J].LWT, 2022, 154:112711.
[8] 陆文轩, 张碧颖, 巴旦加布, 等.植物乳杆菌在不同品种葡萄酒中苹果酸乳酸发酵性能的评价[J].食品与发酵工业, 2022, 48(12):82-89;96.LU W X, ZHANG B Y, BA D, et al.Evaluation on malolactic fermentation performance of Lactobacillus plantarum in wine fermentation with different grape varieties[J].Food and Fermentation Industries, 2022, 48(12):82-89;96.
[9] IORIZZO M, TESTA B, LOMBARDI S J, et al.Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J].LWT, 2016, 73:557-566.
[10] 曹颖, 郑玉娟, 刘龙祥, 等.葡萄酒苹果酸-乳酸发酵优良菌株的筛选与发酵性能分析[J].食品研究与开发, 2021, 42(11):138-144.CAO Y, ZHENG Y J, LIU L X, et al.Isolation and characterization of autochthonous Oenococcus oeni from a Chinese native grape variety[J].Food Research and Development, 2021, 42(11):138-144.
[11] LERM E, ENGELBRECHT L, DU TOIT M.Selection and characterisation of Oenococcus oeni and Lactobacillus plantarum South African wine isolates for use as malolactic fermentation starter cultures[J].South African Journal of Enology and Viticulture, 2016, 32(2):280-295.
[12] ZHAO H Y, LIU L X, PENG S, et al.Heterologous expression of argininosuccinate synthase from Oenococcus oeni enhances the acid resistance of Lactobacillus plantarum[J].Frontiers in Microbiology, 2019, 10:1393.
[13] BISOTTO A, JULIEN A, RIGOU P, et al.Evaluation of the inherent capacity of commercial yeast strains to release glycosidic aroma precursors from Muscat grape must[J].Australian Journal of Grape and Wine Research, 2015, 21(2):194-199.
[14] GRIMALDI A, BARTOWSKY E, JIRANEK V.A survey of glycosidase activities of commercial wine strains of Oenococcus oeni[J].International Journal of Food Microbiology, 2005, 105(2):233-244.
[15] 董梅. 酒类酒球菌31MBR β-D-葡萄糖苷酶的分离纯化及酶学性质研究[D].杨陵:西北农林科技大学, 2014.DONG M.Purification and characterization of β-D-glucosidase from Oenococcus ostreatus 31MBR[D].Yangling:Northwest A&F University, 2014.
[16] FERRANDO N, ARAQUE I, ORT S A, et al.Evaluating the effect of using non-Saccharomyces on Oenococcus oeni and wine malolactic fermentation[J].Food Research International, 2020, 138:109779.
S A, et al.Evaluating the effect of using non-Saccharomyces on Oenococcus oeni and wine malolactic fermentation[J].Food Research International, 2020, 138:109779.
[17] WANG C S, SUN S Y, ZHOU H R, et al.The influence of Lactiplantibacillus plantarum and Oenococcus oeni starters on the volatile and sensory properties of black raspberry wine[J].Foods, 2023, 12(23):4212.
[18] KRIEGER-WEBER S, HERAS J M, SUAREZ C.Lactobacillus plantarum, a new biological tool to control malolactic fermentation:A review and an outlook[J].Beverages, 2020, 6(2):23.
[19] BRIZUELA N S, BRAVO-FERRADA B M, LA HENS D V, et al.Comparative vinification assays with selected Patagonian strains of Oenococcus oeni and Lactobacillus plantarum[J].LWT, 2017, 77:348-355.
[20] BONOMO M G, DI TOMASO K, CALABRONE L, et al.Ethanol stress in Oenococcus oeni:Transcriptional response and complex physiological mechanisms[J].Journal of Applied Microbiology, 2018, 125(1):2-15.
[21] GUTH H.Quantitation and sensory studies of character impact odorants of different white wine varieties[J].Journal of Agricultural and Food Chemistry, 1997, 45(8):3027-3032.
[22] 杨毓. 葡萄酒酿造过程中萜烯分子重排及其挥发呈香的多酚基质效应研究[D].杨凌:西北农林科技大学, 2023.YANG Y.Molecular rearrangement and polyphenolic matrix effects on volatile aroma presentationofterpene in winemaking[D].Yangling:Northwest A&F University, 2023.
[23] LI N, WANG L Y, YIN J, et al.Adjustment of impact odorants in Hutai-8 rose wine by co-fermentation of Pichia fermentans and Saccharomyces cerevisiae[J].Food Research International, 2022, 153:110959.
[24] BELDA I, RUIZ J, ESTEBAN-FERN NDEZ A, et al.Microbial contribution to wine aroma and its intended use for wine quality improvement[J].Molecules, 2017, 22(2):189.
NDEZ A, et al.Microbial contribution to wine aroma and its intended use for wine quality improvement[J].Molecules, 2017, 22(2):189.
[25] 张嘉璇, 张萃异, 刘辉, 等.本土乳酸菌苹果酸-乳酸发酵对“户太十一号” 葡萄酒品质的影响[J].中国酿造, 2024, 43(9):29-37.ZHANG J X, ZHANG C Y, LIU H, et al.Effect of malic-lactic fermentation by indigenous lactic acid bacteria on the quality of ‘Hu Tai No.11’ wine[J].China Brewing, 2024, 43(9):29-37.