乳酸菌是指一类通过发酵碳水化合物而大量产生乳酸的细菌[1]。由于其独特的功能和特性,乳酸菌在食品、医药等多个领域得到了广泛应用。具备耐酸、耐胆盐及高胞外多糖产量等特性的唾液联合乳杆菌(Ligilactobacillus salivarius)在肠道上皮细胞的黏附性和定植能力方面表现优异[2]。从健康成人口腔样品中分离得到一株具有高产胞外多糖能力的唾液联合乳杆菌AR809,其生物学功能包括拮抗致病菌;黏附口腔上皮细胞;对酸、溶菌酶和H2O2等具有一定程度的耐受性,通过改善咽部微生态环境,调节机体免疫功能,从而缓解咽症[3]。胞外多糖(exopoly saccharides,EPS)是乳酸菌在生长过程中代谢并释放到细胞壁外的一种具有显著生理活性的天然高分子聚合物,乳酸菌胞外多糖对发酵乳的口感、外观及营养价值均具有改善作用[4]。
发酵乳由于其营养丰富、口感独特等特性备受大众青睐[5],低脂发酵乳的低脂肪含量可有效降低过多摄入脂肪导致的肥胖、动脉硬化、冠心病、高血压等风险[6]。但由于其脂肪含量低,在生产过程中易导致乳清析出、凝块破碎,在一定程度上影响发酵乳品质及口感[7]。研究表明,针对这一问题主要通过添加明胶、琼脂、变性淀粉等脂肪替代品提供脂肪口感、质构,使发酵乳呈现黏稠、流动的凝胶结构[8],或合理控制工艺流程控制发酵乳黏稠度,从而赋予发酵乳良好的外观和口感[9]。
研究发现,由于乳酸菌胞外多糖具有较强的水合能力,能够显著提升发酵乳的黏度,改善低脂发酵乳质构、降低乳清析出率,因此,乳酸菌胞外多糖常被用作一种天然发酵剂、增稠剂添加到乳制品中[10]。本文旨在研究不同浓度的乳酸菌胞外多糖对低脂发酵乳发酵品质及感官性能的影响,并探讨不同浓度下的变化原因。这一研究为生产品质优良、营养均衡的发酵乳产品提供了有效的手段,同时为发酵乳品质改良的相关研究提供了参考依据。
1 材料与方法
1.1 材料与试剂
唾液联合乳杆菌AR809分离自人类唾液,保藏于中国微生物保藏中心,保藏编号 CGMCC 17206;低脂牛奶、全脂牛奶、发酵剂,上海光明乳业有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
KBF240型培养箱,德国Binder公司;3-18K型冷冻离心机,西格玛德奥里奇贸易有限公司;冷冻冻干机,美国LABCONCO公司;PB-10型pH计,瑞士梅特勒-托利有限公司;Discovery HR-3流变仪,美国TA仪器公司;低场核磁、NDI-5S黏度计,上海昌吉地质仪器有限公司;WNB7-45型水浴锅,德国Memmert有限公司;MASTER型扩散波光谱仪,法国Microtrac有限公司;NM120型核磁共振分析仪,上海钮迈电子科技有限公司。
1.3 实验方法
1.3.1 EPS809制备
唾液联合乳杆菌AR809活化于固体MRS培养基,37 ℃培养24 h。挑取成熟单菌落于1 mL液体MRS培养基,厌氧条件下培养12 h。4 ℃,8 000 r/min离心10 min,取上清发酵液,弃菌体至无菌体沉淀。向上清液添加质量分数80%三氯乙酸溶液,4 ℃放置9 h,8 000 r/min离心10 min,去除蛋白沉淀。取上清液,添加乙醇至终体积分数为75%,4 ℃沉淀12 h,离心弃上清液,沉淀用去离子水复溶,流动水透析72 h,冻干。
1.3.2 低脂发酵乳的制备
低脂鲜牛乳(蛋白质6%,脂肪0%)、全脂鲜牛乳(蛋白质6%,脂肪6%)预热至75 ℃,95 ℃灭菌10 min,冷却至42 ℃,添加蔗糖60 g/L,添加发酵剂0.1 g/L,添加唾液乳酸菌及其不同浓度EPS,于42 ℃发酵5 h使其凝固,取出,置于4 ℃冷藏后熟12 h,备用。
全脂、低脂对照组只加入60 g/L蔗糖及发酵剂,实验组(AR809、EPS-0.02、EPS-0.04、EPS-0.06)除添加发酵剂和蔗糖外分别添加唾液联合乳杆菌AR809、0.02、0.04、0.06 g/100 mL的EPS809。
1.3.3 发酵乳指标的测定
对低脂发酵乳发酵时的微流变特性进行测定,并在发酵终点时测定样品的pH值、流变特性、持水力、质构、水分迁移、微观结构及挥发性风味物质。
1.3.3.1 发酵乳后熟pH值测定
使用pH计分别测定发酵乳4 ℃冷藏后熟8、16、24、32 h样品的pH值。
1.3.3.2 持水力的测定
离心条件为转速8 500 r/min,称量空的标号离心管质量记为m0,加入10 mL发酵乳样品后称重记为m1,15 ℃,离心10 min,静置10 min后弃去上清液,称取质量记为m2,平行测定3次,持水力计算如公式(1)所示:
持水力![]()
(1)
1.3.3.3 流变学特性的测定
采用小振幅频率扫描法对发酵乳样品的流变特性进行测定。选用DHR-3旋转流变仪,直径40 mm不锈钢探头,平板与底面的间隙为1 mm,测试温度25 ℃,剪切速率范围1~200 s-1,应变2%。
1.3.3.4 质构指标的测定
发酵乳样品置于4 ℃冰箱冷藏后熟12 h,采用Brookfield CT3质构仪对发酵乳进行全质构测定,探头选取TA10平底柱形探头,直径2.5 cm,测定速率5.0 mm/s,刺入深度10 nm,返回速率5.0 mm/s。统计第一循环硬度、黏力、内聚性。
1.3.3.5 微流变特性指标的测定
取接种后的牛乳20 mL至微流变仪专用样品池中,并将样品池插入微流变仪,运行测试程序。在42 ℃检测发酵凝胶形成过程中微流变学参数即弹性指数(elasticity index, EI)、宏观黏度指数(microviscosity index, MVI)及流动性指数(fluididty index, FI)随时间的变化情况,每隔1 min记录1次数据[11]。
1.3.3.6 水分分布的测定
将含有2.00 g样品的1.5 mL玻璃小瓶嵌入15 mm核磁共振管中,然后插入核磁共振探针,通过CarrPurcell MeiboomGill (CPMG)序列采集横向弛豫时间(TZ)信号。共振频率参数为40 MHz,采样频率为200 kHz,90°硬脉冲RF脉宽11 μs, 180° ,硬脉冲RF脉宽11 μs, 180°硬脉冲RF脉宽17 μs。重复采样次数为16次,重复采样等待时间为3 000 ms,回波次数为18 000[12]。
1.3.3.7 扫描电镜观察
发酵乳切成3~5 mm厚的长条,加入足量质量分数为2.5%的戊二醛溶液并4 ℃浸泡2 d;之后用 0.1 mol/L pH 4.5的磷酸盐缓冲液清洗样品6次,每次 20 min;再用梯度乙醇(25%、55%、75%、95%)脱水30 min,无水乙醇脱水2次,每次1 h;加入V(乙醇)∶V(叔丁醇)=1∶1混合溶液置换乙醇30 min,叔丁醇置换2次,每次1 h,最后冻干。对发酵乳断裂面进行喷金,在3 kV,放大5 000倍下观察发酵乳的微观结构[13]。
1.3.3.8 挥发性风味物质的测定
使用气相色谱-质谱联用技术对发酵乳样品的挥发性风味物质进行测定。称取3 g成熟发酵乳样品置于30 mL萃取瓶内,加入2 g NaCl,10 μL仲辛醇溶液,加盖密封,样品于50 ℃水浴锅平衡30 min,固相微萃取吸附30 min后插入气相色谱进样口,250 ℃条件下解吸10 min。
上机分析:GC和MS升温程序、离子源温度等具体条件,参考许倩倩等[14]的方法,化合物由质谱数据库NIST08、文献报道的保留指数和芳香特性分析鉴定。仲辛醇作为内标物,采用内标法计算挥发性风味物质的含量。
1.4 数据分析
实验设置3组平行,实验结果以“平均值±标准差”来表示,用分析软件SPSS 25.0对实验结果进行统计学分析,显著性检验采用ANOVA 程序中的Duncan法,P<0.05即差异显著,用小写字母表示,图片采用Origin 2021、Graphpad Prism 9绘制。
2 结果与分析
2.1 唾液联合乳杆菌AR809及其不同浓度EPS对低脂发酵乳pH值的影响
如图1所示,加入了唾液联合乳杆菌AR809的发酵乳与对照组相比,在后熟8 h时AR809组pH没有显著改变。添加胞外多糖发酵乳与对照组相比,随着EPS添加量的提高,发酵乳pH也逐渐升高,但是并没有显著性差异。结果表明,唾液联合乳杆菌AR809作为附属发酵剂并不会引起发酵乳后熟8 h时pH的显著下降,添加EPS对后熟8 h时的pH也没有显著影响。
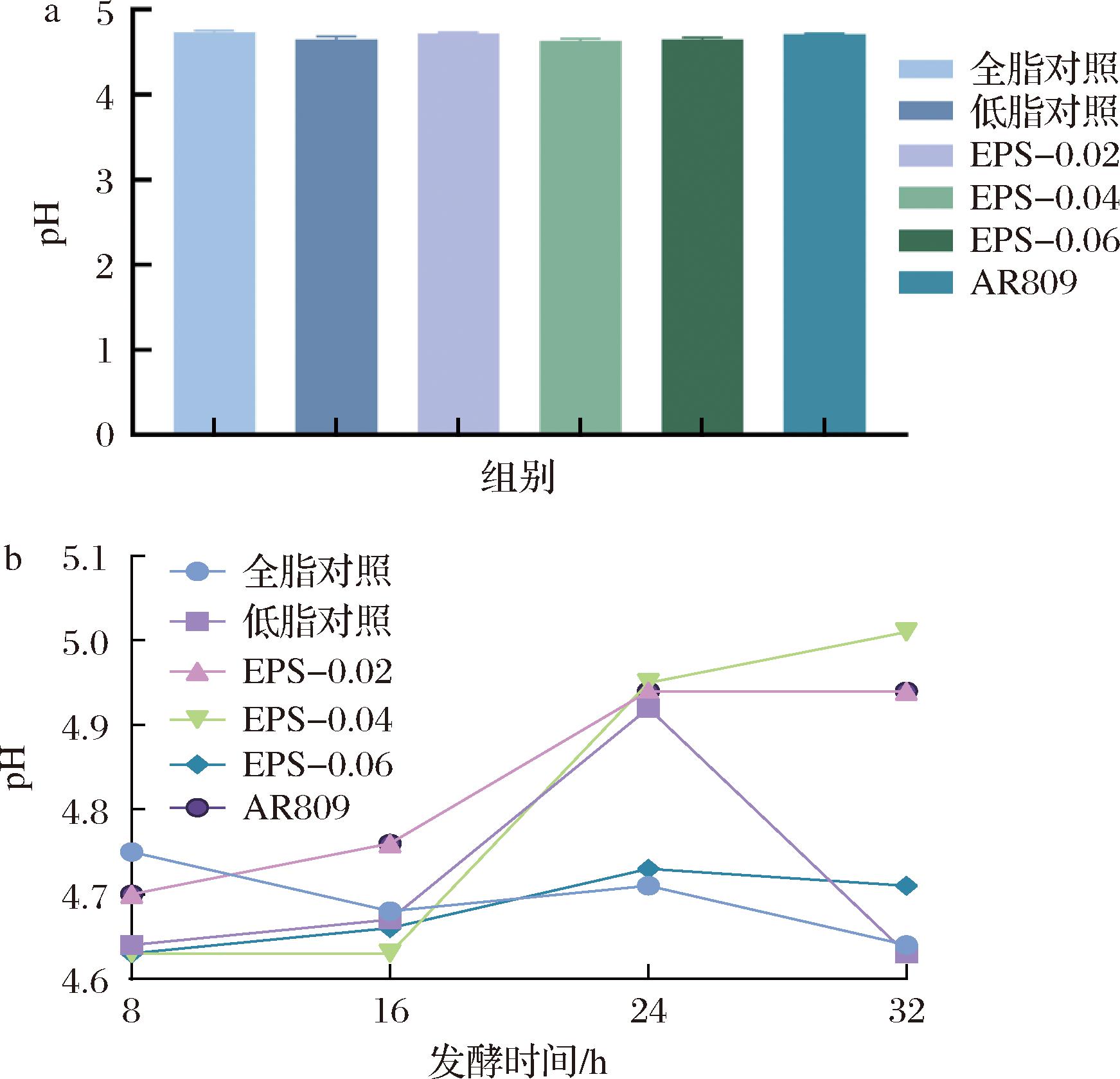
a-后熟8 h中pH变化;b-不同发酵时间pH变化
图1 AR809及EPS添加量对低脂发酵乳pH值影响
Fig.1 Effect of AR809 and different concentrations on pH of skimmed yogurt
AR809组在发酵后32 h内pH值下降速率明显低于对照组。其实验结果表明,添加产胞外多糖的菌株能够有效延缓发酵乳的酸化时间。在EPS添加组中,发酵乳pH值随着EPS添加浓度的增加逐渐上升,这表明高浓度的EPS能够降低发酵乳的酸化速率。GENG等[15]在研究菌种的发酵过程时,采用动力流变学的方法发现,产EPS的菌株能够在较高的pH值(5.59~5.62)下实现凝乳,并缩短凝乳时间。在发酵乳的发酵过程中,随着pH值的逐渐降低,蛋白质发生聚集沉淀。添加EPS与酪蛋白之间通过静电作用或空间位垒作用相互影响,从而改变发酵乳的质构,延缓酸化速率[16]。
2.2 唾液联合乳杆菌AR809胞外多糖EPS809对低脂发酵乳持水力的影响
如图2所示,实验组持水力均大于对照组,样品持水力随EPS添加量增加而持续增强,EPS-0.06组持水力数值最高达到50.19%。这可能由于EPS添加量的增加导致酪蛋白分子间交联作用增强,增强了对乳清的诱捕能力使发酵乳体系水分保持能力增加。AR809组持水力显著高于对照组,产EPS的菌株能够在发酵过程中不断产生胞外多糖,空间位垒作用从无到有,从小到大[17],使低脂发酵乳中酪蛋白分子与多糖所形成的网状结构更加细密、连续,从而提高低脂发酵乳的稳定性。
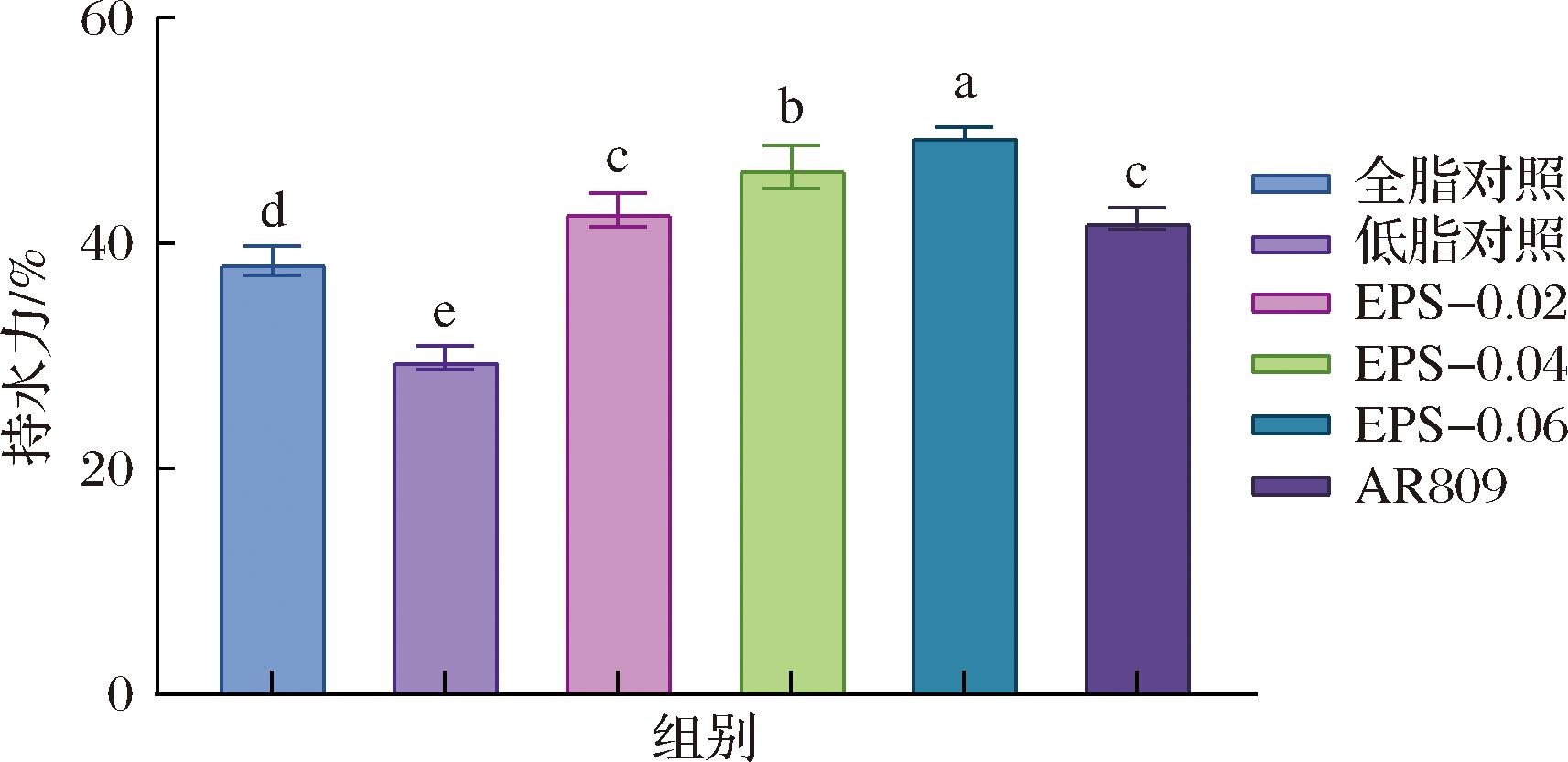
图2 AR809及EPS添加量对低脂发酵乳持水力的影响
Fig.2 Effect of AR809 and EPS at different concentrations on watey-holding capacity of skimmed yogurt
注:字母不同表示差异显著(P<0.05)。
2.3 唾液联合乳杆菌AR809胞外多糖EPS809对低脂发酵乳流变特性的影响
发酵乳样品在机械搅拌力作用下,分散体系的黏度和剪切应力随时间改变产生的流变学现象称为触变性。图3-a说明,对照组与实验组发酵乳黏度达到最大值时,随着剪切速率不断增大,发酵乳样品表观黏度逐渐下降,呈现出表观黏度与时间因素相关的剪切稀化现象。AR809组表观黏度明显高于其他EPS组,且EPS-0.04添加组的表观黏度高于其余实验组。这表明,添加一定浓度的EPS能够使全脂发酵乳具有更稳定的组织结构,有效增加发酵乳的黏度,大规模机械生产搅拌发酵乳时,添加EPS809能在一定程度上降低剪切应力对发酵乳凝胶体系的破坏。
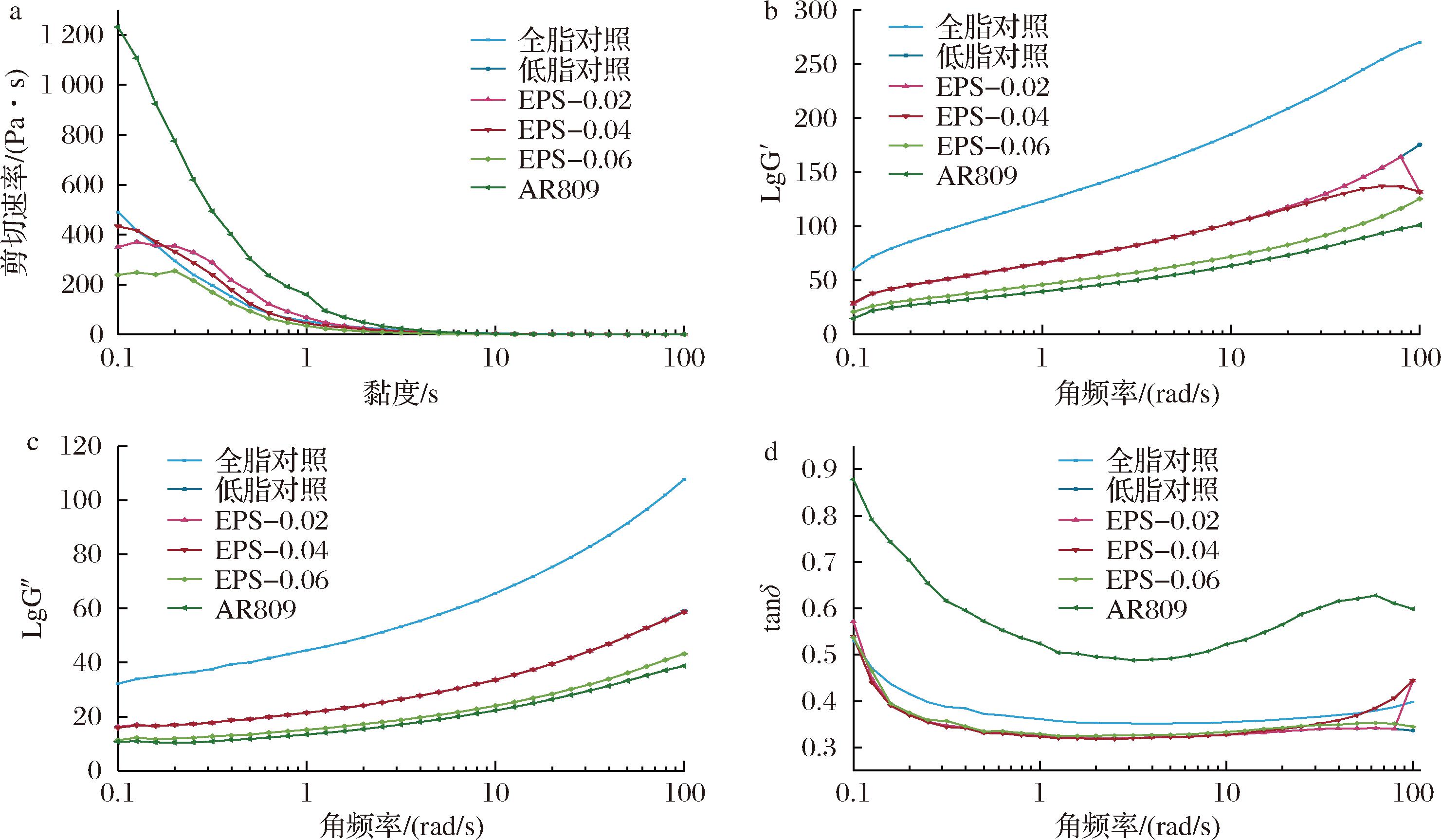
a-黏度;b-lgG′;c-lgG″;d-tanδ
图3 AR809及EPS添加量对低脂发酵乳流变特性的影响
Fig.3 Effect of AR809 and EPS at different concentrations on rheological properties of skimmed yogurt
图3-b~图3-d所示,实验组均对发酵乳的黏弹性模量产生了显著影响。总体而言,所有样品的G′值均高于G″值,表明弹性模量大于黏性模量,进而说明发酵乳表现出弱凝胶行为,具有明显的弹性特征和类固体性质[18]。介损(δ)反映了发酵乳体系在外界力量作用下的能量消耗及其黏性特性的恢复能力。AR809组的下降幅度显著区别于其他组,表明唾液乳酸菌AR809能够使发酵乳形成更有序的聚合物结构,增强其内聚性。
2.4 唾液联合乳杆菌AR809胞外多糖EPS809对低脂发酵乳质构的影响
如表1所示,相比对照组低脂发酵乳的硬度58.86 g,各EPS组,EPS-0.02、EPS-0.04、EPS-0.06,AR809组硬度分别为52.17、45.66、43.24、49.73 g;表明添加EPS可降低低脂发酵乳硬度,且当EPS添加量较大时,硬度下降明显。AR809组硬度高于全脂对照组,表明EPS对低脂发酵乳硬度的影响高于AR809。与硬度变化不同,AR809及EPS的添加能够显著提高低脂发酵乳的黏力和内聚性,使发酵乳具有较高的稳定性。其中EPS-0.06硬度下降了26.91%、黏力提高了38.1%、内聚性提高了56.09%,表明当EPS添加量达到0.06 g/100 mL时,能够使低脂发酵乳具有更大的黏度和更稳定的组织结构。唾液联合乳杆菌AR809及其胞外多糖应用到低脂发酵乳的工业生产中能够提高乳制品的内部结合力与产品稳定性,具有较好的应用前景。
表1 AR809及其EPS添加量对低脂发酵乳硬度、黏力和内聚性的影响
Table 1 Effect of AR809 and EPS at different concentrations on hardness, viscous force, and cohesiveness of skimmed yogurt

注:肩标字母不同表示存在显著差异(P<0.05)。
指标全脂对照低脂对照EPS-0.02EPS-0.04EPS-0.06AR809硬度/g46.74±0.47d58.86±0.57a52.17±0.22b45.66±0.49e43.24±0.51f49.73±0.35c黏力/g1.55±0.09b1.26±0.06d 1.48±0.09bc1.54±0.04b1.74±0.04a1.35±0.04cd内聚性0.46±0.006c0.41±0.007d0.61±0.004b0.65±0.013a0.64±0.023ab0.49±0.019c
2.5 唾液联合乳杆菌AR809胞外多糖 EPS809对低脂发酵乳发酵过程微流变特性变化的影响
在低脂发酵乳发酵过程中,乳中微粒运动状态发生改变,最终形成以酪蛋白胶粒为基础的凝胶结构,样品流变特性发生变化,通过光学流变仪对样品中粒子的运动状态进行检测,能够在不改变样品特性的条件下测定其微流变特性指标。
由图4-a可知,在发酵开始至30 min后,EPS-0.06开始凝胶化,EI几乎垂直快速增加;40 min时EPS-0.04开始凝胶化,EI缓慢上升,其余实验组与对照组无明显差别。可见在发酵前期EPS-0.06、EPS-0.04对于低脂发酵乳凝胶化影响显著,AR809及EPS-0.02在低脂发酵乳发酵前期凝胶化与对照组无明显差别。因此,较高添加量EPS能够在一定程度上提升凝乳弹性。
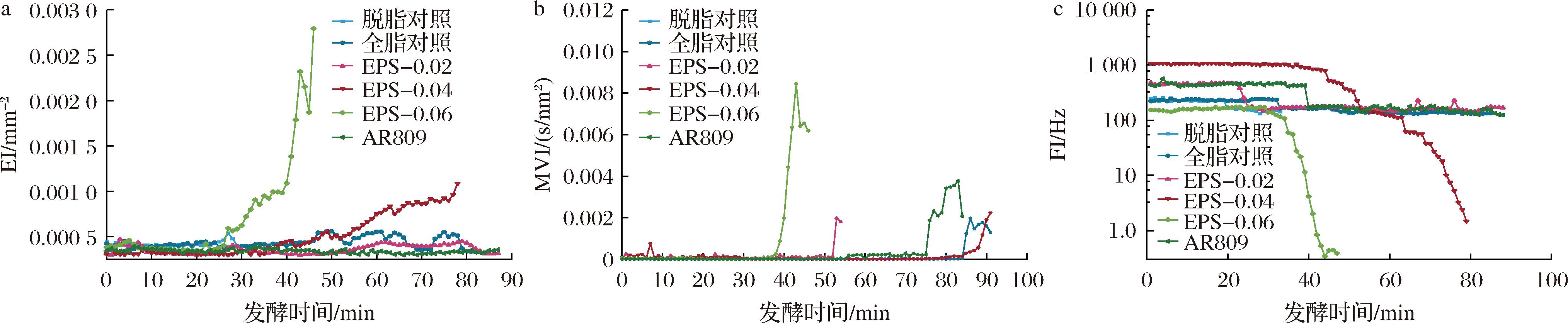
a-EI;b-MVI;c-FI
图4 AR809及EPS添加量发酵过程中的EI、MVI、FI
Fig.4 Effects at AR809 and different concentrations on FI, MVI, and FI during the fermentation of skimmed yogurt
由图4-b所示,发酵开始后30 min由于样品处于低黏度的液体状态,各组发酵乳MVI值均较小且无明显差异;40 min后EPS-0.06 MVI值迅速上升,在42 min达到最大值,EPS-0.02组在50 min时MVI值上升,其余各组MVI值在70~90 min开始上升,均在达到最大值后下降。此时低脂发酵乳处于凝乳阶段,乳清逐渐析出,发酵乳凝胶体系不稳定,与EI值变化趋势相似,EPS组、AR809组MVI值高于对照组,EPS-0.06组最大,表明添加唾液联合乳杆菌AR809及其适量EPS能使低脂发酵乳黏稠性增加。
由图4-c所示,在凝胶形成前(40 min)各组样品处于液体状态,其FI值较高,表明各组样品中粒子流动较强;FI值能够显示样品中粒子运动强度,FI值越大,粒子运动能力越强[19]。低脂发酵乳凝胶化出现时,各组样品由液态向固态转变,各组样品FI值均有下降,EPS-0.06组42 min时其FI值垂直下降,EPS-0.04组60 min其FI值时下降速率加快,此阶段该样品由脱水缩合作用导致凝胶结构逐渐稳定。约至80 min时各组样品FI值达到最低值且无明显差异,表明发酵前期,EPS-0.06、EPS-0.04对低脂发酵乳的流动性影响较大。
2.6 唾液联合乳杆菌AR809把胞外多糖EPS809对低脂发酵乳水分分布的影响
通过对比添加AR809及其不同浓度EPS对发酵乳样品弛豫时间峰比例的影响,可以分析其对水分迁移能力及流动性的影响。弛豫时间在0.1~10 ms(T21)范围内,代表紧密附着在大分子极性基团上的水分,例如与蛋白质结合的水;弛豫时间在10~100 ms(T22)范围内,代表固定的不易流动水;而弛豫时间在100~1 000 ms(T23)范围内,则代表游离水。如图5所示,各实验组体系仍以游离水为主,与对照组组别相比,实验组的结合水含量均有所增强,表明添加AR809及其不同浓度的EPS均能够提高发酵乳样品对水分迁移的控制能力。其中,EPS-0.04组结合水能力显著高于其他实验组,部分游离水转化为结合水。不同浓度的EPS对发酵乳凝胶网络中水分分布的影响并不一致,适量的添加可以有效增强发酵乳中酪蛋白凝胶的结构。
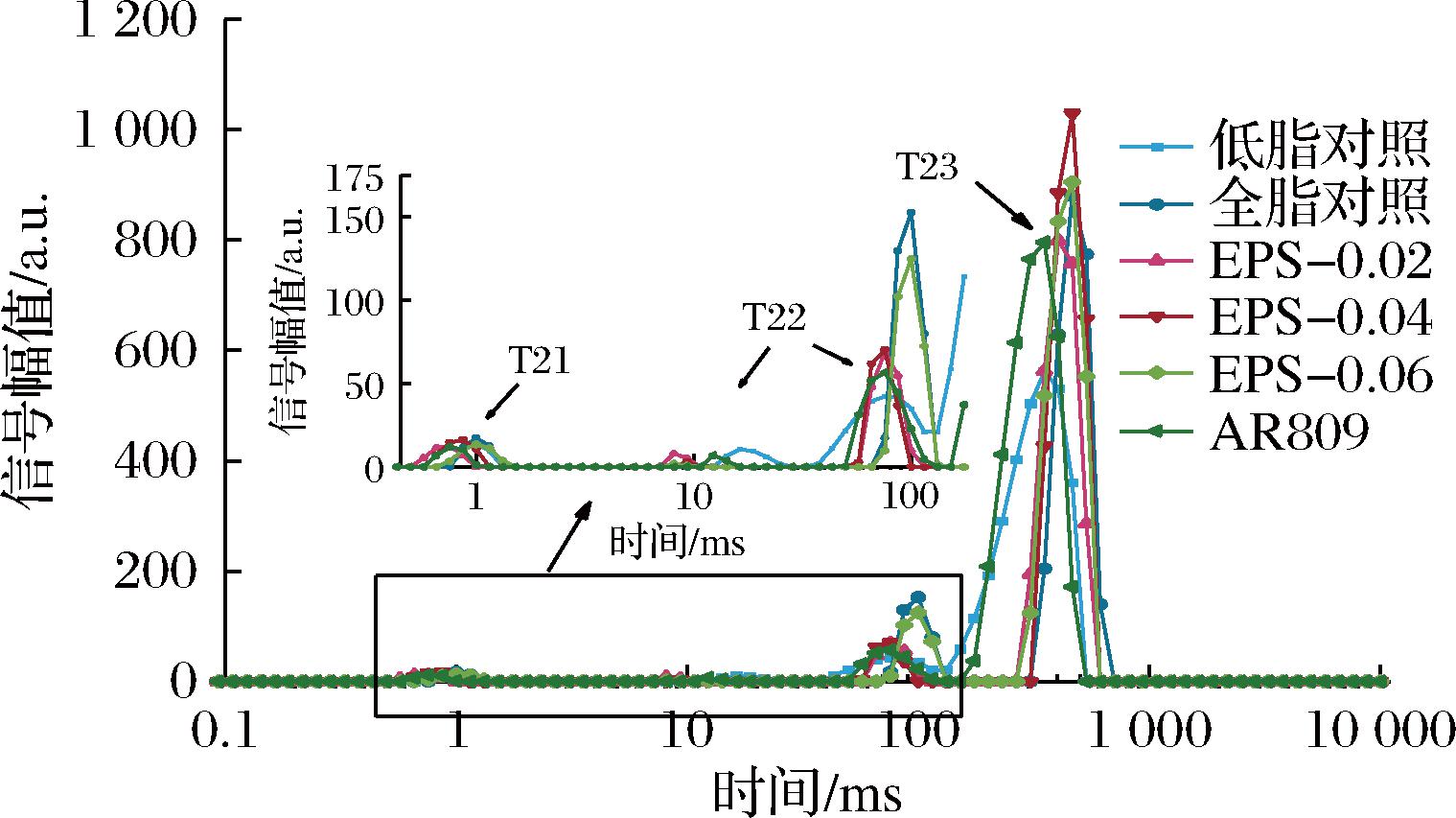
图5 AR809及EPS添加量对低脂发酵乳水分分布的影响
Fig.5 Effect of AR809 and EPS at different concentrations on water distribution of skimmed yogurt
2.7 AR809胞外多糖EPS809对低脂发酵乳微观结构的影响
如图6所示,对照组与实验组发酵乳样品均呈现多孔网状结构,AR809及其EPS809的添加对发酵乳微观结构具有较大影响。全脂对照组的网络结构连续性良好,结构分布均匀,形成的网孔较密较小;低脂对照组样品结构紧密,网孔较小。EPS-0.04组发酵乳样品的网络结构中存在较大的孔隙,酪蛋白表现出被拉伸和扭曲的现象,并与EPS发生共交联,呈现出大孔隙的微观胶状态。而AR809组样品的网孔分布相对不均匀,但其交联程度有所增强,酪蛋白结构则显得细碎。研究表明,发酵乳体系中,胞外多糖并不是单纯的覆盖在蛋白质簇的表面或是填充在空隙中间,而是通过链状形式将发酵乳体系中的蛋白质簇与多糖分子连接[20]。这可能是由于胞外多糖的产生发生在蛋白胶粒聚合之后,因而被限制在网状结构的空隙内。这种空间限制阻碍了胞外多糖与核蛋白之间的相互作用。在此情况下,蛋白聚合物之间以及胞外多糖所在的空隙部分均处于不断的动态变化中,这种动态环境使得蛋白簇更加厚重,网状结构的重组速度更快且更为致密[21]。
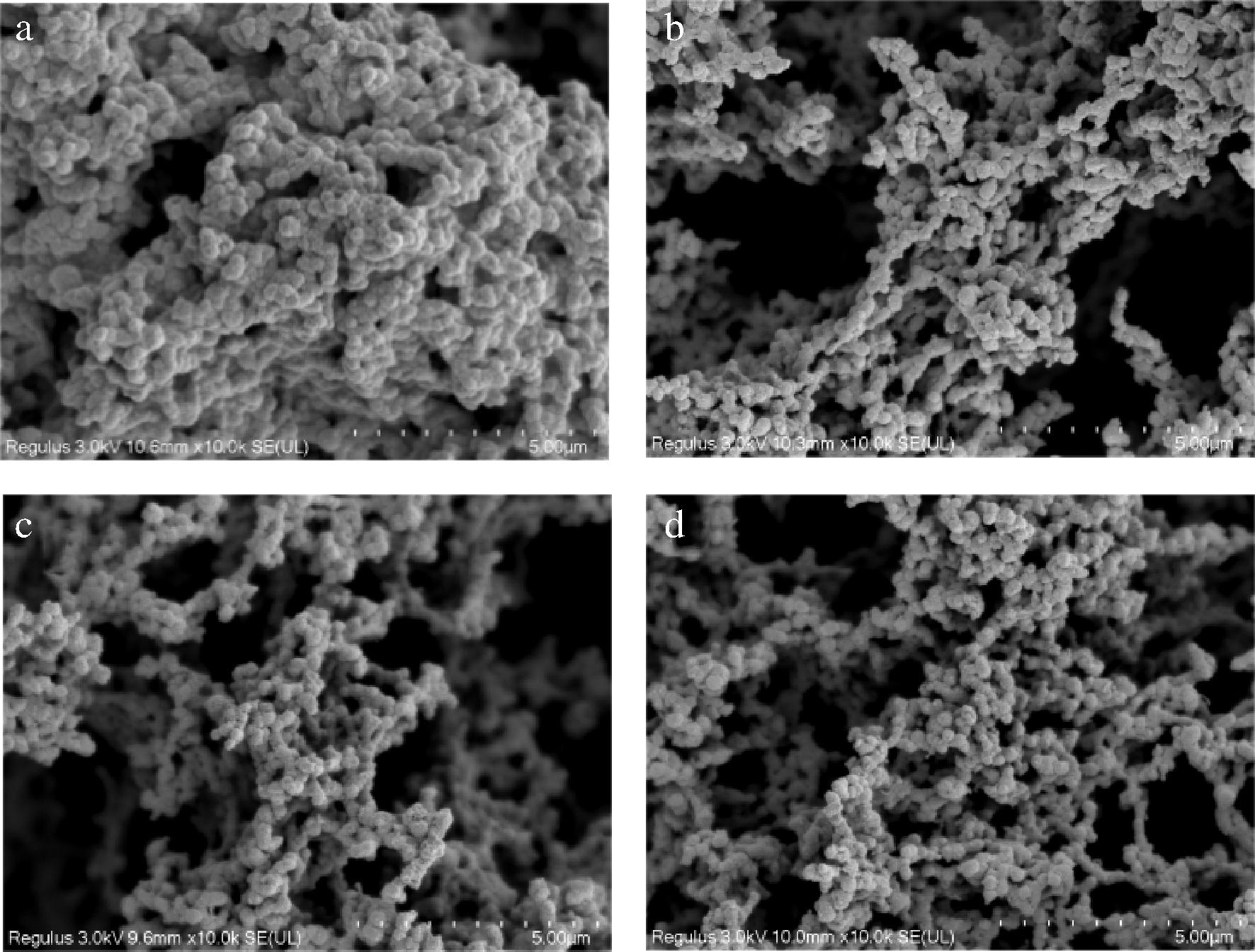
a-全脂对照;b-低脂对照;c-EPS-0.04;d-AR809
图6 AR809及其EPS添加低脂发酵乳样品的扫描电镜图
Fig.6 Scaning wlwctron microgra pHs of skimmed samples added with AR809 and EPS
2.8 AR809胞外多糖EPS809对低脂发酵乳风味特性的影响
通过固相微萃取-气相色谱-质谱联用法对各组低脂发酵乳进行挥发性风味物质分析,结果如表2所示。5组发酵乳共检测出59种挥发性风味物质,包括9种酮类、7种烃类、2种醛类、10种酸类、15种醇类、16种酯类。在发酵乳中添加AR809及其EPS809能够促进发酵乳中醇酯类风味物质的形成。
表2 AR809及其EPS添加量对低脂发酵乳挥发性风味物质的影响 单位:ng/g
Table 2 Effect of AR809 and its EPS on volatile flavor compounds in low-fat fermented milk

编号挥发性风味物质全脂对照低脂对照EPS-0.02EPS-0.04EPS-0.06AR809酮类13′,4′,7-三甲氧基槲皮素0.07±0.001 20.276±0.0050.659±0.0112.598±0.096——22,6-二甲基-4-吡喃酮0.32±0.029—————32-壬酮0.87±0.0411.014±0.001 6—1.037±0.001 61.103±0.0141.436±0.002 143-羟基-2-丁酮18.2±0.02213.34±0.0351.076±0.002 10.183±0.002 117.02±0.001 618.95±0.0295仲辛酮——————62-十三烷酮—0.291±0.004 30.456±0.008 60.93±0.001 21.19±0.002 90.589±0.01972-庚酮——————82-羟基-3-戊酮—————3.24±0.04692,3-戊二酮——————合计26.0714.922.1914,74819.3124.215烃类10(+)-柠檬烯————0.159±0.002 40.21±0.03311癸烷8.22±0.0746.23±0.0125.7±0.0127.891±0.0496.315±0.0126.632±0.003 612正十六烷13.2±0.0389.036±0.0169.56±0.0140.653±0.007 717.463±0.08112.189±0.02313正十七烷3.24±0.0150.696±0.0770.959±0.0220.279±0.006 62.941±0.005 70.946±0.009 414十三烷—0.764±0.0210.804±0.003 51.033±0.006 30.9±0.004 10.696±0.029
续表2

注:“—”表示未检测出该成分。
编号挥发性风味物质全脂对照低脂对照EPS-0.02EPS-0.04EPS-0.06AR80915十四烷30.81±0.0832.94±0.01423.59±0.02844.73±0.0244.891±0.02739.87±0.02916正十五烷—0.169±0.004 33.502±0.0047.043±0.0146.66±0.0323.454±0.004合计55.4749.8444.1261.6139.3263.99醛类17壬醛6.83±0.0331.142±0.0141.767±0.003 61.939±0.0372.548±0.0150.864±0.01518苯甲醛1.7±0.03—————合计8.531.1421.7671.9392.5480.864酸类199-癸烯酸2.18±0.0250.897±0.028—1.896±0.025—1.44±0.02520冰醋酸1.22±0.002 110.43±0.0552.731±0.008 5—1.017±0.003 312.98±0.01921丁酸22.134±0.0151.842±0.0231.859±0.001 613.07±0.0443.701±0.005 73.508±0.02222庚酸3.014±0.0250.864±0.0160.671±0.004 11.063±0.0261.03±0.004 41.143±0.01423己酸1.659±0.01413.604±0.007 714.838±0.004 42.741±0.01831.06±0.09627.97±0.01624油酸——————25月桂酸1.433±0.018—1.483±0.001 62.091±0.0271.672±0.0241.536±0.01426正癸酸—7.483±0.0477.451±0.002 913.36±0.148 913.63±0.03713.18±0.05327正壬酸1.594±0.013—0.982±0.0122.12±0.054——28辛酸63.39±0.0213.12±0.01628.751±0.000 93.944±0.01439.13±0.02840.536±0.016合计96.62438.2458.76640.28591.24102.291醇类292-壬醇4.723±0.0161.194±0.0831.02±0.0100.957±0.0310.787±0.0250.841±0.022302-癸醇——0.583±0.003 70.594±0.0161.071±0.0210.62±0.004 7312-十六醇—0.156±0.004 40.696±0.005 01.415±0.0131.148±0.003 80.141±0.002 8322-乙基己醇—0.591±0.0280.71±0.0371.245±0.0193.182±0.004 00.993±0.01333苯乙醇——————34乙醇0.256±0.005 72.946±0.02016.92±0.0120.954±0.0629.793±0.0121.582±0.02135正庚醇—0.818±0.008 23.86±0.0050.247±0.0123.598±0.004 04.673±0.015362-十二烷醇———0.186±0.003 8——37正辛醇—3.716±0.0320.857±0.0241.179±0.009 41.065±0.0140.76±0.02438十二醇—0.432±0.0742.028±0.003 74.155±0.0175.931±0.008 61.983±0.01239八乙二醇0.174±0.018—0.112±0.009 2———40芳樟醇———1.399±0.004 2——41α-毕橙茄醇———0.308±0.014—0.429±0.03042环丁醇————2.492±0.031—43柏木脑0.564±0.004 30.767±0.03110.117±0.03332.71±0.02262.55±0.01813.115±0.023合计5.71710.6236.90345.34991.61725.136酯类44邻苯二甲酸二异丁酯1.446±0.004 11.124±0.0122.317±0.008 41.532±0.0133.613±0.0453.37±0.007 345水杨酸-2-乙基己基酯0.75±0.004 20.305±0.0111.015±0.054—3.897±0.0231.595±0.006 146辛酸乙酯0.275±0.001 60.294±0.002 290.338±0.004 80.242±0.014——47亚油酸乙酯——0.348±0.0365.892±0.005——48乙酸苯乙酯—0.379±0.0220.401±0.006 71.124±0.023——49硬脂酸乙酯0.531±0.021—0.281±0.0043——0.232±0.02150棕榈酸乙酯0.471±0.0911.591±0.0182.092±0.004 50.362±0.0330.946±0.0232.152±0.01451癸酸酯—————0.373±0.008 552反油酸乙酯3.378±0.001 60.926±0.00350.978±0.008 5—0.439±0.006 1—532,2,4-三甲基戊二醇异丁酯10.431±0.0280.441±0.02112.51±0.0333.512±0.006 65.117±0.006 921.429±0.006 154邻苯二甲酸二异丁酯1.44±0.012——1.532±0.017——55肉豆蔻酸异丙酯—0.112±0.0061.65±0.009 41.481±0.006 12.574±0.007 11.686±0.02656原膜散酯0.286±0.002 00.442±0.0200.367±0.002 15.3±0.0120.961±0.0160.507±0.01157正己酸乙酯——0.382±0.005 7—0.382±0.008 0—58甲酸-2-苯乙酯————0.26±0.017—59丙酸叶醇酯————8.029±0.007 1—合计19.0085.61422.62520.97726.21831.344
醛类化合物是发酵乳特征风味的重要成分,壬醛带有柑橘、鲜花香味,各组样品中均检测出壬醛,与低脂对照组相比,各实验组壬醛含量均有提升,并在EPS-0.06组含量最高。酸类物质能够促进发酵乳清爽口感,增加发酵乳乳香风味,同时也是其他风味物质转化前体。本研究发现,AR809组及其EPS添加组均能提高丁酸、辛酸等风味物质的含量。说明添加AR809及其EPS809有利于发酵乳良好风味的形成。
3 结论
本研究表明,在低脂发酵乳加工过程中,添加唾液联合乳杆菌AR809胞外多糖EPS809对发酵乳成品产生了显著影响,唾液联合乳杆菌AR809及EPS能够缩短凝乳时间,控制冷藏阶段发酵乳的后酸化程度。同时,EPS809有效改善低脂发酵乳持水力差、乳清易析出等问题。适量添加EPS809可提高发酵乳黏度,降低低脂发酵乳硬度。并且增强了低脂发酵乳内部蛋白质的交联结构,使其蛋白颗粒变小,与EPS形成链状聚合,使低脂发酵乳具有更强的内聚性和抗剪切应力。挥发性物质分析进一步表明,AR809胞外多糖EPS809能够提高低脂发酵乳的风味和适口性,有利于醇酯类风味物质的形成。本文研究表明,AR809胞外多糖EPS809可作为一种稳定的脂肪替代物添加至低脂发酵乳中, 为EPS在发酵乳加工等应用中展现出改善结构和风味特性的良好前景。
[1] 李春燕, 熊智强, 王光强, 等.乳酸菌附属发酵剂的筛选及其对干酪浆蛋白水解的影响[J].食品与发酵工业, 2022, 48(17):129-135.LI C Y, XIONG Z Q, WANG G Q, et al.Screening of lactic acid bacteria adjunct culture and its effect on the proteolysis of cheese slurry[J].Food and Fermentation Industries, 2022, 48(17):129-135.
[2] 沈兴旺, 李婉麒, 赵创谦, 等.高品质牦牛发酵乳的成熟特性[J].食品与发酵工业, 2020, 46(20):40-45;52.SHEN X W, LI W Q, ZHAO C Q, et al.Study on maturation characteristics of high-quality yak yogurt[J].Food and Fermentation Industries, 2020, 46(20):40-45;52.
[3] 杨勇, 宋馨, 熊智强, 等.人源唾液乳杆菌AR809全基因组测序及不同唾液乳杆菌菌株比较基因组学分析[C].第十七届益生菌与健康国际研讨会论文集, 北京:中国轻工业出版社,2022.YANG Y, SONG X, XIONG Z Q, et al.Whole genome sequencing of human Lactobacillus salivarius AR809 and comparative genomic analysis of different Lactobacillus salivarius strains[C].Proceedings of the seventeenth International Symposium on Probiotics and Health, 2022.
[4] BURNS P, VINDEROLA G, REINHEIMER J, et al.Technological characterization and survival of the exopolysaccharide-producing strain Lactobacillus delbrueckii subsp.lactis 193 and its bile-resistant derivative 193+ in simulated gastric and intestinal juices[J].Journal of Dairy Research, 2011, 78(3):357-364.
[5] 高鑫, 李博.低脂发酵乳品质改善研究进展[J].保鲜与加工, 2023, 23(9):76-80.GAO X, LI B.Progress in improving the quality of low-fat fermented dairy products[J].Storage and Process, 2023, 23(9):76-80.
[6] NG K S, CHANG Y C, CHEN Y P, et al.Characterization of exopolysaccharide-producing lactic acid bacteria from Taiwanese ropy fermented milk and their application in low-fat fermented milk[J].Asian-Australasian Journal of Animal Sciences, 2022, 35(2):281-289.
[7] Y LD
LD Z N, BAK
Z N, BAK RC
RC I.Investigation of the use of whey powder and buttermilk powder instead of skim milk powder in yogurt production[J].Journal of Food Science and Technology, 2019, 56(10):4429-4436.
I.Investigation of the use of whey powder and buttermilk powder instead of skim milk powder in yogurt production[J].Journal of Food Science and Technology, 2019, 56(10):4429-4436.
[8] 刘清霞, 林伟锋, 陈中.嗜热链球菌在脱脂乳中发酵特性的研究[J].食品工业科技, 2017, 38(3):122-126.LIU Q X, LIN W F, CHEN Z.Study on fermentation of Streptococcus thermophilus in skimmed milk[J].Science and Technology of Food Industry, 2017, 38(3):122-126.
[9] DOLEYRES Y, SCHAUB L, LACROIX C.Comparison of the functionality of exopolysaccharides produced in situ or added as bioingredients on yogurt properties[J].Journal of Dairy Science, 2005, 88(12):4146-4156.
[10] 李佳伟, 虞宁馨, 于连升, 等.乳酸菌胞外多糖在食品工业中的应用研究[J].中国酿造, 2023, 42(6):17-21.LI J W, YU N X, YU L S, et al.Application of exopolysaccharides of lactic acid bacteria in food industry[J].China Brewing, 2023, 42(6):17-21.
[11] 蔡淼, 郝晓娜, 罗天淇, 等.植物乳杆菌YW11胞外多糖对酸乳加工特性的影响[J].食品科学, 2021, 42(14):39-45.CAI M, HAO X N, LUO T Q, et al.Processing properties of yogurt affected by the exopolysaccharide produced by Lactobacillus plantarum YW11[J].Food Science, 2021, 42(14):39-45.
[12] 王辑. 植物乳杆菌K25在发酵乳中的应用研究[D].长春:吉林农业大学, 2012.WANG J.Application of Lactobacillus plantarum K25 in fermented milk[D].Changchun:Jilin Agricultural University, 2012.
[13] CHEN X Q, ZHAO Z F, ZHANG C Y, et al.Effect of epigallocatechin gallate on the fermentative and physicochemical properties of fermented milk[J].Journal of Dairy Science, 2022, 105(9):7322-7333.
[14] 许倩倩, 林美丽, 刘雪妮, 等.红烧牛肉罐头香味活性化合物的分析[J].食品科学, 2012, 33(12):238-241.XU Q Q, LIN M L, LIU X N, et al.Analysis of aroma-active compounds in canned stewed beef[J].Food Science, 2012, 33(12):238-241.
[15] GENG T T, HE F, SU S, et al.Probiotics Lactobacillus rhamnosus GG ATCC53103 and Lactobacillus plantarum JL01 induce cytokine alterations by the production of TCDA, DHA, and succinic and palmitic acids, and enhance immunity of weaned piglets[J].Research in Veterinary Science, 2021, 137:56-67.
[16] PANG Z H, DEETH H, YANG H S, et al.Evaluation of Tilapia skin gelatin as a mammalian gelatin replacer in acid milk gels and low-fat stirred yogurt[J].Journal of Dairy Science, 2017, 100(5):3436-3447.
[17] 房晓彬. 植物乳杆菌JLAU103胞外多糖的理化特性及生物活性研究[D].长春:吉林农业大学,2019.FANG X B.Characterization and biological activities of the exopolysaccharide from Lactobacillus plantarum JLAU103 [D].Changchun:Jilin Agricultural University, 2019.
[18] 李瑞东. 植物乳杆菌胞外多糖协同鱼明胶改善低脂酸奶品质特性研究[D].长春:吉林农业大学, 2022.LI R D.Study on Lactobacillus plantarum exopolysaccharide synergistically withfish gelatin to improve the quality characteristics of low-fat yogurt [D].Changchun:Jilin Agricultural University, 2022.
[19] 罗天淇, 蔡淼, 张敏, 等.辅助发酵菌株对发酵乳品质的影响[J].乳业科学与技术, 2019, 42(3):1-8.LUO T Q, CAI M, ZHANG M, et al.Effects of adjuvant starter cultures on the quality of fermented milk[J].Journal of Dairy Science and Technology, 2019, 42(3):1-8.
[20] ZHAO J L, MA C M, ZHAO X H, et al.Effects of yam (Dioscorea opposita Thunb.) juice on fermentation and textural attributes of set-style skimmed yoghurt[J].Journal of Food Measurement and Characterization, 2021, 15(3):2220-2230.
[21] OLEKSY M, KLEWICKA E.Exopolysaccharides produced by Lactobacillus sp.Biosynthesis and applications[J].Critical Reviews in Food Science and Nutrition, 2018, 58(3):450-462.