生物胺 (biogenic amine, BA)是发酵食品中普遍存在的健康风险因子之一,主要由氨基酸脱羧或醛酮氨基化反应形成[1-2]。发酵食品中包括乳酸菌(lactic acid bacteria, LAB)在内的多种微生物均可能产生物胺[3-4],抑制产生物胺微生物的生长是控制生物胺积累的方法之一。与杂菌不同,乳酸菌作为食品发酵中的关键功能性微生物[5-6],不能通过简单地抑制其生长实现减少生物胺生成的目的。采用不产生生物胺或具有降低生物胺能力的乳酸菌,是常用的解决方案[7-11]。但在混菌发酵体系中,强化优良乳酸菌株在减少生物胺生成方面的作用规律尚不完全清楚。添加外源物是减少食品发酵中生物胺积累的常用方式[12-15]。本研究室前期研究结果显示,添加西洋参提取液,可在较小影响乳酸菌发酵的前提下减少生物胺形成。本研究考察了不同比例的产胺和不产胺乳酸菌混菌发酵中的生物胺积累规律,以及添加西洋参提取液对乳酸菌混菌发酵中生物胺形成的影响,为乳酸菌主导或参与的食品发酵中的生物胺控制提供参考。
1 材料与方法
1.1 材料与试剂
产酪胺的Lactobacillus brevis A1-8(产胺菌Ⅰ)、产腐胺的L.brevis B2(产胺菌Ⅱ)和不产生物胺的Lactiplantibacillus plantarum-6(不产胺菌),本实验室保藏。
MRS肉汤培养基、MRS琼脂培养基、溴甲酚紫、鸟氨酸、酪氨酸,北京Solarbio科技有限公司;5′-磷酸吡哆醛,阿达玛斯科技有限公司;丹磺酰氯,上海阿拉丁生化科技股份有限公司;NaOH、NaCl、NaHCO3、丙酮、乙醚(色谱级)、乙腈(色谱级),四川兴向实验设备有限公司;PBS,北京兰杰柯科技有限公司。
1.2 仪器与设备
1260 Infinity Ⅱ型高效液相色谱仪,美国安捷伦科技有限公司;TGL-1650型高速冷冻离心机,四川署科仪器有限公司;JY96ⅡN型超声细胞破碎仪,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 菌株活化及西洋参提取液制备
将1 mL甘油管中保存的乳酸菌接种至100 mL灭菌后的MRS液体培养基中,37 ℃,培养24 h。
将西洋参饮片打磨成粉,过30目筛后取30 g粉末,添加100 mL超纯水浸泡1 h,然后大火熬煮至沸腾转小火继续熬煮1 h,用8层无菌纱布过滤,收集滤液并调整西洋参提取液质量浓度为0.2 g/mL。
1.3.2 乳酸菌混菌发酵体系
配制酪氨酸和鸟氨酸质量浓度均为2.0 g/L、NaCl体积分数为2%的MRS液体培养基灭菌后分别接种:混菌体系Ⅰ(产胺菌Ⅰ+不产胺菌)和混菌体系Ⅱ(产胺菌Ⅱ+不产胺菌)。两种混菌体系均采用两种组合:1)产胺菌0.5 mL+不产胺菌0.5 mL;2)产胺菌0.3 mL+不产胺菌0.7 mL,分别以两种产胺菌纯菌株接种1 mL作为对照,其中,产胺菌Ⅰ、产胺菌Ⅱ和不产胺菌的接种浓度均为2×106 CFU/mL。
在前述各发酵体系分别加入8%(以发酵液体积计)的西洋参提取液,构成含西洋参提取液的混菌发酵体系,37 ℃培养48 h,取培养第0、4、8、12、24、48 h的样品测定发酵液pH、总酸、乳酸菌数量、生物胺含量。
1.3.3 乳酸菌氨基酸脱羧酶粗酶液活性的检测
酪氨酸脱羧酶(产胺菌Ⅰ)和鸟氨酸脱羧酶(产胺菌Ⅱ)粗酶液的制备参考彭春龙等[16]的方法,在酶反应体系中分别加入8%(以反应液体积计)的西洋参提取液,以不含西洋参提取液的两种产胺菌氨基酸脱羧酶粗酶液作为对照,37 ℃培养48 h,取培养第0、6、12、24、48 h的样品测定其生物胺含量。
1.3.4 生长曲线测定
将活化后的产胺菌Ⅰ、产胺菌Ⅱ和不产胺菌菌液置于37 ℃恒温摇床中培养24 h,每隔2 h测定1次菌液在600 nm处的吸光度。
1.3.5 理化指标测定
pH值采用pH计进行测定;总酸采用酸碱滴定法测定,总酸含量以乳酸计,具体操作参照国标GB 12456—2021《食品安全国家标准 食品中总酸的测定》。
1.3.6 产生物胺和不产生物胺乳酸菌计数
参照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》乳酸菌计数方法略作修改,培养基在MRS琼脂的基础上加入2.0 g/L的氨基酸、5′-磷酸吡哆醛0.05 g/L、溴甲酚紫0.06 g/L并调节pH至7.0。取不同发酵时间的样品梯度稀释至10-6,接种到含有显色剂溴甲酚紫的MRS显色培养基上,37 ℃培养48 h后对产胺和不产胺乳酸菌进行计数,其中淡蓝色乳酸菌菌落为产胺菌,黄色乳酸菌菌落为不产胺菌[17-18]。
1.3.7 生物胺含量测定
参照唐小曼等[19]的方法,其中高效液相色谱条件为:C18色谱柱(250 mm×4.6 mm,5 μm),紫外检测波长254 mm,进样量20 μL,流速0.8 mL/min,柱温35 ℃,流动相A为超纯水,流动相B为乙腈,梯度洗脱条件参考GB 5009.208—2016 《食品安全国家标准 食品中生物胺的测定》。
1.4 数据分析
采用SPSS 22.0和Excel 2021软件进行数据分析,Origin 2021 软件作图。
2 结果与分析
2.1 两种混菌体系的发酵和生物胺积累规律
产胺菌Ⅰ、产胺菌Ⅱ及不产胺菌的生长曲线如图1-a所示,3种菌在0~4 h均为迟滞期,之后的培养过程中,不产胺菌的生长速度极显著高于产胺菌Ⅱ(P<0.000 1)、显著高于产胺菌Ⅰ(P<0.01)。

a-生长曲线;b-pH;c-总酸
图1 三种乳酸菌的生长曲线及pH和总酸变化
Fig.1 The growth curve and the changes of pH and total acid contents of the three LAB strains
3种乳酸菌发酵中的pH和总酸变化如图1-b和图1-c所示。发酵结束时,产胺菌Ⅰ、产胺菌Ⅱ及不产胺菌的pH分别为3.56、3.56和3.68,总酸含量分别为16.47、15.23、17.07 g/L;不产胺菌和产胺菌Ⅰ的产酸能力相当,显著高于产胺菌Ⅱ(P<0.01)。
2种乳酸菌混菌发酵体系中的pH、总酸、乳酸菌总数、产胺乳酸菌数和生物胺含量变化如图2所示。随着发酵的进行,两种混菌体系各发酵组的pH值均先快速下降,后随着发酵的进行至平稳状态,处于3.5~4.0;总酸先上升后至平稳。混菌体系I中,不同比例的混菌发酵组pH和总酸在发酵后期较对照无显著差异(P>0.05);混菌体系Ⅱ在发酵过程中pH低于对照组(P<0.01),总酸高于对照组(P<0.001),且随着不产胺菌接种比例的增大而增加,推测与产胺菌Ⅱ产酸能力相对较弱有关。

a-混菌体系Ⅰ pH;b-混菌体系Ⅰ总酸;c-混菌体系Ⅰ乳酸菌总数;d-混菌体系Ⅰ产胺乳酸菌数;e-混菌体系Ⅰ生物胺含量;f-混菌体系Ⅱ pH;g-混菌体系Ⅱ总酸;h-混菌体系Ⅱ乳酸菌总数;I-混菌体系Ⅱ产胺乳酸菌数;J-混菌体系Ⅱ生物胺含量
图2 乳酸菌混菌体系Ⅰ和混菌体系Ⅱ发酵中的pH、总酸、乳酸菌总数、产胺乳酸菌数及生物胺含量变化
Fig.2 Changes of pH, total acid contents, total number of LAB, number of BA-producing LAB, and BA contents during the fermentation processes of mixed LAB system Ⅰ and Ⅱ
2种混菌体系各发酵组乳酸菌总数随着发酵的进行增加至平稳;混菌发酵组在整个发酵过程中乳酸菌总数和产胺乳酸菌数均显著低于对照(P<0.05)。混菌体系Ⅰ中,不产胺菌接种比例对乳酸菌总数和产胺乳酸菌数无显著影响(P>0.05),混菌体系Ⅱ中,乳酸菌总数和产胺乳酸菌数随着不产胺菌接种比例的增大而减少(P<0.05),产胺菌Ⅱ菌数在发酵结束时减少60%~80%,推测与产胺菌Ⅱ生长速度慢、竞争力较弱有关。
2种混菌体系各发酵组生物胺含量变化趋势大致相同,在发酵前期迅速上升后趋于平稳;整个发酵过程中生物胺含量均显著低于对照(P<0.05),混菌体系Ⅰ和混菌体系Ⅱ发酵结束时与对照相比可分别降低18%和23%。混菌体系Ⅰ中,不产胺菌接种比例对生物胺含量影响不大;混菌体系Ⅱ中,生物胺含量随着不产胺菌接种比例的增大而降低。2种混菌体系中生物胺与产胺菌数量的减少趋势大体一致,但不成比例。一般而言,增加不产胺微生物接种比例可以达到减少生物胺生成的效果[20-21],本研究显示,这种效果在不同乳酸菌混菌体系中存在差异,与产胺乳酸菌本身的产酸及生长能力有关;此外,不产胺微生物的接入对生物胺的降低幅度有限,生物胺的降低与不产胺菌的接入比例的增加并非简单的线性关系。
2.2 添加西洋参提取液对乳酸菌混菌体系生物胺积累和氨基酸脱羧酶催化活性的影响
为探讨在不影响乳酸菌发酵的前提下进一步减少生物胺生成的可能,在2种混菌体系中添加了西洋参提取液进行试验(图3)。与2.1节中不含西洋参提取液的两种混菌体系相比,添加西洋参提取液,对各组pH和总酸,以及混菌体系I中乳酸菌总数及产胺乳酸菌数量无明显影响(P>0.05);混菌体系Ⅱ中乳酸菌总数及产胺乳酸菌数量略有降低(P<0.05),发酵结束第48 h时产胺乳酸菌数可降低5%~10%;各组生物胺水平均进一步降低,发酵结束后混菌体系Ⅰ酪胺含量降低10%~20%,混菌体系Ⅱ腐胺含量降低约20%~30%。

a-混菌体系Ⅰ pH;b-混菌体系Ⅰ总酸;c-混菌体系Ⅰ乳酸菌总数;d-混菌体系Ⅰ产胺乳酸菌数;e-混菌体系Ⅰ生物胺含量;f-混菌体系Ⅱ pH;g-混菌体系Ⅱ总酸;h-混菌体系Ⅱ乳酸菌总数;i-混菌体系Ⅱ产胺乳酸菌数;j-混菌体系Ⅱ生物胺含量
图3 添加西洋参提取液对乳酸菌混菌体系I和混菌体系Ⅱ发酵中的pH、总酸、乳酸菌总数、产胺乳酸菌数及生物胺含量的影响
Fig.3 Effects of adding American ginseng extract on the pH, total acid, total number of LAB, number of BA-producing LAB, and BA contents in the fermentation of mixed LAB system Ⅰ and Ⅱ
添加西洋参提取液的实验组的生物胺形成和产胺菌生长都有所下降,但降低幅度不成比例,说明生物胺形成的减少还与其他环节有关。添加西洋参提取液对酪氨酸脱羧酶和鸟氨酸脱羧酶粗酶液催化活性的影响见图4,添加西洋参提取液组的生物胺含量都低于不含西洋参提取液的对照组;反应结束第48 h时的酪胺和腐胺含量分别较对照降低27%和58%,这与前文西洋参提取液对产胺菌Ⅱ腐胺积累有较强的抑制效果相对应,提示西洋参提取液有可能直接抑制氨基酸脱羧酶活性。
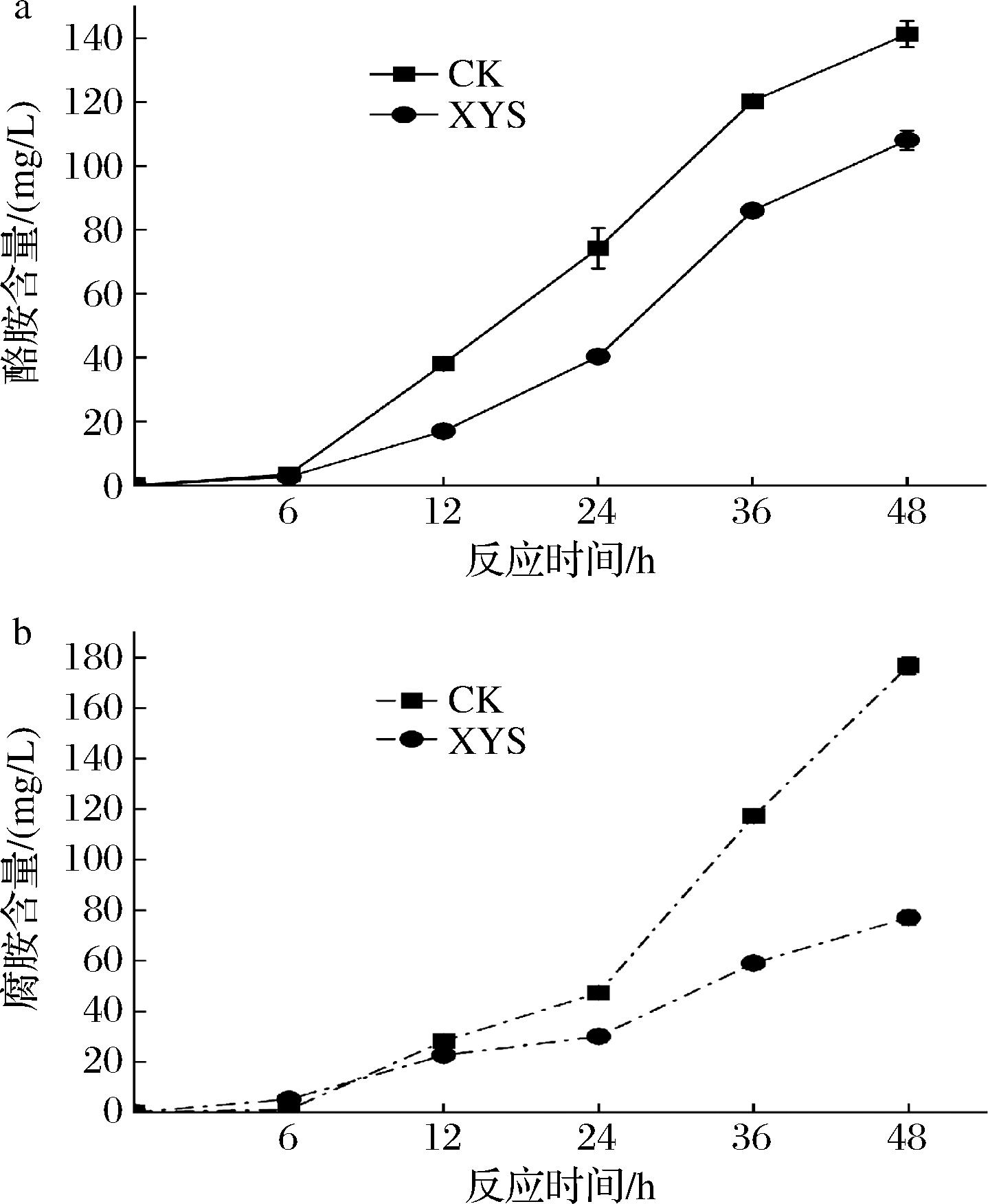
a-酪氨酸脱羧酶;b-鸟氨酸脱羧酶
图4 西洋参提取液对酪氨酸脱羧酶和鸟氨酸脱羧酶催化产胺的影响
Fig.4 Effects of adding American ginseng extract on BA formation catalyzed by tyrosine decarboxylase and ornithine decarboxylase
本研究显示西洋参提取液可能通过减少产胺菌Ⅱ 5%~10%的生物数量和直接抑制两种氨基酸脱羧酶活性来达到降低生物胺积累的效果。由于生物胺的积累还涉及氨基酸脱羧酶基因转录表达和相关组分转运等环节,故西洋参提取液对生物胺的控制详细机制还有待进一步探讨。
3 结论与讨论
本研究考察了不同比例的产胺和不产胺乳酸菌混菌发酵中的生物胺积累规律,以及添加西洋参提取液对乳酸菌混菌发酵中生物胺形成的影响。结果表明,混菌体系Ⅰ中不同比例混菌发酵组之间生物胺水平差异不大;混菌体系Ⅱ中生物胺含量随着不产胺菌接种比例的增大而降低,主要是由于产胺菌Ⅱ生长速度慢、竞争力较弱。添加西洋参提取液,对两种混菌体系发酵中的pH和总酸,以及混菌体系I中乳酸菌总数及产胺乳酸菌无明显影响;混菌体系Ⅱ中乳酸菌总数及产胺乳酸菌数量略有降低;混菌体系Ⅰ和Ⅱ的生物胺水平均分别降低10%~20%和20%~30%。西洋参提取液对酪氨酸脱羧酶和鸟氨酸脱羧酶活性分别降低27%和58%。西洋参提取液可能通过减少产胺菌Ⅱ 5%~10%的生物数量和直接抑制两种氨基酸脱羧酶活性来达到降低生物胺积累的效果。
[1] JAGUEY-HERN NDEZ Y, AGUILAR-ARTEAGA K, OJEDA-RAMIREZ D, et al.Biogenic amines levels in food processing:Efforts for their control in foodstuffs[J].Food Research International, 2021, 144:110341.
NDEZ Y, AGUILAR-ARTEAGA K, OJEDA-RAMIREZ D, et al.Biogenic amines levels in food processing:Efforts for their control in foodstuffs[J].Food Research International, 2021, 144:110341.
[2] SAHA TURNA N, CHUNG R, MCINTYRE L.A review of biogenic amines in fermented foods:Occurrence and health effects[J].Heliyon, 2024, 10(2):e24501.
[3] ZHANG L L, XIONG S J, DU T H, et al.Exploring the core microorganisms and mechanisms responsible for biogenic amines production during soy sauce fermentation[J].Food Bioscience, 2024, 59:104236.
[4] BANICOD R J S, NTEGE W, NJIRU M N, et al.Production and transformation of biogenic amines in different food products by the metabolic activity of the lactic acid bacteria[J].International Journal of Food Microbiology, 2025, 428:110996.
[5] 马岩, 李玉星, 李柏良.瑞士乳杆菌LH43作为辅助发酵剂对酸奶品质和蛋白质构象的影响[J].食品科学, 2025, 46(5):134-141.MA Y, LI Y X, LI B L.Effect of Lactobacillus helveticus LH43 as an auxiliary starter on the quality and protein conformation of yogurt[J].Food Science, 2025, 46(5):134-141.
[6] 罗珍岑, 杨宗朋, 赵艳军, 等.乳酸菌对固态发酵食醋品质提升的研究进展[J].食品研究与开发, 2024, 45(21):217-224.LUO Z C, YANG Z P, ZHAO Y J, et al.Research progress on quality improvement of solid-state fermented vinegar using lactic acid bacteria[J].Food Research and Development, 2024, 45(21):217-224.
[7] 田旭艳, 高沛, 夏文水, 等.接种戊糖乳杆菌和酿酒酵母菌对低盐发酵鳊鱼品质的影响[J].南方水产科学, 2022, 18(2):124-133.TIAN X Y, GAO P, XIA W S, et al.Effects of inoculation of Lactiplantibacillus pentosus and Saccharomyces cerevisiae on quality of low-salt fermented bream[J].South China Fisheries Science, 2022, 18(2):124-133.
[8] FONG F L Y, LAM K Y, SAN LAU C, et al.Reduction in biogenic amines in Douchi fermented by probiotic bacteria[J].PLoS One, 2020, 15(3):e0230916.
[9] ZHANG Y, QIN Y X, WANG Y, et al.Lactobacillus plantarum LPL-1, a bacteriocin producing strain, changed the bacterial community composition and improved the safety of low-salt fermented sausages[J].LWT, 2020, 128:109385.
[10] 潘思弋, 徐佳敏, 张惠玲, 等.一株降解生物胺乳酸菌用于葡萄酒苹果酸乳酸发酵的特性研究[J].食品与发酵工业, 2023, 49(24):140-148.PAN S Y, XU J M, ZHANG H L, et al.Characteristics of wine malolactic fermentation by a biogenic amine-degrading lactic acid bacterium[J].Food and Fermentation Industries, 2023, 49(24):140-148.
[11] 张杨, 李歆宇, 马新秀, 等.生物胺降解菌Staphylococcus xylosus JCM2418的特性研究及应用[J].食品研究与开发, 2023, 44(20):191-198.ZHANG Y, LI X Y, MA X X, et al.Characterization research and application of biogenic amine degrading bacterium Staphylococcus xylosus JCM 2418[J].Food Research and Development, 2023, 44(20):191-198.
[12] BOZKURT H.Comparison of the effects of sesame and Thymbra spicata oil during the manufacturing of Turkish dry-fermented sausage[J].Food Control, 2007, 18(2):149-156.
[13] 张永生, 刘冬敏, 王建辉, 等.植源性天然产物在食品中降生物胺作用研究进展[J].食品科学, 2022, 43(3):315-324.ZHANG Y S, LIU D M, WANG J H, et al.Advances in understanding the effects of plant-derived natural products on biogenic amine reduction in foods[J].Food Science, 2022, 43(3):315-324.
[14] 肖付才, 刘凯, 陈凤仪, 等.有机酸对泡菜亚硝酸盐和生物胺的抑制作用[J].中国调味品, 2020, 45(10):80-84.XIAO F C, LIU K, CHEN F Y, et al.Inhibition of nitrite and biogenic amines in pickle by organic acids[J].China Condiment, 2020, 45(10):80-84.
[15] JIN Y H, LEE J S, PAWLUK A M, et al.Inhibitory effects of nicotinic acid, glycine, and other food additives on biogenic amine formation in Baechu kimchi fermentation[J].LWT, 2022, 155:112921.
[16] 彭春龙, 黄俊, 赵伟睿, 等.酸胁迫下短乳杆菌谷氨酸脱羧酶系统关键基因的表达及酶活性响应[J].高校化学工程学报, 2015, 29(2):359-365.PENG C L, HUANG J, ZHAO W R, et al.Effects of acid stress on the expression of key genes of glutamate decarboxylase system and enzyme activity in Lactobacillus brevis[J].Journal of Chemical Engineering of Chinese Universities, 2015, 29(2):359-365.
[17] 黄岩, 鲜双, 李倩, 等.豇豆泡菜中产生物胺菌株的筛选鉴定及其产胺特性研究[J].食品与发酵工业, 2023, 49(23):119-126.HUANG Y, XIAN S, LI Q, et al.Screening and identification of biogenic amines producing strains in cowpea pickle and their biogenic amines producing characteristics[J].Food and Fermentation Industries, 2023, 49(23):119-126.
[18] 蒙菊. 酸鱼典型产胺微生物菌株产胺效应研究[D].贵阳:贵州大学, 2020.MENG J.Amine-producing effects of typical amine-producingmicroorganism strains of Suan Yu[D].Guiyang:Guizhou University, 2020.
[19] 唐小曼, 唐垚, 张其圣, 等.四川工业泡豇豆主要生物胺的形成及降解分析[J].食品与发酵工业, 2019, 45(21):86-92.TANG X M, TANG Y, ZHANG Q S, et al.Formation and degradation analysis of main biogenic amines in Sichuan industrial pickled cowpea[J].Food and Fermentation Industries, 2019, 45(21):86-92.
[20] 段亮杰. 黄酒中生物胺代谢合成微生物群落初步探究[D].无锡:江南大学, 2020.DUAN L J.Formation and degradation analysis of main biogenic amines in Sichuan industrial pickled cowpea[D].Wuxi:Jiangnan University, 2020.
[21] HE H P, GE Y Y, MA X Y, et al.Effect of LacBS/LacBP on biogenic amines degradation, physicochemical property, and flavor of Huangjiu[J].Food Chemistry, 2025, 475:143244.