鹰嘴豆是蛋白质的良好来源,据研究发现,鹰嘴豆分离蛋白(chickpea protein isolate,CPI)具有产量高、成本低、必需氨基酸比例良好、生物利用度高、致敏性低等优点[1]。然而,由于植物细胞壁的复杂性、各种抗营养因子的存在以及提取方式对蛋白质的破坏,导致CPI功能特性(如溶解度、乳化性、起泡性等)受到限制。因此,需通过改性技术修饰CPI的结构并改善其功能性质,拓展其在食品领域的应用范围[2]。
作为一种简单、温和且有效的化学改性方法,pH偏移可以增强功能特性,当蛋白质暴露在极端酸性或碱性条件下,会造成氨基酸带电侧链基团之间的分子排斥,从而导致蛋白质结构部分展开。然后将溶液pH回调至中性,蛋白质部分重新折叠形成新的聚集态或柔性构象[3]。研究证明,pH偏移可以提高蛋白质的溶解度和乳化性,例如大豆蛋白和豌豆蛋白[4]。但对于结构刚性较强的CPI,单一pH偏移的改性效率有限,需结合其他技术协同增效。
高压均质是一种物理非热加工技术,近年来在蛋白质结构修饰与功能调控方面展现出独特优势。该技术主要通过产生空化、剪切、湍流等多重物理作用,实现对蛋白质分子构象的精准调控[5]。研究表明,经适当强度的高压均质处理可显著改善多种蛋白质的功能特性,WANG等[6]研究发现,高压均质改性使酵母蛋白zeta电位增加,同时粒径减小,从而提高了蛋白质的乳化性能。大豆分离蛋白经过均质化改性后,其胶体稳定性和加工适应性得到明显改善[7]。在分子机制研究方面,学者发现不同压力阈值会对蛋白质产生差异化影响,例如乳球蛋白在中等压力范围内呈现构象可逆变化,但当压力超过临界值时则可能发生不可逆的纤维化转变[8]。相较于传统热加工方式,该技术在保持蛋白质生物活性方面具有突出优势。目前研究重点正转向工艺参数的精细化调控,以及与其他新兴技术的协同应用,以期在食品营养强化和生物材料开发等领域实现突破。
基于此,本研究提出假设:高压均质剪切和空化效应与pH偏移对CPI的协同作用,可以更高效地改善CPI的功能特性,满足饮料、肉制品、冰淇淋等多元化食品体系的应用需求。因此,本研究旨在探讨高压均质、pH偏移和二者联合如何改变CPI的结构和功能性质,为鹰嘴豆蛋白加工产业的技术提供理论支撑。
1 材料和方法
1.1 材料与仪器
CPI(80%),汉溯源(陕西)生物科技有限公司;金龙鱼大豆油,益海(周口)粮油工业有限公司;SDS,天津市风船化学试剂科技有限公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB],上海麦克林生化科技股份有限公司;1-苯胺-8-萘磺酸(1-anilino-8-naphthalenesulfonic acid,ANS),阿拉丁试剂(上海)有限公司;其余试剂均为分析纯。
GJJ-0.05/60实验室高压均质机,上海诺尼轻工机械有限公司;FE28 pH计,梅特勒-托利多仪器(上海)有限公司;Zetasizer NANO-ZS90型纳米粒度表面电位分析仪,英国Malvern公司;Sigma 360扫描电镜,德国Zeiss公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;Vertex 70傅里叶变换红外光谱仪,德国布鲁克光谱仪器分析;F-7000荧光光度计,日本日立公司;Tracker S全自动界面流变仪,法国泰克利斯仪器有限公司。
1.2 实验方法
1.2.1 样品的制备
将CPI粉末分散在超纯水中至终质量浓度为10 mg/mL,并搅拌过夜以确保水合,得到原始CPI溶液。实验分为4组:对照(CK)组,未处理的CPI;pH偏移处理(P12)组,分别用1 mol/L HCl和NaOH将蛋白质溶液的pH值调至12,并在磁力搅拌器下搅拌1 h,随后,用相应的酸或碱将pH为12的蛋白质溶液pH调为7,并搅拌1 h;高压均质处理(H40)组,将蛋白质溶液在40 MPa下进行高压均质化,持续3个循环;高压均质联合pH偏移(P12H40)组,将蛋白质溶液的pH值调为12,在室温下搅拌1 h,进行高压均质,均质后用相应的酸和碱将溶液调为7,并搅拌1 h使其稳定。
1.2.2 粒径和电位
将样品溶于超纯水中,制备0.5 mg/mL的样品溶液,在25 ℃下进行磁力搅拌直至溶解,然后,使用纳米粒度电位仪在25 ℃下测定蛋白质溶液的粒径和电位,每个样品重复测定3次。
1.2.3 游离巯基含量的测定
参考HUANG等[9]的方法并稍作修改。用PBS(pH=7)配制浓度为5 mmol/L的DTNB,用超纯水配制1 mg/mL的蛋白样品,然后向3 mL各蛋白样品中分别加入50 μL DTNB,室温下避光反应30 min,8 000 r/min离心15 min,取其上清液,并采用紫外分光光度计于412 nm处测其吸光度,按公式(1)计算游离巯基含量。
—SH含量![]()
(1)
式中:A,样品的吸光度值;D,稀释倍数;C,样品溶液的浓度,mg/mL。
1.2.4 溶解度
参考徐亚等[10]的方法并稍作修改。称取0.005 g的样品与5 mL的超纯水溶于10 mL离心管中,在室温下搅拌1 h,使其样品充分溶解,8 000 r/min离心20 min,取上清液100 μL并加入考马斯亮蓝5 mL,涡旋30 s后静置2 min,使用紫外分光光度计在595 nm波长处测量吸光度。使用牛血清白蛋白作为标准曲线,通过考马斯亮蓝方法进行测定,按公式(2)计算溶解度。
溶解度![]()
(2)
1.2.5 表面疏水性(H0)
参考满金花等[11]的方法并稍作修改。将样品溶于超纯水中,配制0.065、0.125、0.25、0.5、1 mg/mL的蛋白质溶液,取20 μL 8 mmol/L的ANS加入到4 mL蛋白溶液中,混合均匀后避光静置20 min,测定其荧光强度,用荧光强度与蛋白浓度关系曲线的初始斜率表示H0。
1.2.6 扫描电子显微镜
取少量冻干样品固定在铝样品台上,对其进行喷金处理,在扫描电镜下分别观察放大10 000倍和1 000倍的不同CPI的表面形貌,并拍摄照片。
1.2.7 傅里叶红外光谱法
参考赵磊等[12]的方法并稍加修改。将干燥的KBr和3 mg的样品(KBr∶样品=100∶1)混合研磨成细碎粉末并进行压片,使用傅里叶红外光谱仪进行扫描,参数稳定在4 000~400 cm-1波数,分辨率为4 cm-1,并进行了32次扫描。通过PeakFit 4.12软件进行对红外光谱数据进行拟合分析。
1.2.8 内源荧光光谱
将上述各蛋白样品稀释至0.4 mg/mL,用荧光光度计测其内源荧光光谱,激发波长为280 nm,光电倍增管电压为400 V,激发和发射狭缝宽度分别为5 nm和5 nm。发射光谱设置为300~450 nm[13]。
1.2.9 持水性和持油性
将离心管质量记为m1,称取0.015 g的CPI,样品质量记为m0,向离心管中加入5 mL超纯水或大豆油,混合均匀,8 000 r/min离心15 min,去除上清液,然后称量离心管和其中剩余的样品质量,记为m2,持水性/持油性按公式(3)计算:
持水性/持油性![]()
(3)
1.2.10 起泡性和起泡稳定性
使用超纯水将各CPI蛋白样品分别配制成5 mg/mL的溶液,然后将20 mL蛋白溶液(V0)以20 000 r/min的速度匀浆1 min,将其快速倒入量筒内,测量0 min的泡沫层体积(V1)和静置20 min后的泡沫层体积(V2)。按公式(4)和公式(5)计算起泡性和起泡稳定性:
起泡性![]()
(4)
起泡稳定性![]()
(5)
1.2.11 乳化性能
参考WANG等[14]的方法并稍作修改。通过使用高速分散器将15 mL 3 mg/mL的CPI溶液与5 mL的大豆油以10 000 r/min粗均质化1 min来获得乳液。分别在均质后的0 min和10 min时,从容器底部吸取50 μL的乳液,并用5 mL的0.1%(质量分数)SDS将其稀释,然后用紫外分光光度计在500 nm波长下测量稀释溶液的吸光值。乳化活性和乳化稳定性分别按公式(6)、公式(7)计算:
乳化活性![]()
(6)
乳化稳定性![]()
(7)
式中:A0和A10分别是乳化0 min和10 min后的吸光度;N,稀释倍数;ρ,蛋白质质量浓度,mg/mL;φ,乳化液中油相的体积分数。
1.2.12 界面张力
参考WANG等[15]的方法并稍作修改。在25 ℃下,使用全自动界面流变仪测量样品与大豆油之间的界面张力,使用悬滴法观察界面张力随时间的变化规律。将各蛋白样品分别配制为0.2 mg/mL的溶液,置于注射器中,然后将15 μL蛋白样品溶液缓慢滴入盛有大豆油的比色皿中,连续测定7 200 s。
1.3 数据统计与分析
数据采用SPSS 27进行LSD和邓肯显著性分析,用Origin 2022作图。取3次平行试验的平均值, 以“平均数±标准差”表示,小写字母表示不同差异显著(P<0.05)。
2 结果与分析
2.1 高压均质和pH偏移处理对CPI粒径和电位的影响
如图1-a所示,与CK相比,处理组的粒径均显著降低,且经过高压均质和pH偏移联合处理的样品粒径最小从1 361.33 nm减小至275.8 nm。可能是极端碱性条件诱导蛋白质成为熔融球状结构,减少了部分蛋白质因去折叠而导致的侧链之间的相互作用,高压均质的剪切和空化效应进一步破坏了蛋白质分子间非共价相互作用,从而解聚成小的蛋白质颗粒[16]。粒径的减小可显著增加蛋白质在溶液中的结合效率,从而提高蛋白质的溶解度。
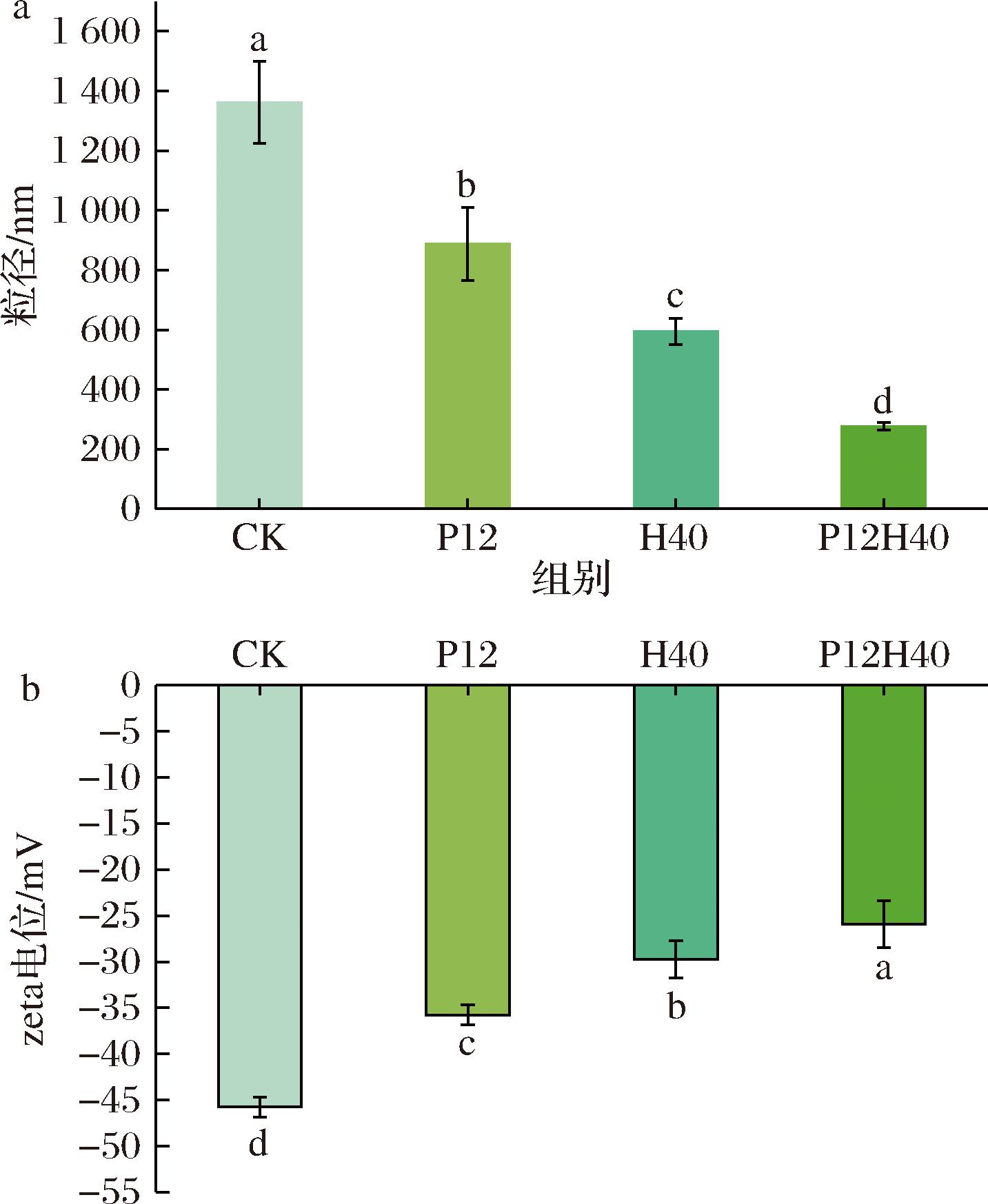
a-粒径;b-zeta电位
图1 不同处理下CPI的粒径和zeta电位
Fig.1 Particle size and zeta potential of CPI under different treatments
注:不同小写字母表示差异显著(P<0.05)(下同)。
如图1-b所示,与CK相比,经过改性的CPI样品的电位绝对值均显著降低,各样品的zeta电位绝对值排序为:CK>P12>H40>P12H40。其电位绝对值的降低可能是因为在pH变化过程中改变了蛋白质的暴露基团,进而影响了带正电的基团和带负电的基团之间的平衡,从而导致zeta电位的降低[17]。同时高压均质进一步通过剪切力和空化效应破坏蛋白质的聚集体,使蛋白表面暴露出更多的正电荷,削弱了CPI之间的静电斥力[18]。
2.2 高压均质和pH偏移处理对CPI游离巯基含量的影响
游离巯基(—SH)是影响蛋白质功能特性的官能团之一。如图2-a所示,与CK相比,经改性的CPI样品的游离巯基含量均发生了显著变化。P12的游离巯基含量显著低于CK,可能是由于在极端碱性环境下,—SH去质子化形成反应活性更高的硫醇离子种类,从而促进—SH氧化成S—S。同时,碱性环境有利于—SH与S—S的交换反应,从而导致—SH含量的降低[19]。与之相反的是,H40和P12H40的游离巯基含量显著高于CK,可能是由于高压均质会引起蛋白结构的变化,使粒径减小,蛋白质分子内部的巯基转移至分子表面,从而增加了游离巯基的含量[20]。本研究中的协同处理是在pH偏移的基础上,叠加高压均质的物理效应,进一步提高游离巯基暴露的效率,从而表现出更高的游离巯基含量。由于暴露的—SH基团本身属于极性基团,可增强蛋白质的水合作用,改善蛋白质的溶解性。此外,游离巯基的暴露还可提高蛋白质在界面的吸附能力,降低界面张力,从而稳定乳液或泡沫[21]。
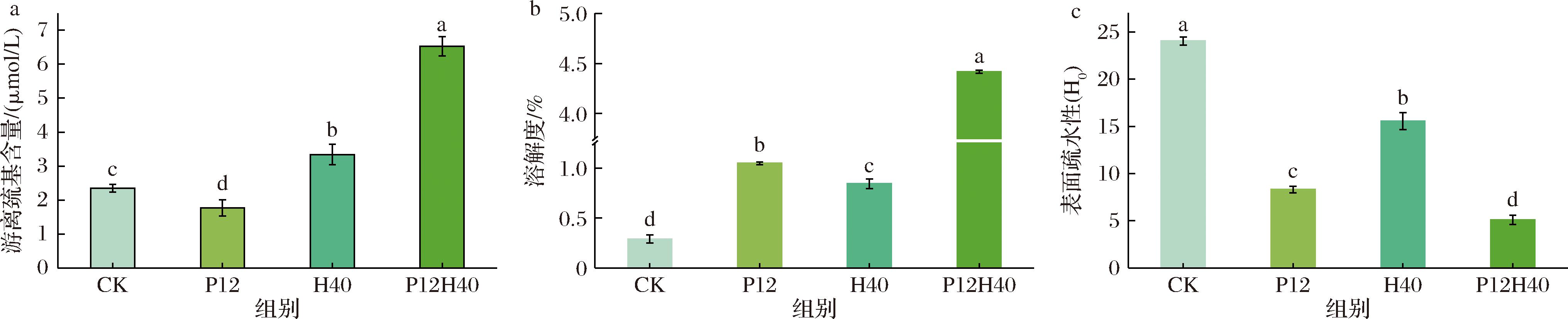
a-游离巯基含量;b-溶解度;c-表面疏水性
图2 不同处理下CPI的游离巯基含量、溶解度、表面疏水性
Fig.2 Free sulfhydryl content, solubility, and surface hydrophobicity of CPI under different treatments
2.3 高压均质和pH偏移处理对CPI溶解度的影响
如图2-b所示,相较于CK,改性CPI的溶解性均得到了显著提高。协同处理组(P12H40)的溶解度显著优于单一处理组(P12或H40)从0.29%增至4.42%。P12溶解度的增加可能是因为在碱性环境中,蛋白质发生可逆变性,疏水区域暴露,在回调为中性pH时部分重折叠,疏水区域重新被包埋,暴露出更多的亲水性氨基酸,从而增加了溶解度[22]。而H40溶解度的增加可能是由于高压均质通过强烈的剪切力、空穴效应和湍流作用,破坏蛋白质的聚集体或大分子组装体,将其解聚为更小的颗粒,增加表面亲水基团(如—OH、—COOH、—NH2)的暴露,从而提升水合能力[23]。然而,单一的高压均质处理无法有效地打开紧密的天然结构。因此,当高压均质联合pH偏移时,改性的CPI溶解度又显著升高。
2.4 高压均质和pH偏移处理对CPI表面疏水性的影响
表面疏水性(H0)可以用于表示蛋白质表面疏水基团的变化。如图2-c所示,与CK相比,P12、H40和P12H40的表面疏水性均显著降低,排序为CK>H40>P12>P12H40。P12的表面疏水性降低可能是因为pH偏移处理使蛋白经历先展开后折叠的过程,在展开的过程中会暴露一些疏水基团,但在极碱条件下,疏水基团重新聚集,依赖于疏水侧链间相互作用而包埋在分子内部,从而导致表面疏水性降低[24]。此外,在极端碱性环境下,蛋白质分子中的氨基和羧基被离子化,增加了电荷与水的相互作用,使亲水基团暴露在分子表面。H40的表面疏水性降低可能是高压均质的空化和剪切使蛋白质颗粒减小,其颗粒表面氨基酸残基的非极性键合相互作用减弱,导致表面疏水性降低[25]。而P12H40由于高压均质和pH偏移之间的协同作用,使其对蛋白溶液的作用更加剧烈,从而导致表面疏水性显著降低。改性CPI表面疏水性的降低与2.3节结果中溶解度的增加相一致。
2.5 高压均质和pH偏移处理对CPI的微观形貌影响
如图3所示,未经处理的CPI的表面形貌相对不规则和粗糙,而P12表面出现小颗粒,但其颗粒分布不均匀,可能在极碱条件下蛋白质结构展开,从而出现小颗粒。H40的表面变得光滑,并出现了孔洞,而两者联合作用使CPI的表面颗粒显著减小且在空间中呈现出高度均一的分散状态,可能是因为高压均质的剪切和空化导致不溶性聚集体的分解和展开,从而形成更分散的蛋白质结构[25]。

图3 不同处理下CPI的扫描电镜图像
Fig.3 SEM images of CPI under different treatments
2.6 高压均质和pH偏移处理对CPI的傅里叶红外光谱的影响
傅里叶变换近红外光谱通常用于分析蛋白质二级结构构象的变化,其中酰胺Ⅰ带主要是C![]() O双键拉伸振动峰值(1 600~1 700 cm-1),酰胺Ⅱ带包括C—N拉伸振动和N—H弯曲振动峰值(1 500~1 600 cm-1)。如图4-a所示,样品在3 200~3 500 cm-1出现较宽的羟基吸收峰,主要是由O—H和N—H伸缩振动引起的,与CK相比,P12、H40和P12H40的羟基吸收峰从3 280 cm-1分别红移至3 285.53、3 288.95、3 291.07 cm-1,表明改性处理后可以增强CPI分子间的氢键作用[26]。2 964 cm-1附近的吸收峰是由—CH3和—CH2—基团中的C—H伸缩振动产生的。与CK相比,P12、H40、P12H40在酰胺Ⅱ带处的吸收峰均发生不同程度的红移,表明蛋白结构发生了不同程度的展开[27]。改性CPI均在酰胺Ⅰ带发生了红移,表明改性后CPI的二级结构发生了变化[27]。
O双键拉伸振动峰值(1 600~1 700 cm-1),酰胺Ⅱ带包括C—N拉伸振动和N—H弯曲振动峰值(1 500~1 600 cm-1)。如图4-a所示,样品在3 200~3 500 cm-1出现较宽的羟基吸收峰,主要是由O—H和N—H伸缩振动引起的,与CK相比,P12、H40和P12H40的羟基吸收峰从3 280 cm-1分别红移至3 285.53、3 288.95、3 291.07 cm-1,表明改性处理后可以增强CPI分子间的氢键作用[26]。2 964 cm-1附近的吸收峰是由—CH3和—CH2—基团中的C—H伸缩振动产生的。与CK相比,P12、H40、P12H40在酰胺Ⅱ带处的吸收峰均发生不同程度的红移,表明蛋白结构发生了不同程度的展开[27]。改性CPI均在酰胺Ⅰ带发生了红移,表明改性后CPI的二级结构发生了变化[27]。
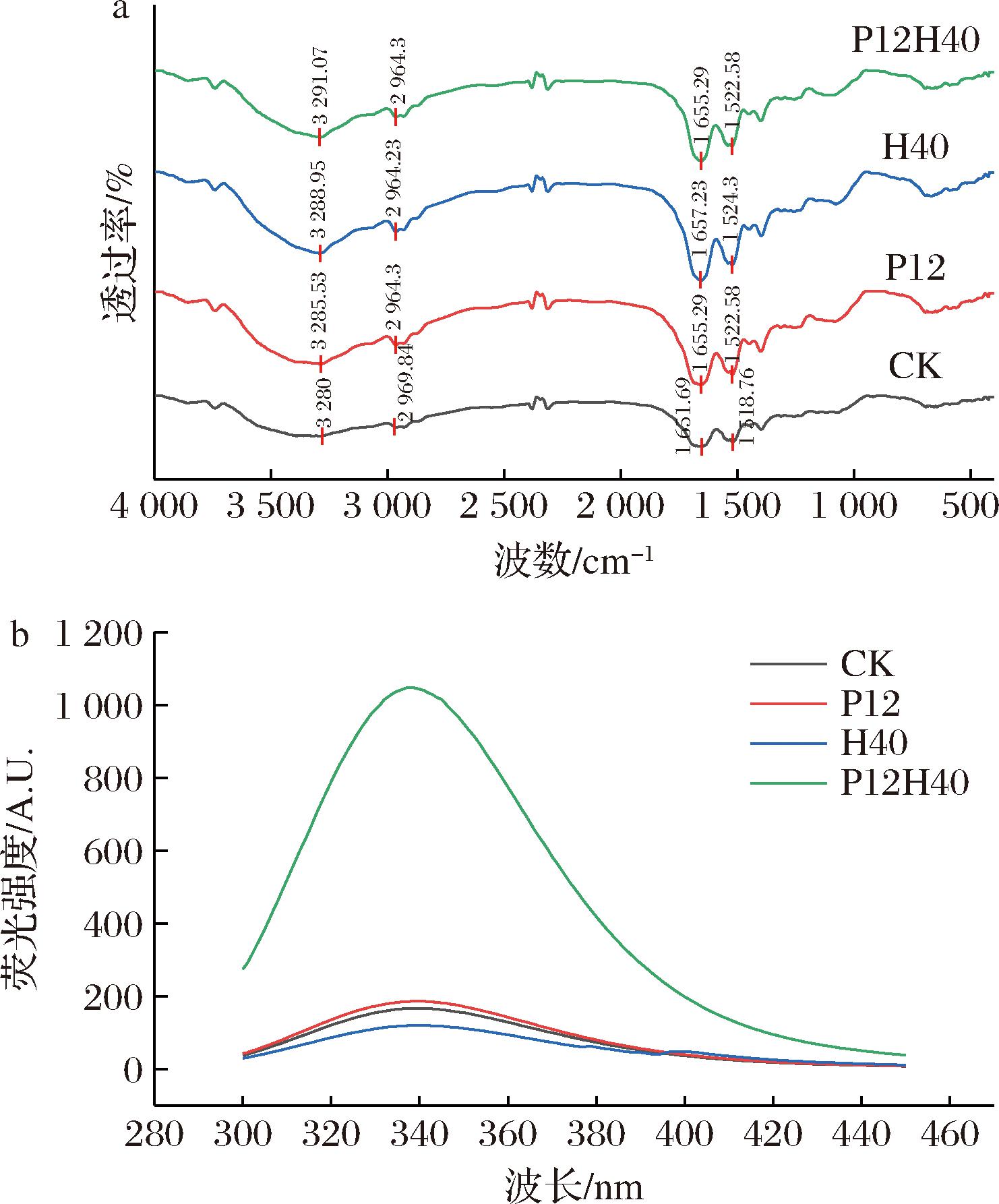
a-傅里叶变换红外光谱;b-内源荧光光谱
图4 不同处理对CPI的傅里叶变换红外光谱和内源荧光光谱
Fig.4 Fourier transform infrared spectra and endogenous fluorescence spectra of CPI under different treatments
为了进一步分析CPI的二级结构含量,使用PeakFit 4.12软件对傅里叶红外光谱的酰胺Ⅰ带进行去卷积处理。蛋白质的二级结构主要由β-折叠(1 615~1 637和1 682~1 700 cm-1)、无规则卷曲(1 637~1 645 cm-1)、α-螺旋(1 646~1 664 cm-1)、β-转角(1 664~1 681 cm-1)组成[28]。如表1所示,与CK相比,其改性样品的α-螺旋和无规则卷曲相对含量均有所增加,而β-折叠和β-转角相对含量均有所降低,表明pH偏移、高压均质及二者联合处理可以改变CPI的二级结构,β-折叠的相对含量降低表明蛋白质分子中的氢键断裂,导致蛋白质结构展开并从聚集状态变为解聚状态[29]。其中α-螺旋的增加可能是由于部分原本松散或β-折叠的区域重组为α-螺旋,无规则卷曲的增加可能与结构柔性增强或部分区域解折叠有关。
表1 不同处理下CPI的二级结构含量 单位:%
Table 1 Secondary structure content of CPI under different treatments
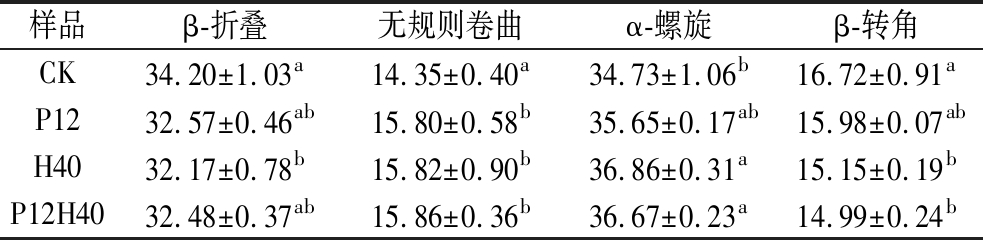
注:同列不同小写字母表示差异显著(P<0.05)。
样品β-折叠无规则卷曲α-螺旋β-转角CK34.20±1.03a14.35±0.40a34.73±1.06b16.72±0.91aP1232.57±0.46ab15.80±0.58b35.65±0.17ab15.98±0.07abH4032.17±0.78b15.82±0.90b36.86±0.31a15.15±0.19bP12H4032.48±0.37ab15.86±0.36b36.67±0.23a14.99±0.24b
2.7 高压均质和pH偏移处理对CPI荧光光谱的影响
荧光光谱法是一种表征蛋白质三级结构构象的灵敏方法。如图4-b所示,与CK相比,H40的荧光强度呈下降趋势,P12和P12H40的荧光强度均增加;同时改性CPI的λmax均发生了不同程度的红移或蓝移,其中P12从340 nm红移至341 nm,H40和P12H40分别蓝移至339 nm和338 nm。H40荧光强度降低和蓝移可能是因为高压均质通过剪切力、空穴效应和压力波动使蛋白质的结构发生部分解折叠,使隐藏在蛋白质分子内部的色氨酸、酪氨酸残基暴露在蛋白质表面,引发分子间的荧光猝灭,同时残基环境极性增加导致λmax蓝移[30]。而P12的荧光强度高于CK并发生红移,这可能归因于在碱性偏移下蛋白质构象发生剧烈变化,且碱性处理的蛋白质在远离等电点具有更高的折叠能力;而λmax红移表明少量色氨酸残基暴露在亲水环境中,使得蛋白质结构局部展开[31]。此外,高压均质的联合使用进一步加剧了这种变化,导致更多的发色团暴露于溶剂中,从而导致P12H40的荧光强度增加并发生蓝移[17]。综上,高压均质、pH偏移和两者联合均可以改变CPI的三级结构。
2.8 高压均质和pH偏移处理对CPI持水性和持油性的影响
如图5-a所示,与CK相比,P12、H40和P12H40的持水性均显著降低。其中,P12H40的持水性最低。2.1节的结果证明改性后的CPI zeta电位绝对值降低,表明表面净电荷减少,而电荷减少会导致结合水分子数量下降,因此持水性降低。持水性大小排序为:CK>P12>H40>P12H40,这与zeta电位的绝对值变化趋势是一致的。此外,pH偏移先使蛋白质内部疏水基团短暂暴露,随后疏水相互作用促使分子内折叠或分子间聚集,将疏水基团重新包埋至聚集体内部,这种重排引发蛋白质形成致密聚集体,蛋白质网络孔隙率骤减反而会减少水分子截留,最终导致持水性下降[32]。如图5-b所示,所有改性CPI的持油性均高于CK,排序为:CK
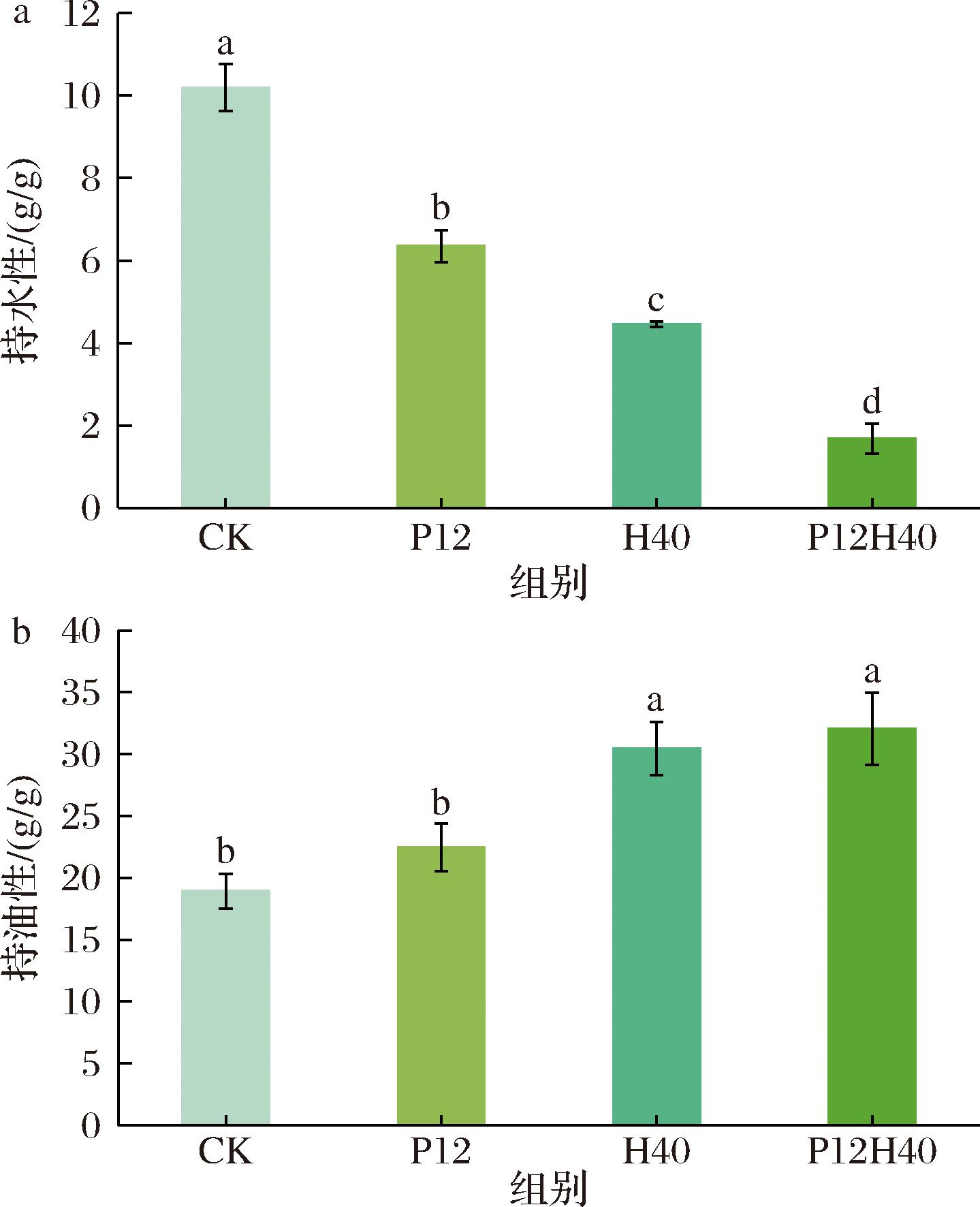
a-持水性;b-持油性
图5 不同处理下CPI的持水性和持油性
Fig.5 Water holding and oil holding capacities of CPI under different treatments
2.9 高压均质和pH偏移处理对CPI起泡性和起泡稳定性的影响
起泡特性反映了蛋白在空气-水界面处吸附、重排和保持稳定性的能力。如图6所示,与CK相比,改性CPI样品的起泡性均提高。P12中起泡性增加可能是因为在极端碱性条件下蛋白质分子部分展开,中性pH回调后CPI呈熔融状态,粒径减小,使其易吸附到空气-水界面上,从而使起泡性增加[17];H40中可能是因为高压均质破坏了蛋白质中的疏水相互作用和离子键,使蛋白质分子更加灵活,增强了蛋白质分子在空气-水界面的吸附能力,从而增加了起泡性[33];P12H40中增加可能是因为pH值变化和高压均质的剪切和空化效应改善了分子迁移率和柔韧性,增强了起泡性[23]。改性CPI的起泡稳定性均优于CK,可能是因为改性CPI携带的表面电荷降低,分子间静电斥力减弱,促使蛋白质-蛋白质相互作用增强,进而有利于增强蛋白质的泡沫稳定性[34]。这与zeta电位的结果一致,较低的zeta电位绝对值意味着颗粒间的静电屏障减小,有利于蛋白质在气-水界面紧密聚集,维持泡沫的稳定性。
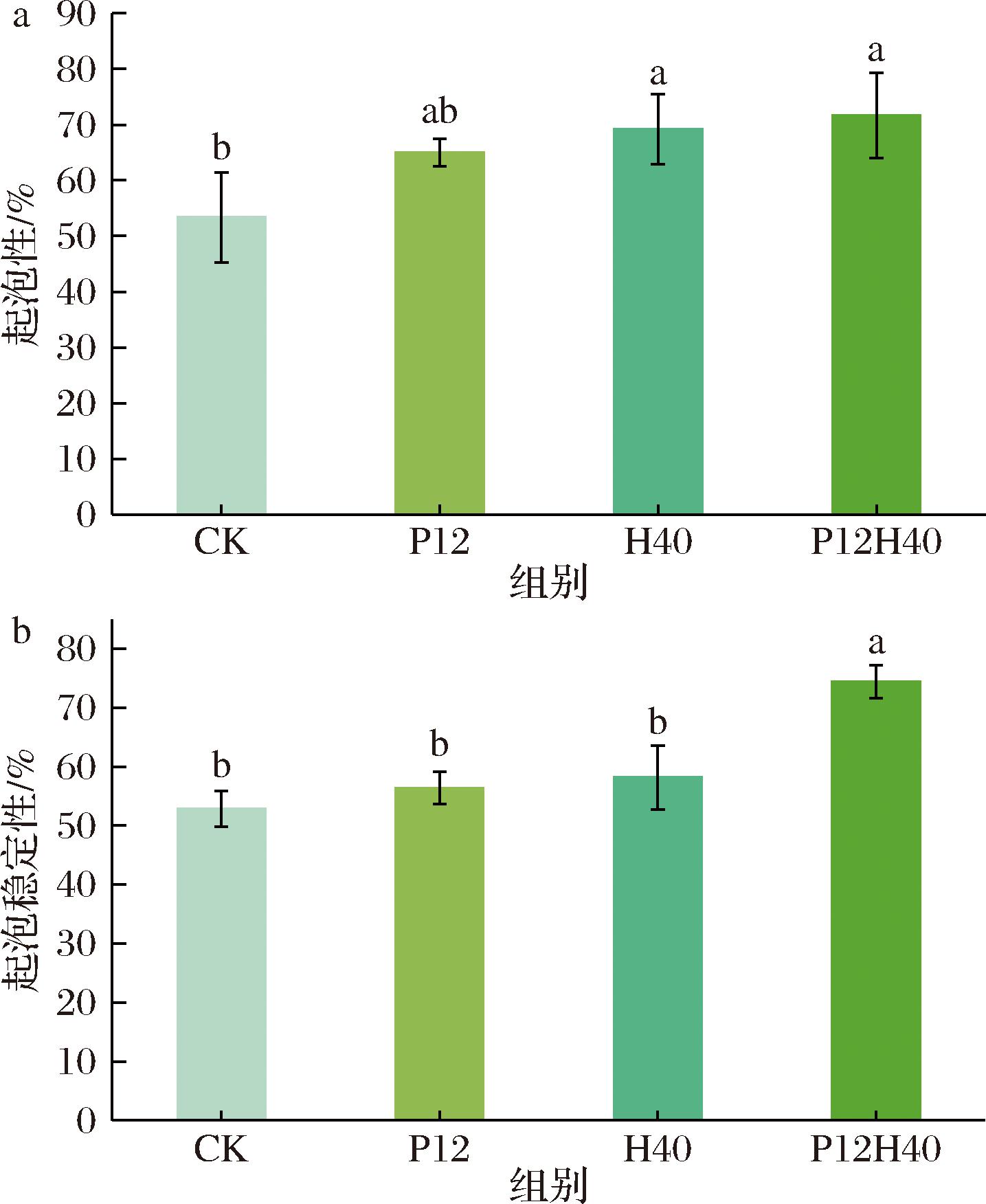
a-起泡性;b-起泡稳定性
图6 不同处理下CPI的起泡性和起泡稳定性
Fig.6 Foaming and foaming stability of CPI under different treatments
2.10 高压均质和pH偏移处理对CPI乳化性能的影响
乳化活性和乳化稳定性可以评价蛋白质分子的乳化性能,代表着蛋白质油水界面稳定分散的能力。如图7-a所示,与CK相比,其P12、H40、P12H40的样品均显著提高,从13.34 m2/g增至18.40 m2/g。可能是由于CPI在极碱条件下发生分子解聚,使其蛋白质粒径减小,而高压均质进一步产生的剪切力、空化效应等降低了颗粒尺寸,增强了油水界面的吸附和重排,从而使其乳化活性增加[35]。同时,改性CPI的表面疏水性降低,但ANS探针检测仅结合暴露的疏水斑块,若改性后疏水区被亲水基团部分屏蔽,即使表面疏水性降低,但内部或局部仍存在油脂结合位点,从而使其乳化活性升高[36]。如图7-b所示,改性CPI的乳化稳定性均低于CK,可能是因为展开的蛋白质分子灵活性增强,限制了分子间的相互作用,形成了弱的界面膜,从而导致乳化稳定性降低[34]。
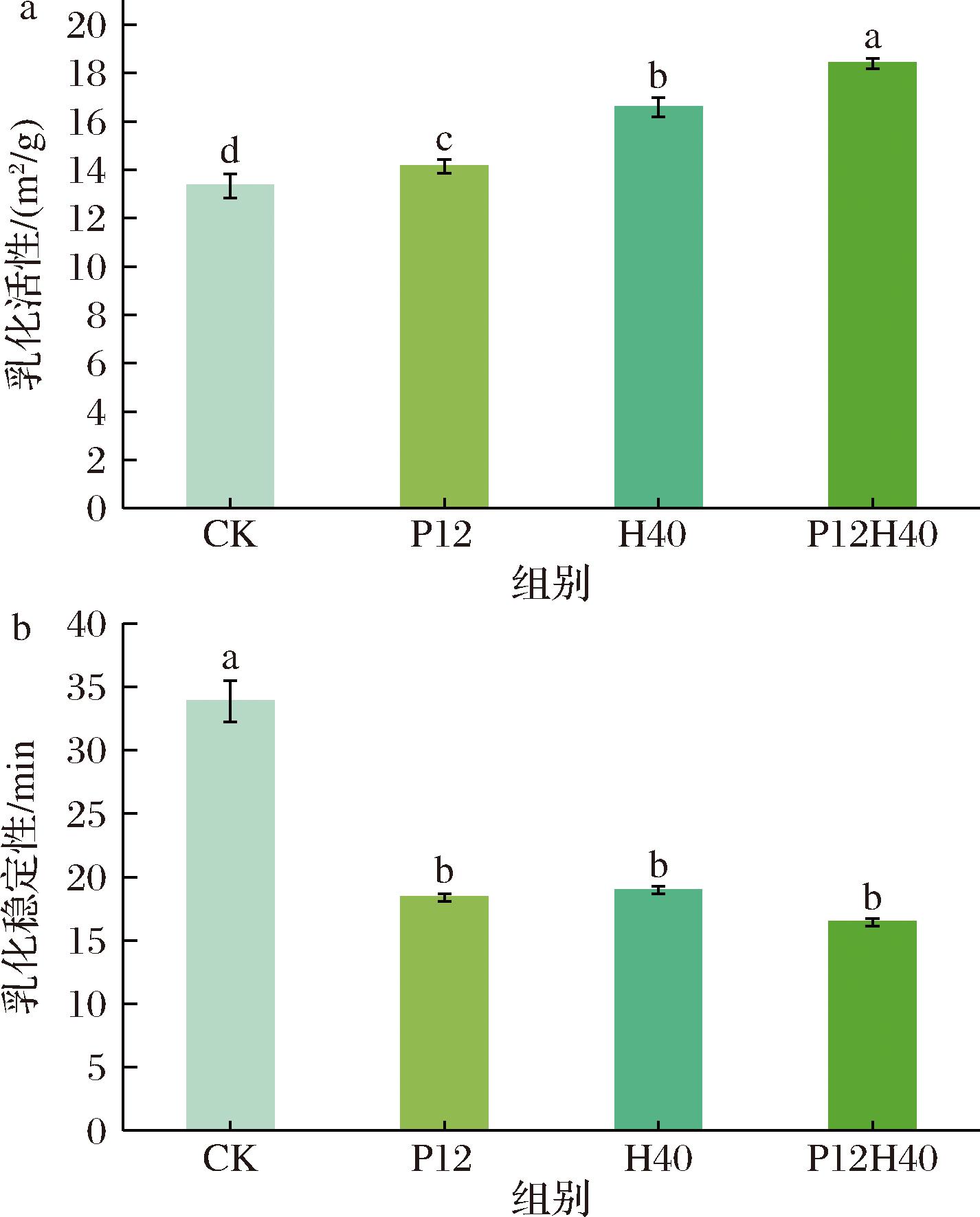
a-乳化性;b-乳化稳定性
图7 不同改性条件下CPI的乳化性能
Fig.7 Emulsification property of CPI under different modification conditions
2.11 高压均质和pH偏移处理对CPI界面张力的影响
蛋白质的活性是由分子在油水界面的扩散和吸附能力决定的。从图8可知,相较于CK,P12、H40和P12H40的界面张力均下降,从26.12 mN/m降至19.89 mN/m。在油-水界面中,各体系的界面张力随时间的增加而迅速下降,随后趋于平缓。这可能是因为pH值变化和高压均质使蛋白质的粒径减小,从而能够快速向油水界面扩散,同时电位绝对值降低使其静电斥力减弱,有利于蛋白吸附到油水界面上,从而降低界面张力[35]。其中P12H40显著降低可能是因为两者之间的协同作用加剧了蛋白质的结构展开和伸展,因此其界面张力最低。此外,改性CPI溶解度的增加使得蛋白质分子与油水界面的相互作用加大,亦可导致界面张力的降低[23]。
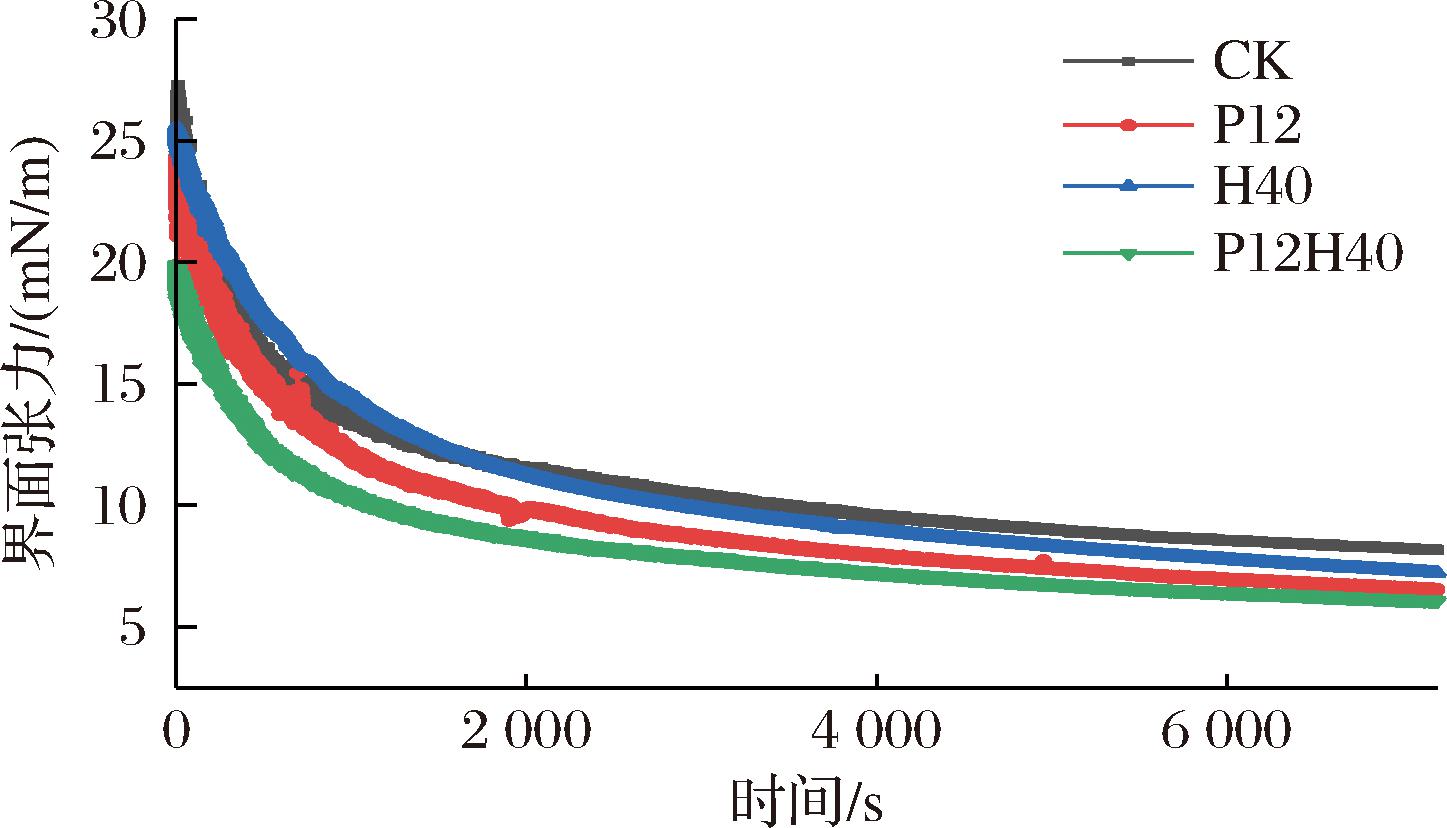
图8 不同改性条件下CPI的界面张力
Fig.8 Interfacial tension of CPI under different modification conditions
3 结论
在本研究中,CPI通过pH偏移、高压均质和两者协同处理后,其结构和功能性质均发生了显著变化,其中协同处理对CPI的改性效果最为显著。结果表明,经过改性后CPI的α-螺旋和无规则卷曲含量增加,β-折叠和β-转角含量减少,荧光强度发生变化并发生红移或蓝移,表明高压均质协同pH偏移改性CPI可以改变蛋白的二级和三级结构。此外,改性后的CPI粒径、zeta电位绝对值、表面疏水性、持水性和界面张力下降,而溶解度、持油性、起泡性和乳化性均显著增加。本研究为CPI在食品工业作为新型功能性成分应用提供理论参考。
[1] 尹思睿, 冯娇, 杨晓宇, 等.植物蛋白复配对植物肉品质的影响[J].轻工学报, 2024, 39(5):18-28.YIN S R, FENG J, YANG X Y, et al.Influence of plant protein compounding on plant-based meat quality[J].Journal of Light Industry, 2024, 39(5):18-28.
[2] 贾伟祎, 李甜甜, 郑思羽, 等.糖基化改性对鹰嘴豆分离蛋白结构及功能性质的影响[J].食品工业科技, 2025,46(15):115-125.JIA W Y, LI T T, ZHENG S Y, et al.Effect of glycosylation modification on the structure of chickpea protein isolate and functional properties[J].Science and Technology of Food Industry, 2025,46(15):115-125.
[3] ZHANG T, CHEN T T, JIANG H Y, et al.pH-induced egg white protein foaming properties enhancement:Insight into protein structure and quantitative proteomic analysis at protein adsorption layer[J].Food Hydrocolloids, 2023, 144:109060.
[4] JIANG J, WANG Q L, XIONG Y L.A pH shift approach to the improvement of interfacial properties of plant seed proteins[J].Current Opinion in Food Science, 2018, 19:50-56.
[5] LIU Z F, GUO Z X, WU D, et al.High-pressure homogenization influences the functional properties of protein from oyster (Crassostrea gigas)[J].LWT, 2021, 151:112107.
[6] WANG Z H, XU X L, LIU Z L, et al.High-pressure homogenization treatment on yeast protein:Effect on structure and emulsifying properties[J].Food Research International, 2025, 213:116550.
[7] LIANG Y R, GUO Y N, ZHENG Y X, et al.Effects of high-pressure homogenization on physicochemical and functional properties of enzymatic hydrolyzed soybean protein concentrate[J].Frontiers in Nutrition, 2022, 9:1054326.
[8] KLEBER N, MAIER S, HINRICHS J.Antigenic response of bovine β-lactoglobulin influenced by ultra-high pressure treatment and temperature[J].Innovative Food Science &Emerging Technologies, 2007, 8(1):39-45.
[9] HUANG Y R, HUA Y F, QIU A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2):240-249.
[10] 徐亚, 范会芬, 赵玎玲, 等.考马斯亮蓝法测定大豆水溶性蛋白提取方法的优化[J].大豆科学, 2022, 41(2):196-202.XU Y, FAN H F, ZHAO D L, et al.Optimization of extraction method for water-soluble protein determination by coomassie bright blue method[J].Soybean Science, 2022, 41(2):196-202.
[11] 满金花, 黄鑫, 杨曦, 等.多酚对脂氧合酶诱导亚油酸-花生球蛋白氧化体系的干预研究[J/OL].食品与发酵工业, 2025:1-9.(2025-04-29).https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.042861.MAN J H, HUANG X, YANG X, et al.Interventional effects of nine polyphenols on arachin linoleic acid oxidation system induced by lipoxygenase[J/OL].Food and Fermentation Industries, 2025:1-9.(2025-04-29).https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.042861.
[12] 赵磊, 夏杨毅, 姬雯馨.剪切稀化效应对肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业, 2022, 48(16):216-222.ZHAO L, XIA Y Y, JI W X.Effects of shear-thinning on gel properties of myofibrillar protein[J].Food and Fermentation Industries, 2022, 48(16):216-222.
[13] SUN P, ZHANG Q, ZHAO Y, et al.Improving gel properties of soy protein isolate through alkaline pH-shifting, mild heat treatment, and TGase cross-linking[J].Food Hydrocolloids, 2023, 144:108924.
[14] WANG S Y, ZHOU B, SHEN Y B, et al.Effect of ultrasonic pretreatment on the emulsification properties of Clanis bilineata tingtauica Mell protein[J].Ultrasonics Sonochemistry, 2021, 80:105823.
[15] WANG S N, YANG J J, SHAO G Q, et al.Dilatational rheological and nuclear magnetic resonance characterization of oil-water interface:Impact of pH on interaction of soy protein isolated and soy hull polysaccharides[J].Food Hydrocolloids, 2020, 99:105366.
[16] ZHANG J N, LIU Q, CHEN Q, et al.Synergistic modification of pea protein structure using high-intensity ultrasound and pH-shifting technology to improve solubility and emulsification[J].Ultrasonics Sonochemistry, 2022, 88:106099.
[17] WANG Y T, WANG S S, LI R, et al.Effects of combined treatment with ultrasound and pH shifting on foaming properties of chickpea protein isolate[J].Food Hydrocolloids, 2022, 124:107351.
[18] ZHAO Q L, YAN W Q, LIU Y F, et al.Modulation of the structural and functional properties of perilla protein isolate from oilseed residues by dynamic high-pressure microfluidization[J].Food Chemistry, 2021, 365:130497.
[19] SUN Y Z, CHEN H M, CHEN W X, et al.Effect of ultrasound on pH-shift to improve thermal stability of coconut milk by modifying physicochemical properties of coconut milk protein[J].LWT, 2022, 167:113861.
[20] 谢宜桐. 超高压均质对大豆分离蛋白美拉德反应及乳化性质的影响研究[D].哈尔滨:东北农业大学, 2023.XIE Y T.Effect of high-pressure homogenization on Maillard reaction and emulsifying properties of soybean protein isolates[D].Harbin:Northeast Agricultural University, 2023.
[21] ZHAO Q, SELOMULYA C, XIONG H, et al.Comparison of functional and structural properties of native and industrial process-modified proteins from long-grain indica rice[J].Journal of Cereal Science, 2012, 56(3):568-575.
[22] CHEN C, LIU Z H, XIONG W F, et al.Effect of alkaline treatment duration on rapeseed protein during pH-shift process:Unveiling physicochemical properties and enhanced emulsifying performance[J].Food Chemistry, 2024, 459:140280.
[23] YILDIZ G.From seed to solution:Enhancing techno-functionality and digestibility of pumpkin seed protein isolate through high-intensity ultrasound, high-pressure processing, and pH-shifting[J].Food Chemistry, 2025, 474:143222.
[24] 周向军, 董瑞红, 高义霞.pH偏移结合温和热处理对蚕豆分离蛋白结构和功能的影响[J].食品与发酵工业, 2019, 45(1):100-108.ZHOU X J, DONG R H, GAO Y X.Effects of pH-shifting combined with mild heating processes on structural and functional properties of broad bean protein isolates[J].Food and Fermentation Industries, 2019, 45(1):100-108.
[25] LI S S, LIU Z, HEI X, et al.Effect of physical modifications on physicochemical and functional properties of walnut protein[J].Foods, 2023, 12(19):3709.
[26] ZHANG Z H, MENG Y X, WANG J P, et al.Preparation and characterization of zein-based core-shell nanoparticles for encapsulation and delivery of hydrophobic nutrient molecules:Enhancing environmental stress resistance and antioxidant activity[J].Food Hydrocolloids, 2024, 148:109524.
[27] 吴淼. 基于pH-U改性大豆分离蛋白复合凝聚迷迭香精油微胶囊的制备与应用[D].重庆:西南大学, 2024.WU M.Preparation and application of pH-U modified soybean protein isolate complex coacervation rosemary essential oil microcapsules[D].Chongqing:Southwest University, 2024.
[28] 杨盼盼, 赵贺开, 袁兵兵, 等.剪切预处理对大豆蛋白纳米纤维形成及结构特征的影响[J/OL].食品工业科技, 2025:1-15.(2025-03-18).https://link.cnki.net/doi/10.13386/j.issn1002-0306.2024110072.YANG P P, ZHAO H K, YUAN B B, et al.Effect of shear pretreatment on the formation and structural characteristics of soy protein isolate fibrils[J/OL].Science and Technology of Food Industry, 2025:1-15.(2025-03-18).https://link.cnki.net/doi/10.13386/j.issn1002-0306.2024110072.
[29] YI J, LIU K L.Effect of high hydrostatic pressure and ultrasonic treatment on solubility and structural changes of rice bran protein[J].International Journal of Food Science &Technology, 2023, 58(6):2962-2973.
[30] 崔露平, 梅燕茹, 石玮, 等.高压均质处理对鹰嘴豆分离蛋白理化特性的影响[J].食品科技, 2024, 49(3):257-264.CUI L P, MEI Y R, SHI W, et al.Effect of high pressure homogenization on physicochemical properties of chickpea protein isolate[J].Food Science and Technology, 2024, 49(3):257-264.
[31] 卢家维, 李甜甜, 吴淼, 等.琥珀酰化改性对鹰嘴豆分离蛋白结构和功能特性的影响[J].食品与发酵工业, 2024, 50(17):169-177.LU J W, LI T T, WU M, et al.Effect of succinylation modification on structure and functional properties of chickpea protein isolate[J].Food and Fermentation Industries, 2024, 50(17):169-177.
[32] JEONG M S, CHO S J.Effect of pH-shifting on the water holding capacity and gelation properties of mung bean protein isolate[J].Food Research International, 2024, 177:113912.
[33] PARLAK M E, SAR CAOGLU F T, YILMAZ M T.Application of high-pressure homogenization-assisted pH-shift to enhance techno-functional and interfacial properties of lentil protein isolate[J].Food Hydrocolloids, 2024, 157:110425.
CAOGLU F T, YILMAZ M T.Application of high-pressure homogenization-assisted pH-shift to enhance techno-functional and interfacial properties of lentil protein isolate[J].Food Hydrocolloids, 2024, 157:110425.
[34] 邴树静. 杏鲍菇和香菇蛋白及酶解物的结构、功能特性及抗氧化活性研究[D].济南:齐鲁工业大学, 2024.BING S J.Study on structural, functional properties and antioxidant activities of Pleurotus eryngii protein, Lentinus edodes protein and their hydrolysates[D].Jinan:Qilu University of Technology, 2024.
[35] 孟瑞龙, 章绍兵.酸性pH偏移协同超声处理对花生蛋白结构与功能性质的影响[J].河南工业大学学报(自然科学版), 2024, 45(4):11-18.MENG R L, ZHANG S B.Effect of acidic pH-shifting combined with sonication on the structural and functional properties of peanut protein[J].Journal of Henan University of Technology (Natural Science Edition), 2024, 45(4):11-18.
[36] OTA C, TANAKA S I, TAKANO K.Revisiting the rate-limiting step of the ANS-protein binding at the protein surface and inside the hydrophobic cavity[J].Molecules, 2021, 26(2):420.