刺梨(Rosa roxburghii Tratt,RRT)是中国西南地区特色蔷薇科植物,具有抗动脉粥样硬化、抗衰老、降糖及调节肠道菌群等多重生物活性[1],其深加工产业在贵州省快速发展,2024年其种植面积达11.333 3万hm2,综合产值突破180亿元,在功能性饮料、膳食补充剂等领域形成特色产品矩阵[2],现代研究证实其所含的维生素C(2 000~2 500 mg/100 g)和熊果酸(ursolic acid,UA,800~1 200 mg/100 g)等成分,通过抗氧化、抗炎、代谢调节等多途径发挥健康功效[3],但产业开发中普遍存在活性成分利用率低(<30%)、产品稳定性差等技术瓶颈。
近年来,食品复杂体系中分子互作研究为活性成分高效利用提供了新思路。研究显示,维生素C可增强三萜类化合物对脂质过氧化的抑制作用,从而更有效保护细胞膜免受氧化损伤[4]。UA与维生素C通过互补机制协同增强抗氧化及免疫调节活性,而两者联用还能更全面地抑制炎症反应[5],但作用机制尚不明确,现有研究多局限于单一成分活性评价,对天然复合体系中分子互作的作用力类型、作用位点等关键问题缺乏系统解析,严重制约食品功能的开发。
因此,本研究创新性地构建“实验表征-计算模拟”联用技术体系分析维生素C-UA互作关系:采用紫外-可见光谱(ultraviolet-visible spectroscopy, UV-Vis)/傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)解析基团互作模式,循环伏安法(cyclic voltammetry,CV)追踪氧化还原特性变化;通过分子对接揭示优势结合构象,结合密度泛函计算氢键结合能。首次阐明刺梨特征成分维生素C-UA的分子互作规律,为破解刺梨活性成分利用率低、产品易氧化等产业难题提供理论支撑。
1 材料与方法
1.1 试剂
维生素C(分析纯),上海麦克林生化科技有限公司;芸香苷(分析纯),中国药品生物制品检定所;熊果酸(ursolic acid,UA)(分析纯),北京华威锐科化工有限公司;Na2HPO4(分析纯)、K2HPO4(分析纯),天津市致远化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,分析纯)、磷酸(分析纯),茂名市雄大化工有限公司;无水乙醇(分析纯),成都金山化学试剂有限公司;偏磷酸(分析纯),山东西亚化学有限公司;甲醇(分析纯),北京百灵威科技有限公司;KBr(光谱纯),上海国药试剂集团;Al2O3(分析纯),贵州逢源生物技术有限公司;二次蒸馏水,实验室自制;NaCl(分析纯)、KCl(分析纯),南京全隆生物技术有限公司;PBS(pH=7.40),北京诺博莱德科技有限公司。
1.2 仪器与设备
Aglient 1260 Ⅱ高效液相色谱仪(配紫外检测器),美国安捷伦公司;CJ-CS-K04型实验室纯水机,苏州普沃特净化器材有限公司;FA2004型分析天平,上海良平仪器仪表有限公司;ST5000型pH计,奥豪斯国际贸易(上海)有限公司;GUTEL型超声波清洗机,上海冠特超声仪器有限公司;Titramax 1000混匀振荡器,Hei-dolph公司;SHZ-u型循环水真空泵,上海亚荣生化仪器厂;UV-2450型紫外-可见分光光度计,日本岛津公司;Frontier智能FTIR仪,美国PerkinElmer公司;压盖型冷冻干燥机,上海田枫实业有限公司;CHI660C电化学工作站,上海辰华仪器有限公司;101-3A电热鼓风干燥箱,天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 稳定性实验
样品准备:以刺梨果实中维生素C、UA含量水平为参考,刺梨维生素C、UA与标品结构相同[3],利用标品维生素C、UA配制刺梨维生素C-UA二元体系混合液:
参考文献[4]方法并做出调整,具体操作如下:准确称取160.0 mg的维生素C标准样品,以无水乙醇溶解,定容于10 mL容量瓶中,维生素C溶液浓度为16.0 mg/mL。以相同方法分别配制质量浓度为10 mg/mL 的UA标准溶液。
精确量取UA标准溶液2.5 mL置于5 mL离心管中,向其中加入2.5 mL的16.0 mg/mL 维生素C溶液,以维生素C、UA单体溶液为对照,平行组3份,充分混合,分别取样0.5 mL检测,剩余样品放入恒温培养箱中于35 ℃下贮藏,每隔5 d取样0.5 mL检测。维生素C、UA均采用HPLC法检测,具体检测方法参考文献[6]。
1.3.2 UV-Vis分析
参考文献[7]方法,取0.088 g维生素C粉末,以DMSO溶解并定容于50 mL容量瓶中,制得1×10-2 mol/L的维生素C溶液储备液,摇匀并静置0.5 h后使用,现配现用。准确称取0.228 4 g UA粉末,以DMSO溶解并定容于50 mL容量瓶中,制得1×10-2 mol/L的UA溶液储备液,摇匀并静置0.5 h后使用,避光保存。上述样品均以DMSO为溶剂。
UA对维生素C作用的紫外-可见光谱分析:取2×10-3 mol/L的维生素C溶液2 mL共5份,向其中分别加入2×10-3、4×10-3、6×10-3、8×10-3、1×10-2 mol/L的UA溶液2 mL,制成维生素C-UA浓度梯度混合液,室温(25 ℃)避光静置12 h,以维生素C单体标准液为对照,在1 cm石英比色皿内记录240~500 nm的紫外-可见吸收光谱,实验3次结果取平均值。维生素C对UA作用的紫外-可见光谱分析同上。
1.3.3 FTIR分析
参考文献[8]的方法,称取0.176 g维生素C粉末,以无水乙醇溶解并定容于100 mL容量瓶中,制得1×10-2 mol/L的维生素C溶液储备液。准确称取0.456 8 g UA粉末,以无水乙醇溶解并定容于100 mL容量瓶中,制得1×10-2 mol/L的UA溶液储备液。所有溶液均储存于4~5 ℃的黑暗环境中,实验用水为纯水机所制超纯水。
取制备好的维生素C溶液、UA溶液以等体积比复配为维生素C-UA混合液置于磁力搅拌器混匀,同对照组(维生素C溶液、UA溶液)一起真空干燥24 h,收集所得晶片状产物,粉碎后过100目筛即得维生素C-UA粉末,称取2 mg维生素C、UA、维生素C-UA粉末样品与200 mg KBr粉末混合,于玛瑙研钵中均匀研磨后置于模具中压成均匀薄片,同一样品扫描2次,扫描前使用空白片扫描背景以去除CO2和水的干扰,在32 cm的分辨率条件下扫描32次,4 000~400 cm-1波数范围内扫描红外光谱。
1.3.4 电化学分析
缓冲溶液准备:以CNTs/GCE为工作电极,考察等浓度的维生素C、UA溶液(均为4×10-4 mol/L)分别在pH=7.40的柠檬酸-柠檬酸钠溶液、体积分数为2%DMSO配制的磷酸溶液及PBS三种溶液中的CV曲线,发现3种活性物质在pH=7.40的PBS中的氧化峰电流最大,峰型最好,故本实验采用PBS为底液进行电化学分析。pH=7.40的PBS可以用来模拟人体的生理环境,故本次实验选择PBS,pH值为7.40。
参考文献[9],采用碳纳米管(carbon nanotube,CNT)对玻碳电极(glassy carbon electrode,GCE)进行修饰,对等浓度的维生素C及UA溶液(均为4×10-4 mol/L)分别进行测试,氧化峰电流对比裸玻碳电极、碳棒电极大,故本实验采用碳纳米管修饰玻碳电极(CNTs/GCE)进行电化学分析。
电极预处理方法:将铂电极用0.3 μm和0.05 μm的Al2O3粉末打磨并抛光至镜面,然后依次用清水、乙醇、超纯水中超声波清洗(重复3次)后于PBS中活化。CNTs/GCE的制备:取8 μL超声波30 min的碳纳米管分散液滴在清洗干净的GCE电极表面,用红外灯烤干。参比电极为饱和甘汞电极,对电极为铂丝电极。
测试范围为-0.4~1.6 V,扫描速度为50 mV/s。实验温度为室温,所有样品在配制前,溶剂通高纯N2 15 min,去除溶剂中溶解氧。取2×10-3 mol/L的维生素C、UA储备液1 mL与4 mL PBS混合均匀后,分别进行CV测试。维生素C、UA储备液的CV测试为对照组。维生素C对UA作用的电化学分析:取2×10-2 mol/L的UA分散液1 mL与3 mL PBS混合,再加入1 mL 2×10-3 mol/L的维生素C溶液混合均匀进行CV测试。
1.3.5 维生素C、UA互作的分子模拟
维生素C、UA的3D结构从NCBI网站(PubChem Compound,维生素C CID:54670067,UACID:64945)下载,采用分子操作环境(molecular operating environment, MOE)软件平台,依次执行以下预处理流程:通过能量最小化模块进行质子化状态修正、偏电荷计算及能量优化,最终获得最低能量构象,为后续分子对接与动力学模拟提供标准化小分子三维结构。
1.3.6 独立梯度模型(independent gradient model,IGM)方法
将MOE软件优化后的维生素C、UA分子三维结构信息文件,输入ORCA量子化学软件中,采用密度泛函理论中GRIMME提出的B97-3c泛函(基于BECKE的三参数交换泛函和LEE、YANG和PARR相关泛函组合)方法[10],对各构型进行结构优化以得到稳定的复合物分子结构。采用IGM方法,通过Multiwfn软件对复合物非共价相互作用进行分析[11-13],得到复合物轨道电子密度数据,通过VMD软件将轨道电子密度可视化,具体检测方法参考文献[14]。
IGM分析方法可以考察分子间非共价相互作用进行空间分布和类型分析,通过分子片段间的作用区域的颜色进行判断,蓝、绿、红分别代表强吸引(氢键、卤键)、范德华力及强排斥,如图1所示:

图1 IGM可视化对比条带
Fig.1 IGM visual contrast strip
1.3.7 结合能、氢键键能计算
使用ORCA软件对维生素C-UA分子复合物的几何结构采用B3LYP泛函,并使用DFT-D3(BJ)色散校正进行充分优化,结合ma-TZVPP基组计算波函数,对优化后的几何结构做进一步频率计算,确保定位点无虚频率。
优化后的几何结构信息使用Multiwfn软件采用CCSD(T)方法和Truhlar的“calendar”基组jul-cc-pVTZ方法进行单点能计算,根据结合能计算公式得出结合能,并分析分子间氢键键临界点的电子密度ρ(BCP),得到的ρ(BCP)通过图2的拟合公式计算出氢键键能,以上方法、泛函基组以及拟合公式使用依据参考文献[15]。
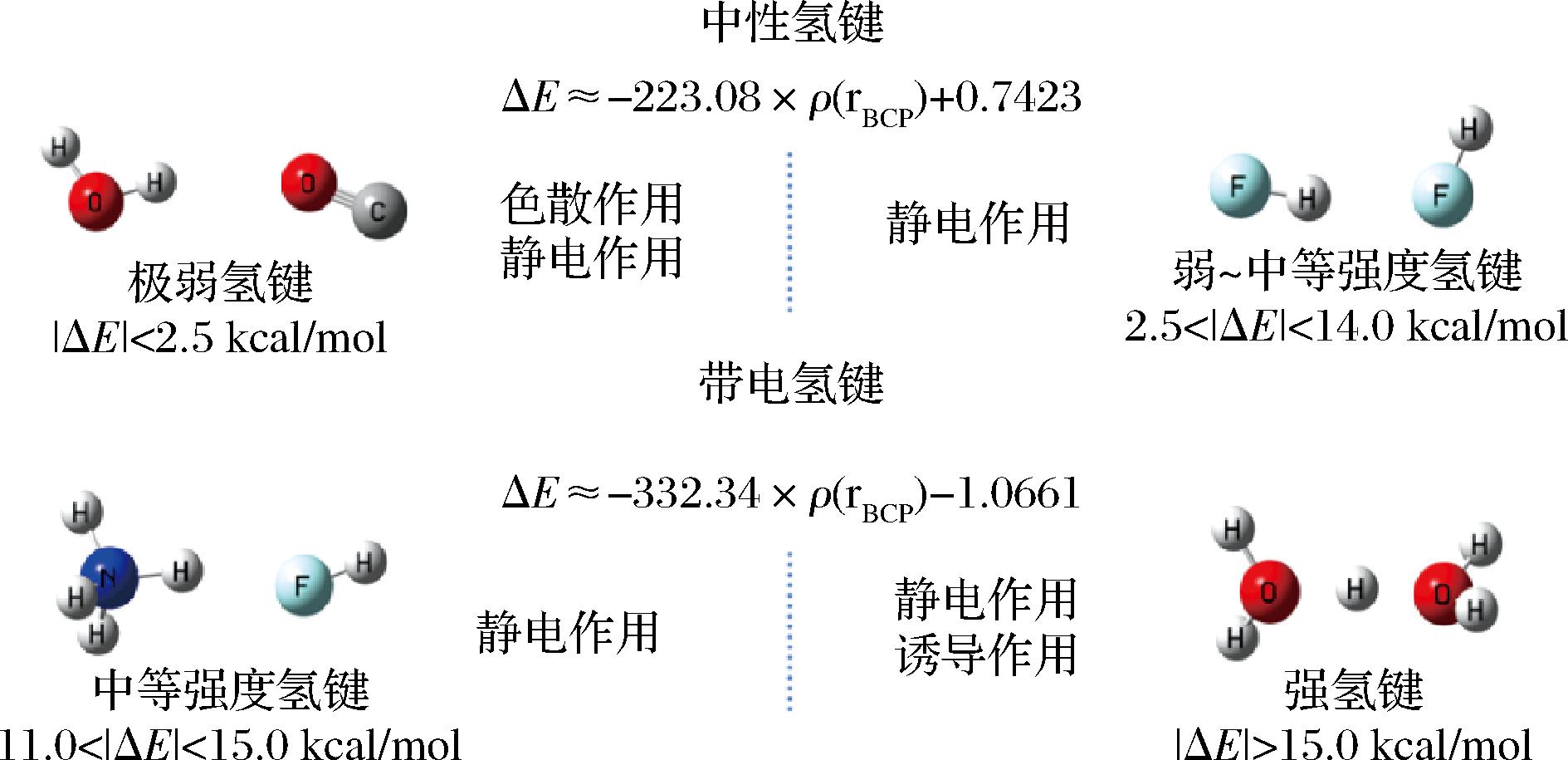
图2 中性氢键与带电氢键的拟合公式[15]
Fig.2 The fitting formula of neutral hydrogen bond and charged hydrogen bond[15]
结合能通过公式(1)进行计算:
Ebind=Eplex-(EpartV+EpartU)
(1)
式中:Eplex,优化后体系总能量,kJ/mol;EpartV、EpartU,单体维生素C、UA能量,kJ/mol;Ebind,结合能,kJ/mol。
1.4 数据处理与统计
使用Origin Pro 2022软件绘图。采用SPSS 22.0软件进行统计分析,用one-way ANOVA进行方差分析,Bonferroni进行组间显著性检验,统计显著性水平设定为P<0.05。
2 结果分析
2.1 维生素C-UA体系组分稳定性的互作影响
由图3-a可知,处理组维生素C-UA贮藏30 d,维生素C损失率较对照组维生素C无显著差异(P>0.05);由图3-b可知,UA损失率比对照组UA降低27%(P<0.05),表明在该存放条件下,维生素C-UA互作体系中维生素C对UA稳定性作用显著,而UA对维生素C稳定性影响不显著。
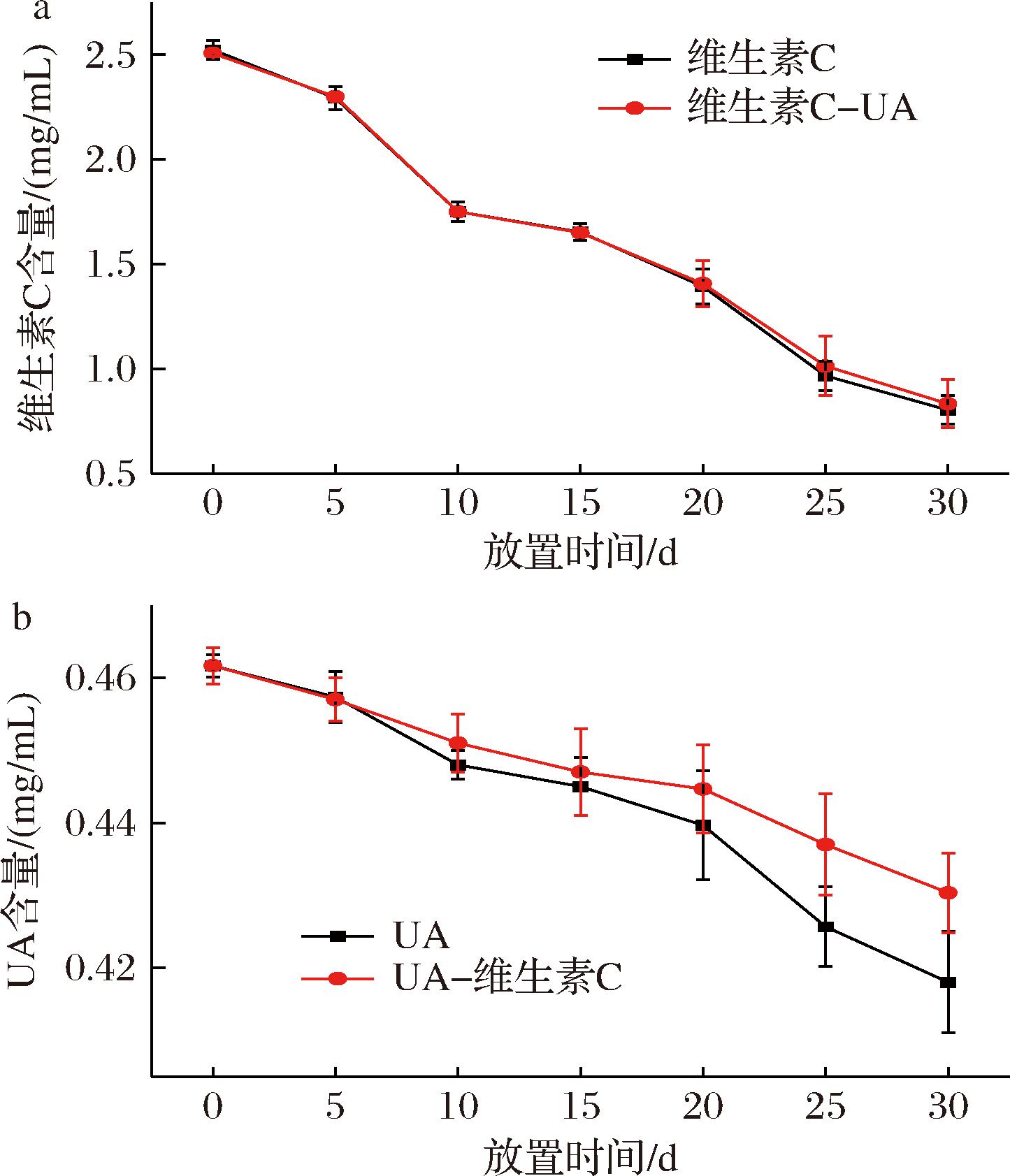
a-维生素C含量变化;b-UA含量变化
图3 维生素C-UA体系的互作影响
Fig.3 Interaction effects of vitamin C-UA systems
2.2 维生素C-UA体系UV-Vis检测结果分析
不同浓度UA对维生素C的相互作用紫外光谱图由图4所示, 维生素C∶UA(1∶1~1∶2)为低浓度时,维生素C的最大吸收峰红移,电荷转移复合物形成:UA作为三萜酸(含羧酸基团和疏水骨架),其羧酸基团(—COOH)的羟基可能作为电子供体,与维生素C的烯二醇结构(含富电子双键)形成电荷转移复合物,延长共轭体系,降低激发态能量,导致红移(287.4→290.4 nm)。
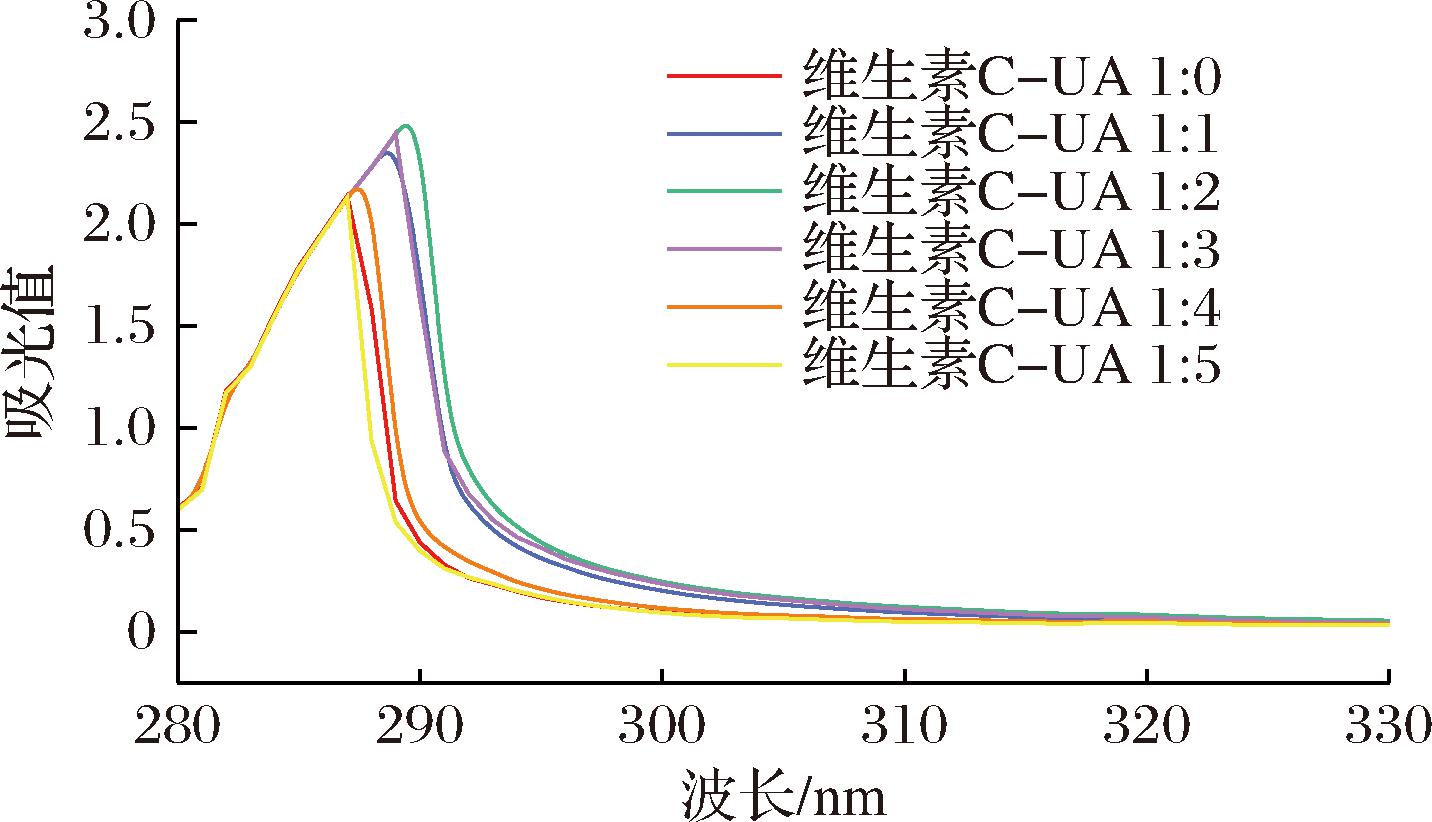
图4 UA对维生素C作用的UV-Vis图
Fig.4 UV-Vis spectrum of the interaction between UA and vitamin C
已有研究表明,UA与维生素C的相互作用可形成分子连接,且UA分子能够与其他分子通过氢键结合且紫外光谱吸收峰的红移现象与分子间相互作用引起的微环境极性变化密切相关[16]。本研究发现,随着UA浓度增加,维生素C在287.4 nm和290.4 nm处的吸收峰强度显著增强,并伴随波长红移至290.4 nm(Δλ=3.0 nm),表明UA的引入改变了维生素C分子周围的微环境极性。结合UA的氢键形成特性及红移效应,推测维生素C与UA通过氢键发生分子间相互作用,该作用可能通过电荷转移复合物的形成增强UA结构稳定性。
由图5所示,在230~340 nm光谱图出现了噪音峰,这是由于UA的最大紫外吸收波长在190~220 nm之间,在紫外区吸收可以忽略不计,紫外光谱测定无法保证分辨率,有着相对较低的灵敏度。因此对维生素C对UA的相互作用需要其他方法进行分析印证。

图5 维生素C对UA作用的UV-Vis图
Fig.5 UV-Vis spectrum of the interaction between vitamin C and UA
上述分析说明UA分子对维生素C分子有氢键作用,维生素C-UA体系产生了共轭效应,2个分子间氢键的形成降低了维生素C-UA体系的能量,形成了电荷转移复合物,使UA的结构得到稳定,从而保护了UA的稳定性。
2.3 维生素C-UA体系的红外光谱图分析
由图6可知,3组样品的峰形和峰位基本相近,但是峰高(吸光度A)存在差别,含量有所不同。可以观察出维生素C在3 149、1 399、3 413 nm及1 674 nm波段附近有波峰;UA在3 139、3 436、1 400、1 627 nm到1 698 nm有波峰;维生素C-UA波峰在3 434、3 138、1 629、1 399 nm及1 698 nm波段附近,表明复合物的某些特征波段的吸光度和峰值强度变化,分子结构发生了相应改变。
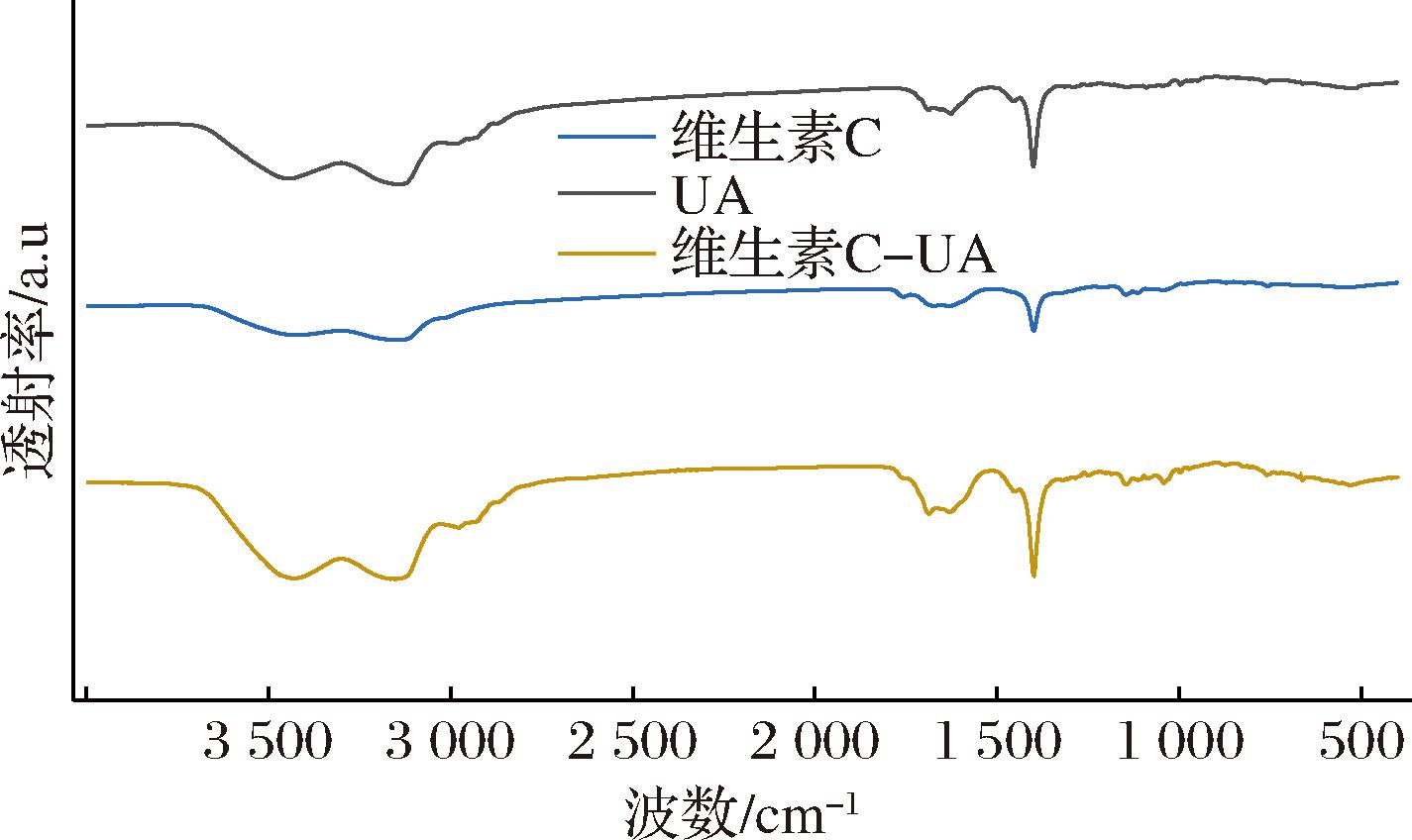
图6 维生素C、UA、维生素C-UA的傅里叶红外光谱图
Fig.6 FTIR spectra of vitamin C, UA, and vitamin C-UA
维生素C-UA红外光谱归属结果如表1所示,对比维生素C、UA标准品红外光谱曲线,维生素C-UA峰曲线特征无明显变化,峰值(吸光度)明显增强,说明维生素C-UA体系中化学键的数量增多;对比UA的红外谱线,维生素C-UA峰值从3 139 nm到3 138 nm,3 436 nm到3 434 nm发生了蓝移,体系发生了能量转移,已有研究发现氢键的形成通常会导致O—H伸缩振动峰的蓝移,因为氢键会增强O—H键的强度[17],说明维生素C与UA产生了相互作用,根据维生素C、UA的分子结构结合紫外、红外光谱图数据,尤其是3 436 nm到3 434 nm的蓝移推测维生素C烯二醇结构上的羟基—OH与UA的C-28位上羧基或C-3上的羟基形成氢键,维生素C、UA的分子结构发生变化。
表1 维生素C-UA红外光谱归属
Table 1 Attribution of vitamin C-UA infrared spectra

频率/nm-1归属3 434羟基O—H伸缩振动峰3 138羟基O—H伸缩振动峰1 399为—CH3的弯曲振动1 629α,β不饱和酮的CO伸缩振动1 698CC的伸缩振动
2.4 维生素C-UA体系的CV检测结果
在0~1 V电位范围内,UA以及等浓度的UA与维生素C混合体系,在pH=7.4的PBS中,于CNTs/GCE上的电化学行为如图7所示。结果显示,UA具有良好的电化学活性,出现2个氧化峰,但未出现还原峰,这表明UA在CNTs/GCE上的氧化过程分2步进行,且反应不可逆。UA的2个氧化峰电位分别为0.311 V和0.773 V,峰电流分别为2.358×10-5 A和6.184×10-5 A。在UA体系中加入维生素C后,UA-维生素C体系的氧化峰电流升高,峰电位变为0.299 V和0.707 V。这表明维生素C与UA之间发生了相互作用。已有研究表明,维生素C的存在会显著影响UA的氧化峰电流和峰电位[18],UA的氧化过程涉及羧基活性基团的参与[19]。结合维生素C和UA的分子结构,以及UA的电化学行为机制推测,反应机制为UA的C-28位上的活性基团羧基C![]() O与维生素C烯二醇结构上的羟基—OH通过氢键连接,形成了具有一定电化学活性的复合物。
O与维生素C烯二醇结构上的羟基—OH通过氢键连接,形成了具有一定电化学活性的复合物。
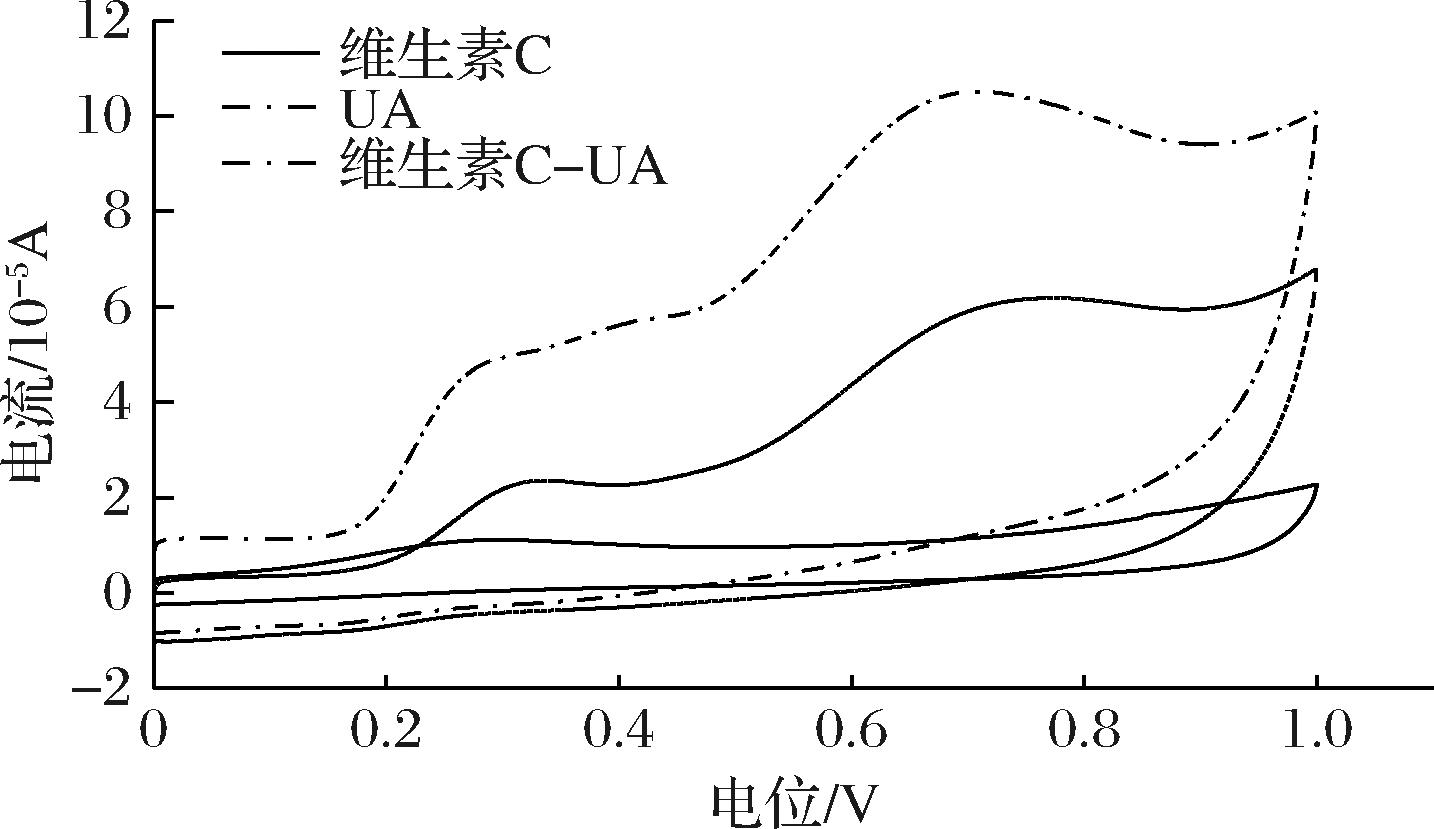
图7 UA、维生素C及UA-维生素C体系的CV曲线
Fig.7 Cyclic voltammetry curves of the UA, vitamin C, and UA-vitamin C systems
维生素C的锋电位为0.284 V,峰电位为1.112×10-5 A,只有一个氧化峰。维生素C中加入UA后,维生素C-UA体系峰电位出现2个氧化峰,峰电流随之升高,说明在等浓度条件下,UA在CNTs/GCE上的氧化还原反应远强于维生素C,表明CNTs/GCE对UA的电化学反应有良好的催化作用,使电子的传递速度增大,可以归因于电极经氧化处理后,表面会形成一层含氧基团的氧化层,它本质上有助于削弱羟基键能,通过O—H—O促进了电活化电极上的电子转移。从维生素C、UA的分子结构上看,UA的C-28上羧基比维生素C烯二醇结构上的羟基活性强,当UA与维生素C同时存在因UA上的羧基活性强而在电极上富集,导致与维生素C的伏安响应重叠。上述结果与稳定性实验结果高度吻合,维生素C通过氢键选择性稳定UA,而UA因羧基活性强主导电化学反应(峰电流升高、电位左移),导致维生素C氧化信号被掩盖且稳定性未改善,表明二者互作呈现单向保护效应,氢键复合物形成增强UA稳定性但未提升维生素C抗降解能力。
2.5 IGM分析
维生素C-UA复合物分子IGM如图8所示,蓝色部分表明有强吸引力,位于:结合位点A的维生素C烯二醇结构C-2上—OH与UA的C-28位上—COOH氧原子间;结合位点B的维生素C羟甲基上的—OH与UA的C-28位上—COOH氢原子间。由于蓝色部分周围有上述氢键的受体和氢键给体,因此确定蓝色部分强吸引力是维生素C-UA分子间形成了氢键。这与紫外光谱、红外光谱、电化学分析的结论一致。维生素C与UA之间存在绿色块状,此为两分子间范德华弱相互作用的可视化显示。然而IGM分析表明,UA与维生素C之间的氢键作用未能显著增强维生素C的结构稳定性,这与2.1节的实验结果(维生素C损失率无显著差异,P>0.05)一致。尽管UA的羧基通过氢键与维生素C的羟基结合(如C-2和C-5位点),但其作用位点未覆盖维生素C烯二醇结构中的易氧化区域,因而无法有效抑制维生素C的氧化降解,与2.1节的结论相互支持,进一步揭示了该体系中氢键介导的单向保护效应。
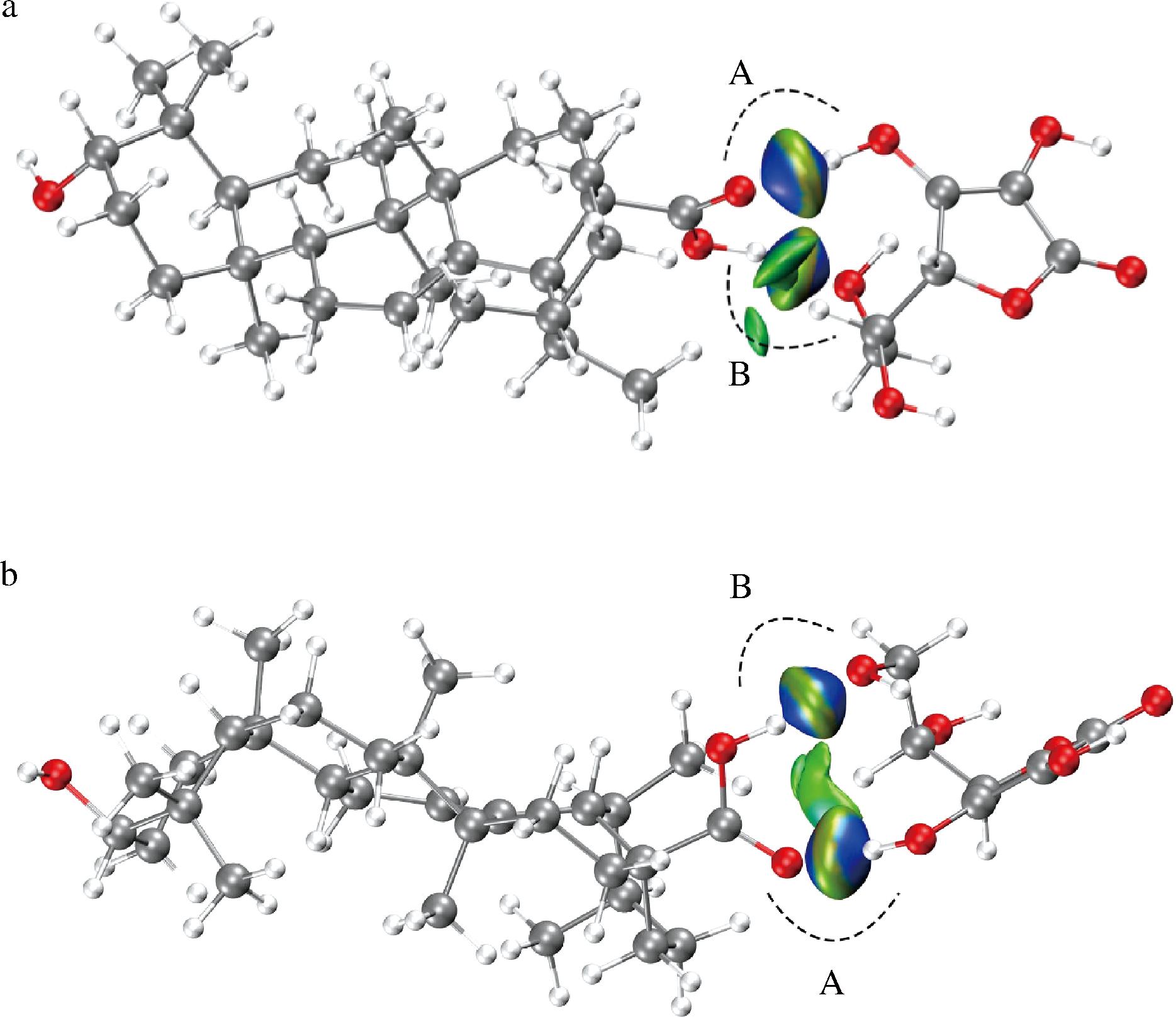
图8 维生素C-UA分子相互作用体系IGM轨道电子密度可视化图的2个互补视角
Fig.8 Two complementary views of IGM orbital electron density in Vitamin C-UA molecular interaction system
2.6 维生素C-UA复合物的几何构型及氢键结合位点
利用ORCA软件,在B3LYP泛函、DFT-D3(BJ)色散校正水平下对维生素C、UA分子进行结构优化,结果如图9-a所示,计算所得无虚频,表明优化后的结构稳定。从图9-b可见,结合位点A(H100…O32)位于维生素C烯二醇结构C-2上的—OH与UA的C-28位—COOH的氧原子之间,结合位点B(O989…H81)处于维生素C羟甲基的—OH与UA的C-28位—COOH的氢原子之间,且这2个结合位点均在IGM可视化图中得到验证,这表明维生素C与UA相互作用的本质是维生素C的烯二醇结构C-2上—OH和C-5羟基(—OH)与UA的C-28位—COOH形成氢键。已有研究发现羧基(—COOH)可作为氢键供体与受体,能和维生素C分子的羟基(—OH)形成氢键[20]。可见,作为UA主要活性基团的C-28位—COOH,能同时作为氢原子的供体和受体与维生素C形成氢键,该结论与紫外、红外光谱及电化学分析结论相似。
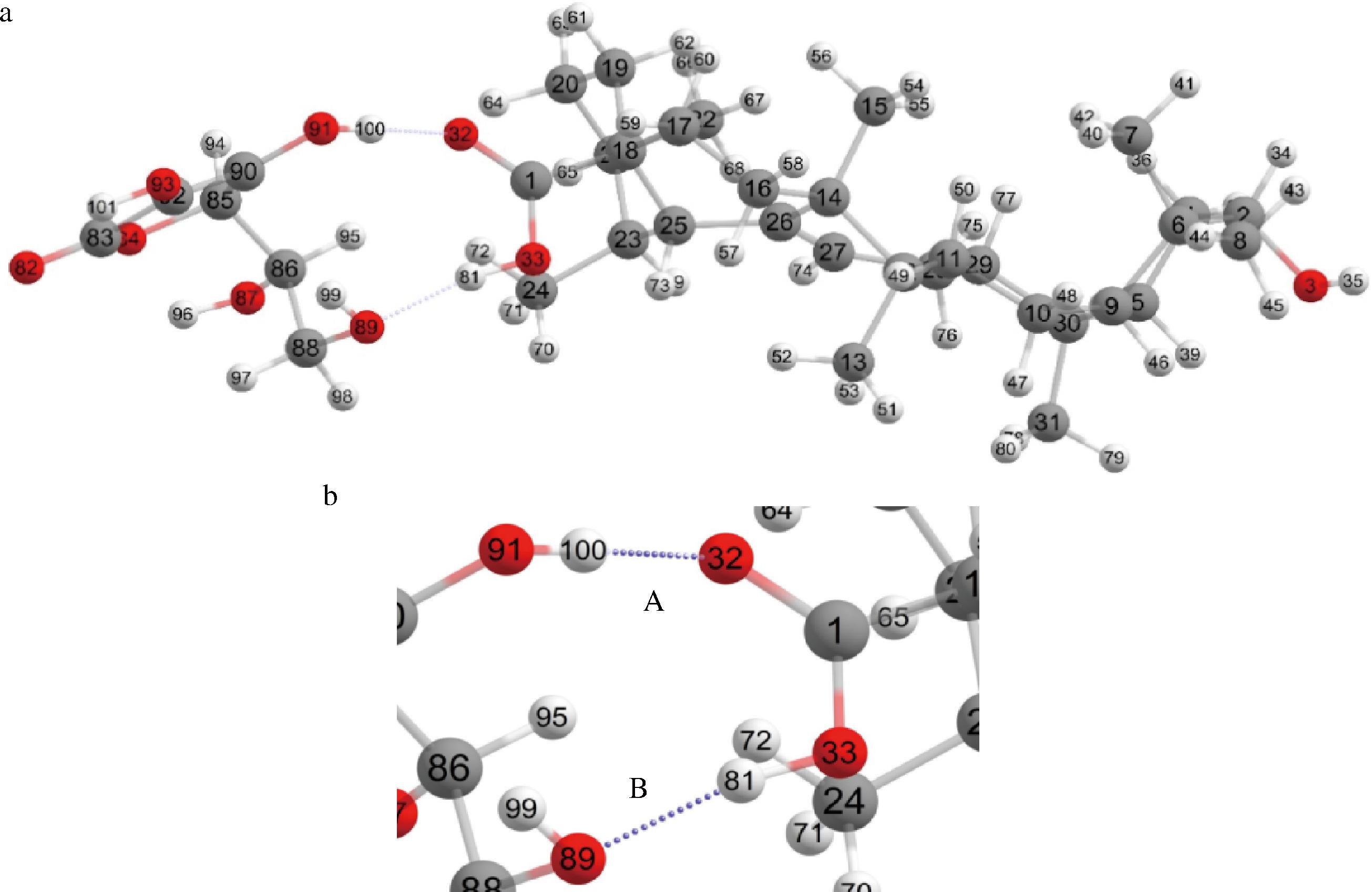
a-单分子维生素C与UA相互作用体系优化后几何构型;b-单分子维生素C与UA相互作用体系的氢键结合位点A(H100…O32)结合位点B(O89…H81)
图9 维生素C-UA优化后几何构型及氢键结合位点
Fig.9 Vitamin C-UA optimized geometry and hydrogen bonding sites
2.7 维生素C、UA分子相互作用结合能、键临界点电子密度及氢键键能
在CCSD(T)方法和TRUHLAR的“calendar”基组jul-cc-pVTZ方法水平下对维生素C-UA 体系进行结构优化和频率计算,根据结合能计算公式(1),对优化后各构型的分子间结合能进行计算。优化后的几何结构信息采用CCSD(T)/jul-cc-pVTZ方法,得到分子间氢键键临界点的电子密度ρ(BCP),代入EMAMIAN等[15]得出的拟合公式得到体系中氢键键能,计算结果列于表2。
表2 维生素C-UA分子互作结合能、键临界点电子密度及氢键键能
Table 2 Binding energy, bond critical point (BCP) electron density, and hydrogen bond energy of vitamin C-UA molecular interactions

注:维生素C-UA(复合物总体系):维生素C与UA结合形成的复合物的总能量;维生素C-UA-V:从复合物中维生素C分子部分(保留其在复合物中的几何构型),去除UA后单独计算的能量;维生素C-UA-U:从复合物中UA分子部分(保留其在复合物中的几何构型),去除维生素C后单独计算的能量。
复合物参数总体系和各部分能量(hartree)结合能/(kcal/mol)氢键位点键临界点电子密度(a.u.)氢键键能/(kcal/mol)维生素C-UA-2 081.666-23.465H100…O324.87×10-2-10.127O89…H814.59×10-2-9.493维生素C-UA-V-1 397.137维生素C-UA-U-684.492
从表2中可以看到体系结合能-23.465 kcal/mol为负值,说明体系结构稳定。维生素C-UA体系的(H100…O32)位点,即由维生素C烯二醇结构C-2上的—OH与UA的C-28位—COOH的氧原子形成的氢键,其键能最大为-10.127 kcal/mol;UA羧基与维生素C的C-5上羟基形成的氢键键能次之为-9.493 kcal/mol。键能分配与2.1节的单向保护效应相互印证,氢键的能量贡献集中于UA羧基,而维生素C的氧化敏感位点(烯二醇双键)未获足够能量支撑,导致其稳定性未提升。
3 结论
研究表明,维生素C-UA体系中,维生素C对UA具有显著保护作用,其损失率较对照组降低27.2%(P<0.05),而UA对维生素C的稳定性无显著改善(P>0.05)。光谱与电化学实验证实,维生素C与UA通过氢键形成电荷转移复合物,关键作用位点为UA的C-28羧基(—COOH)与维生素C烯二醇结构的C-2羟基(—OH)。紫外光谱中290.4 nm处红移(Δλ=3.0 nm)及红外光谱中O—H伸缩振动峰蓝移(3 436→3 434 cm-1),表明体系中氢键的形成改变了分子微环境极性;电化学分析进一步显示,UA氧化峰电流升高且电位左移(0.773→0.707 V),同时维生素C氧化信号因UA的强活性羧基富集而被掩盖,表明氢键复合物通过质子转移选择性稳定UA结构,但未提升维生素C抗氧化降解能力。分子模拟与独立梯度模型(IGM)验证了氢键位点的空间分布(结合能-23.465 kcal/mol),其中UA羧基氧原子(O32)与维生素C羟基(H100)的相互作用(键能-10.127 kcal/mol)为主导,另一氢键(O89…iH81,键能-9.493 kcal/mol)次之。综上,维生素C-UA互作呈现单向保护效应,UA羧基作为电子供体通过氢键稳定自身结构,而对维生素C的氧化敏感位点缺乏保护作用。研究揭示了刺梨原料活性成分之间相互关系,为功能因子高效利用技术精准设计提供了参考依据,同时为天然产物复合体系的稳定性优化策略提出了借鉴思路。
[1] 范晓燕, 孙彬焰, 郝东升, 等.刺梨的生物活性成分及加工利用研究进展[J].保鲜与加工, 2025, 25(1):139-147.FAN X Y, SUN B Y, HAO D S, et al.Research progress on bioactive components and processing and utilization of Rosa roxburghii[J].Storage and Process, 2025, 25(1):139-147.
[2] 杜涛. 贵州刺梨产业全链条发展[N].中国食品报, 2024-12-24(002).DU T.Comprehensive development of Guizhou Rosa roxburghii industry chain[N].China Food News, 2024-12-24(002).
[3] WANG J M, WANG G P, WANG X T, et al.Chemical constituents and bioactivities of Rosa roxburghii:A systematic review[J].Food Science and Technology, 2022, 42:e72722.
[4] FU M, LIU J, LI Q, et al.Synthesis of lipophilic vitamin C and evaluation of its antioxidant performance in sunflower seed oil frying[J].Food Chemistry, 2024, 460:140727.
[5] LUAN M Z, WANG H Y, WANG J Z, et al.Advances in anti-inflammatory activity, mechanism and therapeutic application of ursolic acid[J].Mini Reviews in Medicinal Chemistry, 2022, 22(3):422-436.
[6] KRASTEVA D, IVANOV Y, CHENGOLOVA Z, et al.Antimicrobial potential, antioxidant activity, and phenolic content of grape seed extracts from four grape varieties[J].Microorganisms, 2023, 11(2):395.
[7] TOFFALINI A, VIGOLO N, ROLLI N, et al.Association of low vitamin C concentrations and low consumption of fresh fruit and vegetables with cardiovascular disease in type 2 diabetes[J].BMC Nutrition, 2025, 11(1):68.
[8] 王晓霞, 马力通, 孙吉盛, 等.多光谱法和分子对接模拟法研究茶碱和胃蛋白酶的相互作用[J].光谱学与光谱分析, 2024, 44(3):714-721.WANG X X, MA L T, SUN J S, et al.Study on the interaction between theophylline and pepsin by multispectral and molecular docking simulation[J].Spectroscopy and Spectral Analysis, 2024, 44(3):714-721.
[9] 尚永辉, 李子媛, 刘鑫雨, 等.抗坏血酸在多壁碳纳米管修饰玻碳电极上的电化学行为及其与DNA的相互作用[J].咸阳师范学院学报, 2021, 36(6):37-40;71.SHANG Y H, LI Z Y, LIU X Y, et al.Electrochemical behavior of ascorbic acid on multi-walled nanotubes modified glassy carbon electrode and the intercation asarbic acid with DNA[J].Journal of Xianyang Normal University, 2021, 36(6):37-40;71.
[10] LU T, CHEN F W.Multiwfn:A multifunctional wavefunction analyzer[J].Journal of Computational Chemistry, 2012, 33(5):580-592.
[11] BRANDENBURG J G, BANNWARTH C, HANSEN A, et al.B97-3c:A revised low-cost variant of the B97-D density functional method[J].Journal of Chemical Physics, 2018, 148(6):064104.
[12] LEFEBVRE C, RUBEZ G, KHARTABIL H, et al.Accurately extracting the signature of intermolecular interactions present in the NCI plot of the reduced density gradient versus electron density[J].Physical Chemistry Chemical Physics, 2017, 19(27):17928-17936.
[13] LU T, CHEN Q X.Independent gradient model based on hirshfeld partition:A new method for visual study of interactions in chemical systems[J].Journal of Computational Chemistry, 2022, 43(8):539-555.
[14] 董志, 舒启江, 田爽, 等.黄芩苷与苦参碱分子间相互作用的量子化学计算与验证 [J].原子与分子物理学报, 2025(4):14-20.DONG Z, SHU Q J, TIAN S, et al.Quantum chemical calculation and verification of the intermolecular interaction between baicalin and matrine [J].Journal of Atomic and Molecular Physics, 2025(4):14-20.
[15] EMAMIAN S, LU T, KRUSE H, et al.Exploring nature and predicting strength of hydrogen bonds:A correlation analysis between atoms-in-molecules descriptors, binding energies, and energy components of symmetry-adapted perturbation theory[J].Journal of Computational Chemistry, 2019, 40(32):2868-2881.
[16] 高莉, 任燕玲, 刘琳琳, 等.黑色素-纳米硒的制备及其性质[J].食品科学, 2023, 44(6):97-106.GAO L, REN Y L, LIU L L, et al.Preparation and properties of melanin-nanoselenium complex[J].Food Science, 2023, 44(6):97-106.
[17] ALI H H, GHAREEB M M, AL-REMAWI M, et al.New insight into single phase formation of capric acid/menthol eutectic mixtures by Fourier-transform infrared spectroscopy and differential scanning calorimetry[J].Tropical Journal of Pharmaceutical Research, 2020, 19(2):361-369.
[18] MOTSHAKERI M, TRAVAS-SEJDIC J, PHILLIPS A R J, et al.Rapid electroanalysis of uric acid and ascorbic acid using a poly(3, 4-ethylenedioxythiophene)-modified sensor with application to milk[J].Electrochimica Acta, 2018, 265:184-193.
[19] TANG H, HU G Z, JIANG S X, et al.Selective determination of uric acid in the presence of ascorbic acid at poly(p-aminobenzene sulfonic acid)-modified glassy carbon electrode[J].Journal of Applied Electrochemistry, 2009, 39(12):2323-2328.
[20] CAI Z C, ZHU C, CHEN G Q, et al.Study on intermolecular hydrogen bond of uric acid water-clusters[J].Chemical Physics Letters, 2023, 818:140424.