果胶是一种来源广泛的天然植物多糖,其主链由半乳糖醛酸(galacturonic acid, GalA)通过α-1,4键线性连接而成,可作为稳定剂、乳化剂、凝胶剂和增稠剂应用于食品中,但其复杂的分子结构限制了其应用研究[1]。果胶降解后产生低相对分子质量的果胶低聚糖(pectin oligosaccharide,POS),与果胶相比,其结构相对明确,在抑菌活性[2]、肠道益生[3]和抗氧化活性[4]等方面均优于果胶,具有与低聚果糖(fructo oligosaccharides,FOS)相似的缓解便秘、降低血糖水平、降低结肠癌的发病率和调节免疫系统等益生活性[5]。果蔬产品加工产业每年会产生大量的农业副产品,其中含有丰富的果胶,如芒果皮(10%~15%)、火龙果皮(17%)、苹果渣(18%~19%)[6]。然而,仅20%农业副产品被用于动物饲料,大部分被废弃,其营养价值和经济价值未得到充分利用,造成资源浪费。火龙果(Hylocereus undatus)是常见的热带和亚热带水果,广泛种植于越南以及我国海南、广西等地,有数据显示,2021年中国火龙果消费量达到207.54万 t,产量和消费量逐年递增[7],但约1/3的火龙果皮因无有效方法回收而被废弃。将火龙果皮作为生产果胶和POS的原料,将有助于提高火龙果皮附加值,提高农民收入,符合国家乡村振兴发展战略要求。
目前制备POS的方法主要有3种:从原料中直接提取、利用化学法合成和酶解法降解果胶[8]。由于各种植物中POS含量较低,直接提取法得率低,不具备可行性;利用化学合成手段能得到特定结构的POS,但存在成本高、产量低、难以工业化应用的问题;降解果胶制备POS又分为物理法、化学法和酶解法[9]。物理降解果胶主要包括水热法、超声波法、高压降解法等,其随机性大[8];化学降解手段有酸水解和碱水解,需要使用大量的化学试剂,对环境不友好,且得到的POS聚合度有限[10];酶解法主要依靠内切多聚半乳糖醛酸酶[11]和果胶裂解酶[12]对果胶主要结构区域糖苷键进行随机切割,或使用鼠李糖半乳糖醛酸酶水解果胶中性糖侧链区域[13],从而制备特定结构、聚合度或分子质量的POS,不产生不良副产物,具有环保、条件温和等特点,是工业中生产食品级POS的常用手段。从制备流程看,酶解法需经过4个步骤:首先从植物原料中提取果胶[14],得到的果胶粗提物再经初步纯化,才能作为底物酶解制备POS,同时,酶的提取纯化也需要单独作为一个步骤,整个过程需要多种设备且耗费能源[15]。若直接以农业副产品作为原料,采用菌酶协同发酵法,整合果胶提取和酶解过程,将是一条经济、环保的生产路线。但目前探究生物发酵法制备POS的研究较少,且天然筛选得到的菌株有的酶活力较低,而且如黑曲霉不仅会产生内切型的果胶酶,其外切型的果胶酶会促进果胶进一步降解成单糖[16]。采用分子生物学手段,将特定果胶酶基因在大肠杆菌、毕赤酵母中异源表达,不仅能有效提高酶活力而且针对不同结构的果胶可以设计不同的重组酶进行表达,获得特定结构的POS,具有潜在的应用前景。YANG等[17]采用工程酵母菌发酵实现以柑橘皮废弃物为底物发酵生产2~7个聚合度的POS,产率达到26.1%。
本研究从实验室保藏的可降解果胶的黄曲霉JN-H10中挖掘内切多聚半乳糖醛酸酶,并利用毕赤酵母X-33进行重组表达,优化酶反应条件和发酵条件,采用菌酶协同发酵火龙果皮释放并酶解果胶,进一步利用乙醇分级沉淀制备HPOS,并对其单糖组成、分子质量分布和体外抗氧化活性进行了研究,为农副产品废物资源的有效再利用提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
黄曲霉JN-H10(筛选自腐烂植物中,保藏号为:JNSG00009762)、大肠杆菌(Escherichia coli)JM109、毕赤酵母(Komagataella phaffii)X-33、质粒pPICZα,均为本实验室保藏;克隆载体pUCm-T,生工生物工程(上海)股份有限公司。
1.1.2 菌株与质粒
PDA培养基(g/L):马铃薯200,葡萄糖20。
溶菌肉汤培养基(LB)(g/L):NaCl 10,酵母粉5,蛋白胨10,pH 7.2。
低氯化钠溶菌肉汤培养基(low sodium chloride Luria-Bertani medium,LLB)(g/L):除了NaCl用量为5,其余成分同LB培养基。
缓冲甘油基础培养基(buffered glycerol-complex medium,BMGY)(g/L):甘油10,酵母粉10,胰蛋白胨20,酵母氮源基础13.4,生物素4×10-4。
缓冲甲醇基础培养基(buffered methanol-complex medium,BMMY)(g/L):除甘油换成一定浓度的甲醇外,其余成分同BMGY。
火龙果皮发酵培养基(g/L):火龙果皮粉20,MgSO4·7H2O 0.5,KCl 0.5,生物素4×10-4。
1.1.3 主要试剂
胶回收试剂盒、质粒提取试剂盒、高保真酶、DNAmaker,南京诺唯赞公司;反转录试剂盒,上海生工生工生物工程(上海)股份有限公司;Μltrapμra RNA Kit,北京康为世纪生物科技有限公司;Zeocin(博来霉素),北京索莱宝公司;总抗氧化能力检测试剂盒(ferric ion reducing antioxidant power,FRAP法),上海碧云天生物技术有限公司;单糖标准品,美国Sigma生物公司;间羟基联苯,上海麦克林生物科技有限公司;果胶甲酯酶、木聚糖酶,夏盛(北京)生物科技开发有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP),北京伊诺凯有限公司;多聚半乳糖醛酸,上海源叶生物科技有限公司;红心火龙果,广西北流寻味君农业有限公司;其他常规试剂及药品为国产或进口分装。
1.2 仪器与设备
Mastercycler® nexus-PCR仪,德国Eppendorf股份公司;FD-1A-50型真空冷冻干燥机,江苏天翎仪器有限公司;Synergy H1型酶标仪,南京拜尔沃克智能科技有限公司;DM2000 LED型光学显微镜,德国徕卡仪器有限公司;DEAE-Sepharose Fast Flow型高效凝胶过滤色谱,北京索莱宝科技有限公司;Waters高效液相色谱仪,配备紫外检测器,美国沃特斯科技公司。
1.3 实验方法
1.3.1 重组表达菌株构建
从黄曲霉 JN-10斜面刮取孢子于PDA培养基培养3 d,按照Μltrapμra RNA Kit提供的方法提取总RNA,利用反转录试剂盒反转录获得cDNA,以其为模板,根据黄曲霉内切多聚半乳糖醛酸酶基因序列(U05015.1)设计引物:endoPecA-F:GGAATTCGTCCCAGTAGAACTCGAAGCCC和endoPecA-R:CTAGTC-TAGATTAACAAGAAGCACCAGTAGGAACG,进行PCR扩增,产物经胶回收后进行dA加尾并连接至pUCm-T载体,获得重组载体T-endoPecA,使用EcoRⅠ和XbaⅠ对T-endoPecA和pPICZα分别进行双酶切,连接并转化E.coli JM109,转化子经菌落PCR验证,转接含有100 μg/mL Zeocin的LLB培养基,提取质粒进一步双酶切和测序验证,获得重组质粒pPICαA-endoPecA,使用SacⅠ将其线性化,电转至毕赤酵母X-33感受态,涂布于含100 μg/mL Zeocin的YPD平板,阳性转化子经 PCR验证,获得重组菌株X-33-endoPecA。
1.3.2 酶表达与纯化
将重组菌X-33-endoPecA活化后,接种至BMGY培养基,30 ℃ 220 r/min培养扩增至OD600nm值为2.0,用无菌水洗净菌体后转接至BMMY培养基使OD600nm值为1.0,每隔24 h添加1%(体积分数)甲醇诱导,培养5 d,4 ℃ 8 000 r/min离心10 min,收集上清液,使用10 kDa的超滤离心管进行浓缩,用pH 7.0的PBS洗涤3次,由于重组酶的等电点为3.93,故浓缩液中重组酶带负电荷,采用阴离子交换色谱柱纯化蛋白。采用SDS-PAGE进行蛋白电泳分析,采用Bradford法进行蛋白浓度的测定。
1.3.3 酶活力性质研究
参考王婷[16]的方法,采用3,5-二硝基水杨酸法测定内切聚半乳糖醛酸酶活力。将100 μL 稀释至适当浓度的酶液与400 μL 多聚半乳糖醛酸底物(pH 4.5,3.3 g/L) 混合,在30 ℃ 条件下反应5 min后用3,5-二硝基水杨酸试剂终止反应。反应的样品于沸水内显色7 min后立即用水冷却,并在540 nm 条件下测定吸光度。酶活力单位(U) 定义为每1 min水解多聚半乳糖醛酸所产生的1 μmol GalA所需的酶量。
采用单因素试验,分别测定不同温度(20~80 ℃)和不同pH(4.0~8.0)下重组酶的最佳活力,测定不同温度(50、60、70 ℃)和不同pH(4.0、5.0、6.0)对酶活力稳定性的影响。
分别加入金属离子Fe2+、K+、Ca2+、Cu2+、Zn2+、Mn2+、Mg2+和Na+稀释粗酶液,使反应体系中的金属离子终浓度为2 mmol/L。在最适反应条件下反应5 min,以不加金属离子的空白组酶活力记为100%。
在最适反应条件下,测定重组酶对不同底物(多聚半乳糖醛酸、火龙果皮提取果胶)的酶活力。
1.3.4 外源添加酶对发酵过程中果胶释放量的影响
分别外源添加1%(体积分数)果胶甲酯酶、0.8 g/L木聚糖酶、0.8 g/L纤维素糖酶和0.8 g/L的纤维素糖酶+木聚糖酶到10 g/L的火龙果皮粉中,在30 ℃,180 r/min条件下培养12 h,采用间羟基联苯法测定发酵上清液中总GalA含量。
1.3.5 菌酶协同发酵火龙果皮制备POS
按照1.3.2节的方法将重组菌株X-33-endoPecA活化、扩增后接种至火龙果皮发酵培养基使OD600nm值达到2.0,加入1%(体积分数)甲醇、1%(体积分数)果胶甲酯酶和0.8 g/L木聚糖酶,28 ℃ 180 r/min发酵48 h。发酵结束后,将发酵液煮沸10 min,冷却后4 ℃ 12 000 r/min离心10 min,取上清液,利用3,5-二硝基水杨酸法测定OD540nm的吸光度值来反应还原糖含量变化,利用间羟基联苯法测定总GalA含量反映果胶的释放程度。
1.3.6 POS分离纯化
参照王婷[16]的方法,采用乙醇分级沉淀法分离POS。发酵上清液经过旋蒸浓缩后向其中加入乙醇使其体积分数达到60%,4 ℃ 8 000 r/min离心15 min,收集沉淀得到HC60组分;向上清液中加入乙醇使其体积分数达到80%,4 ℃ 8 000 r/min离心15 min,收集沉淀得到HC80组分;向上清液中加入乙醇使其体积分数达到90%,4 ℃ 8 000 r/min离心15 min,收集沉淀得到HC90组分,最后的上清液旋蒸浓缩后命名为HC100,得到的沉淀物进行冷冻干燥。
1.3.7 单糖组成分析
参照乔梦如等[18]的方法,采用PMP柱前衍生化HPLC法分别测定不同样品的单糖组成。
1.3.8 分子质量测定
采用蔡国林[19]的方法测定POS的分子质量。多分散性指数采用公式(1)计算,聚合度采用公式(2)计算。
多分散性指数![]()
(1)
聚合度![]()
(2)
式中:Mw,重均分子质量, Mn,数均分子质量。
1.3.9 薄层色谱分析
参考郝梦洁[20]的方法,利用薄层层析色谱(thin layer chromatography,TLC)分析发酵前后不同组分的多糖或POS的迁移程度。
1.3.10 抗氧化活性测定
采用CHEN等[21]的方法测定POS的DPPH自由基清除活性,按照公式(3)计算自由基清除率。
清除率![]()
(3)
式中:A0,用蒸馏水替换样品测定的吸光度值;Ax,样品溶液测定的吸光度值;Ax0,无水乙醇代替DPPH溶液测定的吸光度值。
采用CHEN等[21]的方法测定POS的ABTS阳离子自由基清除活性,按照公式(4)计算自由基清除率。
清除率![]()
(4)
式中:Ax,样品吸光度值;Ax0,用PBS替换ABTS稀释液测定的吸光度值;A0,用蒸馏水替换样品测定的吸光度值。
采用QI等[22]的方法测定POS的羟自由基清除活性,按照公式(5)计算自由基清除率。
清除率![]()
(5)
式中:Ax,样品吸光度值;A0,用蒸馏水替换样品吸光度值;Ax0,用蒸馏水替换H2O2溶液吸光度值。
采用总抗氧化能力检测试剂盒(FRAP法)测定总抗氧化能力。
1.4 数据处理
所有实验测定3次,实验数据以“平均值±标准差”表示。使用Origin 2023、Excel 2021软件绘图,采用SPSS 25进行数据分析统计,采用ANOVA进行单因素分析,事后多重比较采用LSD+Duncan法检验,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 内切多聚半乳糖醛酸酶重组表达
以可降解果胶的黄曲霉JN-H10的RNA为模板进行反转录PCR获得cDNA,以cDNA为模板,利用引物endoPecA-F和endoPecA-R进行PCR扩增后测序,扩增产物与来源于Aspergillμs flavus(GenBank:U05015.1)的内切多聚半乳糖醛酸酶endoPecA基因相似度为99.54%,氨基酸相似度为100%。将去除信号肽的成熟肽基因endoPecA连接到pPICαA载体中获得重组表达质粒pPICαA-endoPecA。利用限制性内切酶EcoRⅠ和XbaⅠ进行双酶切验证,电泳结果如图1-a,酶切获得3 200 bp和1 000 bp片段,与预期相符。将pPICαA-endoPecA电转化至X-33中获得重组表达菌株X-33-endoPecA,利用载体通用引物α-factor和3-AOX进行PCR验证,电泳结果如图1-b所示,扩增产物为1 300 bp,与预期相符,表明重组菌X-33-endoPecA构建成功。
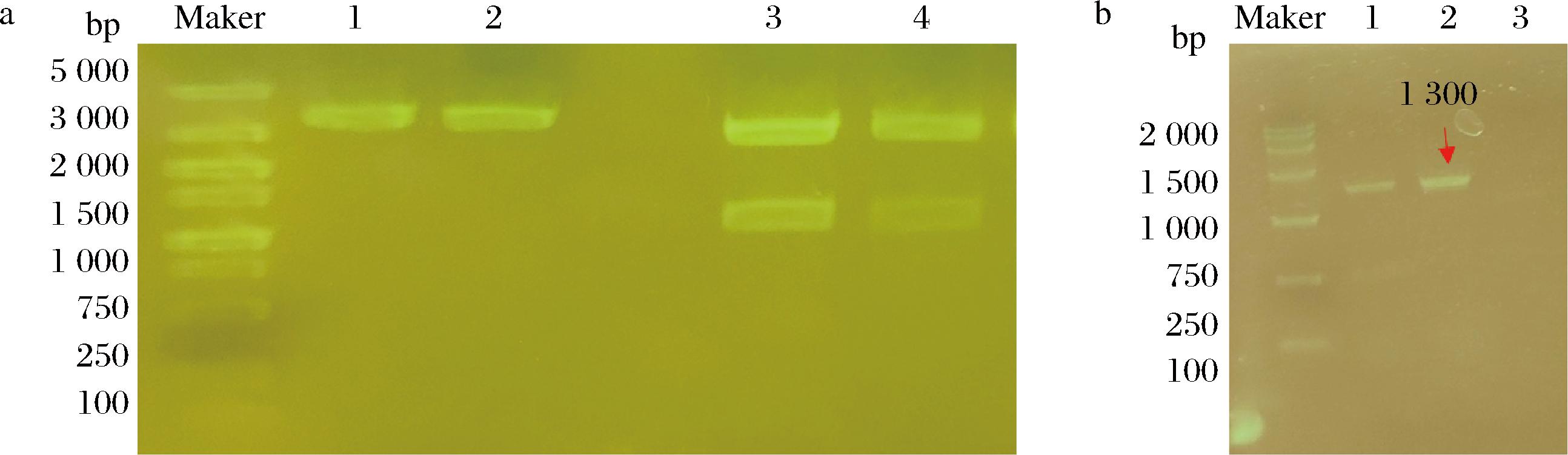
a图:泳道1~2-空质粒;泳道3~4-pPICαA-endoPecA;b图:泳道1~2-重组菌株;泳道3-对照菌株X-33。
a-重组表达载体;b-重组菌株
图1 重组表达载体和重组菌株验证
Fig.1 Verification of the recombinant plasmid and strain
将X-33-endoPecA培养后添加甲醇诱导重组酶表达,诱导120 h时,发酵上清液酶活力达到1 654.32 U/mL,蛋白质量浓度达到0.55 mg/mL,菌体浓度OD600nm值为26.26。收集发酵上清液,利用阴离子交换柱纯化,经SDS-PAGE检测结果如图2所示,蛋白条带均一无其他明显杂带,实际大小比理论值稍大(36 kDa),可能是毕赤酵母后翻译修饰导致的。
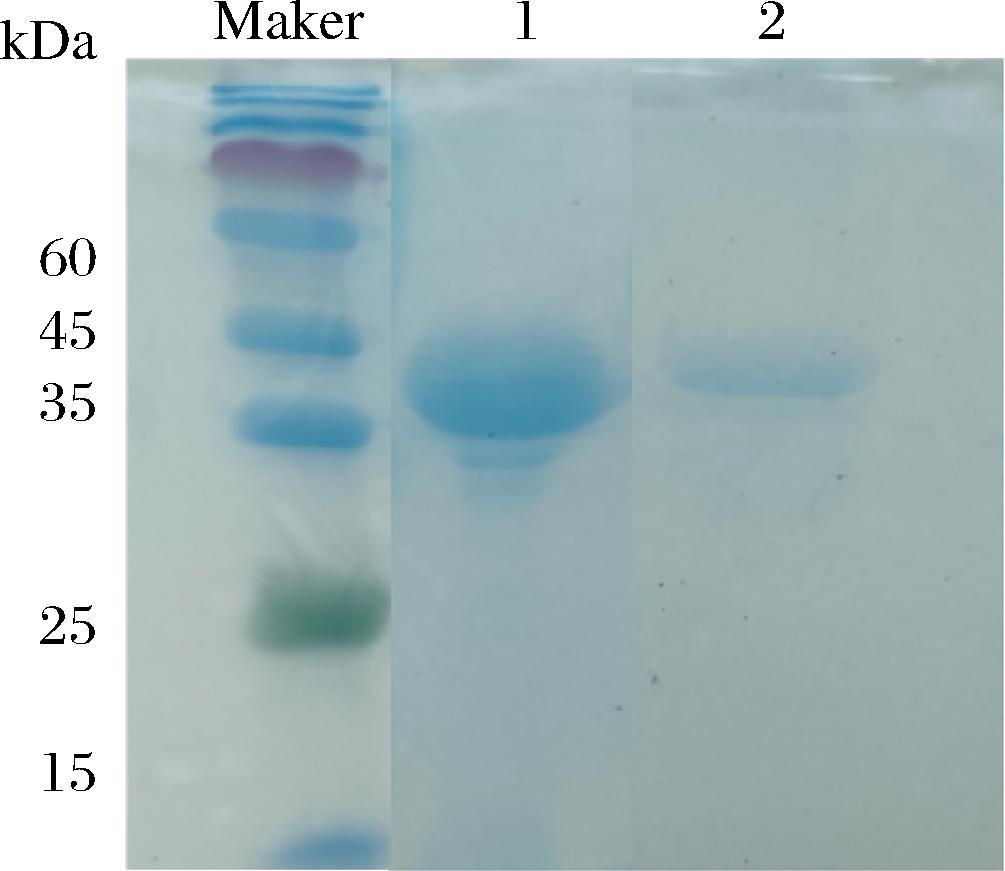
泳道1-发酵上清浓缩液;泳道2-纯化的重组酶endoPecA。
图2 SDS-PAGE检测endoPecA
Fig.2 Identification of endoPecA by SDS-PAGE
2.2 重组酶endoPecA的酶学性质
endoPecA(EC 3.2.1.15)属于糖苷水解酶家族28,是典型的内切型果胶酶,作用底物为果胶酸和多聚半乳糖醛酸,催化水解内部的1,4-α糖苷键生成半乳糖醛酸单糖和低聚糖半乳糖醛酸。对纯化后的endo-PecA进行酶学性质研究,其最适反应温度为30 ℃(图3-a),最适pH值为4.5,在偏酸性条件下酶活力最高,在偏碱性条件下酶活力急剧下降(图3-b)。endoPecA热稳定性较高(图3-c),在50 ℃和60 ℃处理30 min后保留90%以上的相对酶活力,在70 ℃处理30 min保留60%的相对酶活力;随着处理时间的延长,稳定性逐渐下降,在50~70 ℃处理90 min后仍保留超过50%的相对酶活力。pH稳定性实验表明,在pH 4~6处理120 min仍保留超过50%的相对酶活力, pH 4和5在处理30 min后酶活力下降超过20%,但随着处理时间延长,酶活力损失增速降低。多数研究表明[23-24],多聚半乳糖醛酸酶属于酸性果胶酶,在偏酸性条件下发挥最大酶活力且酶活力稳定性高。与其他多聚半乳糖醛酸酶相比[20,25],本研究表达的endoPecA酶活力在酸性pH和常温条件下较高,酶活力条件和稳定性适宜,适用于发酵具有酸性pH(4~5)的火龙果皮基质培养基。
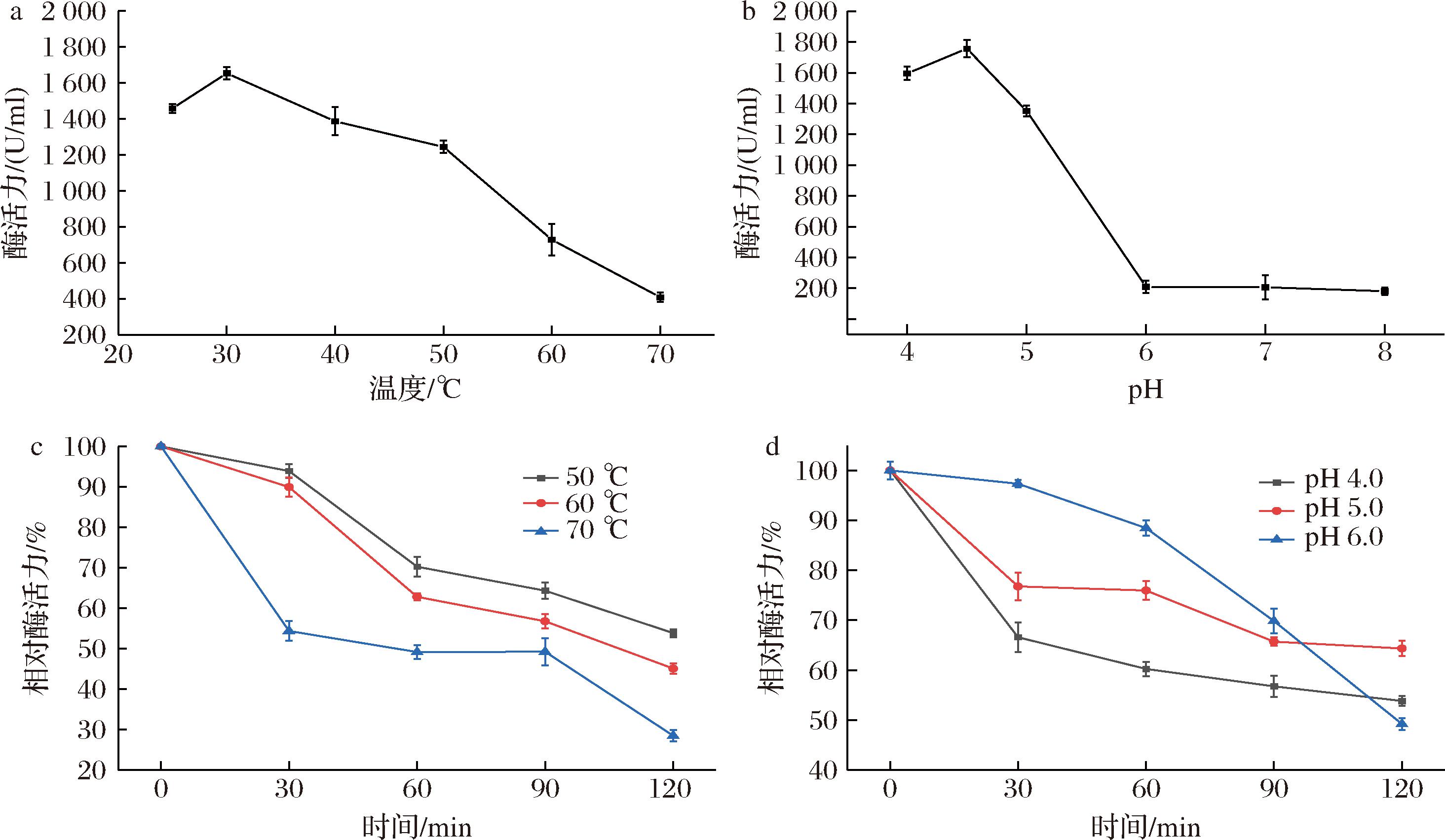
a-最适温度;b-最适pH;c-温度稳定性;d-pH稳定性
图3 endoPecA酶学性质研究
Fig.3 Enzyme activity characteristic of endoPecA
不同的金属离子对酶有抑制或促进作用,在最佳酶活力条件下测定不同二价金属离子对endPecA催化活力的影响,结果如图4所示。Na+、K+、Fe2+、Mg2+均能促进endPecA的酶活力(P<0.05),Cu2+、Mn2+、Ca2+、Zn2+均对酶活力有强烈的抑制作用,这与杨成玮等[26]的研究类似,但其研究中Zn2+对多聚半乳糖醛酸酶有促进作用。金属离子对酶活力的抑制作用可能源自其直接结合底物聚半乳糖醛酸分子中带负电荷的羧基基团,并通过破坏酶-底物复合物的构象稳定性间接干扰催化反应进程,最终导致酶活力下降[27]。
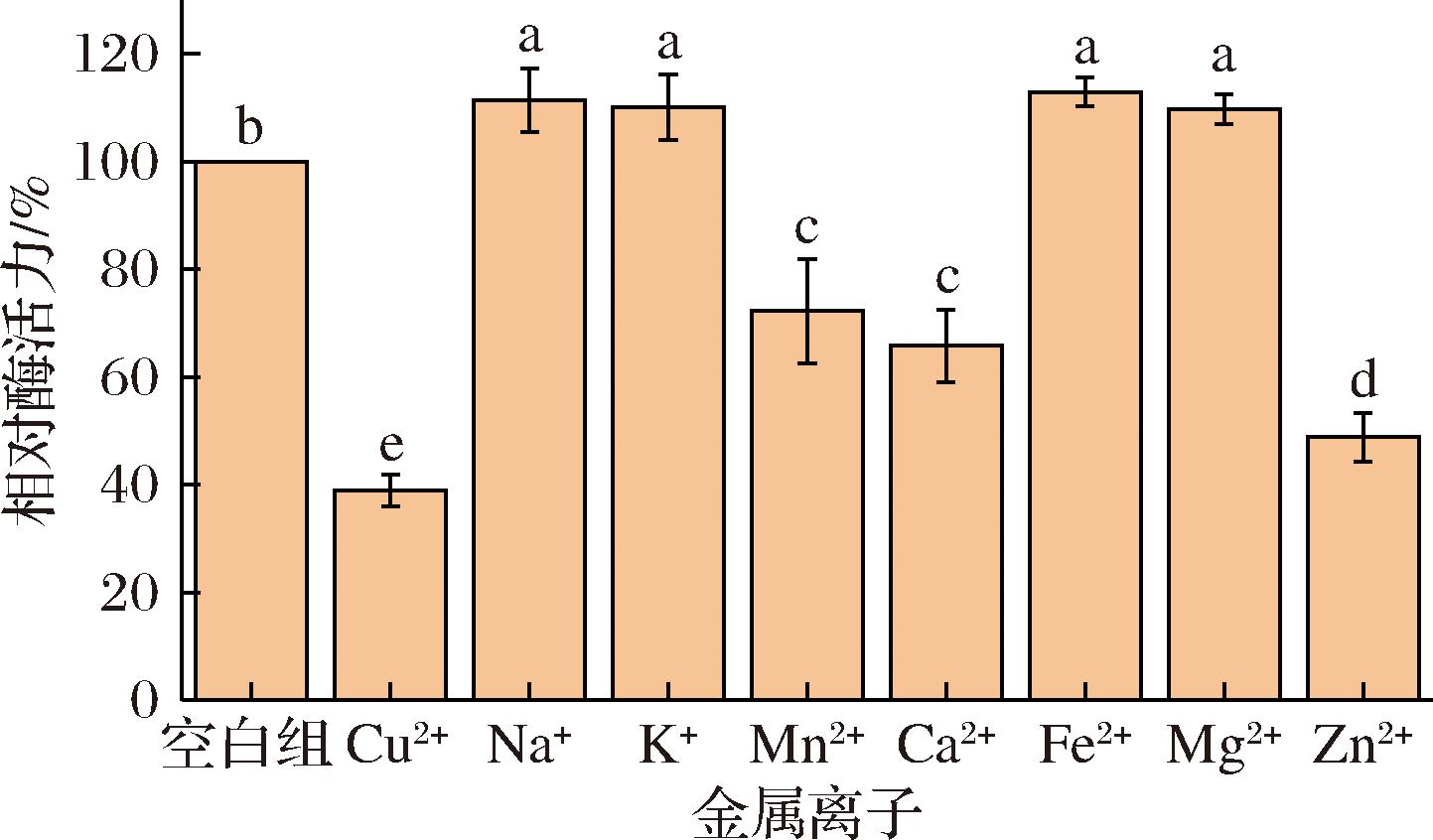
图4 金属离子对endoPecA催化活性的影响
Fig.4 Effects of metal ions on the catalytic activity of endoPecA
注:不同小写字母之间表示差异显著(P<0.05)。
多聚半乳糖醛酸酶对不同的底物有其特异性,以多聚半乳糖醛酸和火龙果皮提取果胶为底物探究endoPecA对不同底物的酶活力。结果如表1所示,以火龙果皮提取果胶为底物的酶活仅为多聚半乳糖醛酸酶的1/5,当加入果胶甲酯酶协同测定酶活力,相对酶活力提高了2.54倍。前期测定了火龙果皮提取果胶的酯化度为65%,而果胶甲酯酶能催化降解多聚半乳糖醛酸区域的甲酯基团从而有效提高endoPecA对底物的酶活力。
表1 不同底物对endoPecA催化活性的影响
Table 1 Effect of different substrates on the catalytic activity of endoPecA

注:不同小写字母之间表示差异显著(P<0.05)(下同)。
多聚半乳糖醛酸酶火龙果皮提取果胶endoPecAendoPecAendoPecA+果胶甲酯酶相对酶活力/%100.06±2.99a22.26±1.02c56.50±3.24b
2.3 工程菌发酵火龙果皮制备POS
为了更好地释放、降解果胶并且促进可发酵性糖的生成,让重组菌更好的生长和表达,研究了外源添加纤维素酶、木聚糖酶和果胶甲酯酶对果胶释放的影响。结果如表2所示,添加果胶甲酯酶并不能提高果胶的释放(P>0.05),添加纤维素酶和木聚糖酶均能促进果胶的释放(P<0.05),同时观察到酶解液的黏度下降,但木聚糖酶效果更好。外源添加酶能水解植物细胞壁中的半纤维素层和纤维素层,促进果胶释放和endPecA接触,故后续发酵实验添加0.8 g/L木聚糖酶。此外根据2.2节研究结果,优化发酵培养基的培养条件为28 ℃,pH自然,并添加1%(体积分数)果胶甲酯酶、0.5 g/L MgSO4·7H2O、0.5 g/L KCl。
表2 不同外源添加酶对火龙果皮果胶释放的影响
Table 2 Impact of different exogenously added enzymes on pectin release from H.undatus peel
未添加果胶甲酯酶木聚糖酶纤维素酶纤维素酶+木聚糖酶发酵液中总GalA含量/(mg/mL)0.63±0.02c0.69±0.09c1.90±0.02a1.82±0.00b1.80±0.02b
进一步优化发酵底物浓度和起始OD600nm,使用不同底物(10、20、40 g/L)质量浓度发酵,在发酵过程中,发酵液中的还原糖含量均呈现先上升后下降最后稳定的趋势(图5-a),发酵前期,在木聚糖酶和重组酶endoPecA的作用下,果胶解聚和木聚糖解聚产生还原端,还原糖含量也随之升高,发酵后期酵母不断消耗可发酵糖[28],还原糖含量逐渐下降[17],当底物质量浓度为20 g/L时,总GalA含量最高(图5-b),说明在20 g/L底物质量浓度下原料中果胶的释放更快,有利于酶解生成HPOS,且40 g/L底物质量浓度的培养基流动性差,酵母的生长发酵较慢。使用不同接种量,当起始OD600nm值为 2和3时,前期还原糖含量增加较少,这主要是由于酵母快速生长需要消耗更多的可发酵还原糖,发酵至48 h后,各发酵条件下还原糖含量也趋于一致(图5-c),说明提高接种量可以促进酵母生长发酵从而诱导酶的表达,并且消耗原料中不必要的可发酵糖。当起始OD600nm值为2时,发酵前24 h的总GalA含量增速最快,发酵至48 h时总GalA含量为7.71 mg/mL与OD600nm值为3时7.78 mg/mL无显著差异(P>0.05),经测定火龙果皮粉中GalA含量为7.98 mg/mL,说明此时果胶已完全释放。从发酵时间上看,前24 h主要是果胶和其他多糖组分从植物细胞壁中释放出来,还原糖含量增加,前48 h是果胶酶解和酵母利用发酵液中的可发酵糖。综上,采用20 g/L底物质量浓度,起始OD600nm值为2,发酵48 h从火龙果皮原料中制备HPOS。
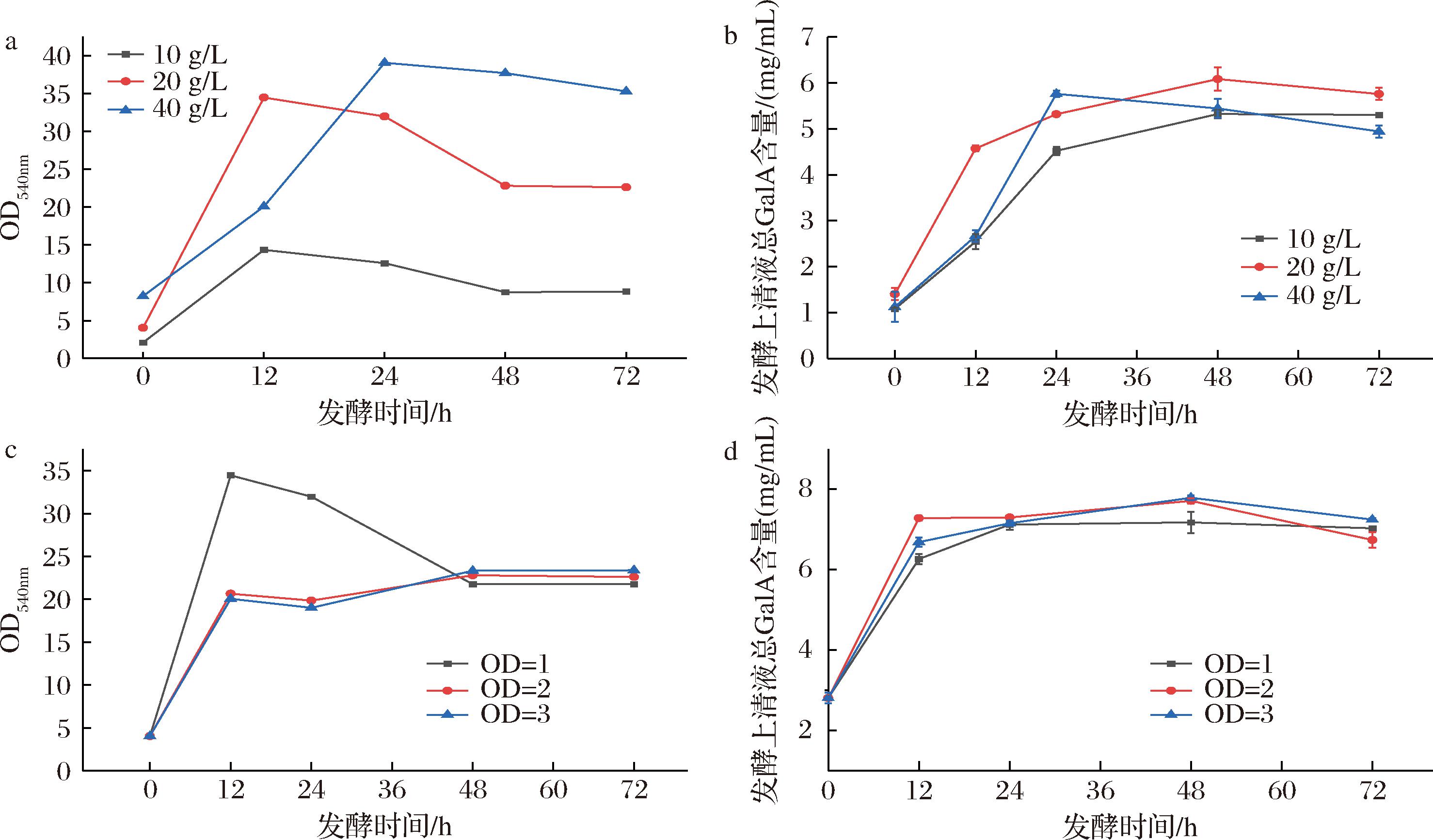
a-不同底物质量浓度还原糖变化(以OD540nm值表示);b-不同底物质量浓度GalA含量变化;c-不同起始OD600nm
还原糖变化(以OD540nm值表示);d-不同起始OD600nm GalA含量变化
图5 不同底物浓度和不同起始OD600nm对发酵生产HPOS的影响
Fig.5 Effect of substrate concentration and starting OD600nm on HPOS yield
采用优化后的发酵工艺制备POS,根据2.4节结果测定了发酵液中HPOS产量为5.09 mg/mL(以GalA计)。而火龙果皮粉中GalA的含量为38.54%(以干物质计),计算出火龙果皮果胶转化为HPOS的产率为63.78%(以GalA含量计),相对于原料HPOS的产率为25.45%(以GalA含量计)。该产率与YANG等[17]从柑橘皮粉中制备得到的oligogalacturonides(OGs)相当,经过RSM优化后,发酵72 h OGs产量为4.49 mg/mL,产率26.1%,而本研究中制备POS的时间更短,得到产量更高,说明以火龙果皮为底物原料制备POS有更好的优势,且发酵培养基不需要添加缓冲液,采用天然pH就能有效提取、降解果胶。此外,未水解的不溶物、粗蛋白和灰分可在煮沸离心后去除,大大降低了后续产物提取的成本,且与酸法、物理法相比,不耗费化学试剂,对环境友好,设备简单,降解效率高。而与纯粹用酶法来制备POS相比,该法不需要单独纯化酶,仅靠重组菌的诱导表达就能持续产生,生产POS的成本更低。
2.4 POS的理化性质
乙醇分级沉淀法是一种可以较好地分离不同聚合度多糖的方法,在王婷[16]的研究中,柑橘果胶酶解液在不同乙醇浓度下能较好地沉淀出不同分子质量、聚合度的POS,在60%乙醇终体积分数下,醇沉上清液的多糖组分聚合度在2~20,属于严格意义上的低聚糖范畴[29];在90%乙醇终体积分数下,醇沉上清液中只剩下半乳糖醛酸单糖,不含低聚糖组分。本研究参照此方法,对发酵液进行浓缩醇沉,得到一系列醇沉产物,并通过分子质量分布、TLC和单糖组成分析其理化性质。
分子质量分布结果显示(图6-a),未发酵液的峰较多且相对分子质量高,而经过菌酶协同发酵后的组分分子质量大小显著降低,HC60、HC80和HC90的相对分子质量分别为6.64、1.57、0.68 kDa,重均聚合度分别为36.8、8.70、3.77,其中HC80和HC90属于低聚糖范畴,多分散性指数分别为5.46、1.68、1.33,说明低分子质量组分的分子质量分布较均一。TLC结果表明(图6-b),发酵上清液显示3条显色带,其中一条条带迁移率与半乳糖醛酸单糖一致;HC60显色带位于点样孔附近,说明其分子质量较大,难以在硅胶板上迁移;HC80与HC90均含有2条显色带,HC90中小分子质量条带显色更深,说明其含有更多的小分子质量低聚糖;HC100仅存在1条显色带,且与半乳糖醛酸单糖标准品迁移率一致。结果表明,乙醇分级沉淀能很好地分离不同聚合度的多糖,本研究的火龙果皮经菌酶协同发酵后,果胶被释放并降解形成GalA和POS,其中HC80和HC90组分属于低聚糖范畴。因此,将组分HC80和HC90并命名为HPOS。
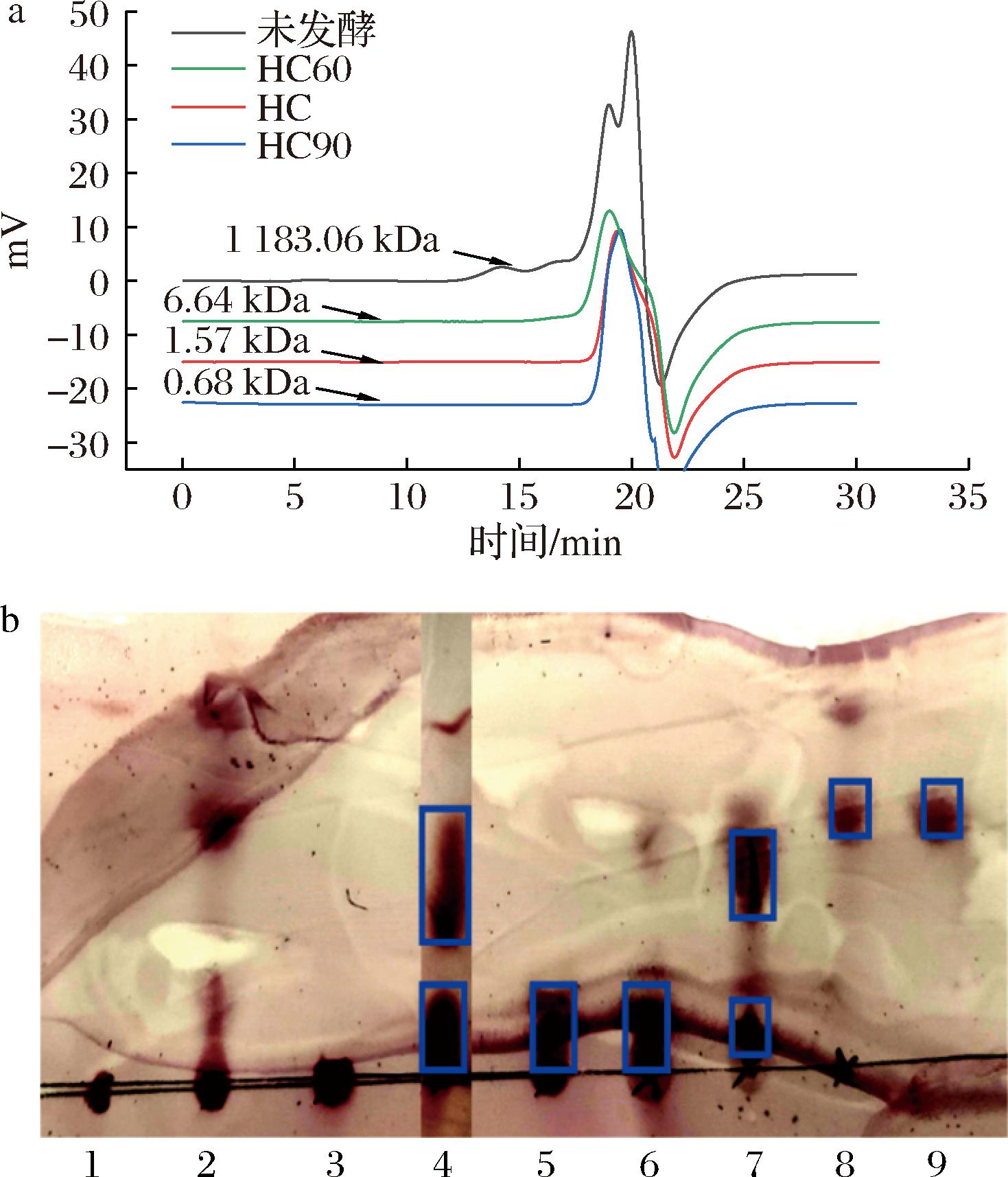
1-原料;2-发酵上清液;3-HC60;4-HPOS;5-HC80;6-HC90;7-HC100;8-GalA标准品。
a-不同醇沉组分的分子质量分布;b-TLC分析
图6 醇沉组分的分子质量分析
Fig.6 Molecular mass analysis of precipitated components
为了进一步了解低聚糖组分HPOS中的单糖组成,采用柱前衍生HPLC法分析。结果表明,火龙果皮提取果胶以鼠李糖、GalA、葡萄糖、半乳糖和阿拉伯糖为主,摩尔比为7.35∶25.04∶1∶2.34∶1.47,GalA含量为68.83%,同型聚半乳糖醛酸(HG)区占比49.88%,鼠李糖半乳糖醛酸-Ⅰ(RG-Ⅰ)区占比47%(图7),说明该火龙果皮果胶富含GalA和鼠李糖,且支链程度高,水溶性、黏稠度和凝胶性较好[21],火龙果皮粉的单糖组成也发现鼠李糖、阿拉伯糖、半乳糖等中性糖含量较高,含有中性糖较高的POS可能具有更高的益生活性[16]。HPOS含有GalA、鼠李糖、葡萄糖、半乳糖和少量的阿拉伯糖,以半乳糖醛酸含量最高(63.36%),说明通过菌酶协同发酵也能一定程度上降解果胶的非HG区,但具体的降解机制需要进一步的研究,可能与发酵本身的环境(如pH)或者酶有关。与提取果胶相比,HPOS中含有较高比例的葡萄糖,有研究指出[30],火龙果皮中含有4~8聚合度的低聚葡萄糖或低聚果糖,由于本发酵体系缺乏相关降解酶系,这些低聚糖得以保留。在未水解发酵液的单糖色谱图中仅发现了GalA峰,由于火龙果皮中还含有一些如葡萄糖、果糖等[31]可发酵性糖,在发酵过程中不断被酵母消耗[32],仅有GalA难以被酵母利用,故发酵液中仅存在GalA。因此,微生物联合酶发酵法与生物酶法相比,能够去除发酵过程中产生的单糖,有利于后续产物的提取和纯化。
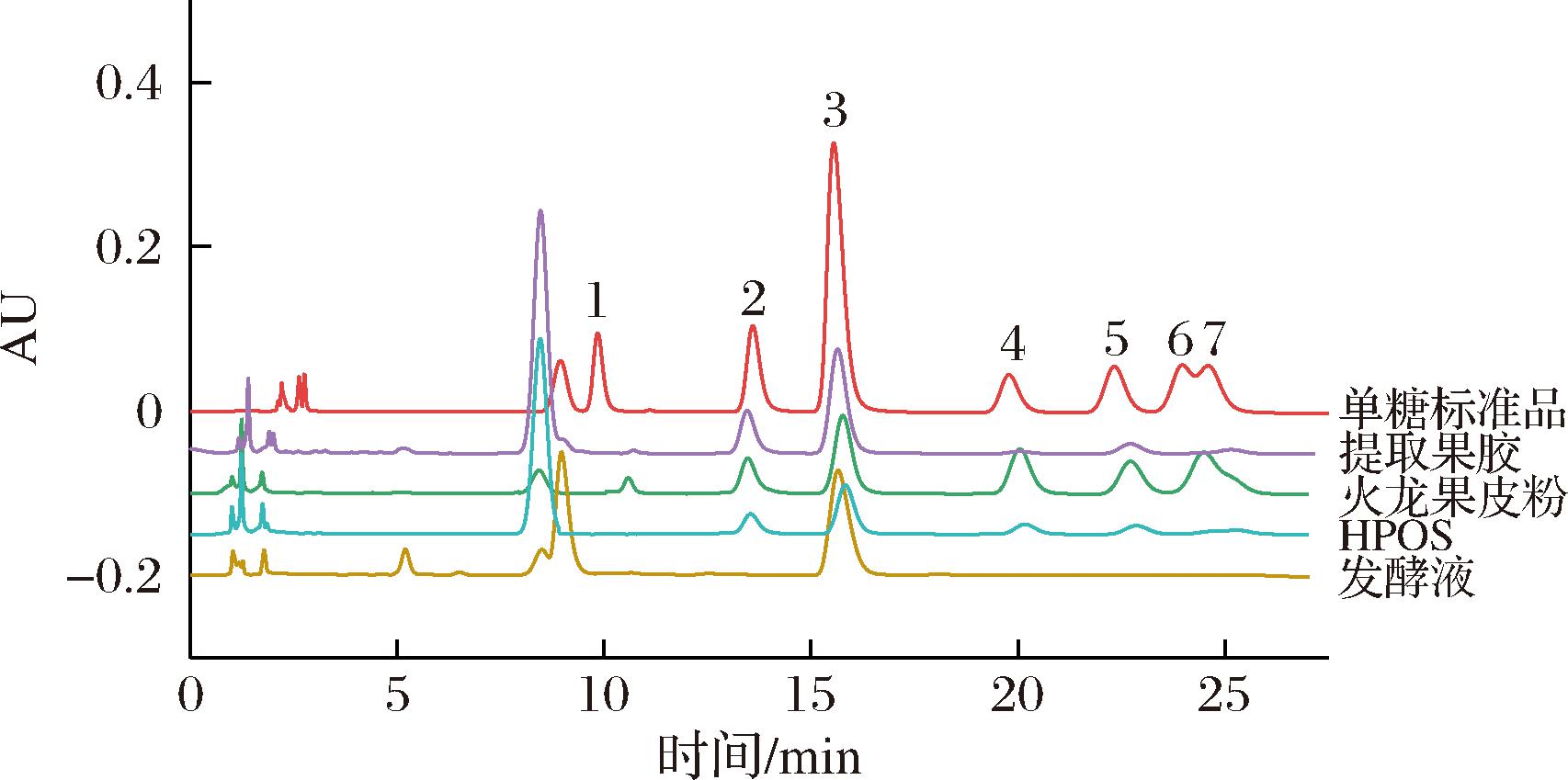
1-甘露糖;2-鼠李糖;3-GalA;4-葡萄糖;5-半乳糖;6-木糖;7-阿拉伯糖。
图7 标准品及各衍生化样品色谱图
Fig.7 Chromatogram of monosaccharide standards and derivatization samples
2.5 POS的体外抗氧化活性
研究表明,果胶具有一定的抗氧化能力,但由于其分子质量大、空间阻碍高且多糖结构复杂,抗氧化能力较低[33],但经降解产生的POS由于分子质量和聚合度下降,羟基、氢键被暴露出来,抗氧化能力显著提升。因此,本研究采用DPPH、ABTS阳离子、羟自由基清除活性以及总抗氧化能力评估不同醇沉组分的体外抗氧化活性,以维生素C作为阳性对照。结果如图8所示,与火龙果皮提取果胶相比,HPOS、HC80、HC90的DPPH、ABTS阳离子、羟自由基清除活性及总抗氧化能力均显著提升(组内P<0.05),抗氧化活性与质量浓度(2.5~15 mg/mL)成正比。不同分子质量的低聚糖组分显示出不一样的抗氧化性能,HC90在各项抗氧化性能上明显高于HC80,随着分子量的减少,POS的IC50值越小(表3,P<0.05),抗氧化能力越强。与QI等[22]对金银花POS的研究一致,随着分子质量的不断减少,高聚合度的果胶酸链被打断,产生了更多的羟基和羧基,更容易地释放氢原子与羟自由基结合。
表3 不同组分的DPPH、ABTS、羟自由基的IC50值
Table 3 The IC50 values of DPPH, ABTS and hydroxyl radicals for different components
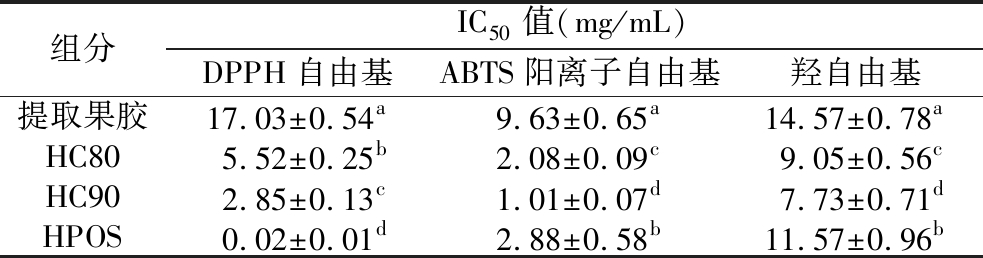
组分IC50值(mg/mL)DPPH自由基ABTS阳离子自由基羟自由基提取果胶17.03±0.54a9.63±0.65a14.57±0.78aHC805.52±0.25b2.08±0.09c9.05±0.56cHC902.85±0.13c1.01±0.07d7.73±0.71dHPOS0.02±0.01d2.88±0.58b11.57±0.96b
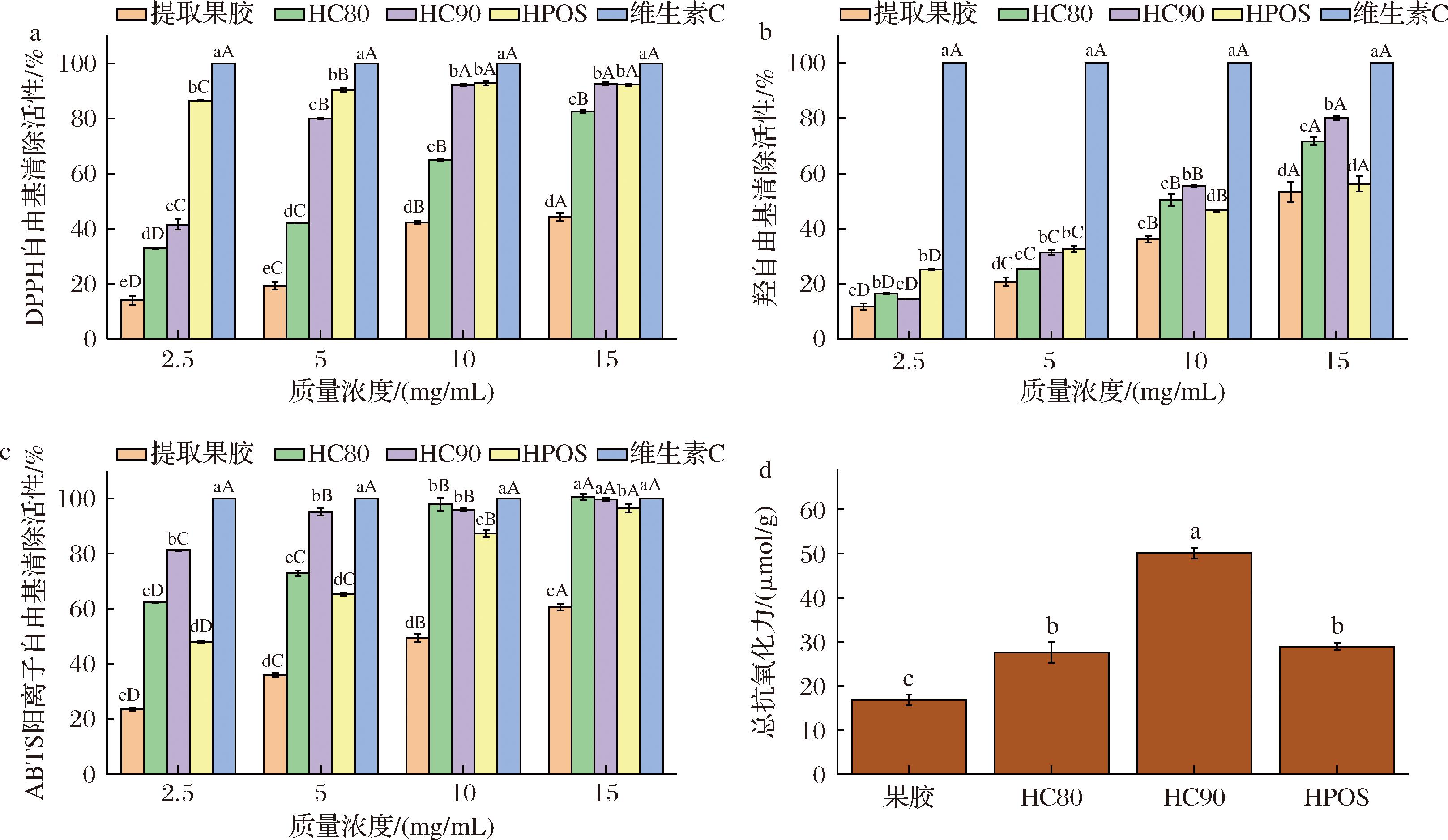
a-DPPH自由基清除率;b-羟自由基清除率;c-ABTS阳离子自由基清除率;d-总抗氧化能力
图8 不同组分的体外抗氧化活性比较
Fig.8 Comparison of antioxidative activity of different components
注:不同大写字母表示组间差异显著(P<0.05)。
3 结论与讨论
本研究挖掘黄曲霉JN-H10的内切多聚半乳糖醛酸酶基因endoPecA,并构建了重组表达工程毕赤酵母X-33 endoPecA,利用工程菌进行菌酶协同发酵火龙果皮制备HPOS,发酵过程中有效释放和降解了果胶并消耗可发酵性糖。分子质量分布和TLC分析表明经醇沉后得到的HPOS组分(HC80和HC90)属于低聚糖,其单糖组成以GalA为主,此外含有少量的鼠李糖、半乳糖、阿拉伯糖、葡萄糖等,发酵产物中HPOS含量为5.09 mg/mL(以GalA含量计),相对于原料HPOS的产率25.45%(以GalA含量计),发酵时间为48 h。体外抗氧化活性结果表明,HPOS的各项抗氧化能力显著高于果胶,且HPOS中较低分子质量的HC90抗氧化能力更高。本研究以富含GalA含量的火龙果皮为直接原料采用一步法发酵联合酶解制备HPOS,预处理简单,水解效率高,仅在培养基中添加少量无机盐,采用自然pH,常温发酵,不额外添加其他碳源、氮源和缓冲液,简化了HPOS的制备流程,促进了一步发酵法利用水果废弃副产物生产POS的研究,为火龙果皮等水果副产物的高附加值产品的生产制备提供了参考和研究价值。
[1] ZEEB B, ROTH M, ENDREß H U. Commercial Pectins[M]. Handbook of Hydrocolloids. Amsterdam: Elsevier, 2021:295-315.
[2] 郑辰, 寇田田, 谷新晰, 等.嗜热多聚半乳糖醛酸酶AfPGA性质表征及其在果胶低聚糖制备中的应用[J].食品科学, 2025, 46(9):130-138.ZHENG C, KOU T T, GU X X, et al.Characterization of thermophilic polygalacturonase AfPGA and its application in the preparation of pectin oligosaccharides[J].Food Science, 2025, 46(9):130-138.
[3] GUO X Y, ZHANG X M, YING X, et al.Fermentation properties and prebiotic potential of different pectins and their corresponding enzymatic hydrolysates[J].Food Hydrocolloids, 2023, 143:108878.
[4] LI T, JI W H, DONG H J, et al.A comprehensive review on the isolation, bioactivities, and structure-activity relationship of hawthorn pectin and its derived oligosaccharides[J].Foods, 2024, 13(17):2750.
[5] GULL N B, G
N B, G MEZ B, MART
MEZ B, MART NEZ-SABAJANES M, et al.Pectic oligosaccharides:Manufacture and functional properties[J].Trends in Food Science &Technology, 2013, 30(2):153-161.
NEZ-SABAJANES M, et al.Pectic oligosaccharides:Manufacture and functional properties[J].Trends in Food Science &Technology, 2013, 30(2):153-161.
[6] PICOT-ALLAIN M C N, RAMASAWMY B, EMMAMBUX M N.Extraction, characterisation, and application of pectin from tropical and sub-tropical fruits:A review[J].Food Reviews International, 2022, 38(3):282-312.
[7] FERREIRA V C, AMPESE L C, SGANZERLA W G, et al.An updated review of recent applications and future perspectives on the sustainable valorization of pitaya (Hylocereus spp.) by-products[J].Sustainable Chemistry and Pharmacy, 2023, 33:101070.
[8] 黄林华, 吴厚玖, 马亚琴, 等.果胶低聚糖的研究进展[J].食品科学, 2015, 36(19):277-281.HUANG L H, WU H J, MA Y Q, et al.Progress in pectic oligosaccharides[J].Food Science, 2015, 36(19):277-281.
[9] SINGH R P, TINGIRIKARI J M R.Agro waste derived pectin poly and oligosaccharides:Synthesis and functional characterization[J].Biocatalysis and Agricultural Biotechnology, 2021, 31:101910.
[10] 焦旭, 张路遥, 韦云路, 等.果胶特性及其低聚糖制备的研究综述[J].食品工业, 2021, 42(7):244-248.JIAO X, ZHANG L Y, WEI Y L, et al.Review in pectin properties and preparation of pectin oligosaccharides[J].The Food Industry, 2021, 42(7):244-248.
[11] MART NEZ SABAJANES M, Y
NEZ SABAJANES M, Y
 EZ R, ALONSO J L, et al.Pectic oligosaccharides production from orange peel waste by enzymatic hydrolysis[J].International Journal of Food Science &Technology, 2012, 47(4):747-754.
EZ R, ALONSO J L, et al.Pectic oligosaccharides production from orange peel waste by enzymatic hydrolysis[J].International Journal of Food Science &Technology, 2012, 47(4):747-754.
[12] HUMEREZ-FLORES J N, KYOMUGASHO C, GUTIÉRREZ-ORTIZ A A, et al.Production and molecular characterization of tailored Citrus pectin-derived compounds[J].Food Chemistry, 2022, 367:130635.
[13] HOLCK J, HJERNØ K, LORENTZEN A, et al.Tailored enzymatic production of oligosaccharides from sugar beet pectin and evidence of differential effects of a single DP chain length difference on human faecal microbiota composition after in vitro fermentation[J].Process Biochemistry, 2011, 46(5):1039-1049.
[14] COSTA K P B, REICHEMBACH L H, DE OLIVEIRA PETKOWICZ C L.Pectins with commercial features and gelling ability from peels of Hylocereus spp[J].Food Hydrocolloids, 2022, 128:107583.
[15] CHANDEL V, BISWAS D, ROY S, et al.Current advancements in pectin:Extraction, properties and multifunctional applications[J].Foods, 2022, 11(17):2683.
[16] 王婷. 柑橘果胶低聚糖的酶法制备及生物活性研究[D].南京:南京林业大学,2023.WANG T.Study on the enzymatic preparation and biological activity of citrus pectin oligosaccharides[D].Nanjing:Nanjing Forestry University, 2023.
[17] YANG G J, TAN H D, LI S G, et al.Application of engineered yeast strain fermentation for oligogalacturonides production from pectin-rich waste biomass[J].Bioresource Technology, 2020, 300:122645.
[18] 乔梦如, 王云, 贾哲, 等.基于柱前衍生-HPLC法研究焦栀子炮制过程单糖组成及含量变化[J].中草药, 2023, 54(7):2096-2105.QIAO M R, WANG Y, JIA Z, et al.Composition and content change of monosaccharide in Gardeniae Fructus Praeparatus during heat processing based on pre-column derivatization HPLC method[J].Chinese Traditional and Herbal Drugs, 2023, 54(7):2096-2105.
[19] 蔡国林. 解淀粉芽孢杆菌胞外多糖的结构及其益生作用机制[D]. 无锡:江南大学, 2020.CAI G L. Structure and probiotic mechanism of extracellular polysaccharides from Bacillus amyloliquefaciens[D]. Wuxi: Jiangnan University, 2020.
[20] 郝梦洁. 青霉内切多聚半乳糖醛酸酶的表征及热稳定性改造[D].无锡:江南大学,2023.HAO M J. Expression, characterization and thermostability modification of endo-polygalacturonase from Penicillium[D]. Wuxi: Jiangnan University, 2023.
[21] CHEN R Z, LUO S J, WANG C X, et al. Effects of ultra-high pressure enzyme extraction on characteristics and functional properties of red pitaya (Hylocereus polyrhizus) peel pectic polysaccharides[J]. Food Hydrocolloids, 2021, 121: 107016.
[22] QI X D, YU Y, WANG X Y, et al.Structural characterization and anti-oxidation activity evaluation of pectin from Lonicera japonica Thunb[J].Frontiers in Nutrition, 2022, 9:998462.
[23] BENEN J A, KESTER H C, VISSER J.Kinetic characterization of Aspergillus niger N400 endopolygalacturonases Ⅰ, Ⅱ and C[J].European Journal of Biochemistry, 1999, 259(3):577-585.
[24] PAG S S, HEIJNE W H M, KESTER H C M, et al.Subsite mapping of Aspergillus niger Endopolygalacturonase Ⅱ by site-directed mutagenesis[J].Journal of Biological Chemistry, 2000, 275(38):29348-29353.
S S, HEIJNE W H M, KESTER H C M, et al.Subsite mapping of Aspergillus niger Endopolygalacturonase Ⅱ by site-directed mutagenesis[J].Journal of Biological Chemistry, 2000, 275(38):29348-29353.
[25] SATHYA T A, JACOB A M, KHAN M.Cloning and molecular modelling of pectin degrading glycosyl hydrolase of family 28 from soil metagenomic library[J].Molecular Biology Reports, 2014, 41(4):2645-2656.
[26] 杨成玮, 朱婧, 韦云伊, 等.拟康宁木霉聚半乳糖醛酸酶的酶学特征及潜在应用[J].食品科学, 2023, 44(10):215-223.YANG C W, ZHU J, WEI Y Y, et al.Enzymatic characterization and potential application of polygalacturonase from Trichoderma koningiopsis[J].Food Science, 2023, 44(10):215-223.
[27] 王恒震, 李化强, 吴菲菲, 等.棘孢木霉(Trichoderma asperellum)产聚半乳糖醛酸酶的特性[J].食品与发酵工业, 2020, 46(16):99-104.WANG H Z, LI H Q, WU F F, et al.Characterization of pectin degrading polygalacturonase produced by Trichoderma asperellum[J].Food and Fermentation Industries, 2020, 46(16):99-104.
[28] ABURTO C, GUERRERO C, VERA C, et al.Co-immobilized β-galactosidase and Saccharomyces cerevisiae cells for the simultaneous synthesis and purification of galacto-oligosaccharides[J].Enzyme and Microbial Technology, 2018, 118:102-108.
[29] NAVEED M, PHIL L, SOHAIL M, et al.Chitosan oligosaccharide (COS):An overview[J].International Journal of Biological Macromolecules, 2019, 129:827-843.
[30] LE N L.Functional compounds in dragon fruit peels and their potential health benefits:A review[J].International Journal of Food Science &Technology, 2022, 57(5):2571-2580.
[31] BAKAR J, SHUC E, MUHAMMAD S K S, et al.Physico-chemical characteristics of red pitaya (Hylocereus polyrhizus) peel [J].international food research journal, 2011, 18(1):279.
[32] LI S Y, WANG Z P, WANG L N, et al.Combined enzymatic hydrolysis and selective fermentation for green production of alginate oligosaccharides from Laminaria japonica[J].Bioresource Technology, 2019, 281:84-89.
[33] 卢泳强, 周朝曦, 张丽丽, 等.苹果果胶的理化特性、抗氧化及降血脂作用研究[J].食品与发酵工业, 2024, 50(7):61-68.LU Y Q, ZHOU Z X, ZHANG L L, et al.Physicochemical properties, antioxidant, and hypolipidemic effects of pectin from Malus pumila[J].Food and Fermentation Industries, 2024, 50(7):61-68.