玉竹[Polygonatum ordoratum (Mill.) Druce],百合科黄精属植物,在我国的主要种植区是湖南、安徽和广东等省份,是一种极富营养价值的食药同源食品。在传统中药学中,玉竹味甘、性寒,归肺、胃经,可“滋阴润燥,生津止渴”。而现代药理学发现,玉竹具有降血糖、抗肿瘤和调节糖脂代谢等功效。同时,玉竹低淀粉高膳食纤维的特点符合人们对健康饮食的需求,有利于减肥瘦身,将其与饮食合理调配可预防疾病,在食品开发领域有巨大潜力[1]。
膳食纤维作为第七大营养素,根据溶解性可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF),而玉竹中SDF含量高于IDF[1]。研究表明,SDF相较于IDF具有更好的口感质地、降血糖和抗氧化的能力,易应用于食品加工中。SDF是指能溶于水,但不能在人体小肠内消化吸收,而在大肠中发酵的物质,包括低聚糖、部分半纤维素和多聚糖等[2]。高含量SDF具有降低血糖[3]、抗氧化[4]、改善便秘[5]等生物活性,能促进益生菌增殖,起到优化肠道菌群结构的作用,有利于代谢平衡与疾病防治[6]。近年来,国内外研究大都集中在对玉竹多糖、多酚、糖蛋白等功能活性成分的研究,尚未有酶法制备玉竹可溶性膳食纤维(Polygonatum ordoratum soluble dietary fiber,POSDF)及其生物活性相关的报道。通常SDF的生物活性与其化学组成、官能团种类和糖苷键构型等有关[7-8],因此,本文对玉竹SDF的组成和结构特性进行深入分析,为玉竹膳食纤维保健食品的应用提供理论依据。
本研究采用酶法提取POSDF并对其进行分离纯化,获得高纯度POSDF后,采用多种手段对其结构特征进行综合分析,并测定其体外降血糖、抗氧化活性,探究其结构与生物活性间的关联,以期为POSDF在饮食调理、保健食品开发等食药同源领域的应用提供科学依据,深度挖掘玉竹加工产物的价值。
1 材料与方法
1.1 材料与试剂
玉竹原料,同芙湖南省怀化县种植基地提供;热稳定α-淀粉酶(40 000 U/g),上海源叶生物科技有限公司;木瓜蛋白酶(100 000 U/g)、淀粉葡萄糖苷酶(100 000 U/g),上海Macklin生物科技有限公司;其他实验试剂均为国产分析纯。
1.2 仪器与设备
ICS 5000+离子色谱分析仪,美国Thermo公司;F16502扫描电镜,荷兰PHENOM公司;高效液相色谱仪,美国Waters公司;Nicolet iS 50傅里叶红外光谱仪,美国赛默飞世尔公司;UV-3200紫外分光光度计,上海美普达仪器公司;AVANCEⅢHD500核磁仪器,德国BRUKER公司。
1.3 实验方法
1.3.1 POSDF的制备及分离纯化
1.3.1.1 POSDF的制备
参考并修改沈康等[7]方法,采用复合酶法,按料液比1∶20(g∶mL)提取玉竹粗可溶性膳食纤维,命名为POS。
1.3.1.2 除蛋白
参照沈康等[7]的方法,采用Sevag法除蛋白。
1.3.1.3 脱色
参照霍达等[9]的方法,采用AB-8大孔树脂吸附脱色。
1.3.1.4 DEAE-52柱层析纯化
参照并修改沈康等[7]的方法,通过DEAE-52柱梯度洗脱,用苯酚-硫酸法检测多糖含量,绘制洗脱曲线,并分别收集不同组分后计算膳食纤维得率。
1.3.1.5 凝胶柱层析分离
使用Sephadex G-50凝胶柱分离经DEAE-52柱层析分离得到的组分,按1.2.1.4节的方法得到洗脱曲线。收集主要组分透析后冻干,得到纯化样品,命名为POSDF。
1.3.2 POSDF的化学组成分析
水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;灰分含量测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;脂肪含量测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;淀粉含量测定参照GB 5009.9—2023《食品安全国家标准 食品中淀粉的测定》;膳食纤维含量测定参照GB 5009.88—2023《食品安全国家标准 食品中膳食纤维的测定》;总糖含量采用苯酚-硫酸法测定;糖醛酸含量采用间羟基联苯法测定[9]。
1.3.3 POSDF的结构表征
1.3.3.1 分子质量测定
采用凝胶渗透色谱法进行分析[10]。
1.3.3.2 单糖组成测定
利用离子色谱仪对样品单糖组成进行分析[11]。
1.3.3.3 紫外与红外光谱分析
通过紫外-分光光度计在200~400 nm进行波谱扫描。
将样品与KBr粉末混合研磨,压成片剂,通过傅里叶红外光谱仪在4 000~500 cm-1进行扫描。
1.3.3.4 核磁结构分析
使用核磁共振光谱仪进行氢谱、碳谱信号采集。信号使用MestReNova-11.04软件处理。
1.3.3.5 三螺旋结构分析
采用刚果红法确定样品是否含有三螺旋结构[9]。
1.3.3.6 扫描电镜
参照全文斌等[2]的方法,使用扫描电镜对样品进行微观形态分析。
1.3.3.7 X-射线衍射分析
参照金书涵等[12]的方法,设置扫描速度、角度、电压和电流,收集数据并作图。
1.3.4 体外生物活性研究
1.3.4.1 体外降血糖活性研究
参考并改进马二兰等[13]的方法,以阿卡波糖为阳性对照,测定α-葡萄糖苷酶抑制率。
1.3.4.2 体外抗氧化活性研究
参照霍达等[9]的方法,以维生素C为对照,测定ABTS阳离子自由基、羟自由基和DPPH自由基清除率。
1.4 数据处理
数据采用SPSS 26.0软件进行统计学分析,图形采用Origin Pro 2021软件进行绘制。
2 结果与分析
2.1 膳食纤维的洗脱曲线
玉竹粗SDF经过除蛋白、脱色后,利用DEAE-52纤维素层析柱进行洗脱分离,洗脱曲线如图1-a所示,出现4个主要洗脱峰,且无明显拖尾。收集多糖含量较高的洗脱峰得到2个组分,分别为POS-1和POS-2,得率分别为34.05%和18.42%。对多糖含量及得率高的POS-1通过Sephadex G-50凝胶柱进一步分离纯化,结果如图1-b所示,出现单峰,表明分离效果较好,收集主要单管组分透析后冻干,将其命名为POSDF。
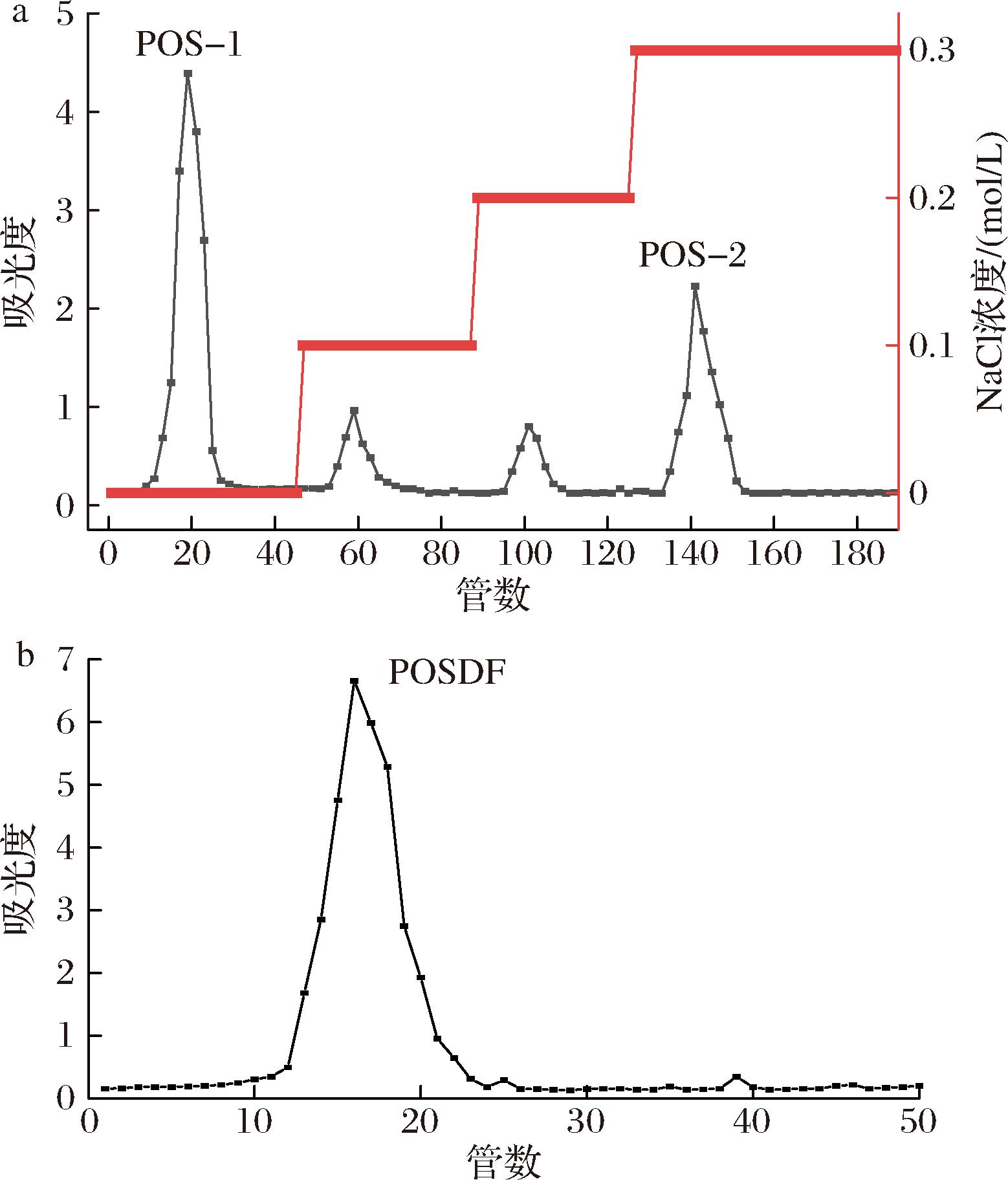
a-DEAE-52纤维柱洗脱曲线;b-Sephadex G-50 凝胶柱洗脱曲线
图1 POSDF洗脱曲线
Fig.1 Elution curves of POSDF
2.2 基本成分测定及紫外光谱分析
如表1所示,POSDF纯化前后的基础理化性质中,除水分含量无明显区别(P>0.05),其他成分均具有显著性差异(P<0.05)。具体表现为,纯化后POSDF的多糖含量由51.42%提升为83.23%,纯度显著提高,而纯化后的蛋白质、糖醛酸含量显著下降(P<0.05)。结合POSDF的紫外光谱图(图2)可知,在200~400 nm范围内的曲线较为平滑,说明纯化后的POSDF较为纯净,仅存在少量蛋白质和核酸,与蛋白质含量测定结果一致。综上说明,POSDF纯化效果较好,可用于后续结构表征与生物活性研究。
表1 POSDF纯化前后的基本成分 单位:%
Table 1 Basic components of POSDF before and after modification

注:“—”示未检测出;同列不同字母表示差异性显著(P<0.05)(下同)。
样品水分脂肪灰分蛋白质糖醛酸多糖纯化前5.42±0.55a—2.73±0.87a3.12±0.35a5.56±0.34a51.42±0.25b纯化后4.83±0.46a—0.82±0.13b0.82±0.13b2.09±0.12b83.23±0.49a
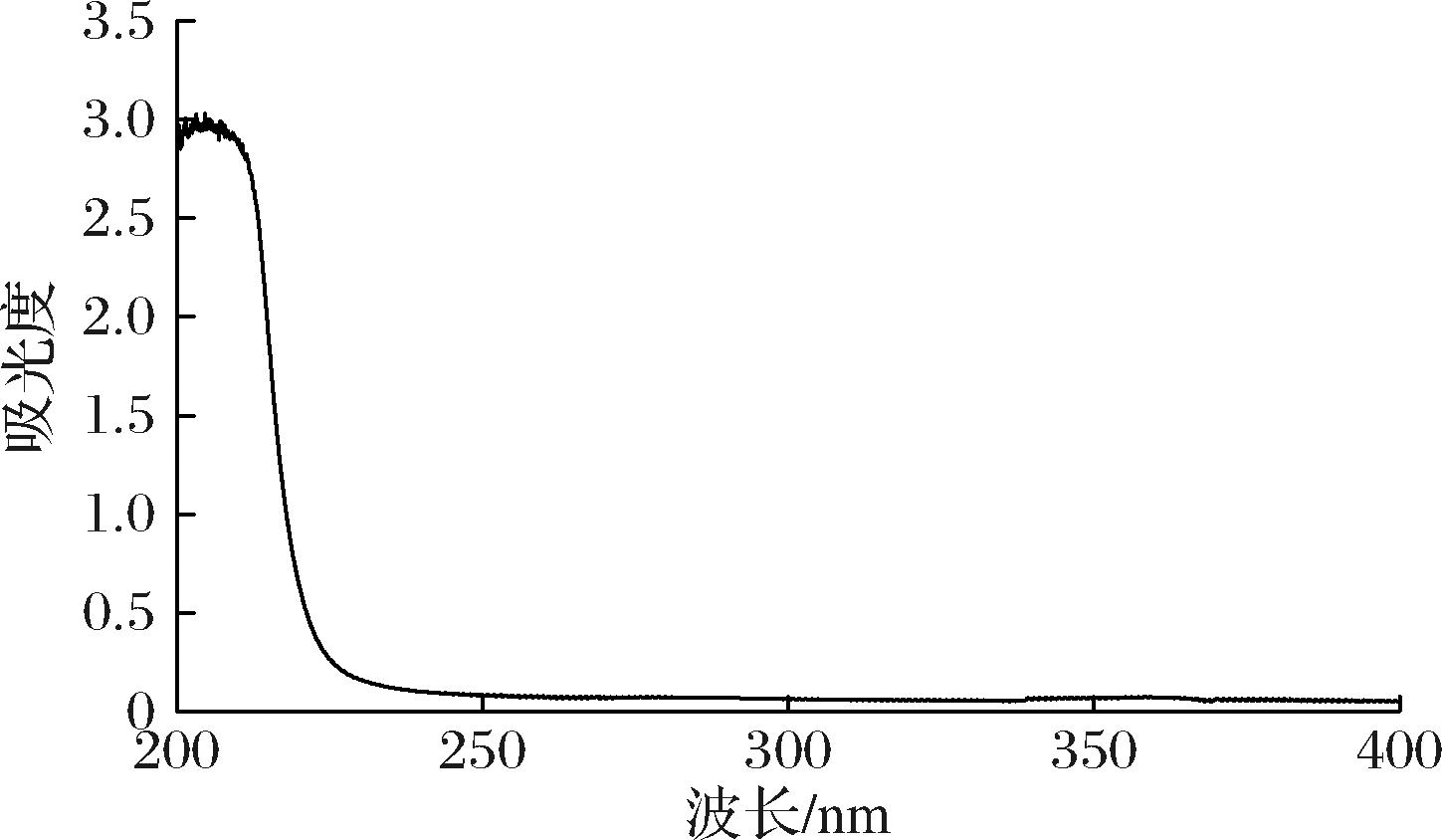
图2 POSDF的紫外光谱图
Fig.2 Ultraviolet spectra of POSDF
2.3 分子质量分析
如图3所示,分子质量谱图显示出一个单一且对称的峰,表明POSDF为分子质量均一的多糖类物质。通过计算可知,POSDF的分子质量为3 381 Da,重均分子质量为4 024 Da,多分散性为1.19。
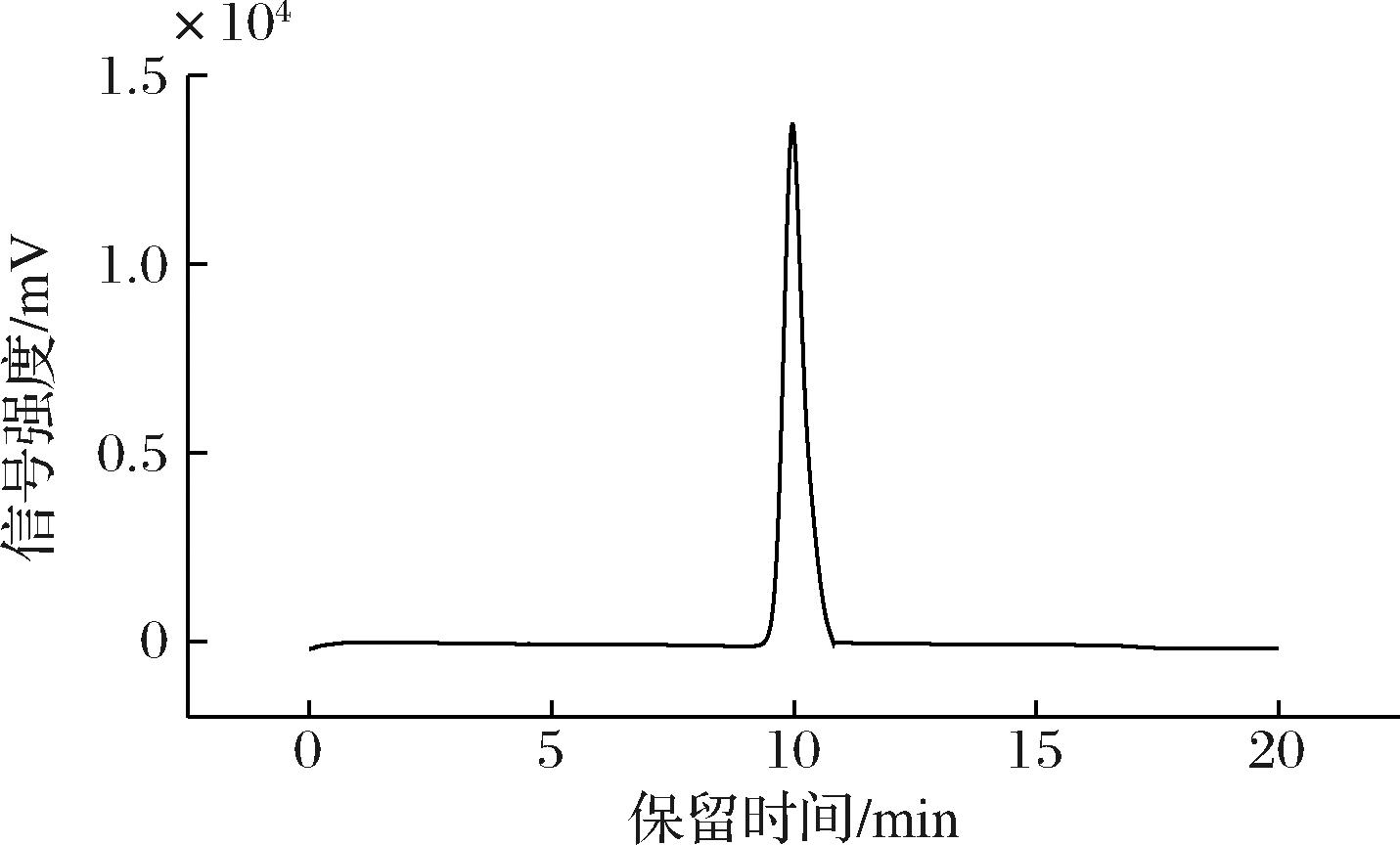
图3 POSDF的分子质量谱图
Fig.3 Molecular weight profile of POSDF
2.4 单糖组成分析
如图4所示,通过各峰的保留时间,并对照混合单糖标品图,经计算后可知,POSDF主要由鼠李糖(4.66%)、阿拉伯糖(19.20%)、葡萄糖(30.17%)和半乳糖(45.97%)组成,摩尔质量比为1∶4.5∶5.9∶9.0。研究表明[2],半纤维素的主要组成包括木糖、阿拉伯糖、葡萄糖、半乳糖,POSDF组成与之相似,说明其含有一定的半纤维素成分,但未检测出木糖,推测是由于木糖较难溶出导致[14]。而半纤维素不仅可以延缓食物的吸收和胃的排空,减缓血糖上升速度,还可作为益生元来源,调节肠道菌群促进肠胃消化[15]。因此,可以推测POSDF具有一定的降血糖生物活性。
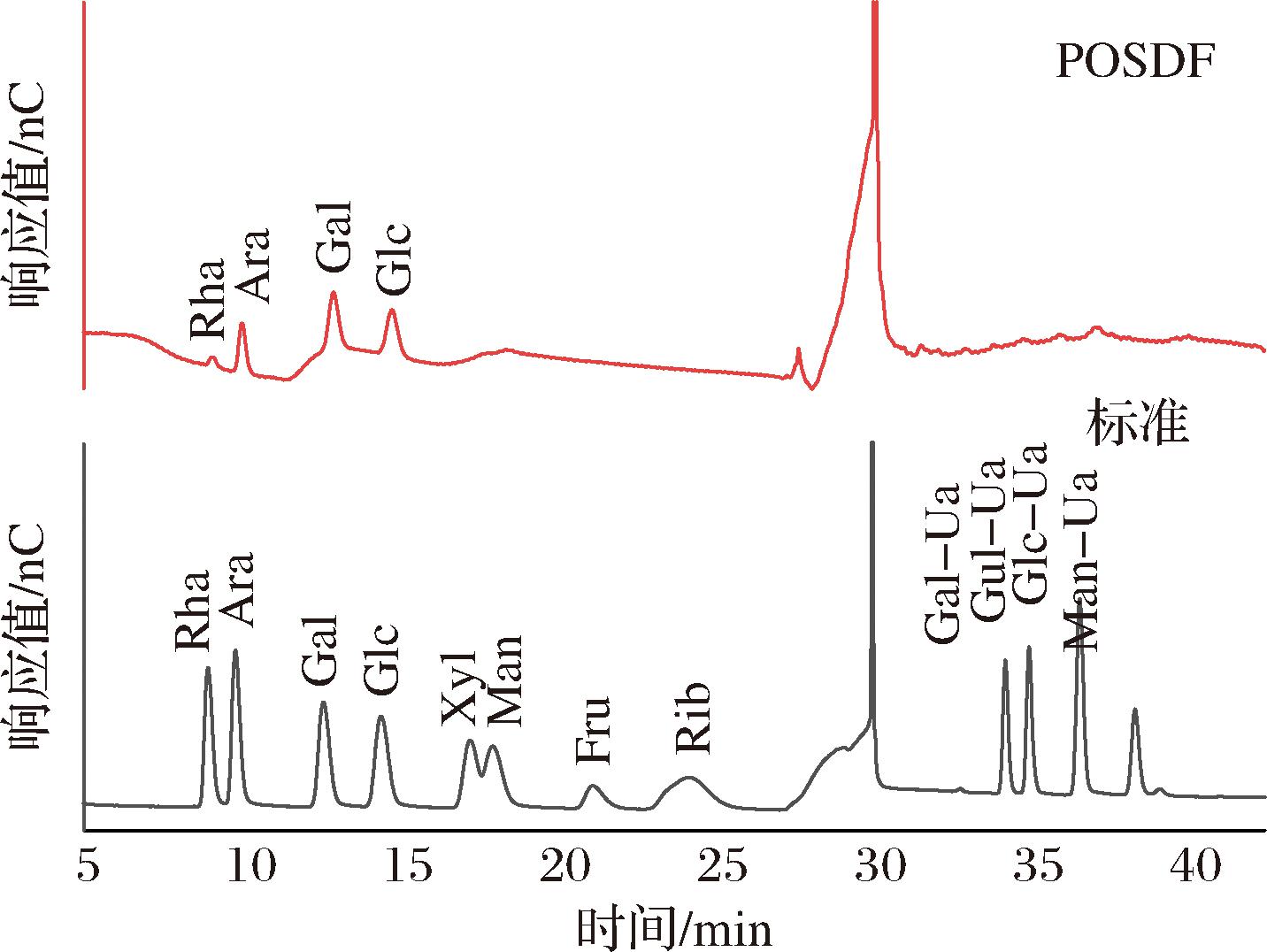
图4 POSDF的离子色谱图
Fig.4 Ion chromatogram of POSDF monosaccharide composition
注:Rha:鼠李糖;Ara:阿拉伯糖;Gal:半乳糖;Glc:葡萄糖;Xyl:木糖;Man:甘露糖;Fru:果糖;Rib:核糖;Gal-Ua:半乳糖醛酸;Gul-Ua:古罗 糖醛酸;Glc-Ua:葡萄糖醛酸;Man-Ua:甘露糖醛酸。
2.5 红外光谱及核磁共振分析
本研究采用红外光谱及核磁共振分析共同对POSDF的官能团及分子结构进行表征。如图5所示,波数在3 411 cm-1的强吸收峰是纤维素O—H伸缩振动的典型表现[16],而2 935 cm-1处的吸收峰反映出多糖特有的甲基伸缩振动。此外,1 635.5 cm-1的吸收峰可能为C![]() O的伸缩振动,1 423.45 cm-1的尖峰可能为C—H弯曲振动引起。在1 124 cm-1处的峰可能源于葡萄糖苷键的C—O—C拉伸振动或侧链C—O—H的弯曲振动,1 072 cm-1处的振动峰则表明存在吡喃糖环。而在930.94 cm-1和814.52 cm-1处的吸收峰分别对应了α和β型糖苷键的伸缩振动。红外光谱结果表明,POSDF是一种既含有α型糖苷键,又含有β型糖苷键的吡喃糖环结构的多糖类物质。
O的伸缩振动,1 423.45 cm-1的尖峰可能为C—H弯曲振动引起。在1 124 cm-1处的峰可能源于葡萄糖苷键的C—O—C拉伸振动或侧链C—O—H的弯曲振动,1 072 cm-1处的振动峰则表明存在吡喃糖环。而在930.94 cm-1和814.52 cm-1处的吸收峰分别对应了α和β型糖苷键的伸缩振动。红外光谱结果表明,POSDF是一种既含有α型糖苷键,又含有β型糖苷键的吡喃糖环结构的多糖类物质。
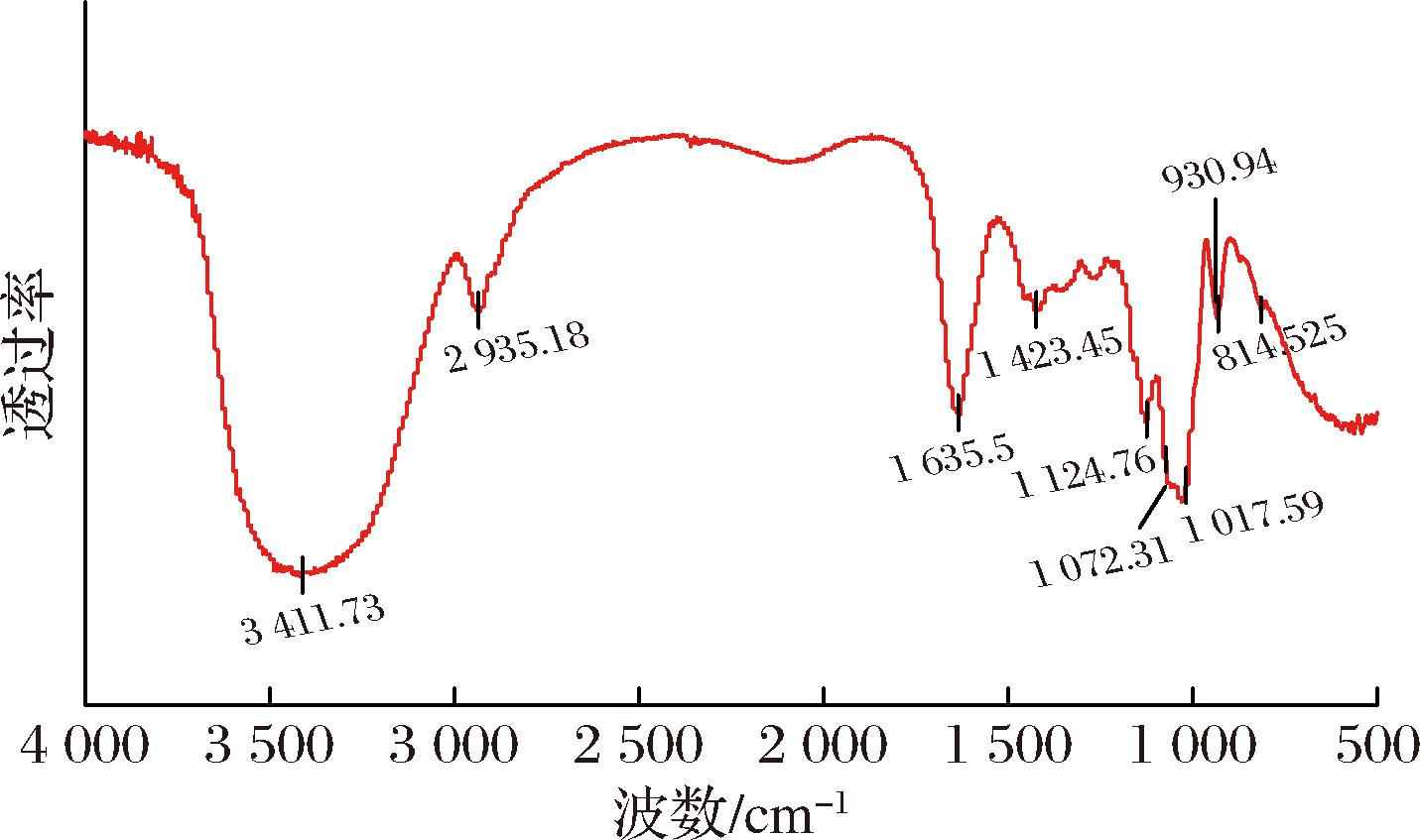
图5 POSDF的红外光谱图
Fig.5 Infrared spectra of POSDF
通过核磁共振谱图的表征,进一步确定主体组成及糖苷键构型。图6-a中,除4.79 ppm为溶剂水峰信号外,信号主要集中在3.0~5.5 ppm,为多糖核磁氢谱的典型特征,且同时含有α和β型糖苷键。位于4.8~5.5 ppm出峰,判断有主要的1种α构型残基,推测可能为阿拉伯糖或者葡萄糖的异头H1;在4.2~4.8 ppm的出峰为少量比例的β构型残基,结合单糖组成,推断为半乳糖β残基;而高场1.35 ppm区域的几组弱峰,代表了结构中较少的鼠李糖残基的H6信号。图6-b中信号较弱,但可以推测,在108.56 ppm 和106.67 ppm附近的信号归属为POSDF中阿拉伯糖残基的异头C1,101.35 ppm附近的为半乳糖残基的异头C1,97.91 ppm附近的为葡萄糖残基的异头C1。其中,位于84 ppm附近出峰判断为阿拉伯残糖或半乳糖的3位置糖苷键碳所对应;而位于相对高场的63 ppm和65 ppm附近出峰则归属于未形成糖苷键的阿拉伯糖C5或者半乳糖和葡萄糖的C6。
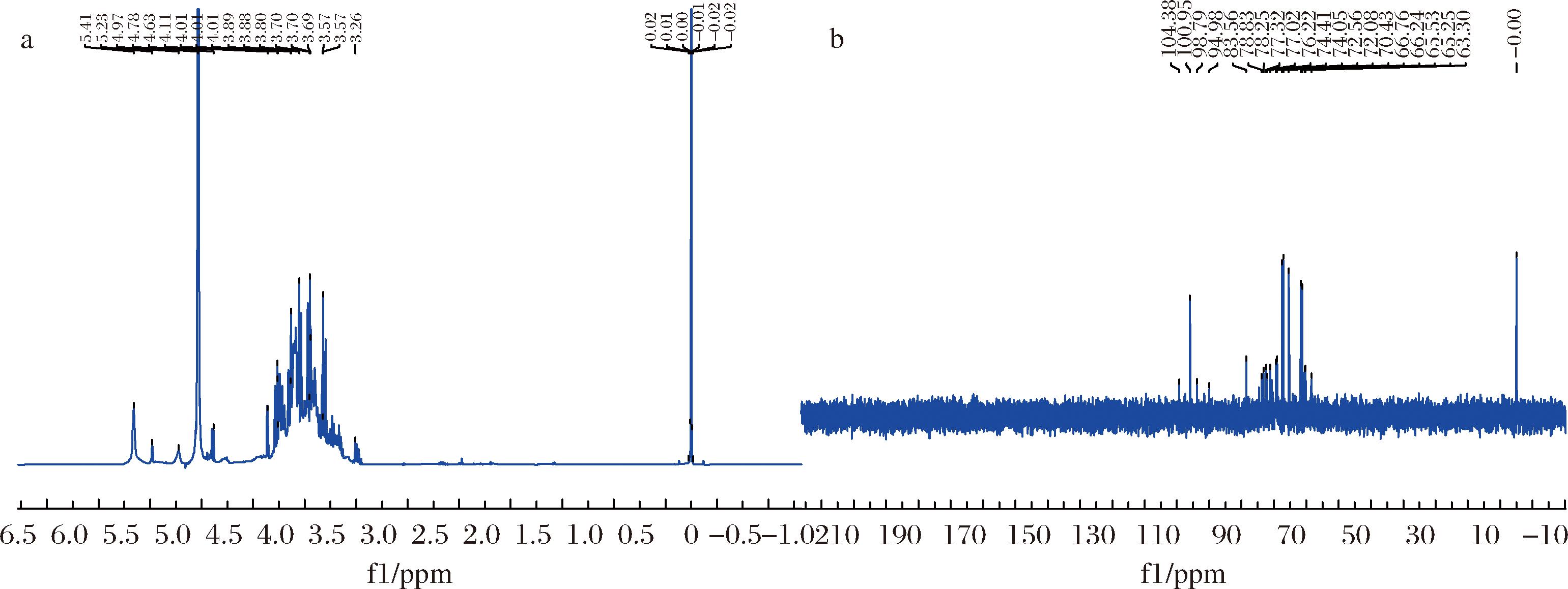
a-核磁共振氢谱;b-核磁共振碳18谱图
图6 POSDF的核磁共振谱图
Fig.6 Nuclear magnetic resonance spectrum of POSDF
POSDF的红外光谱信息提示出峰符合多糖的各个官能团信息,由氢谱和碳谱的分析,证实核磁一维谱图与单糖组成基本对应。POSDF还需通过甲基化和核磁二维测试,获得具体糖苷键类型和连接方式后,进行综合分析,才可推测出更全面的结构信息。
2.6 刚果红实验分析
刚果红溶液能与具有三螺旋结构的多糖反应生成络合物,其最大吸收峰向长波方向移动,即为红移[17]。如图7所示,在0.1 mol/L NaOH溶液下,POSDF与刚果红溶的紫外吸收移向长波,表明二者形成络合物,当NaOH浓度继续增大时,最大吸收波长下降,红移削弱,表明络合物的螺旋结构解体。结果表明,POSDF具有三螺旋结构。
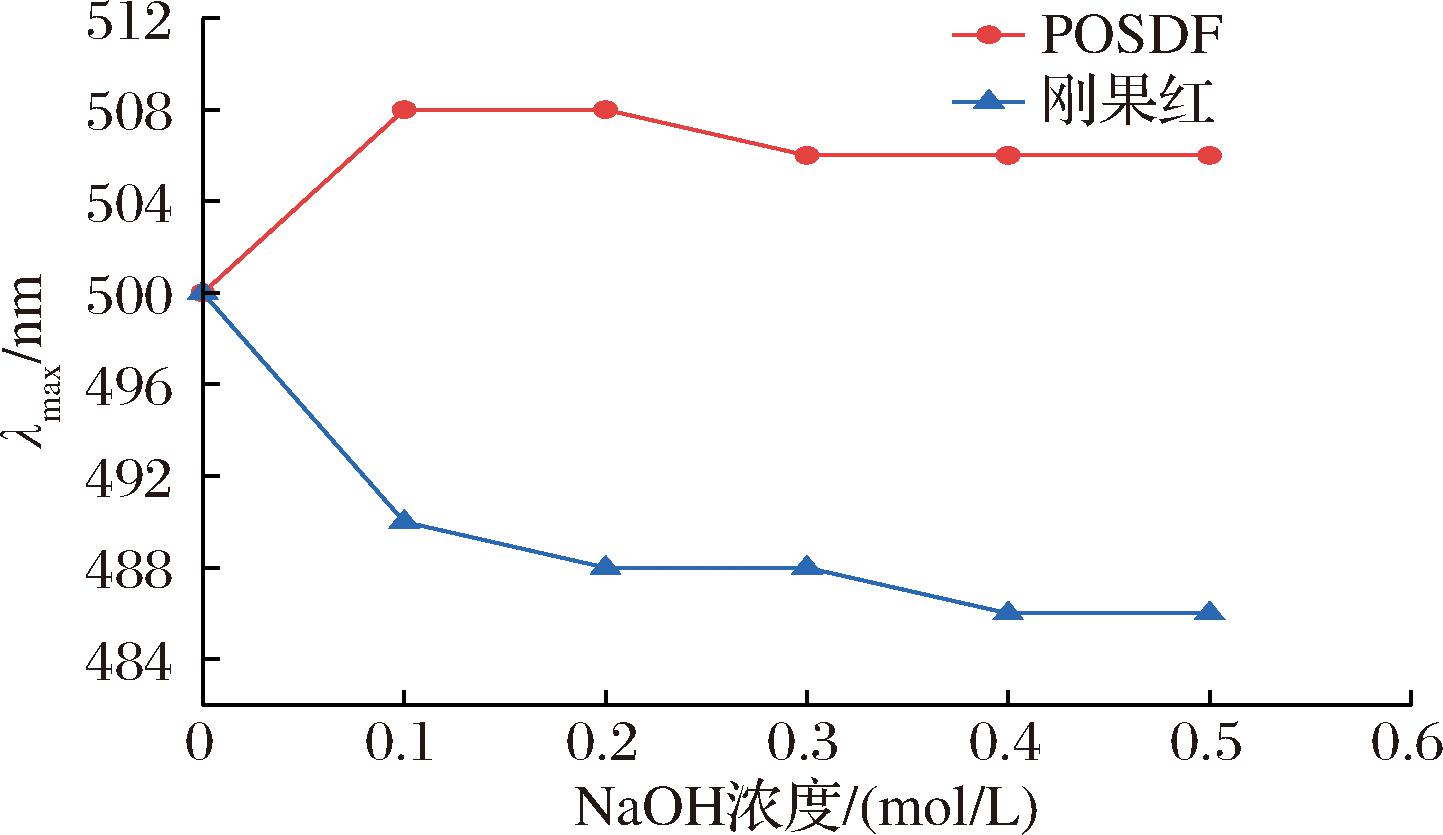
图7 刚果红与POSDF复合物在不同浓度NaOH溶液下的最大吸收波长
Fig.7 The maximum absorption wavelength of Congo red and POSDF complex at various concentrations of NaOH solution
2.7 扫描电镜分析
如图8所示,POSDF呈现出蓬松多孔的纤维球状结构和复杂的空间网状结构,整体结构松散,孔隙大小不一。并且其球状结构上布满小孔,整体比表面积较大,进而暴露的活性基团较多,有利于对水分子、葡萄糖和胆固醇的吸附,具有较强的生物活性。

图8 POSDF的扫描电镜图
Fig.8 Scanning electronic micrographs of POSDF
2.8 X-射线衍射分析
在19°~22°范围内的衍射峰是纤维素的特征结晶区[18]。如图9所示,POSDF在2θ约为20°处有一个明显的衍射峰,显示出典型的纤维素Ⅰ晶体构型,通过Jade 6.0软件处理得出其结晶度为34.85。研究表明,膳食纤维结晶度的高低直接影响其微观结构的致密程度,结晶度低则膳食纤维结构松散[19]。POSDF的结晶度不高则其结构相对松散,这与上文扫描电镜的结果互相印证。
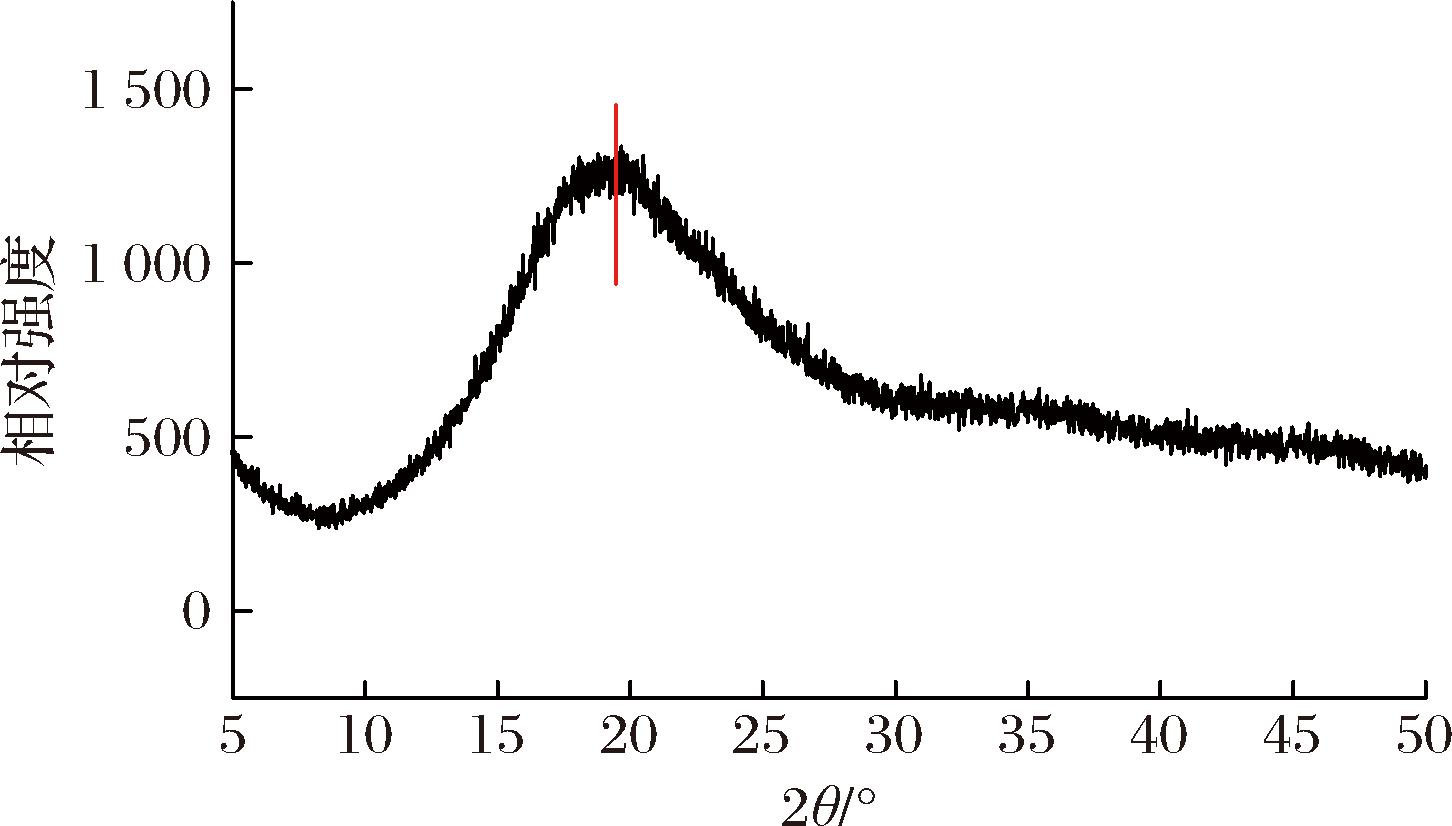
图9 POSDF的X射线衍射图
Fig.9 X-Ray diffraction patterns of wheat bran POSDF
2.9 体外活性研究
2.9.1 降血糖活性分析
研究表明,抑制α-葡萄糖苷酶活性可减缓小肠对碳水化合物的吸收,进而达到降低血糖的效果[19]。如图10所示,最高抑制率达到(93.23±0.57)%,虽然仍低于阳性对照,但也展现出了高效的降血糖能力。WOJDY O等[20]发现,苹果膳食纤维具有较高的α-葡萄糖苷酶抑制率,与其单糖组成相关。JI等[21]综述说明,具有降血糖活性的多糖大都含有较高含量的半乳糖、半乳糖醛酸残基和阿拉伯糖等。此外,低分子质量的多糖会有更多的游离氨基和羟基,更利于降血糖活性的发挥。因此,POSDF具有高效的降血糖活性可能与其分子质量较低且含有半乳糖、半乳糖醛酸及阿拉伯糖有关。同时,由于POSDF结构松散、蓬松多孔,更有利于对葡萄糖和胆固醇的吸附,结合玉竹本身甘甜微润的特点,可以将其应用于泡水、煲汤等饮食搭配,达到降低血糖、调节血脂、预防疾病的功效。
O等[20]发现,苹果膳食纤维具有较高的α-葡萄糖苷酶抑制率,与其单糖组成相关。JI等[21]综述说明,具有降血糖活性的多糖大都含有较高含量的半乳糖、半乳糖醛酸残基和阿拉伯糖等。此外,低分子质量的多糖会有更多的游离氨基和羟基,更利于降血糖活性的发挥。因此,POSDF具有高效的降血糖活性可能与其分子质量较低且含有半乳糖、半乳糖醛酸及阿拉伯糖有关。同时,由于POSDF结构松散、蓬松多孔,更有利于对葡萄糖和胆固醇的吸附,结合玉竹本身甘甜微润的特点,可以将其应用于泡水、煲汤等饮食搭配,达到降低血糖、调节血脂、预防疾病的功效。
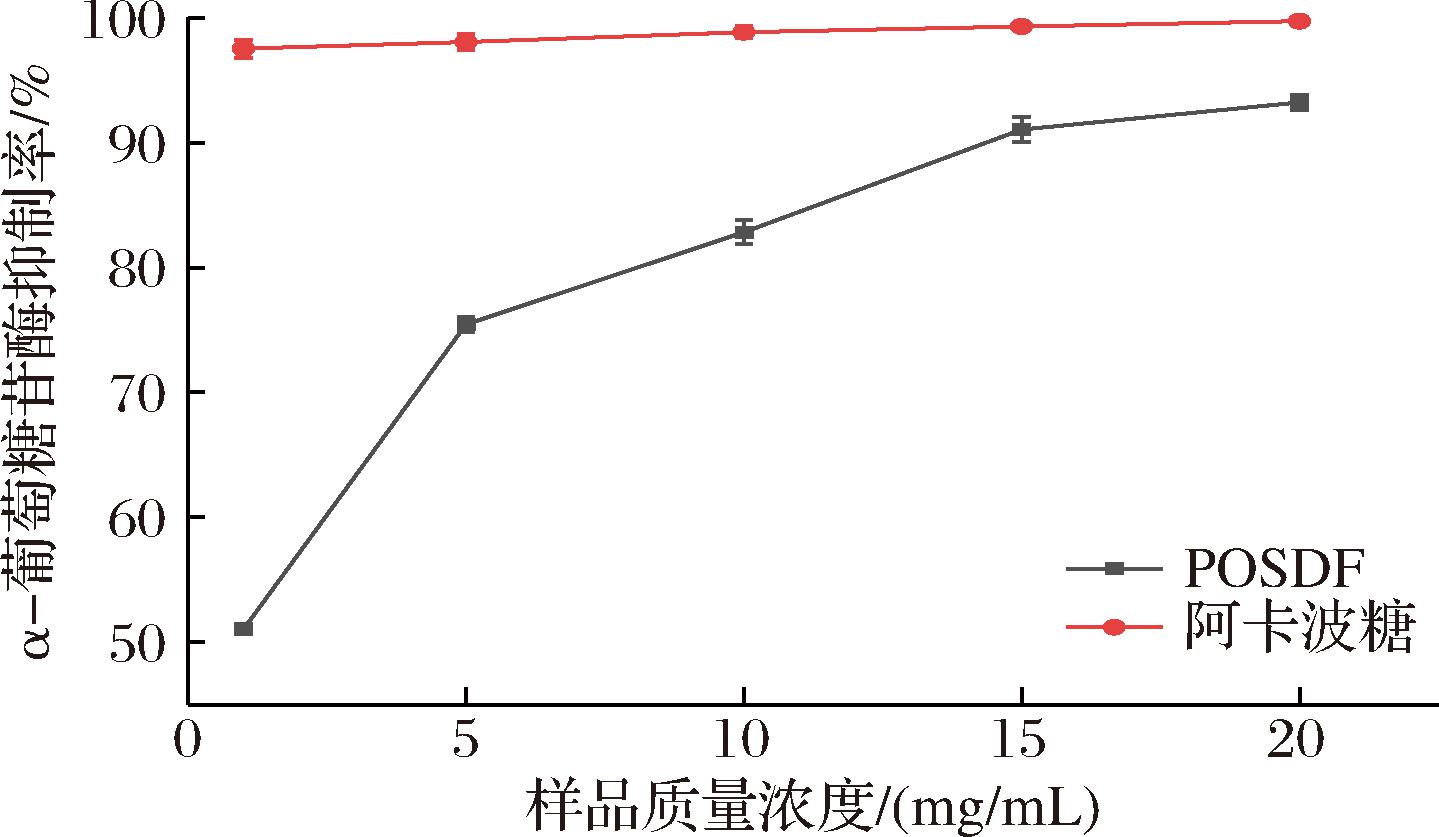
图10 POSDF对α-葡萄糖苷酶的抑制率
Fig.10 α-Amylase inhibition rate of POSDF
2.9.2 抗氧化活性分析
研究表明,膳食纤维中的多酚、多糖类物质具有清除自由基的能力[7]。由图11可知,ABTS阳离子自由基最高清除率为(72.60±1.52)%,达到高效水平。羟自由基清除率次之,达到(51.92±1.17)%,而DPPH自由基清除率较差,最高仅为(28.65±0.77)%,可能是因为DPPH使用乙醇为溶剂,有沉淀生成。LIU等[22]研究表明,SDF具有较多的亲水基团和较小的颗粒尺寸,使它们更容易与自由基接触并发生反应。并且其中某些特定酚类、多糖等成分也能使其具有更强的抗氧化活性[23]。CHEN等[24]综述说明富含半乳糖的多糖物质可能具有更好的抗氧化活性。因此,推测POSDF具有较好的体外抗氧化活性是由于其分子质量低、糖链分支多和含有较高比例的半乳糖[20]。此外,抗氧化活性还可能与α和β型糖苷键的连接方式有关。因此,POSDF的抗氧化能力还需结合更详细的结构特征来解释。

a-ABTS阳离子自由基;b-羟自由基;c-DPPH自由基
图11 POSDF的抗氧化活性
Fig.11 Antioxidant activities of POSDF
3 结论
经酶法提取醇沉、脱色、除蛋白以及DEAE-52层析和Sephadex G-50层析得到均一组分的POSDF,分子质量为3 381 Da,纯度为(83.23±0.49)%。紫外光谱扫描结果显示,纯化后的POSDF较为纯净。单糖组成结果表明,POSDF主要由鼠李糖(4.66%)、半乳糖(45.97%)、葡萄糖(30.17%)和阿拉伯糖(19.20%)组成。并且,结合红外光谱和核磁共振分析,POSDF是一种含有α和β型糖苷键的吡喃糖环结构的多糖类化合物,具有三螺旋结构。扫描电镜结果显示,POSDF具有疏松多孔的纤维球状结构和空间网状结构。X-射线衍射表明POSDF结晶度低,属于纤维素Ⅰ型晶体结构。经过测定,POSDF具有较好的降血糖和抗氧化能力,推测与其分子质量较低、含有较高比例的半乳糖、结构疏松多孔和结晶度较低有关。
此外,玉竹的抗氧化、降血糖的功效被进一步证实,为玉竹在饮食调理和保健食品研发领域提供了科学依据。结合玉竹膳食纤维高效的抗氧化活性和降血糖活性,将其与其他食材一起泡茶、煲汤和烹饪,这样既可丰富口感、补充营养,又能保持食材的鲜艳颜色,同时达到降低血糖、调节血脂、抵抗氧化的功效。本研究揭示了POSDF的降血糖、抗氧化活性与其结构之间的关联,为开发POSDF功能性食品提供参考。
[1] 张凯, 张昭, 范永芳, 等.药食同源药材黄精 玉竹营养及生物活性成分分析[J].中国现代中药, 2022, 24(8):1463-1472.ZHANG K, ZHANG Z, FAN Y F, et al.Nutritional and bioactive components of polygonati rhizoma and polygonati odorati rhizoma with medicinal and edible property[J].Modern Chinese Medicine, 2022, 24(8):1463-1472.
[2] 全文彬, 王娟, 黄继红, 等.小麦麸皮可溶性膳食纤维的理化性质和结构表征[J].食品与发酵工业, 2024, 50(21):259-265.QUAN W B, WANG J, HUANG J H, et al.Physicochemical properties and structural characterization of soluble dietary fiber of wheat bran[J].Food and Fermentation Industries, 2024, 50(21):259-265.
[3] 方微, 庞邵杰, 宋歌, 等.膳食纤维通过理化性质和肠道微生物途径调控糖脂代谢的研究进展[J].粮油食品科技, 2021, 29(5):152-158.FANG W, PANG S J, SONG G, et al.Research progress of dietary fiber regulating glucolipid metabolism through physicochemical properties and gut microbiota[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(5):152-158.
[4] 唐孝青, 焦凌霞, 樊明涛, 等.梨渣可溶性膳食纤维的提取及抗氧化特性[J].西北农业学报, 2010, 19(9):93-98.TANG X Q, JIAO L X, FAN M T, et al.Extraction and antioxidant properties of soluble dietary fiber from pear residue[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2010, 19(9):93-98.
[5] 张旭, 林晚, 朱利涛, 等.可溶性膳食纤维联合益生菌治疗老年便秘型肠易激综合征的临床疗效观察[J].中国微生态学杂志, 2021, 33(9):1082-1085.ZHANG X, LIN W, ZHU L T, et al.Clinical efficacy of soluble dietary fiber in treatment of irritable bowel syndrome with predominant constipation in the elderly[J].Chinese Journal of Microecology, 2021, 33(9):1082-1085.
[6] BACH KNUDSEN K E.The nutritional significance of “dietary fibre” analysis[J].Animal Feed Science and Technology, 2001, 90(1-2):3-20.
[7] 沈康, 郭瑞成, 徐天旭, 等.DEAE-52纤维素柱层析纯化处理对西梅可溶性膳食纤维的影响[J].食品与发酵工业, 2024, 50(17):209-217.SHEN K, GUO R C, XU T X, et al.Effect of DEAE-52 cellulose column chromatography on soluble dietary fiber of prune[J].Food and Fermentation Industries, 2024, 50(17):209-217.
[8] WAN F C, FENG C F, LUO K Y, et al.Effect of steam explosion on phenolics and antioxidant activity in plants:A review[J].Trends in Food Science &Technology, 2022, 124:13-24.
[9] 霍达, 李琳, 张霞, 等.玉竹多糖的提取工艺优化、结构表征及抗氧化活性的研究[J].食品科技, 2020, 45(7):200-208.HUO D, LI L, ZHANG X, et al.Optimization of extraction, structure characterization and antioxidant activity of polysaccharide from Polygonatum ordoratum(mill.) druce[J].Food Science and Technology, 2020, 45(7):200-208.
[10] 刁春仁. 藕渣可溶性膳食纤维的提取分离、结构表征及其对肠道微生物的影响[D].镇江:江苏大学, 2019.DIAO C R.Extraction, separation, structural characterization of soluble dietary fiber of lotus root residue and its effects on intestinal microbes[D].Zhenjiang:Jiangsu University, 2019.
[11] WANG L, ZHANG B, XIAO J, et al.Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J].Food Chemistry, 2018, 249:127-135.
[12] 金书涵, 崔蓬勃, 姚雨馨, 等.竹叶可溶性膳食纤维的高效提取及其结构、功能特性分析[J].食品与发酵工业, 2025, 51(5):203-210.JIN S H, CUI P B, YAO Y X, et al.Efficient extraction of soluble dietary fiber from bamboo leaves and analysis of its structure and function[J].Food and Fermentation Industries, 2025, 51(5):203-210.
[13] 马二兰, 林莹, 涂连, 等.芋头球蛋白的提取纯化及其对α-淀粉酶和α-葡萄糖苷酶抑制活性研究[J].食品工业科技, 2021, 42(14):25-32.MA E L, LIN Y, TU L, et al.Extraction, purification of taro globulin and its inhibitory activity on α-amylase and α-glucosidase[J].Science and Technology of Food Industry, 2021, 42(14):25-32.
[14] 宋昕. 蒸煮中半纤维素在纤维素上的吸附特性研究[D].大连:大连工业大学, 2015.SONG X.The adsorption characteristics of hemicellulose on cellulose in cooking[D].Dalian:Dalian University of Technology, 2015.
[15] 董吉林, 王雷.膳食纤维对肠道微生物及机体健康影响的研究进展[J].粮食与饲料工业, 2019(1):36-40.DONG J L, WANG L.Research progress of the effect of dietary fiber on intestinal microorganism and host health[J].Cereal &Feed Industry, 2019(1):36-40.
[16] JIA F J, LIU X C, GONG Z Q, et al.Extraction, modification, and property characterization of dietary fiber from Agrocybe cylindracea[J].Food Science &Nutrition, 2020, 8(11):6131-6143.
[17] 魏磊, 李宁洁, 金饶, 等. 赤松茸酸性多糖的结构表征及抗氧化活性研究[J]. 食品与发酵工业, 2025, 51(14):167-174.WEI L, LI N J, JIN R, et al. Structural characterization and antioxidant activity of acidic polysaccharides from Stropharia rugosoannulata[J]. Food and Fermentation Industries, 2025, 51(14):167-174.
[18] 杨开, 杨振寰, 吴伟杰, 等.雷笋膳食纤维酶法改性及其理化性能和结构变化[J].食品与发酵工业, 2019, 45(4):36-41.YANG K, YANG Z H, WU W J, et al.Physicochemical properties and structural changes of bamboo shoots dietary fiber with enzymatic modification[J].Food and Fermentation Industries, 2019, 45(4):36-41.
[19] 朱阳东, 丁金铭, 于斋卓, 等.低相对分子质量海藻多糖的分离纯化、结构鉴定及其生物活性研究[J].药物评价研究, 2024, 47(12):2806-2815.ZHU Y D, DING J M, YU Z Z, et al.Isolation, purification, structure identification and biological activity of low relative molecular weight Sargassum polysaccharides[J].Drug Evaluation Research, 2024, 47(12):2806-2815.
[20] WOJDY O A, NOWICKA P, TURKIEWICZ I P, et al.Comparison of bioactive compounds and health promoting properties of fruits and leaves of apple, pear and quince[J].Scientific Reports, 2021, 11:20253.
O A, NOWICKA P, TURKIEWICZ I P, et al.Comparison of bioactive compounds and health promoting properties of fruits and leaves of apple, pear and quince[J].Scientific Reports, 2021, 11:20253.
[21] JI X L, GUO J H, CAO T Z, et al.Review on mechanisms and structure-activity relationship of hypoglycemic effects of polysaccharides from natural resources[J].Food Science and Human Wellness, 2023, 12(6):1969-1980.
[22] LIU Y, AO H P, ZHENG J X, et al.Improved functional properties of dietary fiber from Rosa roxburghii Tratt residue by steam explosion[J].Journal of Food Processing and Preservation, 2022, 46(1):e16119.
[23] 袁梦, 刘晓倩, 张浩, 等. 芡实膳食纤维的结构、理化和功能特性[J]. 食品工业科技, 2025, 46(17):151-161.YUAN M, LIU X Q, ZHANG H, et al. Structural, physicochemical, and functional properties of dietary fiber extracts from Euryale ferox[J]. Science and Technology of Food Industry, 2025, 46(17):151-161.
[24] CHEN N, JIANG T Y, XU J X, et al.The relationship between polysaccharide structure and its antioxidant activity needs to be systematically elucidated[J].International Journal of Biological Macromolecules, 2024, 270:132391.