黄绿蜜环菌[Armillaria luteo-virens(Aalb.et Schw:Fr.)Sacc.],又称黄蘑菇、皇菇、双环菌,在我国主要产于西藏、四川及青海等地[1]。黄绿蜜环菌作为一种药食同源真菌,早在《农桑经》中记载具有促进新陈代谢、降低胆固醇、增强免疫力的功效[2],并且其风味独特、营养价值高,富含黄酮、多酚、多糖、氨基酸、挥发油和多种维生素物质,此外还含有硒、铁、锌、铜等人体所需的微量元素[3]。现代药理学表明黄绿蜜环菌具有预防流感、治疗神经炎症、抗氧化、抗细胞毒性等功效[4]。
多糖是由10种以上的单糖通过不同的糖苷键链接形成的天然大分子物质[5]。来源分布广泛,主要存在于植物、动物内脏和微生物中[6]。近年来,多糖在降血糖、抗病毒、抗增殖、抗氧化、免疫调节、毒副作用低等方面的特点逐渐被揭示[7-8]。然而天然多糖的活性往往受其结构和性质的限制,应用现代化学技术修饰如羧甲基化、硫酸化、磷酸化、硒化等可以改善多糖的理化性质,增强其生物活性,拓宽其应用领域[9-11]。羧甲基化修饰多糖有溶解性好、安全、生物相容性高及稳定性高等优点[12-13]。例如海带多糖[14]、黑木耳多糖[15]等羧甲基化后可用于膳食补充剂、免疫增强剂及辅助药物生产中,对天然多糖在食品、中药领域应用意义重大。硒是人体必需微量元素,具有抗衰老、抗氧化、抗肿瘤、调节免疫力、影响生殖发育、解毒等功能[16]。LIAN等[17]研究发现,硒化修饰蕨麻多糖能明显提高抗氧化活性,此外,张阳等[18]还发现白术硒化多糖能够显著改善免疫力。
本研究聚焦于对黄绿蜜环菌多糖(Armillaria luteo-virens polysaccharide,ALVP)进行羧甲基化、硒化修饰,系统分析修饰前后ALVP的理化性质、结构表征以及生物活性,旨在为天然资源的深度开发和药用价值提升提供全面而坚实的理论支撑。
黄绿蜜环菌采自青海省洛藏族自治州玛多县,经新疆生物质资源清洁转化与高值利用重点实验室鉴定为伞菌目,白蘑科,蜜环菌属的子实体。α-葡萄糖甘酶、α-淀粉酶、阿卡波糖、PBS、岩藻糖(fucose,Fuc)、鼠李糖(rhamnose,Rha)、甘露糖(mannose,Man)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glu)、DPPH、盐酸羟胺、刚果红(分析纯),上海阿拉丁生化科技股份有限公司;透析袋(截留相对分子质量3 500 Da),美国BioSharp公司;亚硒酸钠,国药集团化学试剂有限公司;石油醚、无水乙醇、NaOH、三氟乙酸等均为分析纯,上海源叶有限公司。
PRI24ZH/E型电子天平,中国奥斯仪器公司;ASC7000型原子吸收光谱(atomic absorption spectroscopy,AAS)仪、UV-2550型紫外可见分光光度(UV-visible spectrophotometer,UV-Vis)计,日本岛津公司;Cary 630型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪,Agilent科技有限公司;JSM-7500 F型扫描电子显微镜,日本Jeol有限公司;LGJ-10 C型冷冻干燥机,北京福瑞科仪科技有限公司;HH-S 6型数显恒温水浴锅,江苏金怡仪器科技有限公司;Precision MLG3型旋转蒸发仪,德国Heidolph有限公司;5430 R型高速台式离心机,德国Eppendof公司;Spectra Max M5酶标仪,美国Thermo科技有限公司;*Clarus680+SQ8T型GC-MS、STA-8000型热重分析(thermal gravimetric analyzer,TGA)仪,美国PerkinElmer股份有限公司;AVANCE Ⅲ HD 500 MHz型核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)仪,美国赛默飞有限公司;D8 ADVANCE型X-射线衍射(X-ray diffractometer,XRD)仪,德国布鲁克公司。
1.3.1 ALVP制备
将自然风干至恒重的黄绿蜜环菌粉碎过20目筛,依次用石油醚、无水乙醇于索氏提取器回流24 h,以除去色素及小分子杂质,随后收集滤渣,经自然晾干后,于-4 ℃冰箱保存备用。称取100 g黄绿蜜环菌粉末,采用超声波辅助水提法提取ALVP,其中功率为400 W,多糖与水的比例为1∶30(g∶mL),提取温度70 ℃,提取时间150 min。反复提取3次确保多糖彻底被提取后,收集提取液离心(4 000 r/min,8 min)后减压浓缩至原体积1/4,采用三氯乙酸法除去蛋白[19]。随后加入3倍体积无水乙醇,醇沉24 h,透析(24 ℃,72 h,截留分子质量3 500 Da),冷冻干燥(-70 ℃,24 h)得黄绿蜜环菌粗多糖,命名为ALVP。
1.3.2 CM-ALVP制备及取代度测定
羧甲基化修饰参照陈栅等[20]的方法稍作修改,简单来说,称取ALVP 500 mg于烧杯中,加入50 mL NaOH(2 mol/L)在60 ℃下磁力搅拌1 h,随后再加入50 mL体积分数为2%的氯乙酸继续反应5 h,待反应结束后,冷却至室温。加入体积分数为1%的盐酸溶液调节pH值至7.0,透析(24 ℃,72 h,截留分子质量3 500 Da)72 h,冷冻干燥(-70 ℃,24 h),得羧甲基化黄绿蜜环菌多糖(CM-ALVP)。
CM-ALVP取代度测定参照AN等[21]方法稍作修改。向20 mg CM-ALVP中加入NaOH溶液(20 mL,0.1 mol/L),随后在45 ℃下反应30 min,反应结束后冷却至室温,以酚酞为指示剂,采用0.01 mol/L HCl标准溶液滴定剩余NaOH至粉色褪去。取代度(DS)按公式(1)、公式(2)计算。
(1)
(2)
式中:A,消耗的NaOH,mmol/g;V0,NaOH的体积,mL;C0,NaOH浓度,mol/L;V1,消耗HCl溶液的体积,mL;C1,HCl溶液浓度,mol/L;m,CM-ALVP质量,g。
1.3.3 Se-ALVP制备及硒含量测定
硒化修饰方法参照李晓娇等[22]的方法稍作修改。首先称取200 mg ALVP溶于10 mL蒸馏水中,加入0.3 g亚硒酸钠和0.3 mL冰醋酸于60 ℃下水浴反应24 h,待反应结束后冷却至室温。纯水流动透析直至加入抗坏血酸(维生素C)后不呈现红色。随后减压浓缩至原体积的1/3,醇沉,冷冻干燥(-70 ℃,24 h)得硒化黄绿蜜环菌多糖,命名为Se-ALVP。
Se-ALVP的硒含量测定方法:称取100 mg Se-ALVP,加入5 mL HNO3溶液消化,待硝酸消耗殆尽,立即转移至10 mL容量瓶,采用AAS仪测定Se-ALVP的硒元素含量,标准曲线方程为Y=0.993X+0.235 (R2=0.992),其中Y为吸光度,X为硒元素的质量浓度,μg/mL。
1.3.4 溶解性、分子质量及单糖组成
溶解度采用GB/T 21845—2008《化学品 水溶解度试验》进行测定。分子质量测定参照徐海军等[23]的方法稍作修改。将样品配制成2 mg/mL的溶液,使用HPLC检测(色谱柱:TSK-gel G3000 PW XL(柱尺寸:300 mm×7.8 mm;粒径7 um),检测器:shodex RI201-H示差折光检测器。流动相:去离子水,流速0.3 mL/min,进样量20 μL,柱温36 ℃。
单糖组成测定参考王俊龙等[24] 的方法。
1.3.5 UV分析
将ALVP、Se-ALVP和CM-ALVP多糖分别配制成质量浓度为0.2 mg/mL水溶液,采用UV-Vis仪在200~400 nm扫描,得紫外谱图。
1.3.6 XRD分析
采用XRD仪对样品进行扫描,扫描范围5°~80°,步长0.02°,速度0.1 s/步。
1.3.7 微观结构分析
将ALVP、CM-ALVP和Se-ALVP样品用导电胶带固定于扫描电镜样品台上,用离子溅射仪喷金后,在加速电压为15.0 kV下放大100倍和20 000倍,观察样品微观结构。
1.3.8 TGA分析
分别称取10 mg ALVP、CM-ALVP和Se-ALVP于铂坩埚中,以N2作为保护气,以10 ℃/min从35 ℃升温至600 ℃,测定样品的热重分析(thermogravimetric analysis, TG)、微分热重分析(derivative thermogravimetry, DTG)、差示扫描量热法(differential scanning calorimetry, DSC)曲线。
1.3.9 刚果红实验
分别移取1 mL质量浓度为3 mg/mL的ALVP、CM-ALVP和Se-ALVP水溶液、依次加入1 mL刚果红溶液(0.2 mmol/L)、不同质量浓度(0、0.1、0.2、0.3、0.4、0.5 mg/mL)的NaOH溶液,混匀,避光反应10 min,用UV-Vis测定溶液在400~600 nm的最大吸收波长(λmax),以刚果红为对照,绘制刚果红实验结果曲线。
1.3.10 FTIR分析
分别称取5 mg的ALVP、CM-ALVP和Se-ALVP与250 mg KBr混匀压片,用FTIR在4 000~400 cm-1扫描。
1.3.11 NMR分析
称取60 mg的ALVP、CM-ALVP和Se-ALVP,分别溶解于3 mL D2O进行NMR测定。
1.3.12 对DPPH自由基、羟自由基(·OH)、ABTS阳离子自由基清除能力及Fe3+还原能力测定
分别参考高长久等[25]、郭青枝等[26]、马永强等[27]的方法,以蒸馏水为空白对照,以维生素C为阳性对照,测定不同质量浓度(0、0.5、1、2、4、6、8 mg/mL)样品溶液对DPPH自由基、·OH、ABTS阳离子自由基清除能力,每组实验重复3次,结果取平均值。
Fe3+还原能力测定方法:取1 mL不同质量浓度(0、0.5、1、2、4、6、8 mg/mL)的样品溶液与2.5 mL PBS(2.5 moL/L)、2.5 mL质量分数为1%的铁氰化钾溶液混合,于50 ℃孵育20 min后,加入1 mL质量分数为10%的CF3COOH,离心(3 000 r/min,10 min)后,取1 mL上清液与0.6 mL去离子水和0.4 mL质量分数为1%的FeCl3溶液充分混合,静置10 min,用UV-Vis在700 nm处测定吸光度。以蒸馏水为空白对照,以维生素C为阳性对照,实验重复3次,结果取平均值。
1.3.13 对α-葡萄糖苷酶、α-淀粉酶抑制力测定
分别参考冯学珍等[28]、LYU等[29]的方法,以阿卡波糖为阳性对照,测定不同质量浓度(0.25、0.5、1、2、4、6、8 mg/mL)的ALVP、CM-ALVP和Se-ALVP对α-葡萄糖苷酶和α-淀粉酶的抑制作用。
实验数据均以3次独立实验结果的“平均值±标准误差”表示。利用Origin 2021软件进行图表绘制,并采用SPSS软件进行差异显著性分析,以P<0.05为差异具有统计学意义。
由表1可知,通过羧甲基化、硒化修饰,制备出取代度为0.492%的CM-ALVP和硒元素含量为512.98 μg/g的Se-ALVP。取代度和硒含量不同可能与多糖的分子质量有关,分子质量越大,多糖的结构片段越多,从而具有更多的取代点位[30]。与ALVP相比,CM-ALVP和Se-ALVP的水溶性分别提高20%和10%,这可能是羧甲基化修饰后亲水性的羧基与水分子形成氢键,并且电离出H+,使多糖分子带有负电荷,带有相同电荷的多糖分子之间相互排斥,分子链不易聚集缠绕,有利于多糖分子在水中的分散,从而使水溶性增加[31]。硒化修饰可能改变了多糖的空间结构,使其变得更加舒展,多糖分子与水接触的表面积增大,有利于水分子和多糖分子间形成更多的氢键等相互作用[32]。修饰后CM-ALVP和Se-ALVP的分子质量均从23.2 kDa增加至23.3 kDa,这可能是因为修饰后多糖分子结构中引入羧甲基和含硒基团,导致分子质量增加。
表1 ALVP、Se-ALVP和CM-ALVP的取代度、溶解性和分子质量
Table 1 Degree of substitution, solubility and molecular weight of ALVP, Se-ALVP, and CM-ALVP

注:“—”表示无此项检测。
样品取代度/%硒离子含量/(μg/g)溶解度/(mg/mL)分子质量/kDaALVP——85.35±0.5423.2CM-ALVP0.492—102.45±0.3723.3Se-ALVP—512.9897.24±0.8423.3
采用气相质谱检测ALVP、CM-ALVP和Se-ALVP的单糖组成。如图1所示,通过与标准品的保留时间、质谱数据对比显示,ALVP主要由岩藻糖(0.39%)、鼠李糖(4.98%)、甘露糖(1.54%)、半乳糖(80.86%)、葡萄糖(12.13%)等组成的杂多糖,修饰后的多糖CM-ALVP和Se-ALVP单糖组成没有发生变化,但单糖的组成比例发生明显变化,其中半乳糖和葡萄糖摩尔比例无明显变化,岩藻糖和甘露糖明显增加。这表明羧甲基化、硒化修饰主要发生在多糖的支链上,可能不发生在主链。这是因为与主链相比,支链上的修饰点位更多,且更容易受到外界基团的攻击,导致其—OH、—NH4、—CHO等更容易被取代[33]。
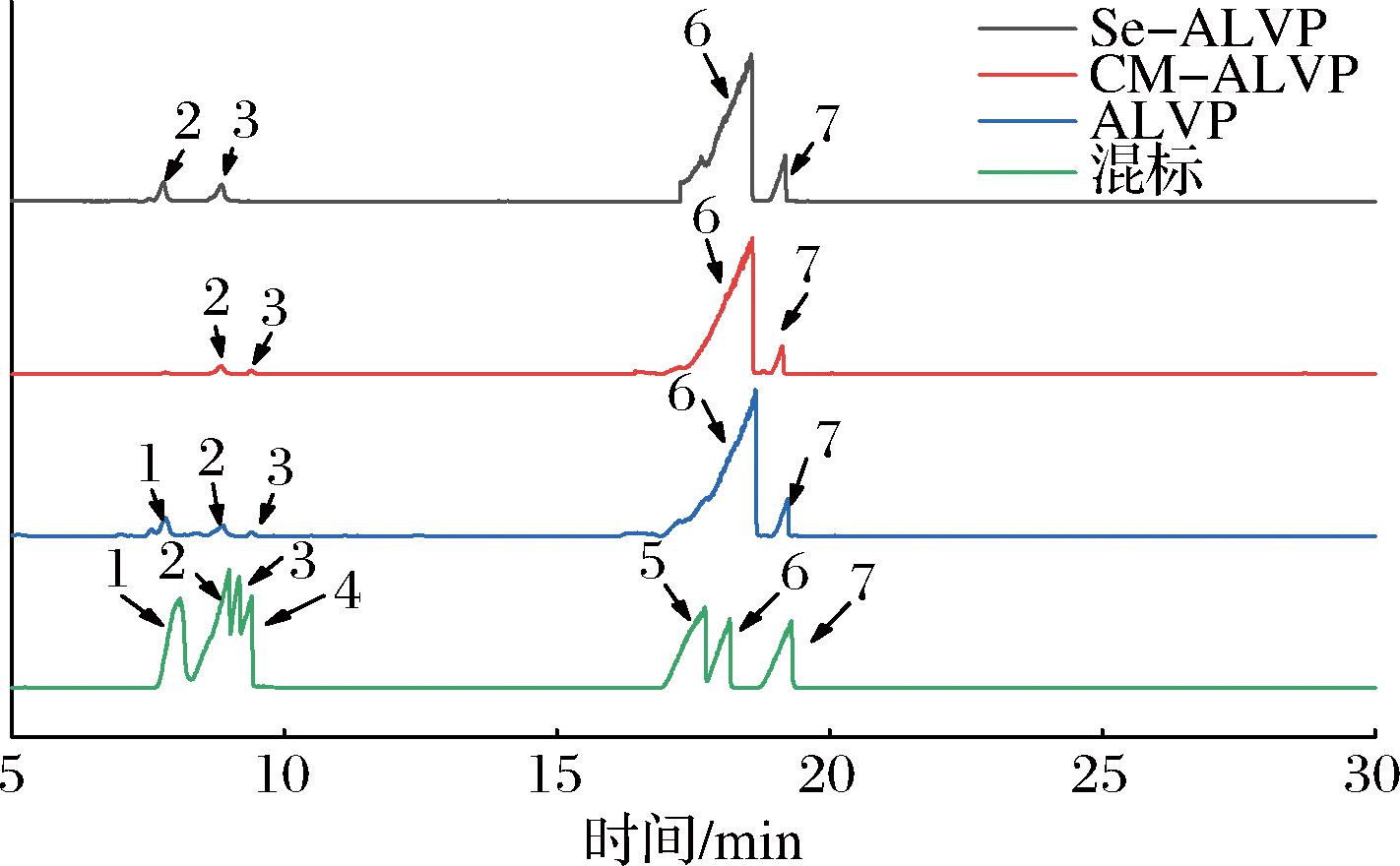
1-岩藻糖;2-鼠李糖;3-甘露糖;4-阿拉伯糖;5-木糖;6-半乳糖;7-葡萄糖。
图1 ALVP、CM-ALVP和Se-ALVP单糖组成
Fig.1 Monosaccharide composition of ALVP, CM-ALVP, and Se-ALVP
如图2-a所示,ALVP在260 nm和280 nm处有明显的吸收峰,表明粗糖中存在少量的糖醛酸和蛋白质[34]。与ALVP相比,CM-ALVP和Se-ALVP在260 nm和280 nm峰强度明显降低,表明修饰后的多糖在一定程度上对糖醛酸和蛋白质进行改性。
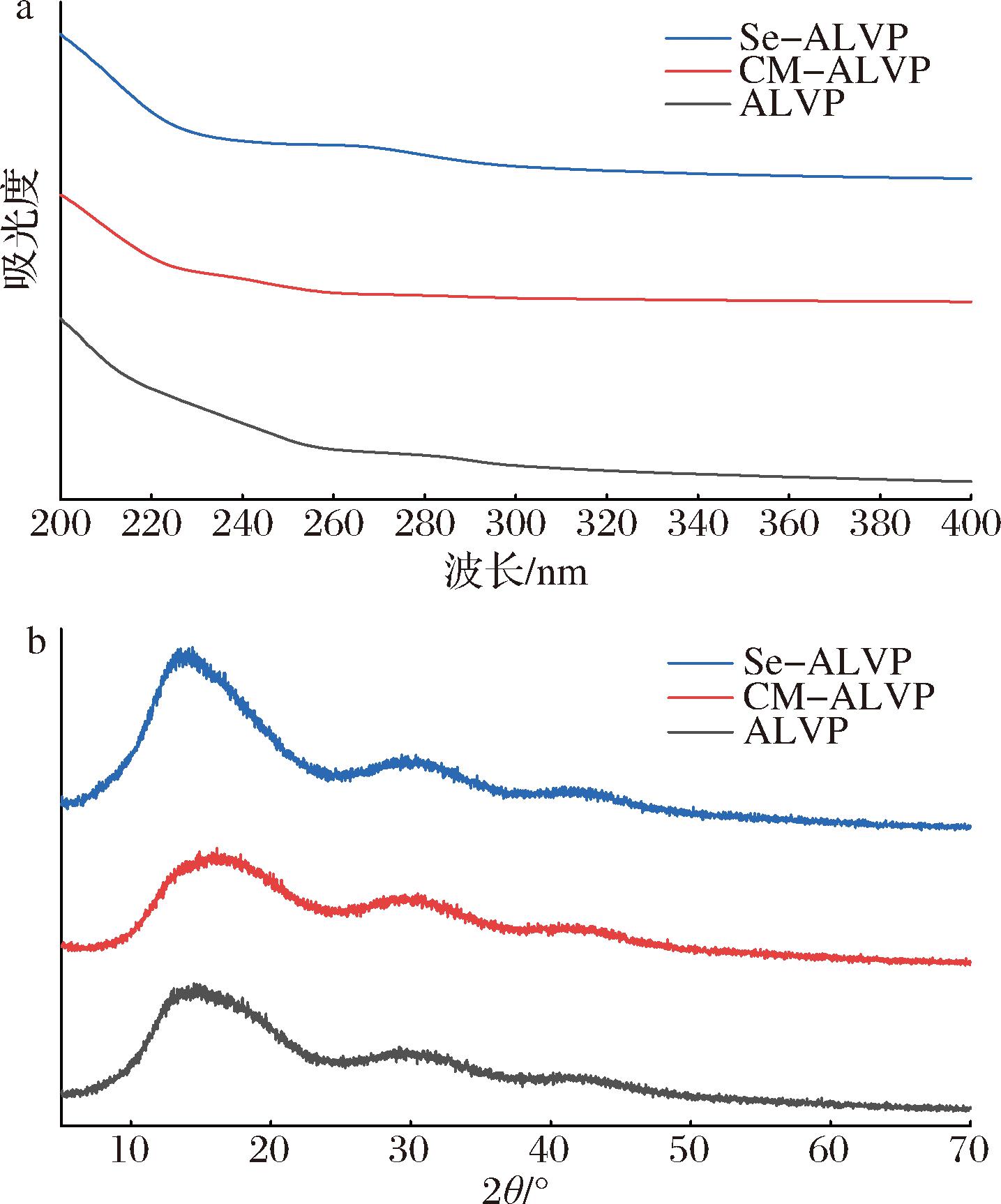
a-UV-Vis;b-XRD
图2 ALVP、CM-ALVP和Se-ALVP的UV-Vis、XRD谱图
Fig.2 UV-Vis, XRD spectra of ALVP, CM-ALVP, and Se-ALVP
XRD可用于检测多糖的晶体结构。衍射峰的形状可反应物质的结构,峰型尖且窄表示存在晶体结构,峰型宽说明存在非晶体结构[35]。由图2-b可知,ALVP、CM-ALVP和Se-ALVP在15°、30°、42°均出现较宽松散的多糖特征峰,表现为非晶体结构,但Se-ALVP在2θ为15°时,峰强度明显增大,表明硒化作用会使ALVP多糖结晶度提高。多糖结晶度的改变导致其稳定性、溶解性、溶胀能力、柔韧性发生改变,通常结晶度提高、多糖的溶解性降低,稳定性、柔韧性增强,更难被生物降解,此外结晶度的改变可能影响多糖的生物活性,高结晶度的多糖,因其结构紧密,从而限制了其与生物分子的相互作用,但沈琴等[36]发现黑木耳多糖硒化修饰后结晶度提高,抗氧化、降血糖、降血脂能力提升,与本文研究结果一致。
如图3所示,3种多糖在低倍镜下形貌存在较大差异,但均存在棒状、条状、颗粒状和网状结构,并无规则堆集叠放。高倍镜下ALVP和Se-ALVP的表面粗糙,层状堆积,带有空隙褶皱结构,说明分子之间存在排斥,分子间吸引力较小,而CM-ALVP的结构更加紧密,表面较为光滑带有刺状小颗粒,无裂缝,说明羧甲基化修饰后多糖分子结构发生改变,分子间作用力增强,分子结构更加紧密。

a-ALVP×100;b-CM-ALVP×100;c-Se-ALVP×100;d-ALVP×20 000;e-CM-ALVP×20 000;f-Se-ALVP×20 000
图3 ALVP、CM-ALVP和Se-ALVP的扫描电镜图
Fig.3 SEM images of ALVP, CM-ALVP, and Se-ALVP
由图4可知,ALVP、CM-ALVP和Se-ALVP随温度的升高呈现相同的变化规律,分为3个失重阶段。第一阶段在30~240 ℃曲线下降,ALVP、CM-ALVP和Se-ALVP质量损失率分别为10.75%、21.42%和10.15%,这是由于多糖中自由水和结合水被蒸发导致的[37],第二阶段发生在210~360 ℃,ALVP、CM-ALVP和Se-ALVP分别从210、240 ℃和204 ℃开始降解,此阶段ALVP、CM-ALVP和Se-ALVP质量明显损失,质量损失率分别为39.21%、34.74%和39.51%,这可能是因为多糖的热分解和糖苷键断裂导致的[38],第三阶段在310~600 ℃,多糖降解速率缓慢,此阶段为多糖的碳化阶段,ALVP、CM-ALVP和Se-ALVP的最终残碳率分别为30.38%、32.98%和35.48%。表明ALVP经羧甲基化、硒化修饰后,CM-ALVP和Se-ALVP的热稳定性得到提高,特别是Se-ALVP热稳定性明显提升。这可能是硒化修饰后形成具有更高键能的C—O—Se、Se![]() O等化学键,这些化学键受热不易断裂,从而增强了分子结构的稳定性[39]。
O等化学键,这些化学键受热不易断裂,从而增强了分子结构的稳定性[39]。

a-ALVP;b-CM-ALVP;c-Se-ALVP
图4 ALVP、CM-ALVP和Se-ALVP的TG、DTG、DSC曲线图
Fig.4 TG, DTG, and DSC curves of ALVP, CM-ALVP,and Se-ALVP
刚果红可以与具有三股螺旋结构的多糖形成络合物,该络合物的最大吸收波长会根据NaOH溶液的浓度产生变化。当NaOH浓度较低时,λmax会红移,随着NaOH浓度增大,多糖的三股螺旋结构中的氢键被破坏,伴随着可能会发生解旋、无规则卷曲等构象改变,此时λmax下降[40]。如图5-a所示,当NaOH浓度为0.1 mol/L时,ALVP、CM-ALVP和Se-ALVP均达到λmax,随着NaOH浓度的继续增大,λmax开始降低,这是因为在强碱环境下,多糖的三股螺旋结构被破坏所致。表明ALVP、CM-ALVP和Se-ALVP均具有三股螺旋结构。具有三螺旋结构的多糖结构稳定,有助于生物体保持完整的结构形态,提高多糖对自由基的捕捉能力,同时多糖中特定的官能团(酚羟基、羧基等)可直接清除自由基从而提高其抗氧化活性,此外三股螺旋结构可能影响多糖在消化系统中的酶解速率和吸收路径,螺旋结构可能阻碍多糖与代谢酶之间的相互作用,从而延缓多糖的降解和葡萄糖的释放,以达到降糖效果。毛子俊等[41]研究结果显示,与不具有三股螺旋结构干马齿苋多糖相比,具有三股螺旋结构的鲜马齿苋多糖抗氧化能力更强。
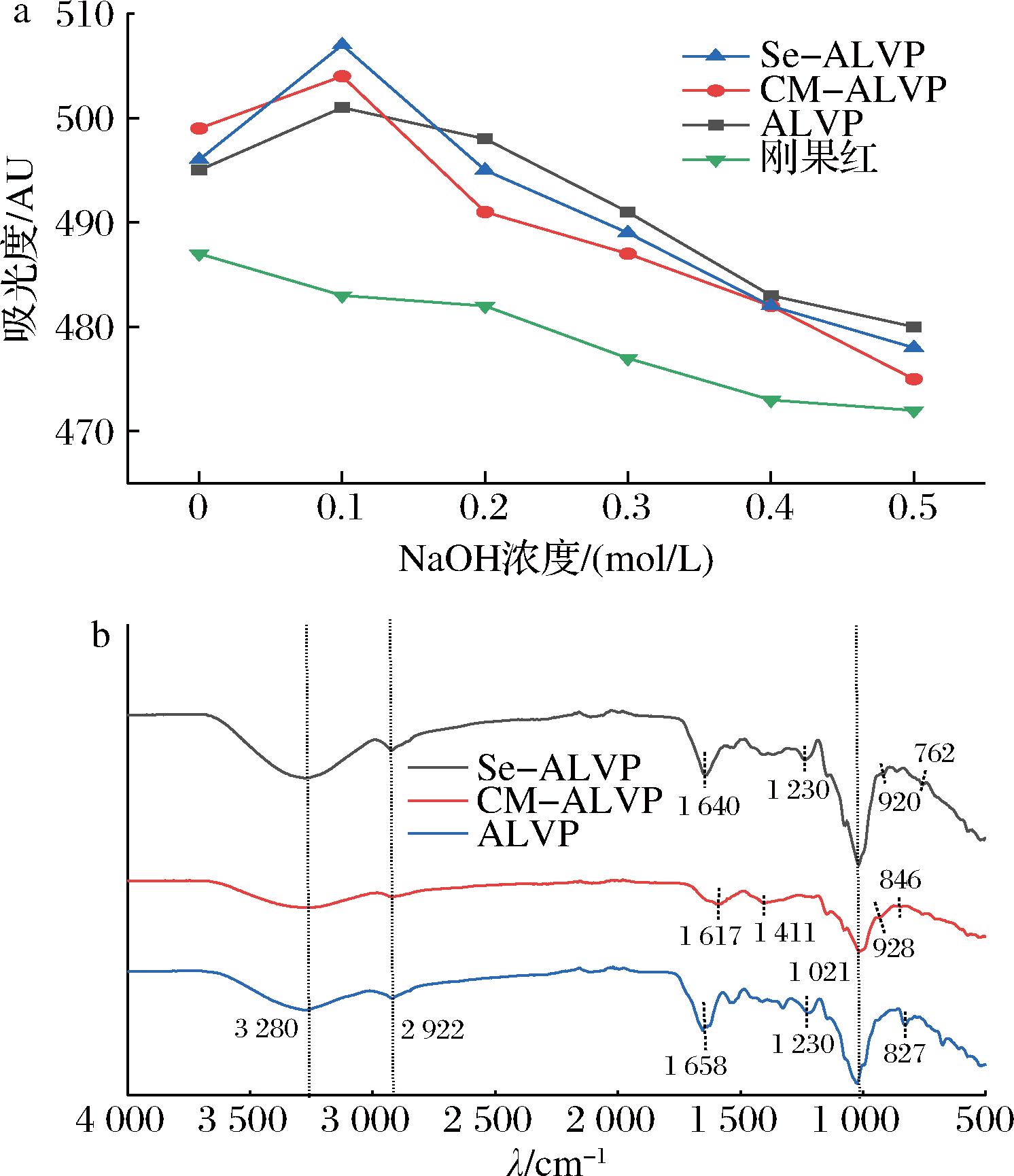
a-λmax;b-IR谱图
图5 ALVP、CM-ALVP、Se-ALVP在不同浓度NaOH溶液中的λmax和ALVP、CM-ALVP和Se-ALVP的IR谱图
Fig.5 λmax of ALVP, CM-ALVP, and Se-ALVP in different concentrations of NaOH solutions and IR spectra of ALVP, CM-ALVP, and Se-ALVP
由图5-b可知,ALVP修饰前后主体结构未发生改变,3 280 cm-1左右处强而宽的吸收峰由多糖中分子间氢键O—H伸缩振动引起的,2 922 cm-1处的吸收峰主要是由多糖的C—H伸缩振动引起的。1 000~1 200 cm-1附近出现的强而宽的谱带是由C—O伸缩振动和C—O—C振动引起的,这表明ALVP、CM-ALVP和Se-ALVP可能存在吡喃糖[42]。ALVP在1 658 cm-1左右出现尖强的吸收峰为多糖中结合水的特征吸收峰,1 230 cm-1处的吸收峰为C—O—C的伸缩振动,827 cm-1附近的吸收峰表明可能存在α-型糖苷键。CM-ALVP在1 617 cm-1和1 411 cm-1处的吸收峰归因于C![]() O之间的不对称和对称伸缩振动,表明存在去质子化羧基,说明存在糖醛酸[43],表明已成功被羧甲基化。928 cm-1和846 cm-1左右的峰表明CM-ALVP中可能存在β-型糖苷键和α-型糖苷键[44]。Se-ALVP在1 640 cm-1处的吸收峰是C
O之间的不对称和对称伸缩振动,表明存在去质子化羧基,说明存在糖醛酸[43],表明已成功被羧甲基化。928 cm-1和846 cm-1左右的峰表明CM-ALVP中可能存在β-型糖苷键和α-型糖苷键[44]。Se-ALVP在1 640 cm-1处的吸收峰是C![]() O伸缩振动引起的,920 cm-1处的特征吸收峰为β-型糖苷键的特征吸收峰,762 cm-1处的吸收峰为Se
O伸缩振动引起的,920 cm-1处的特征吸收峰为β-型糖苷键的特征吸收峰,762 cm-1处的吸收峰为Se![]() O特征吸收峰,这说明硒以亚硒酸基的形式与ALVP上的羟基结合成硒化黄绿蜜环菌。
O特征吸收峰,这说明硒以亚硒酸基的形式与ALVP上的羟基结合成硒化黄绿蜜环菌。
由图6-a可知,ALVP、CM-ALVP和Se-ALVP的1H NMR谱图可以看出,1H信号分布在3.0~4.3 ppm和4.3~6 ppm。δ 4.75 ppm为D2O的氢质子信号,在δ 4.75~5.79 ppm范围内出现的信号峰是多糖的特征峰。异头氢的信号区域在4.46~5.82 ppm,异头氢化学位移大于4.95 ppm是α构型的糖苷键,小于4.95 ppm是β构型的糖苷键[45],说明在ALVP中含有α构型糖苷键,CM-ALVP和Se-ALVP可能同时具有α构型糖苷键和β构型糖苷键。与ALVP相比,CM-ALVP和Se-ALVP在δ 4.46 ppm和δ 4.45 ppm处出现的信号峰是—OH上的氢被羧甲基(—OCH2COO)和硒基取代所致。
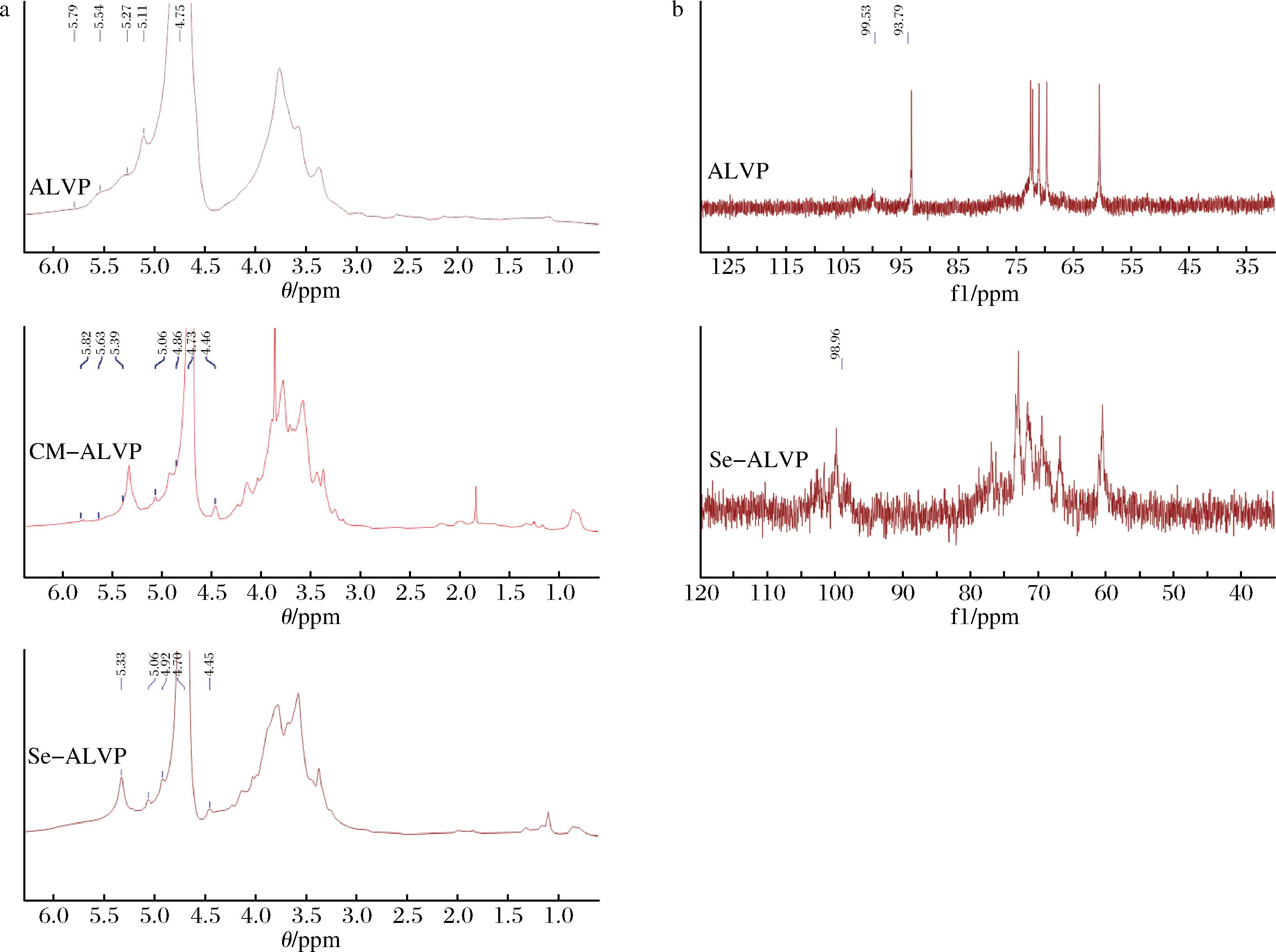
a-1H NMR;b-13C NMR
图6 ALVP、CM-ALVP和Se-ALVP的1H NMR、13C NMR谱图
Fig.6 1H NMR and 13C NMR spectra of ALVP, CM-ALVP, and Se-ALVP
在图6-b中,ALVP和Se-ALVP的13C信号分别在60~75 ppm和93~100 ppm。多糖的碳链包括异位碳区和糖环碳区,一般情况下,α构糖苷键的异头碳化学位移信号区域在98~103 ppm,β构糖苷键的异头碳化学位移信号区域在101~105 ppm[46],ALVP的异碳头在99.53 ppm和93.79 ppm,Se-ALVP的异碳头在98.96 ppm,表明ALVP可能具有α构型和β构型糖苷键,Se-ALVP可能具有β构型糖苷键。
植物多糖作为天然生物活性物质,正逐渐成为抗氧化研究的焦点。研究显示,植物多糖不仅能有效清除自由基,还可提升细胞中抗氧化酶的活性,从而增强机体的防御功能。在评估多糖的抗氧化活性时,清除率、半抑制浓度(IC50)等指标尤为重要。清除率反映多糖中和自由基的能力,较高的清除率意味着有效减少细胞氧化应激对细胞的损害。IC50是评估多糖抗氧化效力的关键,较低的IC50值表明在低浓度下,多糖也能表现出显著的抗氧化效果,用来评估其作为天然抗氧化剂的潜力。如图7所示,在实验研究范围内,ALVP、CM-ALVP和Se-ALVP对DPPH自由基、ABTS阳离子自由基、·OH清除率及Fe3+还原力均呈现一定的剂量依赖关系,当质量浓度为8 mg/mL时,ALVP、CM-ALVP和Se-ALVP对DPPH、ABTS阳离子、·OH的清除能力及Fe3+还原力达到最大,对DPPH自由基清除率分别为60.1%、70.98%和78.91%,IC50值分别为3.05、1.76、1.35 mg/mL,对ABTS阳离子自由基清除率分别为52.01%、60.02%和70.55%,IC50值分别为5.72、1.79、0.96 mg/mL,对·OH清除率分别为58.44%、66.7%、74.10%,IC50值分别为4.00、2.00、2.00 mg/mL,对Fe3+的还原力分别为0.89、0.96、1.05 AU,结果表明羧甲基化、硒化修饰能明显增强ALVP的抗氧化活性,这可能是因为羧甲基化修饰可以增强多糖的电负性、改变其空间结构从而提高自由基清除能力,而硒化修饰降低了多糖的氢键解离能,提高了供氢能力[47]。
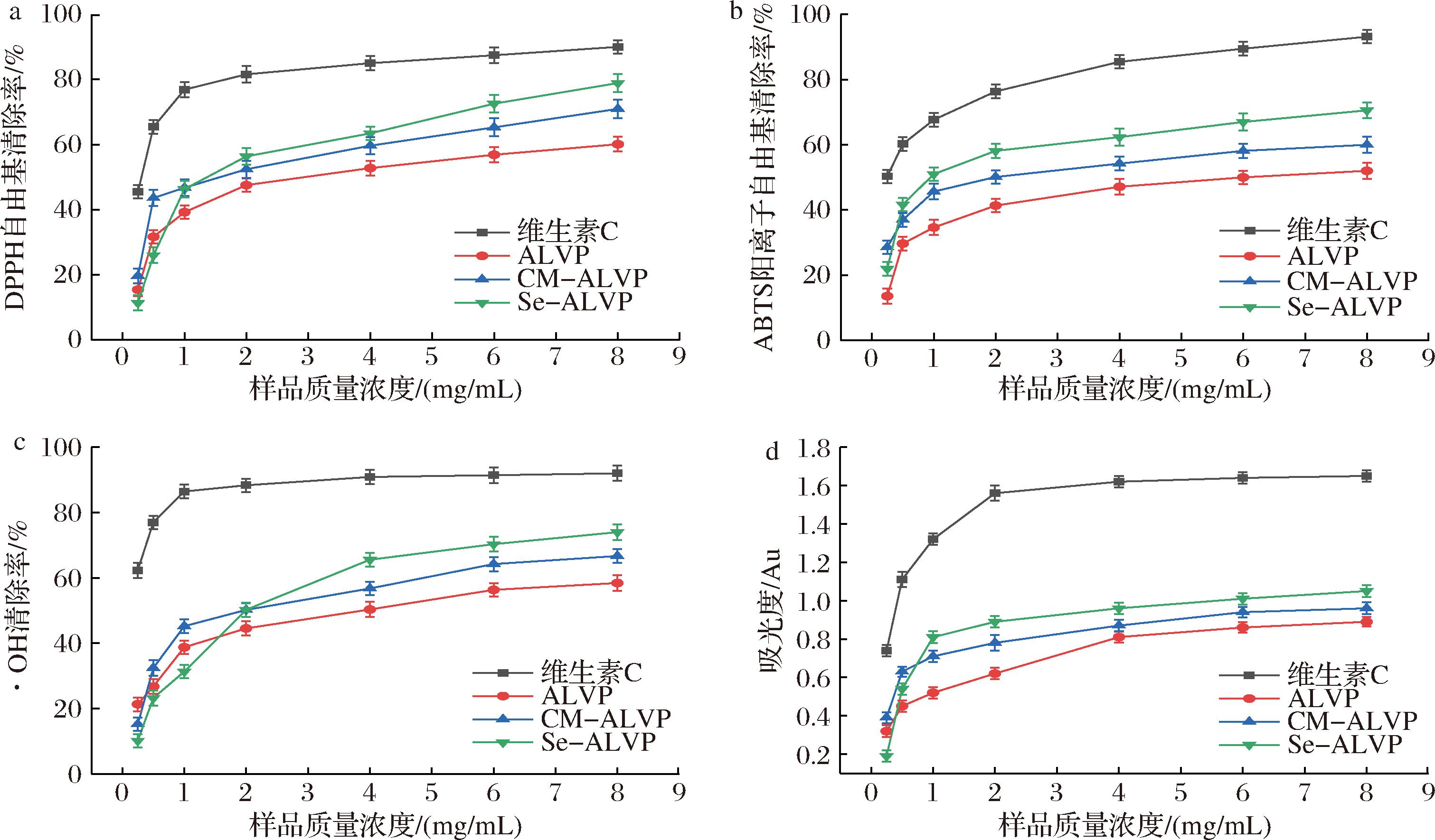
a-DPPH自由基;b-ABTS阳离子自由基;c-·OH;d-Fe3+的还原力
图7 ALVP、CM-ALVP和Se-ALVP抗氧化活性
Fig.7 Antioxidant capacity of ALVP, CM-ALVP, and Se-ALVP
图8为ALVP、CM-ALVP和Se-ALVP对α-葡萄糖苷酶和α-淀粉酶的抑制能力结果。糖尿病是一种由胰岛β细胞破坏而导致胰岛素绝对缺乏(1型糖尿病)或相对不足(2型糖尿病)所引起的,导致血糖升高的终生慢性疾病,并且伴随多种并发症。多糖能够通过抑制α-葡萄糖苷酶和α-淀粉酶的活性,进而减缓食物中碳水化合物分解为葡萄糖的速度,葡萄糖的吸收随之减少,从而达到调节血糖水平的效果。抑制率用于评估多糖对酶活性的影响,例如对α-葡萄糖苷酶、α-淀粉酶的抑制力,高抑制率意味多糖能够有效减缓糖分吸收速率,在降低血糖方面具有显著的作用。ALVP、CM-ALVP和Se-ALVP对α-葡萄糖苷酶和α-淀粉酶的抑制力与浓度成正相关,但始终低于阿卡波糖。ALVP、CM-ALVP和Se-ALVP的质量浓度为8 mg/mL时,对α-葡萄糖苷酶和α-淀粉酶的抑制率达到最大,对α-葡萄糖苷酶的抑制率分别为45.56%、49.12%和54.11%,对α-淀粉酶的抑制率分别为42.44%、48.77%和55.78%,结果表明,羧甲基化和硒化修饰能显著增强ALVP对α-葡萄糖苷酶和α-淀粉酶的抑制能力,这可能是因为羧甲基化修饰后多糖的水溶性改变了电负性,增强对α-葡萄糖苷酶和α-淀粉酶的抑制作用,从而提高降血糖作用。硒化修饰后的多糖降血糖活性可能与硒含量和是否具有三螺旋结构有关,LIU等[48]研究发现与不具有三螺旋结构多糖相比,具有三螺旋结构的多糖降血糖能力更高,且硒含量会影响三螺旋结构的形成,硒化程度高将导致三股螺旋结构消失。
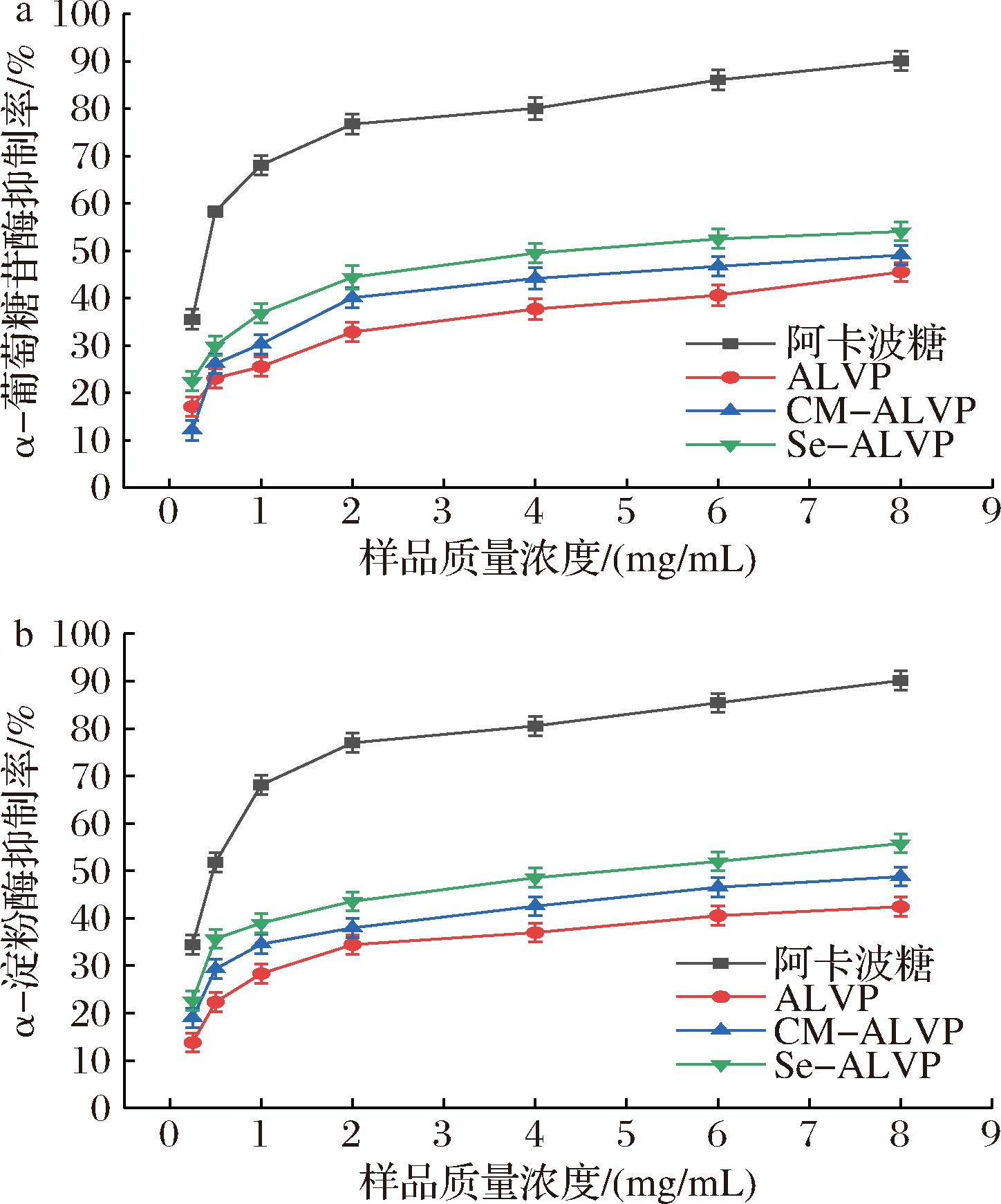
a-α-葡萄糖苷酶;b-α-淀粉酶
图8 ALVP、CM-ALVP和Se-ALVP对α-葡萄糖苷酶和α-淀粉酶的抑制能力
Fig.8 Inhibitory effects of ALVP, CM-ALVP, and Se-ALVP on α-glucosidase and α-amylase
为改善ALVP的功能,本研究采用碱性氯乙酸法和亚硒酸钠法成功制备了羧甲基化的CM-ALVP和硒化的Se-ALVP。通过对ALVP、CM-ALVP和Se-ALVP的理化性质研究与结构表征发现,与ALVP相比,CM-ALVP和Se-ALVP的相对分子质量、溶解度和热稳定性均有所提升。这可能是由于羧基和硒元素的引入,增加分子质量。CM-ALVP中的羧基与水分子形成氢键,增强了溶解性,同时在高温下保持了稳定的分子结构。硒化修饰形成了C—O—Se、Se![]() O等化学键,改变了多糖的空间结构,增加了与水的接触表面积,进一步提高了水溶性,增强了热稳定性。微观结构分析显示,与ALVP相比,CM-ALVP和Se-ALVP的表面形貌发生了变化,尤其是CM-ALVP结构更紧密,这可能是因为分子间作用力增强所致;刚果红实验和XRD分析结果显示,ALVP修饰前后主体结构未发生改变,仍为非晶体且保持三股螺旋结构。不过修饰后的多糖因引入新基团,限制了分子链的活动,并促使其排列更规则,增加了结晶度。多糖的降解主要发生在侧链基团(如羟基),没有破坏主链的化学键,三股螺旋结构依然依赖主链间的氢键维持。FTIR分析显示,ALVP与CM-ALVP和Se-ALVP的主要特征吸收峰相似,但CM-ALVP在1 617 cm-1和1 411 cm-1处出现的C
O等化学键,改变了多糖的空间结构,增加了与水的接触表面积,进一步提高了水溶性,增强了热稳定性。微观结构分析显示,与ALVP相比,CM-ALVP和Se-ALVP的表面形貌发生了变化,尤其是CM-ALVP结构更紧密,这可能是因为分子间作用力增强所致;刚果红实验和XRD分析结果显示,ALVP修饰前后主体结构未发生改变,仍为非晶体且保持三股螺旋结构。不过修饰后的多糖因引入新基团,限制了分子链的活动,并促使其排列更规则,增加了结晶度。多糖的降解主要发生在侧链基团(如羟基),没有破坏主链的化学键,三股螺旋结构依然依赖主链间的氢键维持。FTIR分析显示,ALVP与CM-ALVP和Se-ALVP的主要特征吸收峰相似,但CM-ALVP在1 617 cm-1和1 411 cm-1处出现的C![]() O吸收峰是羧甲基的特征,Se-ALVP在762 cm-1处的Se
O吸收峰是羧甲基的特征,Se-ALVP在762 cm-1处的Se![]() O峰表明修饰成功。NMR谱图显示,ALVP和CM-ALVP中可能同时具有α型糖苷键和β型糖苷键,而Se-ALVP具有β型糖苷键,可能是修饰过程中化学试剂对糖苷键的攻击导致的异构化。抗氧化、降血糖实验结果显示,CM-ALVP和Se-ALVP抗氧化、降糖能力明显提升,表明修饰后出现的新基团或结构变化能够更多地参与抗氧化反应机制,更好地作用于血糖调节系统,这表明通过化学修饰引入特定的官能团,改变多糖的化学结构,可优化其生理功能,这为开发功能性食品、药物提供了思路。
O峰表明修饰成功。NMR谱图显示,ALVP和CM-ALVP中可能同时具有α型糖苷键和β型糖苷键,而Se-ALVP具有β型糖苷键,可能是修饰过程中化学试剂对糖苷键的攻击导致的异构化。抗氧化、降血糖实验结果显示,CM-ALVP和Se-ALVP抗氧化、降糖能力明显提升,表明修饰后出现的新基团或结构变化能够更多地参与抗氧化反应机制,更好地作用于血糖调节系统,这表明通过化学修饰引入特定的官能团,改变多糖的化学结构,可优化其生理功能,这为开发功能性食品、药物提供了思路。
尽管本研究通过羧甲基化和硒化修饰成功改善了ALVP的理化性质和生物活性,但仍存在一些局限性,例如修饰过程中引入的化学试剂可能带来的潜在毒性尚未深入评估,且当前研究主要集中于多糖的理化性质和体外生物活性,对其在体内的代谢途径、长期安全性和生物效力缺乏详细研究。未来将展开对CM-ALVP和Se-ALVP在细胞和动物模型中的安全性和生物效应测试,以评估其在人体内的应用潜力;探索多糖在复杂生理环境中的稳定性和功能表现;开发绿色合成方法以提高过程的环保性和可持续性;以及尝试与其他天然活性成分联合应用,研究其协同效应,从而进一步增强多糖的生物功能。这些研究将为开发安全高效的多糖基功能性食品和药物提供更加全面的科学依据。
[1] 李梅, 刁治民.青海黄绿蜜环菌营养成分及其可持续利用研究[J].陕西师范大学学报(自然科学版), 2008, 36 (S1):93-98.LI M, DIAO Z M.Study on the nutritive composition in Armillaria luteo-virens and sustainable utilization of Qinghai Province[J].Journal of Shaanxi Normal University(Natural Science Edition),2008, 36 (S1):93-98.
[2] 马琳. 黄绿蜜环菌化学成分及生物活性研究[D].天津:天津大学, 2015.MA L.Study on chemical constituents and bioactivity of Armillaria luteo-virens[D].Tianjin:Tianjin University, 2015.
[3] 刘西周, 王润楠.黄绿蜜环菌的研究进展[J].中国食用菌, 2021, 40 (1):1-6.LIU X Z, WANG R N.Research progress on the Armillaria luteo-virens[J].Edible Fungi of China, 2021, 40 (1):1-6.
[4] 蔡箫, 张颖, 王晓立.黄绿蜜环菌培养基优化及人工培养条件研究[J].安徽农学通报, 2013, 19 (20):33-34;50.CAI X, ZHANG Y, WANG X L.Study on medium optimization of yellow-green Armillaria luteo virens and condition of artificial culture[J].Anhui Agricultural Science Bulletin, 2013, 19 (20):33-34;50.
[5] HU Y B, WANG S Q, SHI Z H, et al.Purification, characterization and antioxidant activity of polysaccharides from Okara[J].Journal of Food Processing and Preservation, 2022, 46(3):e16411.
[6] CHEN F, HUANG G L.Preparation and immunological activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules, 2018, 112:211-216.
[7] CHEN L, HUANG G L.The antiviral activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules, 2018, 115:77-82.
[8] 任二芳, 牛德宝, 刘功德, 等.水果多糖的开发及应用进展[J].农业研究与应用, 2017, 30(2):66-70.REN E F, NIU D B, LIU G D, et al.Development and application of fruit polysaccharide[J].Agricultural Research and Application, 2017, 30(2):66-70.
[9] YUE Y, WU S C, LI Z K, et al.Wild jujube polysaccharides protect against experimental inflammatory bowel disease by enabling enhanced intestinal barrier function[J].Food &Function, 2015, 6(8):2568-2577.
[10] 李灿, 张慧慧, 刘会平, 等.裙带菜多糖羧甲基化修饰及降血糖活性[J].食品研究与开发, 2024,45(6):60-68.LI C, ZHANG H H, LIU H P, et al.Study on carboxymethylation modification and hypoglycemic activity of Undaria pinnatifida polysaccharide[J].Food Research and Development, 2024,45(6):60-68.
[11] 崔芳铭, 毕书瑜, 侯江燕, 等.广叶绣球菌多糖磷酸化修饰及体外抗氧化和降糖活性[J].食用菌学报, 2024, 31(3):51-58.CUI F M, BI S Y, HOU J Y, et al.Phosphorylation of Sparassis latifolia polysaccharides and their antioxidant and hypoglycemic activities in vitro[J].Acta Edulis Fungi, 2024, 31(3):51-58.
[12] BAI L L, ZHU P L, WANG W B, et al.The influence of extraction pH on the chemical compositions, macromolecular characteristics, and rheological properties of polysaccharide:The case of okra polysaccharide[J].Food Hydrocolloids, 2020, 102:105586.
[13] XU J L, ZHANG J C, LIU Y, et al.Rheological properties of a polysaccharide from floral mushrooms cultivated in Huangshan Mountain[J].Carbohydrate Polymers, 2016, 139:43-49.
[14] 杨嘉欣, 李瑶, 黄显健, 等.海带多糖羧甲基化修饰工艺优化及其生物活性研究[J].食品与发酵工业, 2024, 50(18):115-122.YANG J X, LI Y, HUANG X J, et al.Optimization of carboxymethylation modification process and study on biological activity of Laminaria japonica polysaccharide[J].Food and Fermentation Industries, 2024, 50(18):115-122.
[15] 赵迪. 黑木耳多糖对炎性肠病的预防作用及其化学修饰[D].上海:华东理工大学, 2021.ZHAO D.The preventive effect of Auricularia auricular-judae (Bull.) polysaccharide against IBD and its modification[D].Shanghai:East China University of Science and Technology, 2021.
[16] 陈浒华. 黄芪多糖的硒化修饰及其体外抗氧化作用的研究[D].南京:南京农业大学, 2010.CHEN H H.Selenide modification of astragalus polysaccharide and its antioxidant activity in vito[D].Nanjing:Nanjing Agricultural University, 2010.
[17] LIAN K X, ZHU X Q, CHEN J, et al.Selenylation modification:Enhancement of the antioxidant activity of a Glycyrrhiza uralensis polysaccharide[J].Glycoconjugate Journal, 2018, 35(2):243-253.
[18] 张阳, 梅翠, 李会, 等.硒化修饰对白术多糖抗氧化和免疫调节作用的影响[J].中国兽医学报, 2022, 42 (6):1249-1255.ZHANG Y, MEI C, LI H, et al.Effects of selenylation modification on the enhancement of antioxidant capability and immune activity of Atractylodes macrocephala polysaccharide[J].Chinese Journal of Veterinary Science, 2022, 42 (6):1249-1255.
[19] 王俊龙, 江升旗, 刘梦瑶, 等.磷酸化修饰鬼臼果多糖的制备及生物活性[J].精细化工,2025,42(9):1994-2004.WANG J L, JIANG S Q, LIU M Y, et al.Preparation and bioactivity of phosphorylated Podophyllum emodi polysaccharides[J].Fine Chemicals, 2025,42(9):1994-2004.
[20] 陈栅, 冯润芳, 袁野, 等.酸枣多糖羧甲基化修饰及活性研究[J].中国食品学报, 2022, 22(4):55-66.CHEN S, FENG R F, YUAN Y, et al.Studies on carboxy methylation modification and activity of wild jujube polysaccharide[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):55-66.
[21] AN Y Z, LIU H T, LI X X, et al.Carboxymethylation modification, characterization, antioxidant activity and anti-UVC ability of Sargassum fusiforme polysaccharide[J].Carbohydrate Research, 2022, 515:108555.
[22] 李晓娇, 段绍丽, 曹凯红, 等.硒化铁皮石斛多糖的制备工艺及抗氧化活性研究[J].西南农业学报, 2022, 35(7):1548-1554.LI X J, DUAN S L, CAO K H, et al.Preparation process and antioxidant activity of selenium-containing Dendrobium officinale polysaccharide[J].Southwest China Journal of Agricultural Sciences, 2022, 35(7):1548-1554.
[23] 徐海军, 杨洋, 董雅琪, 等.霍山石斛药渣中多糖的提取、乙醇分级沉淀、纯化和分子量测定[J].皖西学院学报, 2022, 38(5):1-6.XU H J, YANG Y, DONG Y Q, et al.Extraction, ethanol fractional precipitation, purification and molecular weight determination of polysaccharides from Dendrobium huoshanense (Dendrobium candidum) drug residue[J].Journal of West Anhui University, 2022, 38(5):1-6.
[24] 王俊龙, 蔺永刚, 时文盼, 等.酶辅助离子液体提取大球盖菇多糖、结构表征及生物活性[J/OL].精细化工, 2024:1-17.(2024-05-10).https://link.cnki.net/doi/10.13550/j.jxhg.20240178.WANG J L, LIN Y G, SHI W P, et al.Extraction process, structural characterization and biological activity of polysaccharides from Stropharia rugosoannulata[J/OL].Fine Chemicals, 2024:1-17.(2024-05-10).https://link.cnki.net/doi/10.13550/j.jxhg.20240178.
[25] 高长久, 李文超, 张朝立, 等.红瑞木果多糖抗氧化活性的初步研究[J].中国中医药现代远程教育, 2024, 22(10):139-141.GAO C J, LI W C, ZHANG C L, et al.Preliminary study on the antioxidant activity of polysaccharides from Swida alba Opiz fruit[J].Chinese Medicine Modern Distance Education of China, 2024, 22(10):139-141.
[26] 郭青枝, 赵二劳, 白建华.沙棘叶提取物抗氧化性能研究[J].化学与生物工程, 2008, 25(3):58-59.GUO Q Z, ZHAO E L, BAI J H.Study on antioxidant performance of extracts of seabuckthorn leaves[J].Chemistry &Bioengineering, 2008, 25(3):58-59.
[27] 马永强, 张一鹏, 王鑫, 等.黄精多糖羧甲基化修饰及其抗氧化活性研究[J].中国食品添加剂, 2023, 34(6):38-47.MA Y Q, ZHANG Y P, WANG X, et al.Carboxymethylation modification of Polygonatum polysaccharide and its antioxidant activity[J].China Food Additives, 2023, 34(6):38-47.
[28] 冯学珍, 覃慧逢, 冯书珍.网地藻多糖对α-葡萄糖苷酶体外抑制作用的研究[J].食品研究与开发, 2020, 41(3):35-40.FENG X Z, QIN H F, FENG S Z.Study on inhibition kinetics of polysaccharide from Dictyota dichotoma on α-glucosidase[J].Food Research and Development, 2020, 41(3):35-40.
[29] LYU T T, LIU X, TAO J, et al.Ultrasound-assisted enzymatic extraction of polysaccharides from Paulownia flowers:Process optimization, structural characterization, antioxidant and hypoglycemic activities[J].Microchemical Journal, 2024, 199:109940.
[30] 寇德正, 林秀贤, 李伟, 等.硒化修饰对多糖的分子构象、物理特性和生理功能的影响[J].食品与发酵工业, 2024, 50 (19):361-370.KOU D Z, LIN X X, LI W, et al.Effects of selenide modification on molecular conformation, physical properties and physiological functions of polysaccharides[J].Food and Fermentation Industries, 2024, 50 (19):361-370.
[31] WANG W, LIU J Y, XU H W, et al.Characterization and comparison of carboxymethylation and TEMPO-mediated oxidation for polysaccharides modification[J].International Journal of Biological Macromolecules, 2024, 256:128322.
[32] YUAN M H, HUANG X Y, TIAN S, et al.Selenized modification and structural characterization of Pleurotus eryngii polysaccharides and their immunomodulatory activity[J].Process Biochemistry, 2024, 144:97-111.
[33] 张嫱. 木蹄层孔菌胞外多糖的结构表征、化学修饰及生物活性研究[D].合肥:合肥工业大学, 2022.ZHANG Q.Structure characterization, modification andbioactivities of exopolysaccharide from Fomes fomenta[D].Hefei:Hefei University of Technology, 2022.
[34] GAO N B, ZHANG W J, HU D J, et al.Study on extraction, physicochemical properties, and bacterio-static activity of polysaccharides from Phellinus linteus[J].Molecules, 2023, 28(13):5102.
[35] MA Y Q, XIU W Y, WANG X, et al.Structural characterization and in vitro antioxidant and hypoglycemic activities of degraded polysaccharides from sweet corncob[J].Journal of Cereal Science, 2022, 108:103579.
[36] 沈琴, 路乐乐, 潘票, 等.黑木耳硒化多糖制备、结构及体外活性分析[J].食品工业科技, 2025, 46(10):250-259.SHEN Q, LU L L, PAN P, et al.Preparation, structure and in vitro activity analysis of selenopolysaccharide from Auricularia[J].Science and Technology of Food Industry, 2025, 46(10):250-259.
[37] 边鹏, 杜刚, 柴雨阳, 等.羧甲基化、磷酸化薰衣草多糖理化性质和抗氧化活性[J].精细化工, 2025,42(6):1286-1294.BIAN P, DU G, CHAI Y Y, et al.Physicochemical properties and antioxidant activity of carboxymethylated and phosphorylated Lavandula polysaccharides[J].Fine Chemicals, 2025,42(6):1286-1294.
[38] ABUDUWAILI A, NUERXIATI R, MUTAILIFU P, et al.Isolation, structural modification, characterization, and bioactivity of polysaccharides from Folium Isatidis[J].Industrial Crops and Products, 2022, 176:114319.
[39] 张翼飞. 香加皮多糖衍生物的制备及保润效果研究[D].郑州:河南农业大学, 2019.ZHANG Y F.Periplocae polysaccharide derivative perparation and moisturizing effect study[D].Zhengzhou:Henan Agricultural University, 2019.
[40] 张洁, 张巧铃, 卢凤来, 等.罗汉果根多糖的分离纯化及免疫活性研究[J].中草药, 2024, 55 (4):1100-1109.ZHANG J, ZHANG Q L, LU F L, et al.Isolation, purification and immunomodulatory activity of polysaccharides from roots of Siraitia grosuenorii[J].Chinese Traditional and Herbal Drugs, 2024, 55 (4):1100-1109.
[41] 毛子俊,王金兰,张树军,等.干鲜2种马齿苋多糖的提取及其抗氧化活性与吸湿保湿性能研究[J].中国野生植物资源, 2024, 43 (11):1-10.MAO Z J, WANG J L, ZHANG S J, et al.Study on the extraction of polysaccharides from dry and fresh Portulaca oleracea and their antioxidat, hygroscopic and moisturizing properties[J].Chinese Wild Plant Resources, 2024, 43 (11):1-10.
[42] NUERXIATI R, ABUDUWAILI A, MUTAILIFU P, et al.Optimization of ultrasonic-assisted extraction, characterization and biological activities of polysaccharides from Orchis chusua D.Don (Salep)[J].International Journal of Biological Macromolecules, 2019, 141:431-443.
[43] CHEN T T, ZHANG Z H, WANG Z W, et al.Effects of ultrasound modification at different frequency modes on physicochemical, structural, functional, and biological properties of citrus pectin[J].Food Hydrocolloids, 2021,113:106484.
[44] CHEN L, HUANG G L.Extraction, characterization and antioxidant activities of pumpkin polysaccharide[J].International Journal of Biological Macromolecules, 2018, 118:770-774.
[45] CAO C L, HUANG Q, ZHANG B, et al.Physicochemical characterization and in vitro hypoglycemic activities of polysaccharides from Sargassum pallidum by microwave-assisted aqueous two-phase extraction[J].International Journal of Biological Macromolecules, 2018, 109:357-368.
[46] 唐婷. 地黄多糖提取纯化、结构表征及生物活性研究[D].贵阳:贵州师范大学, 2023.TANG T.Extraction, purification, structural characterization andbioactivity of polysaccharides from Rehmannia glutinosa Libosch[D].Guiyang:Guizhou Normal University, 2023.
[47] 张娜, 刘扬, 陈小强, 等.化学修饰植物多糖的生物活性及其在食品领域中的应用研究进展[J].食品工业科技, 2025, 46(7):375-384.ZHANG N, LIU Y, CHEN X Q, et al.Research progress on chemically modified plant polysaccharides:Bioactivities and applications in the food industry[J].Science and Technology of Food Industry, 2025, 46(7):375-384.
[48] LIU Y T, YOU Y X, LI Y W, et al.The characterization, selenylation and antidiabetic activity of mycelial polysaccharides from Catathelasma ventricosum[J].Carbohydrate Polymers, 2017, 174:72-81.