核桃中蛋白质含量约为15%~22%,核桃蛋白(walnut protein isolate,WPI)含有丰富的人体必需氨基酸,尤其是精氨酸、谷氨酸、组氨酸和酪氨酸,还具有优异的抗氧化、抗高血压和抗癌特性[1-2]。然而WPI中谷蛋白含量较高(70.11%),其溶解度低,从而使WPI的功能性质较差,限制了WPI在食品工业中的应用。
pH偏移是一种简便有效的加工方法,已广泛用于修饰蛋白质结构以实现理想的功能特性,即将蛋白质暴露于极端碱性或者酸性pH的条件下,使蛋白质的结构部分展开,亚基解离,然后重新调整pH至中性,使蛋白质的结构重新折叠[3]。经过pH偏移处理,蛋白质两亲性增强,但仍保持相对紧凑的状态。pH偏移可能会导致其三级结构的一些损失,但能在很大程度上保留了蛋白质的二级结构,进而改善蛋白质的功能特性,如溶解性、乳化性等[4]。TIAN等[5]利用pH偏移方法对大豆7S球蛋白进行处理,结果表明,pH偏移改变了7S球蛋白的构象和界面黏弹性,提高了其在界面处的吸附能力和乳液在热处理下的稳定性。YU等[6]利用加热辅助pH偏移对蛋清蛋白进行修饰,结果表明,pH偏移使蛋清蛋白的结构展开、疏水性基团暴露,从而形成更多非共价键,增强了蛋清蛋白的乳化特性,其形成的乳液在加热和盐离子条件下具有优异的稳定性。
与单一蛋白质或多糖粒子相比,使用蛋白多糖复合粒子作为Pickering稳定剂可以进一步提高Pickering乳液的性能和稳定性。与多糖的复合可能会改变蛋白质的亲疏水性,改善其界面性质,使其更利于吸附和稳定于界面,提高Pickering乳液的稳定性[7]。通常,可以通过改变复合粒子中所含组分的种类和比例以及制备方法或制备条件(如pH、离子强度)来调节复合粒子的功能特性和乳化性能,从而使复合粒子更适合于Pickering乳液的构建。YI等[8]利用静电相互作用制备的豌豆分离蛋白-高甲氧基果胶复合粒子,可用于制备高内相Pickering乳液,所制备的乳液在不同环境压力下均表现出良好的稳定性,且对负载的β-胡萝卜素具有较高的生物可及性。JIANG等[9]使用超声/pH偏移组合方法制备豌豆分离蛋白-菊粉缀合物,与单独的蛋白质相比,缀合物制备的高内相Pickering乳液油滴粒径更小、更均匀,且乳液具有更高的黏度、弹性和触变恢复性,更适用于作为3D打印油墨。目前已有许多核桃蛋白Pickering乳液的研究,然而关于核桃蛋白和羧甲基壳聚糖(carboxymethyl chitosan,CMCS)稳定的高内相Pickering乳液尚未见报道。
因此,本文以WPI、CMCS为原料,通过pH偏移预处理,改善WPI的性能,制备WPI-CMCS复合物,并对复合物的结构和性质进行表征,探究其稳定Pickering乳液的潜力,以期为WPI在乳化体系的应用提供参考。
1 材料与方法
1.1 材料与试剂
核桃蛋白,健肽生物科技(山西)有限公司;羧甲基壳聚糖,上海麦克林生化科技股份有限公司;大豆油,金龙鱼粮油食品股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS),天津市科密欧化学试剂有限公司;尼罗红,上海源叶生物科技有限公司;异硫氰酸荧光,索莱宝生物科技有限公司。
1.2 仪器与设备
F18高速剪切乳化均质机,上海弗鲁克科技发展有限公司;LGJ-25E真空冷冻干燥机,北京市四环科学仪器有限公司;BeNano 90 zeta纳米粒度及zeta电位分析仪,丹东百特仪器有限公司;UV-2700I紫外可见分光光度计、RF-6000荧光分光光度计,岛津仪器(苏州)有限公司;WQF-510A傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析仪,美国赛默飞世尔科技公司;TESCAN MIRA LMS扫描电子显微镜(scanningelectronmicroscope,SEM),泰思肯有限公司;FV3000激光共聚焦显微镜(confocal laser scanning microscope,CLSM),奥林巴斯公司;DSA100光学接触角测量仪,克吕士科学仪器有限公司;ML31生物显微镜,广州市明美光电技术有限公司。
1.3 实验方法
1.3.1 WPI-CMCS复合物制备
WPI母液:取一定量的WPI分散于去离子水中,室温搅拌30 min,获得WPI原液,然后用1 mol/L的NaOH溶液分别调节pH值至8、9、10、11、12、13,磁力搅拌2 h,使蛋白结构充分展开,接着用0.1 mol/L的HCl溶液将不同pH的WPI溶液缓慢调节pH至中性,磁力搅拌2 h,得到质量浓度为20.0 g/L的WPI母液,置于4 ℃冰箱中冷藏过夜,使其充分水化,未经pH偏移处理的记为pH 7。
CMCS母液:取一定量的CMCS分散于去离子水中,制备出CMCS质量浓度为8.0 g/L的母液,磁力搅拌2 h,接着将溶液放置于4 ℃冰箱中过夜,使其充分水化。
WPI-CMCS复合物制备:将相同体积的WPI母液和CMCS母液混合,使最终复合溶液中WPI质量浓度为10.0 g/L,CMCS质量浓度为4.0 g/L,磁力搅拌30 min后,在去离子水中形成WPI与CMCS自组装形成的WPI-CMCS复合物,复合物溶液于4 ℃下保存用于后续试验。
1.3.2 浊度测定
参考赵茹[10]的方法,使用紫外-可见分光光度计,以去离子水作为空白对照,在600 nm波长下测量不同pH预处理后复合物溶液的吸光度值。
1.3.3 粒径和电位测定
参考JI等[11]的方法,使用纳米粒度及zeta电位分析仪,测量不同pH预处理后复合物的平均粒径和zeta电位。测量前所有样品用去离子水稀释100倍,以防止多重散射效应,在25 ℃下平衡2 min,然后进行测定,每个样品都重复测定3次。
1.3.4 FTIR分析
参考XIE等[12]的方法,称取2 mg冻干的WPI、CMCS和WPI-CMCS粉末与干燥的KBr按照质量比(1∶100)混合,用红外压片机将研磨均匀后的固体粉末压成1 mm厚的薄片。然后用FTIR仪测量不同样品的FTIR光谱,环境温度为25 ℃,扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32次,以空气为采集背景。然后采用Peak Fit软件对酰胺Ⅰ(1 600~1 700 cm-1)进行二阶倒数峰拟合,获得复合物的二级结构信息。
1.3.5 内源荧光光谱分析
参照ZHU等[13]的方法,对不同复合物样品的荧光光谱进行测定,并略作修改。用去离子水将样品稀释500倍,使用荧光光谱仪进行波长扫描。参数设置为激发波长280 nm,发射波长300~450 nm,狭缝宽度5 nm。
1.3.6 表面疏水性测定
参考XIE等[12]的方法,将不同复合物样品溶液稀释到蛋白质质量浓度为1 mg/mL,取5 mL样品溶液与50 μL 8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(8.0 mmol/L,pH 7.0)充分混匀,避光反应20 min,然后利用荧光光谱仪进行扫描,激发波长390 nm,发射波长470 nm,狭缝宽度设置为5 nm,温度为25 ℃。
1.3.7 三相接触角测量
参考赵巧丽[14]的方法,采用光学接触角测量仪测量不同WPI-CMCS复合颗粒的三相接触角(θ)。首先用红外压片机将冷冻干燥后的复合物粉末样品压成2 mm×13 mm的薄片,然后放置于装有大豆油的透明玻璃池中,静置5 min排出气泡,然后通过自动进样系统,将2 μL的去离子水滴在样品表面,接着用摄像机捕捉液滴轮廓,并拍照记录液滴形状变化,最后用软件自带应用程序通过杨氏-拉普拉斯方程计算出复合物的三相接触角。
1.3.8 动态界面张力测定
参考WANG等[15]的方法,采用光学接触角测量仪测量不同WPI-CMCS复合物溶液与大豆油之间的动态界面张力(γ),基于悬滴法观察界面张力随时间的变化规律。首先将装有复合物溶液的注射器针头伸入纯化后的大豆油中,然后由自动进样器将15 μL的复合物溶液注入油中,在针头处形成一滴悬挂的复合物液滴,随后记录液滴形成后的轮廓图像,采用软件对图像进行分析,根据杨氏-拉普拉斯方程拟合计算得到界面张力。测定过程均在25 ℃的环境下进行,连续测定7 200 s,记录界面张力随时间的动态变化。界面压力计算如公式(1)所示:
π=γ0-γ
(1)
式中:π,界面压力,mN/m;γ,样品的界面张力,mN/m;γ0,纯水的界面张力,mN/m。
界面压力随时间的变化规律可以用Ward和Tordai方程的改进形式计算如公式(2)[16]所示:
π=2C0KT(Dt/3.14)1/2
(2)
式中:C0,连续相的质量浓度,g/mL;K,波兹曼常数;T,绝对温度,K;t,时间,s;D,扩散系数。
蛋白质在界面处的渗透和重排可以用一阶方程公式(3)[17]描述:
ln[(πf-πt)/(πf-π0)]=-kit
(3)
式中:πf,7 200 s时的界面压力,mN/m;π0,0 s时的界面压力,mN/m;πt,任意时刻的界面压力,mN/m;ki,一阶速率常数;t,时间,s。
1.3.9 SEM观察
参考ZHU等[18]的方法,WPI-CMCS复合物溶液经真空冷冻干燥后的样品喷金几秒钟,然后利用SEM观察不同WPI-CMCS复合物的微观形态。
1.3.10 乳化活性(emulsification activity index,EAI)和乳化稳定性(emulsification stability index,ESI)测定
参考刘晨[19]的方法,取21 mL复合物溶液和7 mL大豆油置于50 mL离心管中,用高速剪切分散机在16 000 r/min的转速下混合2 min,制备好乳液后立即从离心管底部收集50 μL乳液,并用1 g/L SDS溶液稀释至500倍,接着使用紫外-可见分光光度计测量不同样品在500 nm处的吸光度值,用SDS溶液作为空白对照。10 min后从底部重新吸取50 μL乳液,稀释后测定吸光度值。EAI和ESI计算分别如公式(4)和公式(5)所示:
(4)
(5)
式中:C,蛋白质质量浓度,g/mL;φ,油相体积分数;L,比色皿光程,1 cm;N,稀释倍数,100;A0,0 min时测得稀释乳液的吸光度值;A10,10 min时测得稀释乳液的吸光度值。
1.3.11 Pickering乳液的制备
以经不同pH偏移预处理的WPI-CMCS复合物溶液作为水相,大豆油作为油相,油相体积分数为75%,用高速剪切乳化均质机在16 000 r/min的转速下均质2 min,制备高内相Pickering乳液。
1.3.12 乳液光学显微镜观察
参考YI等[20]的方法,将新鲜制备的WPI-CMCS Pickering乳液用去离子水稀释3倍,然后取少量稀释后的乳液用光学显微镜观察其微观结构和形态。
1.3.13 CLSM观察
参考ZHANG等[21]的方法,通过CLSM观察WPI-CMCS Pickering乳液的微观结构,取1 mL新鲜制备的乳液,然后分别加入15 μL的尼罗红(0.1 mg/mL)和FITC(1 mg/mL),混合均匀后避光染色20 min,通过CLSM观察并记录WPI-CMCS Pickering乳液的微观图像。
1.3.14 Pickering乳液的储存稳定性
参考蒋晓芬[22]的方法。将新鲜制备的Pickering乳液置于样品瓶中于4 ℃密封保存,定期测量乳析层高度,并拍照记录,然后通过公式(6)计算乳液在储存期间的乳析指数(creaming index,CI),以此来评估乳液的储存稳定性。将乳液用质量分数为1%SDS溶液适当稀释,然后用激光粒度分布仪测量新鲜乳液以及储存120 d后乳液的平均粒径。
(6)
式中:Hs,下层清液的高度;Ht,乳液的总高度。
1.4 数据统计与分析
所有试验重复测量3次,试验数据采用SPSS 27进行显著性分析(P<0.05,显著),采用Origin 2024作图。
2 结果与分析
2.1 pH偏移对WPI-CMCS浊度的影响
浊度是表征复合物形成的常见方法,而且浊度的变化与复合物的数量和尺寸有着紧密的关系[23]。如图1所示,随着pH的增加(pH 8~13),复合物的浊度由(0.90±0.01)逐渐降低至(0.14±0.01),显著低于未经pH偏移预处理的复合物(1.14±0.03),这是因为在碱性条件下,蛋白质结构展开,暴露出内部的疏水位点,在pH回调后以紧密的方式结合,与糖复合后形成可溶性复合物,且随着pH的升高,蛋白结构展开程度升高,暴露出更多的疏水位点,pH回调后与多糖形成的复合颗粒结构更加紧密。浊度结果初步表明,经过pH偏移预处理后,WPI和CMCS可能结合并形成了复合颗粒。
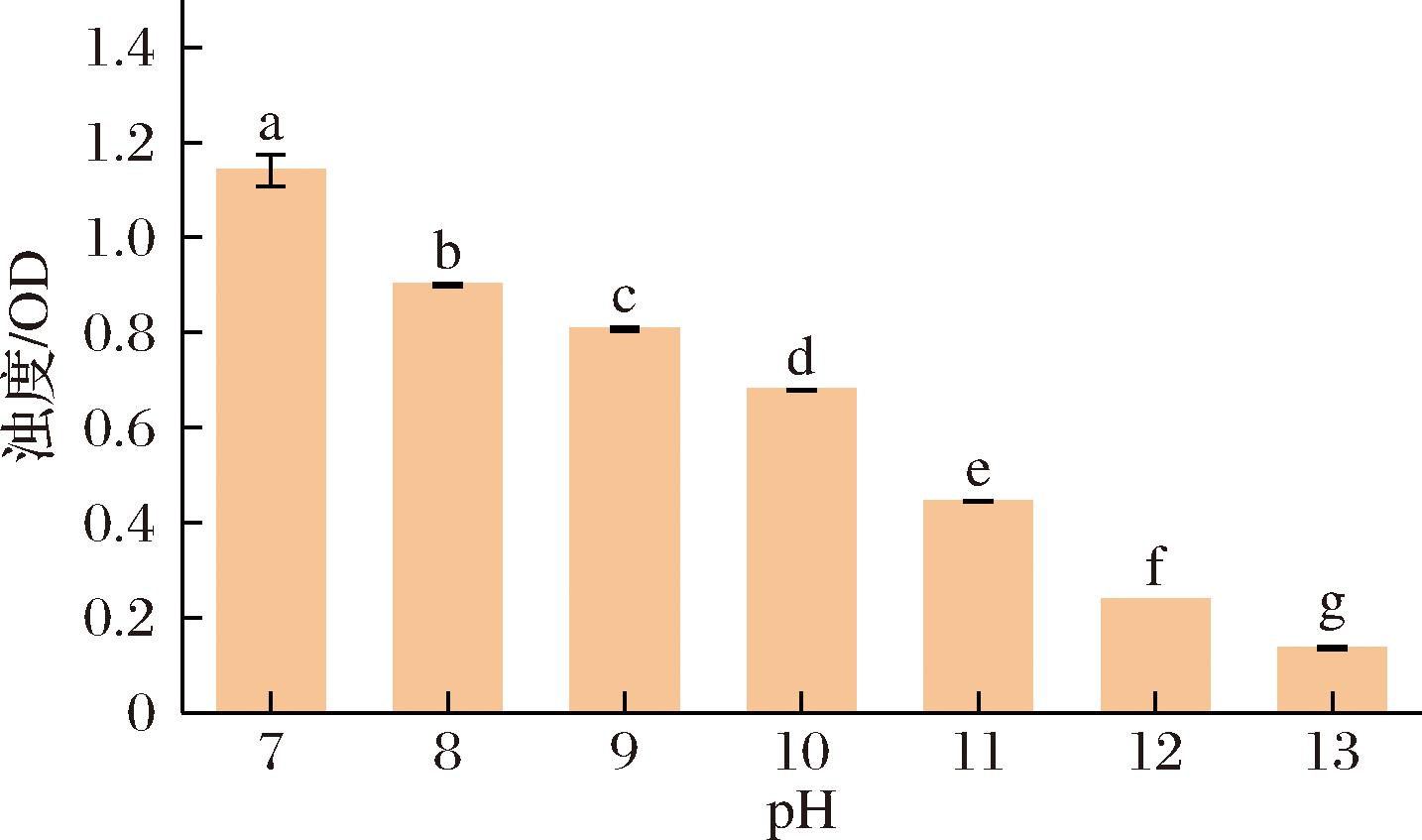
图1 不同pH偏移预处理后WPI-CMCS复合物的浊度
Fig.1 Turbidity of WPI-CMCS complexes after pretreatment with different pH shifts
注:图中不同小写字母表示差异显著(P<0.05)(下同)。
2.2 pH偏移对WPI-CMCS粒径和电位的影响
由图2-a中可知,经过pH偏移,复合物的平均粒径从(1 016.27±8.15) nm显著降低至(211.15±3.09) nm。这是由于蛋白质在碱性状态下亚基解离,暴露出内部的疏水位点,在pH回调后以更紧密的方式结合,粒径降低。而且随着碱性pH的升高,复合颗粒平均粒径继续下降,可能是由于蛋白结构在碱性状态下,解离程度不断上升,展开程度更高,暴露出更多的疏水位点,促进了更强的分子间相互作用[24],pH回调后与多糖形成的复合颗粒结构更加紧密。图2-b为pH偏移处理后复合物的zeta电位图,zeta电位反映了复合物的表面携带的电荷,反映了复合物的稳定性,zeta电位值发生改变说明蛋白质结构的改变,蛋白质表面暴露出不同数量的带电基团[25]。随着pH的增加,复合物的zeta电位绝对值由(34.12±0.70) mV逐渐增至(47.51±0.76) mV,表面负电荷的数量增加,当pH 11时复合物的zeta电位绝对值最大,为(47.51±0.76) mV,复合物最稳定,这是因为当pH逐渐远离蛋白质等电点时,蛋白质带电氨基酸残基中电荷逐渐增多,静电斥力增强。当静电斥力增加到一定程度时,会破坏原本维持蛋白结构的其他相互作用,导致蛋白质结构展开和亚基解离[26],从而使更多的带电基团从蛋白质内部迁移到表面,zeta电位值增大,提高了体系的稳定性[27]。粒径的减小和zeta电位的升高表明了pH偏移预处理有效改善了WPI的水分散性,形成了稳定的亲水性复合物,这也与浊度的结果一致。
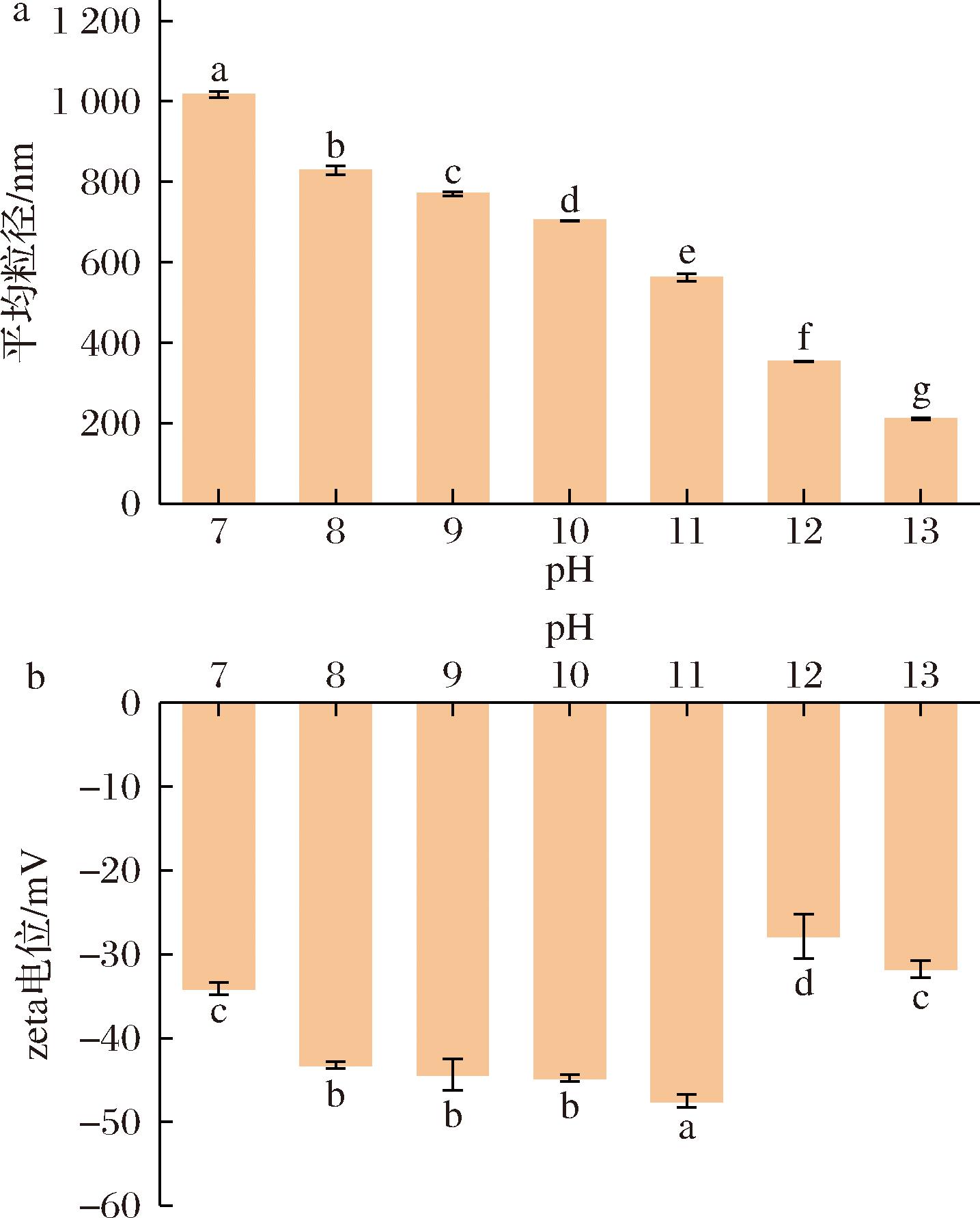
a-粒径;b-电位
图2 不同pH偏移预处理后WPI-CMCS复合物的粒径和zeta电位
Fig.2 Particle size and zeta potential of WPI-CMCS complexes after pretreatment with different pH shifts
2.3 pH偏移对WPI-CMCS FTIR光谱和二级结构的影响
图3-a为不同pH偏移预处理后WPI-CMCS复合物的FTIR光谱,WPI-CMCS复合物在3 200~3 500 cm-1出现的较宽的羟基吸收峰,主要是由O—H 和N—H伸缩振动引起的,随着pH的改变,羟基吸收峰从3 346 cm-1红移至3 370 cm-1,这表明WPI和CMCS分子间形成了氢键[28]。2 929 cm-1处的吸收峰是由C—H伸缩振动引起的,最大吸收峰向短波长方向移动(由2 930 cm-1移至2 928 cm-1),说明WPI和CMCS分子间存在疏水相互作用[3]。酰胺I(1 600~1 700 cm-1)吸收峰主要是由C![]() O拉伸振动引起的,最大吸收峰由1 647 cm-1移至1 654 cm-1,表明WPI与CMCS之间存在静电相互作用[3, 29]。因此,氢键、疏水相互作用和静电相互作用是WPI和CMCS结合的主要原因。
O拉伸振动引起的,最大吸收峰由1 647 cm-1移至1 654 cm-1,表明WPI与CMCS之间存在静电相互作用[3, 29]。因此,氢键、疏水相互作用和静电相互作用是WPI和CMCS结合的主要原因。
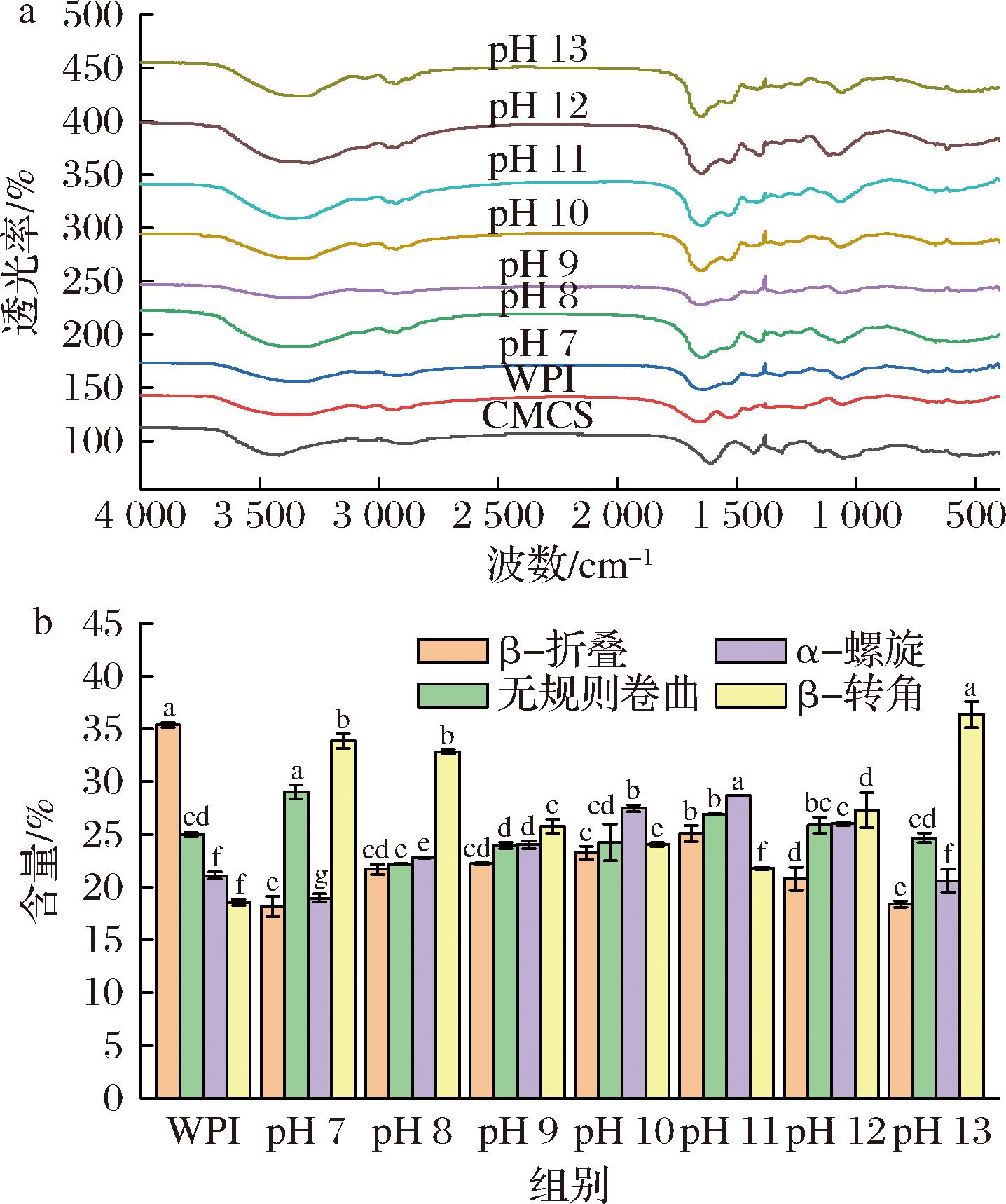
a-FTIR;b-二级结构
图3 不同pH偏移预处理后WPI-CMCS复合物的FTIR光谱和二级结构含量
Fig.3 FTIR spectra and secondary structure contents of WPI-CMCS complexes after pretreatment with different pH shifts
不同pH偏移预处理后WPI-CMCS复合物的二级结构含量如图3-b所示,pH偏移对WPI-CMCS二级结构的影响主要体现在α-螺旋从(18.97±0.39)%增加至(28.69±0.02)%、β-折叠从(18.14±0.97)%增加至(25.09±0.75)%、β-转角从(33.85±0.70)%降低至(21.78±0.12)%、无规则卷曲从(29.04±0.67)%降低至(26.93±0.05)%。在二级结构中,α-螺旋和β-折叠反映蛋白质分子的有序性,β-转角和无规卷曲反映蛋白质分子的无序性[12, 30]。因此pH偏移可以使WPI有序结构含量升高,无序结构含量降低,蛋白质结构变得更加有序,形成更加紧凑和稳定的复合物,这也解释了复合物粒径减小的原因。
2.4 pH偏移对WPI-CMCS荧光光谱的影响
内源荧光光谱可以反映蛋白质三级结构的变化。如图4所示,随着pH的逐渐增大,WPI-CMCS的荧光强度下降,最大发射波长(339 nm)不变,说明复合物中蛋白内部芳香族氨基酸的极性未发生改变,而荧光强度的降低表明了WPI与CMCS之间发生了相互作用,引起了荧光猝灭,WPI与CMCS形成了稳定的非共价复合物,两者间存在疏水相互作用[23, 31]。这主要是因为经过pH偏移,蛋白质去折叠,使更多疏水基团被暴露,而在随后的折叠过程中,各亚基之间依靠疏水位点更紧密更充分地结合,使荧光基团被更紧密地包裹在重组颗粒内部,导致荧光强度的下降,该结果也与复合颗粒平均粒径的减小相符,形成了更紧密的结构。
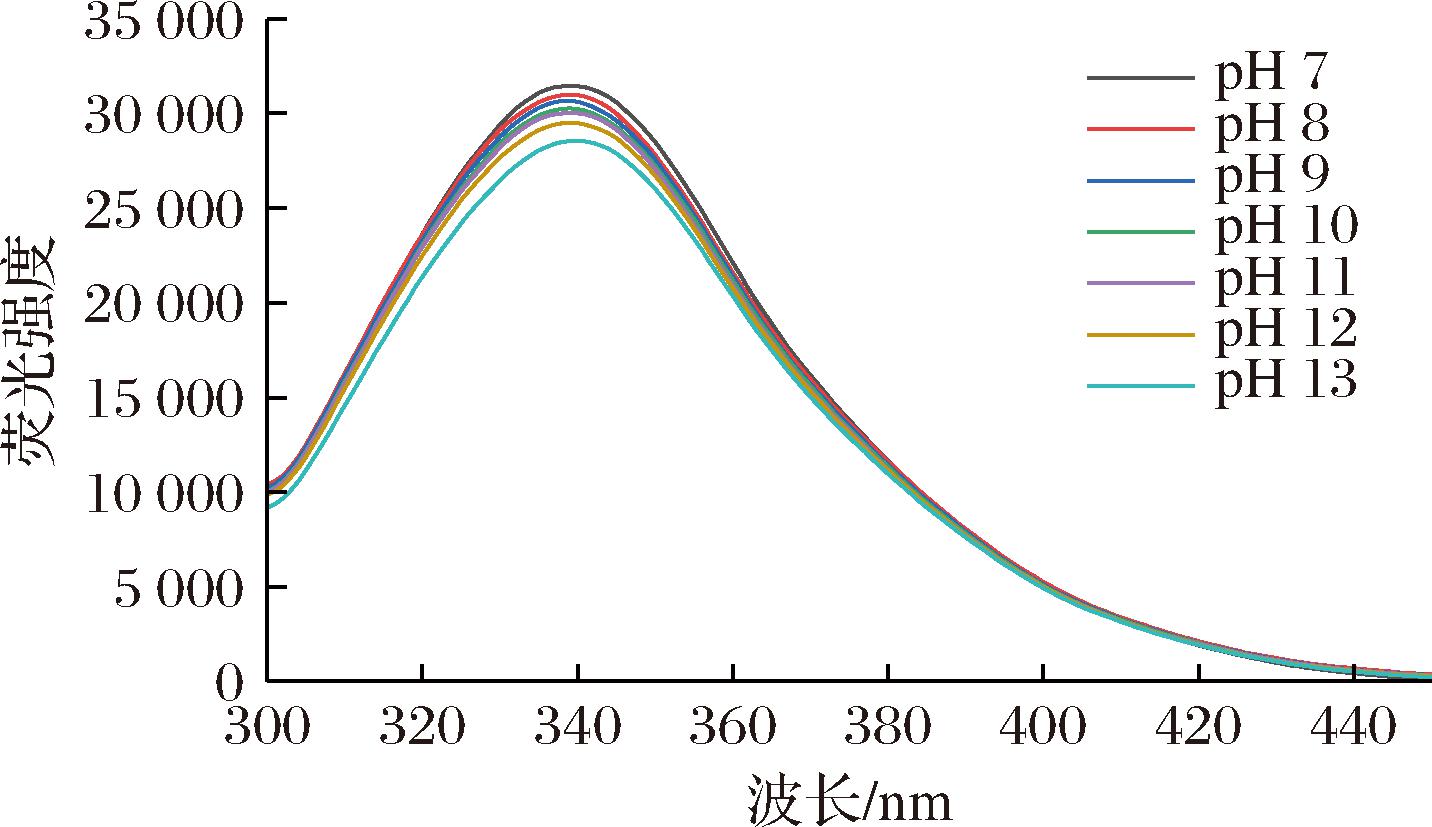
图4 不同pH偏移预处理后WPI-CMCS复合物的荧光光谱
Fig.4 Fluorescence spectra of WPI-CMCS complexes after pretreatment with different pH shifts
2.5 pH偏移对WPI-CMCS表面疏水性的影响
表面疏水性与蛋白质表面性质的改变密切相关,可以直接反映疏水残基在蛋白质表面的分布情况。由图5可知,复合物的疏水性呈先减小后增加的趋势,当pH=11时复合物疏水性最小。这是因为:一方面,经pH偏移处理,蛋白质分子解折叠导致更多的非共价键延伸[32],在pH回调过程中,WPI结构发生折叠,将部分疏水氨基酸包埋于WPI内部,导致疏水性降低。另一方面,WPI与CMCS相互作用导致WPI-CMCS结构紧凑,掩盖了疏水基团,从而使蛋白质表面疏水性氨基酸残基不与ANS结合,导致表面疏水性降低。随着pH继续升高(pH>11),蛋白质的解折叠程度增大,回调过程中仍有更多的疏水基团暴露,增加了表面疏水性。因此,适度的pH偏移预处理可以降低WPI-CMCS的表面疏水性。
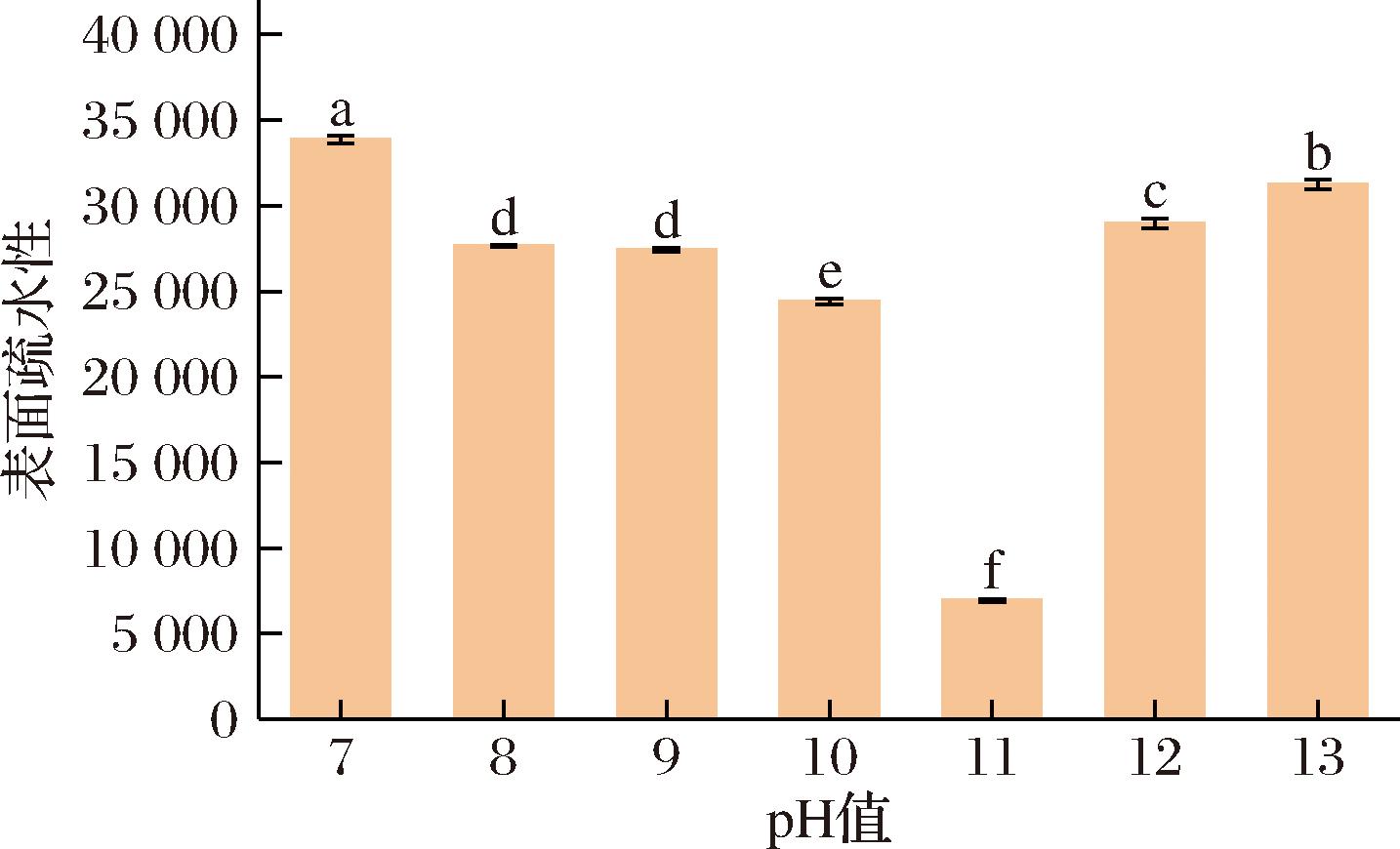
图5 不同pH偏移预处理后WPI-CMCS复合物的表面疏水性
Fig.5 Surface hydrophobicity of WPI-CMCS complexes after pretreatment with different pH shifts
2.6 pH偏移对WPI-CMCS三相接触角的影响
固体颗粒的润湿性是决定Pickering乳液形成和稳定的关键因素,因为它可以反映吸附在油水界面的颗粒的亲疏水性,常用三相接触角来反映固体颗粒的湿润性[18]。疏水性/亲水性较高的粒子不利于Pickering乳液的稳定,因为大多数粒子会浸入油相或水相中,而不是吸附在油水界面上。图6为不同pH偏移预处理后WPI-CMCS的三相接触角,随着pH的增加,复合物的三相接触角逐渐减小,pH值为11时复合物的接触角最小,为(91.2±1.0)°,这时复合物颗粒的湿润性接近中性,两亲性较好,解吸能最大,非常有利于WPI-CMCS在油水界面的吸附,因此界面稳定效果最好,有利于形成稳定的乳液体系[33]。pH>11时,接触角增大,可能是因为过高的pH使更多的疏水性基团暴露,导致接触角增加,这也与疏水性结果一致。因此pH偏移预处理可以降低WPI的疏水性,可以通过调节pH来调节复合物的界面行为。
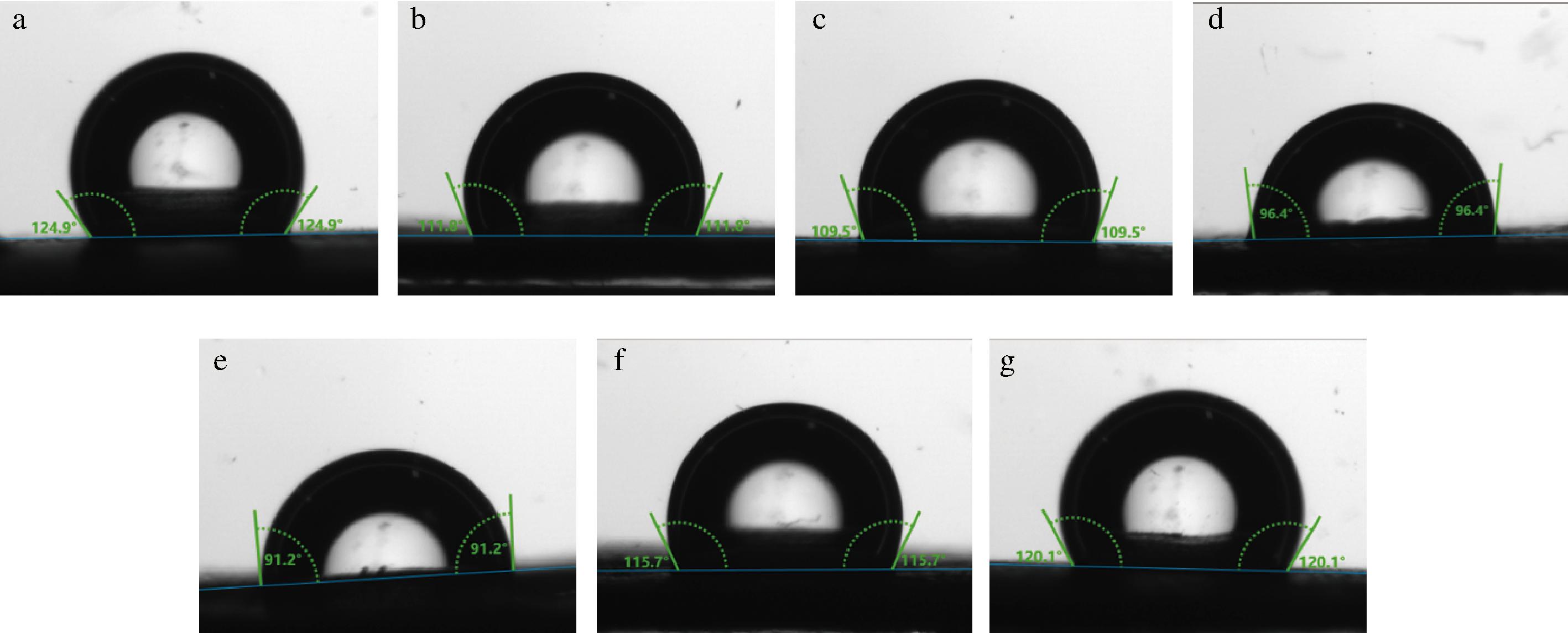
a-pH 7;b-pH 8;c-pH 9;d-pH 10;e-pH 11;f-pH 12;g-pH 13
图6 不同pH偏移预处理后WPI-CMCS复合物的三相接触角
Fig.6 Three-phase contact angles of WPI-CMCS complexes after pretreatment with different pH shifts
2.7 pH偏移对WPI-CMCS界面吸附行为的影响
蛋白质在油水界面的吸附过程可以由蛋白质吸附到油水界面过程中界面压力随时间的变化来表示。如图7-a所示,所有样品的界面压力均随吸附时间的增加而逐渐升高,说明油水界面吸附的复合物量逐渐增加。在吸附初期界面压力迅速增加,表明WPI-CMCS能自发吸附到油水界面上,随后增加速率减慢,这是由于吸附在界面上的蛋白质和多糖逐渐饱和以及吸附静电能垒的增加。pH 11时界面压力最高,表明其乳化所需的能量最低,可以更快地吸附在界面上并重新排列,这可能是因为其接触角接近90°,具有良好的两亲性能。在吸附2 h后,界面压力仍在缓慢增加,说明界面仍未达到吸附平衡状态,这是由于蛋白质和多糖大分子表面活性剂在降低界面张力方面的能力较弱,在界面上的吸附比较缓慢,即使在油-水界面上吸附更长的时间(2~3 d)也很难达到平衡状态。与未经pH偏移预处理的WPI-CMCS相比,经pH偏移预处理的WPI-CMCS界面压力以及界面压力增加的速率明显升高,说明pH偏移预处理改变了复合物的结构,使其有利于在界面上吸附。
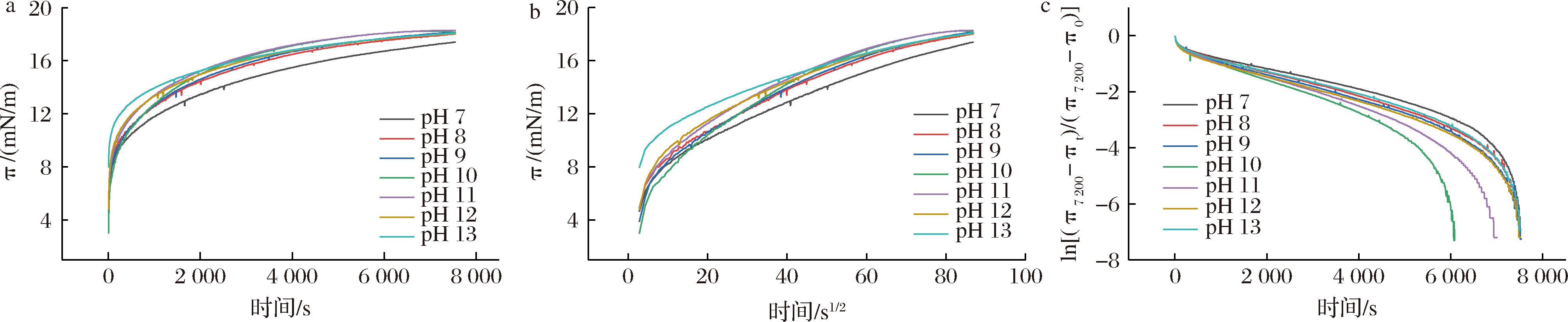
a-界面压力随时间的变化;b-界面压力随时间平方根的变化;c-ln[(π7 200-πt)/(π7 200-π0)]随时间的变化
图7 不同pH偏移预处理后WPI-CMCS复合物的界面吸附行为
Fig.7 Interfacial adsorption behavior of WPI-CMCS complexes after different pH shifts pretreatment
一般而言,胶体颗粒在油水界面的动态吸附主要包括扩散、渗透、重排3个过程。图7-b为界面压力(π)随时间平方根(t1/2)的变化关系,界面压力增加的初始阶段,吸附过程由蛋白质的扩散控制,π与t1/2的关系图为线性,对其直线部分进行拟合,该曲线的斜率即为扩散速率(Kdiff)。胶体分子扩散到界面后,在界面上渗透并重新排列。蛋白质在界面处的渗透和重排可以用一级方程表示[公式(3)],该等式的图像(图7-c)中有2个线性区域,第一线性区域的斜率为一级渗透速率常数(Kp),第二线性区域的斜率为一级重排速率常数(Kr)。不同pH偏移预处理WPI-CMCS的油-水界面吸附动力学参数如表1所示,与不经pH偏移预处理的WPI-CMCS相比,经过pH偏移预处理复合物的Kdiff和Kp显著增加,说明pH偏移使WPI-CMCS的疏水性降低,接触角接近90°,具有良好的两亲性,从而有利于复合物向油-水界面扩散和展开。Kr主要由蛋白质的构象柔韧性决定[34],复合物的Kr随着pH的增加先降低后增加,这可能是因为pH偏移使蛋白质分子去折叠,回调后形成更紧密的结构,蛋白分子构象柔韧性降低,从而降低了重排速率。因此,pH偏移预处理可以改善WPI-CMCS的界面吸附特性,使其可以在界面上快速的吸附并展开。
表1 不同pH偏移预处理后WPI-CMCS复合物在油-水界面的吸附动力学参数
Table 1 Adsorption kinetic parameters of WPI-CMCS complexes at the oil-water interface after pretreatment with different pH shifts
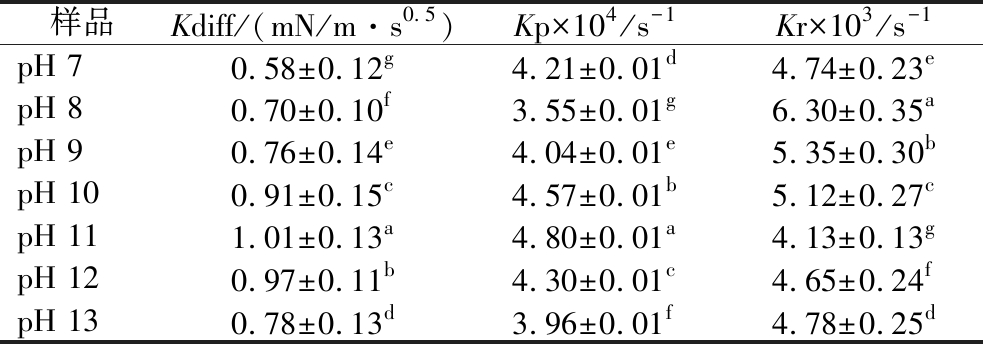
注:不同小写字母表示同列数据间具有显著差异(P<0.05)。
样品Kdiff/(mN/m·s0.5)Kp×104/s-1Kr×103/s-1pH 70.58±0.12g4.21±0.01d4.74±0.23epH 80.70±0.10f3.55±0.01g6.30±0.35apH 90.76±0.14e4.04±0.01e5.35±0.30bpH 100.91±0.15c4.57±0.01b5.12±0.27cpH 111.01±0.13a4.80±0.01a4.13±0.13gpH 120.97±0.11b4.30±0.01c4.65±0.24fpH 130.78±0.13d3.96±0.01f4.78±0.25d
2.8 不同WPI-CMCS的微观形貌
如图8所示,不经pH偏移预处理的复合物SEM图中可以看到蛋白的球形结构,分散均匀,此时的蛋白和多糖并未结合到一起,只是简单的混合分散体系。而经过pH偏移预处理的WPI-CMCS复合物呈现纤维骨架结构,WPI和CMCS通过氢键、疏水、静电相互作用紧密连接,形成紧凑和稳定的结构,且随着pH的增加,纤维骨架结构逐渐增多,复合物结构变得更加紧凑,SEM的结果进一步证实了经过pH偏移预处理,WPI和CMCS通过相互作用结合形成紧密的复合物,这与FTIR和二级结构的结果一致。

a-pH 7;b-pH 8;c-pH 9;d-pH 10;e-pH 11;f-pH 12;g-pH 13
图8 不同pH偏移预处理后WPI-CMCS复合物的SEM图像(10 000×)
Fig.8 SEM images of WPI-CMCS complexes after pretreatment with different pH shifts
2.9 pH偏移对WPI-CMCS乳化性能的影响
EAI以单位质量能够稳定的水包油(oil in water,O/W)界面面积来表征蛋白质的乳化能力,可以反映蛋白质在乳化界面处的吸附能力[35]。ESI与蛋白质在一定时间内维持乳化液物理稳定性的能力有关,可以反映蛋白质抵抗聚集、絮凝等不稳定性的能力[36]。如图9所示,随着pH的增加WPI-CMCS复合物的EAI和ESI都呈先增加后降低的趋势,与不经pH偏移预处理后的复合物相比,经pH偏移处理后,复合物的EAI和ESI都显著提升,且当pH值为11时,复合物的EAI最高,为(180.48±1.50) m2/g,ESI最强,为(99.03±0.93)%,主要是因为pH偏移处理使蛋白质经过解折叠和折叠的过程,蛋白本身的亲/疏水性平衡被破坏,从而改善了蛋白质亲水基团和疏水基团平衡,有利于WPI-CMCS复合物包裹在油滴的表面,促进了WPI-CMCS在油水界面的快速吸附,降低了WPI-CMCS复合物在油水界面的界面张力,从而提升了WPI-CMCS复合物的乳化性能,因此显示出更好的界面特性和稳定性。然而,过高的pH导致蛋白质的表面疏水性和构象柔性下降,使EAI和ESI降低,这也和接触角与界面张力结果一致。
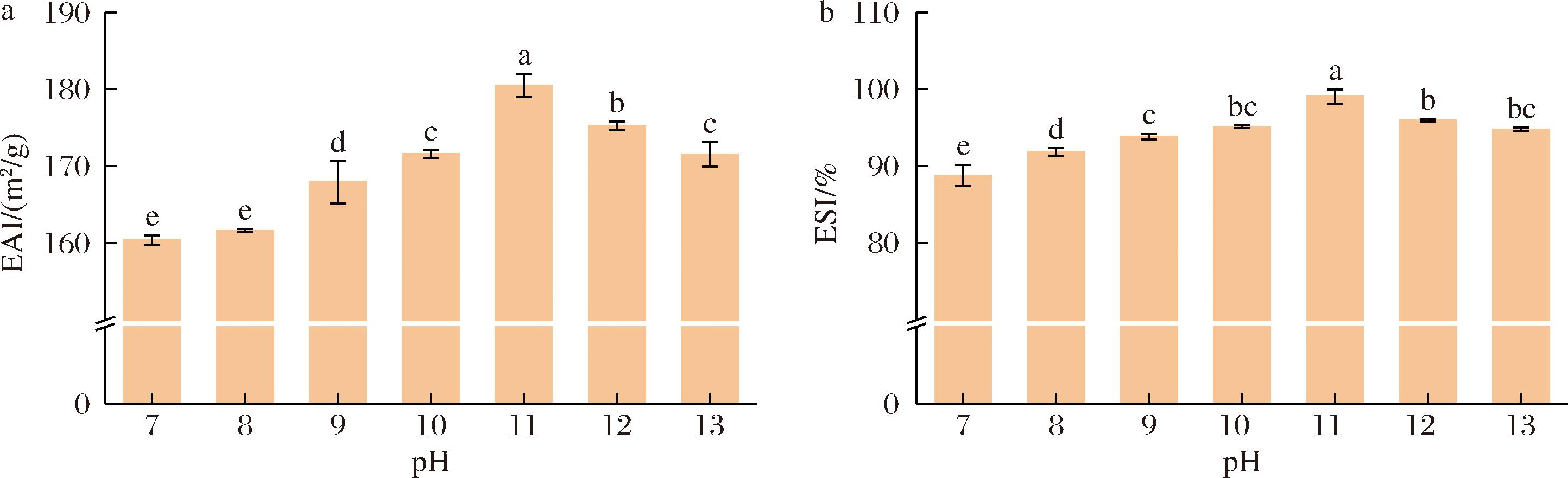
a-EAI;b-ESI
图9 不同pH偏移预处理后WPI-CMCS复合物的EAI和ESI
Fig.9 EAI and ESI of WPI-CMCS complexes after pretreatment with different pH shifts
注:图中不同小写字母表示差异显著(P<0.05)。
2.10 Pickering乳液的光学显微镜观察
如图10所示,乳液液滴间排列紧密,相互堆叠,呈现出典型的高内相乳液的特征。不经pH偏移处理的复合物乳液粒径较大、分布不均匀,随着pH的升高,乳液的粒径呈现逐渐降低的趋势,分布越来越均匀,pH 11时粒径最小,分布最为均匀,主要是因为经过pH偏移预处理,复合物的湿润性和界面性质得到提高,吸附于油滴表面,增强了液滴间的静电斥力,阻止液滴聚集。pH>11时,乳液粒径增加,可能是因为pH>11时复合物的界面活性降低,液滴之间的静电斥力降低和空间位阻降低,从而导致油滴之间发生碰撞,使油滴的聚集程度增大。
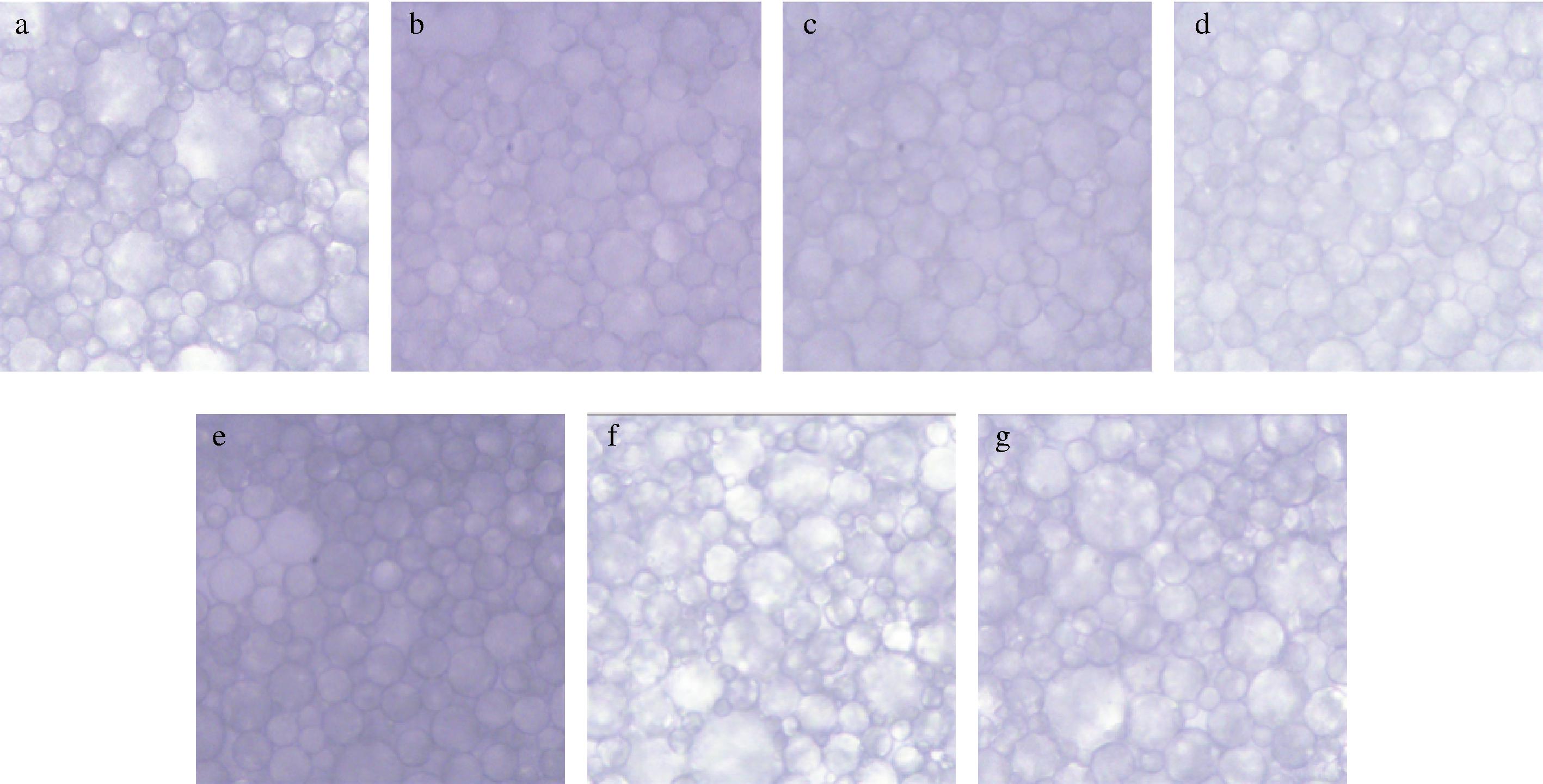
a-pH 7;b-pH 8;c-pH 9;d-pH 10;e-pH 11;f-pH 12;g-pH 13
图10 WPI-CMCS Pickering乳液的光学显微镜图
Fig.10 Optical microscope of WPI-CMCS Pickering emulsion
2.11 Pickering乳液的CLSM观察
如图11所示,可以清楚地观察到连续相中油滴(红色荧光)被蛋白质(绿色荧光)包围,表明Pickering乳液为O/W型乳液。所有Pickering乳液中的油滴都紧密堆积,这也显示出高内相乳液的典型特征。乳液液滴粒径呈现先降低后增加的趋势,pH=11时乳液液滴最小、分布最均匀,这也与光学显微镜结果一致。与不经pH偏移预处理的复合物稳定的Pickering乳液相比,经pH偏移预处理的复合物乳液液滴尺寸更小,且更均匀。油滴表面的绿色荧光形成了致密的界面层,证明了WPI-CMCS复合物在油水界面的有效吸附,形成界面屏障以阻止液滴聚集。绿色荧光占据了液滴之间的空间,这可能是WPI-CMCS复合物在连续相中形成的网络结构,阻碍了液滴之间聚集,提升了乳液的稳定性。
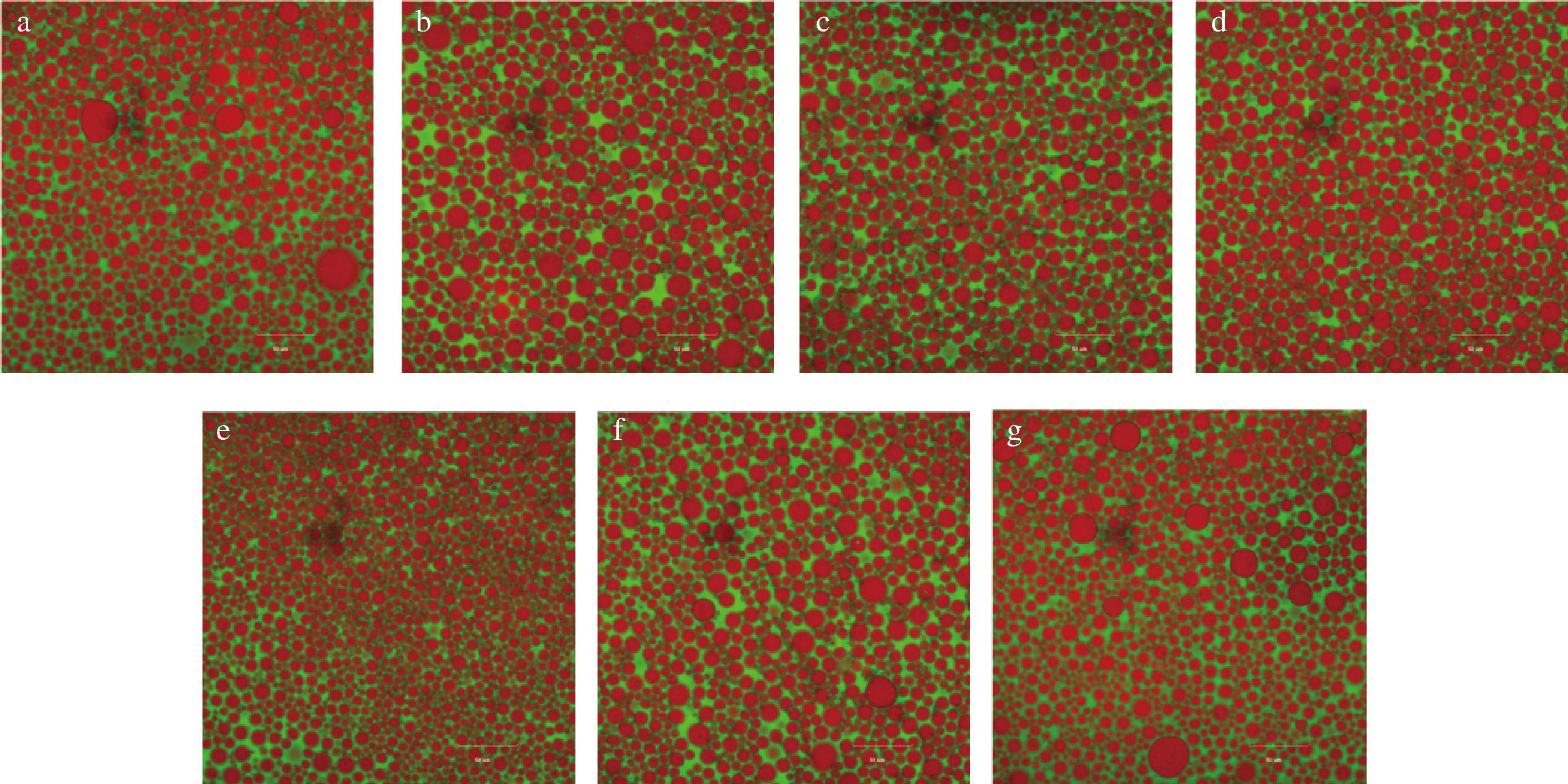
a-pH 7;b-pH 8;c-pH 9;d-pH 10;e-pH 11;f-pH 12;g-pH 13
图11 WPI-CMCS Pickering乳液的CLSM图
Fig.11 CLSM images of WPI-CMCS Pickering emulsions
2.12 Pickering乳液的储存稳定性
储存稳定性是评价乳液稳定性和质量的重要指标之一,如图12所示,新鲜制备的乳液均表现出均匀一致的外观,在7 d的储存过程中,未经pH偏移处理的复合物乳液出现了明显的分层。如图13-a所示,CI值为(10.24±0.02)%,这表明未经pH偏移预处理的复合物乳液稳定性较差,可能是因为油水表面之间没有足够的静电斥力来防止液滴聚集。在储存120 d后,经pH偏移预处理后的复合物稳定的乳液均未出现分层,CI值无明显变化,仍然呈现固体状外观,这表明pH偏移预处理增强了乳液液滴之间的静电斥力和空间位阻,从而阻止液滴之间的相互聚集,提高了WPI-CMCS Pickering乳液的稳定性。乳液储存前后的平均粒径如图13-b所示,经过pH偏移预处理后,乳液粒径显著降低,且pH 11时乳液的粒径最小,为8.74 μm,这也与光学显微镜和激光共聚焦结果一致。储存120 d后,乳液粒径均变大,pH 11预处理的复合物乳液粒径变化较小,仅增加了0.69,相较于其他乳液显示出更强的储存稳定性。

a-0 d;b-1 d;c-7 d;d-15 d;e-30 d;f-60 d;g-90 d;h-120 d
图12 WPI-CMCS Pickering 乳液在4 ℃下储存120 d后的视觉外观
Fig.12 Visual appearance of WPI-CMCS Pickering emulsion after storage at 4 ℃ for 120 days
注:图中从左到右依次为pH 7、pH 8、pH 9、pH 10、pH 11、pH 12、pH 13。
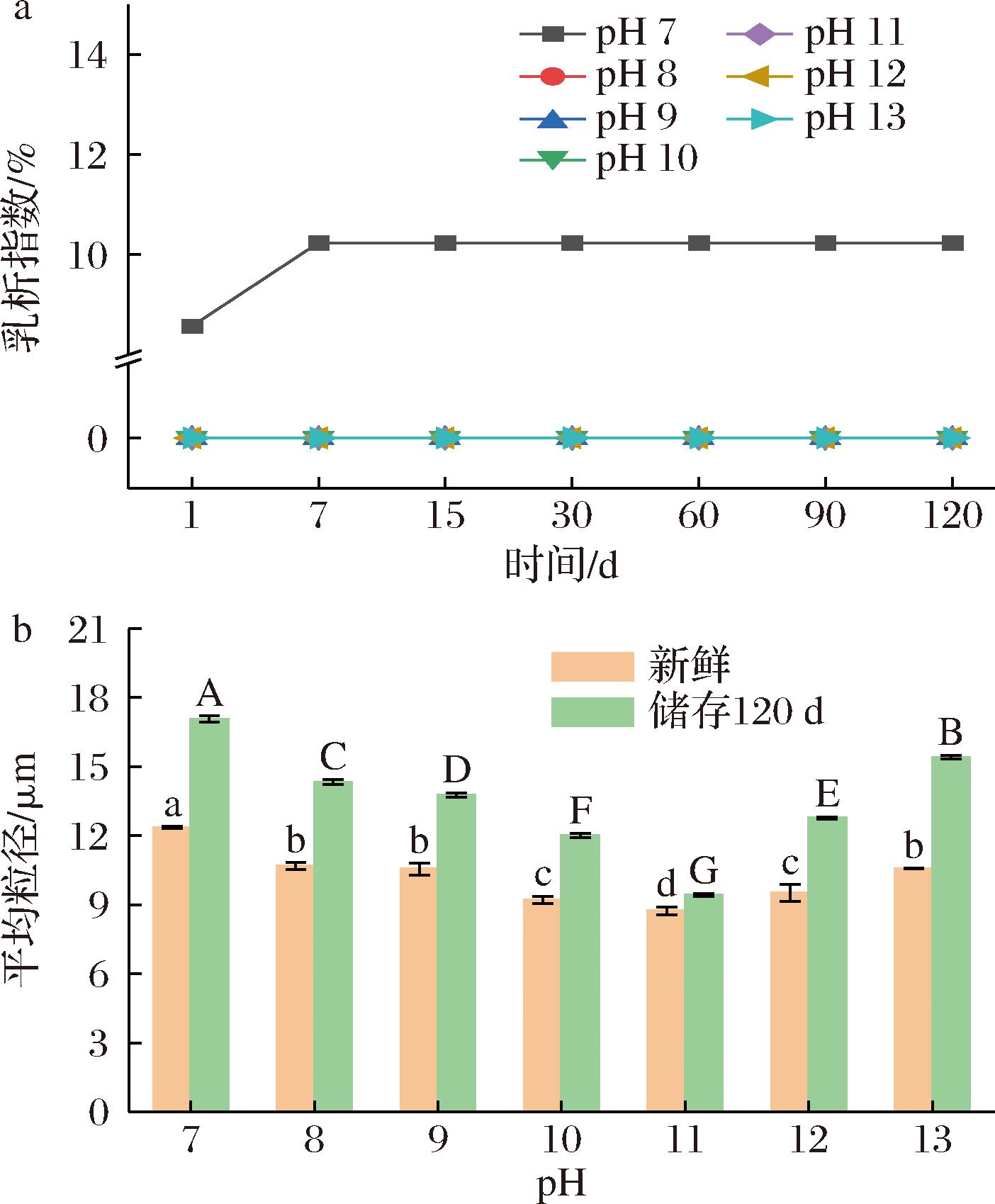
a-乳析指数;b-平均粒径
图13 WPI-CMCS Pickering乳液在4 ℃下储存120 d的乳析指数和平均粒径
Fig.13 The creaming index and average particle size of WPI-CMCS Pickering emulsions stored at 4 ℃ for 120 days
注:图中不同大小写字母表示差异显著(P<0.05)。
3 结论与讨论
pH偏移可以改善WPI的结构和性质,pH偏移预处理使WPI和CMCS通过氢键、静电相互作用、疏水相互作用结合在一起,改善了WPI的乳化性能。经过pH偏移预处理,WPI-CMCS复合物的二级结构中有序结构含量上升、无序结构含量下降,复合物结构变得紧密有序,粒径减小,湿润性增强,界面性质和乳化性能得到提高。与未经pH偏移预处理的WPI-CMCS复合物相比,经过pH偏移预处理的WPI-CMCS复合物具有较好的稳定乳液的能力,乳液在保存4个月以上仍未出现分层。其中,当pH=11时,复合物的电位值最大,湿润性最好,接触角接近90°,此时稳定界面所需的能量最低,EAI和ESI最高,其稳定的乳液也显示出更均匀的粒径大小和分布,相较于其他pH预处理条件下的乳液,pH 11预处理的复合物乳液在经过长期储存后粒径变化较小,显示出更强的稳定性。研究结果可为WPI在乳液体系的应用提供一定的参考。
[1] WEN C T, ZHANG Z Y, CAO L Y, et al.Walnut protein:A rising source of high-quality protein and its updated comprehensive review[J].Journal of Agricultural and Food Chemistry, 2023, 71(28):10525-10542.
[2] LIU L, SHI L S, HU C Y, et al.Walnut protein isolate based emulsion as a promising delivery system enhanced lutein bioaccessibility[J].International Journal of Biological Macromolecules, 2024, 275:133608.
[3] HUANG G, LIU G C, XU Z J, et al.Stability, rheological behavior and microstructure of Pickering emulsions co-stabilized by soy protein and carboxymethyl chitosan[J].Food Hydrocolloids, 2023, 142:108773.
[4] FANG Z, CAI X X, WU J L, et al.Effect of simultaneous treatment combining ultrasonication and pH-shifting on SPI in the formation of nanoparticles and encapsulating resveratrol[J].Food Hydrocolloids, 2021, 111:106250.
[5] TIAN Y, ZHANG Z, ZHANG P P, et al.The role of conformational state of pH-shifted β-conglycinin on the oil/water interfacial properties and emulsifying capacities[J].Food Hydrocolloids, 2020, 108:105990.
[6] YU Y L, GUAN Y, WEN H D, et al.Mild heating assisted alkaline pH shifting modify the egg white protein:The mechanism and the enhancement of emulsifying properties[J].LWT, 2021, 151:112094.
[7] LI X F, DE VRIES R.Interfacial stabilization using complexes of plant proteins and polysaccharides[J].Current Opinion in Food Science, 2018, 21:51-56.
[8] YI J, GAN C, WEN Z, et al.Development of pea protein and high methoxyl pectin colloidal particles stabilized high internal phase Pickering emulsions for β-carotene protection and delivery[J].Food Hydrocolloids, 2021, 113:106497.
[9] JIANG W, LI W H, LI J X, et al.High internal phase emulsions stabilized by pea protein isolate-inulin conjugates:Application as edible inks for 3D printing[J].Food Hydrocolloids, 2023, 142:108820.
[10] 赵茹. 乳清蛋白/豌豆蛋白可溶性复合物制备及在乳液基递送体系中应用[D].长春:吉林大学, 2024.ZHAO R.Preparation of whey protein/pea protein soluble complex and itsapplication in emulsion based delivery system [D].Changchun:Jilin University, 2024.
[11] JI Y, HAN C L, LIU E C, et al.Pickering emulsions stabilized by pea protein isolate-chitosan nanoparticles:Fabrication, characterization and delivery EPA for digestion in vitro and in vivo[J].Food Chemistry, 2022, 378:132090.
[12] XIE M Y, ZHOU C X, LI X, et al.Preparation and characterization of tilapia protein isolate-Hyaluronic acid complexes using a pH-driven method for improving the stability of tilapia protein isolate emulsion[J].Food Chemistry, 2024, 445:138703.
[13] ZHU Q Q, PEI J F, CHEN W J, et al.Conjugation of coconut protein with ferulic acid promotes interfacial adsorption and mitigates lipid oxidation in O/W emulsion[J].Food Hydrocolloids, 2024, 156:110371.
[14] 赵巧丽. 紫苏粕蛋白基高内相乳液体系的构建、表征及其性能研究[D].无锡:江南大学, 2023.ZHAO Q L.Fabrication, characterization and performanceinvestigation of perilla residue protein-basedhigh internal phase emulsion system [D].Wuxi:Jiangnan University, 2023.
[15] WANG S N, YANG J J, SHAO G Q, et al.Dilatational rheological and nuclear magnetic resonance characterization of oil-water interface:Impact of pH on interaction of soy protein isolated and soy hull polysaccharides[J].Food Hydrocolloids, 2020, 99:105366.
[16] WARD A F H, TORDAI L.Time-dependence of boundary tensions of solutions I.The role of diffusion in time-effects[J].The Journal of Chemical Physics, 1946, 14(7):453-461.
[17] LIU L Y, ZHAO Q Z, LIU T X, et al.Dynamic surface pressure and dilatational viscoelasticity of sodium caseinate/xanthan gum mixtures at the oil-water interface[J].Food Hydrocolloids, 2011, 25(5):921-927.
[18] ZHU Q M, LU H Q, ZHU J Y, et al.Development and characterization of Pickering emulsion stabilized by zein/corn fiber gum (CFG) complex colloidal particles[J].Food Hydrocolloids, 2019, 91:204-213.
[19] 刘晨. 水酶法提取花生油过程中油体组成、结构及稳定机制研究[D].郑州:河南工业大学, 2022.LIU C.Study on composition, structure, and stabilitymechanism of OB during aqueous enzymaticextraction of peanut oil [D].Zhengzhou:Henan University of technology, 2022.
[20] YI J, GAO L Y, ZHONG G T, et al.Fabrication of high internal phase Pickering emulsions with calcium-crosslinked whey protein nanoparticles for β-carotene stabilization and delivery[J].Food &Function, 2020, 11(1):768-778.
[21] ZHANG L J, ZHOU C F, XING S H, et al.Sea bass protein-polyphenol complex stabilized high internal phase of algal oil Pickering emulsions to stabilize astaxanthin for 3D food printing[J].Food Chemistry, 2023, 417:135824.
[22] 蒋晓芬. 玉米蛋白-姜黄素-刺梧桐胶三元颗粒稳定皮克林乳液并包埋β-胡萝卜素的研究[D].长春:吉林大学, 2023.JIANG X F.Zein-curcumin-polysaccharide composite particles stabilized by pickering emulsion encapsulation study of β-carotene [D].Changchun:Jilin University, 2023.
[23] 杜晓倩. 大豆分离蛋白-葡聚糖聚合物构建槲皮素乳液基运载体系[D].哈尔滨:东北农业大学, 2022.DU X Q.Construction of emulsion delivery systems loaded quercetin with soybean protein isolate-dextran complexes [D].Harbin:Northeast Agricultural University, 2022.
[24] JIANG J, WANG Q L, XIONG Y L.A pH shift approach to the improvement of interfacial properties of plant seed proteins[J].Current Opinion in Food Science, 2018, 19:50-56.
[25] SAVCHENKO E A, VELICHKO E.New techniques for measuring Zeta-potential of colloidal system[C].Saratov Fall Meeting 2018:Optical and Nano-Technologies for Biology and Medicine.SPIE, 2019:79.
[26] 吴宇森. pH诱导蛋白质组装包埋姜黄素的研究[D].广州:华南理工大学,2022.WU Y S.Study on pH-induced protein assembly forencapsulation of curcumin [D].Guangzhou:South China University of Technology, 2022.
[27] KANG Z M, ZHANG S, KONG Y, et al.Modification of soybean protein isolate by pH-shifting combined with ultrasonic treatment:Structural, viscosity, and functional properties[J].Food Structure, 2024, 42:100383.
[28] ZHANG Z H, MENG Y X, WANG J P, et al.Preparation and characterization of zein-based core-shell nanoparticles for encapsulation and delivery of hydrophobic nutrient molecules:Enhancing environmental stress resistance and antioxidant activity[J].Food Hydrocolloids, 2024, 148:109524.
[29] FENG T T, WANG X J, WANG X W, et al.High internal phase Pickering emulsions stabilized by pea protein isolate-high methoxyl pectin-EGCG complex:Interfacial properties and microstructure[J].Food Chemistry, 2021, 350:129251.
[30] 申慧珊. 面团加工过程中小麦A、B淀粉影响面筋蛋白结构转变的机制研究[D].杨凌:西北农林科技大学, 2023.SHEN H S.Study on the mechanism of wheat A- and B-starch affecting the structural transformation of gluten protein during dough processing [D].Yangling:Northwest A&F University, 2023.
[31] GUO B Z, HU X T, WU J Y, et al.Soluble starch/whey protein isolate complex-stabilized high internal phase emulsion:Interaction and stability[J].Food Hydrocolloids, 2021, 111:106377.
[32] MIN C, ZHANG C, PU H Y, et al.pH-shifting alters textural, thermal, and microstructural properties of mung bean starch-flaxseed protein composite gels[J].Journal of Texture Studies, 2023, 54(2):323-333.
[33] LI M, YU H Y, GANTUMUR M A, et al.Insight into oil-water interfacial adsorption of protein particles towards regulating Pickering emulsions:A review[J].International Journal of Biological Macromolecules, 2024, 272:132937.
[34] WANG S Y, LIU L G, BI S H, et al.Studies on stabilized mechanism of high internal phase Pickering emulsions from the collaboration of low dose konjac glucomannan and myofibrillar protein[J].Food Hydrocolloids, 2023, 143:108862.
[35] TIAN Y J, LV X H, OH D H, et al.Emulsifying properties of egg proteins:Influencing factors, modification techniques, and applications[J].Comprehensive Reviews in Food Science and Food Safety, 2024, 23(5):e70004.
[36] LIU Y Q, WU Q Z, ZHANG J, et al.Food emulsions stabilized by proteins and emulsifiers:A review of the mechanistic explorations[J].International Journal of Biological Macromolecules, 2024, 261:129795.